-
Medical journals
- Career
Kortikosteroidy a azathioprin v prvním roce léčby Crohnovy nemoci u dětí
: J. Malý; O. Pozler; P. Dědek
: Dětská klinika FN a LF UK, Hradec Králové přednosta prof. MUDr. M. Bayer, CSc.
: Čes-slov Pediat 2009; 64 (6): 271-282.
: Original Papers
Úvod:
V terapii Crohnovy nemoci (CN) dětí hrají dominantní úlohu systémové kortikosteroidy (SKS) společně s imunosupresivní léčbou azathioprinem. První z uvedených jsou velmi účinným nástrojem pro navození remise a zvládnutí následných relapsů nemoci, druhé přispívají k udržení navozené remise.Cíle:
Zhodnocení aplikované dávky SKS včetně kalkulace kumulativní dávky v 8., 12. a 52. týdnu léčby ve vztahu k aktivitě CN; analýza SKS šetřícího efektu azathioprinu v 52. týdnu léčby.Soubor a metoda:
Předmětem studie byli pacienti, kteří splňovali vstupní kritéria: věk 0–19 let, diagnóza CN, prospektivní hodnocení aktivity nemoci, léčba SKS v průběhu 1. roku sledování, follow-up nejméně 52 týdnů. Diagnóza CN byla stanovena na základě kritérií České koordinační skupiny pro studium chronických onemocnění trávicího traktu u dětí a v letech 2005–2006 na základě tzv. Portských kritérií.Výsledky:
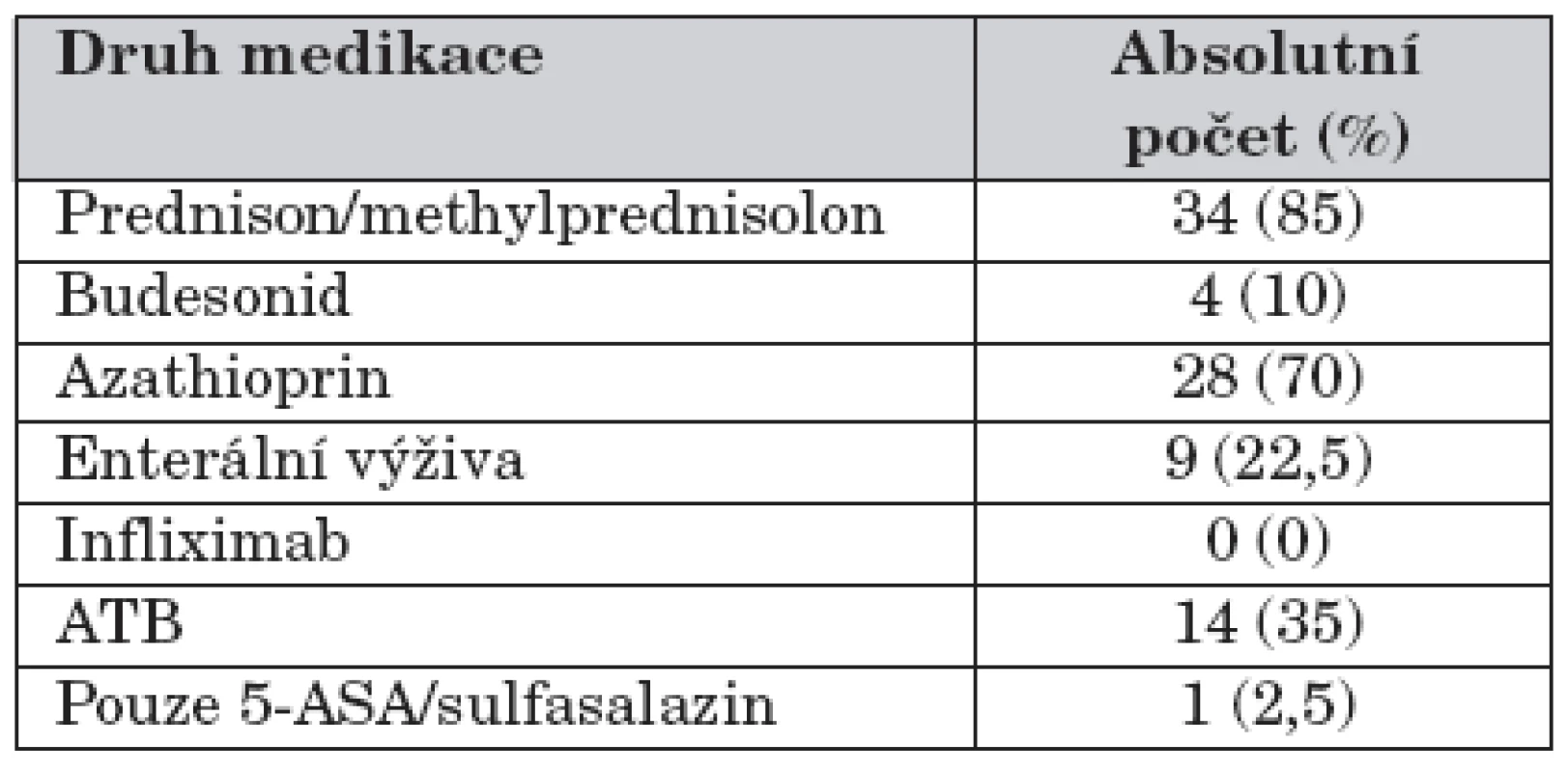
Čtyřicet pacientů splnilo vstupní kritéria, medián věku při stanovení diagnózy byl 14 let, PCDAI 32,5 bodů a délka sledování 44,5 měsíců. Léčba SKS byla v týdnu 0 zahájena u 35 pacientů (87,5 %), prednisonem nebo methylprednisolonem bylo léčeno 32 (91,4 %) pacientů s mediánem iniciální dávky ekvivalentu prednisonu 1 mg/kg (0,8–2,0). Budesonid byl použitý u 3 (8,6 %) pacientů v dávce 9 mg/den. Do 12. týdne bylo SKS léčeno 38 pacientů, medián dávky ekvivalentu prednisonu klesl z 1,0 na 0,21 mg/kg/den. Medián kumulativní dávky prednisonu ve 12. týdnu léčby byl 46,6 mg/kg. Remise bylo dosaženo u 33 (86,8 %), parciální terapeutické odpověďi u 4 (10,5 %) pacientů. V 52. týdnu sledování bylo SKS léčeno 20 pacientů, přičemž 16 dětí patřilo do skupiny prednisonu a 4 děti do skupiny budesonidu. Minimální dávkou ekvivalentu prednisonu ≤0,09 mg/kg/den bylo léčeno 11 (68,8 %) pacientů prednisonové skupiny. Medián roční kumulativní dávky (u n = 40) byl 70,1 mg/kg/rok (15,0–159,6) ekvivalentu prednisonu, tj. 0,19 mg/kg/den. V remisi bylo 35 (87,5 %) pacientů. Kortikodependentních bylo 6 (15 % ze 40) pacientů. K relapsu v průběhu 1. roku došlo u 7 (20 %) pacientů léčených prednisonem nebo methylprednisolonem a u 3 (60 %) pacientů léčených budesonidem. Operaci podstoupilo do 52. týdne 6 (12,5 %) pacientů z celého souboru. Roční kumulativní dávka prednisonu skupiny iniciálně léčené azathioprinem byla 66,3 mg/kg/rok. U skupiny dětí, která nebyla léčena iniciálně azathioprinem, dosáhla roční kumulativní dávka 102,8 mg/kg/rok (p = 0,089).Závěr:
SKS jsou vysoce efektivním nástrojem pro dosažení remise a zvládnutí relapsu CN u dětí. Kumulativní dávka aplikovaných kortikosteroidů v prvním roce léčby nedosáhla hodnot, které jsou spojeny s negativním ovlivněním růstu. Léčba azathioprinem je nedílnou, vysoce efektivní součástí léčby nespecifických střevních zánětů u dětí, přispívá ke snížené expozici SKS a zvyšuje pravděpodobnost dlouhodobé remise.Klíčová slova:
Crohnova nemoc, léčba nespecifických střevních zánětů u dětí, azathioprinÚvod
Léčba Crohnovy nemoci (CN) prodělala v posledních letech významný rozvoj v podobě začlenění biologické terapie do instrumentária gastroenterologa pečujícího o pacienty s mnohdy velmi komplikovaným chronickým onemocněním trávicího traktu. Terapie dětí se dnes významněji neliší od léčby dospělých a i zde hrají dominantní úlohu systémové kortikosteroidy (SKS) společně s imunosupresivní léčbou [1]. První z uvedených jsou velmi účinným nástrojem pro navození remise a zvládnutí následných relapsů nemoci, druhé pak přispívají k udržení navozené remise s podstatně menšími nežádoucími účinky pro pacienta, než by s sebou přinášela dlouhodobá aplikace vysokých dávek SKS, která je z hlediska medicínského i z hlediska pacienta nepřijatelná.
Přestože jsou SKS používány k léčbě akutního vzplanutí nespecifických střevních zánětů u dětí více než 30 let, jsou literární zdroje sledující průběh nemoci po indukci remise SKS velmi sporé a navíc ne nevýznamná část sledovaných pacientů se stává v průběhu nemoci kortikodependentní nebo kortikorezistentní [2, 3, 4]. Při stoupající incidenci CN a výše uvedených skutečnostech je velmi žádoucí vědět, jak naši pacienti reagují na léčbu SKS, jak tato léčba ovlivňuje následující průběh nemoci a lze-li vystopovat prediktivní faktory následného nepříznivého průběhu – např. kortikodependence, kortikorezistence, nutnosti operace, rescue biologické léčby apod.
Cíl práce
Cílem práce je zhodnocení aplikované dávky SKS včetně kalkulace kumulativní dávky v 8., 12. a 52. týdnu léčby ve vztahu k aktivitě nemoci a analýza SKS šetřícího efektu azathioprinu v 52. týdnu léčby.
Soubor a metoda
Soubor
V letech 1988–2006 bylo na Dětské klinice FN a LF UK v Hradci Králové léčeno 176 dětí s nespecifickým střevním zánětem. U 114 dětí byla diagnostikována CN, u 52 ulcerózní a u 10 indeterminantní kolitida. Od roku 1996 byla prospektivně hodnocena aktivita nemoci pomocí pediatrického indexu aktivity Crohnovy nemoci (PCDAI) [5].
Předmětem studie byli pacienti, kteří splňovali vstupní kritéria:
- věk 0–19 let,
- diagnóza Crohnova nemoc,
- prospektivní hodnocení aktivity nemoci,
- léčba kortikosteroidy v prvním roce sledování,
- sledování minimálně 52 týdnů.
V letech 1996-2006 byla na Dětské klinice FN a LF UK v Hradci Králové stanovena diagnóza CN u 54 pacientů. Vstupním kriteriím vyhovělo 40 pacientů ve věkovém rozmezí 5–18 let při stanovení diagnózy. Průměrná délka sledování činila 48 měsíců (13–117).
Crohnova nemoc
V letech 1996–2004 byla diagnóza CN stanovena na základě kritérií České koordinační skupiny pro studium chronických onemocnění trávicího traktu u dětí a v letech 2005–2006 na základě tzv. Portských kritérií [6, 7, 8].
Iniciální terapie
Medikace aplikovaná prvních 12 týdnů od stanovení diagnózy s cílem navození remise.
Dávka systémových kortikosteroidů
Aplikované dávky SKS byly zaznamenávány v týdenních intervalech jako dávka prednisonu nebo ekvivalentu prednisonu při použití methylprednisolonu v miligramech na kilogram tělesné hmotnosti pacienta. Převod protizánětlivé dávky methylprednisolonu na ekvivalent prednisonu byl proveden podle obecně známých kritérií (tab. 1). V dalším textu je termín ekvivalent prednisonu použit pro pacienty léčené prednisonem nebo ekvivalentem prednisonu podle uvedeného přepočtu. Pacienti léčení budesonidem (celkem 5 pacientů – 10,2 % souboru) nebyli zařazeni do analýzy dávek SKS a byli hodnoceni zvlášť.
1. Tabulka pro kalkulaci protizánětlivé dávky glukokortikoidů ve formě ekvivalentu prednisonu [38]. ![Tabulka pro kalkulaci protizánětlivé dávky glukokortikoidů ve formě ekvivalentu prednisonu [38].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4c3ff54456ded67a1cd19e36afc67bc5.png)
Kumulativní dávka kortikosteroidů byla vypočítána pomocí Newtonova-Cotesova kvadraturního vzorce (tzv. lichoběžníkové pravidlo) jako integrál spojité funkce definované týdenními dávkami ekvivalentu prednisonu v mg/kg tělesné hmotnosti během 52 týdnů sledování.
kde
Remise, parciální terapeutická odpověď, relaps
Aktivita CN byla hodnocena pomocí pediatrického indexu aktivity Crohnovy nemoci (PCDAI). Kalkulace PCDAI byla realizována při stanovení diagnózy a dále ve 12., 26., 38. a 52. týdnu léčby, event. kdykoliv při podezření na relaps onemocnění. PCDAI >30 bodů byl považován za marker středně těžké až těžké aktivity nemoci, naopak PCDAI ≤10 bodů byl hodnocen jako remise onemocnění. PCDAI v rozmezí 11–30 bodů byl hodnocen jako mírná aktivita nemoci. Jako parciální terapeutická odezva byl hodnocen pokles PCDAI o 12,5 a více bodů. Jako relaps onemocnění byl hodnocen vzestup PCDAI nad 15 bodů po předcházející remisi, nebo vzestup PCDAI o více než 10 bodů.
Kortikodependence
Relaps onemocnění do 30 dnů po vysazení léčby nebo po pokusu o snížení dávky kortikosteroidů.
Kortikorezistence
Zvyšování dávek kortikosteroidů (k maximální dávce prednisonu 2 mg/kg/den) nevede k dosažení remise.
Statistická analýza
Ke statistickému zhodnocení výsledků byly použity standardní statistické metody – testy k posouzení normality souboru, párové i nepárové testy (dvouvýběrový test, Wilcoxonův test, Mannův-Whitneyův test, párový T-test, Fisherův přesný test). Hodnota p <0,05 byla použita jako kritérium pro zamítnutí nulové hypotézy a stanovení statisticky významného rozdílu.
Výsledky
Soubor tvořilo celkem 40 pacientů ve věku 5–18 let s diagnózou CN. Charakteristika souboru je znázorněna v tabulce 2. Lokalizace onemocnění a frekvence postižení jednotlivých částí trávicí trubice jsou zachyceny v tabulce 3 a grafu 1. Iniciální léčba je uvedena v tabulce 4.
2. Vstupní charakteristika souboru. 
*p = 0,01 3. Lokalizace onemocnění při stanovení diagnózy. 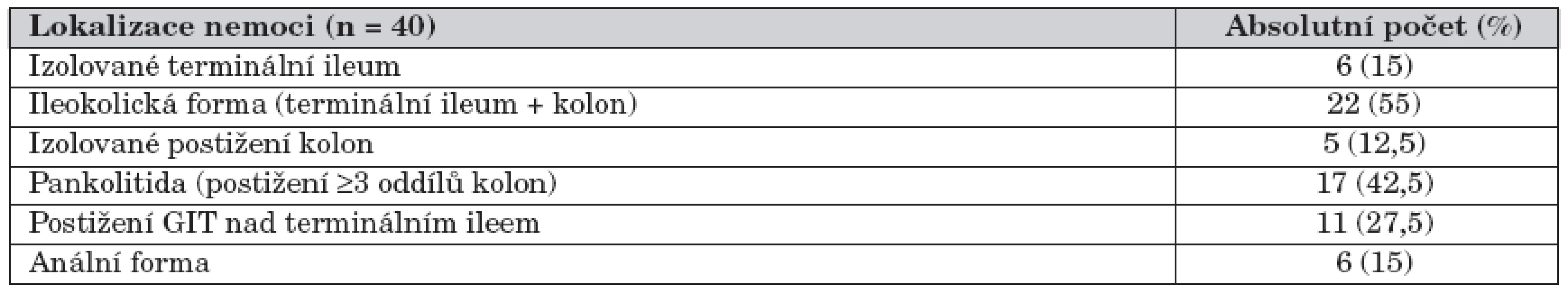
1. Frekvence postižení jednotlivých částí GIT v době stanovení diagnózy. 
V rámci iniciální terapie byla léčba systémovými kortikosteroidy zahájena u 38 pacientů, dvěma zbývajícím byly SKS ordinovány v průběhu prvního roku sledování (13. a 39. týden).
Zhodnocení aplikované dávky kortikosteroidů včetně kalkulace kumulativní dávky v 8., 12. a 52. týdnu léčby
Léčba SKS byla v týdnu 0 zahájena u 35 pacientů, medián PCDAI této skupiny při stanovení diagnózy byl 30 bodů (5–52,5 bodů). Prednisonem nebo methylprednisolonem bylo léčeno 32 pacientů s mediánem iniciální dávky ekvivalentu prednisonu 1 mg/kg (0,8–2,0) a s mediánem PCDAI 32,5 bodů (5–52,5 bodů). Budesonid byl použit u 3 pacientů v dávce 9 mg/den, medián PCDAI u těchto pacientů činil 30 bodů (22,5–50 bodů). Iniciální léčba SKS byla do 12. týdne sledování rozšířena o další 3 pacienty (2 ve skupině prednisonu a 1 ve skupině budesonidu).
Ve 12. týdnu bylo hodnoceno 38 pacientů, kteří byli léčeni kortikoidy v rámci iniciální terapie. Medián dávky ekvivalentu prednisonu klesl z 1,0 na 0,21 mg/kg/den. Medián kumulativní dávky prednisonu ve 12. týdnu léčby byl 46,6 mg/kg (tab. 5, graf 2). Remise bylo dosaženo u 33 (87 %), parciální terapeutické odpověďi u 4 (11 %) pacientů a u 1 pacienta nebylo dosaženo ani parciální terapeutické odpovědi. Medián PCDAI ve 12. týdnu sledování byl 5 bodů (0–32,5 bodů). Vývoj PCDAI v průběhu prvních 12 týdnů sledování je uveden v grafech 2 a 5.
5. Medián dávky kortikosteroidů v prvním roce léčby. 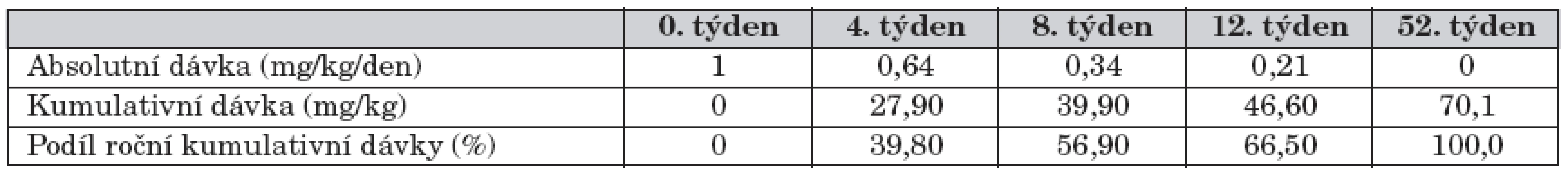
2. Vývoj PCDAI v prvních 12 týdnech léčby (osa X – čas, osa Y – PCDAI). 
3. Vývoj dávky kortikosteroidů v prvních 12 týdnech léčby (osa X – čas, osa Y – dávka kortikosteroidů v ekvivalentu prednisonu (kg/den). 
4. Kumulativní dávka kortikosteroidů v 1. roce léčby. 
5. Vývoj PCDAI v 1. roce léčby (osa X – čas, osa Y – PCDAI). 
SKS byly použity během prvního roku léčby u 40 pacientů, kteří byli hodnoceni v 52. týdnu. U 35 (87,5 %) dětí se jednalo o prednison nebo methylprednisolon, ve zbývajících 5 (12,5 %) případech šlo o budesonid (tab. 6).
6. Iniciální léčba kortikosteroidy a v průběhu prvního roku sledování. 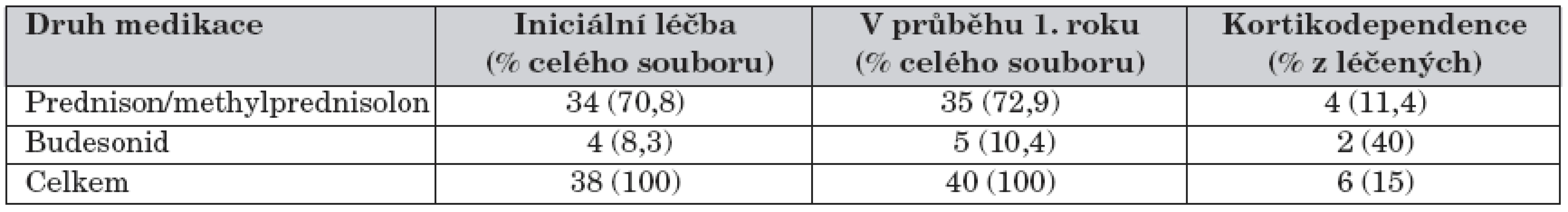
V 52. týdnu sledování bylo SKS léčeno 20 pacientů, přičemž 16 dětí patřilo do skupiny prednisonu a 4 děti do skupiny budesonidu. Minimální dávkou ekvivalentu prednisonu ≤0,09 mg/kg/den bylo léčeno 11 (69 %) pacientů prednisonové skupiny. Medián roční kumulativní dávky (u n = 40) byl 70,1 mg/kg/rok (15,0–159,6) ekvivalentu prednisonu, tj. 0,19 mg/kg/den (graf 4). Medián PCDAI v 52. týdnu byl 0 bodů (0–47,5 bodů), v remisi bylo 35 (87,5 %) pacientů. Jako kortikodependentní bylo označeno 6 (12,5 % ze 48) pacientů – tabulka 6. K relapsu v průběhu 1. roku sledování došlo u 7 (20 %) pacientů léčených prednisonem nebo methylprednisolonem a u 3 (60 %) pacientů léčených budesonidem. Rozdíl ve frekvenci relapsů nebo ve frekvenci kortikodependence ve skupině prednisonu nebo budesonidu nebyl statisticky významný (p = 0,089, resp. 0,154). Vývoj PCDAI je znázorněn v grafech 2, 5, 6 a 7.
6. Vývoj PCDAI ve skupině léčených kombinací prednison/methylprednisolon + azathioprin. Komentáře v tab. 9 (osa X – čas, osa Y – PCDAI). 
7. Vývoj PCDAI ve skupině léčených jinak než kombinací prednison/methylprednisolon + azathioprin. Komentáře v tab. 10 (osa X – čas, osa Y – PCDAI). 
Operaci podstoupilo do 52. týdne 6 (15 %) pacientů z celého souboru. Ve 2 případech byla operace realizována do 2 měsíců od stanovení diagnózy – v prvním případě šlo o těžkou stenózu v oblasti ileocékální chlopně, ve druhém o závažné postižení terminálního ilea v kombinaci s těžkou růstovou retardací, opožděním puberty a prokázanou osteoporózou.
Analýza steroidy šetřícího efektu azathioprinu v 52. týdnu léčby
Léčba azathioprinem byla indikována u 31 (78 %) pacientů v průběhu 1. roku sledování. Do 12. týdne sledování (iniciální léčba) bylo takto léčeno 28 pacientů. Průměrná iniciální dávka (resp. medián) azathioprinu byla 1,8 mg/kg/den (1,9 mg/kg/den), s rozptylem 0,7–2,9 mg/kg/den.
Kortikosteroidy šetřící efekt azathioprinu je graficky znázorněn v grafech ilustrujících společně s tabulkami klinický průběh u jednotlivých pacientů. Graf 6 představuje vývoj PCDAI v 1. roce sledování u skupiny pacientů, kteří byli iniciálně léčeni kombinací prednison/methylprednisolon a azathioprin. Tabulka 7 pak blíže dokresluje kazuistiky jednotlivých pacientů, u nichž do 52. týdne sledování došlo k relapsu nebo nebylo dosaženo remise.
7. Charakteristika 6 pacientů ze skupiny iniciálně léčených kombinací prednison/methylprednisolon + azathioprin, u kterých došlo v průběhu prvního roku sledování k relapsu nebo neočekávané odpovědi na léčbu. 
(číslo – číslo PCDAI křivky v grafu 6; dg. – věk stanovení diagnózy; IXF – léčba infliximabem; AZA – léčba azathioprinem; lab. – laboratorní); PCDAI – pediatrický index aktivity Crohnovy nemoci Obdobně je znázorněn průběh u pacientů, kteří nebyli iniciálně léčeni kombinací prednisonu/methylprednisolonu a azathioprinu (graf 7). Těmto pacientům byla ordinována jiná iniciální léčba – např. budesonid + azathioprin, 5-ASA + prednison aj. Tabulka 8 potom opět dokresluje jednotlivé kazuistiky v závislosti na vývoji PCDAI.
8. Charakteristika 9 pacientů ze skupiny neléčených iniciálně kombinací prednison/ methylprednisolon + azathioprin, u kterých došlo v průběhu prvního roku sledování k relapsu nebo neočekávané odpovědi na léčbu. 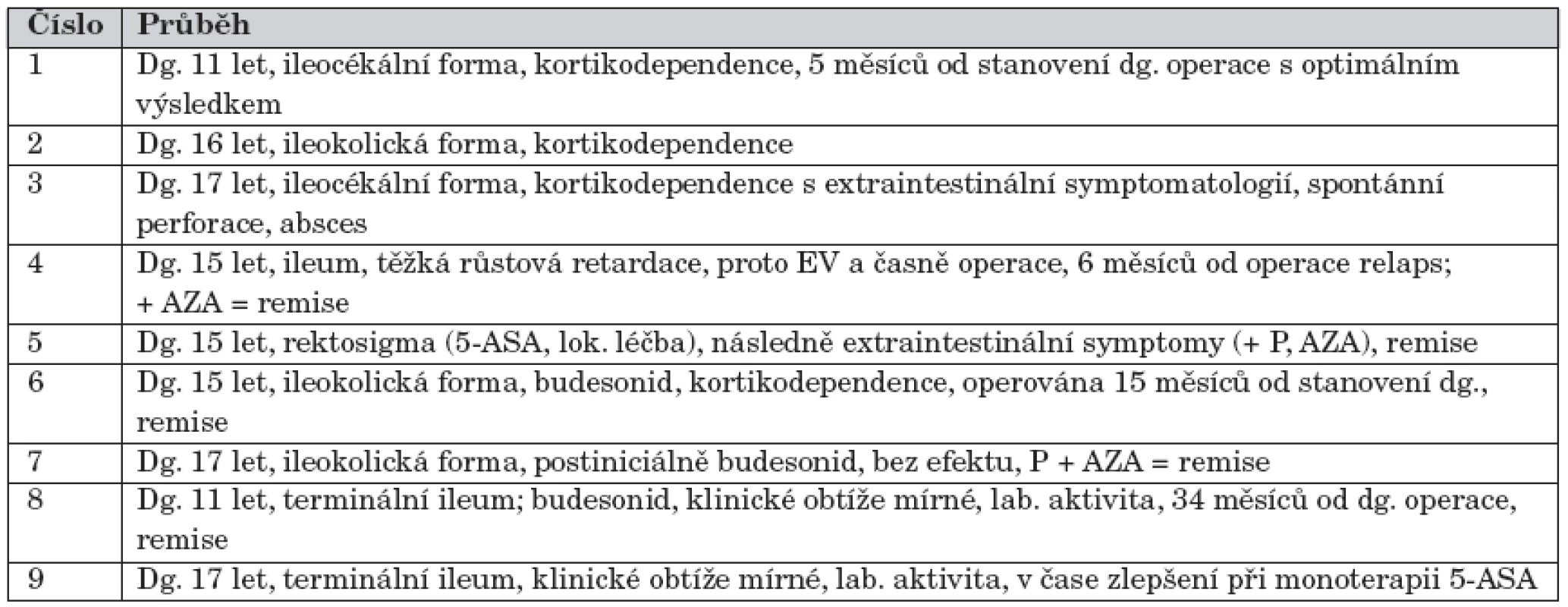
(číslo – číslo PCDAI křivky v grafu 7; dg. – věk stanovení diagnózy; EV – enterální výživa; AZA – léčba azathioprinem; 5-ASA – léčba deriváty kyseliny 5-aminosalicylové; lok. léčba – topická léčba klyzmaty; P – léčba prednisonem) PCDAI – pediatrický index aktivity Crohnovy nemoci Průměr, resp. medián kumulativní dávky ekvivalentu prednisonu v závislosti na zahájené léčbě (prednison + azathioprin vs. jinak než uvedeným algoritmem – tedy porovnání skupiny znázorněné grafem 6 a grafem 7) nebyl rozdílný (76,3 vs. 81,1, resp. 68,7 vs. 68,4 mg/kg/rok, p = 0,273). Získaný rozdíl nebyl statisticky významný ani při odfiltrování pacientů s potvrzenou non-compliance (65,4 vs. 81,1, resp. 63,5 vs. 68,4 mg/kg/rok, p = 0,060).
Roční kumulativní dávka prednisonu skupiny iniciálně léčené azathioprinem (do 12. týdne od stanovení diagnózy) byla 66,3 mg/kg/rok. U skupiny dětí, která nebyla léčena azathioprinem časně (tzn. vůbec nebo po 12. týdnu sledování), dosáhla roční kumulativní dávka 102,8 mg/kg/rok. Ani tento rozdíl však nebyl statisticky významný (p = 0,089; graf 8).
8. Rozdíl v kumulativní dávce kortikosteroidů (skupina léčených azathioprinemčasně a ostatních). 
Diskuse
Práce představuje v České republice první výhradně pediatrickou studii zaměřenou na léčbu Crohnovy nemoci systémovými kortikosteroidy. U všech pacientů se jednalo o diagnózu splňující kritéria jak ČSKSGE [6, 7], tak tzv. Portská kritéria [8].
Indukce remise systémovou léčbou kortikosteroidy je hlavním nástrojem navození remise u pacientů se středně těžkou až těžkou formou nemoci [1]. Indikace k iniciální léčbě SKS ani azathioprinu neměla striktní pravidla, jedná se o observační studii. V rozhodování hrál roli celkový stav pacienta, endoskopický nález a rozsah postižení i vztah pacienta k medikamentózní léčbě. Jak ale vyplývá z výsledků, SKS byly použity v iniciální léčbě především u dětí se středně vysokou a vysokou aktivitou nemoci.
Frekvence podání systémových kortikosteroidů v rámci iniciální léčby Crohnovy nemoci u dětí kolísá v závislosti na začlenění definované enterální výživy a biologické léčby do algoritmu léčby. Enterální výživa má silnou pozici zvláště ve Velké Británii a Nizozemí, kde je její aplikace nástrojem při indukci remise u 19–47 % pacientů s nově diagnostikovanou CN s velmi dobrými výsledky [9, 10].
V našem souboru byla enterální výživa použita výhradně v kombinaci s další léčbou ve snaze o co nejrychlejší možné navození remise a současně zlepšení nutričního stavu pacientů. Tento postup je možná překvapivě bližší strategii známé z USA [12] a odráží snahu spíše o top-down přístup – tedy co nejrychlejší zmírnění projevů onemocnění a zlepšení kvality života pacientů s následným snížením a vysazením kortikosteroidů a ponecháním udržovací léčby azathioprinem [13]. Důkazem o uvedeném přístupu je vysoká frekvence konkomitantní aplikace azathioprinu (70 % iniciálně léčených). Markowitz et al. v metodicky dobře provedené a dostatečně velké studii prokázali, že tento postup vede k nižší expozici kortikosteroidů a nižší frekvenci kortikosteroid-dependence [14].
Byť jsou výsledky citované práce obecně známé, přístup k pacientům s CN není zdaleka tak jednoznačný. V nedávné době publikovaných retrospektivních multicentrických studiích byl azathioprin indikován v průběhu prvního měsíce sledování jen u 2–5 % pacientů s nově diagnostikovanou CN [9, 10]. Podávání azathioprinu/6-merkaptopurinu je v západní Evropě, USA a Izraeli zvažováno při nutnosti steroidní léčby u aktivní nemoci ve 45 % případů, v případě relabující nemoci se k tomuto postupu přiklání 93 % gastroenterologů [12].
Vzhledem k tomu, že je azathioprin používán v léčbě nespecifických střevních zánětů více než 30 let a je povšechně považován za účinnou a bezpečnou léčbu, domníváme se, že je zcela legitimním krokem časné zahájení léčby u středně těžké a těžké CN [15, 16]. Pacientova adherence k léčbě totiž může být významně narušena prodlevou v nástupu účinku v důsledku specifické farmakokinetiky azathioprinu a 6-merkaptopurinu.
Z našeho sledování je nápadné, že pokud byla po stanovení diagnózy zahájena léčba SKS a azathioprinem, bylo nedosažení remise nebo relaps v prvním roce sledování v příčinné souvislosti s pacientovou non-compliance. Ačkoliv nebyla studie cílena na zjištění frekvence non-compliance, 12,5 % pacientů již v prvním roce sledování přiznalo, že ordinované léky dlouhodobě neužívalo. Tudíž se jeví přínosné současně s indukcí remise SKS, event. enterální výživou zahájit podávání azathioprinu a do doby plného nástupu účinku (2–3 měsíce) snižovat a event. vysadit systémovou léčbu kortikosteroidy. Tento postup v mírně modifikované formě vedl v prospektivně vedené recentní multicentrické studii ke snížené expozici kortikosteroidů a snížené frekvenci hospitalizací [17]. Autoři zaznamenali aplikaci azathioprinu/6-merkaptopurinu v souboru dětí se středně těžkou a těžkou CN (PCDAI ≥30 bodů) během prvních 3, 12 a 24 měsíců v 61 %, 80 % a 86 % případů.
Přestože v našem souboru je skupina „kontrolních“ – tedy azathioprinem neléčených pacientů velmi malá, zaznamenali jsme značné rozdíly. Ve skupině léčených SKS a azathioprinem od stanovení diagnózy nebo velmi časně (do 3 měsíců) byl medián kumulativní dávky 66,3 mg/kg/rok ekvivalentu prednisonu, ve skupině léčených SKS bez azathioprinu byl medián kumulativní dávky 102,8 mg/kg/rok ekvivalentu prednisonu. Přestože tento výsledek nebyl statisticky významný, především v důsledku značné variability a malé velikosti souboru, efekt SKS šetřícího efektu azathioprinu je patrný (graf 8) a naznačuje důvod časné aplikace imunomodulačních léků u středně těžkých a těžkých forem CN u dětí.
Aplikace systémových kortikosteroidů je provázená obavami z adverzních účinků léčby, především z rozvoje Cushingova syndromu a zpomalení růstu. Hodnocení růstu a růstové rychlosti je jednou z nejsnáze sledovatelných, nicméně velmi obtížně interpretovatelných oblastí pediatrie. Přestože jsou SKS používány v klinické praxi přes 50 let, exaktní informace o ovlivnění růstu dětí s nespecifickými střevními záněty nemáme a drtivá většina známých dat o růstu nebo růstové rychlosti pacientů byla získána z retrospektivních sledování.
Cílem naší práce nebyla analýza růstové rychlosti pacientů léčených SKS, nebyly detailně analyzovány antropometrické údaje rodinných příslušníků, růstová predikce jednotlivých pacientů atd. Naším cílem bylo zjištění, za jak dlouho po stanovení diagnózy snižujeme dávku kortikosteroidů na dávku, která podle dostupných údajů nemá negativní efekt na růstovou rychlost, tudíž ji lze považovat za relativně bezpečnou i pro dětský organismus. V 8. týdnu po zahájení léčby byl medián dávky kortikosteroidů 0,34 mg ekvivalentu prednisonu/kg – tedy na horní hranici rozmezí nízké dávky kortikosteroidů [18]. Ve 12. týdnu pak 0,21 mg ekvivalentu prednisonu/kg, což přibližně odpovídá dávce (0,18 ± 0,07 mg), která při dlouhodobém podávání (14,4 ± 7,2 měsíce) neměla negativní vliv na růstovou rychlost převážné většiny pacientů [19]. Aplikovaná dávka prednisonu v prvním roce léčby našeho souboru dětí s CN přesáhla o 53 % hypoteticky kalkulovanou průměrnou kumulativní „fyziologickou“ substituční dávku perorálně podávaného prednisonu 36,5–54,8 mg/kg/rok [20, 21]. Medián použité dávky – 0,19 mg/kg/den – pak relativně dobře koresponduje s prací citovaných autorů, zvláště, pokud se jedná o léčbu v prvním roce sledování, tedy indukci a udržení remise [19].
Literární odkazy popisující léčbu SKS v prvním roce po stanovení diagnózy jsou velmi sporé, pouze jedna retrospektivní práce analyzuje dětský soubor pacientů (nicméně částečně s podobným designem). Tung et al. hodnotili úspěšnost indukční léčby SKS na souboru 26 dětí s CN a stav pacientů po 1 roce léčby [4]. Definice jednotlivých cílů jsou uvedeny v tabulce 9. Po 30 dnech léčby prednisonem dosáhlo 62 % pacientů klinické remise, 27 % pacientů částečné klinické remise, 1 pacient (4 %) neodpověděl na zahájenou léčbu a 2 pacienti (8 %) byli do 1 měsíce od stanovení diagnózy operováni.
9. Hodnocení cílů v práci Tung J., et al. A population-based study of the frequency of corticosteroid resistance and dependence in pediatric patients with Crohn’s disease and ulcerative colitis (Inflamm. Bowel Dis. 2006; 12: 1093–1100). 
V našem souboru byla remise hodnocena ve 12. týdnu léčby a byla dosažena u 34 pacientů (85 %), pozitivní terapeutická odpověď byla zaznamenána u 38 pacientů (95 %). Rovněž 2 pacienti (4 % souboru) byli operováni během prvního měsíce po stanovení diagnózy. V práci amerických autorů byla dlouhodobá remise po 1 roce sledování dosažena ve 42 % případů, kortikodependence byla zaznamenána v 31 % případů a chirurgická resekce GIT byla provedena u 27 % pacientů. V našem souboru bylo operováno 12,5 % pacientů v prvním roce léčby, v 52. týdnu léčby bylo 85,7 % pacientů v remisi a 59 % nebylo léčeno SKS. Dvacet (41 %) pacientů bylo léčeno systémovými kortikosteroidy (2 děti dostávaly SKS v 52. týdnu pro relaps onemocnění), 16 dětí patřilo do skupiny prednisonu a 4 děti do skupiny budesonidu. Kortikodependence byla stanovena u 6 pacientů (12,5 %), 3 pacienti patřili do prednisonové skupiny a 3 do skupiny budesonidové. U pacientů, kteří nesplňovali kritérium kortikodependence (n = 14) a byli léčeni SKS v 52. týdnu, jsme zjistili, že u všech dětí v prednisonové skupině (n = 13) nebyly SKS během 1. roku sledování ukončeny, byť 11 z nich dostávalo dávku prednisonu/ekvivalentu prednisonu ≤0,09 mg/kg/den. Důvodem pro neukončení SKS byly např. mírná perzistující aktivita, subjektivní stesky pacienta nebo obava pacienta či jeho rodiny z recidivy při úplném ukončení SKS. Tento fakt může do určité míry zkreslovat frekvenci kortikodependence ve smyslu falešné negativity a výsledek naší práce by měl přispět k důslednějšímu ukončování léčby SKS při nízkých dávkách. Práce Tunga et al. byla cílena na identifikaci kortikodependence a kortikorezistence. Ačkoliv autoři neuvádí detailnější rozbor léčby SKS (trvání, dávky atd.) a metodika prací je částečně odlišná, jedná se o jedinou srovnatelnou studii v pediatrické literatuře. Výsledky obou studií jsou přehledně uvedeny v tabulce 10.
10. Porovnání výsledků s prací Tung J., et al. A population-based study of the frequency of corticosteroid resistance and dependence in pediatric patients with Crohn´s disease and ulcerative colitis (Inflamm. Bowel Dis. 2006;12: 1093–1100). 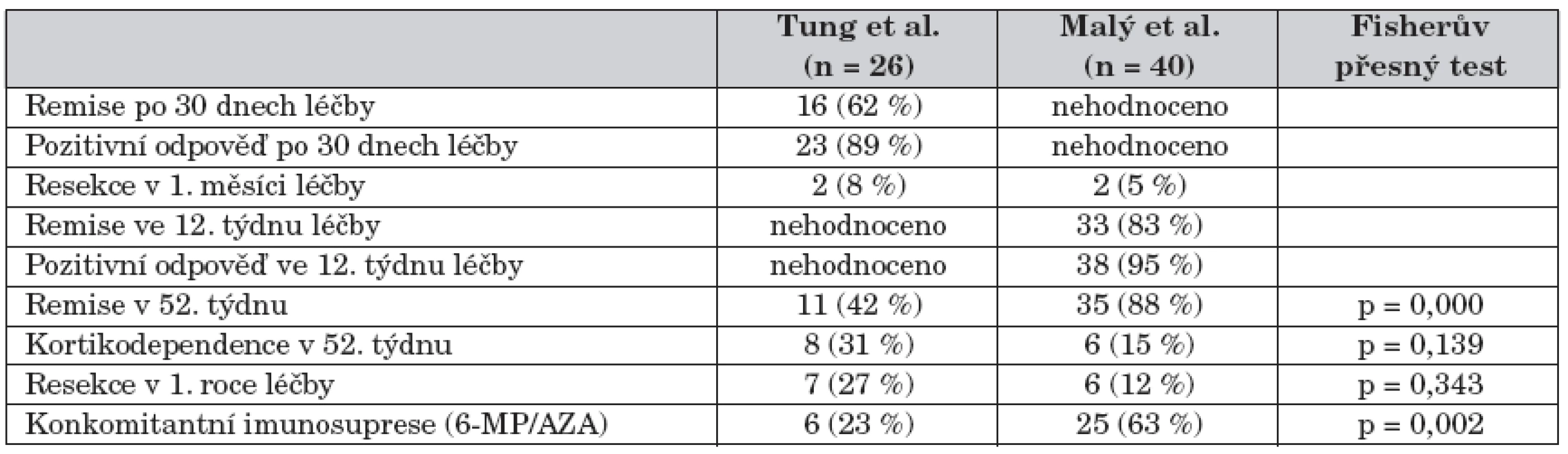
Statisticky významnou převahu konkomitantní medikace azathioprinem v naší práci považujeme za hlavní důvod vysvětlující statisticky významně vyšší frekvenci dosažení remise onemocnění v 52. týdnu od zahájení léčby (90 % vs. 42 %), nižší frekvenci kortikodependence (31 % vs. 15 %) a nižší frekvenci chirurgických resekcí GIT (12 % vs. 27 %).
Závěry
SKS jsou stále vysoce efektivním nástrojem pro dosažení remise a zvládnutí relapsu CN u dětí. Kumulativní dávka aplikovaných kortikosteroidů v prvním roce léčby nedosáhla hodnot, které podle literárních údajů negativním způsobem ovlivňují růstovou rychlost. Léčba azathioprinem je nedílnou, vysoce efektivní součástí léčby nespecifických střevních zánětů u dětí a přispívá ke snížené expozici SKS a vyšší pravděpodobnosti udržení remise.
Je velmi žádoucí posoudit, zda je pro dětského pacienta bezpečnější „nízká dávka SKS“ (pokud existuje) než biologická léčba, nebo zda terapii SKS z medicínského hlediska (ne finančního) postupně z arzenálu dětského gastroenterologa vyřadit. Pokud to nebude možné, bylo by jistě žádoucí navrhnout algoritmus terapie Crohnovy nemoci SKS podobně jako existuje např. pro léčbu nefrotického syndromu.
Podporováno grantem IGA MZ ČR NR 9255-3.
Došlo: 18. 1. 2009
Přijato: 5. 3. 2009
MUDr. Jan Malý
Dětská klinika FN a LF UK
Sokolská 581
500 05 Hradec Králové
e-mail: janmaly@email.cz
Sources
1. Caprilli R, Gassull MA, Escher JC, et al. European evidence based consensus on the diagnosis and management of Crohn’s disease: special situations. Gut 2006;55: i36–i58.
2. Munkholm P, Langholz E, Davidsen M, et al. Frequency of glucocorticoid resistance and dependency in Crohn’s disease. Gut 1994;35 : 360–362.
3. Faubion WA Jr, Loftus EV Jr, Harmsen WS, et al. The natural history of corticosteroid therapy for inflammatory bowel disease: a population-based study. Gastroenterology 2001;121 : 255–260.
4. Tung J, Loftus EV Jr, Freese DK, et al. A population-based study of the frequency of corticosteroid resistance and dependence in pediatric patients with Crohn´s disease and ulcerative colitis. Inflamm. Bowel Dis. 2006;12 : 1093–1100.
5. Hyams JS, Ferry GD, Mandel FS, et al. Development and validation of pediatric Crohn´s disease activity index. J. Pediatr. Gastroenterol. Nutr. 1991;12 : 437–447.
6. www.gastroped.cz.
7. Pozler O, Malý J, Bónová O, et al. Incidence of Crohn disease in the Czech Republic in the years 1990–2001 and assessment of pediatric population with inflammatory bowel disease. J. Pediatr. Gastroenterol. Nutr. 2006;42 : 186–189.
8. IBD Working Group of the European Society of Paediatric Gastroenterology, Hepatology nad Nutrition (ESPGHAN). Medical position paper: Inflammatory bowel disease in children and adolescents: recommendations for diagnosis – The Porto Criteria. J. Pediatr. Gastroenterol. Nutr. 2005;41 : 1–7.
9. Sawczenko A, Lynn R, Sandhu BK. Variations in initial assessment and management of inflammatory bowel disease across Great Britain and Ireland. Arch. Dis. Child. 2003;88 : 990–994.
10. Jaspers GJ, Verkade HJ, Escher JC, et al. Azathioprine maintains first remission in newly diagnosed pediatric Crohn´s disease. Inflamm. Bowel Dis. 2006;12 : 831–836.
11. Heuschkel RB, Menache CC, Megerian JT, Baird AE. Enteral nutrition and corticosteroids in the treatment of acute Crohn´s disease in children. J. Pediatr. Gastroenterol. Nutr. 2000;31 : 8–15.
12. Levine A, Milo T, Buller HA, Markowitz J. Consensus and controversy in the management of pediatric Crohn disease: an international survey. J. Pediatr. Gastroenterol. Nutr. 2003;36 : 464–469.
13. Hanauer SB. Crohn´s disease: step up or top down therapy. Best Pract. Res. Clin. Gastroenterol. 2003;17 : 131–137.
14. Markowitz J, Grancher K, Kohn N, et al. A multicenter trial of 6-mercaptopurine and prednison in children with newly diagnosed Crohn´s disease. Gastroenterology 2000;119 : 895–902.
15. Fraser AG, Orchard TR, Jewell DP. The efficacy of azathioprine for the treatment of inflammatory bowel disease: a 30 year review. Gut 2002;50 : 485–489.
16. Al Hadithy AFY, de Boer NKH, Derijks LJJ, et al. Thiopurines in inflammatory bowel disease: pharmacogenetics, therapeutic drug monitoring and clinical recommendations. Dig. Liv. Dis. 2005;37 : 282–297.
17. Punati J, Markowitz J, Lerer T, et al. Effect of early immunomodulator use in moderate to severe pediatric Crohn disease. Inflamm. Bowel Dis. 2008;14 : 949–954.
18. Michels H. What is low-dose corticosteroid therapy in juvenile idiopathic arthritis? A worldwide, questionnaire-based survey. Z. Rheumatol. 2000;59 : 127–130.
19. Navarro FA, Hanauer SB, Kirschner BS. Effect of long-term low-dose prednisone on height velocity and disease activity in pediatric and adolescent patients with Crohn disease. J. Pediatr. Gastroenterol. Nutr. 2007;45 : 312–318.
20. Miller WL. The adrenal cortex. In: Sperling MA (ed). Pediatric Endocrinology. 2nd ed. Philadelphia: Saunders, 2002 : 385–438.
21. Cuttler L, Rosenfield RL. Somatic growth and maturation. In: DeGeroot LJ, Jameson JL, DeKretser (eds). Endocrinology. 5th ed. Philadelphia: Elsevier, 2005 : 697–732. cit. Navarro FA, Hanuer SB, Kirschner BS. J. Pediatr. Gastroenterol. Nutr. 2007;45 : 312–318.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2009 Issue 6
Most read in this issue- Corticosteroids and Azathioprine in the First Year of Crohn Disease Therapy in Children
- Inhaled Nitric Oxide in Treatment of Severe Respiratory Failure in Children
- Clinical Importance of Identification of PROP1 Gene Mutations in Children with Inherited Growth Hormone Deficiency
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career