-
Medical journals
- Career
Vývoj kůže a její bariérová funkce
Authors: Z. Plzáková
Authors‘ workplace: Dermatovenerologická klinika 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice, Praha, přednosta prof. MUD. Jiří Štork, CSc.
Published in: Čes-slov Derm, 96, 2021, No. 4, p. 163-177
Category: Reviews (Continuing Medical Education)
Overview
Kůže je důležitý bariérový orgán. Její anatomická a funkční zralost je jedním z limitů přežití novorozence a její stav značně ovlivňuje fyzickou a psychickou kvalitu života po celý život člověka. Četná onemocnění kůže vznikají na genetickém podkladě. Znalost vývojových mechanismů a souvislostí je proto důležitá i v běžné dermatologické praxi. Dermatolog navíc může tuto znalost využít při hledání souvislostí kožních a mimokožních projevů, a může tak sehrát důležitou roli v časné diagnostice některých vrozených onemocnění.
Klíčová slova:
gestační věk – histogeneze – organogeneze – nezralost – periderm – mázek – rohová vrstva – pilosebaceózní jednotka – regulační molekuly – mutace/patogenní varianta
ÚVOD
Kůže je bariérový a taktilní orgán komunikující neustále se zevním a vnitřním prostředím. Je viditelná na první pohled, a proto celá řada onemocnění postihujících kůži může kromě fyzického diskomfortu přinášet i psychický handicap a významné snížení kvality života. Bezprostředně po porodu, při kterém dochází k výrazným změnám teploty, vlhkosti a mechanické zátěže, musí být kůže připravena zcela plnit svoji bariérovou funkci. Její zralost je jedním z kritických faktorů pro přechod předčasně narozeného dítěte do zevního prostředí a jeho přežití [5].
V článku je uváděn skutečný gestační věk embrya v týdnech prenatálního vývoje (počínající dnem oplození) na rozdíl od běžně uváděné délky těhotenství (počítané od poslední menstruace), která je cca o 14 dní delší.
HLAVNÍ OBDOBÍ VÝVOJE KŮŽE
Kůže se začíná formovat již na rozhraní 1. a 2. měsíce embryonálního vývoje ze dvou zárodečných vrstev embrya: ektodermu a mezodermu. Z ektodermu se vyvíjí epidermis i nervový systém (část ektodermu se diferencuje v neuroektoderm a posléze v neurální trubici a neurální lištu). Mezoderm a posléze mezenchym je zdrojem pro vývoj dermis a subcutis. Pokud má vzniknout dokonale fungující orgán, či celý organismus, musí být zachován přesný časový a topický harmonogram součinnosti všech signálních molekul, které se na vývoji podílí. V tomto soukolí je nesmírně důležitá i vzájemná interakce epidermálních a dermálních struktur. Obdobně jako u jiných orgánů rozlišujeme ve vývoji kůže období organogeneze (0.–60. den), histogeneze (3.–5. měsíc) a zrání (6.–9. měsíc).
V období organogeneze se zakládají jednotlivé vrstvy, začíná vývoj bazální membrány a adnex. Není ještě patrná hranice mezi kůží a pod ní ležícími svaly. Koncem tohoto období migrují do kůže prekurzory melanocytů a Langerhansových buněk. Objevují se první cévy v oblasti mezi dermis a podkožím. Do kůže prorůstají somatosenzitivní nervová vlákna. Reflexní reakce po taktilní stimulaci kůže byla pozorována již ve 2. měsíci intrauterinního vývoje. Oblast kůže inervována jedním míšním nervem se nazývá dermatom. Klinicky je tento vztah patrný u herpes zoster – bolestivost a kožní projevy jsou lokalizovány v oblasti dermatomu postiženého nervu.
V období histogeneze dochází ke stratifikaci epidermis, rozdělení mezenchymálních struktur na vrstvu dermis a hypodermis, formují se žlázy, vlasové folikuly a nehty. Melanocyty začínají produkovat melanin. Pokračuje angiogeneze a vývoj vegetativní inervace cévních plexů, folikulů a potních žláz. Vytvářejí se specializovaná nervová zakončení zodpovědná za hmatové čití. Dermis je výrazně buněčná, obsahuje málo tenkých vláken a hojně vody. V podkoží se diferencují tukové buňky.
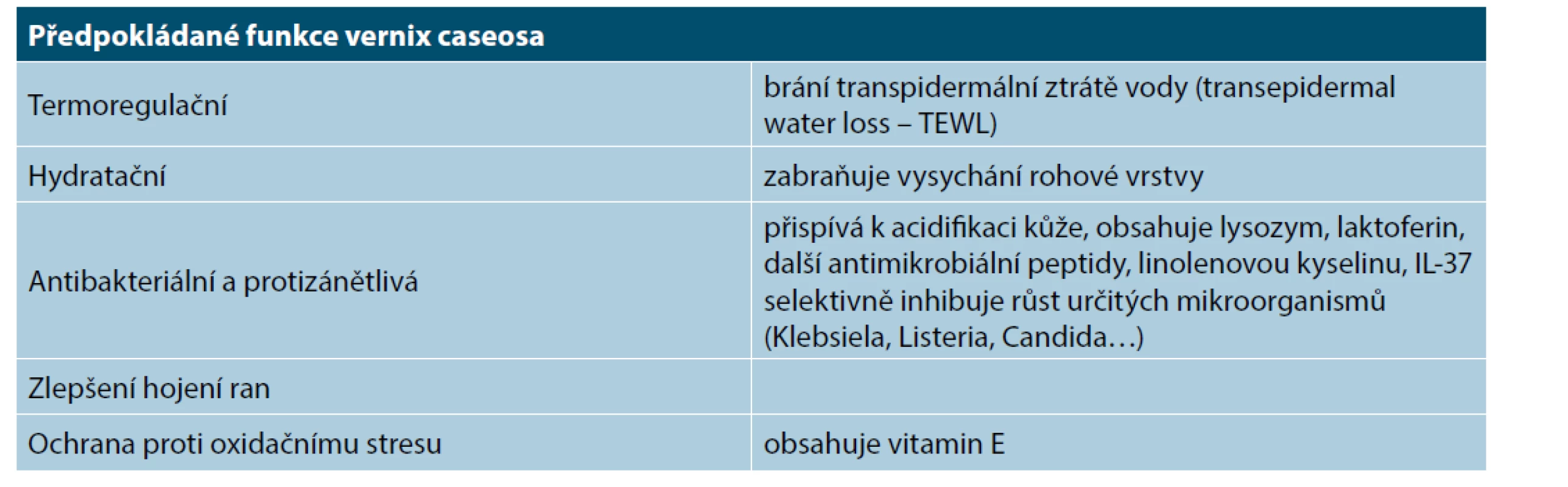
V období zrání všechny struktury dozrají, aby byly připraveny na příchod do zevního prostředí s nižší teplotou, vlhkostí a přítomností patogenů. Vyvíjí se rohová vrstva. Tvoří se mázek, který je patrný od 28. týdne a slouží k intrauterinní ochraně vůči amniové tekutině a taktéž k ochraně kůže plodu první dny postnatálního života (tab. 1). Je tvořen odlučujícími se buňkami epidermis, lanugem a produktem mazových žláz. Obsahuje 80 % vody, 10 % tuků a 10 % bílkovin. Maximální množství mázku je kolem 37. týdne, ve 40. týdnu je přítomen jen na 30 % povrchu těla [25].
VÝVOJ JEDNOTLIVÝCH KOŽNÍCH STRUKTUR
Interfolikulární epidermis
Na konci 4. týdne se povrchový ektoderm embrya rozdělí na 2 vrstvy. Zevní dlaždicová vrstva se nazývá periderm, vnitřní vrstva dělících se kubických buněk se nazývá bazální vrstva. Pod ní leží bazální membrána. V bazální vrstvě je exprimován protein p63 a Notch, které jsou důležité pro zahájení stratifikace epitelů (tab. 2). Periderm je pravděpodobně časnou epidermální bariérou, která chrání kůži embrya a plodu před amniovou tekutinou. Periderm se odlučuje kolem 21. týdne, když je ukončena stratifikace epidermis, u některých patologických stavů však perzistuje první týdny po porodu – collodion baby. Kolem 8. týdne proliferující bazální buňky vytvoří další, tzv. intermediární vrstvu. Její buňky se stále aktivně dělí, na rozdíl od suprabazálních buněk postnatální epidermis. Intermediární vrstva je pouze dočasná a postupně je nahrazena stratum spinosum, jejíž buňky se již nedělí a podléhají terminální diferenciaci, a tak tvoří stratum granulosum a stratum corneum. Schopnost dělení si po celý lidský život zachovají pouze vybrané buňky bazální vrstvy – kmenové buňky – které jsou zdrojem obnovy interfolikulární epidermis.
Table 2. Vybrané regulační molekuly uplatňující se ve vývoji lidské kůže a nemoci spojené s poruchou jejich funkce 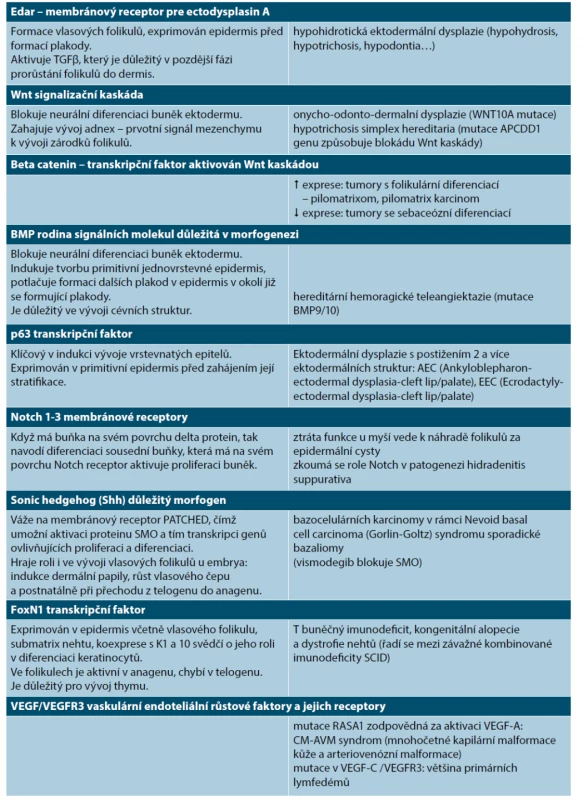
Již v tomto období exprimují keratinocyty základní strukturální proteiny – keratiny (K) – intermediární filamenta epitelů. Keratiny se v buňce vždy vyskytují v párech, typ I a typ II, tj. jako heterodimery. Vytvářejí opornou strukturu chránící před mechanickými a jinými stresy, ale také se účastní na modulaci metabolických dějů a signálních drah. Mohou se různým způsobem seskupovat a rozpojovat, a tak zajišťují flexibilitu cytoskeletu. Uplatňují se i ve spojích mezibuněčných či mezitkáňových (napojení na desmozomy, hemidesmozomy). Exprese jednotlivých keratinů v epidermis se mění v průběhu embryonálního vývoje. Ve 2. měsíci bazální vrstva exprimuje keratiny jednoduchých epitelů K8 a K18, posléze po stratifikaci K5 a K14, K19 a diferencované buňky stratum spinosum exprimují K1 a K10. Ke změně exprese dochází u nádorů – spinocelulární a bazocelulární karcinomy mohou exprimovat K5 a 14, 6, 16 a 17, 8 a 18. Exprese je také závislá na lokalizaci – kůže dlaní a chodidel, nad koleny, na stehně a v tříslech exprimuje v horních vrstvách stratum spinosum K 9 a K2, v neochlupené kůži a v epidermis vlasového folikulu, nehtového lůžka a v ústní sliznici je exprimován K6, 16, 17. Exprese K se mění i při specifických stavech – keratiny K6, 16 a 17, tzv. stresové keratiny, jsou exprimovány keratinocyty poblíž místa poranění a řadíme je společně s antimikrobiálními peptidy a prozánětlivými cytokiny mezi tzv. časné alarminy, které ovlivňují proliferační a migrační schopnosti keratinocytů a zánětlivou odpověď, jejich exprese je typická i pro suprabazální vrstvy psoriatické kůže [30]. Mutace keratinů způsobují celou řadu kožních onemocnění. Příklady uvádí tabulka 3.
Table 3. Mutace keratinů u vybraných kožních onemocnění 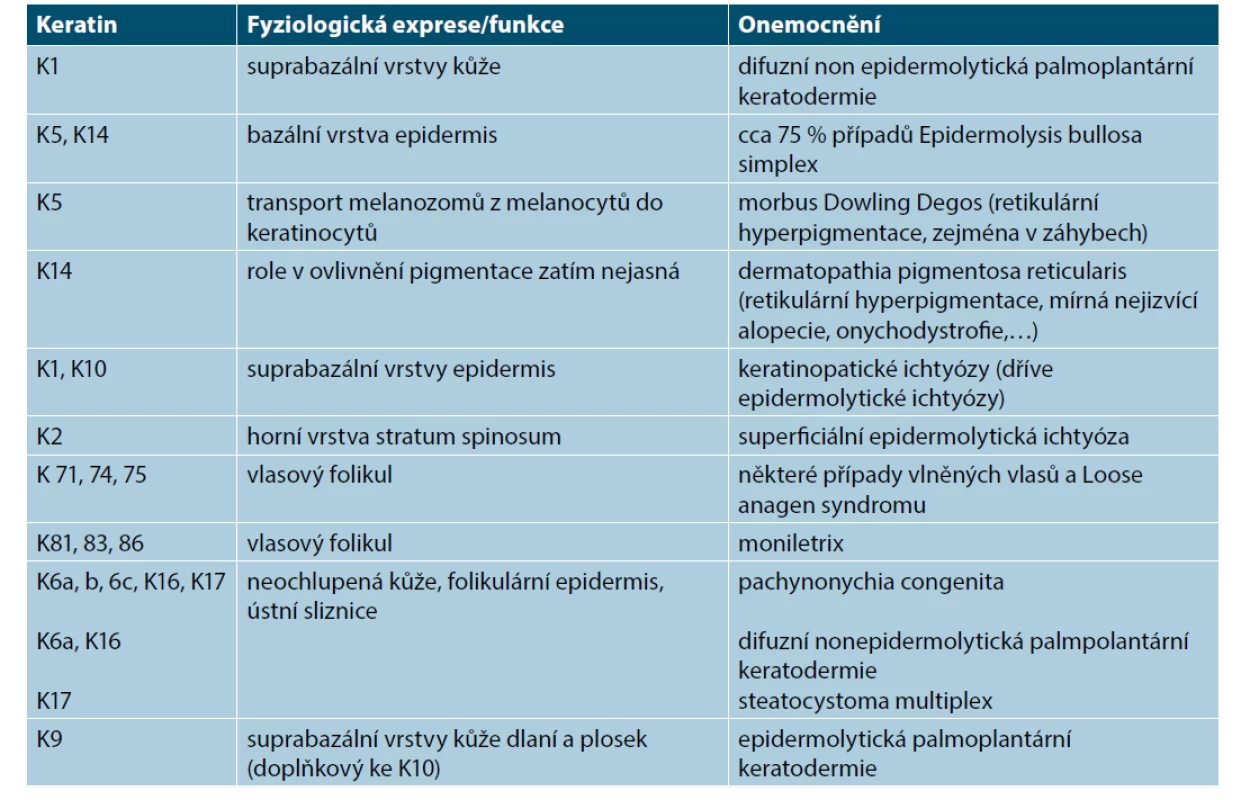
Adheze buněk v suprabazálních vrstvách epidermis je zajištěna především pomocí desmozomů. Každý desmozom má intracelulární část (keratiny, desmoplakin, plakofilin, plakoglobin) a část transmebránovou a extracelulární (desmogleiny a desmokoliny). Jejich mutace jsou zodpovědné za tvorbu suprabazálních puchýřů u některých vzácnějších forem epidermolysis bullosa simplex (EBS s deficiencí plakofilinu, ES superficialis, letální akantolytická EBS). Ve stratum corneum se snižuje exprese K1 a K10 a exprimují se markery pozdní diferenciace transglutamináza, loricrin, involucrin a filagrin, K2 – postupně dochází ke keratinizaci (viz níže). Keratinizace začíná nejdříve v oblasti vlasového kanálu, cca v 15. týdnu (výjimka viz vývoj nehtu), v interfolikulární epidermis je patrná až ve 22.–24. týdnu embryonálního vývoje, a to nejdříve v oblasti hlavy, dlaní a chodidel. Do 26. týdne má rohová vrstva několik řad buněk a začíná se vytvářet mezibuněčná lipidová substance. Anatomicky je vývoj rohové vrstvy ukončen zhruba ve 34. týdnu. Děti narozené před 30. týdnem jsou proto mnohem více ohroženy dehydratací, nadměrnou penetrací lokálních léčiv a chemikálií a infekcí [9]. U dětí narozených před 32. týdnem je zvýšená i transepidermální absorpce kyslíku. Neúplně vyvinutá kožní bariéra je spojená se zvýšenou morbiditou a mortalitou u předčasně narozených dětí [15].
Struktura rohové vrstvy (obr. 1)
Image 1. Schematické znázornění horních vrstev epidermis s náhledem na důležité složky kožní bariéry 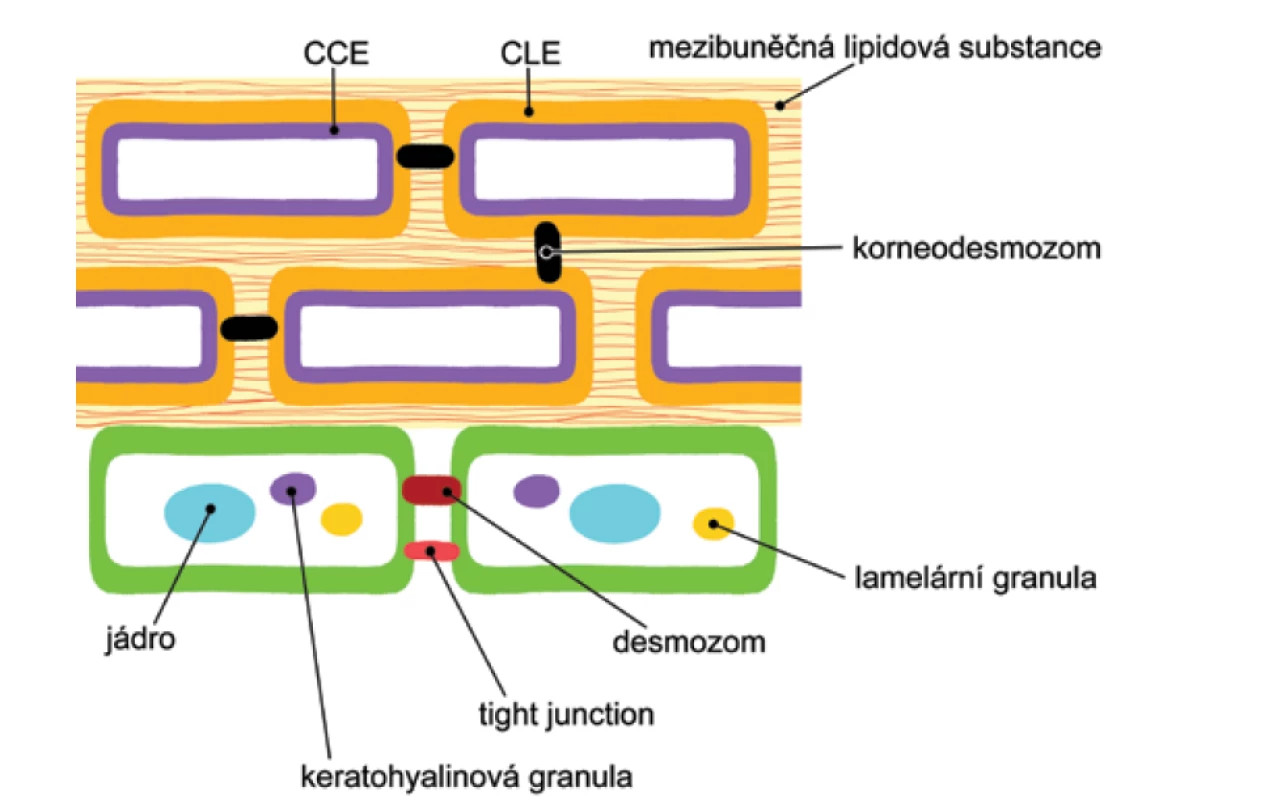
CCE – zrohovělá buněčná obálka
CLE – lipidová obálka korneocytu
Volně upraveno podle [1].Rohová vrstva je zásadní pro bariérovou funkci epidermis. Svou stavbou připomíná cihlovou zeď. Její základní složkou jsou keratinocyty stratum corneum (korneocyty) – „cihly“ a mezibuněčná lipidová substance – „tmelící materiál“.
Korneocyty obsahují 3 důležité složky kožní bariéry [1]:
1. keratiny, filagrin a jejich degradační produkty;
2. zrohovělou buněčnou obálku (cornified cell envelope – CCE);
3. lipidovou obálku korneocytu (corneocyte lipid envelope – CLE).
CCE a CLE nahrazují buněčnou membránu, která je na povrchu keratinocytů v nižších vrstvách epidermis. Proces rohovění zahrnuje také degradaci buněčných organel prostřednictvím proteáz. Důležitou roli v tomto procesu hraje gradient koncentrace Ca2+.
• Filagrin (filamenta agregující protein) je přítomen v keratohyalinových granulích stratum granulosum ve formě shluků (profilagrin). Při vstupu buněk do stratum corneum je štěpen na monomery filagrinu. Je důležitý pro správnou funkci rohové vrstvy v mnoha aspektech:
a) Umožňuje spojení polymerizovaných vláken keratinů v korneocytech.
b) Je postupně degradován na kyseliny trans-urokanovou a pyrolidone 5-karboxylovou, které jsou součástí přirozeného zvlhčujícího faktoru (NMF – natural moisturising factor) uvnitř korneocytů. NMF obsahuje i laktát, močovinu, ionty (Na, K, Cl, Mg, Ca…), aminokyseliny a další složky. Tvoří asi 10 % objemu korneocytů. Tyto tzv. přirozené humektanty aktivně vychytávají vodu z prostředí a zajišťují tím pružnost kůže, osmotickou rovnováhu a funkční prostředí pro proteolytické enzymy zodpovědné za deskvamaci rohové vrstvy. Nižší obsah NMF je pozorován při stárnutí kůže, po expozici UV a koupání, použití mýdel, atopické dermatitidě, psoriáze a ichtyózách.
c) Výše zmíněné kyseliny přispívají k acidifikaci povrchu epidermis. Kyselé prostředí je antibakteriální a zároveň důležité pro správnou funkci enzymů účastnících se tvorby ceramidů, které jsou základní složkou mezibuněčné lipidové substance. Taktéž udržuje integritu epidermální bariéry inhibicí proteáz. Na tvorbě kyselého kožního filmu se však podílí i další mechanismy, jak bude zmíněno níže.
d) Kyselina trans-urokanová je zároveň významným chromatoforem absorbujícím UVA i UVB záření (transformuje se tím na cis-urokanovou kyselinu).
LOF (loss of function – ztráta funkce) mutace filagrinu má za následek vznik ichtyosis vulgaris. Je to semi-dominantně dědičné onemocnění, které se manifestuje už při mutaci jedné alely, ale příznaky jsou výraznější, když jsou mutované alely obě. Mutace filagrinu jsou také asociované s rizikem atopické dermatitidy a sekundárního astmatu, riziko je opět vyšší při mutaci obou alel. Kromě mutací je u atopiků prokázáno nižší množství kopií genu pro filagrin (CNV – copy number variation – variace počtu kopií, tj. alely kódují různé množství filagrinových monomerů). Ukazuje se, že nejenom mutace genu, ale i variace počtu genových kopií hraje roli v patogenezi různých onemocně - ní. Dobrým klinickým vodítkem u mutace filagrinu je hyperlinearita a mírné či střední ztluštění kůže dlaní a chodidel, a to u atopické dermatítídy i u ichtyosis vulgaris [3] (obr. 2).
Image 2. Hyperlinearita ve dlaních je klinickou známkou mutace filagrinu, ruce atopika 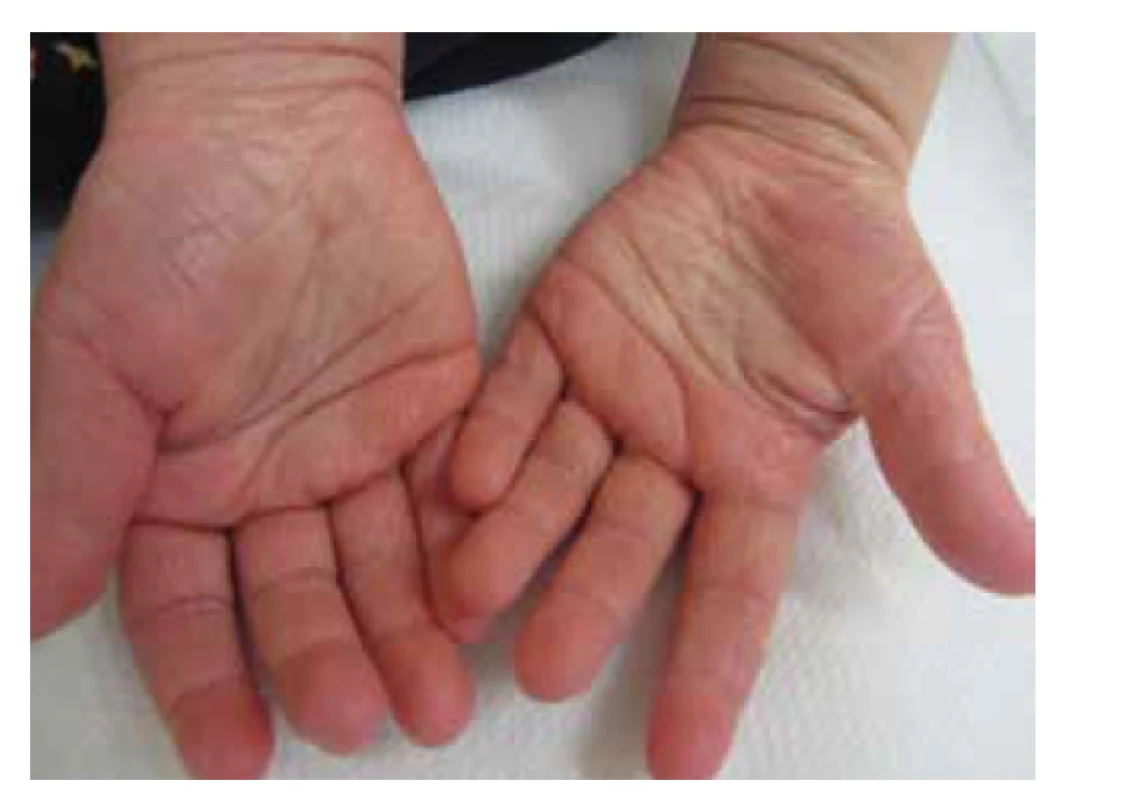
• Zrohovělá buněčná obálka (CCE) je síť tvořená kovalentně vázanými proteiny. Mezi hlavní strukturální proteiny CCE patří loricrin (jeho mutace znemožňuje inkorporaci do CCE a vzniká tzv. loricrin keratoderma s palmoplantární hyperkeratózou a mírnou ichtyózou a erytrodermií končetin, někdy i collodion baby) a involucrin, které jsou kovalentně svázané enzymem 1 (patogenní varianty genu jsou zodpovědné za více než 50 % případů lamelární ichtyózy). Dalšími složkami je filagrin a malé proteiny bohaté na prolin, které mají také schopnost chránit kůži před kyslíkovými radikály. CCE zároveň slouží k ukotvení korneodesmozomů spojujících korneocyty rohové vrstvy. Ve srovnání s desmozomy mají specifické zastoupení proteinů a buněčná část spoje je integrována do CCE. Rozdílné charakteristiky desmozomů v závislosti na vrstvě můžeme pozorovat i v nižších partiích epidermis (známá stratifikace exprese desmogleinu 3 a desmogleinu - 1).
• Lipidová obálka korneocytu (CLE) je tvořená jednou vrstvou hydroxyceramidů a v hydroxy-mastných kyselinách s velmi dlouhým řetězcem (více než 20 uhlíků) a je kovalentně navázaná na involucrin v CCE. Směrem ven také vytváří jakési lešení pro ukotvení lipidů mezibuněčné tmelící substance. Všechny tyto lipidy spolu s hydrolytickými enzymy můžeme najít v lamelárních granulích (Odlandových tělískách, která pocházejí z Golgiho komplexu). Tato tělíska se objevují v horních vrstvách stratum spinosum, shlukují se ve stratum granulosum a na rozhraní se stratum corneum fúzují s buněčnou membránou a uvolňují tak svůj obsah. Zdá se, že ω-OH-(glucosyl)Cer jsou odolné vůči degradaci ceramidázami, čímž je udržována bariérová funkce epidermis. U atopiků je obsah ceramidů nižší, a to může být jedním z faktorů přispívajících ke snížení funkce kožní bariéry, navíc i patogenní bakterie disponují ceramidázami. Syntéza ceramidů je postižena u autozomálně recesivních kongenitálních ichtyóz (dysfunkce cytochrome P450 omega hydroxylázy, arachidonát lipooxygenázy a dalších enzymů), Gaucherovy nemoci (může být také jednou z příčin collodion baby) a taktéž např. u dietního deficitu esenciálních mastných kyselin (projevuje se kromě jiného xerózou, alopecií, zhoršeným hojením ran a zvýšeným rizikem infekce). Za příčinu Harlequin ichtyózy se považuje porucha transportu lipidů do lamelárních granul (LOF mutace ABCA12 lipidového transportéru). Stejná mutace byla detekována i u některých keratinopatických ichtyóz.
Mezibuněčná lipidová substance obsahuje především ceramidy, cholesterol a nasycené volné mastné kyseliny (řetězec delší než 20 uhlíků), které vytváří bilaminární struktury. Studie ukazují, že při nedostatku filagrinu dochází ke zvýšenému podílu volných mastných kyselin v mezibuněčné substanci a tím se narušuje přísně organizovaná struktura lipidových lamel. Mezi onemocnění spojené s poruchou metabolismu cholesterolu patří X-vázáná ichtyóza způsobená dysfunkcí steroid sulfatázy (cholesterol sulfát není odbourán, narušuje se deskvamace rohové vrstvy, v důsledku snížené produkce estriolu dochází u přenašeček k pomalu postupujícímu porodu).
Na povrchu kůže se dále nachází ochranný kyselý kožní film, některé jeho složky již byly zmíněny v odstavci o filagrinu. Dále je tvořen produktem mazových žláz, který obsahuje i vitamín E s antioxidačními vlast nostmi a zejména mastné kyseliny s kratším řetězcem (méně než 20 uhlíků), které mají antibakteriální a fungicidní účinek. Patří k nim např. kyselina laurová a kyselina sapienová, která je jedinečná pro člověka – homo sapiens).
K bariérové funkci navíc přispívají i tight junctions (TJ) mezi buňkami stratum granulosum. Spolu se strukturami stratum corneum TJ regulují toky iontů, vody, středně velkých a velkých molekul zevnitř ven i zvenku dovnitř.
Pilosebaceózní a apokrinní jednotka
Vývoj adnexálních struktur vyžaduje přesnou epitelo - mezenchymální interakci, tj. tyto deriváty ektodermu jsou, zdá se, determinovány právě přilehlou dermální strukturou. Zárodky vlasových folikulů se tvoří pod vlivem signálů z dermis, nejdříve na hlavě plodu kolem 10. týdne ve formě ztluštění epidermis tzv. epidermální plakody (tab. 2). Dermis v kontaktu s plakodou naopak pod vlivem buněk plakody kondenzuje a tvoří základ dermální papily. Z epidermální plakody se stává vlasový zárodek (hair germ), posléze proliferující do hloubky jako vlasový čep (hair peg). Dolní část čepu postupně obklopuje dermální tkáň příští dermální papily a formuje bulbus (bulbous hair peg). Ten obsahuje rychle se dělící buňky – matrix, ze které vzniká samotný vlas a jeho epitelové pochvy. Okolní mezenchym se kondenzuje a tvoří fibrózní pochvu vlasu. Vnitřní kořenová pochva doprovází vlas od bulbu až po vyústění mazové žlázy. Zevní epitelová pochva pokračuje až k interfolikulární epidermis a přechází v ní. Zevní epitelová pochva obsahuje melanocyty, Merkelovy a Langerhansovy buňky, důležité pro hmatovou a obrannou funkci folikulu. Melanocyty jsou také přítomny v bulbu, kde předávají melanin buňkám matrix. Obdobným způsobem se zakládají všechny typy vlasů: lanugo, velusové (bulbus sahá do dermis a jsou nepigmentované) a terminální (jejich bulbus sahá až do podkoží). Na determinaci typu vlasu se podílí i dermální papila, která je také zdrojem četných růstových faktorů, což je dalším příkladem tak důležité dermo-epidermální interakce. V průběhu puberty se pod vlivem sexuálních hormonů mění velusové vlasy v některých oblastech na vlasy terminální. Pokud k tomu dochází v atypických oblastech u žen, mluvíme o hirsutismu.
Vlasové folikuly nejsou přítomny v dlaních a na chodidlech a na červeni rtů. Koncem 5. měsíce jsou viditelné první vlasy u fétu – v 17. týdnu se objevuje lanugo, obočí je patrné dokonce již koncem 4. měsíce, některé údaje dokonce popisují první lanugo už ve 12. týdnu. Vlasy rostou až do konce 7. měsíce a posléze dochází k zástavě růstu – první katagen a telogen, který je následován novým anagenem, perinatálně dochází ke ztrátě lanuga a je zahájen 3. anagen v pořadí. Ze začátku je cyklus synchronizován, po porodu se cykly desynchronizují a střídají se mozaikovitě. V současnosti se domníváme, že po porodu se už nové folikuly netvoří. U novorozence je dokonce pozorována 10krát vyšší hustota folikulů. Jejich počet je přibližně 5 milionů u obou pohlaví [19].
Ve 4. měsíci se na vlasovém čepu vytvoří 3 buněčné shluky, v pořadí z hloubky k povrchu jsou to:
1. tzv. bulge – rozšíření zevní kořenové pochvy v místě, kde se k vazivové pochvě folikulu na konci II. trimestru přikládají vlákna m. arrector pili (kromě obočí a řas). Oblast bulge se dnes považuje za sídlo kmenových buněk vlasového folikulu. Odsud je možná i reepitelizace ran při ztrátě interfolikulárních kmenových buněk. V průběhu cyklu (katagen a telogen) zaniká dolní segment folikulu (bulbus a suprabulbární oblast) včetně matrix, proto nemůže být matrix zdrojem pro obnovu vlasového folikulu v novém cyklu, ale jsou to právě kmenové buňky bulge, ze kterých se na začátku dalšího vlasového cyklu vytvoří nový dolní segment.
2. z prostředního shluku buněk se vyvíjí mazová žláza – oblast folikulu mezi bulge a mazovou žlázou se nazývá istmus. Část folikulu nad vyústěním mazové žlázy se nazývá infundibulum [17]. Mazová žláza produkuje maz pod vlivem mateřských a fetálních androgenů z kůry nadledvin plodu (tato fetální zóna tvoří 80–90 % kůry nadledviny a involvuje v prvních měsících po porodu, což koreluje s obvyklou remisí acne neonatorum). Další aktivace nastává až v období puberty.
3. nejvýše položený shluk buněk je v určitých oblastech zdrojem pro vývoj apokrinní žlázy, které jsou patrné v 7. měsíci na většině povrchu těla, ale v posledních měsících těhotenství zanikají kromě některých oblastí (axily, mons pubis, předkožka, scrotum, labia minora). Jsou přechodně aktivní in utero, ale po porodu jsou v klidovém stavu až do puberty. Vývod apokrinní žlázy se vyprazdňuje do folikulu v oblasti infundibula. Apokrinní žlázou je také žláza prsní.
Nehty
Vývoj nehtu začíná mezi 8. a 10. týdnem, kdy je na epitelu v dorzální části distálních článků prstů patrná mírně vkleslá hladká čtvercová zóna nehtového políčka (nail field) ohraničená proximálně a laterálně mělkým zářezem. Proximální část epitelu se mírně vklíní do mezenchymu a z ní se poté vyvine matrix (ventrální a dorzální), z mezenchymu proximální nehtové lůžko. Epidermis na dorzu distálního článku je první, která keratinizuje, a to už kolem 11.–13. týdne. Tento primární tzv. falešný nehet (ještě pro něj není typický tzv. tvrdý typ rohovění viz níže) je posléze nahrazen novým definitivním nehtem vyrůstajícím z nehtové matrix, který kompletně pokryje nehtové lůžko na rukou koncem 8. měsíce, na nohou přibližně v době porodu. Nehtová ploténka přesahující špičky prstů je jedním ze znaků zralosti plodu [8].
Epitel vlasů a nehtů patří k tzv. tvrdým rohovějícím epitelům, neobsahuje stratum granulosum a buňky těchto epitelů se neodlupují, pouze se opotrěbují. Buňky vlasu a nehtů obsahují speciální typy keratinů (hard type, např. K31-34, 81, 85), které jsou uspořádané longitudinálně a obklopeny matrix tvořenou tzv. keratin asociovanými proteiny. Geny pro tyto proteiny se liší u různých živočišných druhů – to vysvětluje variabilitu adnexálních struktur (peří, srst, šupiny, drápy…). Někdy se pro keratinocyty obsahující keratiny s vysokým obsahem cysteinu používá i název trichocyty. Cystein umožňuje svými chemickými vazbami vytvořit pevný materiál nehtů a vlasů.
Ekrinní žlázy
Na přelomu 2. a 3. měsíce se pod epidermis ve dlaních a na ploskách objevují polštářky mezenchymu. Následně dochází v těchto místech k vyklenutí epidermis, čímž se formuje charakteristický reliéf hmatových lišt. Ve 4. měsíci se na spodině epidermis v pravidelných intervalech objevují čepy, které prorůstají do dermis ve formě pruhů a na jejich spodní straně se po dosažení dolní retikulární dermis či podkoží koncem 4. měsíce diferencují sekretorické buňky a kanalizuje se vývod v dermální části, později v 6. měsíci i v části epidermální (akrosyringium). K jeho spirálovitému stočení dochází až po porodu. Na kůži ochlupené se ekrinní žlázy začínají diferencovat až v 5. měsíci. Ekrinní žlázy nejsou vyvinuty na kůži areol, rtů a glans penis. Adaptační odpověď na změnu teploty prostředí pocením u zralých novorozenců je malá, ale zlepšuje se cca do 10. dne, největší je na čele. Naopak emočně podmíněná sekrece potu je nejvýraznější na dlaních a chodidlech. Děti narozené před 36. týdnem nejsou schopny pocení, tato funkce se upravuje přibližně do 2 týdnů po porodu [9]. Poruchy vývoje ekrinních potních žláz jsou součástí ektodermálních dysplazií. Pot obsahuje především vodu, močovinu, kyselinu mléčnou a malé množství iontů.
Porucha funkce ekrinních žláz vzniká například u cystické fibrózy (CF), kde dochází ke zvýšnému vylučování chloridů v potu, což je využíváno v diagnostice tohoto onemocnění. Příčinou je narušená funkce transmembránového chloridového kanálu (mutace CFTR) v sekrečních epitelech, takže nedochází k jeho zpětnému vstřebávání v buňkách vývodů ekrinních žláz. U pacientů s CF i u zdravých nosičů mutovaného genu je oproti nepostiženým jedincům mnohem výraznější a rychlejší proces tzv. akvagenního vrásnění dlaní – kdy se po ponoření do vody kůže řasí a ve dlaních se vytvoří bělavá elevovaná ložiska. Příčina není přesně známá, uvažuje se o zvýšeném obsahu solí v epidermis, dysfunkci buněk vývodů ekrinních žláz atd. [27].
Melanocyty
Melanocyty pocházejí z neurální lišty. Neurální lišta se formuje během prvního měsíce embryonálního vývoje z neurální trubice a je zdrojem celé řady buněk, které migrují podle přesného časového harmonogramu po přesně definovaných dráhách do různých tkání organismu. Melanoblasty (prekurzory melanocytů) migrují z neurální lišty dorzolaterálním směrem (obr. 3). Ve 2. měsíci a pomocí monoklonálních protilátek lze přítomnost melanoblastů v epidermis prokázat už kolem 6.–7. týdne. Tvoří přibližně 5-10 % buněk stratum basale epidermis. Koncem 10. týdne se melanocyty asociují se strukturami vlasového folikulu, kde jsou zodpovědné za pigmentaci vlasů. Ve fetálním období jsou melanocyty přítomny i v dermis, jsou ale nejspíše nalezeny na cestě do epidermis. Kongenitální dermální melanocytóza (Mongolská skvrna) – obrázek 4 – a nevus Ota a Ito jsou považovány za poruchu této migrace. Recentně se ukazuje, že tyto poruchy spolu s vaskulárními malformacemi v rámci phacomatosis pigmentovascularis (50 % případů je spojeno se systémovými projevy očními, neurologickými, muskulárními a nádory) mohou být způsobeny postzygotickými mutacemi α podjednotek G-proteinů (GNAQ a GNA11), obdobně jako McCune Allbright syndrom (členité cafe au lait makuly, hormonální změny a osteofibrózní dyplazie kostí způsobené mutací GNAS1) či Sturge-Weber syndrom (nevus flammeus a ipsilaterální leptomeningeální angiomatóza) [26]. Rozsáhlé, ventrální a neregredující formy kongenitální dermální melanocytózy mohou být také asociovány s lysozomálními střádavými onemocněními [4].
Image 3. Schematické znázornění zdrojových tkání pro vývoj kůže 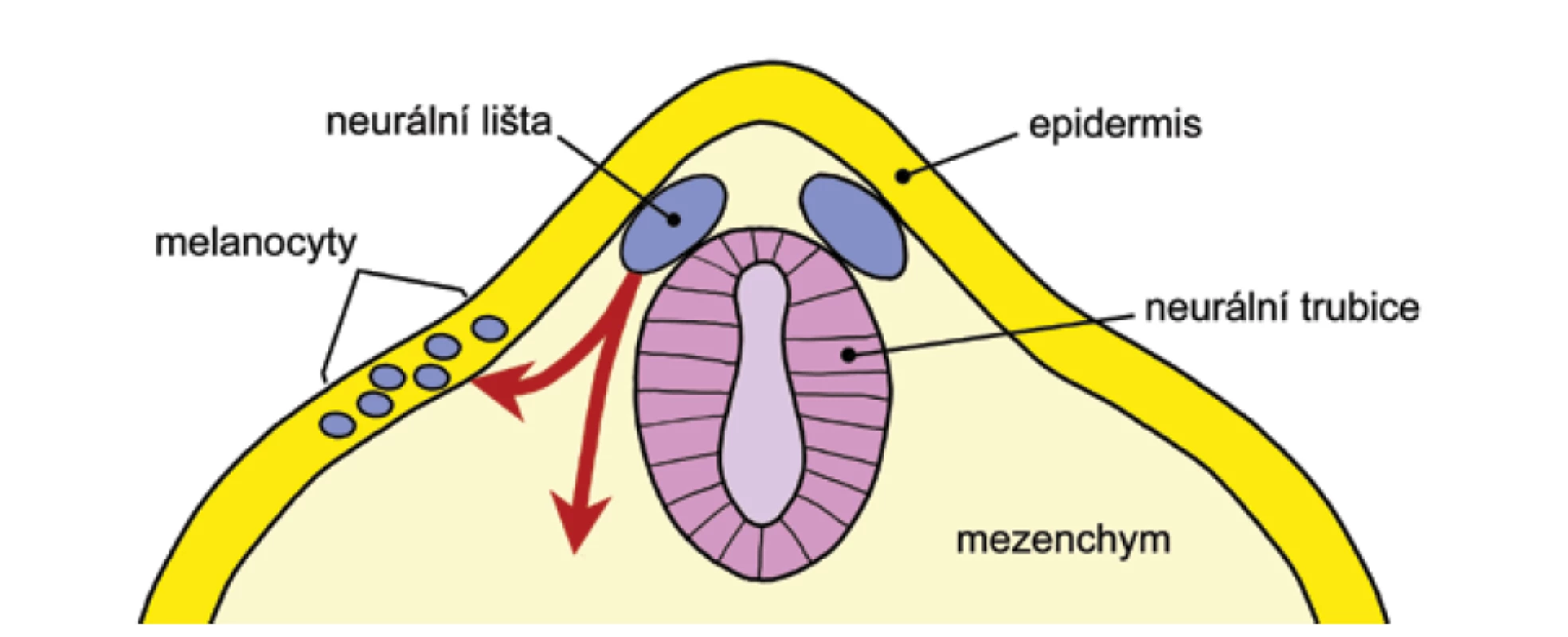
Pro názornost se v obrázku překrývá více časových vrstev (1.–2. měsíc). Červené šipky naznačují migraci buněk neurální lišty s důrazem na melanocyty. Image 4. Kongenitální dermální melanocytóza a její typická lokalizace v lumbosakrální oblasti a na zádech
Nekomplikované případy mizí v prvních letech života.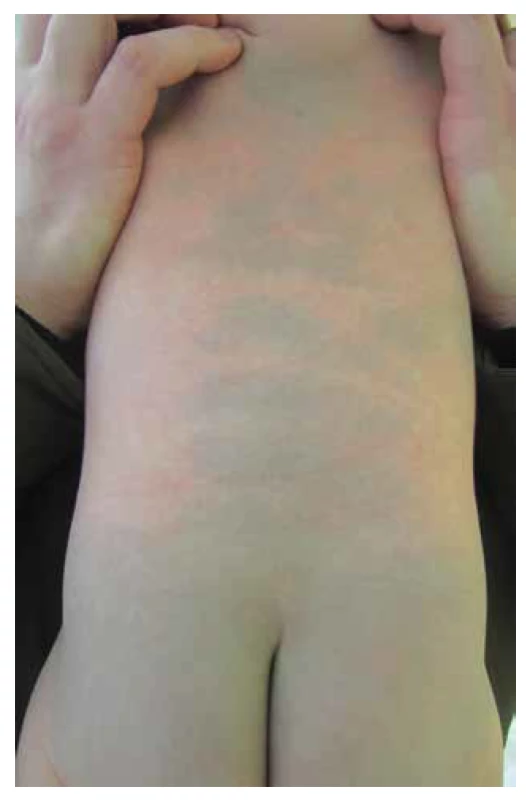
Z neurální lišty dále pochází dermis, hladká svalovina a tuková tkáň obličeje, měkké pleny, periferní neurony a glie v oblasti krku, trupu a končetin, některá ganglia hlavových nervů, dorzální (senzitivní) ganglia, parasympatická a sympatická ganglia autonomního nervového systému včetně enterálního, Schwannovy buňky, ale i chrupavky a kosti v oblasti hlavy a vnitřního ucha, svaly duhovky a corpus ciliare a také odontoblasty [21]. To vysvětluje kombinované vrozené vady těchto struktur při tzv. neurokristopatiích (neurální lišta – neural crest). Řadíme sem např. neurofibromatózu typu I, Waardenburgův syndrom, albinismus totální i piebaldismus – parciální albinismus. Piebaldismus vzniká poruchou migrace melanoblastů zapříčiněnou mutací KIT genu a je velmi častý u zvířat (králíků, skotu, koní…) – obrázek 5. Řadíme sem také neurokutánní melanózu, jejíž nověji navrhovaný název je syndrom kongenitálního névu a v širším pojetí sem můžeme zařadit dokonce i melanom [28]. U syndromu kongenitálních névů se kromě gigantických či mnohočetných kongenitálních névů popisuje i mírná endokrinní dysfunkce, charakteristické rysy obličeje a velmi zřídka metabolické kostní onemocnění. V 80 % případech syndromu nebo u mnohočetných kongenitálních névů byla nalezena pravděpodobně kauzální postzygotická mutace NRAS, a to u více névů jednoho jedince. Mutace BRAF V600E byla nalezena jenom u jednotlivých névů. NRAS mutace byla přítomna i v melanocytárních či nemelanocytárních lezích v CNS. Není však přítomna ve zdravé kůži či krevních elementech, takže se jedná o mozaicismus. U zřídkavých familiárních případů se může jednat o mutaci zárodečnou, pravděpodobně v melanokortinovém receptoru 1 [7, 10].
Image 5. Piebaldismus – ostře ohraničené okrsky depigmentace 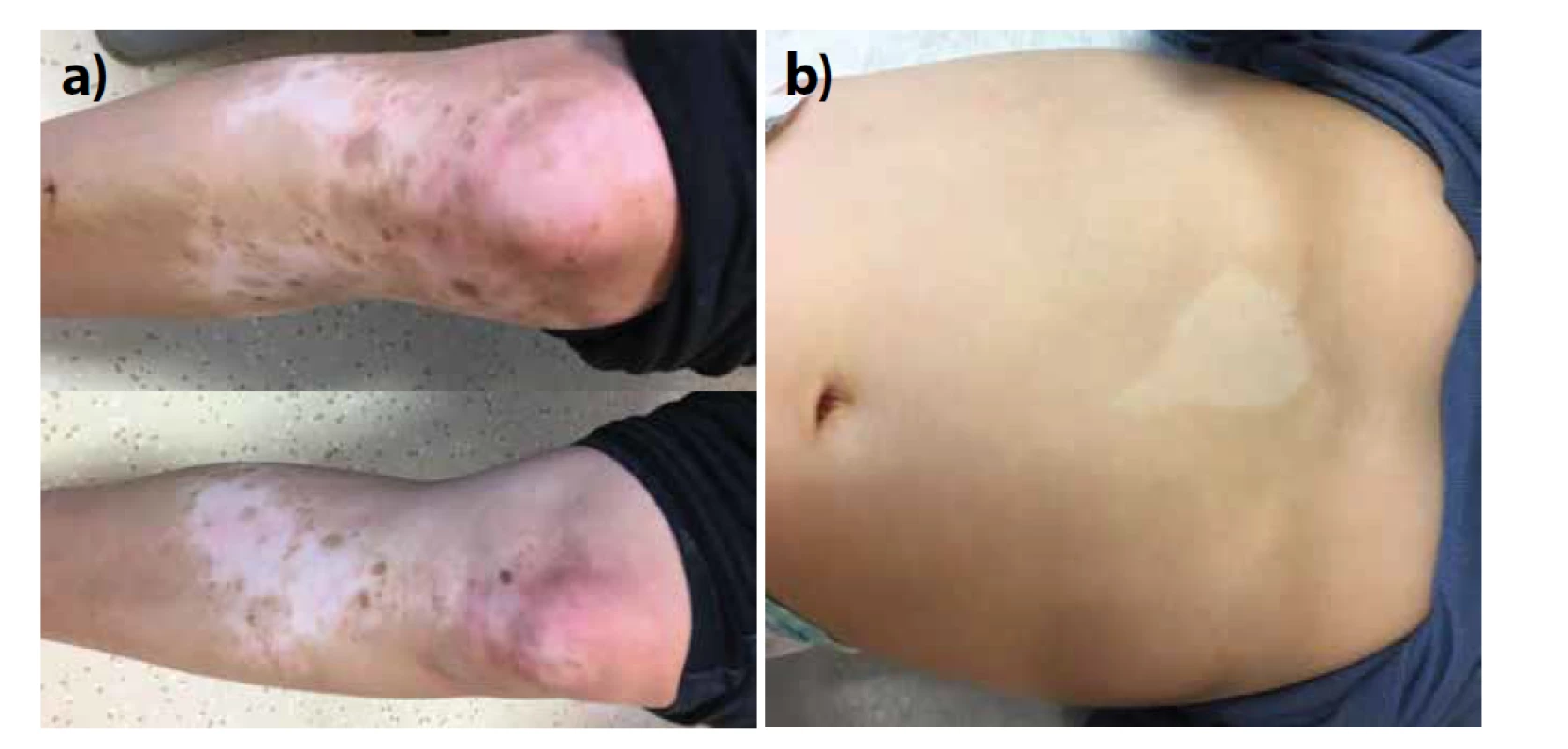
Typická lokalizace uprostřed končetin se zachovalými ostrůvky normální pigmentace až hyperpigmentace a centrálně na přední straně trupu. Na rozdíl od vitiliga jsou projevy přítomny od narození, závažnost projevů záleží od typu mutace v c-KIT genu.
a) matka, b) dítě
(Laskavě zapůjčeno prim. MUDr. Janou Čadovu, FN Motol.)Dermoepidermální junkce
Komplexní struktura dermoepidermální junkce se formuje běhěm 2. trimestru z doposud jednoduché bazální membrány embrya a její plochý reliéf se postupně vlní do rete ridges a dermálních papil. Ke konci 12. týdne už na epidermální straně nacházíme hemidesmozomy a na straně dermální kotvící fibrily kolagenu VII. V dermis pod bazální membránou se přibližně ve 12. týdnu vytvářejí i specifické struktury interagující s epidermálními buňkami, důležité ve vývoji adnex. Jsou to zárodky papil vlasových folikulů, fibrózní pochvy vlasového folikulu a mezenchym nehtového lůžka (viz vývoj adnex). U novorozenců a kojenců je undulace rete ridges bohatší a pravidelnější než v dospělém věku [22]. Adheze bazálních keratinocytů je zajištěna pomocí hemidesmozomů, které mají četné komponenty intracelulární (keratin 5/14, plectin, BPAG1…), transmembránové (BPAG2 – kolagen XVII, integrin α6β4) a extracelulární (laminin, kolagen VII-kotvící fibrily). Různé mutace těchto stavebních komponent mají za následek četné formy epidermolysis bullosa simplex (např. keratin 5/14, plectin a viz i desmozomální proteiny), junkční (laminin, integriny, kolagen XVII) a dystrofické (kolagen VII). Postižené jsou i bazální membrány sliznic.
Dermis a subcutis
Dermis v obličeji a přední části kštice spolu se svaly a kostmi obličeje pochází z neurální lišty (ektomezenchym), na ostatních částech těla pochází dermis z mezodermu. Mezoderm je lokalizován pod ektodermem, po stranách neurální trubice a vytváří se z něj mezenchym – základ pojivových tkání (viz obr. 3). V I. trimestru, již embryonální fibroblasty syntetizují kolagen, a to především kolagen III (v dermis u dospělých naopak převažuje kolagen I a kolagen III zde tvoří volnější retikulární síť s tenčími vlákny např. kolem tukových buněk, v hematopoetických tkáních a v části bazálních membrán), ale fibrily kolagenu ještě nevytvářejí pevná vlákna. Definitivní elastická vlákna jsou v dermis patrná až v 6. měsíci. Na přelomu 3. a 4. měsíce je již patrný rozdíl mezi papilární a retikulární dermis. Avšak studie pomocí konfokální laserové mikroskopie udávají méně výrazný přechod mezi papilární a retikulární dermis ještě i u dětí ve věku od 6–24 měsíců po narození, právě díky nedostatečné tloušťce kolagenních vláken. Dermis novorozence má ve srovnání s dospělým vyšší obsah vody a vyšší buněčnost, méně patrnou hranici mezi dermis a podkožním tukem a je tenčí. Zajímavý je fakt, že poranění u fetů do konce druhého trimestru se hojí bez jizvy, dokonce i časně po porodu je hojení ran rychlejší a téměř bezjizevnaté. Předpokládá se, že zde hraje roli predominance kolagenu III, malá schopnost jeho zesítění, vyšší schopnost migrace a proliferace fibroblastů, časnější a vyšší produkce kyseliny hyaluronové, nižší produkce prozánětlivých cytokinů, rychlejší epitelizace [6, 12, 22].
Rozhraní dermis a subcutis je pozorováno ke konci druhého trimestru. V II. trimestru začínají preadipocyty akumulovat lipidy a ve III. trimestru jsou adipocyty uspořádány v lalůčcích oddělených vazivovými septy. Nárůst objemu tukové tkáně je největší v posledních týdnech gestace. U jiných savců je v porovnání s lidským plodem množství tukové tkáně v době porodu mnohem menší.
Hnědá tuková tkáň má největší význam v adaptaci na extratuterinní podmínky po porodu (změna teploty, krátkodobý nedostatek potravy). Je specifická tím, že buňky na vnitřní mitochondriální membráně exprimují UCP-1 (uncoupling protein) – protein umožňující odpřažení gradientu H+ iontů od syntézy ATP, čímž se energie substrátů uvolňuje ve formě tepla, a to asi 300krát intenzivněji než v jiných tkáních – tzv. netřesová termogeneze. Hnědý tuk se objevuje kolem 20. týdne a jeho produkce roste až do 35. týdne. Adipogeneze je zde koordinována s vaskulogenezí. Hnědou barvu mu dodává vysoký obsah mitochondrií, obsah drobných tukových kapének a bohatší cévní zásobení. Hlavní lokalizací hnědého tuku u fétů a novorozenců je oblast cervikální, okolí perikardu, aorty, trachey, pankreatu, ledvin, nadledvin. Po porodu klesá množství UCP1 m RNA a posléze i proteinu. Během dětství a adolescence je postupně nahrazován tukem bílým a u dospělého zbývá asi 40–50 g hnědého tuku zejména v supraklavikulární oblasti. Hnědý tuk je však detekován i u dospělých, kteří se často pohybují venku. Uvažuje se i o úbytku hnědého tuku s věkem právě díky používání oděvu a častému pobytu lidí ve vnitřních prostorech. U dospělého jedince nacházíme i tzv. béžový tuk, kde se mezi jednotlivými adipocyty bílého tuku nachází buňky zvyšující za určitých podmínek expresi UPC1 (chlad, sympatomimetika, druh potravy atd.). V současné době se zkoumá vztah hnědého tuku k obezitě [2, 24].
Z dědičných onemocnění s poruchou tvorby dermis a subcutis lze zmínit fatální restriktivní dermopatii způsobenou poruchou zrání laminu A (intermediární filamentum v jaderném obalu). Přesný mechanismus dermálního defektu není znám. Již intrauterinně je pozorována hypokineze, dermis je tenká, tuhá, tvoří se eroze. Nemoc je spojená s postižením dalších systémů. Dítě umírá časně po porodu. Jiné patogenní varianty stejného genu jsou spojené s familiární parciální lipodystrofií, kde chybí tuková vrstva na končetinách, a naopak je nadměrně vyvinutá v axiálních částech těla. Adipocyty nejspíše díky defektu nukleární membrány nejsou schopny plnit svoji zásobní funkci. Další nemocí je fokální dermální hypoplazie (Goltzův syndrom), dědí se X vázaně, proto přežívají ženy, které jsou díky lyonizaci X chromozomu postiženy mozaikovitě. Postižení muži přežívají zřídka. Je způsobená patogenní variantou genu PORCN, který kóduje proteiny důležité pro funkci Wnt signální kaskády ovlivňující vývoj kůže, kostí a očí. Onemocnění se projevuje pruhy s teleangiektaziemi a herniací subkutánního tuku skrze tenkou dermis, žluto-červeno-hnědými papulami až noduly až ulceracemi, dystrofiemi nehtů, řídkými vlasy, palmární hypo/ hyperhidrózou, očními vadami a malformacemi prstů, eventuálně postižením dalších orgánových systémů. Cutis laxa je onemocnění způsobené poruchou tvorby elastických vláken na základě mutací různých genů (elastin, fibulin) s různým typem dědičnosti charakterizované nepružnou volnou kůží, dysmorfíí obličeje, postižením velkých cév a srdce, plic, divertikly a prolapsy či herniemi. Průběh jednotlivých variant je různě závažný. Získaná varianta onemocnění je nespíš vyprovokovaná různými zevními a vnitřními spouštěči u jedinců s genetickou predispozicí a manifestuje se spíše v dospělém věku. S mutací fibrilinu-1, který je součástí elastických vláken čočky, aorty a kůže, je spojen Marfanův syndrom. Hlavními příznaky jsou vysoký vzrůst, dlouhé končetiny, arachnodaktylie, nedostatek podkožního tuku, strie, ektopie čočky, dilatace aorty a chlopenní a muskuloskeletální vady. Ehlers-Danlosův syndrom je skupinou onemocnění s autozomálně recesivní či dominantní dědičností způsobených mutacemi genů pro různé druhy kolagenu, jejich posttranslační modifikaci či syntézu proteinů extracelulární matrix. Společným jmenovatelem je hyperelasticita kůže, hypermobilita se subluxacemi kloubů, častou je tvorba modřin, nehojící se či atrofické jizvy, vaskulární typ (kolagen III) je spojen s postižením chlopní, varixy, rupturami arterií, střeva, či dělohy v průběhu třetího trimestru. Klasický typ (kolagen V) má na pohmat typicky sametovou kůži.
Nervový systém kůže
Neurální struktury v kůži pocházejí z neurální lišty (viz výše). Patří k nim senzitivní nervová vlákna včetně specializovaných nervových zakončení (senzorická tělíska) a vlákna vegetativní (sympatická) inervující žlázy, cévy a m. arrector pili. Kůže nemá parasympatickou inervaci. Senzitivní neurony leží v dorzálních míšních gangliích (vlákna dále směřují zadním míšním kořenem do zadních rohů míšních). Senzitivní vlákna zachovávají segmentální inervaci, ale v určité míře přesahují i do sousedních dermatomů (oblast dermis zejména na trupu vyvíjející se z jednoho úseku mezodermu). Jelikož inervace kožních okrsků a orgánů se setkává v zadním míšním kořeni, může při onemocnění některých orgánů být určitý okrsek kůže přecitlivělý na dotek (tento okrsek kůže může být vzdálen od projekce orgánu na povrch kůže, jelikož vnitřní orgány během vývoje migrují spolu se svými nervovými vlákny). Okrsky kůže, do kterých se promítá poškození daného orgánu, se označují jako Headovy zóny. Obecně platí, že vlákna senzitivní prorůstají do cílových orgánů o něco později než vlákna motorická, ale i tak se první vlákna v dermis objevují už v 5. týdnu. Přibližně v 15. týdnu začínají nervová vlákna prorůstající ze subkutánních plexů formovat subepidermální plexus, který je dobře diferencován cca do 23. týdne. Spektrum impulzů, které vnímáme pomocí senzitivních vláken v kůži je velmi široké. Tato fenotypová diverzita se formuje během prenatálního a časného postnatálního vývoje sekvenční aktivací různých transkripčních faktorů. Prorůstání nervových vláken do kůže a jejich zrání a funkce jsou prenatálně ovlivňovány neurotrofiny (NT) produkovanými kůží. Exprese různých NT je typická pro různé buňky v kůži (keratinocyty, fibroblasty, melanocyty, potní žlázy, hladkou svalovinu m. arrector pili). Příkladem může být neurotrofin-3 (NGF), jeho koncentrace je přímo úměrná hustotě inervace dané oblasti. NT pravděpodobně kontrolují i epidermální homeostázu. Nervová vlákna naopak po dosažení kůže exprimují receptory pro tyto NT [13]. Prostřednictvím volných nervových zakončení, která se nachází v epidermis, dermis i subcutis vnímáme teplotu, tlak, dotek, napětí a bolest. Epidermální volná nervová zakončení se objevují na ploskách už v 16. týdnu a jejich denzita postupně roste. Merkelovy buňky, lokalizované v bazální vrstvě epidermis, jsou asociované s nervovými vlákny. V kůži se objevují ve 4. měsíci. Také obsahují keratiny a jsou spojeny s keratinocyty pomocí desmozomů. Je zajímavé, že jejich funkce doposud není přesně definována, považují se za mechanoreceptory či receptory hmatové. V období embryonálního vývoje se nachází i v dermis a slouží obdobně jako majáky navigující prorůstání nervových vláken, poté z dermis mizí [14]. Kolem vlasových folikulů se kromě volných nervových zakončení a Merkelových buněk nachází také Pacciniho tělíska (rychle se adaptující receptory akcelerace, vibrace), Ruffiniho tělíska (pomalu se adaptující receptory napětí, tahu) a receptory rychlosti. Meissnerova tělíska specializovaná na jemný dotek se nachází v dermálních papilách zejména dlaní a rtů. Pacciniho tělíska jsou také v podkoží a slouží k vnímání větších tlakových změn a vibrací. Krauseho tělíska jsou v neochlupené kůži a v podkoží a vnímají zejména napětí. Pro vývoj senzorických tělísek jsou důležitá nervová vlákna. Interakce mezi nimi a cílovými buňkami je obousměrná, ovlivňují i tvorbu neneurálních součástí tělísek např. vazivových obalů. Asi ve 3. týdnu tvořící se tělísko bez interakce s nervovým vláknem podlehne apoptóze, později již tato závislost není tak úzká. Senzitivní nervy jsou již relativně vyzrálé během prvního postnatálního měsíce, stabilní je i počet neuronů [13]. I když anatomicky je systém vytvořen, jeho funkční zrání pokračuje ještě i po porodu, jak bude uvedeno v kapitole o funkčním zrání kůže.
Cévní systém kůže
Krevní i lymfatické cévy pochází z mezodermu. První cévy se vyvíjí už v 1. měsíci, kdy se za účasti signálů z endodermu (např. BMP, VEGF – cévní endotelový růstový faktor, viz tab. 2) některé buňky splanchnického mezodermu transformují v angioblasty, ze kterých vznikají buňky endotelu tvořící drobné vezikulární struktury, které pak splývají v duté cévy, které jsou v dermis patrné již v prvním trimestru. Tento proces se nazývá vaskulogeneze. Prokázalo se, že angioblasty jsou přítomné i v kostní dřeni a periferní krvi dospělého člověka. Posléze až do 3. trimestru dochází k tvorbě plexů (uplatňují se opět geny ze skupin VEGF, BMP, TGFβ, Notch, Shh…). Za stimul podporující tvorbu cév se považuje hypoxie, zvyšující tvorbu VEGF a jeho vyšší exprese je pozorována i u infantilních hemangiomů v růstové fázi včetně exprese GLUT 1 (erytrocytárního glukózu transportujícího proteinu). Hypoxie také zvyšuje produkci NO (oxid dusnatý), čímž dochází k dilataci cév, extravazaci plazmatických proteinů a aktivaci matrix metaloproteináz, které ulehčují proces pučení cév. Nejdříve se vytváří jeden a pak dva paralelní plexy a speciální větvě zásobující vlasové folikuly. Tvorba cévního systému, diferenciace arterií a žil se nazývá angiogeneze, ve které se uplatňuje proces pučení a intususcepce cév již vytvořených ve stadiu vaskulogeneze. Funkční zrání pokračuje i po porodu viz níže. Lymfatické cévy pocházejí také z mezodermu, mohou se vyvíjet z venózních a nevenózních prekurzorů (např. kapilár či hematopoetických prekurzorů). Determinace lymfatických endoteliálních buněk vyžaduje opět účast specifických regulačních molekul (např. SOX18 a PROX1 transkripční faktory). Struktury lymfatického systému jsou pozorovány až v 5. týdnu jako lymfatické váčky. Později se napojují na žilní systém, kam se lymfa drénuje. Drobné lymfatické cévy v dermis a podkoží šíje byly pozorovány již v 11.–16. týdnu. U Turnerova syndromu se vyskytuje hypoplazie lymfatických cév, která vede k tvorbě nuchálního cystického hygromu, který je diagnostickým znakem při prenatálním sonografickém screeningu. Většina kongenitálních lymfedémů (časný I typ Nonne-Milroy, peripubertální II typ Meige a pozdní III typ) jsou spojeny s poruchou funkce proteinů signálních dráhy VEGF-C/VEGFR3, ale i SOX 18 [11, 20].
Imunitní systém kůže (SALT – skin associated lymphoid tissue)
Zahrnuje buňky imunintního systému dlouhodobě přítomné v kůži, které jsou hematopoetického původu. Hematopoéza v embryu začíná ve žloutkovém váčku, posléze se přesouvá do jater a také k ní přispívají i buňky z určitých částí aorty [20]. SALT zahrnuje epidermální a dermální složky. Samozřejmě v rámci imunitní odpovědi dochází k migraci některých buněk (např. LB migrují do lymfatických uzlin, kde prezentují antigen, neutrofily a eozinofily do epidermis atd). Specifické imunitní prostředí má vlasový folikul a mazová žláza.
Epidermální složka:
– nespecifická: keratinocyty,
– specifická: T lymfocyty.
Dermální složka:
– nespecifická: bazofily, eozinofily, neutrofily, žírné buňky, makrofágy, endotel, fibroblasty;
– specifická: NK buňky, T a B lymfocyty.
Dendritické buňky jsou považovány za spojnici mezi nespecifickou a specifickou imunitní odpovědí a sídlí v epidermis (LB) i v dermis.
Langerhansovy buňky (LB) se v epidermis objevují už v 7. týdnu gestačního vývoje a pocházejí převážně z období jaterní hematopoeze. Ve II. trimestru kůže plodu již obsahuje četné buňky imunitního systému (makrofágy, žírné buňky, dendritické buňky a T a B lymfocyty), ale v mnohem nižším množství než u dospělého člověka. Zároveň je v tomto období nižší hladina chemoatraktantů, které umožňují homing imunitních buněk v kůži. Dále bylo pozorováno vyšší množství protizánětlivých makrofágů M2 typu, regulačních T lymfocytů a protizánětlivého cytokinu TGF-β, což svědčí o imunosupresivním prostředí. Tento fakt pravděpodobně sehrává roli i v nejizevnatém hojení ran [29].
Funkční zrání – plnohodnotná kožní bariéra (obr. 6).
Image 6. Bariérové funkce kůže 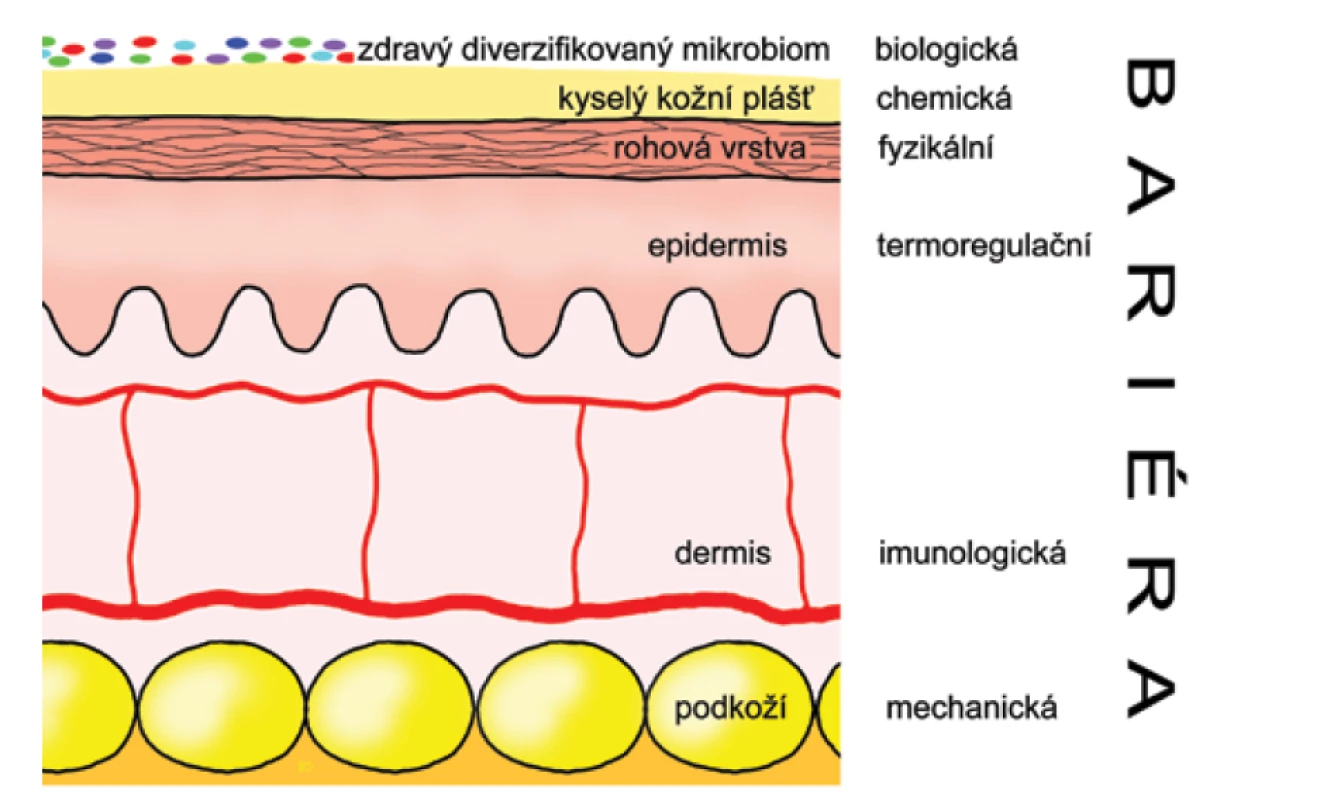
Kůže novorozence, i když anatomicky téměř zralá, není ještě zcela zralá funkčně. Některé práce uvádějí, že je celkově tenčí (1,2 mm) než u dospělého člověka (2,1 mm) a také má mírně tenčí epidermis (30 versus 36 μm) a stratum corneum (7 versus 10 μm), u dětí jsou také drobnější korneocyty [22]. Tyto rozdíly jsou ještě patrnější u předčasně narozených dětí. U těchto dětí je zrání kůže po porodu urychlené a bariérová funkce se dostává na úroveň zralého novorozence během 2–3 týdnů, u nedonošených s extrémně nízkou porodní hmotností tento proces může trvat až 4–8 týdnů. Úplná změna biofyzikálních vlastností kůže může v závislosti od části těla trvat až celý rok, v tomto období je kůže více náchylná k iritaci a infekci. Jedná se zejména o následující změny:
• Povrch kůže novorozence má neutrální pH, částečně i pod vlivem alkalické amniové tekutiny. Acidifikace probíhá různě rychle na různých částech těla, u zralého novorozence trvá v průměru několik dní, u nedonošence i týdny. Cílovou hodnotou je přibližně pH 5,5. K acidifikaci přispívá enzymatické štěpení fosfolipidů na volné mastné kyseliny a histidinu na kyselinu cis-urokanovou a také sekrece laktátu potními žlázami a později mikrobiální degradace triglyceridů produkovaných mazovými žlázami. Opoždění tohoto procesu narušuje integritu rohové vrstvy a zvyšuje riziko mechanického poškození kůže (změny metabolismu lipidů, deskvamace, rovnováha proteáz/antiproteáz).
• Vývody ekrinních potních žláz v epidermis jsou i u zralých dětí při narození rovné, spirálovitými se stávají až posléze. U novorozenců je proto zvýšená transkutánní absorpce léčiv či chemických látek. Neschopnost pocení zejména u nedonošených dětí (viz vývoj ekrinních žláz) vyžaduje regulaci teploty zevního prostředí.
• Ještě není zcela vyvinutá neurovegetativní regulace, což se projevuje např. v podobě akrocyanózy či cutis marmorata, která zmizí v prvním roce života. U nedonošených dětí nezralost neurovaskulárních struktur přispívá k vyšší termolabilitě nebo tzv. harlequin barevným změnám (ataky přesně ohraničené tmavěji prokrvené horní poloviny těla a bledé dolní poloviny těla nejspíše vznikající v důsledku nezralé hypotalamické regulace cévního tonu v prvním týdnu života).
• Kolonizací kůže komenzály se u donošených dětí objevuje 2.–3. den po porodu. Je dočasně rozdílná u dětí narozených per vias naturales (více bakterií typických pro vaginální flóru např. laktobacily) a po porodu císařským řezem (více bakterií typických pro kůži dospělého např. stafylokoky, streptokoky, korynebakterie a propionibakterie). Novorozenecká kůže je více hydratovaná než kůže dospělého člověka, a proto je zpočátku na jejím povrchu více stafylokoků, které jsou typické pro vlhké oblasti kůže dospělých [16]. Malassezie osídluje kůži už první den po porodu a dosahuje denzity srovnatelné s dospělou kůží už v prvním měsíci postnatálně. Postupně s věkem se diverzita kožního mikrobiomu zvyšuje a v dospělosti je rozdíl mezi osídlením různých oblastí kůže určitými bakteriemi (liší se oblasti vlhké, suché a seboroické). Některé kožní erupce u novorozenců se považují za možnou reakci kůže na osídlení mikroorganismy. Patří sem erythema toxicum neonatorum, či neonatální cefalická pustulóza (reakce na osídlení malassezií). Tuto jednotku někteří autoři považují za variantu acne neonatorum, někteří za samostatnou entitu. V diferenciální diagnóze k akné jsou léze monomorfní, nejsou folikulárně vázané a chybí komedony. U seboroické dermatitidy chybí jednoznačný důkaz pro patogenetickou roli malassezií. Osídlení mikroorganismy je důležité pro vyzrávání imunitního systému dítěte. Také u atopické dermatitidy je snížená diverzita mikrobiomu a zvýšené osídlení Staphylococcus aureus v non-lezionální i lezionální kůži. Není však dosud jasné, jestli je dysbióza mikrobiomu primární nebo nasedá na poruchu kožní bariéry [18]. Ukazuje se, že u novorozenců existuje schopnost navodit toleranci k osídlení kůže určitými bakteriemi např. Staphylococcus epidermidis. Kůže novorozenců má tedy nejspíše obdobné imunologické okno, jaké je dnes uznáváno u gastrointestinálního imunitního systému. Je charakterizováno vyšší přítomností Treg IL-17A CD8+ lymfocytů a k této toleranci nejspíše přispívá právě kožní mikrobiom prostřednictvím aktivace IL-1. Naopak při pozdějším osídlení touto bakterií je silnější zánětlivá odpověď. Kůže je však schopna rozeznat patogenní bakterie i v novorozeneckém období – tady tolerance nevzniká. Například u kolonizace S. aureus je alfa toxin důležitým aktivátorem alarminové odpovědi.
Blaschkovy linie
Blashkovy linie byly popsány poprvé v roce 1901 německým dermatologem Alfredem Blaschkem. Reprezentují nejspíše dráhy migrace a proliferace epidermálních buněk v průběhu intrauterinního vývoje. Lze uvažovat i o tom, že se jedná o klony jednotlivých epidermálních kmenových buněk (klon tvoří úsek kůže, který pochází z jednoho buněčného prekurzoru) [23]. Tyto několikacentimetrové okrsky leží na trupu horizontálně a podélně na končetinách, nepřekračují přední střední čáru, jejich rozsah a pozice je obdobná u různých individuí a neodpovídají zcela dermatomům. U zdravého jedince nejsou viditelné, ale jsou patrné u některých vrozených onemocnění např. epidermální névy, incontinentia pigmenti, hypo/ hypermelanózy, fokální dermální hypoplazie (obr. 7). Stejně se manifestují i segmentální formy zánětlivých onemocnění např. lichen planus, psoriasis vulgaris, m. Darier atd. Jedná o typ tzv. mozaicismu kdy mutace vzniká po rozdělení zygoty a genotypově odlišné buňky mají i odlišný fenotyp – liší se od okolní normální kůže. Typ mozaicismu záleží na době vzniku mutace, postiženém genu, typu mutace v tomto genu atd. To rozhoduje o množství postižených tkání a závažnosti projevů, tj. některé kožní projevy mohou být spojeny i s postižením jiných orgánů. Pokud mutace postihne i zárodečné buňky, může se původně mozaiková forma u rodiče projevit ve všech buňkách potomka (epidermolytická hyperkeratotická forma epidermálního névu u rodiče – keratinopatická (epidermolytická) ichtyóza u potomka). Tyto vady jsou dnes předmětem intenzivního výzkumu.
Image 7. Blaschkovy linie
a) hyperpigmentace, b) hypopigmentace
ZÁVĚR
S rozšiřujícími se poznatky moderní medicíny se potvrzují staronové souvislosti a je zřejmé, že kůže je orgán, který může být zrcadlem celého organismu. Funguje nejenom jako fyzikální bariéra, součást neuro - imuno-endokrinního systému, ale má taktéž velký psychosociální význam. Znalosti o její struktuře a vývoji může v interdisciplinární diagnostice uplatnit nejenom dermatolog. Naopak, dobře viditelné změny na kůži mohou být užitečným vodítkem i pro praktické lékaře, pediatry a další specialisty.
Poděkování
Autorka děkuje Mgr. Janu Kacvinskému za grafickou spolupráci.
Do redakce došlo dne 9. 7. 2021.
Adresa pro korespondenci:
MUDr. Zuzana Plzáková, Ph.D.
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 499/2
128 00 Praha 2
e-mail: zuzana.plzakova@lf1.cuni.cz
Sources
1. AKIYAMA, M. Corneocyte lipid envelope (CLE), the key structure for skin barrier function and ichthyosis pathogenesis. J Dermatol Sci, 2017, 88, p. 3–9.
2. AVRAM, A. S., AVRAM, M. M., JAMES W. D. Subcutaneous fat in normal and diseased states 2. Anatomy and physiology of white and brown adipose tissue. J Am Acad Dermatol, 2005, 53, p. 681–683.
3. FUKUIE, T., JASUOKA, R., FUJIYAMA, T. et al. Palmar hyperlinearity in early childhood atopic dermatitis is associated with filaggrin mutation and sensitization to egg. Pediatric Dermatol, 2019, 36, p. 213–218.
4. HANSON, M., LUPSI J. R., HICKS, J. et al. Association of dermal melanocytosis with lysosomal storage disease. Arch Dermatol, 2003, 139, p. 916–920.
5. HOATH, S. B. MAURO, T. Fetal skin development. In Eichenfeld, L, Frieden, I., Mathes, E. et al. in Neonatal and Infant Dermatology, 3rd Edition, London, W B Saunders, 2014, p. 1.
6. HU, M. S., BORRELLI, M. R., HONG, W. X. et al. Embryonic skin development and repair. Organogenesis, 2018, 14, p. 46–63.
7. KINSLER, V., SHAW, A. C., MERKS, J. H. M. et al. The face in congenital melanocytic nevus syndrome. Am J Med Genet Part A, 2012, 158 A, p. 1014–1019.
8. KOSTER, M. I., LOOMIS, C. A., KOS, T. et al. Skin development and maintenance. In BOLOGNIA, JL., JORIZZO, JL., SCHAFFER, JV. Dermatology, 3rd Edition. Philadelphia. Elsevier/Saunders, 2012, 2, p. 55–59.
9. KUSARI, A., HAN, M. A., VIRGEN, C. A. et al. Evidence - based skin care in preterm infants. Pediatr Dermatol, 2019, 36, p16–23.
10. LIM, Y. H., OVEJERO, D., SUGERMAN J. S. et al. Multilineage somatic activating mutation in HRAS and NRAS cause mosaic cutaneous and skeletal lesions, elevated FGF23 and hypophosphatemia. Hum Mol Genet, 2014, 23, p. 37–407.
11. MARZIANO, C., GENET, G., HIRSCHI, K. K. Vascular endotelial cell specification in health and disease. Angiogenesis, 2021, epub. Dostupné z doi 10.1007/ s10456-021-09785-7.
12. MATEU, R., ŽIVICOVÁ, V., DROBNÁ KREJČÍ, E. et al. Functional differences berween neonatal and adult fibroblasts and keratinocytes: donor age affects epithelial-mesenchymal crosstalk in vitro. Int J Mol Med, 2016, 38, p. 1063–1074.
13. MONTAÑO, J. A., PÉREZ‐PIÑERA, P., GARCÍA‐SUÁ - REZ, O. et al. Development and Neuronal Dependence of Cutaneous Sensory Nerve Formations: Lessons From Neurotrophins. Microscopy Research and Technique, 2010, 73, p. 513–529.
14. NARISAVA, Y., HASIHMOTO, K., NIHEI, Y. et al. Biological significance of dermal Merkel cells in development of cutaneous nerves in human fetal skin. J Histochem Cytochem, 1992, 40, p. 65–71.
15. NESS, J. N., DAVIS, D. M. R., CAREY, W. A. Neonatal skin care: a consise review. Int J Dermatol, 2013, 52, p. 14–22.
16. ORANGES, T., DINI, V., ROMANELLI, M. Skin physiology of the neonate and infant: clinical implications. Advances in wound care, 2015, 4, p. 587–595.
17. SAXENA, MOK, M., K. W., RENDL, M. An updated classification of hair follicle morphogenesis. Exp Dermatol, 2019, 28, p. 334–344.
18. SCHOCH, J. J., MONIR, R. L., SATCHER, K. G. et al. The infantile cutaneous microbiome: A review. Pediatric Dermatol, 2019, 36, p. 574–580.
19. SCHOENWOLF, G., BLEYEL, S., BRAUER, P. et al. Development of the skin and its derivatives. In Larsen ´s Human Embryology, Philadelphia, Churchill Livingstone, 2014, p. 203.
20. SCHOENWOLF, G., BLEYEL, S., BRAUER, P. et al. Development of the vasculature. In Larsen´s Human Embryology, Philadelphia, Churchill Livingstone, 2014, p. 390.
21. SCHOENWOLF, G., BLEYEL, S., BRAUER, P. et al. Fourth week: Forming the embryo. In Larsen´s Human Embryology, Philadelphia, Churchill Livingstone, 2014, p. 107.
22. STAMANAS, G. N., NIKOLOVSKI, J. LUEDTKE, M. A. et al. Infant skin microstructure assesed in vivo differs from adult skin in organization and at the cellular level. Pediatr Dermatol., 2010, 27. p. 125–131.
23. STRACHAN, L. R., GHADIALLY, R. Tiers of clonal organization in the epidermis: the epidermal proliferation unit revisited. Stem Cell Review, 2008, 4, p. 149–157.
24. SYMONDS, M. E., POPE, D., SHARKE, M. et al. Adipose tissue and fetal programming. Diabetologia, 2016, 55, p. 1597–1606.
25. TAIEB, A. Skin barrier in the neonate. Pediatr Dermatol, 2018, 35, s. 5–9.
26. THOMAS, A. C., ZENG, Z., RIVIÈRE, J.-B. et al. Mosaic activating mutations in GNA11 and GNAC are associated with phacomatosis pigmentovascularis and Sturge-Weber syndrom. J Invest Dermatol, 2016, 136, p. 770–778
27. THOMAS, J. M., DURACK, A., STERLING A. et al. Aquagenic wrinkling of the palms: a diagnostic clue to cystic fibrosis carrier status and non - classic disease. Lancet, 2017, 389, p. 846.
28. VEGA-LOPEZ, G. A., CERRIZUELA, S., TRIBULO, C. et al. Neurocristopathies: New insights 150 years after neural crest discovery. Developmental Biology, 2018, 444, p. S110–S143.
29. WALRAVEN, M., TALHOUT, W., BEELEN, R. H. J. et al. Healthy human second-trimester fetal skin is deficient in leukocytes and associated homing chemokines. Wound Repair Regen, 2016, 24, p. 533–541.
30. ZHANG, X., YIN, M., ZHANG, L.-J. Keratin 6,16, 17 – critical barrier alarmin molecules in skin wounds and psoriasis. Cells, 2019, 8, p. 807.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2021 Issue 4-
All articles in this issue
- Vývoj kůže a její bariérová funkce
- KONTROLNÍ TEST
- Vliv dlouhodobé terapie adalimumabu na biomarkery systémového zánětu u psoriázy
- Atopický ekzém – zkušenosti s léčbou dupilumabem v době koronaviru
- Pustuly a krusty ve kštici. Stručný přehled
- Zápis ze schůze výboru ČDS konané dne 17. 6. 2021
- Odborné akce 2021
- Czech-Slovak Dermatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vývoj kůže a její bariérová funkce
- Pustuly a krusty ve kštici. Stručný přehled
- Atopický ekzém – zkušenosti s léčbou dupilumabem v době koronaviru
- Vliv dlouhodobé terapie adalimumabu na biomarkery systémového zánětu u psoriázy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career