-
Medical journals
- Career
Vlastní zkušenosti s nestandardním dávkovacím režimem etanerceptu a jeho výhody
Authors: M. Tichý; D. Ditrichová
Authors‘ workplace: přednostka doc. MUDr. Dagmar Ditrichová, CSc. ; Klinika chorob kožních a pohlavních LF UP a FN Olomouc
Published in: Čes-slov Derm, 86, 2011, No. 6, p. 274-278
Category: Pharmacologyand Therapy, Clinical Trials
Overview
Stanovení optimálních léčebných dávek jednotlivých biologických preparátů a určení standardních dávkovacích režimů u psoriázy je výsledkem rozsáhlých randomizovaných studií. Za určitých situací je možné indikovat odlišný dávkovací režim. Většinou se jedná o krátkodobé využití vyšších léčebných dávek z důvodu navození rychlejší remise onemocnění. Méně často je využíváno dávek nižších než standardně doporučených, a to především z obavy z nedostatečného léčebného účinku. Zkušenosti s využitím nízkých dávek etanerceptu v terapii těžkých forem psoriázy a jeho výhody jsou předmětem uvedeného sdělení.
Klíčová slova:
psoriáza – etanercept – dávkovací režimyÚVOD
Biologická léčba dnes tvoří vrchol terapeutických možností u řady imunitně podmíněných onemocnění. V dermatologii je rutinně využívána v terapii těžkých forem psoriázy. V současné době jsou v této indikaci v České republice k dispozici čtyři preparáty. Etanercept, adalimumab a infliximab ze skupiny inhibitorů TNF alfa (tumor necrosis factor) a dále ustekinumab, který je monoklonální protilátkou blokující aktivitu IL 12 a 23 (interleukin). Blokátory TNF alfa jsou s úspěchem využívány již několik let. Jejich pozitivní efekt, ale i nežádoucí účinky, jsou dnes již poměrně dobře prověřeny řadou studií i zkušenostmi z praxe [3, 4, 5, 7, 11, 12, 16, 22]. Ustekinumab je preparátem novějším, jehož jedinou indikací je doposud právě psoriáza, a proto dlouhodobější zkušenosti jsou zatím do jisté míry omezené. Terapeutické výsledky tohoto preparátu i jeho bezpečnostní parametry se však jeví velmi slibně [10].
Indikační kritéria pro zahájení biologické terapie psoriázy se řídí doporučenými postupy, které se průběžně aktualizují [1, 15, 17]. Postup při volbě biologického preparátu není dogmaticky stanoven, vždy je nutné přihlédnout k různým faktorům u konkrétního pacienta. Mezi důležité parametry, které je třeba při výběru preparátu zohlednit, se řadí zejména klinická forma onemocnění, výskyt přidružených chorob, rychlost nástupu účinku, dlouhodobá účinnost přípravku, bezpečnostní lékový profil, možnost přerušení terapie a její opětovné nasazení a konečně i preference pacienta [8, 9, 17]. Přestože se léčebná strategie částečně liší i podle místních zvyklostí, určitý návod a sjednocující pohled nabízí např. aktualizovaná verze Doporučení pro biologickou léčbu psoriázy Britské dermatologické společnosti (BAD) ze srpna 2009 [17].
Jedním z limitujících faktorů pro ještě širší využití biologické léčby je zejména její ekonomická nákladnost. Tento problém se samozřejmě týká i léčby psoriázy. Finanční náročnost na všechna čtyři v současnosti užívaná biologika v indikaci těžkých forem psoriázy je přibližně srovnatelná, ekonomický faktor není obvykle při výběru preparátu příliš zohledňován. Jednou z mála možností, jak v současné době výrazně snížit náklady na léčbu, jsou méně obvyklé dávkovací režimy. Tyto je možné uplatnit zvláště u etanerceptu.
POPIS PŘÍPADŮ
Ve snaze ekonomicky racionalizovat terapii našich pacientů a zároveň udržet dosaženou remisi onemocnění jsme se pokusili přejít na udržovací dávkovací režim etanerceptu 1krát týdně 25 mg zatím u dvou nemocných, které jsme vytipovali jako vhodné kandidáty pro tento postup.
První pacientkou byla 63letá žena bez jiných zdravotních potíží, léčená pro psoriázu od 20 let věku. Zpočátku byl průběh onemocnění kontrolován zevní terapií, následně v kombinaci s fototerapií. Progrese choroby a stupňující se rezistence na uvedené léčebné postupy byly důvodem pro nasazení cyklosporinu, který byl po půl roce pro nedostatečný efekt vysazen. Následovalo několikaleté období terapie metotrexátem, kdy byla choroba stabilizována. Vzhledem k celkové kumulativní dávce metotrexátu i jeho snižující se účinnosti byla pacientka před čtyřmi lety převedena na biologickou léčbu etanerceptem (obr. 1, 2). V úvodních 12 týdnech byl Enbrel podáván v režimu 2krát týdně 25 mg s dosažením úplné remise onemocnění. Následně byla pacientka převedena na pohodlnější dávkování 1krát týdně 50 mg po dobu následujících 6 měsíců. V tomto období byla léčba asi na sedm týdnů přerušena vzhledem k vleklejšímu infektu horních cest dýchacích. Mírný relaps onemocnění byl zvládnut opětovným nasazením etanerceptu v dávce 1krát týdně 50 mg. V této terapii nemocná pokračovala po dobu několika měsíců. Vzhledem k výborné odezvě a přetrvávající úplné remisi jsme se rozhodli přejít na nižší dávkování 1krát týdně 25 mg. K žádné negativní změně klinického stavu nedošlo a úplná remise trvá u této pacientky i po osmi měsících redukovaného dávkování etanerceptu (obr. 3).
Image 1. Obraz těžké formy chronické ložiskové psoriázy – stav před zahájením terapie etanerceptem 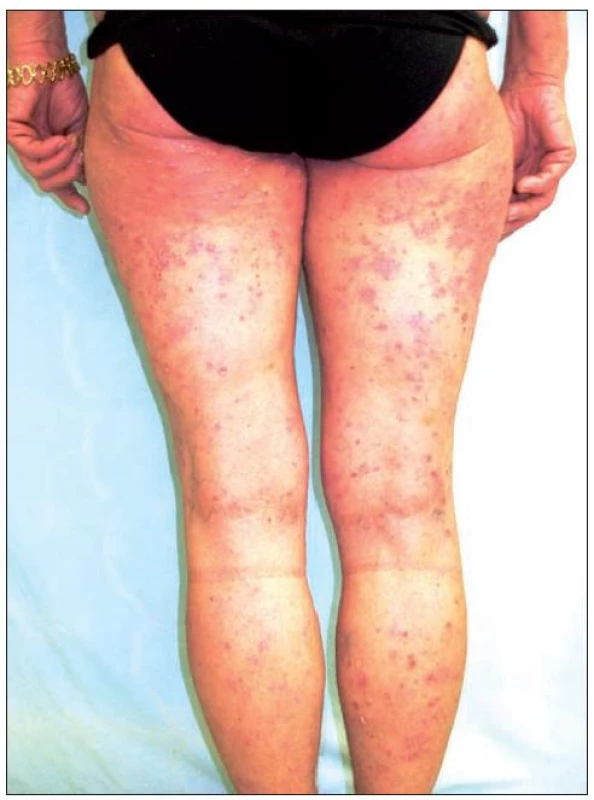
Image 2. Obraz těžké formy chronické ložiskové psoriázy – stav před zahájením terapie etanerceptem 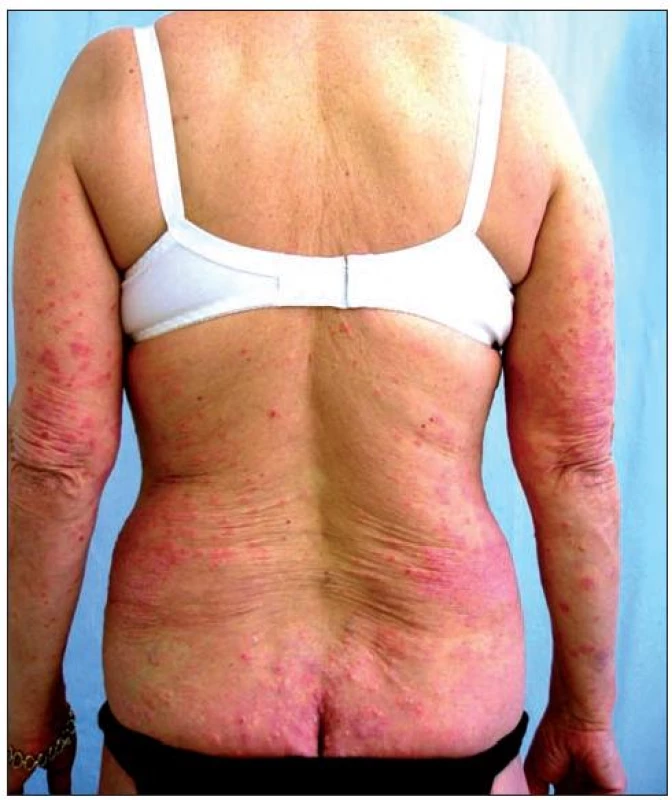
Image 3. Remise onemocnění při terapii Enbrelem v dávce 25 mg s c. 1krát týdně 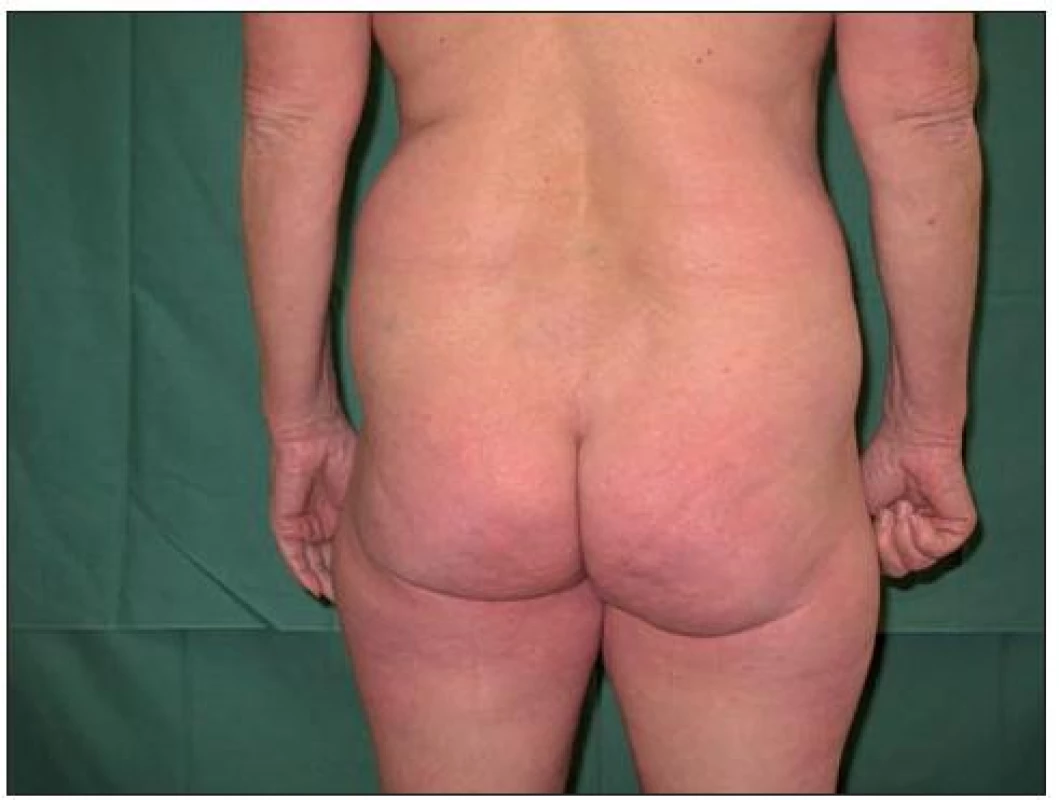
Druhým pacientem byl 42letý muž s bezvýznamnou osobní anamnézou, léčený pro psoriázu od 30 let věku. Původně mírná forma onemocnění s převážně predilekčním postižením postupně přešla do obrazu těžké formy chronické ložiskové psoriázy. Po několika letech se přidaly i kloubní potíže s dominujícím postižením bederní páteře, diagnostikované jako psoriatická sakroileitida. S ohledem na malý efekt zevní terapie a fototerapie byla zavedena léčba cyklosporinem s přechodně dobrou odezvou. Indukce hypertenze a subjektivně horší tolerance léčby byla po několika měsících příčinou redukce dávky cyklosporinu a následného relapsu onemocnění. Pacient byl převeden na terapii metotrexátem, při které se podařilo stabilizovat zejména kloubní potíže, méně již projevy kožní. Po dvou letech byla terapie metotrexátem ukončena pro nevýrazný efekt a byl nasazen etanercept 2krát týdně 25 mg (obr.4). Po 12 týdnech léčby bylo dosaženo úplné remise onemocnění. Pacient pokračoval v zavedeném dávkování dalších 20 měsíců s výborným efektem a následně byl převeden na dávkovací režim lkrát týdně 25 mg. Po 16 měsících terapie redukovanou dávkou etanerceptu se neobjevily známky exacerbace onemocnění, trvá úplná remise onemocnění s regresí kožních i kloubních projevů (obr. 5).
Image 4. Těžká forma chronické ložiskové psoriázy, selhání konvenční terapie – stav před léčbou etanerceptem 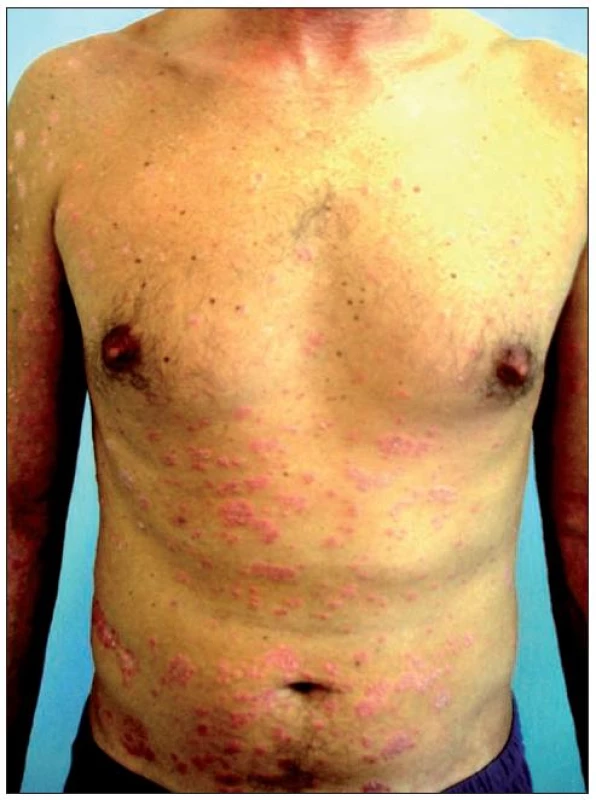
Image 5. Remise onemocnění, stav po 16 měsících léčby Enbrelem v dávce 25 mg s. c. 1krát týdně 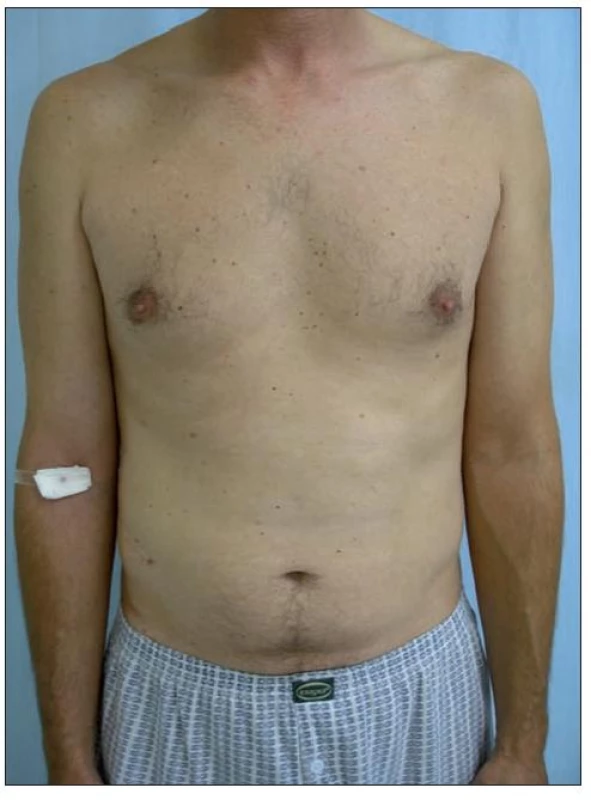
DISKUSE
Etanercept (Enbrel) je solubilní dimerický fúzovaný protein, který vzniká spojením extracelulární vazebné domény TNF alfa p75 s Fc oblastí lidského IgG1. Mechanismus účinku je založen na kompetitivní inhibici TNF alfa vazbou na jeho povrchové buněčné receptory, čímž dochází k vytvoření biologicky neaktivního TNF a oslabení jeho prozánětlivého účinku [19, 20, 22]. Etanercept inhibuje i TNF beta, který se rovněž podílí na zánětlivých procesech. Komplex TNF alfa/etanercept neváže komplement, a proto nezpůsobuje lýzu buněk a rozpad granulomů [6, 11, 20].
Spektrum nežádoucích účinků při terapii TNF alfa blokátory je velmi podobné. Drobné rozdíly u jednotlivých preparátů souvisí s odlišnostmi ve struktuře a molekulárním mechanismu účinku. Zvláštní pozornost je před zahájením terapie inhibitory TNF alfa a v jejím průběhu věnována screeningu TBC infekce, jelikož vzplanutí latentní tuberkulózy patří sice mezi vzácné, ale závažné potenciální komplikace léčby TNF alfa blokátory. Z popsaného mechanismu účinku etanerceptu logicky vyplývá, že u pacientů léčených tímto přípravkem je potencionální riziko reaktivace latentní TBC nižší než u monoklonálních protilátek infliximabu a adalimumabu, kde je základním mechanismem účinku lýza buněk produkujících TNF alfa a následný rozpad epiteloidních granulomů, což zřejmě usnadňuje případné uvolnění intracelulárně lokalizovaných mykobakterií a zvyšuje riziko reaktivace a diseminace TBC infekce [2, 6, 20].
Kontraindikace pro terapii inhibitory TNF alfa jsou v zásadě shodné pro všechny přípravky. Mezi absolutní kontraindikace podání TNF alfa blokátorů patří přecitlivělost na složky přípravku, těhotenství, kojení, vážné aktivní infekce, demyelinizační onemocnění, chronické srdeční selhání NYHA III–IV a malignita v anamnéze [1, 15, 17].
V současnosti je Enbrel jediným biologikem registrovaným v zemích Evropské unie pro léčbu těžkých forem psoriázy u dětí a dospívajících od 8 do 18 let věku [14].
Přípravek se aplikuje formou subkutánní injekce. Etanercept po subkutánní aplikaci dosahuje maximální koncentrace v séru přibližně po 48 hodinách, je vylučován do moči nebo žluče a poločas vylučování je asi 3–5 dnů. Studie neprokázaly, že by farmakokinetika etanerceptu byla ovlivněna poruchou jaterních a ledvinných funkcí, současným podáváním metotrexátu nebo acitretinu, věkem a pohlavím pacientů [3, 5, 20, 21]. Účinek léčby oproti monoklonálním protilátkám nastupuje pomaleji a bývá zřetelný obvykle po 6–8 týdnech od zahájení terapie [15, 17, 22].
Dávkovací schéma je poměrně flexibilní. Standardní doporučená dávka pro léčbu psoriázy u dospělých je 25 mg 2krát týdně nebo 50 mg 1krát týdně. V současnosti je v praxi častěji užívaný dávkovací režim 50 mg 1krát týdně, který vykazuje srovnatelnou klinickou účinnost jako režim 2krát týdně 25 mg a je pro pacienty pohodlnější [4, 19, 20, 22]. V úvodních 12 týdnech léčby lze pro urychlení nástupu účinku podat indukční dávku 50 mg 2krát týdně s následným přechodem na obvyklé dávkování [4, 21]. Zvýšenou dávku 2krát týdně 50 mg lze rovněž použít ke zvládnutí částečných relapsů onemocnění u již léčených pacientů, kdy doba jejího použití je individuální a trvá obvykle rovněž několik týdnů do navození opětovné remise. U dětí a dospívajících se Enbrel podává v dávce 0,8 mg/kg (maximálně však 50 mg) jednou týdně [14].
Méně využívaným léčebným schématem, ale rovněž možným a u biologické léčby psoriázy do jisté míry unikátním, je intervalová aplikace Enbrelu [13]. Tento léčebný postup vychází ze skutečnosti, že protilátky vytvářené u malého procenta pacientů v průběhu terapie etanerceptem mají non-neutralizační charakter, takže opakované nasazení preparátu vykazuje stejný účinek jako na začátku léčby [13, 20, 22]. Terapeutická okna při intervalovém dávkování jsou individuální a závisí především na klinickém stavu pacienta. Obecně by mělo platit, že k opětovnému nasazení etanerceptu přistupujeme při známkách výraznější exacerbace a aktivity onemocnění. Kromě ekonomických faktorů je současně s dalšími opatřeními výhodné využít intervalový dávkovací režim u rizikovějších pacientů (např. chronická hepatitida C, latentní TBC infekce, jaterní onemocnění jiné etiologie atd.) [18, 20]. Na druhé straně je ale tento dávkovací režim možné využít pouze u pacientů s velmi dobrou léčebnou odezvou, kde se podaří navodit prakticky úplnou remisi choroby. Intervalovou aplikaci není vhodné používat u pacientů, kde i při kontinuální léčbě jsou patrné známky aktivity choroby a remise je pouze částečná.
S ohledem na flexibilitu dávkovacích schémat etanerceptu jsme se rozhodli v praxi vyzkoušet i možnost nestandardního, ekonomicky výhodného dávkování etanerceptu. Kontinuální udržovací režim1krát týdně 25 mg s. c. jsem aplikovali u dvou vytipovaných kandidátů. Záměr dlouhodobě udržet dosaženou remisi za současného snížení nákladů na terapii se nám podařilo u obou pacientů úspěšně realizovat. Je třeba říct, že dávkovací schéma 1krát týdně 25 mg není u psoriázy standardně doporučeno, protože optimálního terapeutického účinku je v případě etanerceptu u většiny pacientů dosaženo při dávkování, které je uvedeno v obecné charakteristice přípravku. Přesto se zdá, že v individuálních případech bude možné tento alternativní udržovací léčebný režim s úspěchem využít.
ZÁVĚR
Dávkovací režim etanerceptu 1krát týdně 25 mg nelze považovat na rozdíl od intervalové aplikace za standardní postup, obojí však mají společného jmenovatele v ekonomické efektivitě a také v tom, že o jejich použití je možné uvažovat pouze u pacientů s výbornou klinickou odezvou na standardní dávkování etanerceptu. Naše zkušenosti jsou zatím limitované malým počtem pacientů, přesto se dlouhodobě udržovaná remise u vybraných pacientů i v režimu nízkého dávkování jeví slibně. Rozhodneme-li se přejít na ekonomicky úsporný dávkovací režim, máme tedy u Enbrelu dvě možnosti. Zatímco u rizikovějších pacientů bychom na základě našich zkušeností preferovali spíše intervalovou aplikaci, u ostatních nemocných s primárně velmi dobrou odpovědí na Enbrel se zdá být z hlediska klinické účinnosti výhodnější kontinuální dávkování 1krát týdně 25 mg.
Ostatní v současnosti užívané biologické preparáty pro terapii psoriázy – adalimumab, infliximab, ustekinumab – nenabízejí podobnou flexibilitu dávkování jako etanercept. Možnosti ekonomické úspory bychom při léčbě adalimumabem a ustekinumabem možná mohli u dlouhodobě stabilizovaných nemocných hledat v nepatrném prodloužení dávkovacího intervalu, u infliximabu spíše ve snížení celkově podané dávky. Vzhledem k obecně známé vyšší frekvenci tvorby neutralizačních protilátek, které mohou nepříznivě ovlivnit dlouhodobý terapeutický efekt monoklonálních protilátek, je však výsledek takového postupu ve vztahu k udržení dosažené remise nejistý a doposud s ním nemáme vlastní zkušenosti.
Do redakce došlo dne 6. 9. 2011.
Kontaktní adresa:
Odb. as. MUDr. Martin Tichý, Ph.D.
Klinika chorob kožních a pohlavních LFUP
a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: tichy.martin.jun@fnol.cz
Sources
1. BENÁKOVÁ, N., ŠTORK, J. Léčba psoriázy biologiky. Konsensuální doporučené postupy České dermatovenerologické společnosti ČLS JEP 2006. Čes Slov Derm, 2006, 81 (4) Suppl., S1-11.
2. DOHERTY, S. D., van VOORHEES, A., LEBWOHL, M. G., et al. National psoriasis foundation consensus statement on screening for latent tuberculosis infection in patients with psoriasis treated with systemic and biologic agents. J. Am. Acad. Dermatol., 2008, 59, p. 209–217.
3. DRIESSEN, R. J. B., van de KERKHOF, P. C. M., De JONG, E. M. G. J. Etanercept combined with methotrexate for high-need psoriasis. Br. J. Dermatol., 2008, 159, p. 460–463.
4. ELEWSKI, B., LEONARDI, C., GOTTLIEB, A. B., et al. Comparison of clinical and pharmacokinetic profiles of etanercept 25 mg twice weekly and 50 mg once weekly in patients with psoriasis. Br. J. Dermatol., 2007, 156, p. 138–142.
5. GISONDI, P., DEL GIGLIO, M., COTENA, C., GIROLOMONI, G. Combining etanercept and acitretin in the therapy of chronic plaque psoriasis: a 24-week, randomized, controlled, ivestigator-blinded pilot trial. Br. J. Dermatol., 2008, 158, p. 1345–1349.
6. GOMEZ-REINO, J. J., CARMONA, L., ANGEL, D. M. Risk of tuberculosis in patients treated with tumor necrosis factor antagonists due to incomplete prevention of reactivation of latent infection. Arthritis Rheum., 2007, 57, p. 756–761.
7. GORDON, K. B., LANGLEY, R. G., LEONARDI, C. et al. Clinical Response to Adalimumab Treatment in Patients with Moderate to Severe Psoriasis: Double-Blind, Randomized Controlled Trial and Open_Label Extension Study. J. Am. Acad. Dermatol., 2006, 55 (4), p. 598–606.
8. GRIFFITHS, C. E., CHRISTOPHERS, E., BARKER, J. N., et al. A classification of psoriasis vulgaris according to phenotype. Br. J. Dermatol., 2007, 156, p. 258–262.
9. CHRISTOPHERS, E. Comorbidities in psoriasis. J. Eur. Acad. Dermatol. Venereol., 2006, 20, p. 52–55.
10. LEONARDI, C. L., KIMBALL, A. B., PAPP, K. et al. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1). Lancet, 2008, 371, p. 1665-1674.
11. LEONARDI, C. L., POWERS, J. L., MATHESON, R. T., et al. Etanercept as monotherapy in patients with psoriasis. N. Engl. J. Med., 2003, 349, p. 2014–2022.
12. MENTER, A., TYRING, S. K., GORDON, K. et al. Adalimumab therapy for moderate to severe psoriasis: a randomized, controlled phase III trial. J. Am. Acad. Dermatol., 2008, 58, p. 106–115.
13. MOORE, A., GORDON, K. B., KANG, S. et al. A randomized, open-label trial of continuous versus interrupted etanercept therapy in the treatment of psoriasis. J. Am. Acad. Dermatol., 2007, 56, p. 598–603.
14. PALLER, A. S., SIEGFRIED, E. C, LANGLEY, R. G. et al. Etanercept treatment for children and adolescents with plaque psoriasis. N. Engl. J. Med., 2008, 358, p. 241–251.
15. PATHIRANA, D., ORMEROD, A. D., SAIAG, P. et al. European S3 0 Guidelines on systemic treatment of psoriasis vulgaris. J. Eur. Acad. Dermatol. Venereol., 2009, 23 (suppl. 2), p. 1–70.
16. REICH, K., NESTLE, F. O., PAPP, K. et al. Infliximab induction and maintenance therapy for moderate -to-severe psoriasis: a phase III, multicentre, double-blind trial. Lancet, 2005, 366, p. 1367–1374.
17. SMITH, CH., ANSTEY, A. V., BARKER, J. N. et al. British Association of Dermatologists’ guidelines for biologic interventions for psoriasis 2009. Br. J. Dermatol., 2009, 161 (5), p. 987–1019.
18. ŠPERL, J., ŠPIČÁK, J. Problematika virových hepatitid v průběhu léčby preparáty s anti-TNF alfa aktivitou. Biologická léčba, 2009, 2, s. 69–75.
19. TICHÝ, M., DITRICHOVÁ, D. Biologika v léčbě těžkých forem psoriázy. Dermatol. praxi, 2007, 1, s. 19–21.
20. ICHÝ, M., DITRICHOVÁ, D. Biologická léčba v dermatologii. Klin. Farmakol. Farm., 2008, 22 (2), s. 68–71.
21. TYRING, S., GORDON, K. B., POULIN, Y. et al. Long - -term safety and efficacy of 50 mg of etanercept twice weekly in patients with psoriasis. Arch. Dermatol., 2007, 143, p. 719–726.
22. van de KERKHOF, P. C. M., SEGAERT, S., LAHFA. M. et al. One weekly administration of etanercept 50 mg is efficacious and well tolerated in patients with moderate-to-severe plaque psoriasis: a randomised controlled trial with open-label extension. Br. J. Dermatol., 2008, 159, p. 1177–1185.
Labels
Dermatology & STDs Paediatric dermatology & STDs
Article was published inCzech-Slovak Dermatology

2011 Issue 6
Most read in this issue- Pigmentové névy a jejich vztah ke vzniku kožního melanomu
- Erythema elevatum diutinum
- Vlastní zkušenosti s nestandardním dávkovacím režimem etanerceptu a jeho výhody
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

