-
Medical journals
- Career
Nemoc z ukládání krystalů kalcium pyrofosfátu (CPPD disease)
Authors: T. Zitko
Authors‘ workplace: Canadian medical, Praha ; Centrum pohybové medicíny Pavla Koláře, Praha ; Artmedi UPD s. r. o., Hostivice
Published in: Čes. Revmatol., 29, 2021, No. 3, p. 150-160.
Category: Review Article
Overview
Tvorba krystalů kalcium-pyrofosfát-dihydrátu (CPP krystalů) v pojivových tkáních může být zcela asymptomatická, nebo může vést k degenerativním anebo zánětlivým změnám. Spektrum nemoci z ukládání CPP krystalů tvoří akutní artritida z CPP krystalů (podobná akutní dnavé artritidě), chronická zánětlivá artritida z CPP krystalů (podobná RA), osteoartróza s CPPD (podobná OA) a některé méně časté projevy. Různé typy postižení se mohou kombinovat. Jedná se o jednu z nejčastějších zánětlivých artropatií. Diagnóza je v ideálním případě založena na kombinaci charakteristických klinických projevů a nálezu CPP krystalů v synoviální tekutině postiženého kloubu. Správné vyšetření synoviální tekutiny ale není v praxi vždy dostupné, alternativou jsou nálezy chondrokalcinózy nebo kalcifikací měkkých tkání postiženého kloubu v RTG, popř. v USG či CT obraze. Pokud je zobrazení postiženého kloubu nepřínosné, doplňuje se RTG obou rukou a zápěstí, pánve a kolen. I když u většiny nemocných se jedná o formu idiopatickou, nemoc může vznikat na pozadí mechanického poškození (např. úrazu, operace – menisektomie atp.), nebo některých genetických či vnitřních poruch (především hyperparatyreózy, hemochromatózy nebo hypomagnezemie), a jejich přítomnost je vhodné zvážit u mladších nemocných (< 60 let věku). V léčbě je možné využít obvyklá nefarmakologická opatření (klidový režim, znehybnění, ledování), aspiraci výpotku anebo intraartikulární kortikoidy, analgetickou a především protizánětlivou medikaci. Bohužel, kvalita vědeckých podkladů pro léčebná doporučení je velmi nízká, eventuálně podklady zcela chybí. Zkušenostmi ověřené a široce doporučované jsou NSA, kolchicin a kortikoidy, ale ani jedna modalita nebyla testována v randomizované kontrolované studii. Dalšími, méně ověřenými, možnostmi jsou hydroxychlorochin, methotrexát, magnesium, analoga ACTH, anakinra, tocilizumab a radiační synovektomie. V současnosti není k dispozici kauzální léčba, CPP krystaly z těla odstranit neumíme.
Klíčová slova:
krystaly kalcium-pyrofosfát-dihydrátu – chondrokalcinóza – CPPD
ÚVOD
Nemoc z ukládání CPP krystalů je jednou z krystalových artropatií. Adams je považován za prvního, kdo popsal v roce 1857 kalcifikaci chrupavky na patologickém vzorku (1). K dalšímu pokroku došlo s příchodem radiografie, když Mandl v roce 1927 poprvé podrobně popsal klinicko-patologické spektrum chondrokalcinózy kolene (1). Žitňan a Siťaj z Piešťan použili v roce 1957 chondrokalcinózu pro diagnostiku artritidy v pěti postižených rodinách a poprvé použili termín „chondrocalcinosis polyarticularis“ (1). Průlomem pak byl rok 1961, kdy McCarty a Hollander ve Philadelphii v USA poprvé použili polarizační mikroskop pro identifikaci urátových krystalů v synoviální tekutině pacientů s dnou, a během následujícího roku identifikovali u pacientů s akutní synovitidou a chondrokalcinózou jiné krystaly, které byly pomocí RTG difrakce identifikovány jako calcium pyrofosfát (CPP) dihydrát. Skupina pak poprvé použila pojem „pseudodna“, následoval rozvoj dalších „pseudotermínů, pojem CPPD (CPP depozice), v Evropě se později objevuje pojem „pyrofosfátová artropatie“ a další (1). McCarty v sedmdesátých letech 20. století v Milwaukee v USA přišel poprvé s návrhem na sjednocení názvosloví a diagnostických kritérií (1, 2). Dalším pokusem pak byla iniciativa EULAR z roku 2011, kdy se skupina 15 odborníků shodla na definici hlavních pojmů (uvedených v tabulce 1) a doporučení pro diagnostiku a léčbu (3, 4). V následujícím textu bude používána tato terminologie. Ani jedna klasifikace či kritéria však dosud nebyly validovány (5). V současnosti probíhají práce na nových klasifikačních kritériích (jedna ze současných společných iniciativ ACR a EULAR). Mezinárodní klasifikace nemocí (MKN) současným potřebám neodpovídá, v MKN verzi 10 (poslední modifikace z roku 2019) jsou rozlišovány pouze kódy M11.1 (familiární chondrokalcinóza) a M11.2 (jiná chondrokalcinóza, chondrokalcinóza NS), v 11. verzi MKN, která vstupuje v platnost 1. ledna 2022, je pouze kód FA26.0 (CPPD Disease). Chondrokalcinóza znamená přítomnost krystalů v hyalinní nebo vazivové chrupavce. Je většinou zjištěna radiologicky, ale není absolutně specifická pro nemoc z CPP krystalů, protože může být způsobena i krystaly zásaditého kalcium-fosfátu (anglicky BCP), např. hydroxyapatitu. Ani nemusí být přítomná u všech pacientů s touto nemocí (1, 6). Pojem „CPPD“ se nyní používá pro jakoukoliv přítomnost krystalů CPP (calcium pyrophosphate crystal deposition), zatímco dříve se zkratka CPPD také používala pro calcium pyrophosphate crystal disease, což by vždy znamenalo přítomnost klinických projevů. Nahrazena byla řada pseudotermínů stejně jako „pyrofosfátová artropatie“, které byly používány různými odborníky pro různé klinické projevy. Některé ale nejspíše budou pro svou jednoduchost a srozumitelnost v praxi nadále používány (např. „pseudodna“ pro svoji didaktickou hodnotu) (6).
Table 1. Terminologie nemoci z ukládání CPP krystalů 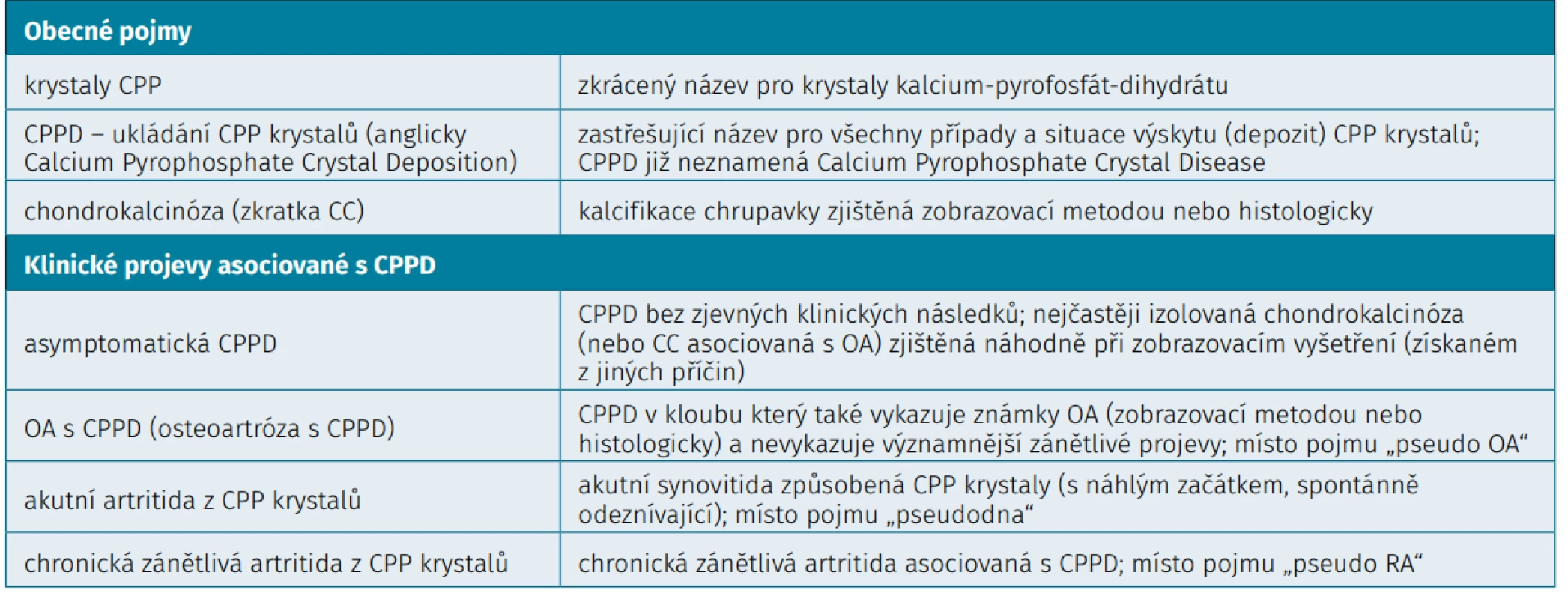
PATOGENEZE
Formování krystalů kalcium-pyrofosfát-dihydrátu (CPP krystalů, chemický vzorec Ca2 P2 O7 · H2 O) většinou začíná pericelulárně v blízkosti povrchu chondrocytů nebo extracelulárních vezikul (articular cartilage vesicles). Jsou k tomu potřeba vysoké extracelulární hladiny kalcia a pyrofosfátu a specifické vlastnosti extracelulární matrix, která umožňuje nukleaci a růst krystalů. Výzkum se doposud soustředil především na metabolismus pyrofosfátu, o kterém je známo mnohem více než o jiných etiopatogenetických faktorech (7, 8). Anorganický pyrofosfátový anion obsahuje dvě fosfátové skupiny (PO4 – ) vázané formou P-O-P, v českém chemickém názvosloví by asi správnější označení bylo difosfát. Pyrofosfátový anion je vedlejším produktem mnoha nitrobuněčných biosyntetických reakcí v celém těle (např. rozklad adenosintrifosfátu na adenosinmonofosfát a pyrofosfátový anion) a má mnoho fyziologických funkcí. Jeho obrat v těle je velmi vysoký, pohybuje se v řádu kg/den, ale intracelulární i extracelulární koncentrace jsou relativně nízké důsledkem působení všudypřítomných pyrofosfatáz (1, 7–9). Pro pohybové ústrojí je důležitá role pyrofosfátového aniontu při mineralizaci hydroxyapatitu, hlavní anorganické složky kostí a zubů. Určitá hladina pyrofosfátového aniontu je důležitá pro zahájení nukleace a růstu krystalů hydroxyapatitu, ale vysoké hladiny tyto procesy inhibují. V extracelulární matrix chrupavky je pyrofosfátový anion účinným inhibitorem vzniku krystalů hydroxyapatitu. Pyrofosfátový anion je rovněž důležitým inhibitorem kalcifikace krystalů zásaditého kalcium fosfátu v cévách, slinných žlázách a močovém ústrojí. V průmyslu se pyrofosfátový anion používá ke změkčování vody (1, 7–9). Na rozdíl od chrupavky růstové ploténky je hyalinní a vazivová chrupavka (v kloubech, meniscích, atd.) vybavena řadou mechanismů k zabránění extracelulární kalcifikace. Pyrofosfátový anion v extracelulárním prostředí buď přímo vzniká z ATP činností jednoho či více membránových enzymů ze skupiny nukleosid-trifosfát-pyrofosfohydroláz, nebo je pyrofosfátový anion transportován zevnitř chondrocytů transmembránovým proteinem ANK (ankylosis protein), který také zevnitř transportuje ATP (obr. 1) (1, 7–9). Je popsáno několik poruch výše uvedených úrovní regulace u myší i lidí, které mění poměr Pi a pyrofosfátového iontu. Nejvíce prostudované jsou mutace genu pro ANK protein, kdy je snížení funkce ANK spojeno s nízkou hladinou extracelulárního pyrofosfátu a excesivní tvorbou hydroxyapatitu (klinicky excesivní ankylóza, spondylartropatie, HA kalcifikace měkkých tkání...), a naopak zvýšení funkce ANK je spojeno se zvýšením hladiny extracelulárního pyrofosfátového iontu a tvorbě krystalů CPP (jak bylo popsáno u některých rodin s familiární formou nemoci z krystalů CPP). O faktorech zvyšujících krystalizační potenciál extracelulární matrix je známo nepoměrně méně. Důležité jsou fyzikálně-chemické vlastnosti prostředí a součin Ca2+ a pyrofosfátových iontů. Nukleaci a růst krystalů CPP především inhibují ionty hořčíku (Mg2+), dále pak monofosfáty, chondroitin sulfát, proteoglykany a řada dalších. Faktory, které tvorbu a růst krystalů CPP podporují, jsou vedle jiných ionty železa a krystaly sodné soli kyseliny močové (1, 8). Role krystalů CPP v patogenezi různých projevů nemoci je poměrně málo známá vyjma akutní artritidy, která je zprostředkována stejnými mechanismy vrozeného imunitního systému jako reakce na krystaly sodné soli kyseliny močové u dny, přičemž na počátku stojí uvolnění krystalů do kloubní dutiny. Ve fagocytujících buňkách je první ze dvou hlavních nitrobuněčných pochodů aktivace inflamazomu NLRP-3 (NOD-Like Receptor family, Pyrin domain containing 3), na jehož konci stojí produkce kaspázy-1, která umožňuje přeměnu pro-IL-1β na IL-1β (interleukin-1 beta) s jeho mnohočetnými prozánětlivými účinky (produkce IL-6 a dalších cytokinů, migrace neutrofilů, aktivace endoteliálních buněk, vazodilatace, hypotenze, horečka a mnohé další). Druhou cestou je aktivace kináz ze skupiny MAP (Mitogen Activated Protein, především ERK, JNK, p38) s následnou aktivací transkripčního faktoru NF-κB (nuclear factor kappa B) a poté zvýšením genové exprese a produkce pro-IL-1β, ale také TNF-α, IL-6 a IL-8 (1, 7, 9, 10). O ostatních patogenetických pochodech je známo výrazně méně. Není uspokojivě a uceleně vysvětleno, jak reagují krystaly s povrchem fagocytujících buněk, jakým způsobem dochází ke spontánnímu ústupu a ukončení akutní zánětlivé reakce (1, 7–9), jak dochází ke chronickým zánětlivým projevům, jaký je přesný vztah mezi krystaly CPP a degenerativními změnami (1, 7, 9, 10).
Image 1. Mechanismus nemoci z ukládání CPP krystalů 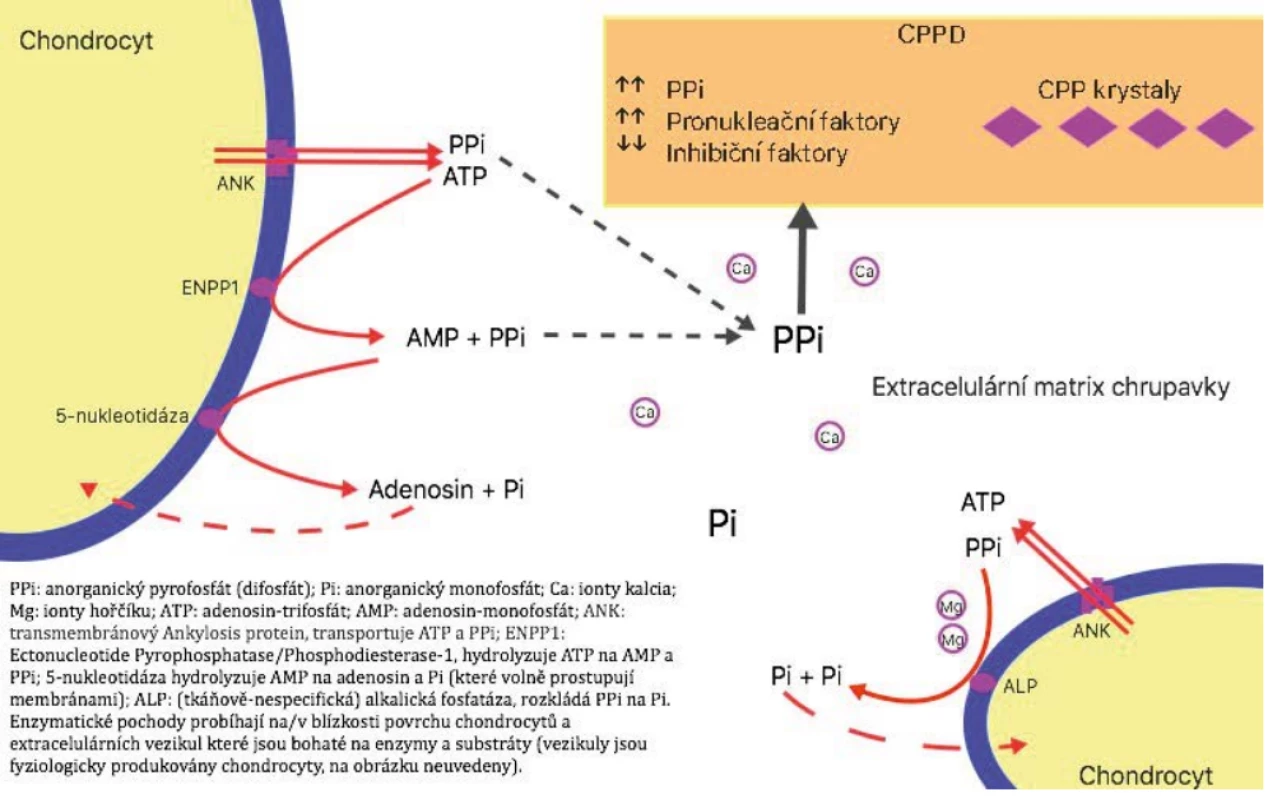
EPIDEMIOLOGIE, RIZIKOVÉ FAKTORY A ASOCIOVANÁ ONEMOCNĚNÍ
Prevalence nemoci z ukládání krystalů CPP se odhaduje na 4–7 % populace Evropy a Severní Ameriky, ale její hodnocení je spojeno s řadou obtíží. Většina studií je založena na RTG detekci chondrokalcinózy a nikoliv na klinických projevech choroby. Chondrokalcinóza je ale přítomna pouze u cca 40 % nemocných a její hodnoce ní na RTG je zvláště obtížné při těžkém úbytku chrupavky. A naopak, chondrokalcinóza se může vyskytovat u asymptomatických osob a také není vždy tvořena krystaly CPP (může být tvořena krystaly zásaditého kalcium fosfátu) (4, 6, 9). Hlavními rizikovými faktory jsou vyšší věk a osteoartróza (OA), dále pak mechanické poškození (trauma, operace), několik metabolických a endokrinních chorob, některé léky a některé monogenní genetické poruchy. Vztah mezi věkem a nemocí z CPP krystalů je napříč studiemi konzistentní. Choroba je vzácná u osob mladších 60 let, poté se prevalence s každou dekádou zdvojnásobuje a dosahuje až 44 % u lidí velmi starých (ve věku > 84 let) (11). Asociace mezi osteoartrózou a nemocí z ukládání krystalů CPP je rovněž zřejmá. I když se obě projevují do určité míry podobně (tedy existuje riziko diagnostické záměny) a jsou obě výrazně závislé na věku, s postupem času přibývají vědecké podklady, že se jedná o vztah nezávislý (11, 12). Ukazují na to jak studie experimentální, tak sledování osob s familiárními formami nemoci (tvorba krystalů předchází vzniku degenerativních změn) nebo současná přítomnost OA a klinických známek nemoci z ukládání krystalů CPP v kloubech, které většinou nebývají postiženy primární OA (metakarpofalangeální – MCP, radiokarpální, loketní, glenohumerální). I když u většiny nemocných se jedná o formy idiopatické, některé vnitřní choroby se mohou na vzniku nemoci podílet. Zjevnými rizikovými faktory jsou hyperparatyreóza (primární i sekundární při renálním selhání), hemochromatóza a hypomagnezemie (především v rámci renálních tubulárních poruch – Gitelmanova syndromu, ale nejspíše také poléková, po resekci střeva atd.). Za další pravděpodobné rizikové faktory je pokládána dna a hypofosfatázie (vzácný vrozený funkční deficit ALP) (6, 11, 12). Z léků byla nemoc z krystalů CPP častěji pozorována po kličkových diuretikách (za možný mechanismus je pokládána hypomagnezemie), bisfosfonátech, intraartikulárních injekcí hyaluronátu a GM-CSF (faktor stimulující granulocyty a makrofágy) (7, 11). Podíl mechanického poškození (úraz, operace) byl dobře demonstrován ve studii Dohertyho et al., kteří srovnávali kolenní kloub po menisektomii s kontralaterální neoperovanou stranou. S odstupem desítek let od zákroku byla chondrokalcinóza nalezena na operované straně ve 20 % případů, na neoperované straně ve 4 % případů (13). Familiální formy se projevují těžší a rozsáhlejší artritidou vznikající v mladším věku. Jsou rozpoznány mutace v genu pro ANK protein, které se přenášejí autozomálně dominantně a vedou k jeho zvýšené expresi. Chondrokalcinóza u postižených předchází projevy degenerativní artropatie. Dále byly rozpoznány mutace v genu pro osteoprotegerin; u nemocných jsou nalézány projevy nemoci z krystalů CPP a současně těžké degenerativní změny (7, 11).
KLINICKÉ PROJEVY
Níže uvedená terminologie jednotlivých klinických projevů pochází z doporučení EULAR z roku 2011 (podrobně v úvodu článku). Tvorba krystalů CPP v pojivových tkáních může být zcela asymptomatická (nejčastěji chondrokalcinóza na RTG), nebo se klinicky manifestovat jako akutní artritida z krystalů CPP, chronická zánětlivá artritida z krystalů CPP, osteoartróza s CPPD nebo některými méně obvyklými syndromy či formami. Akutní artritida z krystalů CPP (dříve pseudodna) se manifestuje jako monoartritida nebo oligoartritida vznikající rychle (maximum klinických projevů dosahuje za 6–24 hodin), je spojena s intenzivní zánětlivou reakcí v postiženém kloubu a okolních měkkých tkáních (bolestí, palpační citlivostí, proteplením, otokem, často erytémem) a nekonstantně se systémovými příznaky (horečkou, zimnicí). Ustupuje během několika dnů až týdnů (trvání je v průměru delší než u dnavého záchvatu). Nejčastěji postiženým kloubem je koleno, následuje zápěstí, rameno, kotník a loket; metatarzofalangeální kloub palce nohy bývá postižen naopak zřídka. V diferenciální diagnóze zvažujeme hlavně septickou artritidu a akutní dnavou či jinou krystalovou artritidu (3, 6, 11). Chronická zánětlivá artritida z krystalů CPP (dříve pseudo RA) se manifestuje jako chronická oligoartritida nebo polyartritida se zánětlivými projevy a příznaky (ranní ztuhlost, únava, otok a hypertrofie synovie). Postiženy mohou být malé i velké klouby HKK a DKK, nejčastěji MCP klouby, zápěstí, lokty, kolena a hlezna, často je postižení oboustranné, symetrické (3, 6, 11). Zánětlivá aktivita v jednotlivých kloubech většinou stoupá a klesá nezávisle na ostatních (asynchronní polyartritida) na rozdíl od revmatoidní artritidy, kde jsou zánětlivá vzplanutí většinou polyartikulární (synchronní) (6). Osteoartróza s CPPD (dříve pseudo OA) znamená současnou přítomnost klinických a radiologických známek OA a zároveň CPPD při zobrazovacím vyšetření (např. chondrokalcinóza na RTG), eventuálně histologicky. Nasedat mohou ataky akutní artritidy. Vztah mezi OA a CPPD je komplexní. CPPD je asociována s výraznějšími zánětlivými projevy OA a s rychlejší progresí OA, i když se jedná o korelaci poměrně slabou. Studie se zcela neshodují, zda CPPD je častěji spojena s určitým fenotypem OA. I když nejčastěji postiženým kloubem je koleno a jeho tibiofemorální kompartmenty, relativně často je v této situaci postiženo i patelofemorální skloubení. Nemoc z CPP krystalů je asociována s OA v atypické distribuci (metakarpofalangeální, radiokarpální, loketní, glenohumerální, hlezenní klouby), i když mohou být postiženy i další klouby typické pro primární OA (např. interfalangeální na rukou). Časté je postižení polyartikulární a symetrické, asymetrická distribuce je ale popisována také (3, 5, 6, 9, 11). Vzácně je popisována těžká degenerace podobná neuropatické artropatii (tzv. „pseudoneuropatická“ forma), nejčastěji postihuje rameno, kyčel nebo koleno (9, 11). Méně obvyklé formy onemocnění vznikají na podkladě ukládání krystalů CPP v periartikulárních měkkých tkáních (šlachách, vazech, burzách, vzácně kostech), v axiálním skeletu (meziobratlových ploténkách, sakroiliakálních kloubech, facetových kloubech, atlantoaxiálním skloubení, ligamentum flavum), vzácně extraskeletálně. Klinicky se mohou projevovat akutními zánětlivými atakami (v periferní i axiální lokalizaci), kompresivními syndromy (syndrom karpálního tunelu, radikulopatie, myelopatie), velká „tumorózní“ („pseudotofózní“) ložiska mohou vést k invazi a destrukci přilehlých struktur a k vyšetřování pro možnou malignitu, v kosti mohou vzácně imitovat osteonekrózu (popsáno v kolenním kloubu) (6, 9, 11). Definovanou klinickou jednotkou je Crowned dens syndrom (syndrom korunovaného dentu), kdy kalcifikované hmoty vytvářejí v CT obraze haló (pomyslnou korunku) které obklopuje dens axis, odontoidní výběžek druhého krčního obratle. Klinicky se projevuje akutní či rekurentní silnou bolestí krční páteře a hlavy v zátylku, horečkou a elevací reaktantů akutní fáze. Diferenciálně diagnosticky se (při první epizodě) zvažuje především meningitida, cervikální discitida, velkobuněčná arteritida a revmatická polymyalgie (6, 11).
DIAGNÓZA
Diagnóza je v ideálním případě založena na kombinaci charakteristických klinických projevů a nálezu krystalů CPP v synoviální tekutině postiženého kloubu. Správné vyšetření synoviální tekutiny ale není v běžné praxi vždy dostupné, náhradou jsou pak nálezy chondrokalcinózy nebo jiných charakteristických kalcifikací při zobrazovacím vyšetření. Součástí správné klinické praxe je kompletní diferenciální diagnostika včetně zvážení možnosti spoluúčasti jiných artropatií, a to také proto, že nálezy krystalů CPP jsou v poslední době pozorovány u řady jiných nemocí včetně OA, RA, PsA, dny a dalších (14). Validovaná diagnostická nebo klasifikační kritéria nejsou k dispozici (blíže v úvodu článku). Detekce CPP krystalů ve světelném mikroskopu je obtížnější než průkaz krystalů sodné soli kyseliny močové. Velikost pyrofosfátových krystalů je menší (0,5–10 µm, krystaly sodné soli kyseliny močové 10–20 µm). V polarizovaném světle jsou krystaly kalcium pyrofosfátu slabě pozitivně dvojlomné, nebo nejsou dvojlomné vůbec (krystaly urátu jsou většinou negativně dvojlomné) a tvarově jsou více variabilní (typicky rhomboidní – kosodélníkové, někdy ale kuboidní nebo tyčinkovité – potom podobné urátovým krystalům, které jsou většinou jehlicovité). Jejich množství pouze částečně koreluje s intenzitou zánětu. Specializované analytické metody jsou přesnější, ale dražší a v běžné praxi špatně dostupné (RTG difrakce, FTIR, elektronová mikroskopie atd.). Výjimkou se v nejbližších letech může stát Ramanova spektroskopie, která se dle několika nedávných studií zdá využitelná jako ambulantní metoda v ordinaci lékaře k diagnostice dnavých, CPP či BCP krystalů (9). Akutní CPP artritida může imitovat septickou artritidu, ale také může s touto koincidovat či v důsledku zánětlivých enzymatických změn může docházet k odhalování depozit krystalů. Současně by tedy mělo být zváženo kultivační vyšetření synoviální tekutiny, eventuálně provedeno Gramovo barvení a vyšetření hemokultury (6, 9). Akutní i chronická zánětlivá artritida z krystalů CPP je nekonstantně spojena se systémovou zánětlivou reakcí, tedy také elevací FW, CRP anebo anemií. Při potvrzení diagnózy, jistě u pacientů mladších 60 let bez anamnézy traumatu nebo operace, je vhodné doplnit další laboratorní vyšetření k vyloučení asociované metabolické či endokrinní choroby: Ca, P, Mg, ALP, PTH, ferritin, Fe, transferin (1, 6, 9). Ze zobrazovacích metod se stále uplatňuje především konvenční RTG, ale určitou roli hraje také výpočetní tomografie a sonografie. Magnetická rezonance zatím není spolehlivá metoda k diagnostice CPPD, protože krystaly pyrofosfátu neobsahují volné protony (9). RTG napomáhá diagnóze průkazem kalcifikací, popř. degenerativních změn. Pyrosfátové kalcifikace se nejčastěji zobrazují jako tečkovité nebo lineární radiodenzity ve vazivové nebo hyalinní chrupavce (chondrokalcinóza), méně často ve vazech, šlachách, burzách, synovii, nalézána ve vazivové chrupavce menisků kolen, symfýzy pánevní kosti, triangulárním fibrokartilaginózním komplexu v zápěstí a labru kyčelního a ramenního kloubu (obr. 2). V hyalinní chrupavce je kalcifikace patrná jako tlustá lineární radiodenzita paralelní s povrchem kosti, nejčastěji v koleni, kyčli nebo rameni (glenohumerálním kloubu), ale postižen může být kterýkoliv diartrodiální kloub. Pyrofosfátové kalcifikace mohou být patrné jako tenké lineární kalcifikace na povrchu šlach (Achillovy, tricepsu, obturátorového svalu, plantární fascie). Postižení kloubního pouzdra nebo synovie je nejčastěji nalézáno v MCP kloubech a kolenech (1, 6, 9, 11). Floridní postižení synovie může napodobovat synoviální osteochondromatózu (1). Chondrokalcinóza není patrná u všech nemocných a není specifická pro krystaly pyrofosfátu; může být také způsobena krystaly bazického kalcium fosfátu. Tyto jsou většinou chabě patrné a mají nepravidelný tvar a ohraničení stejně jako vaskulární kalcifikace, které jsou také tvořeny bázickým kalcium fosfátem a které také mohou být patrné periartikulárně (1, 9). Chondrokalcinóza a jiné kalcium pyrofosfátové kalcifikace jsou dynamickými nálezy a v průběhu času se mohou zvětšovat i zmenšovat (1). Během zánětlivého vzplanutí může být chondrokalcinóza méně patrná vlivem uvolnění krystalů do kloubu, při těžkém úbytku chrupavky se nezobrazuje (1, 11). Při nepřítomnosti chondrokalcinózy či jiných kalcifikací v postiženém kloubu odborníci v rámci diagnostického procesu doporučují doplnění RTG obou kolen, anteroposteriorní zobrazení pánve (především k zobrazení symfýzy) a posteroanteriorní zobrazení obou rukou a zápěstí (k zobrazení triangulárního fibrokartilaginózního komplexu v zápěstí) (1, 6, 9, 11). Strukturální změny, které bývají nalézány u pacientů s nemocí z ukládání CPP krystalů, jsou v zásadě známky OA, tedy úbytek chrupavky, subchondrální skleróza, cysty a osteofyty; studie se zcela neshodují, zda CPPD je častěji spojena s určitým fenotypem OA (atrofický vs. hypertrofický). K odlišení od primární OA může pomoci distribuce kloubního postižení a eventuální přítomnost některých (částečně) charakteristických změn. Oproti primární OA postihuje nemoc z CPP krystalů častěji MCP, radiokarpální (RC), loketní, glenohumerální, eventuálně hlezenní klouby. V RC skloubení může být izolované nebo těžké zúžení kloubní štěrbiny provázené rozšířením štěrbiny mezi os scaphoideum a os lunatum (skafolunátová disociace). V kolenním kloubu může být patrné izolované nebo relativně těžší postižení patelofemorálního skloubení (až do obrazu pately obalující femur). V metakarpofalangeálních kloubech může být patrné oploštění hlaviček metakarpů a zobákovité osteofyty, především při asociaci CPPD s hemochromatózou. Ojediněle může nemoc z ukládání pyrofosfátových krystalů napodobovat neuropatickou artropatii. Potom nalézáme těžkou progredující kloubní destrukci charakterizovanou výrazným úbytkem chrupavky a subchondrální kosti někdy až do obrazu kostního kolapsu (mikrofraktur), fragmentaci chrupavky a kosti a radiodenzní nitrokloubní tělíska; neurologický deficit ovšem chybí (1, 6, 9, 11). V USG obraze se depozita CPP krystalů zobrazují jako hyperechogenní ložiska která většinou nejsou natolik denzní, aby zanechávala akustický stín (akustický stín popisován až při velikosti > 10 mm). V hyalinní chrupavce jsou nalézána ve středních vrstvách chrupavky, izolovaně či v podobě linií paralelních s povrchem subchondrální kosti, na rozdíl od MSU krystalů které jsou nalézány na artikulárním povrchu chrupavky. Ve vazivové chrupavce mají podobu okrouhlých či amorfních hmot, mohou být patrné v měkkých tkáních podobně jako v RTG zobrazení (1, 6, 9, 11). Ve srovnání s RTG je senzitivita pro USG detekci chondrokalcinózy pro některé anatomické oblasti srovnatelná či vyšší, pro chondrokalcinózu v jiných lokalizacích či detekci depozit kalcium pyrofosfátu v měkkých tkáních ale (zatím) poměrně kolísavá. Specificita je při srovnání s rozborem synoviální tekutiny poměrně vysoká (6, 9). Dle nedávného systematického přehledu 27 studií a metaanalýzy 13 z nich se senzitivita pro detekci CPPD v různých kloubech pohybovala mezi 0,34 a 0,87, specificita mezi 0,84 a 1,00 (15). Iniciativa OMERACT rozvíjí definice sonografických nálezů pro CPPD v různých lokalizacích, míra shody i mezi sonografickými experty je ale (zatím) poměrně kolísavá (16, 17). Výpočetní tomografie (CT) hraje nezastupitelnou roli při detekci depozit kalcium pyrofosfátových krystalů v oblasti páteře (1, 6, 9, 11) (viz výše – méně obvyklé formy nemoci). Modalita DECT (CT s duální energií) může odlišit krystaly natrium-urátu od krystalů obsahujících kalcium, jeho použití v detekci CPPD ale nebylo detailně zkoumáno (9). Histologické vyšetření v rutinní diagnostice CPPD užíváno není.
Image 2. Nemoc z ukládání CPP krystalů, RTG snímky – RTG obou kolen, AP projekce: gonartróza stupeň II vpravo, stupeň I vlevo, kalcifikace menisků bilat (77letá pacientka s idiopatickou formou nemoci) 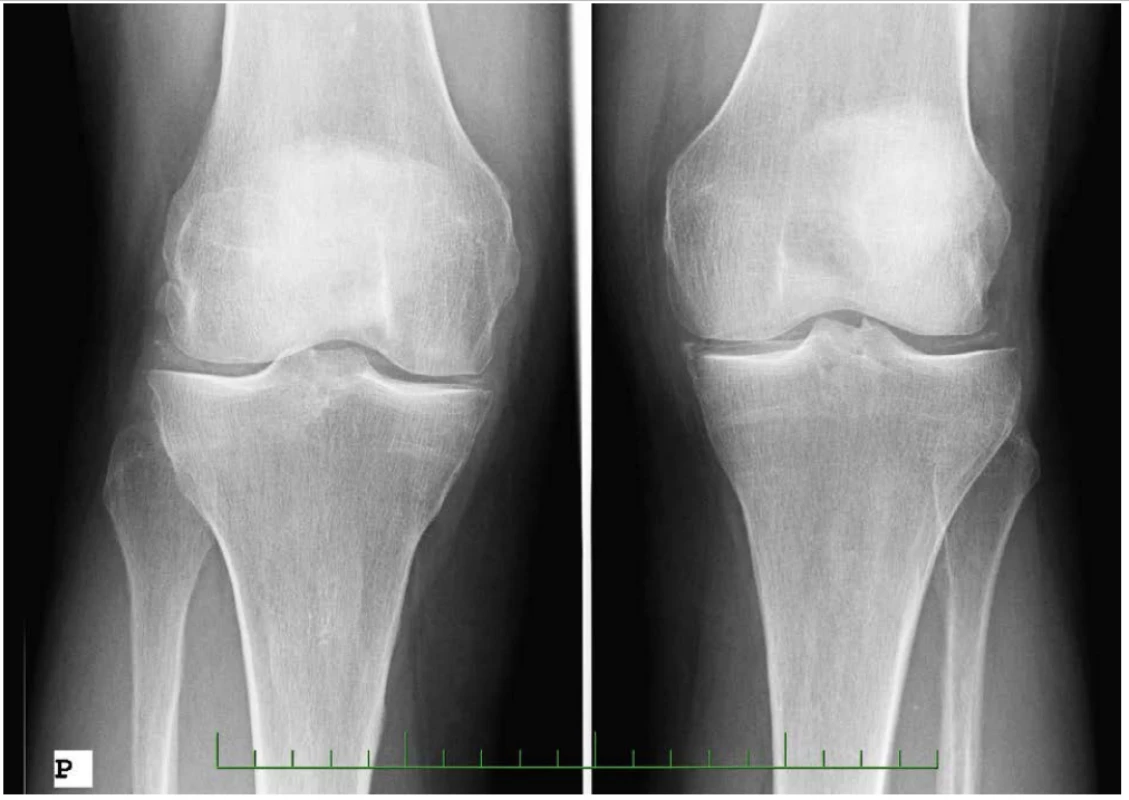
(s poděkováním použito z archivu Revmatologického ústavu) LÉČBA
V léčbě nemoci z ukládání krystalů CPP je možné využít obvyklá nefarmakologická opatření (klidový režim, znehybnění, ledování), aspiraci výpotku a intraartikulární kortikoidy, standardní analgetika a především protizánětlivou medikaci (tab. 2). Jednotlivá doporučení se opírají o zkušenosti, názory expertů a podobnost s dnavou artritidou; vědecké podklady pro jednotlivá doporučení jsou velmi nízké kvality nebo zcela chybí, jak také doložilo nedávné systematické review Parperise et al. (18). Zkušenostmi ověřené a široce doporučované jsou nesteroidní angirevmatika, kolchicin a perorální glukortikoidy, i když ani jedna modalita nebyla testována v randomizované kontrolované studii. Dále lze zvažovat hydroxychlorochin, methotrexát, magnesium, analoga ACTH, anakinru, tocilizumab a radiační synovektomii. Na rozdíl od dny v současnosti není k dispozici kauzální terapie, tedy léčba, která by předcházela tvorbě CPP krystalů nebo již vytvořená depozita zmenšovala anebo zpomalovala nebo zabraňovala degenerativním změnám asociovaným s CPPD (1, 4, 9, 11, 19). Není prokázáno, že by léčba případné asociované hemochromatózy nebo hyperparatyreózy měla vliv na klinické projevy nemoci z ukládání krystalů kalcium pyrofosfátu, při hypomagnezemii existují určité náznaky pozitivního účinku (1, 9, 19). Léčba asymptomatické chondrokalcinózy nebo jiných depozit CPP krystalů není nutná, není doporučována (1, 4, 9, 11, 19, 20). Terapie osteoartrózy s CPPD která není provázena výraznější zánětlivou složkou (ataky akutní anebo chronické CPP artritidy) se v zásadě neliší od léčby osteoartrózy bez depozit CPP krystalů (4, 19), snad s výjimkou intraartikulární viscosuplementace, jejíž možný pozitivní účinek může být převážen indukcí zánětlivého vzplanutí (testováno jen v malých studiích) (4, 18). Přítomnost CPPD pravděpodobně nemá negativní vliv na úspěšnost totální endoprotézy (1, 11). V léčbě akutní pyrofosfátové artritidy je možné volit nefarmakologická opatření (viz výše), aspiraci výpotku anebo intraartikulární aplikaci kortikoidu (metodou volby při postižení jednoho až dvou středních anebo velkých kloubů (19), NSA, kolchicin, nebo kortikoidy v perorální, popř. parenterální formě (1, 4, 9, 11, 19, 20). NSA se podávají v obvyklé protizánětlivé dávce, je možné zvolit kterýkoliv z dostupných preparátů, včetně COX-2 selektivních. Kolchicin je doporučován v dávce 0,5 mg 3–4krát denně, při prvním podání je možné zvolit nasycovací dávku 1 mg. Dávkování perorálního glukokortikoidu ve většině zdrojů uvedeno není, dle jednoho z expertů je možné zvolit prednison v dávce 0,5–1 mg/kg váhy (či jeho ekvivalent) do počátku ústupu příznaků (u většiny nemocných za 2–3 dny) s následným snižováním dávky po dobu 10–14 dní (19, 20), dle jiných se lze řídit doporučeními u akutní dny, tedy např. doporučeními EULAR z roku 2016 (21). Pomalejší snižování kortikoidu je nutné při časném návratu artritidy (9, 19). Dobré účinky byly popsány i po IM a IV aplikaci kortikoidu (4, 18). Efekt kolchicinu je považován za srovnatelný s NSA, pokud je léčba zahájena během 24 hodin od počátku příznaků, ale slabší, pokud začne později (19). Jinak se volba mezi NSA, kolchicinem a glukokortikoidem jako obvykle řídí komorbiditami a souběžnou medikací, eventuálně předchozí účinností a tolerancí daného léku u konkrétního pacienta. Glukokortikoidy jsou lékem první volby relativně častěji vzhledem k vyššímu věku většiny nemocných, a tedy častější přítomností renální insuficience či jiné morbidity anebo polypragmazie, které limitují podávání NSA nebo kolchicinu (např. antikoagulační terapie pro NSA, silné inhibitory glykoproteinu P a cytochromu CYP3A4 pro kolchicin apod.). Akutní artritida z CPP krystalů obecně trvá déle než akutní dnavá artritida, léčba musí často trvat také déle. V rezistentních případech, popř. při neúčinnosti nebo kontraindikaci standardní terapie, lze v léčbě akutní CPP artritidy zvážit podávání inhibitoru IL-1 anakinry (antagonista receptoru pro IL-1), eventuálně tetracosactidu, analoga ACTH (4, 9, 11, 19, 20), obojí v režimu „off-label“. Účinky anakinry byly popsány ve čtyřech retrospektivních analýzách, celkem 57 rezistentních pacientů (s nedostatečnou odpovědí či kontraindikacemi pro standardní léčbu). Dobrá odpověď byla pozorována v cca 80 % případů, ve všech studiích byly výsledky podobné (18). Jiné inhibitory IL-1 zatím v léčbě nemoci z ukládání CPP krystalů studovány nebyly, na rozdíl od akutní dnavé artritidy, pro kterou je anti-IL-1 kanakinumab (Ilaris) již registrován EMA. Při častých epizodách akutní artritidy je možné zvážit profylaktické podávání kolchicinu nebo NSA (4, 9, 11, 19, 20), eventuálně je možnost postupovat jako u chronické CPP artritidy. Jako první se v této indikaci doporučuje kolchicin, což vychází z předpokladu nižší toxicity a z výsledků malé studie na deseti pacientech (pokles celkového počtu akutních epizod z 3,2 % na 1 % za rok) (22). V léčbě chronické zánětlivé artritidy z CPP krystalů se jako úvodní rovněž doporučují NSA, kolchicin nebo glukokortikoidy (žádná modalita nebyla testována v randomizované kontrolované studii), v rezistentních případech je možné zvážit hydroxychlorochin, methotrexát, magnesium, inhibitory IL-1 nebo IL-6 nebo radiační synovektomii (1, 4, 9, 11, 19, 20), vše v režimu „off-label“. NSA se podávají v obvyklé protizánětlivé dávce, je možné zvolit kterýkoliv z dostupných preparátů, včetně COX-2 selektivních. Kolchicin se doporučuje v dávce 0,5 mg 1–2krát denně s přehodnocením po 8–12 týdnech (4, 19). Glukokortikoidy jsou doporučovány v dávce ekvivalentní 5–10 mg prednisonu na den (4, 19). Hydroxychlorochin je doporučován v obvyklé dávce (200 mg 2krát denně) po dobu až 6 měsíců (4, 19). Možná účinnost je podpořena teoretickými předpoklady (stabilizace fagolyzozomů s následným potlačením aktivace inflamazomu NLRP3) (9) a výsledky jedné menší randomizované placebem kontrolované studie na 38 pacientech (23), která měla ovšem řadu metodologických nedostatků (18). Methotrexát má rovněž teoretické předpoklady pro pozitivní účinek (24) a ve dvou velmi malých retrospektivních analýzách byly výsledky pozitivní (18). V jediné randomizované placebem kontrolované studii Fickha et al. nebyla účinnost methotrexátu ve srovnání s placebem odlišná (24), ale lze najít řadu metodologických důvodů, proč byly výsledky negativní: malý počet pacientů (randomizováno 26 osob), heterogenní populace (pouze polovina pacientů s polyartikulární formou), relativně nízká zánětlivá aktivita (DAS44 mezi 2 a 3 a CRP okolo 3 mg/l), povolení pomocné medikace v případě akutních vzplanutí (např. kolchicin, NSA nebo prednison < 30 mg/den po dobu 3 dní) atd. (24). Magnesium má také teoretické předpoklady pro pozitivní účinky u nemoci z CPP krystalů (solubilizace a inhibice nukleace a růstu CPP krystalů). Doherty a Dieppe provedli v osmdesátých letech 20. století randomizovanou placebem kontrolovanou studii, kde pozorovali zlepšení v řadě klinických ukazatelů po podávání magnesium karbonátu v dávce 30 mEq (15 mmol, 365 mg) na den po dobu 6 měsíců (25), a to nezávisle na vstupních hodnotách magnesia v séru a moči. Ve studii byl také pozorován výrazný účinek v placebové skupině a, poněkud překvapivě, doposud nebyla replikována (1, 18, 19). Inhibitory TNF-α nebyly v léčbě nemoci z CPPD podrobně studovány, k dispozici jsou pouze kazuistická hlášení a jejich výsledky jsou protichůdné (1, 9, 26). I když anakinra byla převážně zkoušena při akutní CPP artritidě, dosavadní zkušenosti v léčbě chronické CPP artritidy jsou rovněž vesměs pozitivní (18, 26). Dobrá účinnost inhibitoru IL-6 tocilizumabu byla nedávno naznačena v pilotní otevřené nekontrolované studii ve Francii (27). Latourte et al. sledovali jedenáct pacientů, z nichž sedm mělo chronickou pyrofosfátovou artritidu a čtyři měly časté ataky akutní CPP artritidy (jedno až čtyři vzplanutí za 2 měsíce). U všech byla přítomna polyartikulární chondrokalcinóza na RTG (jeden měl potvrzené CPP krystaly v synoviální tekutině) a standardní léčba nebyla možná či účinná (u sedmi pacientů byla předtím zkoušena i anakinra). Po 3 měsících podávání tocilizumabu (v i.v. i s.c. formě) hlásili významné zlepšení všichni pacienti (celkové hodnocení na VAS pokleslo z mediánu 60/100 na 10/100, p = 0, 006) a pozitivní účinek přetrvával i při pokračování léčby (medián délky sledování 10 měsíců), přičemž nežádoucí účinky byly pozorovány u tří pacientů (u dvou bylo nutné podávání přerušit) (27). Dobrý účinek radiační synovektomie pozorovali Doherty a Dieppe u 15 pacientů s chronickou CPP artritidou obou kolenních kloubů, když jim do jednoho aplikovali yttrium 90 + triamcinolon a do druhého placebo (fyziologický roztok) + triamcinolon (studie byla dvojitě slepá a výběr strany s účinnou látkou byl náhodný) (28). Po 6 měsících bylo na léčené straně pozorováno významné zlepšení bolesti, startovací ztuhlosti, palpační citlivosti, otoku a rozsahu pohybu (p < 0,01) (28).
Table 2. Hlavní možnosti terapie nemoci z ukládání kalcium pyrofosfátových krystalů 
ZÁVĚR
Nemoc z ukládání CPP krystalů je jednou z nejčastějších zánětlivých artropatií. Postiženy jsou hlavně vyšší věkové kategorie a vzhledem ke stárnutí populace lze očekávat přibývání nemocných. Požadavky na analýzu synoviální tekutiny a heterogenita klinických projevů se odráží ve výrazném poddiagnostikování. Nemoc může napodobovat řadu jiných chorob, hlavně primární osteoartrózu, dnu, septickou artritidu, revmatoidní artritidu, revmatickou polymyalgii a další. I když kauzální terapie, tedy odstranění CPP krystalů, není k dispozici, můžeme pečlivou a správnou diagnostikou a léčbou zlepšit osud nemocných. Základem léčby je empirické podávání NSA, kolchicinu nebo kortikoidů. Největší nadějí pro budoucnost jsou biologické léky, především inhibitory IL-1 a IL-6.
Adresa pro korespondenci:
MUDr. Tomáš Zitko
Artmedi UPD s.r.o.
Čsl. armády 18
253 01
Hostivice, Praha-západ
e-mail: dr.tomas.zitko@gmail.com
Autor prohlašuje, že není v konfliktu zájmů.
Sources
- Doherty M, Abhishek A. Calcium pyrophosphate crystal – associated arthropathy. In: Hochberg M, Silman A, Smolen J, Weinblatt M, Weisman M. (eds.) Rheumatology. 5th ed. Philadelphia: Elsevier 2011; 1875–1887.
- McCarty DJ. Calcium pyrophosphate dihydrate crystal deposition disease – 1975. Arthritis Rheum 1976; 3(Suppl): 275–285.
- Zhang W, Doherty M, Bardin T, Barskova V, Guerne PA, Jansen TL, et al. European League Against Rheumatism recommendations for calcium Pyrophosphate Deposition, Part I: Terminology and Diagnosis. Ann Rheum Dis 2011; 4 : 563–570.
- Zhang W, Doherty M, Pascual E, Barskova V, Guerne PA, Jansen TL, et al. European League Against Rheumatism recommendati[1]ons for calcium Pyrophosphate Deposition, Part II: Management. Ann Rheum Dis 2011; 4 : 571–575.
- Abhishek A, Neogi T, Choi H, Doherty M, Rosenthal AK, Terkeltaub R. Review: Unmet Needs and the Path Forward in Joint Disease Associated With Calcium Pyrophosphate Crystal Deposition. Arthritis Rheum 2018; 8 : 1182–1191.
- Rosenthal A. Clinical manifestations and diagnosis of calcium pyrophosphate crystal deposition (CPPD) disease. In: Post TW. (ed.) UpToDate (Internet). Waltham, MA, USA: UpToDate Inc 2021. Available from: www.uptodate.com
- Rosenthal A. Pathogenesis and etiology of calcium pyro[1]phosphate crystal deposition (CPPD) disease. In: Post TW. (ed.) UpToDate (Internet). Waltham, MA, USA: UpToDate Inc; 2021. Available from: www.uptodate.com
- Abhishek A, Doherty M. Update on calcium pyrophosphate deposition. Clin Exp Rheumatol 2016; 34(Suppl 98): S00–S00.
- Terkeltaub R. Calcium Crystal Disease: Calcium Pyrophosphate Dihydrate and Basic Calcium Phosphate. In: Firestein GS, Budd RC, Gabriel SE, McInnes IB, O’Dell J. (eds.) Kelley and Firestein‘s Textbook of Rheumatology. 10th ed. Philadelphia: Elsevier 2016; 1645–1665.
- Campillo-Gimenez L, Renaudin F, Jalabert M, Gras P, Gosset M, Rey C, et al. Inflammatory Potential of Four Different Phases of Calcium Pyrophosphate Relies on NF-κB Activation and MAPK Pathways. Front Immunol 2018; 9 : 48.
- Rosenthal A, Ryan L. Calcium Pyrophosphate Deposition Disease. N Eng J Med 2016; 374 : 2575–2584.
- Abhishek A. Calcium pyrophosphate deposition disease: a review of epidemiologic findings. Curr Opin Rheumatol 2016; 2 : 133–139.
- Doherty M, Watt I, Dieppe PA. Localised chondrocalcinosis in post–meniscectomy knees. Lancet 1982; 1 : 1207–1210.
- Oliviero F, Scanu A, Galozzi P, Gava A, Frallonardo P, Ramonda R, et al. Prevalence of calcium pyrophosphate and monosodium urate crystals in synovial fluid of patients with previously diagnosed joint diseases. Joint Bone Spine 2013; 3 : 287–290.
- Filippou G, Adinolfi A, Iagnocco A, Filippucci E, Cimmino MA, Bertoldi I, et al. Ultrasound in the diagnosis of calcium pyrophosphate dihydrate deposition disease. A systematic literature review and a meta-analysis. Osteoarthritis Cartilage 2016; 6 : 973–981.
- Filippou G, Scirè CA, Damjanov N, Adinolfi A, Carrara G, Picerno V, et al. Definition and Reliability Assessment of Elementary Ultrasonographic Findings in Calcium Pyrophosphate Deposition Disease: A Study by the OMERACT Calcium Pyrophosphate Deposition Disease Ultrasound Subtask Force. J Rheumatol 2017; 11 : 1744–1749.
- Filippou G, Scirè CA, Adinolfi A, Damjanov NS, Carrara G, Bruyn GAW, et al. Identification of calcium pyrophosphate deposition disease (CPPD) by ultrasound: reliability of the OMERACT definitions in an extended set of joints-an international multiobserver study by the OMERACT Calcium Pyrophosphate Deposition Disease Ultrasound Subtask Force. Ann Rheum Dis 2018; 8 : 1194–1199.
- Parperis K, Papachristodoulou E, Kakoullis L, Rosenthal AK. Management of calcium pyrophosphate crystal deposition disease: A systematic review. Semin Arthritis Rheum 2021; 1 : 84–94.
- Rosenthal A. Treatment of calcium pyrophosphate crystal deposition (CPPD) disease. In: Post TW. (ed.) UpToDate (Internet). Waltham, MA, USA: UpToDate Inc 2021. Available from: www.uptodate.com
- Rosenthal A. Calcium pyrophosphate deposition disease (pseudogout). In: Hochberg M, Gravallese E, Silman A, Smolen J, Weinblatt M, Weisman M. (eds.) Rheumatology. 7th ed. Philadelphia: Elsevier 2018; 1621–1631.
- Richette P, Doherty M, Pascual E, Barskova V, Becce F, Castañeda-Sanabria J, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 2017; 76 : 29–42.
- Alvarellos A, Spilberg I. Colchicine prophylaxis in pseudo[1]gout. J Rheumatol 1986; 13 : 804.
- Rothschild B, Yakubov LE. Prospective 6-month, double blind trial of hydroxychloroquine treatment of CPPD. Compr Ther 1997; 23 : 327–331.
- Finckh A, Mc Carthy GM, Madigan A, Van Linthoudt D, Weber M, Neto D, et al. Methotrexate in chronic–recurrent calcium pyrophosphate deposition disease: no significant effect in a randomized crossover trial. Arthritis Res Ther 2014; 5 : 458.
- Doherty M, Dieppe PA. Double blind, placebo controlled trial of magnesium carbonate in chronic pyrophosphate arthropathy. Ann Rheum Dis 1983; 42(Suppl): 106–107.
- Andrés M, Sivera F, Pascual E. Therapy for CPPD: Options and Evidence. Curr Rheumatol Rep 2018; 6 : 31.
- Latourte A, Ea HK, Frazier A, Blanchard A, Lioté F, Marotte H, et al. Tocilizumab in symptomatic calcium pyrophosphate deposition disease: a pilot study. Ann Rheum Dis 2020; 79 : 1126–1128.
- Doherty M, Dieppe PA. Effect of intra-articular yttrium-90 on chronic pyrophosphate arthropathy of the knee. Lancet 1981; 2 : 1243–1246.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2021 Issue 3-
All articles in this issue
- Ošetřovatelský manuál pro perioperační péči pacienta se zánětlivými revmatickými nemocemi
- Baricitinib in the treatment of rheumatoid arthritis in routine clinical practice – results from the Czech National ATTRA Registry
- The role of calprotectin in the pathogenesis of rheumatoid arthritis and its use as a biomarker
- Calcium PyroPhosphate Deposition disease
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Calcium PyroPhosphate Deposition disease
- The role of calprotectin in the pathogenesis of rheumatoid arthritis and its use as a biomarker
- Baricitinib in the treatment of rheumatoid arthritis in routine clinical practice – results from the Czech National ATTRA Registry
- Ošetřovatelský manuál pro perioperační péči pacienta se zánětlivými revmatickými nemocemi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

