-
Medical journals
- Career
Dieta u dny – máme omezit puriny?
Authors: L. Hasíková; J. Závada
Authors‘ workplace: Revmatologický ústav a Revmatologická klinika 1. LF UK, Praha
Published in: Čes. Revmatol., 28, 2020, No. 3, p. 182-191.
Category: Review Article
Overview
Dna je zánětlivá artritida vyvolaná ukládáním krystalů urátu sodného do kloubů a měkkých tkání. Kromě klasických projevů je dna a hyperurikemie asociována s řadou metabolických a kardiovaskulárních onemocnění. Konzumace určitých pokrmů a nápojů byla odjakživa spojována s rozvojem dny. Data z rozsáhlých observačních studií identifikovala některé složky potravy, které zvyšují sérovou hladinu kyseliny močové. Patří mezi ně především nápoje a potraviny s vysokým obsahem fruktózy, pivo, destiláty, červené maso a mořské plody. Naopak se zdá, že nízkotučné mléčné výrobky působí protektivně. Chybí však data z randomizovaných kontrolovaných studií prokazující jasný vztah mezi jednotlivými složkami potravy a dnou. Ukazuje se, že celkový vliv diety má na populační úrovni u jedinců bez dny pouze malý efekt na sérovou hladinu kyseliny močové. Nicméně cílem komplexního léčebného přístupu k pacientovi s dnou by měla být podle doporučení mezinárodních revmatologických společností také úprava stravovacích návyků a životního stylu, jako pokus o snížení sérové hladiny kyseliny močové, frekvence dnavých atak a také jako prevence celkového kardiovaskulárního rizika.
Klíčová slova:
DNA – hyperurikemie – dieta – puriny – alkohol – fruktóza
ÚVOD
Dna je nejčastější zánětlivou artritidou v dospělé populaci. V západních zemích postihuje asi 1–4 % dospělých s narůstající prevalencí s věkem (1). Kauzálním faktorem pro rozvoj dny je chronická hyperurikemie. Ta je dána nerovnováhou mezi vylučováním a tvorbou kyseliny močové (KM). Podkladem vzniku hypeurikemie mohou být některá onemocnění (selhání ledvin, myeloproliferativní onemocnění atd.), genetické faktory, především polymorfismy v urátových transporterech, expozice potravinám, léčivům a toxinům, které mají za následek buď nadprodukci urátu, jeho snížené vylučování, případně jejich kombinaci. Nejčastěji je hyperurikemie způsobena sníženým vylučováním KM v ledvinách. Klinické projevy, jako například akutní artritida, jsou způsobeny zánětlivou reakcí na krystaly urátu sodného, které se mohou ukládat do kloubů a měkkých tkání. Kromě klasických projevů zánětlivé artritidy je dna a hyperurikemie podle řady studií asociována také s dalšími onemocněními jako s arteriální hypertenzí, chronickou renální insuficiencí, diabetem mellitem 2. typu a ischemickou chorobou srdeční (2–4). Nedávná průřezová studie zahrnující 237 pacientů s dnou ukázala, že 92 % zúčastněných pacientů mělo nejméně jeden tradiční kardiovaskulární rizikový faktor (nejčastěji arteriální hypertenzi a dyslipidemii) (5).
Při posuzování významu dietních a režimových opatření pro pacienty s dnou jsou nejčastěji využívány dva základní postupy. První skupinu tvoří observační kohortové studie zkoumající rizikové faktory pro vznik dny nebo hypeurikemie v obecné populaci. Druhá kategorie zahrnuje menší randomizované kontrolované studie hodnotící vliv vybraných dietních a režimových intervencí na hladinu urikemie nebo na zvýšení či potlačení projevů již přítomné dny (především frekvence dnavých atak). Je tedy třeba rozlišovat, jaká byla zkoumaná populace (obecná populace, jedinci se zvýšeným rizikem, pacienti s již přítomnou dnou) a co bylo studovaným výstupem (hladina urikemie, první projev dny, nebo frekvence dnavých atak). Nemusí vždy nutně platit, že údaje získané u jedinců bez hyperurikemie nebo dny se uplatní ve stejném měřítku i u pacientů s hyperurikemií či dnou. Některé intervence také nemusí mít stejný efekt na různé sledované parametry, například rychlý váhový úbytek u pacientů s dnou může snížit hladinu KM a zároveň krátkodobě zvýšit riziko dnavé ataky.
Ukazuje se, že životní styl a změna diety má relativně malý efekt na sérovou hladinu KM (6, 7). Podle rozsáhlé metaanalýzy u jedinců bez dny vysvětlila dieta méně než 1% variaci v hladině sérové KM, kdežto genetické faktory byly zodpovědné za 23,9% variaci (8).
Navzdory malému vlivu diety na sérovou hladinu KM by měl komplexní léčebný přístup k pacientovi s dnou, podle aktuálních doporučení jak evropské, tak americké revmatologické společnosti zahrnovat kromě farmakologické léčby také úpravu životního stylu a stravy, které mohou pomoci snížit sérovou hladinu KM a také zmírnit dlouhodobé důsledky spojené například s metabolickým syndromem či kardiovaskulárními komorbiditami, které často dnu doprovází (9, 10).
REDUKCE HMOTNOSTI
Snížení hmotnosti u pacientů s dnou a současně nadváhou či obezitou by mělo být významným cílem dietních doporučení. Pacienti s indexem tělesné hmotnosti (BMI) nad 25 kg/m2 mají 2–3krát vyšší riziko rozvoje dny ve srovnání s jedinci s normální hodnotou BMI (11). Řada studií, včetně přehledové práce hodnotící několik longitudinálních studií, dokumentovala snížení sérové hladiny KM a snížení výskytu dnavých atak u pacientů s nadváhou a obezitou, kteří zhubli (12). V 12leté studii monitorující 47 150 mužů bez anamnézy dny na začátku sledování byl výskyt dny vyšší s narůstajícím BMI. Muži, kteří přibrali 13,6 kg a více, měli dvojnásobně vyšší riziko rozvoje dny ve srovnání s jedinci, kteří si udrželi stávající váhu. Naopak pokles tělesné hmotnosti vyšší než 4,5 kg byl spojený se sníženým rizikem rozvoje dny (13). Podobná data byla získána ze studie MRFIT, která zahrnovala jedince s vysokým kardiovaskulárním rizikem. Při snížení tělesné hmotnosti o 1–4,9 kg došlo k poklesu sérové KM o 7 µmol/l (95% CI −9, −6), při redukci váhy o 5–9,9 kg o 19 (95% CI −20, −17) µmol/l a při poklesu tělesné hmotnosti o ≥ 10 kg o 37 µmol/l (95% CI −40, −35) (14). Působivé výsledky byly dokumentovány ve studiích s pacienty, kteří podstoupili bariatrickou operaci pro těžkou obezitu. U těchto pacientů došlo taktéž k poklesu sérové hladiny KM a k redukci výskytu dny (15–17).
Na velké kohortě zdravých běžců bylo pozorováno snížené riziko rozvoje dny v závislosti na uběhnuté vzdálenosti (vyjádřené v km/den; 95% CI 0,88–0,97) a kardiorespiračním výkonu (vyjádřenému v m/s při 10 km běhu; 95% CI 0,41–0,75). Jedinci, kteří uběhli ≥ 8 km/den nebo běželi rychlostí > 4,0 m/s, měli 50% a 65% nižší riziko dny. Dále bylo popsáno snížené riziko dny při vyšší konzumaci ovoce a naopak zvýšené riziko při konzumaci alkoholu, masa a vyšším BMI (18).
PURINY
Základním pilířem doporučované diety u pacientů s dnou bylo po dlouhá léta především omezení purinů, což vycházelo z konceptu jejich biochemické degradace na koncový produkt KM. Potraviny jako vnitřnosti, mořské plody či kvasnice mají vysoký obsah purinů (150–1000 mg/100 g). Luštěniny a některé typy zeleniny řadíme mezi potraviny se středním obsahem purinů (50–150 mg/100 g), zatímco mléčné produkty, vejce, obiloviny a většina druhů ovoce a zeleniny obsahují pouze malé množství purinů (tab. 1). Jako takové mohou puriny přispívat k celkové hladině KM asi 60–120 µmol/l (19), a tudíž dieta bez purinů může redukovat sérovou KM o přibližně stejnou hodnotu (20). Některé specifické puriny (tj. adenin a hypoxantin) zvyšují in vivo hladinu KM více než jiné (tj. guanin a xantin) (21). Potraviny bohaté na hypoxantin (> 100 mg/100 g) zahrnují kuřecí a hovězí maso a ryby. Játra, petržel, ančovičky či kvasnice mají zase vysoký obsah adeninu (22, 23).
Table 1. Obsah purinů ve vybraných potravinách a nápojích (upraveno dle 71) 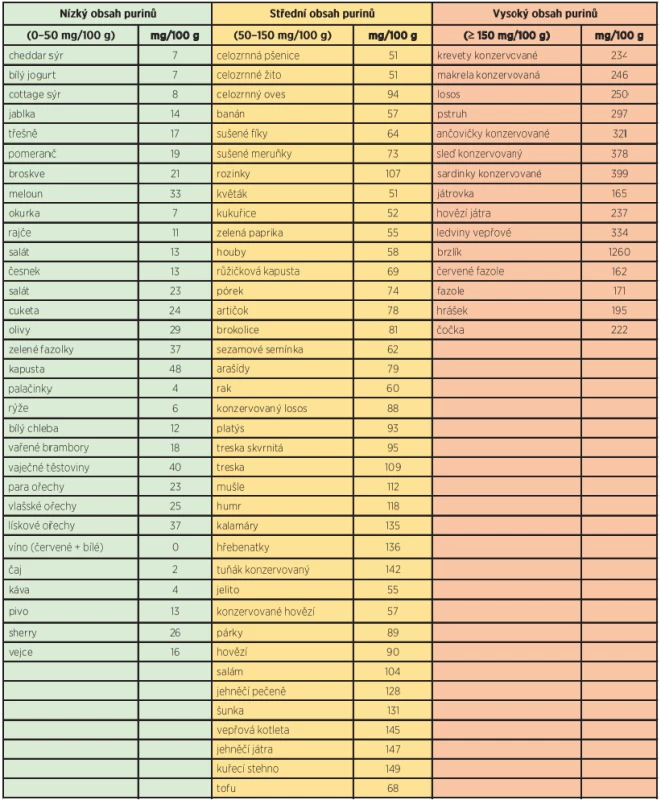
Většina studií, které hodnotí vztah potravy bohaté na puriny a hyperurikemie či dny, je observační. Chybí data z větších randomizovaných kontrolovaných studií, a proto novější doporučení jak evropské, tak americké revmatologické společnosti puriny v potravě zcela nezavrhují. Z dat observačních studií však lze usuzovat, že puriny živočišného původu ovlivňují hladinu sérové KM a výskyt dny, zatímco u purinů rostlinného původu nebyl tento efekt pozorován.
Data z rozsáhlé americké studie NHANES s 14 809 účastníky ukázala, že po adjustaci na věk byly rozdíly v hladině KM mezi nejnižším a nejvyšším příjmem masa asi 29 µmol/l (95% CI 20,2–36,3 µmol/l) a pro mořské plody 9,5 µmol/l (95% CI 3,6 až 16,1 µmol/l). Celkový příjem bílkovin nebyl spojený se zvýšenou hladinou kyseliny močové (24). V podobné prospektivní studii bylo relativní riziko rozvoje dny u mužů s nejvyšším příjmem masa ve srovnání s nejnižším 1,41 (95% CI 1,07–1,8), pro mořské plody 1,51 (95% CI 1,17–1,95). Každá další porce masa denně zvyšovala riziko dny o 21 % a každá další týdenní porce mořských plodů o 7 %. Příjem luštěnin a rostlinné stravy bohaté na puriny nebyl spojený s dnavými atakami, což ukázalo relativní riziko 0,73 (95% CI 0,56–0,96) (25). Tyto závěry byly shodné s po internetu provedenou zkříženou studií, zahrnující 633 pacientů s dnou, kteří zaznamenávali veškerou stravu 2 dny před každou dnavou atakou. Ze získaných dat bylo patrné, že příjem purinů živočišného původu byl spojený s vyšším rizikem dnavých atak, zatímco strava bohatá na rostlinné puriny nikoliv (26). Možným vysvětlením tohoto jevu je vysoký obsah vlákniny v luštěninách, která může vázat KM ve střevě před jejím vyloučením (27).
Data z oxfordské kohorty ze studie EPIC (European Prospective Investigation into Cancer and Nutrition) ukázala, že sérová hladina KM závisí na dietních zvycích. Překvapivě vegani, kteří mají typicky stravu s nízkým obsahem purinů, měli nejvyšší hladinu KM. Následovali konzumenti masa a pescetariáni (částečně bezmasá strava, konzumují pouze ryby). Nejnižší hladinu KM měli vegetariáni. Autoři spekulovali, že nejvyšší hladina KM byla zachycena u veganů vzhledem k absenci mléčných produktů ve stravě, které mohou snižovat hladinu KM (28).
RYBY A OMEGA-3 MASTNÉ KYSELINY
Existuje evidence, která podporuje pozitivní vliv omega-3 nenasycených mastných kyselin (n-3 PUFA), u kterých se předpokládá, že mají protizánětlivé účinky a mohly by redukovat dnavé ataky. V internetové studii zahrnující 724 pacientů s potvrzenou dnou, kteří vyplňovali dotazníky ohledně stravy 48 hodin před dnavou atakou, bylo pozorováno snížené riziko dnavého záchvatu u pacientů, kteří hlásili konzumaci tučných mořských ryb bohatých na n-3 PUFA (OR 0,74, 95% CI 0,54–0,99). Nicméně příjem samotných doplňků stravy s n-3 PUFA nesnižoval riziko dnavého záchvatu (OR 1,01, 95% CI 0,63–1,60). Rozdíl může být vysvětlený nižší dávkou n-3 PUFA užívaných ve výživových doplňcích ve studii (29). Před rutinním doporučováním suplementace n-3 PUFA jako podpůrné prevence dnavých atak je potřeba rozsáhlejších randomizovaných studií.
ALKOHOL
Alkohol je od pradávna známý rizikový faktor pro rozvoj dny a vyvolání dnavé ataky. Riziko rozvoje hyperurikemie a dny závisí na množství a typu alkoholu. Data z americké studie NHANES ukazují, že ve srovnání s žádným příjmem alkoholu zvyšuje konzumace piva sérovou hladinu KM o 27,4 µmol/l (95% CI 19–35,7) na jeden nápoj denně, u destilátů o 17,2 µmol/l na jednu jednotku denně (95% CI 8,3–26,8). U vína nebyla prokázána asociace se zvýšenou hladinou KM (95% CI –11,9–6,5) (30).
Riziko rozvoje dny u jedinců bez předchozí historie onemocnění bylo zkoumáno ve velké prospektivní studii. Byli porovnáni jedinci konzumující podobné množství různého druhu alkoholu denně (pivo, víno, destiláty) ve srovnání s abstinenty. Pití dvou a více piv denně zvyšovalo riziko rozvoje dny 2,5krát ve srovnání s abstinenty. Riziko rozvoje dny bylo zvýšeno také u jedinců konzumujících podobné množství alkoholu ve formě destilátů, i když v této skupině bylo riziko nižší než při pití piva (1,6krát vyšší riziko ve srovnání s abstinenty). Naopak příjem dvou a více sklenek vína (120 ml/sklenka) denně nebyl asociovaný se zvýšeným rizikem dny (31).
Na druhou stranu ve zkřížené studii zkoumající vliv alkoholu na vyvolání dnavé ataky u 724 pacientů s již prokázanou dnou byl pozorován signifikantní vliv alkoholu závislý na dávce. Větší množství alkoholu (piva, destilátů či vína) v předchozích 24 hodinách bylo spojeno s vyšším rizikem rozvoje dnavé ataky pro ≤ 1, > 1 až 2, a > 2 až 4 drinky bylo riziko vyjádřené pomocí odds ratio (OR) 1,13 (95% CI 0,80–1,58); 1,36 (95% CI 1,00–1,88); 1,51 (95% CI 1,09–2,09) ve srovnání s nulovým příjmem alkoholu (32). Rozvoj dny byl tedy spojen pouze s konzumací piva či destilátu, nicméně riziko vyvolání dnavé ataky je asociováno s konzumací všech tří typů alkoholu včetně vína v závislosti na dávce.
Příjem alkoholu a fruktózy zvyšuje hladinu urátu deplecí adenosintrifosfátu (ATP) a generací adenosinmonofosfátu (AMP) během jaterního metabolismu. Akumulace AMP a stimulace AMP deaminázy vede k tvorbě inositolmonofosfátu (IMP) a následně KM (33, 34). Konzumace alkoholu může akcelerovat syntézu KM ještě druhou cestou a to zvýšením sérové hladiny laktátu způsobené oxidací etanolu. V ledvinách dochází ke kompetici vylučování KM a laktátu (35). U piva se navíc připojuje zvýšená produkce KM vzhledem k vyššímu obsahu purinů, obzvlášť při častém pití velkého objemu (36). Alkoholické i nealkoholické pivo vede ke zvýšení hladiny urátu o 6,5 % versus 4,4 % (37).
VYSOKOFRUKTÓZOVÝ KUKUŘIČNÝ SIRUP (HIGH FRUCTOSE CORN SYRUP – HFCS)
Fruktóza zvyšuje tvorbu KM. Podle údajů ze studie NHANES je přítomná jasná korelace mezi dávkou nápojů slazených HFCS a hladinou KM. Ve srovnání s žádným příjmem nápojů slazených HFCS a příjmem < 0,5, 0,5–0,9, 1–3,9 a ≥ 4 porcí za den došlo ke zvýšení hladiny urátu o 4,8; 8,9; 19,6 a 25 µmol/l (95% CI 6,5, 43,4) a relativní riziko rozvoje dny rostlo: 1,01; 1,34; 1,51 a 1,82 (38). Podobná data byla publikována na prospektivní kohortě žen. Relativní riziko dny pro jednu porci HFCS slazeného nápoje denně bylo 1,74 (95% CI 1,19–2,55) a pro nejméně dva nápoje denně 2,39 (95% CI 1,34 – 4,26) (39). Obdobné výsledky byly publikovány i v novozélandských studiích (40, 41) a na dalších kohortách (42). Navíc u pacientů s geneticky podmíněnou alterací v renálním urátovém/glukózovém/fruktózovém transportéru (SLC2A9) byla zvýrazněná hyperurikemie v odpovědi na příjem sacharózy u pacientů s dnou, což podporuje doporučení snížit příjem slazených nápojů v managementu dny (41).
NÍZKOTUČNÉ MLÉČNÉ PRODUKTY
Na několika velkých kohortových studiích bylo popsáno, že příjem mléčných produktů je protektivní proti rozvoji dny (25, 43, 44). Například americká studie NHANES uvádí, že konzumace nejméně jedné porce mléka denně snižuje hladinu KM o 14,9 µmol/l ve srovnání s jedinci bez příjmu mléka (95% CI –23,79, –5,35). Jedna porce jogurtu denně snižuje KM o 15,5 µmol/l (95% CI –24,39, –7,14) ve srovnání s žádným příjmem (24). In vitro na buněčné linii a in vivo na myším modelu byly identifikovány dvě složky mléka s protizánětlivými schopnostmi, syrovátkový protein – glykomakropeptid a extrakt tuku G600 (45). Následně proběhla dvojitě zaslepená randomizovaná studie se 120 pacienty s rekurentními dnavými atakami k ověření konceptu účinnosti glykomakropeptidu a extraktu tuku G600 v redukci dnavých atak. Pacienti byli rozděleni do tří skupin: užívající laktózový prášek, prášek z odstředěného mléka a odstředěné mléko obohacené glykomakropeptidem a extraktem tuku G600. Ve studii byl signifikantně nižší počet dnavých atak za 3 měsíce ve skupině užívající glykomakropeptid/G600 než ve skupině užívající laktózový prášek. Nebyl pozorován žádný rozdíl mezi skupinou konzumující laktózový prášek a prášek z odstředěného mléka (46).
KÁVA/ČAJ
Káva (i bezkofeinová), avšak nikoliv čaj nebo celkový obsah kofeinu, byly spojeny se sníženým rizikem dny v observačních studiích (47–49). Podle dat ze studie NHANES se zdá, že sérová KM klesá se stoupajícím množstvím příjmu kávy. Ve srovnání s žádným příjmem kávy, 4 až 5 šálků a ≥ 6 šálků denně vedly k redukci KM o 15,5 µmol/l (95% CI 6,54–24,39 µmol/l) a 25,6 µmol/l (95% CI 13,68–38,66 µmol/l). Podobný inverzní vztah byl i mezi bezkofeinovou kávou a KM (50). Někteří autoři spekulují, že rostlinné bioaktivní látky přítomné v kávě jako chlorogenní kyselina jsou zodpovědné za možný protektivní efekt kávy (51).
VITAMIN C
Vitamin C má mírný efekt na snížení KM, chybí však evidence ukazující klinický benefit u pacientů se stanovenou diagnózou dny. Rutinně proto není doporučována suplementace vitaminu C u pacientů s dnou. Efekt vitaminu C na snížení urátu byl popsán například v randomizované kontrolované studii u jedinců bez dny, kteří užívali 500 mg vitaminu C nebo placebo denně po dobu 2 měsíců. Vitamin C signifikantně snižoval hladinu KM o 30 µmol/l (95% CI –35,69, –17,84), přičemž v kontrolní skupině nedošlo k žádné změně (52). Efekt vitaminu C na snížení KM u pacientů s asymptomatickou hyperurikemií byl podpořen metaanalýzou 13 studií, která ukázala, že efekt závisí na dávce a je vyšší při vyšších vstupních hladinách KM (53). V další prospektivní studii bylo relativní riziko incidence dny redukováno s narůstajícím denním příjmem vitaminu C. Ve srovnání s jedinci s nižším příjmem vitaminu C než 250 mg/denně bylo relativní riziko incidence dny pro pacienty s denním příjmem 500–999 mg 0,83 (95% CI 0,71–0,97), pro jedince s příjmem 1000–1499 mg denně 0,66 (95% CI 0,52–0,86) a při příjmu ≥ 1500 mg vitaminu C denně 0,55 (95% CI 0,38–0,80) (54). Nicméně v randomizované studii u pacientů s již existující dnou neměl denní příjem vitaminu C v dávce 500 mg významný efekt na průběh onemocnění a průměrné snížení urikemie bylo minimální (55).
TŘEŠŇOVÝ EXTRAKT
Malé studie na zdravých dobrovolnících a zvířatech prokázaly snížení sérové KM pomocí třešňového extraktu. Například studie s deseti zdravými ženami ve věku 22–40 let zkoumala efekt dvou porcí třešní (280 g, což odpovídá asi 45 třešním) na plazmatickou hladinu urátu. Plazmatická hladina KM se snížila o 31 µmol/l po 5 hodinách od konzumace třešní, současně došlo ke zvýšení močové exkrece KM s vrcholem 3 hodiny po požití. Podobné množství hroznů, jahod nebo kiwi nemělo žádný efekt. Nicméně se jedná o množství, které je pro běžnou denní stravu obtížně udržitelné (56). Spekuluje se, že třešně mohou složit jako prevence dnavé ataky, protože obsahují anthocyanin – přirozeně se vyskytující protizánětlivou molekulu, která inhibuje cyklooxygenázu a zachycuje reaktivní radikály. Ve studii s 633 pacienty s dnou byl příjem třešní po dobu 2 dnů asociovaný s 35% snížením rizika dnavé ataky (OR 0,65; 95% CI 0,5, 0,85) (57). Nicméně v recentní randomizované studii s 50 pacienty s dnou nebyl pozorován žádný efekt třešňové šťávy v různých koncentracích (7,5; 15; 22,5 nebo 30 ml 2krát denně) po dobu 28 dnů na sérovou hladinu KM či močovou exkreci KM (58).
OSTATNÍ DOPLŇKY STRAVY
Napříč doplňky stravy byl popsán prospěšný efekt vlákniny a folátu u pacientů s dnou (59). Nicméně je potřeba více dat k rutinnímu doporučení těchto doplňků.
SPOUŠTĚČE DNAVÉ ATAKY
Určité stravovací návyky vedou opakovaně k vyvolání dnavé ataky. In vitro byla popsána možná účast volných mastných kyselin při vyvolání zánětu zprostředkovaného krystaly urátu sodného, což může vysvětlit podíl tučného jídla ve vyvolání dnavé ataky (60). Ve studii s 2501 novozélandskými pacienty s dnou, kteří byli tázáni na spouštěče dnavé ataky, byly na prvním místě mořské plody nebo ryby, dále alkohol, červené maso a rajčata (61). Konzumace rajčat a zvýšení sérové KM může být způsobeno vysokým obsahem glutamátu v rajčatech, který je spojován s produkcí KM (62).
Hladovění a náhlý váhový úbytek může také vést k hyperurikemii a vyvolání dnavé ataky jednak prostřednictvím zvýšeného tkáňového obratu a jednak rozvojem ketoacidózy. Ta vede ke zvýšené reabsorpci KM v ledvinách výměnou za organické anionty přes urát-aniontové přenašeče (URAT1, OAT10) (63, 64).
DIETNÍ DOPORUČENÍ PRO PACIENTY
Dřívější doporučení se zaměřovala především na omezení stravy bohaté na puriny. Avšak tento přístup s sebou nese celou řadu omezení. Jednak limitovanou možnost výběru potravin a také dlouhodobé zvýšení příjmu sacharidů a s tím spojená metabolická rizika. Současná dietní doporučení by měla reflektovat další komorbidity pacienta, vést ke zvýšení inzulinové senzitivity, snižovat triglyceridy, zlepšovat krevní tlak a snižovat riziko ischemické choroby srdeční (65).
Zdá se, že důležitější je celkový přístup k dietě než omezení jednotlivých složek potravy. Několik dietních přístupů se jeví jako slibných při snížení sérové hladiny KM. Jednou z těchto diet je tzv. dietní přístup k zastavení hypertenze (DASH – diatary approaches to stop hypertension). Dieta obsahuje hodně ovoce, zeleniny, nízkotučných mléčných výrobků, naopak omezené je množství sladkostí, masa, saturovaného a celkového tuku. Běžná denní strava DASH diety obsahuje čtyři až pět porcí ovoce, čtyři až pět porcí zeleniny a dvě až tři porce nízkotučných mléčných výrobků. Byl prokázán benefit této diety v redukci krevního tlaku a prevenci kardiovaskulárních onemocnění (66). V doplňkové analýze DASH-sodíkové studie autoři analyzovali vzorky 103 účastníků, na kterých prokázali, že dieta snižuje signifikantně hladinu KM (v závislosti na vstupní hladině KM). Další redukci zaznamenali při snížení obsahu sodíku. Mezi 51 účastníky této studie neměl žádný dnu, osm účastníku mělo hyperurikemii (KM ≥ 416 µmol/l). U jedinců s hyperurikemií se snížila KM v průměru o 77 µmol/l ve srovnání s účastníky užívajícími kontrolní dietu (67).
Práce, která hodnotila data sbíraná po dobu 26 let od 44 444 zdravotníků bez historie dny na začátku sledování, využila dietní dotazníky k vyhodnocení tzv. skóre DASH dietního vzorce (vyšší příjem ovoce, zeleniny, ořechů, luštěnin, nízkotučných mléčných produktů, celozrnných produktů a nízkého příjmu sodíku, slazených nápojů, červeného masa a průmyslově zpracovaných masných výrobků) ve srovnání se „západní“ dietou (vysoký příjem červeného masa a průmyslově zpracovaných masných výrobků, rafinovaných obilnin, hranolků, cukru a sladkostí). Vyšší skóre DASH dietního vzorce bylo spojeno s nižším rizikem rozvoje dny (68).
Efekt na snížení urikemie při dodržování DASH diety nebyl však prozatím dokumentován u pacientů s dnou a pro průkaz vhodnosti této diety jsou potřebné randomizované studie u těchto pacientů.
Dalším potenciálně vhodným dietním přístupem pro pacienty s dnou je středomořská dieta. Ve studii ATTICA, pojmenované podle řecké provincie Attica, byl zkoumán efekt středomořské diety na urikemii u jedinců bez dny. Dodržování středomořské diety bylo spojeno s nižší sérovou hladinou KM a menší pravděpodobností rozvoje hyperurikemie (69).
Nedávno byly prezentovány výsledky z randomizované kontrolované studie DIRECT (Dietary Intervention Randomized Controlled Trial), která zkoumala efekt tří zavedených diet spojených s redukcí hmotnosti na sérovou hladinu KM:
- diety s omezením tuků a restrikcí kalorií
- středomořské diety s restrikcí kalorií a
- diety s omezením sacharidů bez kalorické restrikce
Studie zahrnovala celkem 232 jedinců s BMI nejméně 27 kg/m2 nebo diagnózou diabetes mellitus 2. typu či ischemickou chorobou srdeční (bez ohledu na BMI). Pacienti byli randomizováni do jedné ze tří diet a byla u nich hodnocena sérová hladina KM na začátku a po 6 měsících. Všechny tři diety signifikantně redukovaly sérovou hladinu KM o 48 µmol/l (všechny p < 0,001 a p > 0,98 pro srovnání mezi skupinami). Efekt na snížení KM byl více vyjádřený u pacientů s hyperurikemií na počátku. BMI, krevní tlak, lipidogram a hladina inzulinu se také signifikantně vylepšila u všech tří skupin s nejvýraznějším zlepšením ve skupině s nízkým obsahem sacharidů, obzvlášť v lipidovém profilu. Práce potvrzuje benefit dietních přístupů zaměřených na redukci hmotnosti na snížení sérové hladiny KM, i když efekt není tak výrazný jako při farmakoterapii. Zdá se, že nejlepší výsledky, obzvlášť s ohledem na lipidový profil, má dieta s omezením sacharidů (70).
OBECNÁ DOPORUČENÍ A SHRNUTÍ
Dieta u dny by kromě snížení urikemie a snížení výskytu dnavých atak měla zohledňovat také komorbidity pacientů především ve spojení s metabolickým syndromem. Je vhodná strava bohatá na rostlinné proteiny, ořechy, zeleninu, luštěniny, celozrnné potraviny, ovoce s nízkým obsahem cukru, rostlinné oleje a až dvě porce nízkotučných mléčných výrobků. I když konzumace ryb může zvýšit sérovou hladinu KM, vzhledem k celkovému přínosu na kardiovaskulární systém je umírněná konzumace ryb doporučovaná, především těch bohatých na omega-3 mastné kyseliny, jako jsou losos, tuňák nebo pstruh (65). Vejce a drůbež patří mezi bílkoviny s nižším rizikem, proto je možné je umírněně konzumovat. Jedna porce červeného masa nebo měkkýšů týdně může být také pacientům doporučena. Naopak je vhodné vyhnout se fruktózou slazeným nápojům, pivu, destilátům a sacharidům na škrobové bázi (obr. 1) (65). Během akutní dnavé ataky je vhodné zvýšit příjem vody na nejméně 8 až 16 sklenic denně a vyhnout se alkoholu a masu (tab. 2).
Image 1. Potravinová pyramida pro pacienty s dnou (upraveno dle 72) 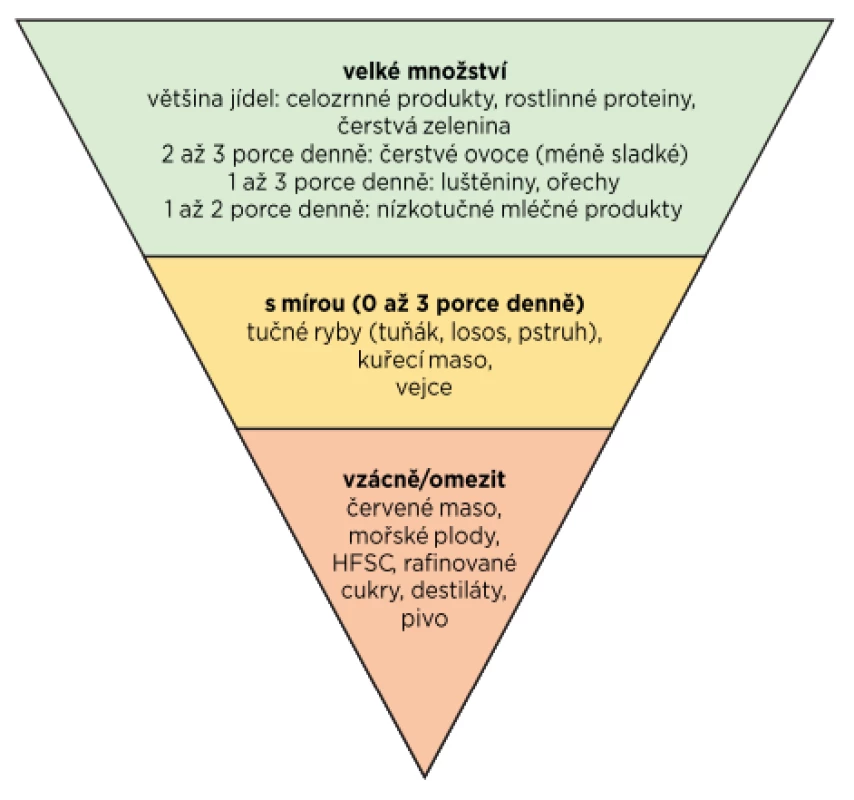
Table 2. Obecná dietní doporučení pro pacienty se dnou (upraveno dle 72) 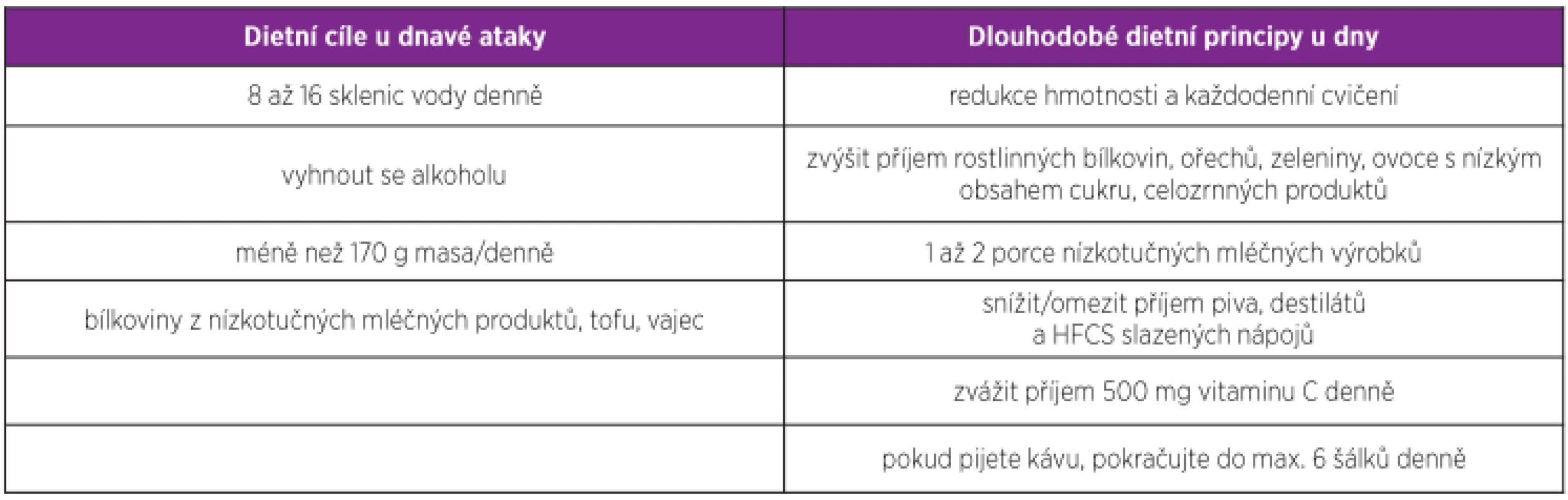
Závěrem lze říci, že výše popsaná dietní opatření k ovlivnění hladiny urikemie mohou hrát významnou roli v prevenci incidentní dny u jedinců s vysokým rizikem jejího vzniku. Mohou být také užitečná při snižování rizika frekvence dnavých atak především u těch pacientů s dnou, u kterých ještě nebyla zahájena farmakoterapie s hypourikemickým účinkem, nebo u těch, kteří ji netolerují nebo k ní mají kontraindikaci. Dietní a režimová opatření u pacientů s dnou musí zahrnovat vhodná opatření k snižování KM (tj. především rozumná redukce živočišných purinů, omezení piva, destilátů a slazených nápojů, podpora mléčných výrobků), ale také odpovídat obecnějším pravidlům zdravé diety a životního stylu vhodných k prevenci kardiovaskulárního rizika (redukce váhy, aerobní pohyb, komplexní dieta typu DASH nebo středomořská). Zcela zásadní pro úspěch jakékoliv režimové intervence je opakované a srozumitelné poučení pacienta.
Práce vznikla za institucionální podpory Ministerstva zdravotnictví ČR pro Revmatologický ústav č. 023728.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Lenka Hasíková
Revmatologický ústav
Na Slupi 4, 128 00 Praha 2
e-mail: hasikova@revma.cz
Sources
1. Roddy E, Choi HK. Epidemiology of gout. Rheum Dis Clin North Am 2014; 40(2): 155–175.
2. Hayden MR, Tyagi SC. Uric acid: A new look at an old risk marker for cardiovascular disease, metabolic syndrome, and type 2 diabetes mellitus: The urate redox shuttle. Nutr Metab (London) 2004; 1(1): 10.
3. Ebrahimpour P, Fakhrzadeh H, Heshmat R, et al. Serum uric acid levels and risk of metabolic syndrome in healthy adults. Endocr Pract 2008; 14(3): 298–304.
4. Heinig M, Johnson RJ. Role of uric acid in hypertension, renal disease, and metabolic syndrome. Cleve Clin J Med 2006; 73(12): 1059–1064.
5. Andres M, Bernal JA, Sivera F, et al. Cardiovascular risk of patients with gout seen at rheumatology clinics following a structured assessment. Ann Rheum Dis 2017; 76(7): 1263–1268.
6. Holland R, McGill NW. Comprehensive dietary education in treated gout patients does not further improve serum urate. Intern Med J 2015; 45(2): 189–194.
7. Moi JH, Sriranganathan MK, Falzon L, et al. Lifestyle interventions for the treatment of gout: a summary of 2 Cochrane systematic reviews. J Rheumatol Suppl 2014; 92 : 26–32.
8. Major TJ, Topless RK, Dalbeth N, et al. Evaluation of the diet wide contribution to serum urate levels: meta–analysis of population based cohorts. BMJ 2018; 363: k3951.
9. Richette P, Doherty M, Pascual E, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 2017; 76(1): 29–42.
10. Khanna D, Fitzgerald JD, Khanna PP, et al. 2012 American College of Rheumatology guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care Res (Hoboken) 2012; 64(10): 1431–1446.
11. Choi HK, McCormick N, Lu N, et al. Population Impact Attributable to Modifiable Risk Factors for Hyperuricemia. Arthritis Rheumatol 2020; 72(1): 157–165.
12. Nielsen SM, Bartels EM, Henriksen M, et al. Weight loss for overweight and obese individuals with gout: a systematic review of longitudinal studies. Ann Rheum Dis 2017; 76(11): 1870–1882.
13. Choi HK, Atkinson K, Karlson EW, et al. Obesity, weight change, hypertension, diuretic use, and risk of gout in men: the health professionals follow-up study. Arch Intern Med 2005; 165(7): 742–748.
14. Zhu Y, Zhang Y, Choi HK. The serum urate-lowering impact of weight loss among men with a high cardiovascular risk profile: the Multiple Risk Factor Intervention Trial. Rheumatology (Oxford) 2010; 49(12): 2391–2399.
15. Maglio C, Peltonen M, Neovius M, et al. Effects of bariatric surgery on gout incidence in the Swedish Obese Subjects study: a non-randomised, prospective, controlled intervention trial. Ann Rheum Dis 2017; 76(4): 688–693.
16. Dalbeth N, Chen P, White M, et al. Impact of bariatric surgery on serum urate targets in people with morbid obesity and diabetes: a prospective longitudinal study. Ann Rheum Dis 2014; 73(5): 797–802.
17. Romero-Talamas H, Daigle CR, Aminian A, et al. The effect of bariatric surgery on gout: a comparative study. Surg Obes Relat Dis 2014; 10(6): 1161–1165.
18. Williams PT. Effects of diet, physical activity and performance, and body weight on incident gout in ostensibly healthy, vigorously active men. The American Journal of Clinical Nutrition 2008; 87(5): 1480–1487.
19. Emmerson BT. The management of gout. N Engl J Med 1996; 334(7): 445–451.
20. Yu T, Yu TF. Milestones in the treatment of gout. Am J Med 1974; 56(5): 676–685.
21. Clifford AJ, Riumallo JA, Young VR, et al. Effect of oral purines on serum and urinary uric acid of normal, hyperuricemic and gouty humans. The Journal of Nutrition 1976; 106(3): 428–434.
22. Havlik J, Plachy V, Fernandez J, et al. Dietary purines in vegetarian meat analogues. J Sci Food Agric 2010; 90(14): 2352–2357.
23. Kaneko K, Aoyagi Y, Fukuuchi T, et al. Total purine and purine base content of common foodstuffs for facilitating nutritional therapy for gout and hyperuricemia. Biol Pharm Bull 2014; 37(5): 709–721.
24. Choi HK, Liu S, Curhan G. Intake of purine-rich foods, protein, and dairy products and relationship to serum levels of uric acid: the Third National Health and Nutrition Examination Survey. Arthritis Rheum 2005; 52(1): 283–289.
25. Choi HK, Atkinson K, Karlson EW, et al. Purine-rich foods, dairy and protein intake, and the risk of gout in men. N Engl J Med 2004; 350(11): 1093–1103.
26. Zhang Y, Chen C, Choi H, et al. Purine-rich foods intake and recurrent gout attacks. Ann Rheum Dis 2012; 71(9): 1448–1453.
27. Torralba KD, De Jesus E, Rachabattula S. The interplay between diet, urate transporters and the risk for gout and hyperuricemia: current and future directions. Int J Rheum Dis 2012; 15(6): 499–506.
28. Schmidt JA, Crowe FL, Appleby PN, et al. Serum uric acid concentrations in meat eaters, fish eaters, vegetarians and vegans: a cross-sectional analysis in the EPIC-Oxford cohort. PLoS One 2013; 8(2): e56339.
29. Zhang M, Zhang Y, Terkeltaub R, et al. Effect of dietary and supplemental omega-3 polyunsaturated fatty acids on risk of recurrent gout flares. Arthritis Rheumatol 2019; 71(9): 1580–1586.
30. Choi HK, Curhan G. Beer, liquor, and wine consumption and serum uric acid level: the Third National Health and Nutrition Examination Survey. Arthritis Rheum 2004; 51(6): 1023–1029.
31. Choi HK, Atkinson K, Karlson EW, et al. Alcohol intake and risk of incident gout in men: a prospective study. Lancet 2004; 363(9417): 1277–1281.
32. Neogi T, Chen C, Niu J, et al. Alcohol quantity and type on risk of recurrent gout attacks: an internet-based case-crossover study. Am J Med 2014; 127(4): 311–318.
33. Johnson RJ, Perez-Pozo SE, Sautin YY, et al. Hypothesis: could excessive fructose intake and uric acid cause type 2 diabetes? Endocr Rev 2009; 30(1): 96–116.
34. Faller J, Fox IH. Ethanol-induced hyperuricemia: evidence for increased urate production by activation of adenine nucleotide turnover. N Engl J Med 1982; 307(26): 1598–1602.
35. Lieber CS, Jones DP, Losowsky MS, et al. Interrelation of uric acid and ethanol metabolism in man. J Clin Invest 1962; 41 : 1863–1870.
36. Gibson T, Rodgers AV, Simmonds HA, et al. Beer drinking and its effect on uric acid. Br J Rheumatol 1984; 23(3): 203–209.
37. Yamamoto T, Moriwaki Y, Takahashi S, et al. Effect of beer on the plasma concentrations of uridine and purine bases. Metabolism 2002; 51(10): 1317–1323.
38. Choi JW, Ford ES, Gao X, et al. Sugar-sweetened soft drinks, diet soft drinks, and serum uric acid level: the Third National Health and Nutrition Examination Survey. Arthritis Rheum 2008; 59(1): 109–116.
39. Choi HK, Willett W, Curhan G. Fructose-rich beverages and risk of gout in women. JAMA 2010; 304(20): 2270–2278.
40. Dalbeth N, Phipps-Green A, House ME, et al. Body mass index modulates the relationship of sugar–sweetened beverage intake with serum urate concentrations and gout. Arthritis Res Ther 2015; 17 : 263.
41. Batt C, Phipps-Green AJ, Black MA, et al. Sugar-sweetened beverage consumption: a risk factor for prevalent gout with SLC2A9 genotype-specific effects on serum urate and risk of gout. Ann Rheum Dis 2014; 73(12): 2101–2106.
42. Raivio KO, Becker A, Meyer LJ, et al. Stimulation of human purine synthesis de novo by fructose infusion. Metabolism 1975; 24(7): 861–869.
43. Zgaga L, Theodoratou E, Kyle J, et al. The association of dietary intake of purine-rich vegetables, sugar-sweetened beverages and dairy with plasma urate, in a cross-sectional study. PLoS One 2012; 7(6): e38123.
44. Ryu KA, Kang HH, Kim SY, et al. Comparison of nutrient intake and diet quality between hyperuricemia subjects and controls in Korea. Clin Nutr Res 2014; 3(1): 56–63.
45. Dalbeth N, Gracey E, Pool B, et al. Identification of dairy fractions with anti-nflammatory properties in models of acute gout. Ann Rheum Dis 2010; 69(4): 766–769.
46. Dalbeth N, Ames R, Gamble GD, et al. Effects of skim milk powder enriched with glycomacropeptide and G600 milk fat extract on frequency of gout flares: a proof-of-concept randomised controlled trial. Ann Rheum Dis 2012; 71(6): 929–934.
47. Kiyohara C, Kono S, Honjo S, et al. Inverse association between coffee drinking and serum uric acid concentrations in middle-aged Japanese males. Br J Nutr 1999; 82(2): 125–130.
48. Choi HK, Willett W, Curhan G. Coffee consumption and risk of incident gout in men: a prospective study. Arthritis Rheum 2007; 56(6): 2049–2055.
49. Pham NM, Yoshida D, Morita M, et al. The relation of coffee consumption to serum uric Acid in Japanese men and women aged 49–76 years. J Nutr Metab 2010; 2010.
50. Choi HK, Curhan G. Coffee, tea, and caffeine consumption and serum uric acid level: the third national health and nutrition examination survey. Arthritis Rheum 2007; 57(5): 816–821.
51. Choi HK, Curhan G. Coffee consumption and risk of incident gout in women: the Nurses’ Health Study. Am J Clin Nutr 2010; 92(4): 922–927.
52. Huang HY, Appel LJ, Choi MJ, et al. The effects of vitamin C supplementation on serum concentrations of uric acid: results of a randomized controlled trial. Arthritis Rheum 2005; 52(6): 1843–1847.
53. Juraschek SP, Miller ER, 3rd, Gelber AC. Effect of oral vitamin C supplementation on serum uric acid: a meta-analysis of randomized controlled trials. Arthritis Care Res (Hoboken) 2011; 63(9): 1295–1306.
54. Choi HK, Gao X, Curhan G. Vitamin C intake and the risk of gout in men: a prospective study. Arch Intern Med 2009; 169(5): 502–507.
55. Stamp LK, O’Donnell JL, Frampton C, et al. Clinically insignificant effect of supplemental vitamin C on serum urate in patients with gout: a pilot randomized controlled trial. Arthritis Rheum 2013; 65(6): 1636–1642.
56. Jacob RA, Spinozzi GM, Simon VA, et al. Consumption of cherries lowers plasma urate in healthy women. J Nutr 2003; 133(6): 1826–1829.
57. Zhang Y, Neogi T, Chen C, et al. Cherry consumption and decreased risk of recurrent gout attacks. Arthritis Rheum 2012; 64(12): 4004–4011.
58. Stamp LK, Chapman P, Frampton C, et al. Lack of effect of tart cherry concentrate dose on serum urate in people with gout. [published online ahead of print, 2019 Dec 31]. Rheumatology (Oxford) 2019; kez606. doi:10.1093/rheumatology/kez606
59. Lyu LC, Hsu CY, Yeh CY, et al. A case-control study of the association of diet and obesity with gout in Taiwan. Am J Clin Nutr 2003; 78(4): 690–701.
60. Joosten LA, Netea MG, Mylona E, et al. Engagement of fatty acids with Toll-like receptor 2 drives interleukin-1beta production via the ASC/caspase 1 pathway in monosodium urate monohydrate crystal-induced gouty arthritis. Arthritis Rheum 2010; 62(11): 3237–3248.
61. Flynn TJ, Cadzow M, Dalbeth N, et al. Positive association of tomato consumption with serum urate: support for tomato consumption as an anecdotal trigger of gout flares. BMC Musculoskelet Disord 2015; 16 : 196.
62. Johnson RJ, Nakagawa T, Sanchez-Lozada LG, et al. Umami: the taste that drives purine intake. J Rheumatol 2013; 40(11): 1794–1796.
63. Bahn A, Hagos Y, Reuter S, et al. Identification of a new urate and high affinity nicotinate transporter, hOAT10 (SLC22A13). J Biol Chem 2008; 283(24): 16332–16341.
64. Enomoto A, Kimura H, Chairoungdua A, et al. Molecular identification of a renal urate anion exchanger that regulates blood urate levels. Nature 2002; 417(6887): 447–452.
65. Choi HK. A prescription for lifestyle change in patients with hyperuricemia and gout. Curr Opin Rheumatol 2010; 22(2): 165–172.
66. Sacks FM, Svetkey LP, Vollmer WM, et al. Effects on blood pressure of reduced dietary sodium and the Dietary Approaches to Stop Hypertension (DASH) diet. DASH-Sodium Collaborative Research Group. N Engl J Med 2001; 344(1): 3–10.
67. Juraschek SP, Gelber AC, Choi HK, et al. Effects of the Dietary Approaches to Stop Hypertension (DASH) Diet and Sodium Intake on Serum Uric Acid. Arthritis Rheumatol 2016; 68(12): 3002–3009.
68. Rai SK, Fung TT, Lu N, et al. The Dietary Approaches to Stop Hypertension (DASH) diet, Western diet, and risk of gout in men: prospective cohort study. BMJ 2017; 357: j1794.
69. Kontogianni MD, Chrysohoou C, Panagiotakos DB, et al. Adherence to the Mediterranean diet and serum uric acid: the ATTICA study. Scand J Rheumatol 2012; 41(6): 442–449.
70. Yokose C RS, Lu N, McCormick N, Curhan G, Choi H. . The effects of a low-fat, mediterranean, or low-carbohydrate diet on serum urate [Abstract]. Arthritis Rheumatol 2019; 71(Suppl 10).
71. Lockyer S, Stanner S. Diet and gout – what is the role of purines? Nutrition Bulletin 2016; 41(2): 155–166.
72. Beyl RN, Jr., Hughes L, Morgan S. Update on Importance of Diet in Gout. Am J Med 2016; 129(11): 1153–1158.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2020 Issue 3-
All articles in this issue
- Národní registr biologické a cílené léčby revmatických onemocnění ATTRA – 20leté zkušenosti
- Validace české verze dotazníků hodnotících únavu a pohybovou aktivitu u pacientů s revmatickými onemocněními: Fatigue Impact Scale (FIS), Multidimensional Assessment of Fatigue Scale (MAF), Human Activity Profile (HAP)
- Současný význam séronegativní revmatoidní artritidy
- Úloha virů při vzniku autoimunitních onemocnění
- Diferenciálně diagnostické stavy systémové sklerodermie z pohledu dermatologa
- Dieta u dny – máme omezit puriny?
- Vzpomínka na profesora Lenocha
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současný význam séronegativní revmatoidní artritidy
- Validace české verze dotazníků hodnotících únavu a pohybovou aktivitu u pacientů s revmatickými onemocněními: Fatigue Impact Scale (FIS), Multidimensional Assessment of Fatigue Scale (MAF), Human Activity Profile (HAP)
- Úloha virů při vzniku autoimunitních onemocnění
- Dieta u dny – máme omezit puriny?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

