-
Medical journals
- Career
Léky indukovaný lupus
Authors: L. Podrazilová
Authors‘ workplace: Revma Praha s. r. o.
Published in: Čes. Revmatol., 28, 2020, No. 2, p. 97-101.
Category: Review Article
Overview
Léky indukovaný lupus erythematodes (DIL) je způsoben podáním určitého léku. V článku jsou popsána možná vyvolávající agens, včetně nových imunomodulačních skupin léků, které mohou léky indukovaný lupus vyvolat. Tzv. anti-TNF lupus (ATIL) se vzácně manifestuje po podání některých biologických preparátů. Popsány jsou odlišnosti klinických i laboratorních projevů obou onemocnění. Léčba léky indukovaného lupusu spočívá ve vysazení vyvolávající látky, v závažnějších případech je nutné podat i imunosupresivní léčbu glukokortikoidy.
Klíčová slova:
léky indukovaný lupus – anti-TNF lupus – autoprotilátky
ÚVOD
Léky indukovaný lupus (lupus-like syndrom), v anglosaské literatuře akronym DIL či DILE (drug induced lupus erythematosus), je onemocnění způsobené podáním určitého léčiva. Klinické projevy jsou podobné systémové formě onemocnění, avšak mírné odlišnosti nacházíme při laboratorním vyšetření.
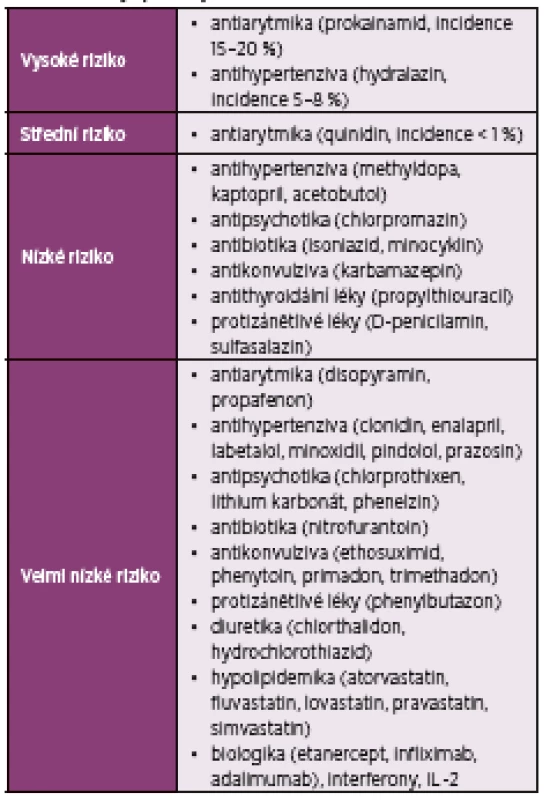
Poprvé bylo onemocnění pozorováno v roce 1945 po podání sulfadiazinu (1) a později po podání hydralazinu (2, 3). Další léky, které mohou toto onemocnění vyvolat, jsou zejména antiarytmika: prokainamid (4), chinidin, acebutol (5), propafenon, amiodaron; antihypertenziva: hydralazin viz výše, methyldopa; inhibitory agregace destiček: ticlopidine (6); antipsychotika a antikonvulziva: chlorpromazin, lithium, chloprothixen, clozapin, carbamazepin (7); antibiotika (8) a chemoterapeutika: izoniazid, minocyklin (9, 10), furantoin; antimykotika (11), hormonální antikoncepce (12) či hormonální substituční terapie (13, 14), D-penicilamin a sulfasalazin (15). Mezi novou skupinu DIL indukujících léků patří interferon alfa, beta i gama (16, 17) a nověji také inhibitory tumor nekrotizujícího faktoru alfa (TNF-α). V současné době je popsáno přes 80 léků, které mohou DIL vyvolat (18) (tab. 1).
Po odstranění styku s vyvolávající látkou vymizí klinické i laboratorní projevy onemocnění. Ačkoliv v literatuře jsou velmi vzácně popisovány i život ohrožující projevy DIL, jako jsou srdeční tamponáda (19), aseptická meningitida (20) či závažná autoimunitní hepatitida (21). Včasná diagnóza a vysazení indukujícího léku jsou zásadní pro úpravu stavu.
VÝSKYT
Incidence onemocnění DIL je většinou velmi nízká až kazuistická. Výskyt onemocnění se zásadně neliší mezi pohlavími (muži a ženy 1 : 1,6) a je závislý na rychlosti přeměny acetylační skupiny CoA na skupinu aminovou či hydralazinovou pomocí enzymu N-acetyltransferázy v játrech. Tzv. pomalá forma acetylace je podmíněna autozomálně recesivně, např. v USA je zastoupena zhruba u poloviny populace. Pomalí acetylátoři léčiv při expozici tvoří protilátky častěji. Určitá asociace je popisována s antigeny HLA-DR4 u hydralazinové formy a DR6 po prokainamidu (22).
Ve studii 41 pacientů s revmatoidní artritidou (RA), kteří užívali salazopyrin (SAS) jako první chorobu modifikující lék v monoterapii, se u čtyř pacientů objevil léky indukovaný lupus. Tři ze čtyř těchto pacientů mělo HLA-DR 0301 haplotyp (proti 4 z 37 bez DIL). Pacienti s DIL měli zvýšenou sérovou hladinu IL-10 a vyšší frekvenci pozitivity antinukleárních protilátek (ANA) s tečkovanou fluorescencí před zahájením terapie. Výsledky dokazují, že u geneticky predisponovaných jedinců může léčba SAS indukovat imunomodulaci a vést k rozvoji DIL (4).
KLINICKÝ OBRAZ A DIAGNÓZA
Neexistují standardní diagnostická kritéria a patogeneze onemocnění je také stále nejasná. Ke stanovení diagnózy je nutné splnit čtyři z jedenácti ACR diagnostických kritérií pro SLE včetně expozice léku, který může DIL vyvolat (23–25) (tab. 2).
Table 2. Diagnostická kritéria pro léky indukovaný lupus z roku 1985 (převzato a upraveno dle Dostál C, et al. Systémový lupus erythematodes. Praha 1997) 
Léky indukovaný lupus můžeme podle převládajících klinických projevů rozdělit na systémovou formu (SLE), subakutní kožní (SCLE) a chronický kožní lupus (CCLE).
Častěji dochází u asymptomatických pacientů pouze k laboratorní indukci tvorby antinukleárních protilátek (ANA) než k rozvoji klinicky manifestního onemocnění. Léky indukovaný lupus provází často nespecifické projevy, jako jsou horečky a únava, pacienti mají často kožní a kloubní postižení, dále postižení srdce a plic. V krevním obrazu bývá vyjádřena anémie a leukopenie, zvýšená je sedimentace a při imunologickém vyšetření nacházíme antinukleární (ANA) protilátky, v minulosti se prokazovaly LE buňky, téměř vždy antihistonové protilátky a protilátky proti ssDNA, zatímco oproti klasickému SLE výskyt anti-dsDNA protilátky a ENA protilátek je vzácný (26, 27), normální bývá i hladina složek komplementu (28).
ANTI-TNF LUPUS (ATIL)
Biologická léčba a zejména blokátory TNF jsou poslední skupinou léků, která je asociována s lupus-like syndromem. Zatím není jisté, zda se jedná o typický DIL, ale vzhledem k určitým odlišnostem většina autorů spíše vyčleňuje jednotku na anti-TNF induced lupus (ATIL) (tab. 3). Častěji se ATIL manifestuje kožním, renálním a cerebrovaskulárním postižením, v laboratoři je častější pozitivita ENA a anti dsDNA protilátek s hypokomplementemií proti klasickému léky indukovanému lupusu (29). Incidence ani patogeneze anti-TNF lupus není známá. Častěji než k rozvoji klinických projevů dochází při anti-TNF léčbě pouze k indukci antinukleárních protilátek u jinak zcela asymptomatických pacientů. To bylo poprvé popsáno v prvních klinických studiích pacientů s revmatoidní artritidou (RA) léčených infliximabem, kdy pozitivita ANA vzrostla z 29 % pacientů před léčbou na 53 % pacientů po léčbě, u 14 % pacientů došlo k indukci tvorby anti-dsDNA protilátek většinou nepatogenní třídy IgM s krátkým poločasem (30). Podobné výsledky byly pozorovány i u pacientů užívajících anti-TNF léčbu se spondyloartritidami (31) a Crohnovou nemocí (32). V odborné literatuře jsou podobné výsledky sérokonverze u pacientů léčených biologiky, nejvíce po infliximabu, který je v praxi používán nejdéle a s ohledem na svoji molekulu má zároveň největší schopnost indukce autoprotilátek, méně po etanerceptu (33) a adalimumabu (29, 34). Diskutováno bylo současné užívání MTX (30), které vede k redukci tvorby autoprotilátek (29), některé studie však toto nepotvrdily (35).
Table 3. Charakteristika anti-TNF lupusu (ATIL) 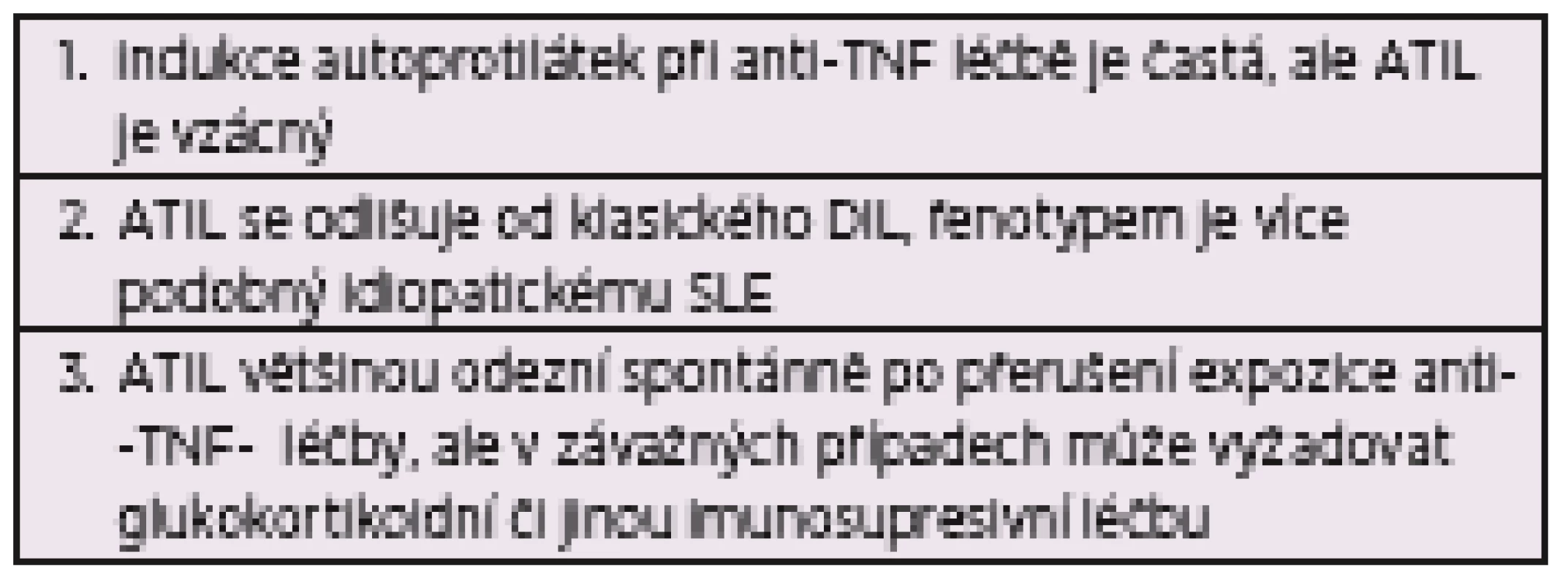
Podobnou práci publikoval Takase 2014, který popsal sérokonverzi do ANA pozitivity u biologicky naivních pacientů s RA, léčených prvním biologickým preparátem (bDMARD) průměrně po 11 měsících léčby (31,2 % pacientů léčených infliximabem, 11,8 % po etanerceptu, 16,1 % po adalimumabu). Pozitivita anti-dsDNA protilátek byla pouze u 7,2 % pacientů ve všech léčených skupinách, průměrně po 2 letech léčby. Pouze tři pacienti z celkového počtu 454 sledovaných vyvinuli lupus. Pozitivita ANA byla zjištěna u sedmi pacientů (9,5 %) léčených tocilizumabem a pěti pacientů (8,6 %) léčených abataceptem (36). Z této studie vyplývá asociace mezi sérokonverzí do ANA pozitivity a rozvojem sekundárního selhání biologické léčby (36).
Retrospektivní analýza francouzských autorů (37) z roku 2005 popisuje nejobsáhlejší soubor 32 pa - cientů s léky indukovaným lupusem po podání TNF inhibitorů při léčbě revmatoidní či psoriatické artritidy, deset pacientů bylo vyloučeno z důvodu preexistující lupusového syndromu nebo kvůli projevům smíšeného onemocnění pojiva před zahájením anti-TNF léčby. Kritéria ke stanovení diagnózy byla použita dle American Congress of Rheumatology (ACR) pro SLE (25), při splnění pouze tří diagnostických kritérií autoři hovoří o inkompletním lupusu s izolovanou kožní manifestací, autoprotilátkovou aktivitou, bez systémových projevů, někdy nazývané „toxidermie“ (deset pacientů ze souboru). Při splnění čtyř diagnostických kritérií se jedná o jednoznačnou diagnózu se systémovými projevy (12 pacientů ze souboru).
V této práci incidence lupusového syndromu po infliximabu (15 manifestovaných/7700 celkově léčených ve Francii = 0,19 %) a etanerceptu (sedm manifestací/3800 léčených = 0,18 %) je stejná. U 15 pacientů vzniklo onemocnění po podání infliximabu v průměru po 9 měsících léčby. U sedmi pacientů onemocnění vyvolalo podávání etanerceptu průměrně po 4 měsících léčby. Po stanovení diagnózy byla ve všech případech léčba přerušena a během několika týdnů (medián 8 týdnů) došlo k vymizení klinických projevů téměř u všech pacientů. Pouze u jediného pacienta perzistovaly klinické projevy déle a úprava trvala 6 měsíců. Část pacientů (osm pacientů) vyžadovala zavedení léčby glukokortikoidy ve formě lokální (dva pacienti), perorální (čtyři pacienti) či pulzní (dva pacienti) (37).
Rozdíl ve výskytu protilátek u klasického DIL a ATIL popisuje Costa 2008 (34) ve své práci (tab. 4). Pacienti s klasickým DIL měli v 99 % ANA pozitivitu a pozitivitu antihistonových protilátek (více než 95 %), zatímco anti-dsDNA protilátky byly pouze u 1 % pacientů. Oproti tomu u 33 ATIL pacientů mělo pouze 57 % pozitivní antihistonové protilátky, avšak 90 % mělo anti-dsDNA pozitivitu. Pozitivita ENA a hypokomplementemie byly častější u ATIL pacientů (34).
Table 4. Rozdíly mezi léky indukovaným lupusem (DIL) a anti-TNF lupusem (ATIL) 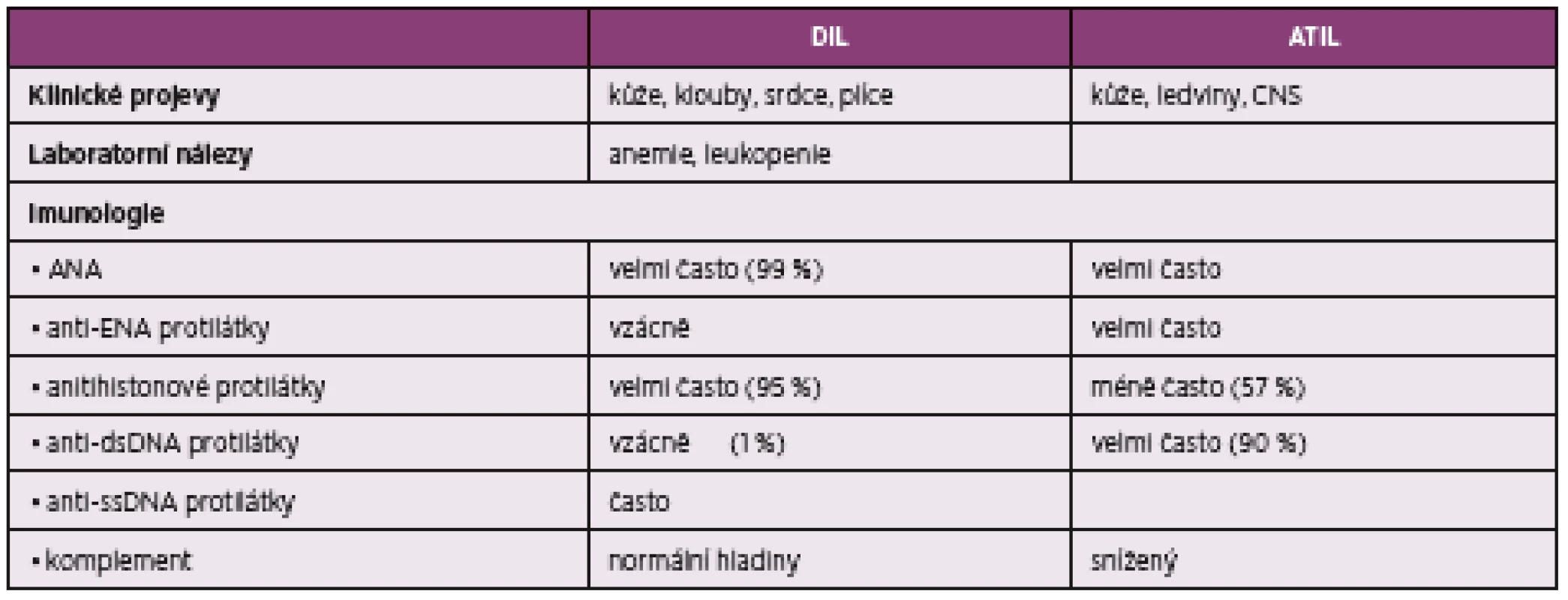
V britském registru (BSR Biologics Register – BSRBR), který zahrnuje 11 394 anti-TNF léčených pacientů, se vyskytlo 40 pacientů s anti-TNF lupusem, ačkoliv zde byli zahrnuti jak pacienti s izolovaným kožním postižením, tak s plně vyjádřeným ATIL (38).
U později zavedených biologických preparátů je výskyt léky indukovaného lupusu v literatuře kazuistický, např. po podání abataceptu (39, 40) či tocilizumabu (36). Po podání malých molekul, i s ohledem na odlišný mechanismus účinku, zatím léky indukovaný lupus nebyl popsán.
V českém registru ATTRA byl léky indukovaný lupus vykázán pouze u dvou pacientů (PsA a AS).
Jedna z hypotéz mechanismu indukce protilátek spočívá ve vzrůstajícím množství apoptotických částí a antigenů z apoptotických buněk. U pacientů s RA nenacházíme cirkulující nukleozomy, avšak u části pacientů vzrůstá hladina plazmatických nukleozomů při terapii infliximabem. U geneticky disponovaného jedince může vyšší hladina nukleozomů vyvolat tvorbu autoprotilátek (41).
Další hypotézou je cytokinový posun, ve kterém TNF-blokátory suprimují Th1-buňky a naopak aktivují odpověď Th2-buněk vedoucí k rozvoji SLE, díky změnám v cytokinové rovnováze a následné indukci autoprotilátek (36), to již bylo potvrzeno in vivo na myším modelu (42).
V neposlední řadě se diskutuje role bakteriální infekce, která je silným stimulátorem polyklonální aktivace B-lymfocytů a tvorby autoprotilátek. Následkem infekce při terapii etanerceptem byla zjištěna pozitivita anti-DNA protilátek, při antibiotické léčbě došlo k opětovné normalizaci hladin ve všech případech (43).
ZÁVĚR
Výskyt léky indukovaného lupusu není častý, ale vzhledem k rozšiřujícím se léčebným možnostem je nutné na tuto diagnózu stále myslet. Tzv. anti-TNF lupus se liší klinicky i laboratorně od klasického léky indukovaného lupusu. Stanovení diagnózy nebývá jednoduché zejména proto, že klinické projevy nejsou specifické a mohou být projevem původního onemocnění. Významné je sledování imunologické autoprotilátkové aktivity před zahájením a v průběhu léčby anti-TNF-α, zejména pak pokud je podezření na léky indukovaný lupus. Léčba léky indukovaného lupusu spočívá ve vysazení léku, který onemocnění vyvolal (44). Ve velmi krátké době po vysazení dochází ve většině případů ke spontánní klinické úpravě stavu, avšak sérologické abnormality přetrvávají i několik měsíců po vysazení. V závažnějších případech onemocnění vyžaduje i léčbu glukokortikoidy.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Lucie Podrazilová, PhD.
Revmatologická ambulance
Seydlerova 2451, 158 00 Praha 5
e-mail: revmapraha@seznam.cz
Sources
1. Hoffman BJ. Sensitivity tu sulfadiazine resembling acute disseminated lupus erythematosus. Arch Dermatol Syphilol 1945; 51 : 190–192.
2. Mansilla-Tinoco R, Harland SJ, Ryan PJ, et al. Hydralazin, antinuclear antibodies, and the lupus syndrome. Br Med J 1984; 289 : 410–412.
3. Batchelor JR, Welsh KI, Tinoco RM, et al. Hydralazine-induced systemic lupus erythematosus: influence of HLA DR and sex on susceptibility. Lancet 1980; 1 : 1107–1109.
4. Gunnarsson I, Nordmark B, Hassan Bakri A, Grondal G, et al. Development of lupus-related side-effects in patients with early RA during sulphasalazine treatment – the role of IL-10 and HLA. Rheumatology 2000; 39(8): 886–893.
5. Totoritis MC, Tan EM, McNally EM, Rubin RL. Association of antibody to histone complex H2A-2B with symptomatic procainamideinduced lupus. N Engl J Med 1988; 318 : 1431–1436.
6. Fenniche S, Dhaoui A, Ammar FB, Benmously R, Marrak H, Mokhtar I. Acebutolol-induced subacute cutaneous lupus erythematosus. Skin Pharmacol Physiol 2005; 18 : 230–233.
7. Spiera RF, Berman RS, Werner AJ, Spiera H. Ticlopidine-induced lupus: A report of 4 cases. Arch Intern Med 2002; 162 : 2240–2243.
8. Capponi A, De Simone C, Guerriero C, Rotoli M, Bartoloni C. Ro/SSA-positive cutaneous lupus induced by carbamazepine. Arch Dermatol 2005; 141 : 103–104.
9. Petri M, Albritton J. Antibiotic allergy in systemic lupus erythematosus. J Rheumatol 1192; 19 : 265–269.
10. Elkayam O, YaronM, Caspi D. Minocycline – induced autoimmune syndromes: on overview. Semin Arth Rheum 1999; 28 : 392–397.
11. Gough A, Chapman S, Wagstaff K, Emery P, Elias E. Minocycline induced autommune hepatitis and systemic lupus erythematosus-like syndrome. Br Med J 1996; 312 : 169–172.
12. Bonsmann G, Schiller M, Luger TA, et al. Terbinafine - incuced subacute cutaneous lupus erythematosus. Arch Dermatol 2001; 44 : 925–931.
13. Petri M, Kim MY, et al. Combined oral contraceptives in women with systemic lupus erythematosus. N Engl J Med 2005; 353 : 2550–2558.
14. Buyon JP, Petri M, Kim MY, et al. The effect of combined estrogenprogesteron hormon replacement therapy on disease akti-vity in systemic lupus erythematosus: a randomized trial. Ann Int Med 2005; 142 : 953–961.
15. Khattak FH, Morris IMM, Mattingly PC. Sulphasalazine-induced systemic lupus erythematosus in a patient with rheumatoid arthritis. Br J Rheumatol 1993; 22 : 104–104.
16. Shiozawa S, Kuroki Y, Kim M, Hirohata S, Ogino T. Interferon – alpha in lupus psychosis. Arthritis Rheum 1992; 35 : 417–422.
17. Wandl UB, Nagel-Hiemke M, May D, et al. Lupus-like autoimmune disease induced by interferfon therapy for myeloproliferative disorders. Clin Immunol Immunopathol 1992; 65 : 70–74.
18. Vasoo S. Drug induced lupus: an update. Lupus 2006; 15(11): 757–761.
19. Siddiqui MA, Khan IA. Isoniazid-induced lupus erythematosus presenting with cardiac tamponade. Am J Ther 2002; 9 : 163–165.
20. Jolles S, Sewell WA, Leighton C. Drug-induced aseptic meningitis: diagnosis and management. Drug Saf 2000; 22 : 215–216.
21. Graziadei IW, Obermoser GE, Sepp NT, Erkhart KH, Vogel W. Druginduced lupus like syndrome associated with severe autoimmune hepatitis. Lupus 2003; 12 : 409–412.
22. Batchelor JR, Welsh KI, Tinico RM, Dollery CT, Hughes GRV, et al. Hydralazine-induced systemic lupus erhythematosus: influence of HLA-D and sex o susceptibility. Lancet 1980; 315 : 1107–1109.
23. Tan EM, Cohen AS, Fries JF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1982; 25 : 1271–1277.
24. Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erthematosus. Arthritis Rheum 1997; 40 : 1725.
25. Aringer M. EULAR/ACR classification criteria for SLE. Semin Athritis Rheum. 2019; 49(3S): S14–17.
26. Fritzler MJ, Tan EM. Antibodies to Histones in Drug-Induced and Idiopathic Lupus Erythematosus. J Clin Invest 1978; 62(3): 560–567.
27. Rubert LR. Drug – induced lupus. J Tox 2005; 209(2): 135–147.
28. Dostál C, Vencovský J. Léky indukovaný lupus erythematodes. Systémový lupus erythemadoes. Cheb: Medprint 1997; 110–112.
29. Williams EL, Gadola S, Edwards CJ. Anti-TNF-induced lupus. Rheumatol 2009; 48 : 716–720.
30. Maini RN, Breedveld FC, Kalden JR, et al. Therapeutic efficacy of multiple intravenous infusion of anti.tumour necrosis factor α monoclonal antibody combined with low-dose weekly methotrexate in rheumatoid artrhritis. Arthritis Rheum 1998; 41 : 1552–1563.
31. De Rycke L, Kruithof E, Van Damme N, et al. Antinuclear anti-bodies following infliximab treatment in patients with rheumatoid arthritis or spondylartrhropathy. Arthritis Rheum 2003; 48 : 1015–1023.
32. Vermiere S, Norman M, Van Assche G, et al. Autoimmunity associated with anti-tumor necrosis factor alpha treatment in Crohn’s disease: a prospective cohort study. Gastroenterology 2003; 125 : 32–39.
33. Bacquet-Deschryver H, Jouen F, Quillard M, et al. Impact of three anti-TNFalpha biologics on existing and emergent autoimmunity in rheumatoid arthritis and spondylarthropathy patients. J Clin Immunol 2008; 28 : 445–455.
34. Costa MF, Said NR, Zimmermann B. Drug-induced lupus due to anti-tumor necrosis factor α agents. Sem Arthr and Rheum 2008; 37 : 381–387.
35. Caramaschi P, Biasi D, Colombatti M, et al. Anti-TNF-α therapy in rheumatoid arthritis and autoimmunity. Rheumatol Int 2006; 26 : 209–214.
36. Takase K, Horton SC, Ganesha A, Das S, McHugh A, Emery P, et al. What is the utility of routine ANA testing in predicting development of biological DMARD-induced lupus and vasculitis in patients with rheumatoid arthritis? Data from a single-centre cohort. Ann Rheum Dis 2014; 9 : 1695–1699.
37. de Bandt M, Sibilia J, Loët XL, Prouzeau S, Fautrel B, Marcelli Ch, et al. Systemic lupus erythematosus induced by anti-tumour necrosis factor alpha therapy: a French national survey. Arthr Res Ther 2005; 7 : 545–551.
38. Thornhill J, Watson KD, Lord PA, Symmons DP, Hyrich KL. Drug-induced lupus inn patients wiht inflammatory artrhitis treated with TNF blocking agents: results from the BSR Biologics Register. BSR Abstracts 2008.
39. Asami Y, Ishiguro H, Ueda A, Nakajima H. First report of membranous nephropathy and systemic lupus erthymetosus associated with abatacept in rheumatoid arthritis. Clin Exp Rheumatol 2016; 34(6): 1122.
40. Tarazi M, Aiempanakit K, Werth VP. Subacute cutaneous lupus erythematosus and systemic lupus erthematosus associated with abatacept. JAAD Case Rep 2018; 4(7): 698–700.
41. Lorenz HM, Herrrmann M, Winkler T, Gaipl U, Kalden JR. Role of apoptosis in autoimmunity. Apoptosis 2000; 5 : 443–449.
42. Via CS, Shustov A, Rus V, Lang T, Nguyen P, Finkelman FD. In vivo neutralization of TNF-alpha promotes humoral autoimmunity by preventing the induction of CTL. J Immunol 2001; 167 : 6821–6826.
43. Ferracioli G, Mecchia F, Di Poi E, Fabris M. Anticardiolipin antibodies in rheumatoid patients treated with etanercept or conventional combination therapy: direct and indirect evidence for a possible association with infections. Ann Rheum Dis 2002; 61 : 358–361.
44. Bertsias GK, Tektonidou M, Amoura Z, et al. EULAR recommendations for the management of systemic lupus erythematosus. Report of a Task Force of the EULAR Standing Commitee for International Clinical Studies Including Theurapeutics. Ann Rheum Dis 2008; 67 : 195–205.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2020 Issue 2
Most read in this issue- Drug induced lupus
- Cutaneou vasculitis in SLE – to treat or not to treat?
- Polyarteritis nodosa with dissection of the iliac arteries
- Symptoms of depression and anxiety in patients with axial spondyloarthritis: a pilot study in patients with an active approach to physical activity treatment
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career