-
Medical journals
- Career
Magnetická rezonance v diagnostice idiopatických zánětlivých myopatií
Authors: K. Kubínová 1,2; J. Vencovský 1,2
Authors‘ workplace: Revmatologický ústav Praha 1; Revmatologická klinika 1. LF UK, Praha 2
Published in: Čes. Revmatol., 28, 2020, No. 1, p. 23-31.
Category: Review Article
Overview
Zobrazovací metody v diagnostice idiopatických zánětlivých myopatií zaujímají v klinické praxi stále pevnější postavení. Nejrozšířenějším vyšetřením je MR stehenních svalů. Tato metoda umožňuje podrobné zobrazení měkkých tkání a probíhajících patologických procesů, často se využívá také k navedení svalové biopsie a zvýšení její diagnostické výtěžnosti. Nejčastěji hodnocenými morfologickými aspekty bývá svalový edém (v oblastech zvýšené permeability cév), svalová atrofie a tuková degenerace nastupující po proběhlém zánětu či denervaci. Přestože byl publikován již nespočet prací zabývající se touto tematikou, doposud není jasně stanovený jednotný protokol hodnocení MR nálezů u pacientů s idiopatickými zánětlivými myopatiemi.
Klíčová slova:
zobrazovací metody – idiopatické zánětlivé myopatie – MR
ÚVOD
Idiopatické zánětlivé myopatie (IZM) jsou heterogenní skupinou chorob. Tato onemocnění jsou způsobena autoimunitním procesem namířeným převážně vůči příčně pruhovanému svalstvu. Následkem probíhajícího zánětu ve svalové tkáni je slabost proximálních svalových skupin, projevující se snížením mobility (neschopnost chůze do schodů, vstát se dřepu atp.), snížením sebeobsluhy (nemožnost zvednout paže nad hlavu), poruchou polykání horního typu s rizikem aspirace, či hlasovou dysfonií (1). Jedná se o onemocnění získaná a často léčitelná, což v praxi znamená, že správná diagnostika může zvrátit stav i prognózu choroby. Včasné zahájení léčby pak může zásadně ovlivnit osud pacienta a jeho výslednou soběstačnost.
Soubor idiopatických zánětlivých myopatií tvoří několik fenotypově i histopatologicky odlišných typů onemocnění. Starší klasifikace od Bohana a Petera z roku 1975 rozděluje idiopatické zánětlivé myopatie do následujících pěti nozologických jednotek:
- polymyozitida (PM)
- dermatomyozitida (DM)
- juvenilní dermatomyozitida (JDM)/juvenilní polymyozitida (JPM)
- polymyozitida nebo dermatomyozitida asociovaná s jinou chorobou pojivové tkáně (overlap PM/DM)
- PM/DM asociovaná s malignitou (2, 3)
Později byla popsána sporadická myozitida s inkluzními tělísky (sporadic inclusion-body myositis – sIBM) a vypracována diagnostická kritéria (4).
Kromě svalové slabosti jednotlivé IZM doprovází další charakteristické rysy. Dermatomyozitida se projevuje patognomickým kožním postižením, typicky periorbitálními otoky s erytémem, heliotropním exantémem (červenofialový exantém) na dekoltu a v dalších lokalizacích (na zádech tzv. shawl sign – příznak šály, na bocích stehen tzv. holster sign). Na dorzálních stranách nad drobnými klouby rukou, kolen a loktů lze najít Gottronovy papuly – makulopapulózní erytémy (5), někdy až splývající v kontinuální plaky.
Tíže svalových projevů může být u každého pacienta odlišná. V praxi se setkáváme s různými stupni svalového postižení od vzácnějších forem tzv. amyopatické (6) dermatomyozitidy (tedy s absencí svalového postižení) až po těžké, rychle progredující imobilizující myopatie se známkami rhabdomyolýzy (častěji např. u nekrotizujících myopatií). Distribuce u poly - a dermatomyozitidy bývá zpravidla proximální a symetrická. Naproti tomu u sporadické myozitidy s inkluzními tělísky mohou být obtíže asymetrické, pomalu progredující a týkají se nejen proximálních (zejména m. quadriceps femoris), ale i distálních svalových skupin (flexory předloktí, distální flexory prstů, dorzální flexory hlezna), které postihují výrazněji (7, 8).
Novější klasifikace (např. Targoff 2005 či Mariampillai 2018) však respektují i další odlišnosti jednotlivých podtypů IZM, především ty histopatologické. Zároveň vycházejí z faktu, že se u zhruba 50 % případů pacientů objevují klinické jevy společné s dalšími systémovými onemocnění pojiva, jako je systémová sklerodermie nebo systémový lupus erythematodes (např. Raynaudův fenomén, horečky či přítomnost intersticiálního plicního procesu) (9, 10). Bereme-li v úvahu tyto příznaky spojené např. s výskytem pro myozitidu specifických protilátek, ze skupiny se nám vyčlení další klinické jednotky, jako je antisyntetázový syndrom (klinicky přítomnost myozitidy horeček, artritidy, Raynaudova fenoménu, plicního postižení a rukou mechanika), který je asociován s detekcí protilátek proti aminoacyl-tRNA syntetázám (11). Dramatičtější průběh onemocnění s výrazným postižením svalů dále může předjímat přítomnost tzv. imunitně zprostředkované nekrotizující myopatie (immune-mediated necrotizing myopathy – IMNM) (10), která může být asociována s přítomností protilátek proti 3-hydroxy-3-methylglutaryl-koenzym A reduktáze (anti-HMGCR) či proti signál rozpoznávající částici (anti-SRP) (signal recongition particle).
Klinické projevy idiopatických zánětlivých myopatií bývají často doprovázeny zvýšením sérové hladiny kreatinkinázy (CK), myoglobinu, laktát dehydrogenázy (LDH) či svalové frakce aspartátaminotranferázy (AST), alaninaminotransferázy (ALT). Dříve se v diagnostice užívalo i stanovení enzymu aldolázy, která je hojně obsažena ve svalových buňkách a uvolňuje se při svalovém rozpadu, dnes se již monitoring tohoto enzymu u nás rutinně nevyužívá. Elevace markerů svalového postižení bývá patrná při aktivním zánětlivém procesu a v obdobích remise se tyto parametry většinou normalizují, je však třeba poznamenat, že ne vždy musí elevace svalových enzymů korelovat s aktivitou onemocnění a ani změny hodnot v závislosti na léčbě nelze přeceňovat. Výše uvolněných enzymů také může být ovlivněna recentním provedením EMG či svalové biopsie, zvyšuje se i po intramuskulární aplikaci léčiv, či po náročnější rehabilitaci (12).
Nezbytnou součástí laboratorního vyšetření je vyšetření imunologické. V posledních letech je předmětem diskuze přímá účast protilátek v patogenezi onemocnění, přesný mechanismus vzniku manifestní nemoci však stále není objasněn (13).
Histologické vyšetření tkáně provádíme ze vzorku svalu, kde je sval dobře přístupný a zároveň nehrozí poranění jiných důležitých struktur, v praxi nejčastěji z vastus lateralis – čtyřhlavého svalu stehenního. Vzorek tkáně svalové biopsie vyžaduje specifické zpracování, proto by se provedení svalové biopsie měla soustředit do zavedených myopatologických laboratoří. Samotná analýza zahrnuje histologické čtení v barvení hematoxylinem-eozinem, vyšetření enzymové histochemie a imunohistochemie a zpracování polotenkých řezů pro elektronovou mikroskopii (14).
MAGNETICKÁ REZONANCE A JEJÍ POSTAVENÍ V DIAGNOSTICE
Od zavedení klasifikace Bohana a Petera do klinické praxe byly idiopatické zánětlivé myopatie diagnostikovány na základě klinického nálezu, laboratorního vyšetření, EMG nálezu a biopsie (2). Při prohlubování znalostí o symptomech a vývoji těchto onemocnění se zároveň začaly využívat další diagnostické metody, ze spektra zobrazovacích technik zejména magnetická rezonance (MR, z angl MRI – magnetic resonance imaging).
Nespornou výhodou MR je podrobné zobrazení měkkých tkání velkého rozsahu při jednom vyšetření, nevýhodou pak nemalá finanční nákladnost a časová náročnost. I přesto dnes metodu můžeme považovat za relativně dobře dostupnou. Význam MR spočívá i v možnosti detekovat optimální lokalizaci pro provedení svalové biopsie (15), což výrazně zvyšuje výtěžnost tohoto vyšetření (16). V neposlední řadě MR pomáhá odlišit míru aktivního svalového postižení od pozánětlivé tukové přestavby a atrofie svalů u pacientů s již etablovanou diagnózou (17). Díky svému přínosu si MR vydobyla i místo v některých později publikovaných diagnostických i klasifikačních kritériích, doposud však není postavení magnetické rezonance v diagnostických kritériích pevné. Přehled užívaných diagnostických kritérií nabízí tabulka 1, která porovnává jednotlivé sety diagnostických kritérií.
Table 1. Srovnání jednotlivých klasifikačních a diagnostických kritérií (upraveno podle 23) 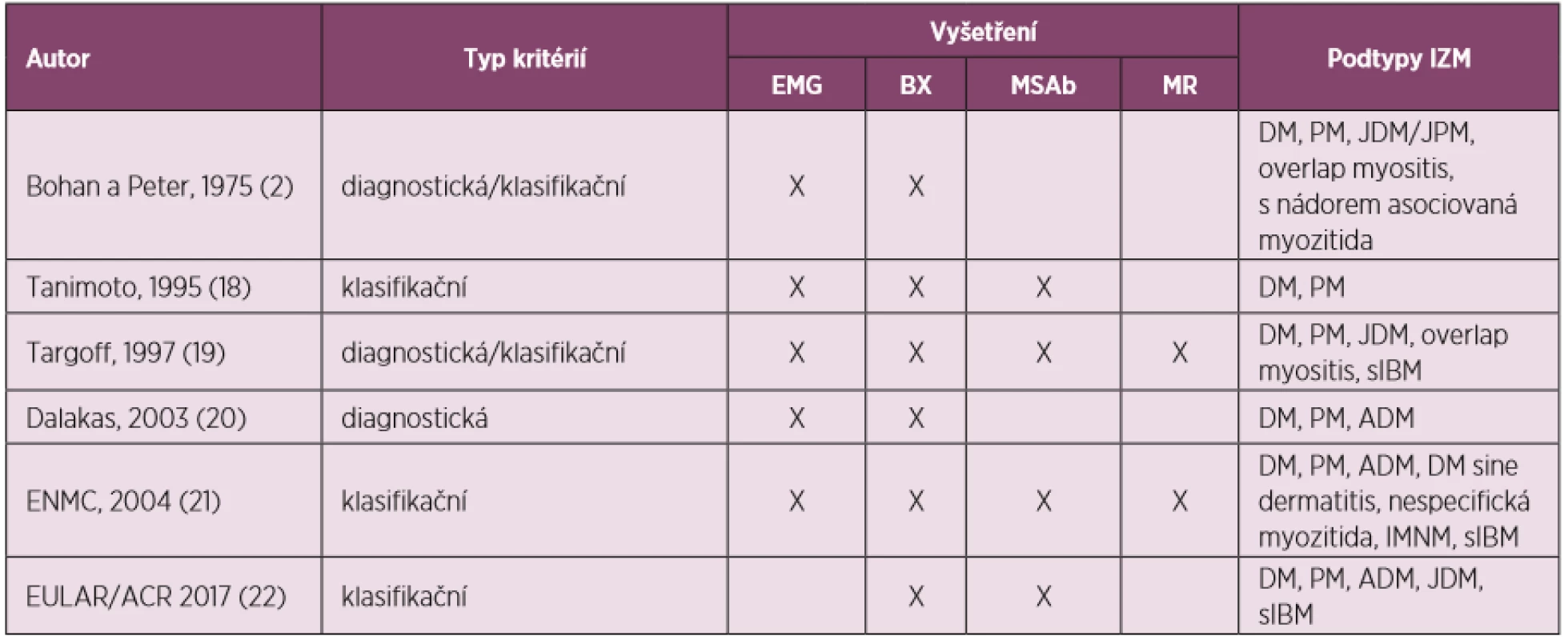
EMG – elektromyografie, BX – biopsie, MSAb – myositis-specifické autoprotilátky, MR – magnetická rezonance, IZM – idiopatické zánětlivé myopatie, DM – dermatomyozitida, PM – polymyozitida, JDM – juvenilní dermatomyozitida, sIBM – sporadická myozitida s inkluzními tělísky, IMNM – imunitně zprostředkovaná nekrotizující myopatie, ADM – amyopatická dermatomyozitida, ENMC – Evropské neuromuskulární centrum, EULAR – Evropská liga proti revmatismu, ACR – Americká kolej revmatologů Z uvedeného vyplývá, že z nověji vydaných diagnostických návodů pouze publikovaná kritéria Targoffa a ENMC kritéria zohledňují nález na magnetické rezonanci ve svém hodnocení, a to i navzdory tomu, že se dnes MR v praxi rutinně používá.
Problémem také zůstává chybějící nejednotný protokol hodnocení MR nálezů. Doposud není vypracovaný a validovaný postup popisu snímků ani nebyla definována metodika, pomocí které by bylo možné tíži postižení kvantifikovat. Z tohoto důvodu je velmi obtížné hodnotit longitudinální morfologické změny navzdory tomu, že již bylo publikováno několik prací dokládajících dobrou výpovědní hodnotu MR při longitudinálním sledování pacientů i hodnocení efektu terapie (24). Recentně bylo publikovaných několik prací, které se systému hodnocení MR věnují, ale jejich metodika se velmi liší jak způsobem hodnocení, tak výběrem pacientů, což činí výsledky vzájemně nesourodými a obtížně srovnatelnými.
NORMÁLNÍ A PATOLOGICKÉ MORFOLOGICKÉ NÁLEZY NA MR
Normální svalová tkáň na T1 vážených sekvencích MR generuje signál střední intenzity – vyšší než signál vody a kostí, ale nižší signál, než vydává kostní dřeň (obr. 1). Na T2 vážených sekvencích se zdravý sval zobrazuje hypointenzní v porovnání s tukovou tkání či vodou (obr. 2) (25).
Image 1. Axiální T1 vážená sekvence – zdravý sval. Zdroj: Archiv Revmatologického ústavu (ÚVN Střešovice, Discovery 450; 1,5 T) 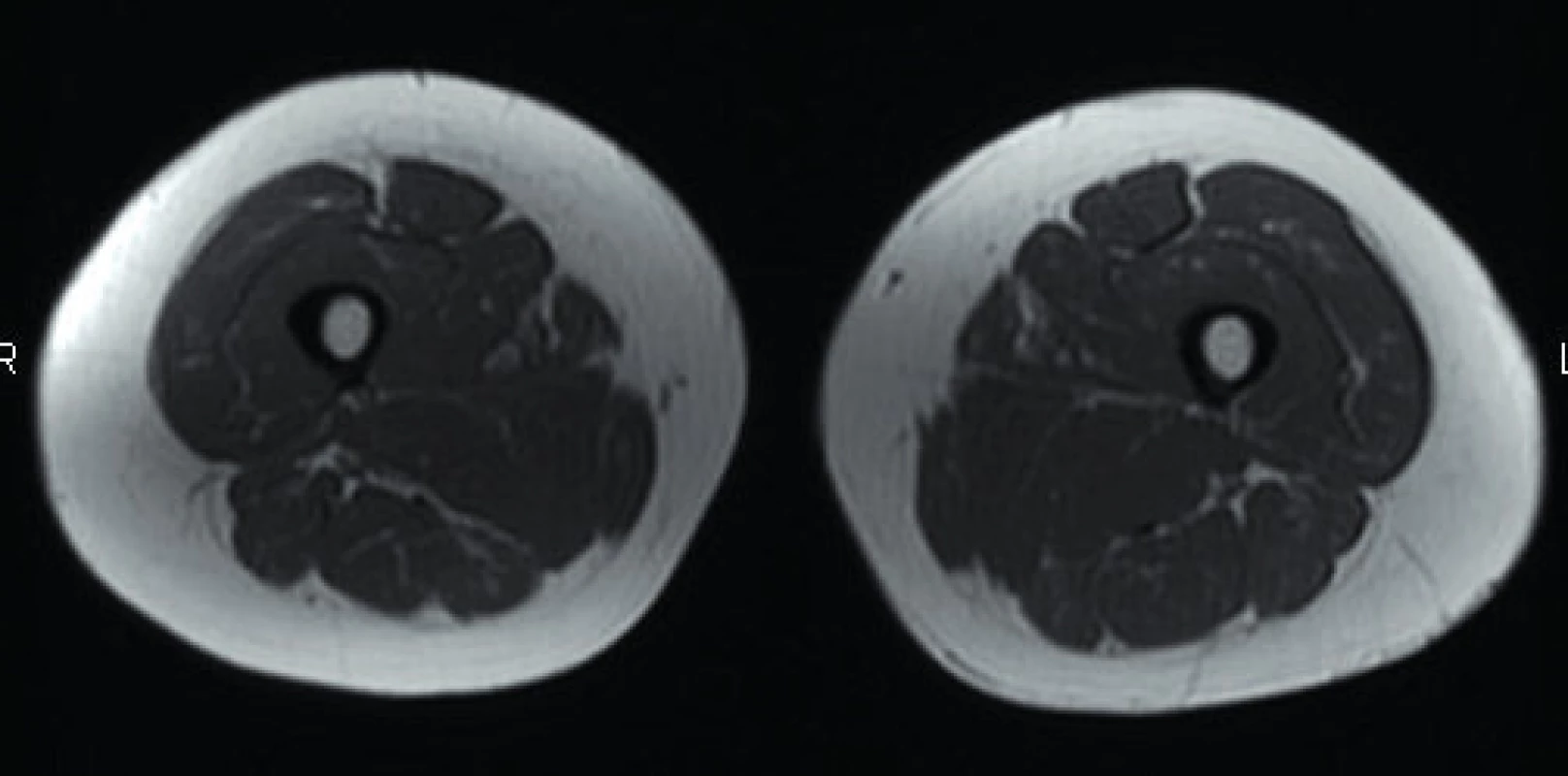
Image 2. Axiální STIR (short tau inversion recovery) sekvence – zdravý sval. Zdroj: Archiv Revmatologického ústavu (ÚVN Střešovice, Discovery 450; 1,5 T) 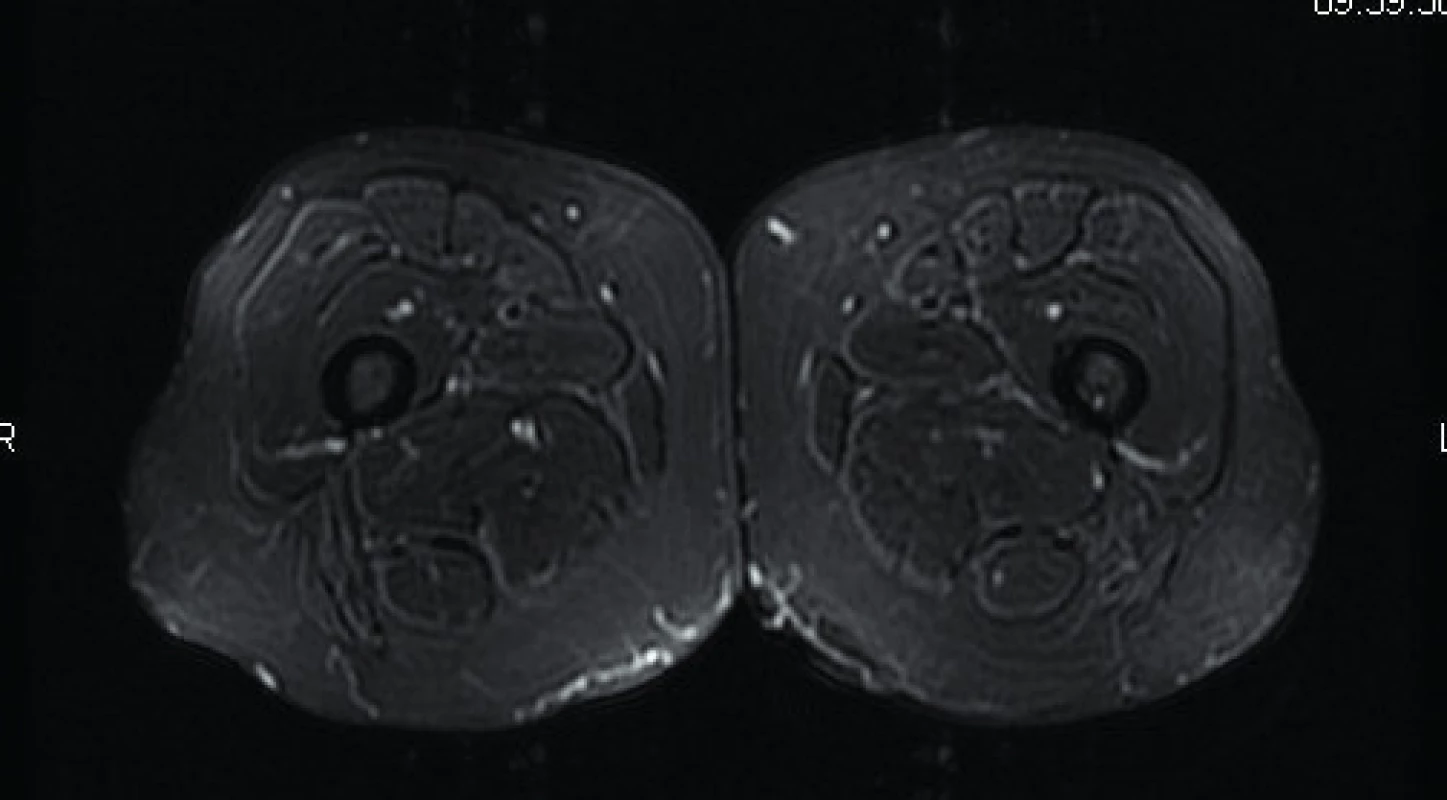
Při aktivním zánětlivém postižení se ve svalové tkáni vlivem zvýšené propustnosti cév vytváří edém. Postižené okrsky se dobře zobrazují na sekvencích senzitivních na přítomnost tekutiny. Dříve se k posouzení zánětlivých oblastí volily T2 vážené sekvence se supresí tuku, dnes se častěji používá technika STIR (short tau inversion recovery). Na STIR snímcích se aktivní zánětlivý edém zobrazí hyperintenzně (26).
Podobně se dá zhodnotit i přítomnost fasciitis, jež vytváří okolo svalů světlý lem (obr. 3). V případě výrazného kožního postižení u pacientů s dermatomyozitidou lze na MR dokumentovat i subkutánní edém v přilehlých lokalizacích (obr. 4).
Image 3. Axiální STIR sekvence – výrazný edém předních svalových skupin, šipkou označena fasciitis m. rectus femoris. Zdroj: Archiv Revmatologického ústavu (ÚVN Střešovice, Discovery 450; 1,5 T) 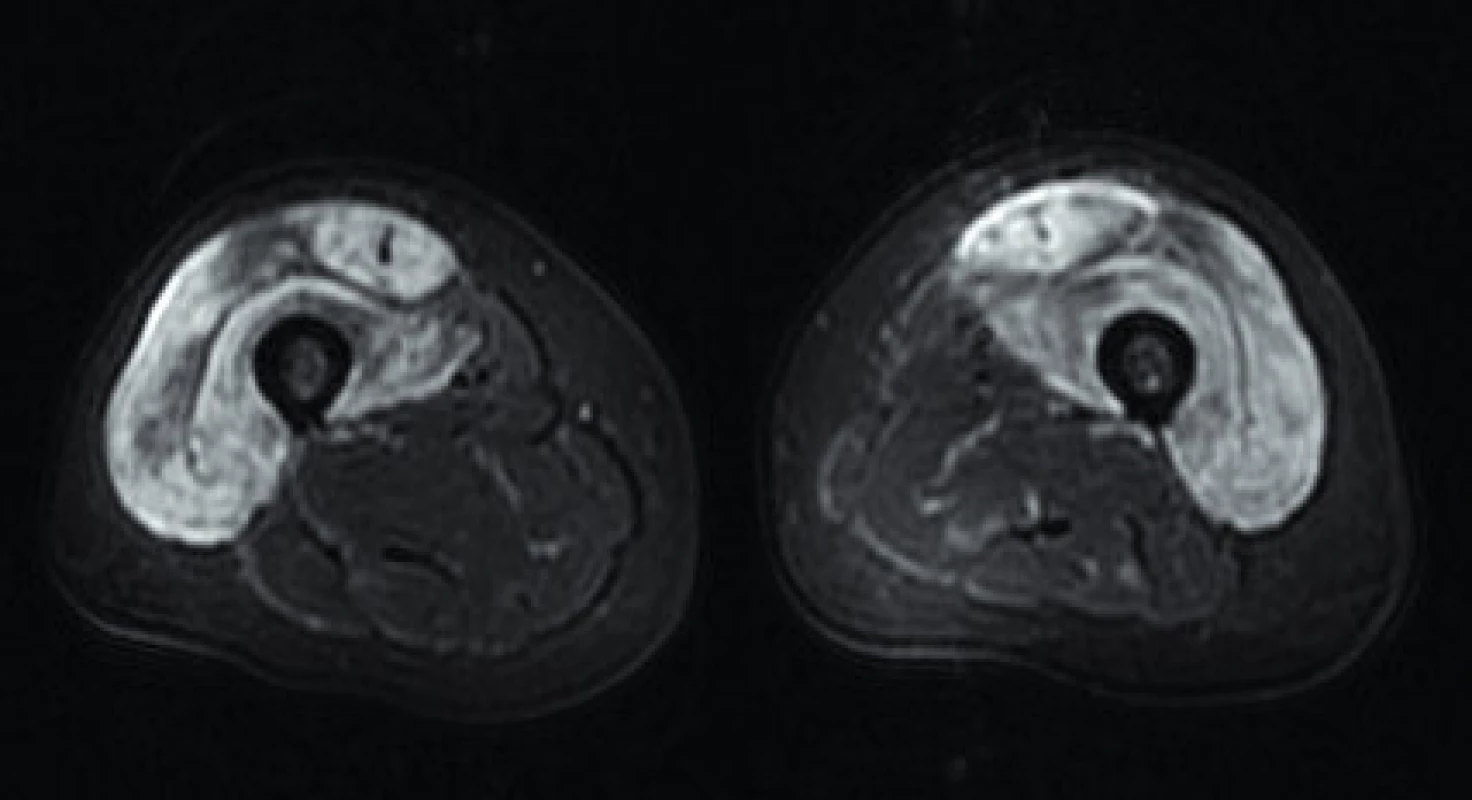
Image 4. Axiální STIR sekvence – postižení kůže a podkoží u pacienta s dermatomyozitidou. Zdroj: Archiv Revmatologického ústavu (ÚVN Střešovice, Discovery 450; 1,5 T) 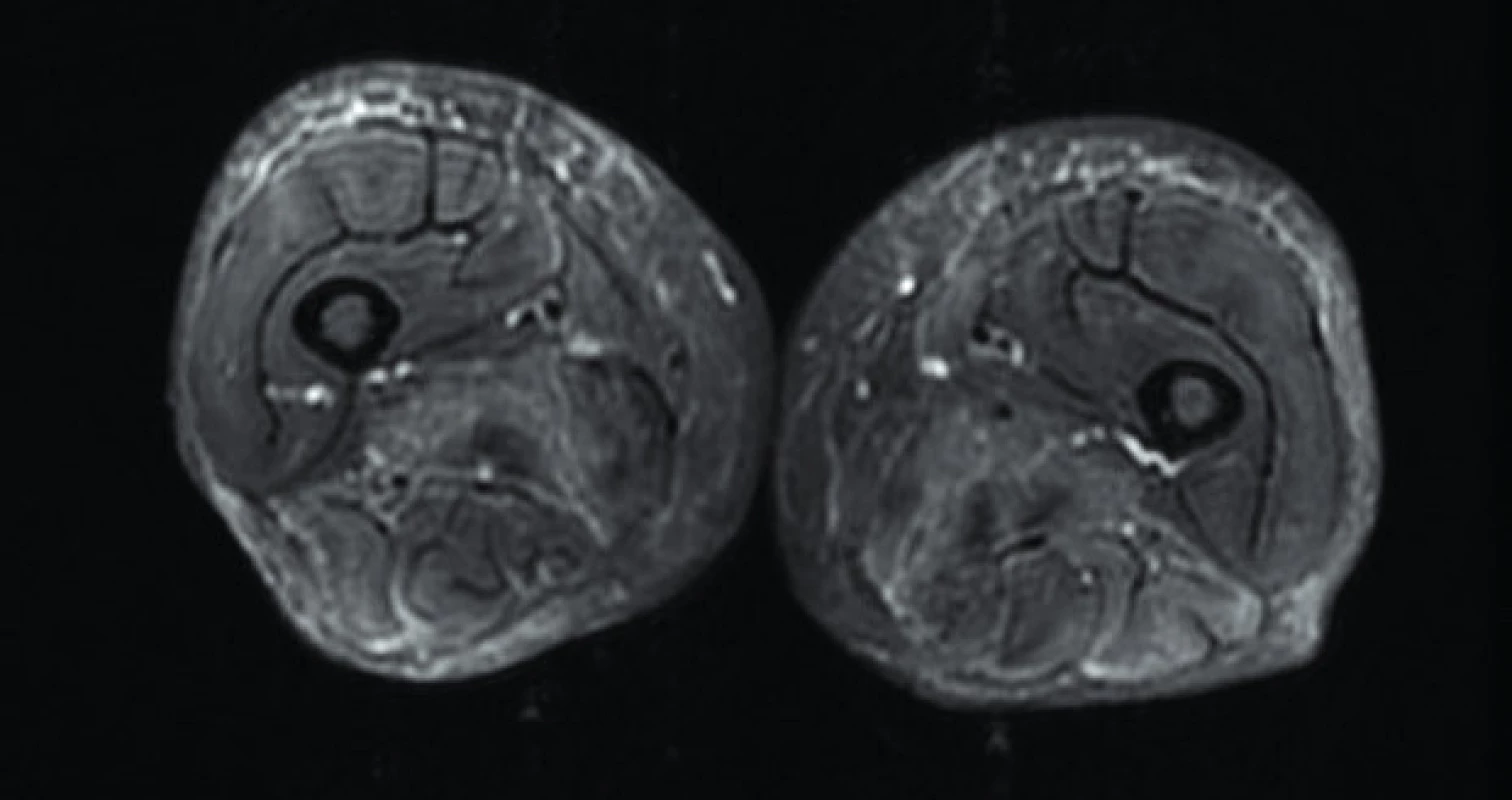
Přítomnost tukové přestavby a atrofie se naopak dobře hodnotí na T1 vážených sekvencích, kde se tuk zobrazuje hyperintenzně vůči svalové tkáni, která má nízkou intenzitu (obr. 5).
Image 5. Axiální T1 vážená sekvence – tuková přestavba a svalová atrofie u pacienta s imunitně zprostředkovanou nekrotizující myopatií. Zdroj: Archiv Revmatologického ústavu (ÚVN Střešovice, Discovery 450; 1,5 T) 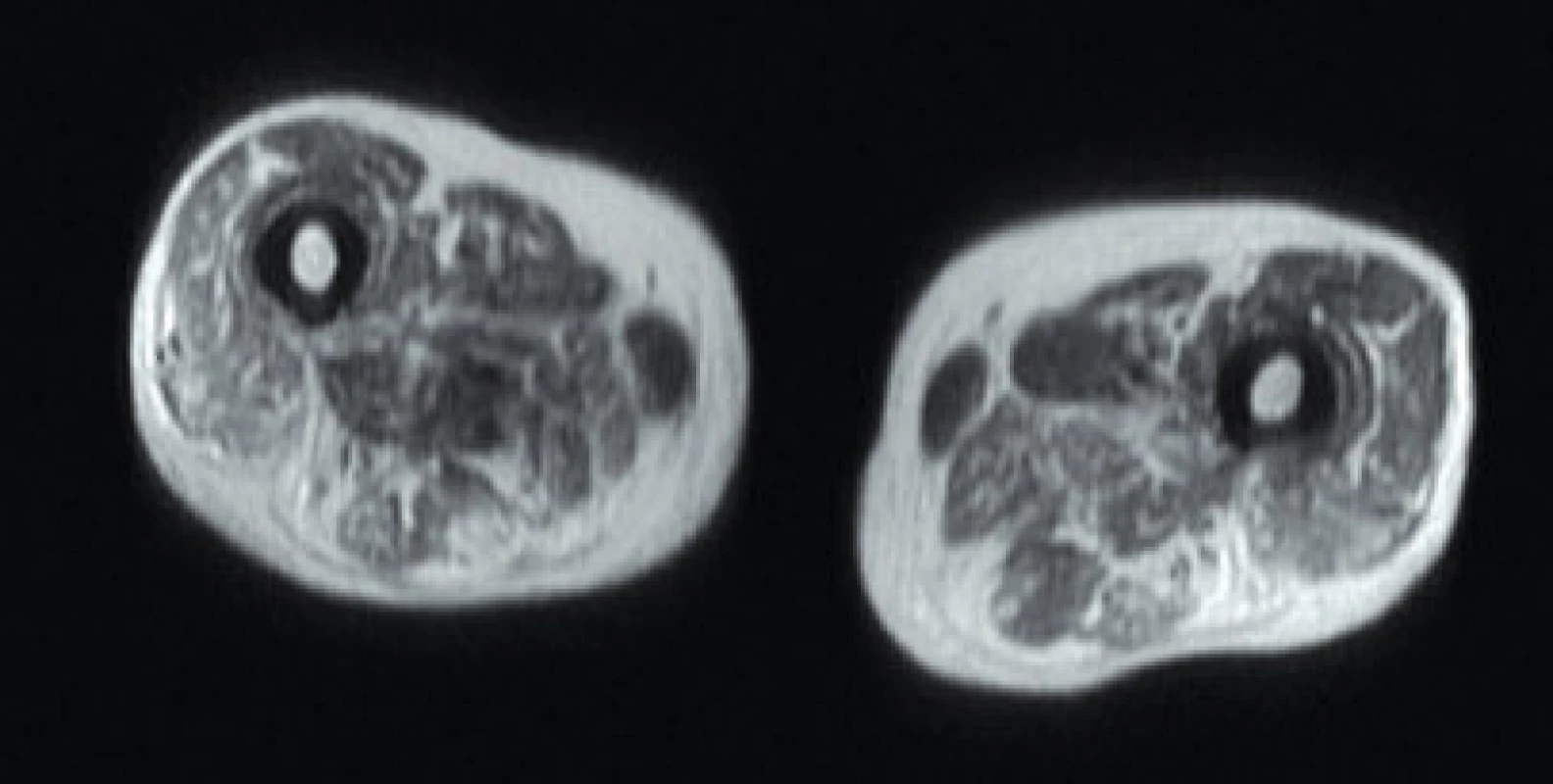
HODNOCENÍ MAGNETICKÉ REZONANCE
Na základě doposud publikovaných prací lze způsoby hodnocení MR nálezů rozdělit do dvou skupin. Část autorů předkládá semikvantitativní skórovací systémy, založené na subjektivním přiřazení tíže nálezu určitému stupni na předem definované škále. Toto hodnocení vyžaduje předchozí zkušenost a je ovlivnitelné individuálním vnímáním hodnotitele. Přesto však v publikovaných studiích hodnotitelé dosahovali dobrých interobservačních shod (27). Druhá část publikací navrhuje metody kvantitativní, založené na rozmanitých softwarových technikách zpracování obrazu.
Semikvantitativní skórovací systémy
První studie zabývající se vývojem semikvantitativního skórovacího systému za účelem posouzení tíže nálezu na MR u idiopatických zánětlivých myopatií se objevily více než před 10 lety. V roce 2007 byla publikována studie Tomasové Studýnkové (15), která předkládala hodnocení rozsahu zánětlivého postižení (EMRI skóre – extent of inflammatory area MRI score), intenzity signálu v postižené oblasti (IMRI skóre – intesity of inflammatory area MRI score) a celkové závažnosti MR afekce (TMRI skóre – total MRI involvement) přiřazené ke stupňům vizuální analogové škály v rozsahu 0 až 10 bodů. Výsledky potvrdily dobrou korelaci vstupních laboratorních a klinických parametrů s tíží postižení na magnetické rezonanci.
Většina později publikovaných studií se také zaměřovala na posouzení zánětlivého edému jako hlavního hodnoceného prvku. V těchto pracích bylo navrženo několik dalších, více či méně komplexních skórovacích systémů (tab. 2) (28). Např. v jedné z italských studií u pacientů s juvenilní dermatomyozitidou bylo použito bodovací skóre 0 až 2, kde stupeň 0 odpovídal absenci signálových změn, stupeň 1 mírným až středním změnám intenzity a stupeň 2 výrazným změnám intenzity (29).
Table 2. Přehled publikovaných skórovacích systémů (upraveno podle 28) 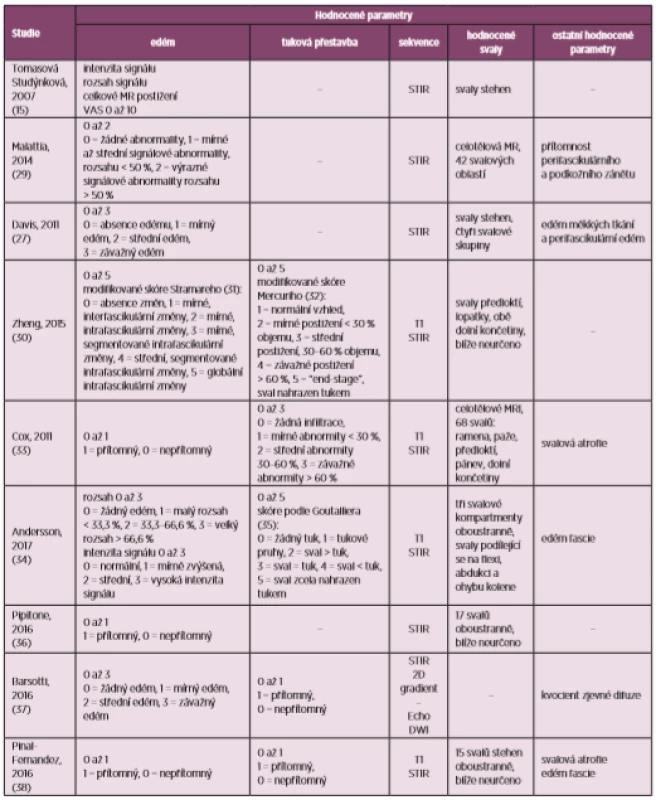
STIR – short-tau inversion recovery sequences, T1 – T1 vážené sekvence, DWI – diffusion-weighted imaging Naproti tomu ve studii Anderssonové (34) byl prezentován rozsáhlejší systém zohledňující jak intenzitu, tak rozsah poškození edémem i tukovou přestavbou, jehož výhodou jistě je přesnější evaluace jednotlivých jevů za cenu výrazné časové náročnosti. Klasifikace tukové přestavby v této práci byla inspirována rutinně využívanou ortopedickou škálou hodnocení přestavby lézí rotátorové manžety (35).
Tabulka 3 názorně demonstruje rozlišnost mezi publikovanými hodnotícími systémy. Většina navržených systémů byla aplikována na MR snímcích stehenních svalů, některé práce však vycházely z hodnocení celotělového MR, přestože výhoda provedení celotělového MR nebyla v literatuře prokázána (39); její přínos je zmiňován spíše v diagnostice komplikací terapie (zejména glukokortikoidy indukované osteonekrózy) (40). Jak je zřejmé, problematická je nejenom variabilita v hodnocených parametrech, ale také nejednotnost v počtu a lokalizaci evaluovaných svalů. Obtížné je také nalezení kompromisu mezi dostatečnou přesností, složitostí a časovou náročností ideálního hodnotícího systému, který by bylo v budoucnu možné využívat i v rámci klinické praxe.
Table 3. Souhrn MR nálezů u jednotlivých fenotypů idiopatických zánětlivých myopatií (upraveno podle 51) 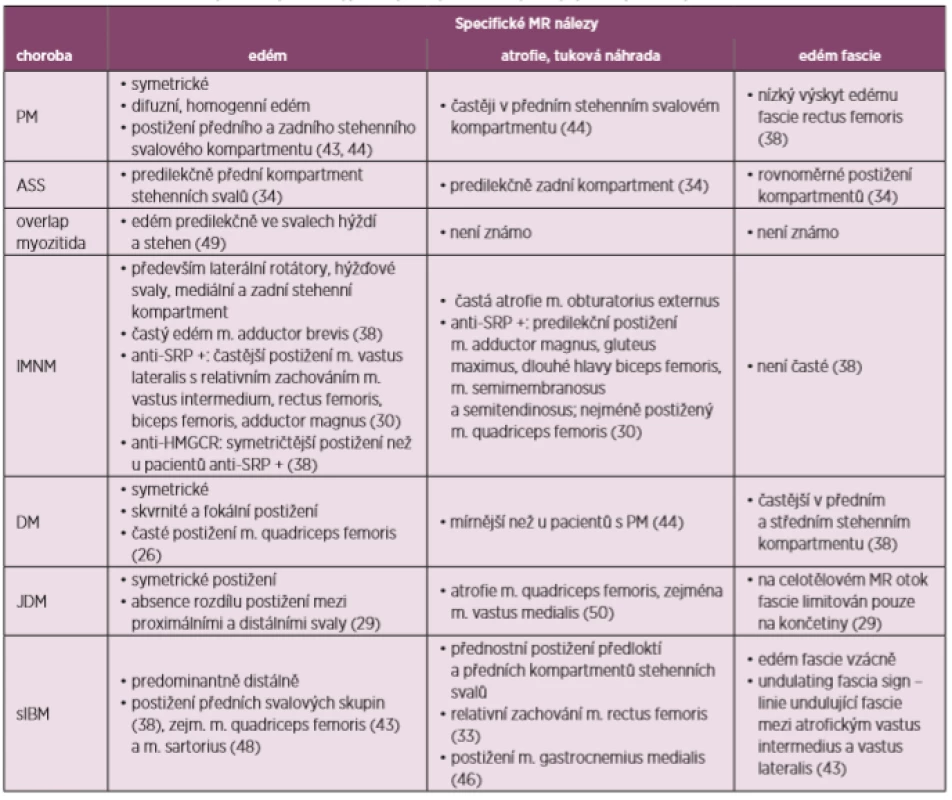
PM – polymyozitida, ASS – antisyntetázový syndrom, IMNM – imunitně zprostředkovaná nekrotizující myopatie, DM – dermatomyozitida, JDM – juvenilní dermatomyozitida, sIBM – sporadická myozitida s inkluzními tělísky Kvantitativní systémy hodnocení
Ve snaze zhodnotit míru poškození svalů přesněji byly vyvinuty postupy využívající speciální softwarové technologie. Tato hodnocení jsou založena na počítačové analýze intenzity jednotlivých pixelů ve výsledném obrazu. Výhodou je exaktní numerický výstup neovlivněný hodnotitelem. Většina z publikovaných kvantitativních evaluačních studií prokázala dobrou korelaci s použitými semikvantitativními metodami (41). Problémem zůstává závislost na přístrojovém a technickém vybavení vyšetřovacího přístroje i softwarového zpracování obrazu, reproducibilita v jiných podmínkách zatím nebyla u těchto studií ověřena. Nejvíce dostupné literatury se věnuje kvantifikaci podílu tukové přestavby v zánětem změněných svalech, např. publikace Morrowa et al. (42) popisuje progresi tukové přestavby u pacientů se sporadickou myozitidou s inkluzními tělísky.
SPECIFICKÉ NÁLEZY MAGNETICKÝCH REZONANCÍ
Pokrok a zpřesňování laboratorní diagnostiky vedlo k poznání a popsání jednotlivých podtypů chorob ve spojitosti se specifickými nebo asociovanými protilátkami. Rozšíření magnetické rezonance v diagnostice IZM vedlo k myšlence, zda existuje vazba mezi imunologickým či histologickým profilem daného onemocnění a jeho morfologickým nálezem postižení na MR.
Některé studie dokumentují predominantní postižení zadního svalového kompartmentu u pacientů s polymyozitidou (43), popřípadě symetrické postižení předního a zadního kompartmentu (obr. 6) (44). Vzhled edému svalové tkáně je v tomto případě popisován jako difuzní (až setřelého vzhledu), zejména vzhledem k zánětu probíhajícímu ve svalových vláknech.
Image 6. Axialní STIR sekvence – symetrické postižení předních a zadních kompartmentů u pacienta s polymyozitidou. Zdroj: Archiv Revmatologického ústavu (ÚVN Střešovice, Discovery 450; 1,5 T) 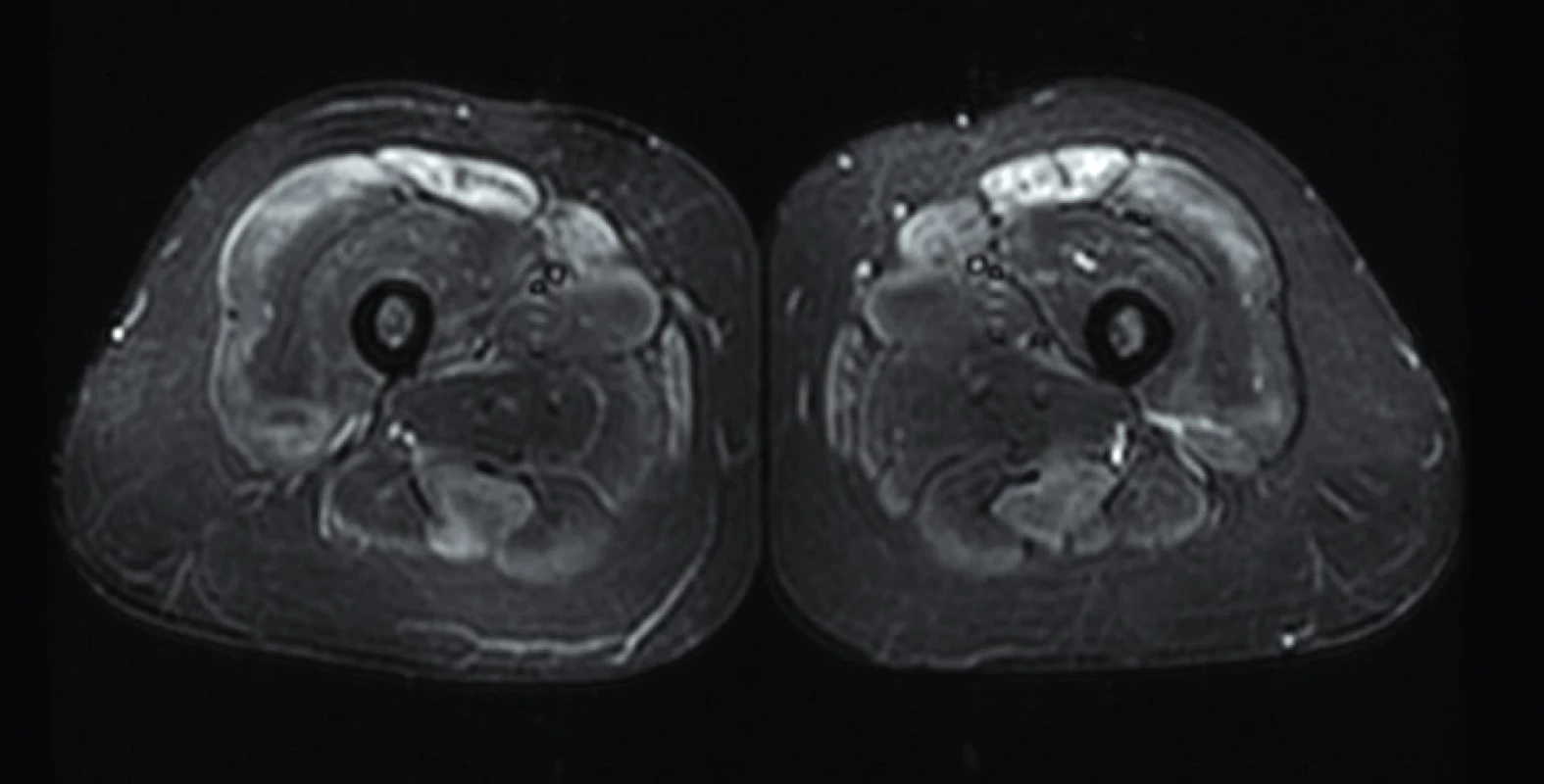
Charakter edému dermatomyozitidy je více skvrnitý a fokální, podobně jako u juvenilní dermatomyozitidy (29), což je připisováno odlišné patogenezi (obr. 7). Zánět vzniká vně svalových vláken, v perivaskulární a perifascikulární lokalizaci, navíc se na etiologii onemocnění suspektně podílejí i ischemické mechanismy (45).
Image 7. Axiální STIR sekvence – edém skvrnitého charakteru u pacienta s dermatomyozitidou (anti-Mi2+); šipkami označen edém podkoží v lokalizacích kožního poškození. Zdroj: Archiv Revmatologického ústavu (ÚVN Střešovice, Discovery 450; 1,5 T) 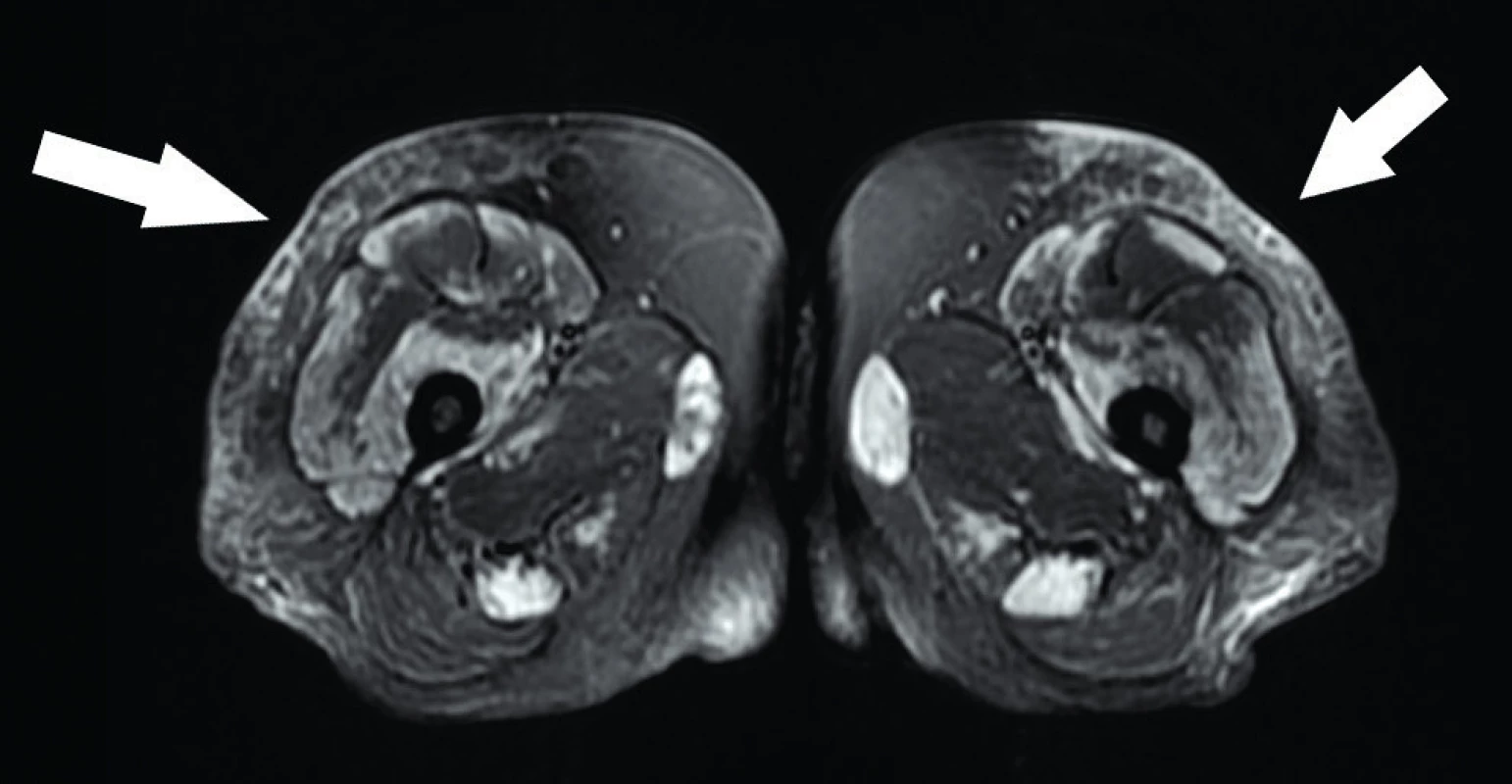
U sporadické myozitidy s inkluzními tělísky jsou ohledně svalového postižení reportována různorodá data. Známá je častá tuková přestavba a atrofie flexor digitorum profundus (33, 46). Některé studie dokumentují predilekční postižení m. quadriceps femoris (33, 47), jiné hovoří o relativním zachování m. rectus femoris (46). Publikace Tasca et al. popisuje postižení m. sartorius a gracilis (48). U sIBM byl také popsán výskyt patognomického nálezu undulující fascie (undulating fascia sign) (43), s nímž jsme se opakovaně setkali i u našich pacientů (obr. 8). Přehled publikovaných nálezů MR u jednotlivých podtypů idiopatických zánětlivých myopatií je shrnut v tabulce 3.
Image 8. Axiální STIR sekvence – undulating fascia sign u pacienta se sporadickou myozitidou s inkluzními tělísky. Zdroj: Archiv Revmatologického ústavu (ÚVN Střešovice, Discovery 450; 1,5 T) 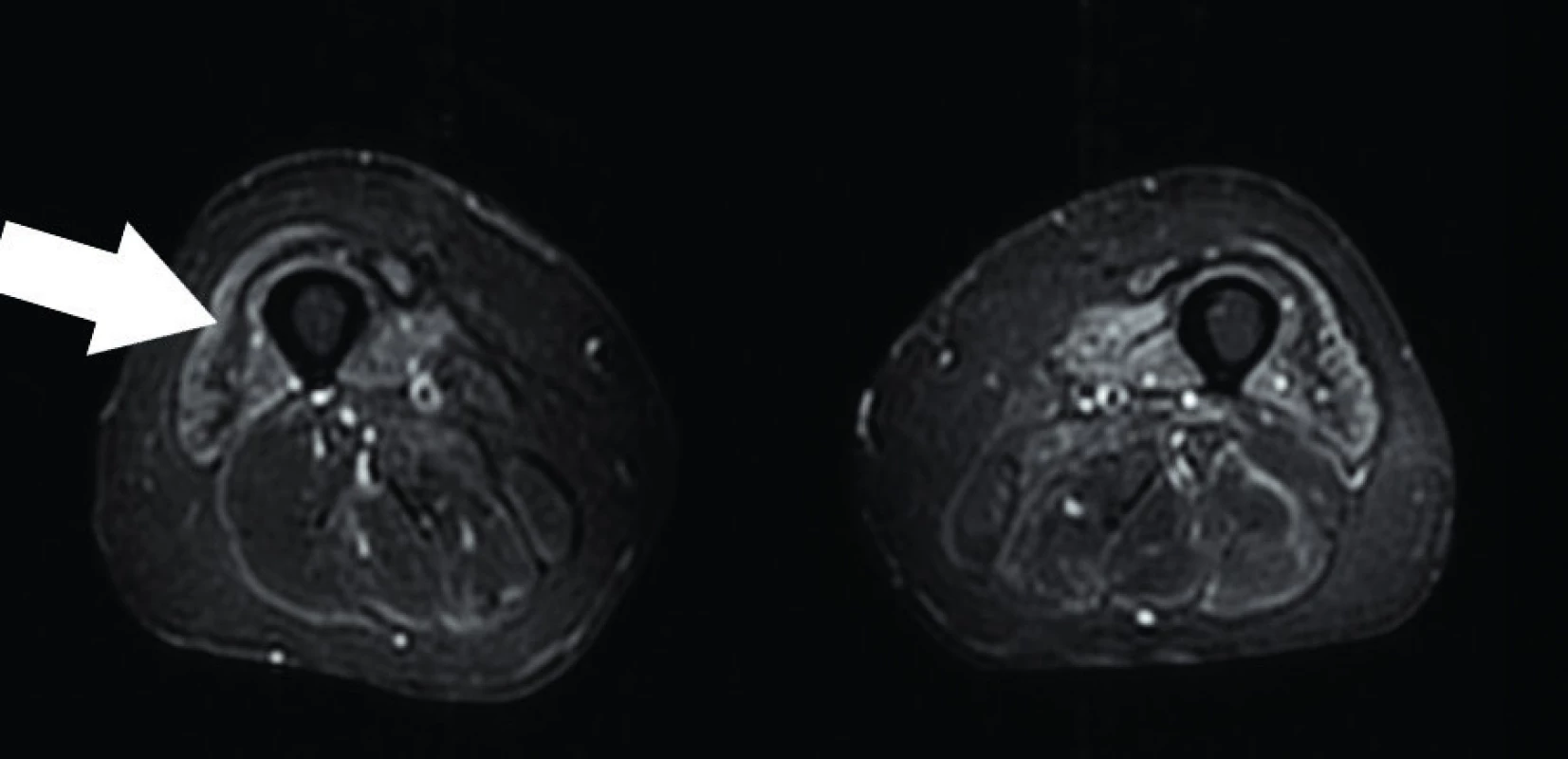
SHRNUTÍ
V současnosti patří vyšetření MR svalů nejpoužívanější a nejpřesnější dostupnou zobrazovací technikou k rozlišení přítomnosti zánětlivého edému a pozánětlivých změn. Přestože do většiny klasifikačních kritérií není výsledek magnetické rezonance zavzat, v diagnostickém procesu přináší nenahraditelné informace o morfologii postižené tkáně. Pro klinickou praxi je zcela zásadní posouzení tíže aktivního nebo chronického postižení nejenom z diagnostického hlediska, ale i pro zhodnocení efektu terapie a optimalizaci další terapeutické strategie. Nález MR zároveň může pomoci k výběru optimálního místa provedení výtěžné svalové biopsie a tím ke zpřesnění diagnózy.
Zásadním problémem provádění MR vyšetření svalů je absence standardizace hodnocení nálezů. Z uvedeného přehledu publikované literatury vyplývá, že nejkonfrontovanější vyšetřovací oblastí jsou stehenní svaly, a hodnocení se nejčastěji zaměřuje na posouzení tří základních aspektů: svalového edému; atrofie a tukové přestavby; přítomnost fasciitidy. V průběhu let bylo navrženo několik skórovacích systémů, které byly testovány na různých skupinách pacientů a lišily se v mnoha parametrech (počet hodnocených svalů, stupnice hodnocení, hodnocené jevy), což je činí vzájemně neporovnatelnými. V současné době se vyvíjí mezinárodní iniciativa s cílem vyvinout jednoduchý, reprodukovatelný a časově únosný hodnotící systém nálezů MR, který by byl v klinické praxi snadno použitelný. Do této iniciativy se zapojuje i tým zaštiťující český myozitický registr.
Práce v oblasti idiopatických zánětlivých myopatií je podporována projektem Ministerstva zdravotnictví ČR Koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav).
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Kateřina Kubínová
Revmatologický ústav, Praha
Revmatologická klinika 1. LF UK, Praha
Na Slupi 4, 128 50 Praha 2
e-mail: kubinova@revma.cz
Sources
1. Vencovský J. Diferenciální diagnostika a léčba idiopatických zánětlivých myopatií. Inter Med 2005; 11(03): 480–483.
2. Bohan A, Peter JB. Polymyositis and dermatomyositis (first of two parts). N Engl J Med 1975; 292(7): 344–347.
3. Bohan A, Peter JB. Polymyositis and dermatomyositis (second of two parts). N Engl J Med 1975; 292(8): 403–407.
4. Griggs RC, Askanas V, DiMauro S, Engel A, Karpati G, Mendell JR, et al. Inclusion body myositis and myopathies. Ann Neurol 1995; 38(5): 705–713.
5. Sontheimer RD. Dermatomyositis: an overview of recent progress with emphasis on dermatological aspects. Dermatol Clin 2002; 20(3): 387–408.
6. Bailey EE, Fiorentino DF. Amyopathic dermatomyositis: definitions, diagnosis, and management. Curr Rheumatol Rep 2014; 16(12): 465.
7. Machado P, Brady S, Hanna MG. Update in inclusion body myositis. Curr Opin Rheumatol 2013; 25(6): 763–771.
8. Needham M, Mastaglia FL. Inclusion body myositis: current pathogenetic concepts and diagnostic and therapeutic approaches. Lancet Neurol 2007; 6(7): 620–631.
9. Troyanov Y, Targoff IN, Tremblay JL, Goulet JR, Raymond Y, Senecal JL. Novel classification of idiopathic inflammatory myopathies based on overlap syndrome features and autoantibodies: analysis of 100 French Canadian patients. Medicine 2005; 84(4): 231–249.
10. Mariampillai K, Granger B, Amelin D, Guiguet M, Hachulla E, Maurier F, et al. Development of a New Classification System for Idiopathic Inflammatory Myopathies Based on Clinical Manifestations and Myositis-Specific Autoantibodies. JAMA Neurology 2018; 75(12): 1528–1537.
11. Katzap E, Barilla-LaBarca ML, Marder G. Antisynthetase syndrome. Curr Rheumatol Rep 2011; 13(3): 175–181.
12. Vencovský J. Polymyozitida. Interní Med 2015; 17(3): 141–146.
13. Mandel DE, Malemud CJ, Askari AD. Idiopathic inflammatory myopathies: A review of the classification and impact of pathogenesis. Int J Mol Sci 2017; 18(5).
14. Zámečník J. Svalová biopsie v deseti bodech. Cesk Slov Neurol N 2018; 81(3): 358–361.
15. Tomasova Studynkova J, Charvat F, Jarosova K, Vencovsky J. The role of MRI in the assessment of polymyositis and dermatomyositis. Rheumatology 2007; 46(7): 1174–1179.
16. Lampa J, Nennesmo I, Einarsdottir H, Lundberg I. MRI guided muscle biopsy confirmed polymyositis diagnosis in a patient with interstitial lung disease. Ann Rheum Dis 2001; 60(4): 423–426.
17. Theodorou DJ, Theodorou SJ, Kakitsubata Y. Skeletal muscle disease: patterns of MRI appearances. Br J Radiol 2012; 85(1020): e1298–1308.
18. Tanimoto K, Nakano K, Kano S, Mori S, Ueki H, Nishitani H, et al. Classification criteria for polymyositis and dermatomyositis. J Rheumatol 1995; 22(4): 668–674.
19. Targoff IN, Miller FW, Medsger TA, Jr., Oddis CV. Classification criteria for the idiopathic inflammatory myopathies. Curr Opin Rheumatol 1997; 9(6): 527–535.
20. Dalakas MC. Polymyositis, dermatomyositis and inclusion-body myositis. N Engl J Med 1991; 325(21): 1487–1498.
21. Allenbach Y, Mammen AL, Benveniste O, Stenzel W, Immune-Mediated Necrotizing Myopathies Working G. 224th ENMC International Workshop: Clinico-sero-pathological classification of immune-mediated necrotizing myopathies Zandvoort, The Netherlands, 14–16 October 2016. Neuromuscular disorders 2018; 28(1): 87–99.
22. Lundberg IE, Tjarnlund A, Bottai M, Werth VP, Pilkington C, Visser M, et al. 2017 European League Against Rheumatism/American College of Rheumatology classification criteria for adult and juvenile idiopathic inflammatory myopathies and their major subgroups. Ann Rheum Dis 2017; 76(12): 1955–1964.
23. Leclair V, Lundberg IE. New Myositis Classification Criteria-What We Have Learned Since Bohan and Peter. Curr Rheumatol Rep 2018; 20(4): 18.
24. Charvát FVJ, Jarošová K, Gatterová J, Šedová L, Lacman J. Magnetická rezonance (MR) u revmatických chorob. Čes. Revmatol. 1999; 1 : 13.
25. May DA, Disler DG, Jones EA, Balkissoon AA, Manaster BJ. Abnormal signal intensity in skeletal muscle at MR imaging: patterns, pearls, and pitfalls. Radiographics: a review publication of the Radiological Society of North America, Inc. 2000; 20(Spec No): S295–S315.
26. Day J, Patel S, Limaye V. The role of magnetic resonance imaging techniques in evaluation and management of the idiopathic inflammatory myopathies. Seminars in arthritis and rheumatism 2017; 46(5): 642–649.
27. Davis WR, Halls JE, Offiah AC, Pilkington C, Owens CM, Rosendahl K. Assessment of active inflammation in juvenile dermatomyositis: a novel magnetic resonance imaging-based scoring system. Rheumatology 2011; 50(12): 2237–2244.
28. Kubinova K, Mann H, Vencovsky J. MRI scoring methods used in evaluation of muscle involvement in patients with idiopathic inflammatory myopathies. Curr Opin Rheumatol 2017; 29(6): 623–631.
29. Malattia C, Damasio MB, Madeo A, Pistorio A, Providenti A, Pederzoli S, et al. Whole-body MRI in the assessment of disease activity in juvenile dermatomyositis. Ann Rheum Dis 2014; 73(6): 1083–1090.
30. Zheng Y, Liu L, Wang L, Xiao J, Wang Z, Lv H, et al. Magnetic resonance imaging changes of thigh muscles in myopathy with antibodies to signal recognition particle. Rheumatology 2015; 54(6): 1017–1024.
31. Stramare R, Beltrame V, Dal Borgo R, Gallimberti L, Frigo AC, Pegoraro E, et al. MRI in the assessment of muscular pathology: a comparison between limb-girdle muscular dystrophies, hyaline body myopathies and myotonic dystrophies. La Radiologia medica 2010; 115(4): 585–599.
32. Mercuri E, Pichiecchio A, Allsop J, Messina S, Pane M, Muntoni F. Muscle MRI in inherited neuromuscular disorders: past, present, and future. J Magn Reson Imaging 2007; 25(2): 433–440.
33. Cox FM, Reijnierse M, van Rijswijk CS, Wintzen AR, Verschuuren JJ, Badrising UA. Magnetic resonance imaging of skeletal muscles in sporadic inclusion body myositis. Rheumatology 2011; 50(6): 1153–1161.
34. Andersson H, Kirkhus E, Garen T, Walle-Hansen R, Merckoll E, Molberg O. Comparative analyses of muscle MRI and muscular function in anti-synthetase syndrome patients and matched controls: a cross-sectional study. Arthritis research & therapy 2017; 19(1): 17.
35. Goutallier D, Postel JM, Gleyze P, Leguilloux P, Van Driessche S. Influence of cuff muscle fatty degeneration on anatomic and functional outcomes after simple suture of full-thickness tears. J Shoulder Elbow Surg 2003; 12(6): 550–554.
36. Pipitone N, Notarnicola A, Levrini G, Spaggiari L, Scardapane A, Iannone F, et al. Do dermatomyositis and polymyositis affect similar thigh muscles? A comparative MRI-based study. Clin Exp Rheumatol 2016; 34(6): 1098–1100.
37. Barsotti S, Zampa V, Talarico R, Minichilli F, Ortori S, Iacopetti V, et al. Thigh magnetic resonance imaging for the evaluation of disease activity in patients with idiopathic inflammatory myopathies followed in a single center. Muscle & Nerve 2016; 54(4): 666–672.
38. Pinal-Fernandez I, Casal-Dominguez M, Carrino JA, Lahouti AH, Basharat P, Albayda J, et al. Thigh muscle MRI in immune-mediated necrotising myopathy: extensive oedema, early muscle damage and role of anti-SRP autoantibodies as a marker of severity. Ann Rheum Dis 2017; 76(4): 681–687.
39. Filli L, Maurer B, Manoliu A, Andreisek G, Guggenberger R. Whole-body MRI in adult inflammatory myopathies: Do we need imaging of the trunk? Eur Radiol 2015; 25(12): 3499–3507.
40. Huang ZG, Gao BX, Chen H, Yang MX, Chen XL, Yan R, et al. An efficacy analysis of whole-body magnetic resonance imaging in the diagnosis and follow-up of polymyositis and dermatomyositis. PloS One 2017; 12(7): e0181069.
41. Yao L, Yip AL, Shrader JA, Mesdaghinia S, Volochayev R, Jansen AV, et al. Magnetic resonance measurement of muscle T2, fat-corrected T2 and fat fraction in the assessment of idiopathic inflammatory myopathies. Rheumatology 2016; 55(3): 441–449.
42. Morrow JM, Sinclair CD, Fischmann A, Machado PM, Reilly MM, Yousry TA, et al. MRI biomarker assessment of neuromuscular disease progression: a prospective observational cohort study. Lancet Neurol 2016; 15(1): 65–77.
43. Dion E, Cherin P, Payan C, Fournet JC, Papo T, Maisonobe T, et al. Magnetic resonance imaging criteria for distinguishing between inclusion body myositis and polymyositis. J Rheumatol 2002; 29(9): 1897–1906.
44. Miranda SS, Alvarenga D, Rodrigues JC, Shinjo SK. Different aspects of magnetic resonance imaging of muscles between dermatomyositis and polymyositis. Revista Brasileira de Reumatologia 2014; 54(4): 295–300.
45. Cantwell C, Ryan M, O’Connell M, Cunningham P, Brennan D, Costigan D, et al. A comparison of inflammatory myopathies at whole-body turbo STIR MRI. Clin Radiol 2005; 60(2): 261–267.
46. Phillips BA, Cala LA, Thickbroom GW, Melsom A, Zilko PJ, Mastaglia FL. Patterns of muscle involvement in inclusion body myositis: clinical and magnetic resonance imaging study. Muscle & Nerve 2001; 24(11): 1526–1534.
47. Reimers CD, Schedel H, Fleckenstein JL, Nagele M, Witt TN, Pongratz DE, et al. Magnetic resonance imaging of skeletal muscles in idiopathic inflammatory myopathies of adults. J Neurol 1994; 241(5): 306–314.
48. Tasca G, Monforte M, De Fino C, Kley RA, Ricci E, Mirabella M. Magnetic resonance imaging pattern recognition in sporadic inclusion-body myositis. Muscle & Nerve 2015; 52(6): 956–962.
49. Elessawy SS, Abdelsalam EM, Abdel Razek E, Tharwat S. Whole-body MRI for full assessment and characterization of diffuse inflammatory myopathy. Acta Radiol Open 2016; 5(9): 2058460116668216.
50. Maillard SM, Jones R, Owens C, Pilkington C, Woo P, Wedderburn LR, et al. Quantitative assessment of MRI T2 relaxation time of thigh muscles in juvenile dermatomyositis. Rheumatology 2004; 43(5): 603–608.
51. Kubinova K, Dejthevaporn R, Mann H, Machado PM, Vencovsky J. The role of imaging in evaluating patients with idiopathic inflammatory myopathies. Clin Exp Rheumatol 2018; 36(Suppl 114/5): 74–81.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2020 Issue 1-
All articles in this issue
- Úvodník
- Doporučení České revmatologické společnosti 2020 k perioperační úpravě léčby zánětlivých revmatických onemocnění
- Optimalizace léčby methotrexátem při terapii revmatoidní artritidy
- Magnetická rezonance v diagnostice idiopatických zánětlivých myopatií
- Revmatoidní artritida a postižení ledvin
- Mezenchymální kmenové buňky: biologie a potenciál v léčbě systémových onemocnění pojiva
- Statiny indukovaná nekrotizující autoimunitní myopatie jako neobvyklá příčina extrémních hodnot kardiálních markerů u pacienta se svalovou slabostí a otoky
- Kongres American College of Rheumatology (ACR) 2019
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Revmatoidní artritida a postižení ledvin
- Doporučení České revmatologické společnosti 2020 k perioperační úpravě léčby zánětlivých revmatických onemocnění
- Magnetická rezonance v diagnostice idiopatických zánětlivých myopatií
- Optimalizace léčby methotrexátem při terapii revmatoidní artritidy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

