-
Medical journals
- Career
Standardy péče o pacienty s revmatoidní artritidou dle doporučení EULAR
Je nutné sdílet léčebná rozhodnutí s pacientem?
Authors: L. Šedová; J. Tomasová-Studýnková
Authors‘ workplace: Revmatologický ústav Praha
Published in: Čes. Revmatol., 27, 2019, No. 4, p. 211-217.
Category: Review Article
Overview
V roce 2014 publikovala Evropská liga proti revmatismu standardy péče pro pacienty s revmatoidní artritidou, které se mají implementovat ve všech zemích Evropské unie do roku 2020. Jejich cílem je zabezpečit srovnatelnou péči o muskuloskeletální zdraví založenou na důkazech. Jeden z hlavních předpokladů této standardní péče je sdílené rozhodování pacienta a lékaře o všech aspektech nemoci, což si vyžádá zevrubné informování nemocného. Tento článek se zabývá nejen 16 body standardů, ale i významem sdíleného rozhodování, což by mělo pacientovi pomoci pochopit charakter nemoci, zlepšit spolupráci s lékařem a udělat informované rozhodnutí.
Klíčová slova:
sdílené rozhodování – standardy péče – léčba k cíli – doporučení pro léčbu revmatoidní artritidy Summary
ÚVOD
Dlouhodobě se předpokládalo, že jen lékaři sami mohou správně rozhodovat o terapeutickém postupu při revmatických chorobách, protože mají k tomu potřebné vzdělaní, dokážou tak problémy identifikovat, charakterizovat a najít, i provést, nejlepší řešení. Tento předpoklad se opíral také o přesvědčení, že pacienti a lékaři mají stejná očekávání od léčby. V posledních letech však vznikla řada publikací poukazujících na to, že existuje výrazná diskrepance mezi očekáváním pacientů a cílem lékařů.
Např. F. Wolfe a K. Michaud ve své práci proká-zali (1):
- 53,3 % pacientů s revmatoidní artritidou (RA) nechce měnit stanovenou terapii, protože jsou spokojených se stávající aktivitou RA.
- 72,5 % si nepřeje riskovat nežádoucí účinky, které by mohly vzniknout v důsledku užívání nových léků.
- 68,1 % se obává, že nová léčba nemusí být tak účinná jako stávající, a že by proto mohli ztratit kontrolu nad chorobou.
- 66,3 % není přesvědčeno o tom, že jsou k dispozici lepší léky než ty, které používá.
- 35,7 % nemocných se bojí užívat léky v podkožních, nebo nitrožilních injekcích.
Tyto postoje však často neodpovídají aktivitě a funkčním stavu RA (1).
Publikace vydané převážně pacientskými organizacemi také naznačovaly, že některé oblasti zdraví, které jsou pro pacienty důležité, jsou lékaři podceňovány. Lékaři kladou při hodnocení stavu nemocných důraz především na jasné měřitelné parametry, jako jsou C-reaktivní protein, počet bolestivých a oteklých kloubů, rentgenové nálezy atd., zatímco pro pacienta jsou významnější únava, poruchy spánku, schopnost vykonávat činnosti denní potřeby, pracovní schopnost, ekonomický a společenský dopad nemoci na rodinu a ztráta nezávislosti (2–4).
Tato diskrepance mezi způsobem hodnocení choroby lékařem a pacientem vede k tomu, že léčba je pak nastavená převážně dle parametrů určených lékařem, neuspokojuje proto plně potřeby pacienta a ve svém důsledku může vést ke špatné adherenci k terapii, a tudíž i k její nedostatečné účinnosti. Compliance a adherence k terapii je přímo závislá na úrovni informovanosti pacienta a na dobré interakci a vztahu mezi pacientem a revmatologem (5).
Od začátku nového tisíciletí se proto postupně zvyšuje zájem o hodnocení revmatických onemocnění z pohledu pacienta, tzv. PROs (patient reported outcomes), a počet publikací na toto téma exponenciálně roste od 1211 v roce 1991 ke 22 345 v září roku 2019 (zdroj PubMed).
V roce 2010 publikovala Evropská liga proti revmatismu (EULAR – European League Against Rheumatism) doporučení pro léčbu revmatoidní artritidy, která obsahovala tři obecné principy a 15 doporučení týkajících se způsobu sledování a hodnocení aktivity a prognózy nemoci, očekávaných cílů léčby a konkrétních terapeutických postupů. Na druhém místě mezi obecnými principy (princip B) byla zmíněna nutnost „… usilovat o zajištění nejlepší péče o pacienty s RA na základě sdíleného rozhodování nemocného a ošetřujícího revmatologa“. Výraz sdílené rozhodování je rozebrán později v textu velmi podrobně a komplexně (6).
Pod pojmem sdílené rozhodování se rozumí, že cíle léčby a jejich zdůvodnění jsou stanoveny v úzké spolupráci s pacientem a je spolu s ním i sestaven plán jak těchto cílů dosáhnout a také způsob hodnocení účinnosti léčby.
Update doporučení EULAR z roku 2013 šel ještě dál a v obecných principech posunul dle důležitosti otázku sdíleného rozhodování z bodu B do bodu A. V tomto smyslu se zde uvádí, že je nutné informovat pacienta o účincích, ale i o rizicích léčby, a o výhodách dosažení cílů léčby RA (remise, nízká aktivita nemoci). Zdůrazňuje se zde potřeba vzájemného sdělování názorů mezi lékařem a pacientem na cíl léčby a na plán k jeho dosažení a je zde dán prostor pro pacientovy osobní preference (7).
V roce 2010 se také poprvé objevily publikace týkající se léčby k cíli u revmatoidní artritidy (treat to target – TTT) (8). Smyslem této strategie je zajištění optimální péče o nemocné s RA. Vztahuje se na nemocné léčené syntetickými i biologickými chorobu modifikujícími preparáty a je založena na pravidelném sledování aktivity onemocnění pomocí kompozitních indexů a na odpovídajících úpravách léčby. Prvním obecným principem TTT bylo již tehdy, že léčba RA má být založena na společném rozhodování pacienta a revmatologa, avšak poslední z deseti doporučení, které se týkalo právě tohoto principu, stavělo pacienta do pasivní role, protože zde bylo uvedeno, že pacient by měl být správně informován o cílech léčby a o plánu jak tohoto cíle dosáhnout pod vedením revmatologa.
O 5 let později byl zpracován update, který ukládá revmatologovi, aby zapojil pacienta s RA do procesu stanovení cílů léčby a strategie k jejich dosažení (9). Zapojení pacienta do diskuze a společné rozhodování o postupu léčby předpokládá ovšem, že pacient bude zejména revmatologem adekvátně informován nejen o charakteru choroby a její prognóze, ale i o rizicích léčby (či „neléčby“), což znamená o rizicích a přínosech jednotlivých preparátů. Toto umožní nemocnému udělat informované rozhodnutí a mělo by pomoci k lepší adherenci k terapii (2, 10–14).
Například dotazníková anketa ohledně ochoty zkusit redukci dávek biologické léčby, která zahrnula bezmála 4000 respondentů s RA z Nizozemí, dokazuje, že pacienti se staví k redukci dávek biologické léčby pozitivně, pokud jsou informováni. Pro pacienty je důležitá i jistota ohledně možnosti návratu k původnímu dávkování při eventuálním zhoršení funkce a bolesti. Neméně podstatný je pak pro ně i názor revmatologa (15).
Pro správné sdílené rozhodování je nutné probrat s nemocným nejen již zmíněné cíle léčby, konkrétní chorobu modifikující i adjuvantní terapii, hodnocení její účinnosti, charakter a prognózu nemoci, ale i komorbidity ovlivňující volbu léků, vlastní potřeby, očekávání a osobní pocity pacienta. Díky tomu lze dosáhnout lepší adherence, ale také zjednodušení budoucího rozhodování ohledně eventuální intenzifikace léčby. Ve zmíněném bodě 10 je také uvedeno, že informace podané pacientovi, způsob jeho zapojení do rozhodování, cíl léčby a mechanismy sledování účinnosti se mají řádně dokumentovat za účelem zavést srovnatelné standardy pro péči nemocných s RA ve všech evropských státech. Cennou pomůckou v tomto procesu by měla být pacientská verze doporučení pro léčbu RA publikovaná v roce 2011 (16).
Vypracování standardů péče (standards of care – SOC) bylo zadané Eumusc.net. Eumusc.net je projekt financovaný komisí Evropské unie a EULAR, jehož cílem je právě zavést ve všech zemích EU srovnatelné standardy pro péči o muskuloskeletální zdraví, které by byly srozumitelné nejen pro odborníky, ale i pro pacienty v celé Evropě. Jejich implementace by měla proběhnout co nejdříve, nejpozději však do roku 2020.
Standardy péče pro pacienty s RA publikovány v roce 2014 (17)
Tyto standardy obsahují 16 bodů k naplnění, ve kterých se uvádí:
- Pacienti s příznaky RA by se měli dostat k lékaři/nelékařským zdravotníkům ke stanovení diagnózy, eventuálně diferenciální diagnózy časně, tj. do 6 týdnů.
- Pacienti s RA by měli dostat relevantní informace a být poučeni o chorobě, jejím managementu a všech životních aspektech zvládání RA dle svých individuálních potřeb, a to písemně, na míru a včas.
- Měli by mít příležitost (pokud je to nutné):
- mít čas o svých problémech hovořit během návštěvy u lékaře z očí do očí
- získávat informace a možnost dále se vzdělávat během celého průběhu onemocnění
- diskutovat o svých nárocích na eventuální sociální, zdravotní či jinou podporu, a o tom kdy a kde o ni žádat
- získat ve správný čas radu a podporu ke zvládání self-managementu choroby
- diskutovat o citovém a psychickém dopadu nemoci na jejich život, např. v rámci roční kontroly
- diskutovat o pracovních problémech a získat pomoc při rozhodování o setrvávání v práci, nebo návratu do ní po pracovní neschopnosti
- Měli by mít příležitost (pokud je to nutné):
- Pacienti s RA by měli dostat při každé návštěvě individuální plán léčby vytvořený ve spolupráci lékaře a pacienta.
- Léčebný plán by měl přinejmenším zahrnovat:
- diagnózu, fyzikální vyšetření a kontrolní hodnocení stavu
- posouzení příznaků a projevů nemoci a jejich důsledků: celkové zdraví, funkční stav, psychosociální aspekty, eventuálně potřeba léčby bolesti, profesní a pracovní problémy, rodinné vztahy, poruchy spánku, zvládání úzkosti a deprese, včetně eventuálního doporučení ergoterapie nebo sociálních služeb. V případě potřeby by měla být zapojena rodina a pečovatelská služba.
- cíle: definovány pacientem a zdravotníky společně
- komunikační plán: např. kontaktní údaje pro odbornou péči v případě zhoršení nemoci
- plán monitorování: celkové přezkoumání stavu by mělo být provedeno alespoň jednou ročně
- plán vzdělávání: přístup k individuálním vzdělávacím programům vytvořeným zdravotníky, prostředky ke zvýšení self-managementu a přístup k důvěryhodným zdrojům informací založených na důkazech (např. kontakt na pacientské organizace)
- Léčebný plán by měl přinejmenším zahrnovat:
- Na začátku každé specifické léčby RA by pacient měl být plně informován o očekávaných přínosech terapie, potenciálních rizicích choroby a o způsobech hodnocení klinického stavu a bezpečnostních otázek.
- Vyšetření klinického stavu a hodnocení bezpečnosti léčby by mělo obsahovat minimálně:
- hodnocení klinického stavu:
- aktivita onemocnění hodnocená komplexním indexem (DAS, CDAI nebo SDAI)
- funkční status (HAQ, pracovní status atd.)
- vyhodnocení strukturálního poškození při vstupním vyšetření na základě rtg nálezu (hodnoceno dostupným skórovacím systémem, nebo kontrola přítomnosti či nepřítomnost kloubního poškození). MR nebo ultrasonografie mohou poskytnout doplňující informace, ale neměly by však nahradit rtg.
- Na základě hodnocení klinického stavu by pacient společně s lékařem, eventuálně s dalšími zdravotníky měli vypracovat individuální společný terapeutický cíl, který by byl realistický a relevantní (remise, nízká aktivita) a měl by obsahovat konkrétní časový termín jeho naplnění.
- Posouzení komorbidit může vést ke změnám preferencí léčebných postupů, protože některé komorbidity mohou být rizikovými faktory pro vývoj specifických nežádoucích účinků, jako např. CHOPN s častějším vznikem infekcí. Jiné komorbidity, jako např. poškození funkce ledvin, si mohou vyžádat omezení dávky nebo být přímou kontraindikací některých preparátů. Vzhledem k imunosupresivní povaze většiny terapií RA a vysoké míře výskytu infekcí v této populaci je velmi důležité, aby bylo zkontrolováno očkování a pacient byl chráněn před infekčními chorobami v souladu s národními očkovacími programy.
- hodnocení klinického stavu:
- Vyšetření klinického stavu a hodnocení bezpečnosti léčby by mělo obsahovat minimálně:
- U pacientů s RA by měly být vyšetřeny příznaky, aktivita choroby, poškození tkání, komorbidity (včetně kardiovaskulárního rizika) a funkční schopnost v čase diagnózy a dále jednou ročně. Pokud není splněný cíl léčby, pak by se aktivita měla kontrolovat minimálně každý 3. měsíc, eventuálně častěji v případě významného zhoršení.
- V závislosti na aktivitě onemocnění, na léčbě a na pacientovi s diagnózou RA mohou být tyto intervaly v rozmezí od několika dnů nebo týdnů do několika měsíců.
- Pacienti v remisi by měli absolvovat celkové přešetření alespoň jednou ročně; pokud v remisi nejsou, měli by mít revmatologickou kontrolu nejpozději do 3 měsíců.
- Klinický cíl by měl být přehodnocen dle aktuální aktivity onemocnění.
- Bezpečnost léčby by měla být posuzována na podkladě kompletního laboratorního vyšetření, zhodnocení možných nežádoucích účinků, nových komorbidit, komplikací RA a úvaze o eventuální ochraně proti infekcím.
- Roční kontrola by navíc měla také zahrnovat:
- Hodnocení schopnosti pacienta zúčastnit se aktivit, které považuje za důležité, jeho pracovní schopnosti, funkčního stavu, kardiovaskulárního rizika a jiných zvláštních potřeb.
- Hodnocení progrese strukturálních změn především v prvních 2 letech, kdy může být tato rychlejší. Naopak při stabilní nízké aktivitě nebo remisi, je možné se domluvit na méně častých rtg kontrolách. Při plánování ortopedického zákroku je rtg povinné.
- Pravidelné kontroly vyžaduje také nefarmakologická léčba.
- V závislosti na aktivitě onemocnění, na léčbě a na pacientovi s diagnózou RA mohou být tyto intervaly v rozmezí od několika dnů nebo týdnů do několika měsíců.
- Pacienti s RA by měli mít rychlý přístup k péči kdykoliv při významném zhoršení choroby.
- Bez ohledu na pravidelný plán kontrol mohou lidé s RA potřebovat akutní kontrolu v nepředvídatelných časových intervalech; toto by mělo být zaručeno bez ohledu na termín další plánované návštěvy. Akutní návštěvy by do schématu dalších pravidelných kontrol neměly zasahovat.
- Hlášení nežádoucích účinků by nemělo být odkládáno do příští plánované návštěvy: proto by měl existovat zrychlený systém (telefonické hlášení atd.).
- Možnost akutní kontroly v případě vzplanutí nemoci.
- Doporučuje se udržovat pravidelné kontroly navzdory eventuálním vmezeřeným návštěvám, v opačném případě může dojít ke ztrátě cíle a některé důležité aspekty bezpečnosti mohou být podhodnoceny.
- Pacienti s RA by měli být léčeni chorobu modifikujícími léky (DMARD), jakmile je diagnóza stanovena.
- Pokud by kromě této léčby byly potřeba nasadit glukokortikoidy, měly by se podat v co nejnižší dávce a po co nejkratší dobu.
- Dokud není dosaženo nízké aktivity choroby nebo remise při klasické léčbě (většinou methotrexátem), hodnocení aktivity by se mělo opakovat nejméně jedenkrát za 3 měsíce.
- Pokud není prvním DMARD nebo první kombinací DMARDs dosaženo cíle léčby, mělo by byt zváženo přidání biologického DMARD, zejména pokud jsou přítomny negativní prognostické markery (tj. špatný funkční stav nebo přítomnost strukturálního poškození). Při absenci negativních prognostických faktorů lze zvážit přechod na jiný syntetický DMARD nebo přidání jiného syntetického DMARD do kombinace (jak je definováno příslušnými doporučeními).
- U nemocných s RA, kteří nemají prediktory závažného průběhu, lze použít jinou syntetickou monoterapii DMARD (nebo v kombinaci s methotrexátem).
- Pokud selhal biologický preparát, je indikován jiný inhibitor TNF, abatacept, rituximab nebo tocilizumab dle lokálních doporučení.
- U pacientů s RA na dlouhodobé remisi by měla být zvážena úprava dávky biologického preparátu a při dlouhodobé remisi pečlivá titrace dávky syntetického DMARD.
- U pacientů s RA měla být zhodnocena přítomnost bolesti asociovaná s tímto onemocněním a zvážena její terapie.
- Nesteroidní antirevmatika (NSA) by měla být zvažována u symptomatických pacientů s prokázanou RA a časnou artritidou po vyhodnocení gastrointestinálního, renálního a kardiovaskulárního rizika.
- U osob se zvýšeným rizikem gastrointestinální toxicity NSA by konvenční NSA měla být nahrazena selektivními COX-2 inhibitory, nebo do léčby přidány gastroprotektivní preparáty (dle příslušných pokynů).
- Analgetika by měla být předepisována, pokud jsou NSA kontraindikována nebo pokud NSA vykazují nedostatečnou úlevu od bolesti.
- Pacienti s RA, u kterých přes veškerou péči včetně intraartikulární aplikace glukokortikoidů a nefarmakologické léčby přetrvávají reziduální kloubní potíže, by měli být vyšetřeny ortopedem do 3 měsíců od konstatování refrakterní povahy problému.
- Mělo by se jim nabídnout předběžné posouzení stavu, informace o možném řešení, jeho rizicích a přínosech, o pooperační péči a nutné době hospitalizace.
- Pacienti s RA by měli mít přístup k farmakologické i nefarmakologické léčbě založené na důkazech.
- Měli by dostat informace o očekávaných účincích, výhodách a možných rizicích jakékoliv farmakologické nebo nefarmakologické léčby, kterou by mohli zahájit.
- Pacienti s RA by měli mít přístup ke specializovaným nelékařským oborům za účelem poradenství a školení ve všech otázkách souvisejících s jejich chorobou např.:
- povzbuzení k pravidelné fyzické činnosti
- poskytnutí odborné poradenství ohledně cvičení (aerobní a posilovací), specifické vzhledem k jejich kloubnímu postižení a adaptované na jejich celkový zdravotní stav
- poskytnutí informace o pozitivním účinku cvičení na celkové a kardiovaskulární zdraví, jakož i na udržení mobility a prevenci úbytku svalů
- poskytnutí informace a poučení o ochraně kloubů, přizpůsobené potřebám konkrétního pacienta
- posouzení eventuální potřeby dlah, poskytnout informace, aby pochopili a akceptovali tuto pomůcku, a předat kontakt ke zdravotnickému odborníkovi, který je poskytuje
- posouzení potřeby adaptace domácího a pracovního prostředí nejlépe prostřednictvím zkušené ergoterapeutické poradny
- poskytnutí odborné rady o zdravotnických pomůckách ke zlepšení nebo udržení schopnosti provádět činnosti každodenního života
- nabídnout vhodnou pomoc vzhledem k psychologickému a sociálnímu dopadu choroby
- pozornost je třeba věnovat problémům postižených nohou a informovat pacienty o správné péči o nohy, možném opotřebení nohou a o eventuálním používání ortéz či vložek
- Pacienti s RA by měli porozumět přínosu cvičení a fyzických aktivit a měli by být instruováni, jak je správně vykonávat.
- Pacienti s RA by měli obdržet informace, rady a školení o způsobech ochrany kloubů, ergonomických principech a cvičeních přispívajících k fungování v běžném denním životě a usnadňujících společenské uplatnění a také o pomůckách, prostředcích a jiných produktech k uzpůsobení okolního prostředí.
- Pacienti s RA by měli obdržet informace a rady o zdravém životním stylu, eventuální chirurgické léčbě, prevenci nehod a úrazů, dostupných pacientských organizacích a dalších možnostech léčby.
- Spolehlivé informace dle nejlepších aktuálních znalostí a založené na konkrétním stavu pacienta by měly zahrnovat materiály:
- o nutnosti ukončit užívání všech typů tabáku
- o střídmém užívání alkoholu
- o vhodné fyzické aktivitě
- o dietě – rady ohledně:
- vyvážené stravy za účelem kontroly hmotnosti a vhodném doplnění vitaminů a minerálů, a to přesto, že v současné době chybí vědecké důkazy o dopadu takových opatření na aktivitu a průběh nemocí
- vyhýbání se dietám s nízkým obsahem vápníku
- vhodnosti středomořské stravě (zvláště ryb)
- vhodnosti doplnění minerálů, vitaminů C a D, vápníku, rybího oleje a podávání kyseliny listové; při užívání methotrexátu o nutnosti kyseliny listové
- o spánku: včasné zvládnutí poruch spánku jako faktoru zvyšujícího kvalitu života
- Spolehlivé informace dle nejlepších aktuálních znalostí a založené na konkrétním stavu pacienta by měly zahrnovat materiály:
- Pacienti s RA, kteří si přejí zkusit alternativní druhy léčby (některými považovány za symptomaticky přínosné), by měli být informováni o její omezené evidenci.
Současně byl vytvořen odpovídajícím a srozumitelným způsobem formulovaný kontrolní dotazník, aby se ověřila implementace těchto doporučení do praxe.
Kontrolní dotazník obsahuje otázky týkajících se např. intervalu mezi prvními příznaky a diagnózou, o tom, jak a jestli vůbec byl pacient informován o diagnóze, cílech léčby, způsobu hodnocení aktivity, kontaktech při relapsu, zvládání situací vyvolaných chorobou atd., aby zahrnul všechna uvedena doporučení.
DISKUZE
Snaha o co nejkvalitnější péči o pacienty s revmatoidní artritidou je stále větší a terapeutické možnosti jsou stále lepší. Od doby vzniku těchto doporučení EULAR přibyly další preparáty v terapii RA, např. inhibitory Janus kinázy. Farmaceutických prostředků k léčbě máme tedy dostatek. Nyní je proto nutné spíše soustředit svou snahu na změnu přístupu k pacientům a změnu přístupu pacientů k léčbě, což si vyžádá i nové speciální vzdělávací programy pro revmatology i pro nemocné.
Jasnými cíli léčby jsou remise nebo nízká aktivita choroby. Jejich definice a stanovení však v praxi přináší určitá úskalí. K jejich hodnocení se používají různé indexy obsahující odlišné parametry (tab. 1–3).
Table 1. Aktivita revmatoidní artritidy dle nejčastěji používaných kompozitních indexů 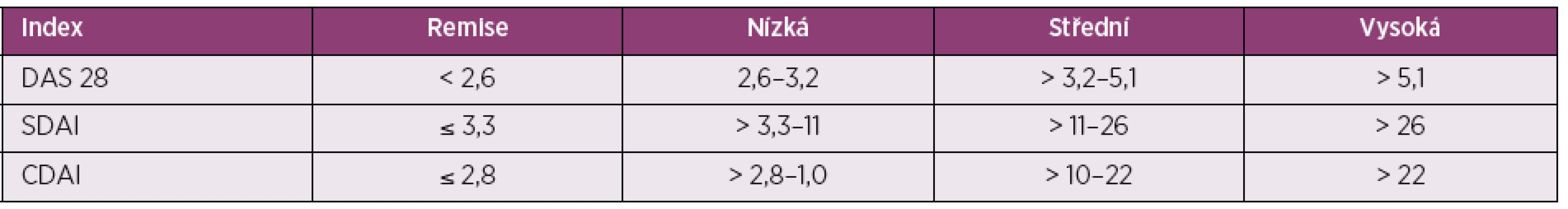
DAS 28 – disease activity score zahrnující všechny klouby horních končetin kromě distálních interfalangeálních a z dolních končetin pouze kolena, SDAI – simplified disease activity index, CDAI – clinical disease activity index Table 2. Porovnání parametrů kompozitních indexů 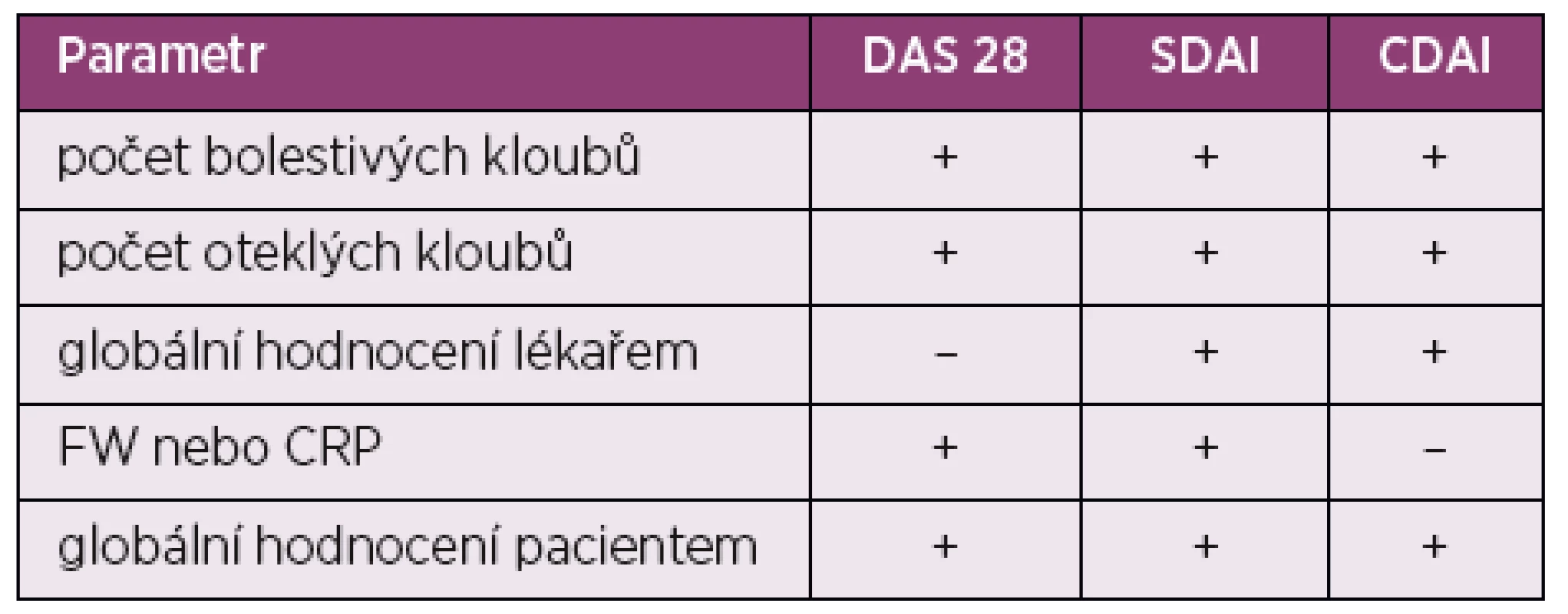
Table 3. Booleovská definice remise RA dle ACR/EULAR 
* Hodnocení pouze 28 kloubů může vynechat aktivně postižené klouby, především nohy a kotníky, a doporučuje se hodnotit i tyto klouby, pokud se hodnotí počet bolestivých a oteklých kloubů k posouzení remise. V běžné klinické praxi je dosaženo remise cca jen ve 40 % případů a je otázkou, jestli je to proto, že léčba není dostatečně účinná, nebo proto, že existují překážky k naplnění cílů léčby jak ze strany lékařů, tak pacientů. Strategie léčby k cíli se zaměřuje mimo jiné právě na to, aby byl pacient dostatečně informován o cílech terapie a snažil se jich dosáhnout.
Pokud by se měla splnit doporučení EULAR pro léčbu revmatoidní artritidy v jejich prvním všeobecném principu o sdíleném rozhodování, je třeba již nyní urychleně zavést do praxe metodologii standardů pro péči o pacienty s RA publikovanou v roce 2014, která má být používaná od roku 2020.
Výsledky celostátní studie provedené v Belgii, v roce 2016, tj. 2 roky po vydání těchto standardů, zdůrazňují, že stále v přibližně 50 % zaznamenaných případů se významně liší názor pacientů a revmatologů v souvislosti s kontrolou onemocnění a stupněm spokojenosti s cestou podávání biologické léčby RA (18).
Znamená to ovšem vypracovat systém umožňující v krátkém, plátcem vyhraněném čase pro kontrolu pacienta s RA, zevrubně a srozumitelně seznamovat nemocné se širokou problematikou tohoto onemocnění, jejího dopadu na fyzické i mentální zdraví a možnosti její léčby.
Konflikt zájmů: žádný.
MUDr. Liliana Šedová
Revmatologický ústav
Na Slupi 4, 128 50 Praha 2
e-mail: sedova@revma.cz
Sources
1. Wolfe F, Michaud K. Resistance of rheumatoid arthritis patients to changing therapy: discordance between disease activity and patients’ treatment choices. Arthritis Rheum 2007; 56 : 2135–2142.
2. Kvien TK, Heiberg T. Patient perspective in outcome assessments-perceptions or something more? J Rheumatol 2003; 30 : 873–876.
3. Kirwan JR, Fries JF, Hewlett S, Osborne SH. Patient Perspective: Choosing or Developing Instruments. J Rheumatol 2011; 38(8): 1716–1719. doi: https://doi.org/10.3899/jrheum.110390
4. Hewlett SA. Patients and clinicians have different perspectives on outcomes in arthritis. J Rheumatol 2003; 30 : 877–879.
5. Viller F, Guillemin F, Briançon S, Moum T, Suurmeijer T, van den Heuvel W. Compliance to drug treatment of patients with rheumatoid arthritis: a 3-year longitudinal study. J Rheumatol 1999; 26 : 2114–2122.
6. Smolen J, Landewé R, Breedveld F, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease–modifying antirheumatic drugs. Ann Rheum Dis 2010; 69 : 964–975.
7. Smolen J, Landewé R, Breedveld F, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis 2014; 73 : 492–509.
8. Smolen JS, Aletaha D, Bijlsma JWJ, et al. Treating rheumatoid arthritis to target: recommendations of an international task force. Ann Rheum Dis 2010; 69 : 631–637.
9. Smolen JS, Breedveld FC, Burmester GR, et al. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force Ann Rheum Dis 2016; 75 : 3–15.
10. Kobue B, Moch S, Watermeyer J. It’s so hard taking pills when you don’t know what they’re for: a qualitative study of patients’ medicine taking behaviors and conceptualization of medicines in the context of rheumatoid arthritis. BMC Health Serv Res 2017; 26(17): 303.
11. Wabe N, Wiese MD. Treating rheumatoid arthritis to target: physician and patient adherence issues in contemporary rheumatoid arthritis therapy. J Eval Clin Pract 2017; 23 : 486–493.
12. Fraenkel L, Peters E, Charpentier P, et al. Decision tool to improve the quality of care in rheumatoid arthritis. Arthritis Care Res (Hoboken) 2012; 64 : 977–985.
13. Barton JL, Imboden J, Graf J, Glidden D, Yelin EH, Schillinger D. Patient-physician discordance in assessments of global disease severity in rheumatoid arthritis. Arthritis Care Res 2010; 62 : 857–864.
14. Smolen JS, Strand V, Koenig AS, Szumski A, Kotak S, Jones TV. Discordance between patient and physician assessments of global disease activity in rheumatoid arthritis and association with work productivity. Arthritis Research & Therapy 2016; 18 : 114.
15. Verhoef LM, Selten EMH, Vriezekolk JE, et al. The patient perspective on biologic DMARD dose reduction in rheumatoid arthritis: a mixed methods study. Rheumatology 2018; 57 : 1947–1955.
16. de Wit MP, Smolen JS, Gossec L, van der Heijde DM. Treating rheumatoid arthritis to target: the patient version of the international recommendations. Ann Rheum Dis 2011; 70 : 891–895.
17. Stoffer MA, Smolen JS, Woolf A, et. al. Development of patient-centred standards of care for rheumatoid arthritis in Europe: the eumusc.net project. Ann Rheum Dis 2014; 73 : 902–905.
18. De Mits S, Lenaerts J, Vander Cruyssen B. A Nationwide survey on patient’s versus physician’s evaluation of biological therapy in rheumatoid arthritis in relation to disease activity and route of administration: The Be-Raise Study. PLoS One 2016; 11(11): e0166607. doi: 10.1371/journal.pone.0166607. eCollection 2016.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2019 Issue 4-
All articles in this issue
- Doporučení České revmatologické společnosti pro léčbu dny
- Závažnost zánětlivých granulomů u revmatických chorob
- Paraneoplastické syndromy
- Muskuloskeletální postižení u pacientů s lyzozomálním střádavým onemocněním
-
Standardy péče o pacienty s revmatoidní artritidou dle doporučení EULAR
Je nutné sdílet léčebná rozhodnutí s pacientem? - Význam dosažení remise u pacientů s revmatoidní artritidou
- Zemřel prof. MUDr. Robert Bardfeld, DrSc. (10. června 1925 – 20. října 2019)
- XVII. seminář mladých revmatologů
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Paraneoplastické syndromy
- Doporučení České revmatologické společnosti pro léčbu dny
- Závažnost zánětlivých granulomů u revmatických chorob
- Význam dosažení remise u pacientů s revmatoidní artritidou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

