-
Medical journals
- Career
Ateroskleróza a kardiovaskulární riziko u pacientů se systémovou sklerodermií
Authors: S. Oreská 1,2; H. Štorkánová 1,2; M. Špiritović 1,3; M. Tomčík 1,2
Authors‘ workplace: Revmatologický ústav, Praha 1; Revmatologická klinika, 1. lékařská fakulta, Univerzita Karlova, Praha 2; Katedra fyzioterapie, Fakulta tělesné výchovy a sportu, Univerzita Karlova, Praha 3
Published in: Čes. Revmatol., 25, 2017, No. 4, p. 172-183.
Category: Review Article
Overview
Ateroskleróza byla dříve považována za degenerativní onemocnění velkých a středních arterií spojené s pasivním ukládáním cholesterolových částic ve stěnách cév. V posledních letech se prokázalo, že významnou roli v patogenezi aterosklerózy hraje imunitní systém. Předpoklad závažnějšího a progresivnějšího vývoje aterosklerózy u chronických zánětlivých onemocnění byl potvrzen zejména u revmatoidní artritidy a systémového lupus erythematodes. Existuje pouze několik studií, které hodnotí prevalenci aterosklerózy a kardiovaskulárního rizika u pacientů se systémovou sklerodermií. Výsledky těchto studií jsou však rozdílné a v mnohém si protiřečí. Mimo jiné je obtížné odlišit vaskulární postižení způsobené primárně patogenezí systémové sklerodermie či sekundárně aterosklerotickým procesem. Většina studií nicméně potvrzuje častější výskyt aterosklerózy a jejích klinických manifestací u pacientů se sklerodermií oproti běžné populaci. Je však zapotřebí dalších studií hodnotících větší kohorty pacientů, které by určily význam aterosklerózy u sklerodermie a zároveň by tak umožnily vytvořit doporučení pro sledování a terapii kardiovaskulárního rizika u tohoto onemocnění.
Klíčová slova:
Ateroskleróza, kardiovaskulární riziko, systémová sklerodermieÚvod
Ateroskleróza (ATS) je chronický proces postihující střední a velké arterie, který je celosvětově vedoucí příčinou morbidity a mortality (1). Jedná se o komplexní onemocnění charakterizované kombinací změn vnitřní vrstvy stěny arterií (intimy) a imunitní reakce na poškození endoteliální tkáně (2).
Akcelerovaná ATS je spolu se zvýšenou kardiovaskulární morbiditou a mortalitou známou komplikací mnoha systémových zánětlivých onemocnění (3). Časnou ATS zde nelze vysvětlit pouze přítomností tzv. tradičních rizikových faktorů (4). Svůj podíl na urychlení aterosklerotického procesu mají i systémový zánět a některé léky s proaterogenními účinky (tab. 1) (3, 5). Vysoká aktivita imunitního systému vede k předčasnému vzniku ATS, přispívá k rychlejší tvorbě plátů a dřívější klinické manifestaci (4, 6).
Table 1. Rizikové faktory pro aterosklerózu a kardiovaskulární onemocnění. 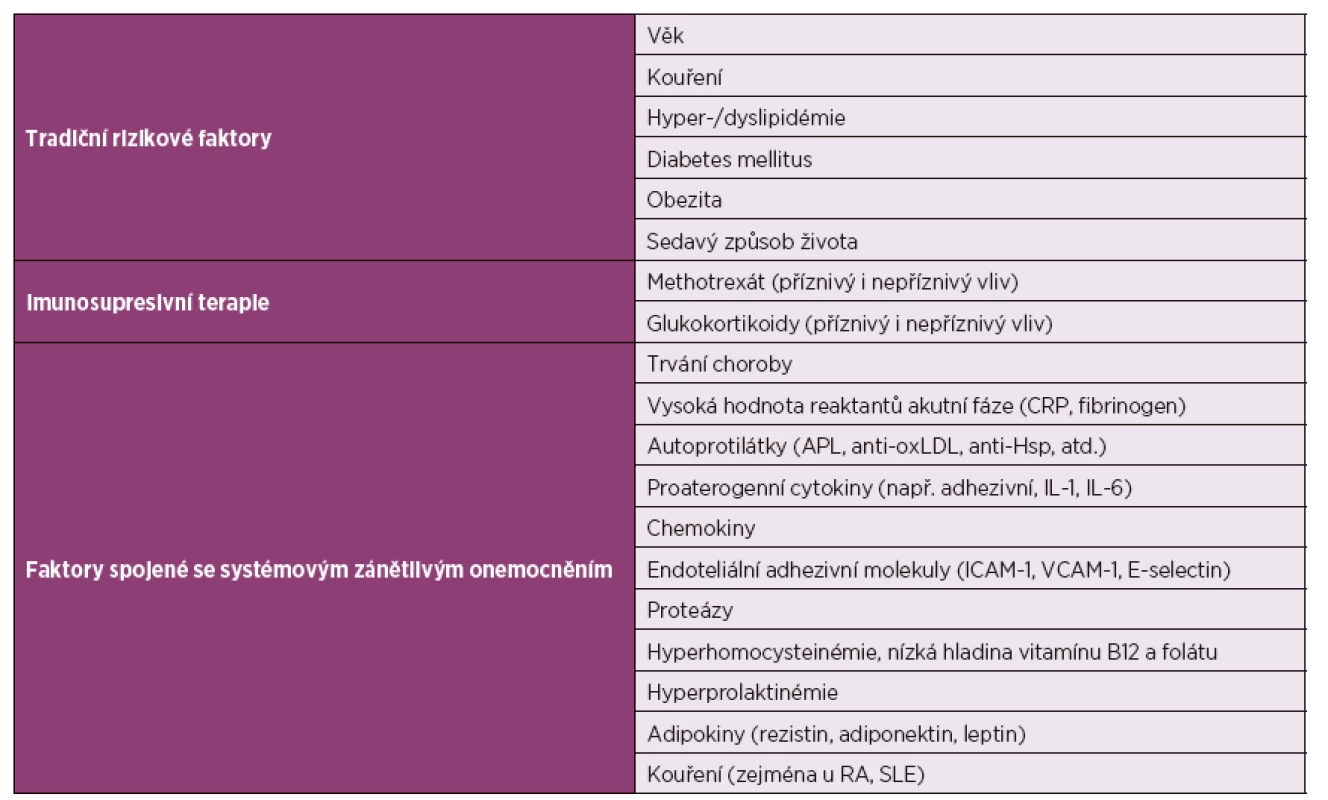
CRP – C-reaktivní protein; APL – antifosfolipidové protilátky; anti-oxLDL – protilátky proti oxidovaným lipoproteinům s nízkou denzitou (anti-oxidised low-density lipoprotein antibodies); anti-Hsp – protilátky proti proteinu tepelného šoku (anti-heat shock protein antibodies); TNF- tumor nekrotizující faktor (tumour necrosis factor); IL-1 – interleukin-1; IL-6 – interleukin-6; ICAM-1 – mezibuněčná adhezní molekula (intercellular adhesion molecule-1); VCAM-1 – vaskulární adhezivní molekula (vascular cell adhesion molecule-1); RA – revmatoidní artritida; SLE – systémový lupus erythematodes. (Upraveno podle: Soltész et al., 2011.) Současné poznatky naznačují, že proces časné akcelerované ATS se uplatňuje také u systémové sklerodermie (SSc). Zatímco u revmatoidní artritidy (RA) a systémového lupus erythematodes (SLE) se objevuje klasická akcelerovaná ATS, pro SSc je charakteristická spíše obliterativní vaskulopatie (tab. 2) (5, 7).
Table 2. Rozdílné cévní patologie u jednotlivých autoimunitních onemocnění. 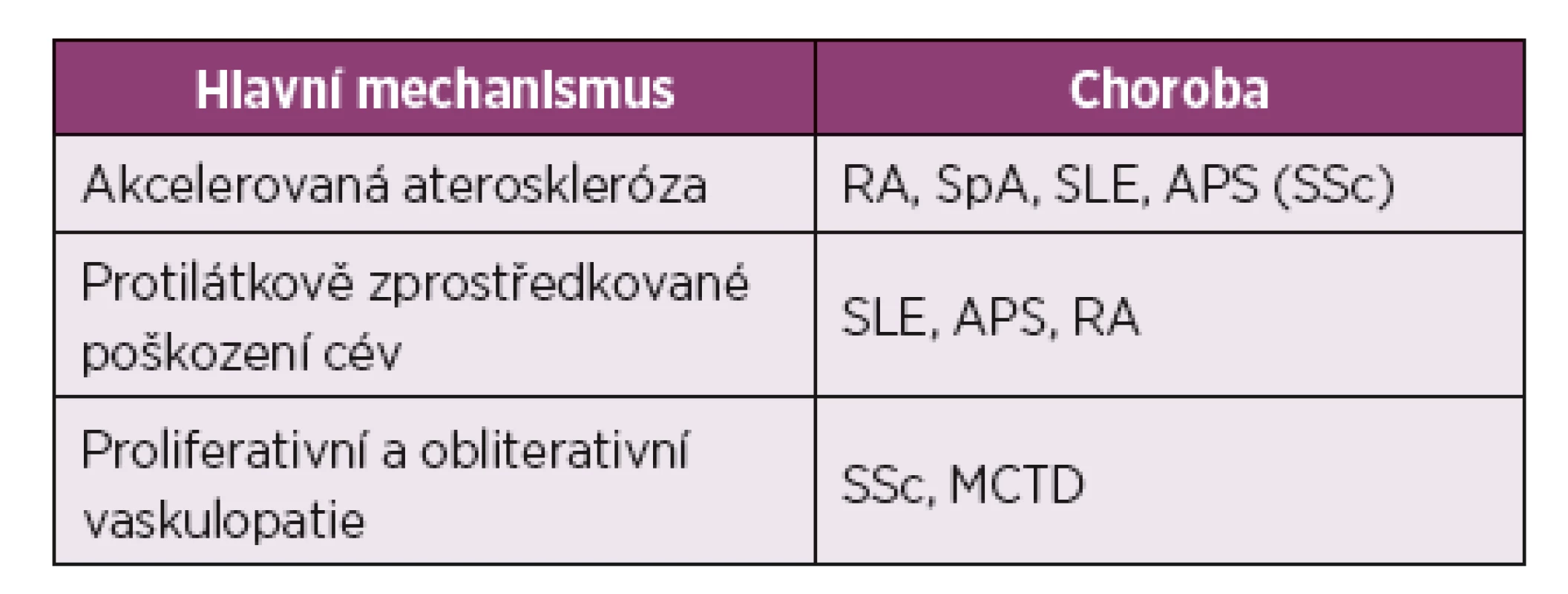
RA, revmatoidní artritida; SpA, spondyloartritida; SLE, systémový lupus erythematodes; APS, antifosfolipidový syndrom; SSc, systémová sklerodermie; MCTD, smíšené onemocnění pojiva (mixed connective tissue disease). (Upraveno podle: Soltész et al., 2011) Díky pokrokům v terapii život ohrožujících komplikací, sklerodermické renální krize (SRC) a plicní arteriální hypertenze (PAH), vystoupily do popředí nové příčiny úmrtí a zároveň vzrostla prevalence ATS u SSc (8). Dle epidemiologických studií přispívají kardiovaskulární příčiny u pacientů se SSc až k jedné třetině úmrtí, které nejsou způsobené patogenezí samotné choroby. Mimoto pacienti se SSc umírají na kardiovaskulární komplikace přibližně o deset let dříve než běžná populace (9).
V posledních letech byla u ATS popsána řada nových biomarkerů, u nichž však dosud nebyl prokázán jednoznačný význam. Nové neinvazivní metody hodnocení subklinického aterosklerotického postižení (zmíněné dále) jsou, co se týče preventivního vyšetření, využívány spíše experimentálně vzhledem k jejich ekonomické nákladnosti (10).
Ateroskleróza u SSc
Systémová sklerodermie je autoimunitní onemocnění charakterizované dysregulací imunitního systému, přítomností cirkulujících protilátek a prozánětlivých cytokinů, vaskulopatií s patognomickým postižením mikrocirkulace a fibrózou kůže a viscerálních orgánů (11).
Etiologie ATS u SSc není dosud zcela známá. Působí zde souběžně více faktorů: tradiční rizikové faktory (hypertenze, dyslipidémie, obezita, diabetes mellitus, kouření), výraznější poškození endotelu, zánětlivé mediátory (např. tumor nekrotizující faktor (TNF), intereukin-6 (IL-6) a C-reaktivní protein (CRP)) a další specifické imunitní faktory, které přispívají ke vzniku i k progresi ATS (3, 12, 13).
Aktivita chronického zánětu je u SSc většinou menší než u RA či SLE, proto se předpokládá, že aterosklerotický proces u SSc není tak agresivní. Na druhou stranu ve studiích zahrnujících většinou malé kohorty pacientů se SSc nemusí být ATS dostatečně detekována (14).
Prevalence aterosklerózy u SSc
Mortalita u pacientů se SSc je přibližně trojnásobná oproti běžné populaci s významným podílem kardiopulmonálních komplikací, včetně PAH a intersticiální plicní fibrózy (ILD) (15). Desetileté přežití u SSc se významně zlepšilo z 54 % (v 70. letech) na 66–88 % (v 80. letech až do současnosti), a to zejména díky časné diagnostice a terapii PAH a SRC. Do popředí se tak dostaly jiné komorbidity včetně ATS ovlivňující dlouhodobý průběh a prognózu SSc (16). Podstatně vzrostl zejména podíl úmrtí z kardio - či cerebrovaskulárních příčin, který v současnosti tvoří 20–30 % (14).
Zprávy o prevalenci ATS, postižení koronárního řečiště a cerebrovaskulárního onemocnění u SSc se však rozcházejí (17). Přesný odhad kardiálního postižení u SSc je obtížný kvůli asymptomatickému subklinickému onemocnění, širokému spektru klinických manifestací, různým diagnostickým metodám a rozdílům mezi populacemi pacientů zahrnutými ve studiích (10).
Rizikové faktory pro ATS u SSc
Existuje relativně málo dat o prevalenci tradičních rizikových faktorů u SSc. Většina studií včetně velké australské kohortové studie neprokázala u SSc častější obezitu, hyperlipidémii, hypertenzi ani diabetes mellitus (18–20). ATS a kardiovaskulární postižení je však u pacientů se SSc přítomno i při malém počtu tradičních rizikových faktorů. Kolem 15–20 % pacientů se SSc vykazuje rozličné vaskulární abnormity včetně kardiovaskulárního onemocnění, cévní mozkové příhody (CMP) a onemocnění periferních tepen. Proto se předpokládá, že na kardiovaskulárním postižení se u SSc podílejí navíc i jiné faktory (17, 18). Mezi ně patří: chronický zánět, zvýšené hladiny CRP a homocysteinu, přítomnost určitých protilátek, změny v lipidovém profilu či porucha funkce lipidů, terapie glukokortikoidy, vyšší věk pacientů a delší trvání choroby (21).Přítomna je také alterace a aktivace koagulační kaskády, narušení fibrinolytického systému (22) a zvýšená produkce adhezivních molekul (23–25).
Alteraci lipidového profilu u SSc provázejí zejména nízké hladiny HDL (lipoproteiny s vysokou denzitou) asociované s pozitivitou anticentromerových protilátek (ACA) (26) nebo zvýšené hladiny lipoproteinu (a) (LpA), které potencují prokoagulační stav svým vlivem na redukci fibrinolýzy (22, 27). U pacientů se SSc byla navíc detekována vyšší hladina prozánětlivé formy molekuly HDL, která na rozdíl od normálního HDL nedokáže zabránit tvorbě oxidovaných forem LDL (lipoproteiny s nízkou denzitou). Přítomnost prozánětlivého HDL tak značí vyšší riziko ATS (28). Zvýšené hladiny protilátek typu IgG proti lipoproteinové lipáze (anti-LPL), které lze nalézt až u 24 % pacientů se SSc, mohou způsobit elevaci triacylglycerolů (TAG) (29).
Hladina homocysteinu pozitivně koreluje s rozvojem makrovaskulárního postižení, PAH a se sníženou hladinou vitamínu B12. Popsána byla i potenciální role methyl-tetra-hydrofolát reduktázy (MTHFR) a polymorfismu jejího genu C677T (24).
Patogeneze a rizikové faktory ATS specifické pro SSc
Mikrovaskulární postižení je jeden z prvotních patologických mechanismů SSc, který předchází a také potenciálně přispívá k fibrotizaci vlivem ischemického poškození tkání. Je charakterizováno vazospazmem a strukturálními změnami cév. Jeho hlavní klinickou manifestací jsou Raynaudův fenomén (RF), PAH a SRC. Předpokládá se, že všechny tyto manifestace – RF, PAH i SRC mohou predikovat makrovaskulární aterosklerotické postižení (17, 30).
Patologické změny spočívají v narušení endotelu, infiltraci cévní stěny mononukleárními buňkami, obliteraci cév a v progredujícím úbytku kapilár. Endoteliální dysfunkce je komponentou jak SSc, tak ATS (30). Ústí v poruchu vazomotorické regulace provázenou změnou poměru vazoaktivních mediátorů, kdy převažují vazokonstrikční faktory – zejména endotelin, a ubývá produkce významného vazodilatátoru oxidu dusnatého (NO) (31). Porucha dilatace cév se objevuje již před klinickou manifestací ATS u SSc (21).
Poškození endotelu vede k nadměrné expresi i zvýšení počtu cirkulujících solubilních adhezivních molekul, jako jsou solubilní E-selektin, intercelulární adhezivní molekula-1 (intercellular adhesion molecule-1, ICAM-1) a vaskulární adhezivní molekula-1 (vascular cell adhesion molecule-1, VCAM-1), jejichž významně zvýšené hladiny u SSc odrážejí míru aktivace endotelu (32). Díky tomu dochází k navázání zánětlivých buněk, migraci přes cévní stěnu a infiltraci extracelulární matrix. Současně je přítomna zvýšená tendence destiček k agregaci (33). Následkem je obliterace cév a tkáňová hypoxie. Histopatologicky lze pozorovat proliferaci intimy, endoteliálních buněk a buněk hladké svaloviny, destrukci vnitřní elastické vrstvy cévní stěny (lamina interna) a transmurální infiltraci lymfocyty a plazmocyty (21, 34).
K patologickým mechanismům patří také narušená angiogeneze a funkční defekty progenitorů endotelových buněk (endothelial progenitor cells, EPCs) (35, 36). U pacientů se SSc je typicky redukovaná hustota kapilární sítě, ačkoli jsou detekovány zvýšené hladiny cirkulujících angiogenních faktorů, jako vaskulární endoteliální růstový faktor (vascular endothelial growth factor, VEGF), jejichž produkce je stimulovaná zejména těžkou tkáňovou hypoxií. Tyto faktory přispívají k defektní vaskularizaci a k rozvoji fibrózy v zánětlivé i nezánětlivé fázi SSc (31). EPCs se za normálních okolností podílejí na novotvorbě cév. Typicky nízký počet EPCs u SSc je asociovaný s vyšší aktivitou onemocnění a těžším průběhem, rizikem vzniku digitálních ulcerací a rizikem rekurentních akutních koronárních příhod (37).
Endoteliální dysfunkci v časném stadiu SSc mohou vyvolat např. ischemicko-reperfuzní poškození, apoptóza indukovaná infekčními agens, humorální i buněčná imunitní odpověď a imunitně zprostředkovaná cytotoxicita. Ischemie, oxidativní stres a oxidované LDL (oxLDL) spouští zánětlivou reakci v cévní stěně (31). Proces aterogeneze dále potencují mnohé další faktory, např. protilátky proti oxidovaným LDL (anti-oxLDL), beta-2-glykoproteinu I (anti-β2GPI) a jejich komplexům (anti-oxLDL/β2GPI), antiendoteliální protilátky (antiendothelial cell antibodies, AECA), polymorfismy genu pro angiotenzin konvertující enzym (ACE), zvýšené hladiny adhezivních molekul (např. ICAM-I) a mikročástice (microparticles, MPs), které jakožto mediátory zánětu selektivně poškozují produkci NO. Tyto faktory se podílejí nejen na vaskulopatii u SSc, ale i na patogenezi ATS a kardiovaskulárních onemocnění v běžné populaci (38–43).
Vyšetřovací metody
K laboratorním markerům patří kromě obvyklých parametrů lipidogramu také oxLDL a LpA, které jsou asociované s ATS u autoimunitních nemocí, porucha glukózové tolerance (44, 45) a hodnoty proteinů akutní fáze a sedimentace erytrocytů, jejichž elevace je spojena s přítomností subklinické aterosklerózy, kardiovaskulárních příhod a vyšší mortalitou (46–49).
Biologické markery srdeční dysfunkce BNP (brain natriuretic peptide) nebo NT-proBNP (N-terminal pro BNP), případně IMA (ischemia modified albumin), které bývají často zvýšené u pacientů se SSc, předpovídají progresi a manifestaci kardiálního postižení (50, 51). Zvýšená hladina kardiální izoformy troponinu T (cTnT) signalizuje stejně jako v běžné populaci myoperikarditidu či kardiovaskulární příhodu neasociovanou se SSc (50).
K odhalení ATS (včetně subklinického postižení) u SSc se používají vedle fyzikálního vyšetření a anamnézy klaudikací i další metody. Patří mezi ně: poměr tlaků na a. tibialis a a. brachialis (ankle brachial pressure index, ABPI), rozdíl systolických nebo diastolických tlaků na horních končetinách, duplexní sonografie a sonografické měření tloušťky stěny karotid (common carotid intima-media thickness, CIMT), vyšetření endoteliální funkce stanovením dilatační schopnosti arterií (flow-mediated dilation, FMD; nitric-mediated dilation, NMD), určení elasticity arterií měřením rychlosti pulzní vlny (pulse wave velocity, PWV) či analýzou pulzní vlny (pulse wave analysis, PWA) a výpočtu augmentačního indexu (AI). Postižení koronárního řečiště lze vyšetřit pomocí angiografie, průtokové koronární rezervy (coronary flow reserve, CFR) a perfúze myokardu. K neinvazivním metodám patří také multidetektorové CT vyšetření s výpočtem podílu kalcifikací v koronárním řečišti (coronary calcium score, CCS) (44, 52).
Typy poškození
Aterosklerotické postižení u SSc je reprezentováno postižením periferních cév, karotických tepen a koronárního a cerebrovaskulárního řečiště (53). Zvýšené riziko kardiovaskulárních příhod je způsobeno jednak ATS a jednak faktory souvisejícími s patogenezí SSc jako vazospazmus, vaskulopatie, vaskulitida a trombotické komplikace (54).
Protilátkový profil a konkrétní podtyp SSc může mít vliv na makrovaskulární postižení. Pozitivita ACA například koreluje s přítomností aterosklerotických plátů a ischemických příhod. Naopak protilátky proti topoizomeráze I (Scl70) jsou spojeny spíše s malým počtem ischemických příhod (55).
Koronární řečiště
Ačkoli je kardiální onemocnění jednou z hlavních příčin mortality u pacientů se SSc, jeho klinické známky jsou zjevné pouze u 10 % pacientů (56). Většinou se manifestuje v pozdní fázi SSc (57) a značí špatnou prognózu (51). Ve studii Montisci a kol. byla při posmrtném vyšetření odhalena určitá forma postižení srdce až u 80 % pacientů se SSc (58). Abnormální angiografické nálezy mohou být u asymptomatických pacientů se SSc častější, než se původně předpokládalo, a nemusí vždy souviset s přítomností tradičních kardiovaskulárních rizikových faktorů (57).
Určení prevalence aterosklerotického postižení koronárního řečiště a jeho klinických manifestací (angina pectoris, akutní infarkt myokardu (AIM), náhlá smrt) je u pacientů se SSc složité. Důvodem je přítomnost primárního srdečního postižení a myokardiálních lézí způsobených poruchou mikrocirkulace a myokardiální fibrózou, jež jsou považovány za charakteristická postižení srdce u SSc. Uplatňují se také arytmie při postižení převodního systému a nelze opomenout ani perikarditidu či postižení chlopní (51, 59). Srdeční funkce je navíc nepříznivě ovlivněna sekundárním kardiálním postižením při renální vaskulopatii, ILD, PAH a dalších komorbiditách (59).
Riziko AIM je u pacientů téměř 2,5krát vyšší než v běžné populaci se srovnatelným věkem, pohlavím a komorbiditami (60). Vliv samotné SSc na AIM může převažovat nad vlivem hypertenze či diabetu. Imunosupresivní terapie zřejmě v tomto případě nepůsobí protektivně (60). V případech ischemie myokardu a AIM u pacientů se SSc, u nichž se neprokáže organické postižení koronárních arterií, se jako hlavní mechanismy uplatňují okluzivní vaskulopatie a intermitentní vazospazmus (tzv. myokardiální Raynaudův fenomén) (61).
Podíl primárního srdečního postižení při SSc podporují také nálezy na jednofotonové emisní tomografii (single-photon emission computed tomography, SPECT), magnetické rezonanci (MRI) a nekropsii myokardu, kde defekty v perfúzi myokardu, respektive ložiska fibrózy, neodpovídaly distribuci koronárních tepen (61–63).
Změny v průtokové koronární rezervě (CRF) mohou odrážet onemocnění koronárních tepen nebo neschopnost mikrocirkulace zajistit dostatečné zásobení při zvýšených nárocích myokardu. Snížená hodnota CFR u SSc sama o sobě nerozliší vazospastickou etiologii od anatomické stenózy a tudíž nemusí nutně znamenat přítomnost aterosklerotických plátů (58). Použití multidetektorového CT může přispět k objasnění souvislosti mezi hodnotou CFR a anatomií koronárních tepen (64).
Kalcifikované pláty se běžně vyskytují u asymptomatických pacientů se SSc a samotná SSc se zdá být nezávislým rizikovým faktorem podmiňujícím ukládání vápníku ve stěnách koronárních tepen (65, 66). I přes možnou podobnost procesu kalcifikace stěn koronárních arterií a vzniku podkožních kalcifikací u SSc nejeví tyto dvě jednotky žádnou souvislost (28).
Postižení periferních tepen
Postižení velkých cév se původně nepovažovalo za typický rys SSc, mnohé studie ale přinesly důkazy o zvýšené prevalenci onemocnění velkých cév horních i dolních končetin u těchto pacientů (20, 67). Makrovaskulární onemocnění se týká cév s průměrem nad 100 mikrometrů. Významně vyšší (4–6krát) výskyt onemocnění periferních tepen u SSc byl prokázán pomocí fyzikálního vyšetření, anamnézy intermitentních klaudikací zjištěné prostřednictvím dotazníku WHO (World Health Organisation) a Edinburského dotazníku (Edinburgh Claudication questionnaire) či použitím vyšetřovacích metod jako ABPI, Dopplerovská sonografie a angiografie tepen dolních končetin. Tyto nálezy se týkaly i pacientů bez významných rizikových kardiovaskulárních faktorů (20, 67–71).
Na periferním vaskulárním postižení se vedle ATS podílí i vaskulopatie v rámci SSc, což dokazují histologické nálezy chronické obliterativní trombangiitidy u amputovaných končetin (69). Za potenciální příčinu onemocnění velkých tepen u SSc se pokládá také postižení vasa vasorum zásobujících tepny (72).
Makrovaskulární postižení je pravděpodobně spojeno s patologií distálnějších malých cév a kapilár (31). Nasvědčují tomu nálezy změn morfologie a průtoku krve v palmárních digitálních arteriích korelující s patologií nehtových kapilár. Progrese mikrovaskulárního postižení (detekovaného pomocí kapilaroskopie nehtového valu) je navíc spojena s rozvojem makrovaskulárního onemocnění. Protilátky Scl70 mohou být nezávislým prediktivním faktorem makrovaskulárního onemocnění (73).
Endoteliální dysfunkci a poruchu dilatace arterií lze objektivizovat pomocí FMD nebo NMD (21). Snížení FMD značí počínající aterosklerotický proces a u SSc může souviset s vysokými hladinami LpA, přičemž LpA je zodpovědné za inhibici inducibilní NO-syntázy (27, 74). FMD i NMD u SSc byly hodnoceny ve vícero studiích, výsledky jsou však nejednoznačné (17, 21, 75–79).
Zhoršení elasticity arterií je nezávislým prediktorem kardiovaskulárních příhod a mortality (80). Výraznější arteriální tuhost stanovená pomocí PWA (respektive AI) u pacientů se SSc může pozitivně korelovat s trváním choroby, zvýšenými hladinami solubilních markerů endoteliální aktivace (včetně plasmatické hladiny NO, solubilního E-selektinu a VCAM-I) a s titrem Scl70, naopak negativně s pozitivitou ACA (77, 78, 81–86). Mikrovaskulární postižení a dysfunkce myokardu u SSc může rovněž přispívat k abnormálním hodnotám AI (87).
Podle angiografických nálezů je vedoucí příčinou abnormalit periferních cév spíše vaskulopatie související s patogenezí SSc než samotná ATS. Zdá se, že kardiovaskulární rizikové faktory souvisí s onemocněním proximálních periferních, nikoli distálních tepen (70).
Karotické arterie
Aterosklerotické postižení karotid je detekováno u více než 60 % pacientů se SSc (21, 77, 82, 88, 89). Postižení je jednak častější a jednak závažnější oproti běžné populaci se srovnatelným věkem a pohlavím a se stejným profilem kardiovaskulárních rizikových faktorů. Vyšší prevalence karotických plátů, ztluštění cévní stěny a stenóz naznačuje zároveň vyšší riziko CMP u SSc (20).
Meta-analýza hodnotící aterosklerotické postižení pacientů s revmatickým onemocněním (RA, SLE, SSc) prokázala významně zvýšenou tloušťku stěny karotid (CIMT) jakožto validovaného markeru subklinické aterosklerózy v porovnání se zdravými kontrolami stejného věku a pohlaví (90). U samotné SSc byla také popsána vyšší prevalence subklinické aterosklerózy (75, 91, 92). Nicméně významné zvýšení CIMT u SSc signalizující vyšší riziko ATS bylo potvrzeno v méně než polovině takto zaměřených studií (90, 93) a několik jednotlivých studií neprokázalo u SSc žádné zvýšení CIMT (19, 21, 78, 83, 89, 94).
Ultrazvukové vyšetření a duplexní sonografie odhalila kromě závažnějšího a častějšího postižení karotid také časté postižení ulnárních arterií, které jsou významně užší v porovnání se sonografickými nálezy u zdravých kontrol. Ostatní arterie zřejmě nejsou závažněji postiženy (95).
Cerebrovaskulární onemocnění
Data týkající se prevalence cerebrovaskulárního postižení u pacientů se SSc a souvislosti mezi SSc a rizikem CMP jsou nejednoznačná. Roli zde hraje více patologických mechanismů – poškození cév, chronický zánět a vazospazmus (96). Na postižení mozkových cév se podílí endoteliální dysfunkce a ATS (97) i mikrovaskulární komplikace v rámci systémového postižení při SSc (98). Vyšší riziko rozvoje neurologických komplikací je zřejmě spojeno s pozitivitou protilátek proti ribonukleoproteinu U1 (anti-U1 RNP) a Scl70 (99). Roli zánětu a imunitních pochodů podporuje zjevné zlepšení stavu pacientů po podání imunosupresiv v rámci terapie CMP (100). Vazospazmus cerebrálních tepen (typu Raynaudova fenoménu) může být spojen s transitorní ischemickou atakou (TIA) či fokálním neurodeficitem (101).
Některé studie naznačují, že se cerebrovaskulární postižení u SSc podceňuje (102–104). Podle studie Youssef a kol. je u pacientů se SSc cerebrovaskulární onemocnění až 1,3krát častější než v běžné populaci (69). Samotná SSc byla podle srovnávací kohortové studie nezávisle asociovaná s o 43 % vyšším rizikem ischemické CMP oproti běžné populaci (54). Zdá se, že ani běžně užívané léky jako blokátory kalciových kanálů a inhibitory ACE a perorální glukokortikoidy a imunosupresivní terapie na riziko nemají vliv (96).
U pacientů se SSc asymptomatických z hlediska neurologických projevů jsou významně častěji přítomné intracerebrální vaskulární kalcifikace na CT a hyperintenzní ložiska v bílé hmotě na MRI mozku oproti běžné populaci. Takovéto nálezy znamenají nezávislý rizikový faktor cerebrovaskulární příhody (105–109).
Prevence a léčba aterosklerózy u SSc
Obecně platí, že časný skrínink kardiovaskulárních rizik je zásadní pro možnost preventivních opatření případně časnou terapii přítomného postižení cév. Evropská liga proti revmatismu (EULAR, European League Against Rheumatism) recentně publikovala doporučení pro kontrolu kardiovaskulárního rizika u pacientů se zánětlivými artropatiemi (110). Podobná doporučení jsou v plánu i pro pacienty se SLE a SSc (5).
Terapie tradičních kardiovaskulárních rizikových faktorů u SSc se většinou řídí národními doporučeními. Některé z běžně užívaných léků prokázaly vedle svého hlavního mechanismu účinku také určitý příznivý protizánětlivý a vaskuloprotektivní efekt. Patří sem například statiny, glitazony (peroxisome proliferator-activated receptor gamma agonists, PPARγ agonists) (111–113), blokátory kalciových kanálů, inhibitory ACE a bosentan (endothelin-1 receptor antagonist, ERA) (114–117).
K prevenci a kontrole kardiovaskulárního rizika je nutná také těsná kontrola aktivity revmatického onemocnění (110, 118, 119). Farmakoterapie by se měla řídit doporučením EULAR pro léčbu SSc (120). Imunosupresivní preparáty užívané u SSc mohou mít různý efekt na kardiovaskulární systém. Glukokortikoidy indikované například k léčbě myokarditidy u SSc působí protektivně díky kontrole aktivity zánětu, na druhé straně zhoršují dyslipidémii, inzulinovou rezistenci a hypertenzi (121, 122). Na základě studií u pacientů s RA byla empiricky stanovena bezpečná maximální denní dávka ekvivalentní 8 mg prednisonu (123). Obecně se doporučuje jejich užívání v co nejnižší dávce po co nejkratší dobu (110).
Methotrexát (MTX) je indikován zejména při terapii kožní fibrózy a jako imunosupresivum u časné kožně difúzní SSc (dcSSc, diffuse cutaneous systemic sclerosis) (120). Protektivní antiaterogenní účinky spočívají v inhibici formace pěnových buněk a modifikaci reverzního transportu cholesterolu (124). Na druhou stranu může zvyšovat produkci proaterogenního homocysteinu, který podmiňuje poškození endotelu a oxidaci LDL částic. Tomuto efektu lze předcházet podáváním kyseliny listové (125).
Cyklofosfamid (CFA) používaný v terapii ILD potencuje poškození myokardu a srdeční selhávání svým vlivem na metabolismus kardiomyocytů a indukcí jejich apoptózy (126).
Biologické preparáty zatím nejsou u SSc běžně užívané. Studie zabývající se jejich efektem na kardiovaskulární systém byly prováděny zejména u RA, případně ankylozující spondylitidy a psoriatické artritidy, kde byl prokázán potenciál rituximabu a inhibitorů TNFα zlepšovat endoteliální funkci, snižovat CIMT a arteriální tuhost (119, 127–131). Některé anti-TNFα preparáty také zlepšují inzulinovou senzitivitu, snižují hladiny rezistinu a zvyšují produkci adiponektinu (128, 132).
Závěr
Systémová sklerodermie je chronicky progredující, potenciálně letální onemocnění. Život ohrožující manifestace, plicní arteriální hypertenze a sklerodermická renální krize, ustoupily do pozadí díky zlepšení včasné diagnostiky a terapie. Zároveň však vyvstaly nové příčiny morbidity a mortality v čele s kardiovaskulárními komorbiditami. Výsledky dosavadních studií potvrzují předpoklad zvýšené prevalence aterosklerózy a kardiovaskulárního rizika u tohoto onemocnění. Zatím ale není jasné, jak moc je kardiovaskulární riziko zvýšené a jaký podíl v něm sehrává ateroskleróza a primární vaskulopatie související s patogenezí systémové sklerodermie. U pacientů se sklerodermií by měly být v rámci vyšetření pečlivě sledovány a včas intervenovány modifikovatelné rizikové kardiovaskulární faktory. Do budoucna je nutné rozšíření poznatků týkajících se kardiovaskulárního rizika o studie s větším souborem pacientů s použitím standardizovaných metod a nástrojů a posléze vytvoření vhodných doporučení pro pacienty se systémovou sklerodermií.
Poděkování: Tato práce vznikla za podpory grantu AZV 16-33574A, AZV 16-33542A, SVV pro FTVS UK na rok 2017, SVV 260373, GAUK 214615, UNCE 204022 a za podpory MZ ČR – Institucionální podpora, Koncepční rozvoj výzkumné organizace č. MZO 023728.
adresa pro korespondenci:
MUDr. Michal Tomčík, Ph.D.
Revmatologický ústav,
Revmatologická klinika 1. LF UK
Na Slupi 4
128 50 Praha 2
e-mail: tomcik@revma.cz
Sources
1. Krause I, Shoenfeld Y. Intravenous immunoglobulin treatment for fibrosis, atherosclerosis, and malignant conditions. Methods Mol Med. 2005; 109 : 403-8.
2. Libby P, Ridker PM, Hansson GK. Progress and challenges in translating the biology of atherosclerosis. Nature. 2011; 473(7347): 317–25.
3. Shoenfeld Y, Gerli R, Doria A, Matsuura E, Cerinic MM, Ronda N, et al. Accelerated atherosclerosis in autoimmune rheumatic diseases. Circulation. 2005; 112(21): 3337–47.
4. Zinger H, Sherer Y, Shoenfeld Y. Atherosclerosis in autoimmune rheumatic diseases-mechanisms and clinical findings. Clin Rev Allergy Immunol. 2009; 37(1): 20–8.
5. Soltesz P, Kerekes G, Der H, Szucs G, Szanto S, Kiss E, et al. Comparative assessment of vascular function in autoimmune rheumatic diseases: considerations of prevention and treatment. Autoimmun Rev. 2011; 10(7): 416–25.
6. Gargiulo P, Marsico F, Parente A, Paolillo S, Cecere M, Casaretti L, et al. Ischemic heart disease in systemic inflammatory diseases. An appraisal. Int J Cardiol. 2014; 170(3): 286–90.
7. Sherer Y, Shoenfeld Y. Mechanisms of disease: atherosclerosis in autoimmune diseases. Nat Clin Pract Rheumatol. 2006; 2(2): 99–106.
8. Soriano A, Afeltra A, Shoenfeld Y. Is atherosclerosis accelerated in systemic sclerosis? Novel insights. Curr Opin Rheumatol. 2014; 26(6): 653-7.
9. Jacobsen S, Halberg P, Ullman S. Mortality and causes of death of 344 Danish patients with systemic sclerosis (scleroderma). Br J Rheumatol. 1998; 37(7): 750–5.
10. Cannarile F, Valentini V, Mirabelli G, Alunno A, Terenzi R, Luccioli F, et al. Cardiovascular disease in systemic sclerosis. Ann Transl Med. 2015; 3(1): 8.
11. Dumoitier N, Lofek S, Mouthon L. Pathophysiology of systemic sclerosis: state of the art in 2014. Presse Med. 2014; 43(10 Pt 2): e267–78.
12. Baraut J, Michel L, Verrecchia F, Farge D. Relationship between cytokine profiles and clinical outcomes in patients with systemic sclerosis. Autoimmun Rev. 2010; 10(2): 65-73.
13. Sarzi-Puttini P, Atzeni F, Gerli R, Bartoloni E, Doria A, Barskova T, et al. Cardiac involvement in systemic rheumatic diseases: An update. Autoimmun Rev. 2010; 9(12): 849-52.
14. Belch JJ, McSwiggan S, Lau C. Macrovascular disease in systemic sclerosis: the tip of an iceberg? Rheumatology (Oxford). 2008; 47 Suppl 5: v16–7.
15. Rubio-Rivas M, Royo C, Simeon CP, Corbella X, Fonollosa V. Mortality and survival in systemic sclerosis: systematic review and meta-analysis. Semin Arthritis Rheum. 2014; 44(2): 208–19.
16. Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972-2002. Ann Rheum Dis. 2007; 66(7): 940–4.
17. Nussinovitch U, Shoenfeld Y. Atherosclerosis and macrovascular involvement in systemic sclerosis: myth or reality. Autoimmun Rev. 2011; 10(5): 259–66.
18. Ngian GS, Sahhar J, Proudman SM, Stevens W, Wicks IP, Van Doornum S. Prevalence of coronary heart disease and cardiovascular risk factors in a national cross-sectional cohort study of systemic sclerosis. Ann Rheum Dis. 2012; 71(12): 1980–3.
19. Zakopoulos NA, Kotsis VT, Gialafos EJ, Papamichael CM, Pitiriga V, Mitsibounas DN, et al. Systemic sclerosis is not associated with clinical or ambulatory blood pressure. Clin Exp Rheumatol. 2003; 21(2): 199–204.
20. Ho M, Veale D, Eastmond C, Nuki G, Belch J. Macrovascular disease and systemic sclerosis. Ann Rheum Dis. 2000; 59(1): 39–43.
21. Szucs G, Timar O, Szekanecz Z, Der H, Kerekes G, Szamosi S, et al. Endothelial dysfunction precedes atherosclerosis in systemic sclerosis-relevance for prevention of vascular complications. Rheumatology (Oxford). 2007; 46(5): 759–62.
22. Cerinic MM, Valentini G, Sorano GG, D'Angelo S, Cuomo G, Fenu L, et al. Blood coagulation, fibrinolysis, and markers of endothelial dysfunction in systemic sclerosis. Semin Arthritis Rheum. 2003; 32(5): 285–95.
23. Gruschwitz M, von den Driesch P, Kellner I, Hornstein OP, Sterry W. Expression of adhesion proteins involved in cell-cell and cell-matrix interactions in the skin of patients with progressive systemic sclerosis. J Am Acad Dermatol. 1992; 27(2 Pt 1): 169-77.
24. Szamosi S, Csiki Z, Szomjak E, Szolnoki E, Szoke G, Szekanecz Z, et al. Plasma homocysteine levels, the prevalence of methylenetetrahydrofolate reductase gene C677T polymorphism and macrovascular disorders in systemic sclerosis: risk factors for accelerated macrovascular damage? Clin Rev Allergy Immunol. 2009; 36(2–3): 145–9.
25. Koch AE, Kronfeld-Harrington LB, Szekanecz Z, Cho MM, Haines GK, Harlow LA, et al. In situ expression of cytokines and cellular adhesion molecules in the skin of patients with systemic sclerosis. Their role in early and late disease. Pathobiology. 1993; 61(5–6): 239–46.
26. Borba EF, Borges CT, Bonfa E. Lipoprotein profile in limited systemic sclerosis. Rheumatol Int. 2005; 25(5): 379–83.
27. Lippi G, Caramaschi P, Montagnana M, Salvagno GL, Volpe A, Guidi G. Lipoprotein[a] and the lipid profile in patients with systemic sclerosis. Clin Chim Acta. 2006; 364(1-2): 345–8.
28. Khurma V, Meyer C, Park GS, McMahon M, Lin J, Singh RR, et al. A pilot study of subclinical coronary atherosclerosis in systemic sclerosis: coronary artery calcification in cases and controls. Arthritis Rheum. 2008; 59(4): 591–7.
29. Kodera M, Hayakawa I, Komura K, Yanaba K, Hasegawa M, Takehara K, et al. Anti-lipoprotein lipase antibody in systemic sclerosis: association with elevated serum triglyceride concentrations. J Rheumatol. 2005; 32(4): 629–36.
30. Ngian GS, Sahhar J, Wicks IP, Van Doornum S. Cardiovascular disease in systemic sclerosis-an emerging association? Arthritis Res Ther. 2011; 13(4): 237.
31. Matucci-Cerinic M, Kahaleh B, Wigley FM. Review: evidence that systemic sclerosis is a vascular disease. Arthritis Rheum. 2013; 65(8): 1953–62.
32. Andersen GN, Caidahl K, Kazzam E, Petersson AS, Waldenstrom A, Mincheva-Nilsson L, et al. Correlation between increased nitric oxide production and markers of endothelial activation in systemic sclerosis: findings with the soluble adhesion molecules E-selectin, intercellular adhesion molecule 1, and vascular cell adhesion molecule 1. Arthritis Rheum. 2000; 43(5): 1085–93.
33. Munzel T, Sinning C, Post F, Warnholtz A, Schulz E. Pathophysiology, diagnosis and prognostic implications of endothelial dysfunction. Ann Med. 2008; 40(3): 180–96.
34. Muller-Ladner U, Distler O, Ibba-Manneschi L, Neumann E, Gay S. Mechanisms of vascular damage in systemic sclerosis. Autoimmunity. 2009; 42(7): 587–95.
35. Altorok N, Wang Y, Kahaleh B. Endothelial dysfunction in systemic sclerosis. Curr Opin Rheumatol. 2014; 26(6): 615–20.
36. Fleming JN, Nash RA, Mahoney WM, Jr., Schwartz SM. Is scleroderma a vasculopathy? Curr Rheumatol Rep. 2009; 11(2): 103–10.
37. Werner N, Kosiol S, Schiegl T, Ahlers P, Walenta K, Link A, et al. Circulating endothelial progenitor cells and cardiovascular outcomes. N Engl J Med. 2005; 353(10): 999–1007.
38. Kuwana M, Okazaki Y. Brief report: impaired in vivo neovascularization capacity of endothelial progenitor cells in patients with systemic sclerosis. Arthritis Rheumatol. 2014; 66(5): 1300–5.
39. Del Papa N, Quirici N, Scavullo C, Gianelli U, Corti L, Vitali C, et al. Antiendothelial cell antibodies induce apoptosis of bone marrow endothelial progenitors in systemic sclerosis. J Rheumatol. 2010; 37(10): 2053–63.
40. Lopez LR, Simpson DF, Hurley BL, Matsuura E. OxLDL/beta2GPI complexes and autoantibodies in patients with systemic lupus erythematosus, systemic sclerosis, and antiphospholipid syndrome: pathogenic implications for vascular involvement. Ann N Y Acad Sci. 2005; 1051 : 313–22.
41. Sanna G, Bertolaccini ML, Mameli A, Hughes GR, Khamashta MA, Mathieu A. Antiphospholipid antibodies in patients with scleroderma: prevalence and clinical significance. Ann Rheum Dis. 2005; 64(12): 1795–6.
42. Bartoli F, Angotti C, Fatini C, Conforti ML, Guiducci S, Blagojevic J, et al. Angiotensin-converting enzyme I/D polymorphism and macrovascular disease in systemic sclerosis. Rheumatology (Oxford). 2007; 46(5): 772–5.
43. Boulanger CM, Scoazec A, Ebrahimian T, Henry P, Mathieu E, Tedgui A, et al. Circulating microparticles from patients with myocardial infarction cause endothelial dysfunction. Circulation. 2001; 104(22): 2649–52.
44. Szekanecz Z, Kerekes G, Vegh E, Kardos Z, Barath Z, Tamasi L, et al. Autoimmune atherosclerosis in 3D: How it develops, how to diagnose and what to do. Autoimmun Rev. 2016; 15(7): 756–69.
45. Montecucco F, Mach F. Common inflammatory mediators orchestrate pathophysiological processes in rheumatoid arthritis and atherosclerosis. Rheumatology (Oxford). 2009; 48(1): 11–22.
46. Danesh J, Wheeler JG, Hirschfield GM, Eda S, Eiriksdottir G, Rumley A, et al. C-reactive protein and other circulating markers of inflammation in the prediction of coronary heart disease. N Engl J Med. 2004; 350(14): 1387–97.
47. Gonzalez-Gay MA, Gonzalez-Juanatey C, Pineiro A, Garcia-Porrua C, Testa A, Llorca J. High-grade C-reactive protein elevation correlates with accelerated atherogenesis in patients with rheumatoid arthritis. J Rheumatol. 2005; 32(7): 1219–23.
48. Gonzalez-Gay MA, Gonzalez-Juanatey C, Lopez-Diaz MJ, Pineiro A, Garcia-Porrua C, Miranda-Filloy JA, et al. HLA-DRB1 and persistent chronic inflammation contribute to cardiovascular events and cardiovascular mortality in patients with rheumatoid arthritis. Arthritis Rheum. 2007; 57(1): 125–32.
49. Book C, Saxne T, Jacobsson LT. Prediction of mortality in rheumatoid arthritis based on disease activity markers. J Rheumatol. 2005; 32(3): 430–4.
50. Montagnana M, Lippi G, Volpe A, Salvagno GL, Biasi D, Caramaschi P, et al. Evaluation of cardiac laboratory markers in patients with systemic sclerosis. Clin Biochem. 2006; 39(9): 913–7.
51. Kahan A, Coghlan G, McLaughlin V. Cardiac complications of systemic sclerosis. Rheumatology (Oxford). 2009; 48 Suppl 3: iii45–8.
52. Kerekes G, Soltesz P, Nurmohamed MT, Gonzalez-Gay MA, Turiel M, Vegh E, et al. Validated methods for assessment of subclinical atherosclerosis in rheumatology. Nat Rev Rheumatol. 2012; 8(4): 224–34.
53. Lorenz MW, Markus HS, Bots ML, Rosvall M, Sitzer M. Prediction of clinical cardiovascular events with carotid intima-media thickness: a systematic review and meta-analysis. Circulation. 2007; 115(4): 459–67.
54. Man A, Zhu Y, Zhang Y, Dubreuil M, Rho YH, Peloquin C, et al. The risk of cardiovascular disease in systemic sclerosis: a population-based cohort study. Ann Rheum Dis. 2013; 72(7): 1188–93.
55. Nordin A, Jensen-Urstad K, Bjornadal L, Pettersson S, Larsson A, Svenungsson E. Ischemic arterial events and atherosclerosis in patients with systemic sclerosis: a population-based case-control study. Arthritis Res Ther. 2013; 15(4): R87.
56. Akram MR, Handler CE, Williams M, Carulli MT, Andron M, Black CM, et al. Angiographically proven coronary artery disease in scleroderma. Rheumatology (Oxford). 2006; 45(11): 1395–8.
57. Tarek el G, Yasser AE, Gheita T. Coronary angiographic findings in asymptomatic systemic sclerosis. Clin Rheumatol. 2006; 25(4): 487–90.
58. Montisci R, Vacca A, Garau P, Colonna P, Ruscazio M, Passiu G, et al. Detection of early impairment of coronary flow reserve in patients with systemic sclerosis. Ann Rheum Dis. 2003; 62(9): 890–3.
59. Ferri C, Giuggioli D, Sebastiani M, Colaci M, Emdin M. Heart involvement and systemic sclerosis. Lupus. 2005; 14(9): 702–7.
60. Chu SY, Chen YJ, Liu CJ, Tseng WC, Lin MW, Hwang CY, et al. Increased risk of acute myocardial infarction in systemic sclerosis: a nationwide population-based study. Am J Med. 2013; 126(11): 982–8.
61. Bulkley BH, Ridolfi RL, Salyer WR, Hutchins GM. Myocardial lesions of progressive systemic sclerosis. A cause of cardiac dysfunction. Circulation. 1976; 53(3): 483-90.
62. Belloli L, Carlo-Stella N, Ciocia G, Chiti A, Massarotti M, Marasini B. Myocardial involvement in systemic sclerosis. Rheumatology (Oxford). 2008; 47(7): 1070–2.
63. Kobayashi H, Yokoe I, Hirano M, Nakamura T, Nakajima Y, Fontaine KR, et al. Cardiac magnetic resonance imaging with pharmacological stress perfusion and delayed enhancement in asymptomatic patients with systemic sclerosis. J Rheumatol. 2009; 36(1): 106–12.
64. Vacca A, Siotto P, Cauli A, Montisci R, Garau P, Ibba V, et al. Absence of epicardial coronary stenosis in patients with systemic sclerosis with severe impairment of coronary flow reserve. Ann Rheum Dis. 2006; 65(2): 274–5.
65. Mok MY, Lau CS, Chiu SS, Tso AW, Lo Y, Law LS, et al. Systemic sclerosis is an independent risk factor for increased coronary artery calcium deposition. Arthritis Rheum. 2011; 63(5): 1387–95.
66. Mok MY, Chiu SS, Lo Y, Mak HK, Wong WS, Khong PL, et al. Coronary atherosclerosis using computed tomography coronary angiography in patients with systemic sclerosis. Scand J Rheumatol. 2009; 38(5): 381–5.
67. Veale DJ, Collidge TA, Belch JJ. Increased prevalence of symptomatic macrovascular disease in systemic sclerosis. Ann Rheum Dis. 1995; 54(10): 853–5.
68. Youssef P, Englert H, Bertouch J. Large vessel occlusive disease associated with CREST syndrome and scleroderma. Ann Rheum Dis. 1993; 52(6): 464–6.
69. Youssef P, Brama T, Englert H, Bertouch J. Limited scleroderma is associated with increased prevalence of macrovascular disease. J Rheumatol. 1995; 22(3): 469–72.
70. Dick EA, Aviv R, Francis I, Hamilton G, Baker D, Black C, et al. Catheter angiography and angioplasty in patients with scleroderma. Br J Radiol. 2001; 74(888): 1091–6.
71. Wan MC, Moore T, Hollis S, Herrick AL. Ankle brachial pressure index in systemic sclerosis: influence of disease subtype and anticentromere antibody. Rheumatology (Oxford). 2001; 40(10): 1102–5.
72. Kahaleh MB, LeRoy EC. Autoimmunity and vascular involvement in systemic sclerosis (SSc). Autoimmunity. 1999; 31(3): 195–214.
73. Rosato E, Gigante A, Barbano B, Cianci R, Molinaro I, Pisarri S, et al. In systemic sclerosis macrovascular damage of hands digital arteries correlates with microvascular damage. Microvasc Res. 2011; 82(3): 410–5.
74. Sedky Abdou MM, El Desouky SM, Helmy El Kaffas KM, Ahmed Hassan AM. Premature atherosclerosis in systemic sclerosis patients: Its relation to disease parameters and to traditional risk factors. International journal of rheumatic diseases. 2016.
75. Lekakis J, Mavrikakis M, Papamichael C, Papazoglou S, Economou O, Scotiniotis I, et al. Short-term estrogen administration improves abnormal endothelial function in women with systemic sclerosis and Raynaud's phenomenon. Am Heart J. 1998; 136(5): 905–12.
76. Lekakis J, Papamichael C, Mavrikakis M, Voutsas A, Stamatelopoulos S. Effect of long-term estrogen therapy on brachial arterial endothelium-dependent vasodilation in women with Raynaud's phenomenon secondary to systemic sclerosis. Am J Cardiol. 1998; 82(12): 1555-7, A8.
77. Andersen GN, Mincheva-Nilsson L, Kazzam E, Nyberg G, Klintland N, Petersson AS, et al. Assessment of vascular function in systemic sclerosis: indications of the development of nitrate tolerance as a result of enhanced endothelial nitric oxide production. Arthritis Rheum. 2002; 46(5): 1324–32.
78. Roustit M, Simmons GH, Baguet JP, Carpentier P, Cracowski JL. Discrepancy between simultaneous digital skin microvascular and brachial artery macrovascular post-occlusive hyperemia in systemic sclerosis. J Rheumatol. 2008; 35(8): 1576–83.
79. D'Andrea A, Caso P, Cuomo S, Scotto di Uccio F, Scarafile R, Salerno G, et al. Myocardial and vascular dysfunction in systemic sclerosis: the potential role of noninvasive assessment in asymptomatic patients. Int J Cardiol. 2007; 121(3): 298–301.
80. Vlachopoulos C, Aznaouridis K, Stefanadis C. Prediction of cardiovascular events and all-cause mortality with arterial stiffness: a systematic review and meta-analysis. J Am Coll Cardiol. 2010; 55(13): 1318–27.
81. Timar O, Soltesz P, Szamosi S, Der H, Szanto S, Szekanecz Z, et al. Increased arterial stiffness as the marker of vascular involvement in systemic sclerosis. J Rheumatol. 2008; 35(7): 1329–33.
82. Cypiene A, Laucevicius A, Venalis A, Dadoniene J, Ryliskyte L, Petrulioniene Z, et al. The impact of systemic sclerosis on arterial wall stiffness parameters and endothelial function. Clin Rheumatol. 2008; 27(12): 1517–22.
83. Liu J, Zhang Y, Cao TS, Duan YY, Yuan LJ, Yang YL, et al. Preferential macrovasculopathy in systemic sclerosis detected by regional pulse wave velocity from wave intensity analysis: comparisons of local and regional arterial stiffness parameters in cases and controls. Arthritis Care Res (Hoboken). 2011; 63(4): 579–87.
84. Sfikakis PP, Papamichael C, Stamatelopoulos KS, Tousoulis D, Fragiadaki KG, Katsichti P, et al. Improvement of vascular endothelial function using the oral endothelin receptor antagonist bosentan in patients with systemic sclerosis. Arthritis Rheum. 2007; 56(6): 1985–93.
85. Peled N, Shitrit D, Fox BD, Shlomi D, Amital A, Bendayan D, et al. Peripheral arterial stiffness and endothelial dysfunction in idiopathic and scleroderma associated pulmonary arterial hypertension. J Rheumatol. 2009; 36(5): 970–5.
86. Piccione MC, Bagnato G, Zito C, Di Bella G, Caliri A, Catalano M, et al. Early identification of vascular damage in patients with systemic sclerosis. Angiology. 2011; 62(4): 338–43.
87. Mahmud A, Feely J. Arterial stiffness is related to systemic inflammation in essential hypertension. Hypertension. 2005; 46(5): 1118–22.
88. Bartoli F, Blagojevic J, Bacci M, Fiori G, Tempestini A, Conforti ML, et al. Flow-mediated vasodilation and carotid intima-media thickness in systemic sclerosis. Ann N Y Acad Sci. 2007; 1108 : 283–90.
89. Hettema ME, Zhang D, de Leeuw K, Stienstra Y, Smit AJ, Kallenberg CG, et al. Early atherosclerosis in systemic sclerosis and its relation to disease or traditional risk factors. Arthritis Res Ther. 2008; 10(2): R49.
90. Tyrrell PN, Beyene J, Feldman BM, McCrindle BW, Silverman ED, Bradley TJ. Rheumatic disease and carotid intima-media thickness: a systematic review and meta-analysis. Arterioscler Thromb Vasc Biol. 2010; 30(5): 1014–26.
91. Sherer Y, Cerinic MM, Bartoli F, Blagojevic J, Conforti ML, Gilburd B, et al. Early atherosclerosis and autoantibodies to heat-shock proteins and oxidized LDL in systemic sclerosis. Ann N Y Acad Sci. 2007; 1108 : 259–67.
92. Kaloudi O, Basta G, Perfetto F, Bartoli F, Del Rosso A, Miniati I, et al. Circulating levels of Nepsilon-(carboxymethyl)lysine are increased in systemic sclerosis. Rheumatology (Oxford). 2007; 46(3): 412–6.
93. Au K, Singh MK, Bodukam V, Bae S, Maranian P, Ogawa R, et al. Atherosclerosis in systemic sclerosis: a systematic review and meta-analysis. Arthritis Rheum. 2011; 63(7): 2078–90.
94. Cheng KS, Tiwari A, Boutin A, Denton CP, Black CM, Morris R, et al. Carotid and femoral arterial wall mechanics in scleroderma. Rheumatology (Oxford). 2003; 42(11): 1299–305.
95. Stafford L, Englert H, Gover J, Bertouch J. Distribution of macrovascular disease in scleroderma. Ann Rheum Dis. 1998; 57(8): 476–9.
96. Chiang CH, Liu CJ, Huang CC, Chan WL, Huang PH, Chen TJ, et al. Systemic sclerosis and risk of ischaemic stroke: a nationwide cohort study. Rheumatology (Oxford). 2013; 52(1): 161–5.
97. Roquer J, Segura T, Serena J, Castillo J. Endothelial dysfunction, vascular disease and stroke: the ARTICO study. Cerebrovasc Dis. 2009; 27 Suppl 1 : 25–37.
98. Pathak R, Gabor AJ. Scleroderma and central nervous system vasculitis. Stroke. 1991; 22(3): 410–3.
99. Hietarinta M, Lassila O, Hietaharju A. Association of anti-U1RNP - and anti-Scl-70-antibodies with neurological manifestations in systemic sclerosis (scleroderma). Scand J Rheumatol. 1994; 23(2): 64–7.
100. Faucher B, Granel B, Nicoli F. Acute cerebral vasculopathy in systemic sclerosis. Rheumatol Int. 2013; 33(12): 3073–7.
101. Heron E, Fornes P, Rance A, Emmerich J, Bayle O, Fiessinger JN. Brain involvement in scleroderma: two autopsy cases. Stroke. 1998; 29(3): 719–21.
102. Schedel J, Kuchenbuch S, Schoelmerich J, Feuerbach S, Geissler A, Mueller-Ladner U. Cerebral lesions in patients with connective tissue diseases and systemic vasculitides: are there specific patterns? Ann N Y Acad Sci. 2010; 1193 : 167–75.
103. Terrier B, Charbonneau F, Touze E, Berezne A, Pagnoux C, Silvera S, et al. Cerebral vasculopathy is associated with severe vascular manifestations in systemic sclerosis. J Rheumatol. 2009; 36(7): 1486–94.
104. Bertinotti L, Mortilla M, Conforti ML, Colangelo N, Nacci F, Del Rosso A, et al. Proton magnetic resonance spectroscopy reveals central neuroaxonal impairment in systemic sclerosis. J Rheumatol. 2006; 33(3): 546–51.
105. Chen XY, Lam WW, Ng HK, Fan YH, Wong KS. Intracranial artery calcification: a newly identified risk factor of ischemic stroke. J Neuroimaging. 2007; 17(4): 300–3.
106. Heron E, Hernigou A, Chatellier G, Fornes P, Emmerich J, Fiessinger JN. Intracerebral calcification in systemic sclerosis. Stroke. 1999; 30(10): 2183–5.
107. Tanabe J. White matter hyperintensities are associated with an increased risk of stroke, dementia and mortality. Evid Based Ment Health. 2011; 14(1): 1.
108. Sardanelli F, Iozzelli A, Cotticelli B, Losacco C, Cutolo M, Sulli A, et al. White matter hyperintensities on brain magnetic resonance in systemic sclerosis. Ann Rheum Dis. 2005; 64(5): 777–9.
109. Mohamed RH, Nassef AA. Brain magnetic resonance imaging findings in patients with systemic sclerosis. Int J Rheum Dis. 2010; 13(1): 61–7.
110. Agca R, Heslinga SC, Rollefstad S, Heslinga M, McInnes IB, Peters MJ, et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Ann Rheum Dis. 2017; 76(1): 17–28.
111. Costenbader KH, Coblyn JS. Statin therapy in rheumatoid arthritis. South Med J. 2005; 98(5): 534-40; quiz 41, 72.
112. Timar O, Szekanecz Z, Kerekes G, Vegh J, Olah AV, Nagy G, et al. Rosuvastatin improves impaired endothelial function, lowers high sensitivity CRP, complement and immuncomplex production in patients with systemic sclerosis-a prospective case-series study. Arthritis Res Ther. 2013; 15(5): R105.
113. Ormseth MJ, Oeser AM, Cunningham A, Bian A, Shintani A, Solus J, et al. Reversing vascular dysfunction in rheumatoid arthritis: improved augmentation index but not endothelial function with peroxisome proliferator-activated receptor gamma agonist therapy. Arthritis Rheumatol. 2014; 66(9): 2331–8.
114. Vignaux O, Allanore Y, Meune C, Pascal O, Duboc D, Weber S, et al. Evaluation of the effect of nifedipine upon myocardial perfusion and contractility using cardiac magnetic resonance imaging and tissue Doppler echocardiography in systemic sclerosis. Ann Rheum Dis. 2005; 64(9): 1268–73.
115. Allanore Y, Meune C, Vignaux O, Weber S, Legmann P, Kahan A. Bosentan increases myocardial perfusion and function in systemic sclerosis: a magnetic resonance imaging and Tissue-Doppler echography study. J Rheumatol. 2006; 33(12): 2464–9.
116. Kahan A, Devaux JY, Amor B, Menkes CJ, Weber S, Guerin F, et al. Pharmacodynamic effect of nicardipine on left ventricular function in systemic sclerosis. J Cardiovasc Pharmacol. 1990; 15(2): 249–53.
117. Kowal-Bielecka O, Landewe R, Avouac J, Chwiesko S, Miniati I, Czirjak L, et al. EULAR recommendations for the treatment of systemic sclerosis: a report from the EULAR Scleroderma Trials and Research group (EUSTAR). Ann Rheum Dis. 2009; 68(5): 620–8.
118. Tomasoni L, Sitia S, Borghi C, Cicero AF, Ceconi C, Cecaro F, et al. Effects of treatment strategy on endothelial function. Autoimmun Rev. 2010; 9(12): 840–4.
119. Atzeni F, Turiel M, Caporali R, Cavagna L, Tomasoni L, Sitia S, et al. The effect of pharmacological therapy on the cardiovascular system of patients with systemic rheumatic diseases. Autoimmun Rev. 2010; 9(12): 835-9.
120. Kowal-Bielecka O, Fransen J, Avouac J, Becker M, Kulak A, Allanore Y, et al. Update of EULAR recommendations for the treatment of systemic sclerosis. Annals of the rheumatic diseases. 2016.
121. Nurmohamed MT, van Halm VP, Dijkmans BA. Cardiovascular risk profile of antirheumatic agents in patients with osteoarthritis and rheumatoid arthritis. Drugs. 2002; 62(11): 1599–609.
122. Kerekes G, Nurmohamed MT, Gonzalez-Gay MA, Seres I, Paragh G, Kardos Z, et al. Rheumatoid arthritis and metabolic syndrome. Nat Rev Rheumatol. 2014; 10(11): 691-6.
123. del Rincon I, Battafarano DF, Restrepo JF, Erikson JM, Escalante A. Glucocorticoid dose thresholds associated with all-cause and cardiovascular mortality in rheumatoid arthritis. Arthritis Rheumatol. 2014; 66(2): 264-72.
124. Reiss AB, Carsons SE, Anwar K, Rao S, Edelman SD, Zhang H, et al. Atheroprotective effects of methotrexate on reverse cholesterol transport proteins and foam cell transformation in human THP-1 monocyte/macrophages. Arthritis Rheum. 2008; 58(12): 3675-83.
125. van Halm VP, Nurmohamed MT, Twisk JW, Dijkmans BA, Voskuyl AE. Disease-modifying antirheumatic drugs are associated with a reduced risk for cardiovascular disease in patients with rheumatoid arthritis: a case control study. Arthritis Res Ther. 2006; 8(5): R151.
126. Finsterer J, Ohnsorge P. Influence of mitochondrion-toxic agents on the cardiovascular system. Regul Toxicol Pharmacol. 2013; 67(3): 434–45.
127. Kerekes G, Soltesz P, Der H, Veres K, Szabo Z, Vegvari A, et al. Effects of biologics on vascular function and atherosclerosis associated with rheumatoid arthritis. Ann N Y Acad Sci. 2009; 1173 : 814–21.
128. Szekanecz Z, Kerekes G, Soltesz P. Vascular effects of biologic agents in RA and spondyloarthropathies. Nat Rev Rheumatol. 2009; 5(12): 677–84.
129. Kerekes G, Soltesz P, Der H, Veres K, Szabo Z, Vegvari A, et al. Effects of rituximab treatment on endothelial dysfunction, carotid atherosclerosis, and lipid profile in rheumatoid arthritis. Clin Rheumatol. 2009; 28(6): 705–10.
130. Gonzalez-Juanatey C, Llorca J, Vazquez-Rodriguez TR, Diaz-Varela N, Garcia-Quiroga H, Gonzalez-Gay MA. Short-term improvement of endothelial function in rituximab-treated rheumatoid arthritis patients refractory to tumor necrosis factor alpha blocker therapy. Arthritis Rheum. 2008; 59(12): 1821–4.
131. van Leeuwen M, Damoiseaux J, Duijvestijn A, Tervaert JW. The therapeutic potential of targeting B cells and anti-oxLDL antibodies in atherosclerosis. Autoimmun Rev. 2009; 9(1): 53–7.
132. Gonzalez-Gay MA, De Matias JM, Gonzalez-Juanatey C, Garcia-Porrua C, Sanchez-Andrade A, Martin J, et al. Anti-tumor necrosis factor-alpha blockade improves insulin resistance in patients with rheumatoid arthritis. Clin Exp Rheumatol. 2006; 24(1): 83–6.
Labels
Dermatology & STDs Paediatric rheumatology Physiotherapist, university degree Internal medicine Cardiology Orthopaedics Rheumatology
Article was published inCzech Rheumatology

2017 Issue 4-
All articles in this issue
- Ateroskleróza a kardiovaskulární riziko u pacientů se systémovou sklerodermií
- Kloubní zánět a mikrobi na škále od mikrobiomu po septickou artritidu
- Překryv projevů trombotické trombocytopenické purpury a antifosfolipidového syndromu u pacientky s juvenilním systémovým lupus erythematodes
- Riziko jaterního poškození při léčbě antagonisty tumor nekrotizujícího faktoru
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kloubní zánět a mikrobi na škále od mikrobiomu po septickou artritidu
- Ateroskleróza a kardiovaskulární riziko u pacientů se systémovou sklerodermií
- Riziko jaterního poškození při léčbě antagonisty tumor nekrotizujícího faktoru
- Překryv projevů trombotické trombocytopenické purpury a antifosfolipidového syndromu u pacientky s juvenilním systémovým lupus erythematodes
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

