-
Medical journals
- Career
Doporučení EULAR pro léčbu revmatoidní artritidy - rozdíly mezi verzí 2013 a 2010
Authors: K. Pavelka
Authors‘ workplace: Revmatologický ústav, Praha
Published in: Čes. Revmatol., 22, 2014, No. 2, p. 70-80.
Category: Recommendation
Overview
Evropská liga proti revmatismu (EULAR) jmenovala komisi odborníků (tzv. Task Force), která publikovala novou verzi Doporučení EULAR pro léčbu revmatoidní artritidy (RA).
Metodologie:
Aplikována doporučená metodologie pro tvorbu všech oficiálních doporučení EULAR. Po jmenování komise byla aplikována obecná metodika EULAR používaná při tvorbě oficiálních EULAR doporučení. Byla provedena literární rešerše všech anglických publikací z let 2009–2012, která doplnila původní evidenci z roku 2010. Začleněny byly všechny kvalitní randomizované, kontrolované klinické studie publikované ve formě kompletních prací anebo abstrakt z EULAR kongresů 2012–2013. Na základě evidence byla navržena jednotlivá doporučení, která pak prošla celkem 5 kol tzv. delfské techniky. Finálně byly definovány tři nadřazené principy a celkem 14 doporučení.Výsledky:
Největšími rozdíly mezi novými a starými doporučeními jsou: dosažení stavu nízké aktivity nebo remise po 6 měsících, ale získání alespoň odpovědi na léčbu csDMARDs po 3 měsících, zahájení léčby MTX buď v monoterapii, nebo v kombinaci více csDMARDs (MTX + SAS + HCQ), větší důraz na aplikaci glukokortikoidů u časné RA v kombinaci s MTX (csDMARDs), ale časově omezená aplikace do 6 měsíců, jako první biologický lék po selhání MTX jsou doporučovány jednak inhibitory TNFα, tocilizumab a abatacept, za určitých okolností i rituximab, jsou uvedena biosimilární léčiva jako alternativa – t. č. byl již biosimilární infliximab schválen, je uveden tofacitinib, který se může aplikovat až po selhání nejméně jednoho anti-TNF léku. EMA však v současné době jeho registraci odmítla.Klíčová slova:
revmatoidní artritida, doporučení EULAR, revmatoidní artritida, terapieÚvod
Terapie revmatoidní artritidy (RA) se v posledních 20 letech dramaticky zlepšila. Od pouhé slabě účinné symptomatické léčby jsme se posunuli k léčbě schopné navodit klinickou remisi a zpomalit strukturální progresi RA. Hlavními faktory těchto v pravdě revolučních změn v léčbě byly: zavedení methotrexátu (MTX) a zvláště vysokodávkového MTX jako léku první volby mezi konvenčními syntetickými chorobu modifikujícími léky (tzv. csDMARDs), zavedení dalších csDMARDs (leflunomid), užívání kombinací csDMARDs (např. MTX + sulfasalazin + antimalarika) a zvláště pak zavedení biologických léků (bDMARDs) do léčby RA. Byla provedena řada randomizovaných, dvojslepých studií, které přinášely evidenci o účinnosti jednotlivých léků. Neméně důležité byly i tzv. strategické studie, které se nezabývaly primárně jednotlivými léky, ale spíše strategiemi léčby RA u jednotlivých skupin nemocných a v různých stadiích nemoci.
V množství informací však zůstává řada klinických otázek, porovnávajících účinnost a bezpečnost jednotlivých postupů nejasná. Proto také Evropská liga proti revmatismu (EULAR) vytvořila v roce 2009 komisi (tzv. task force), která by vytvořila doporučení založená na evidenci. Tato doporučení byla publikována v roce 2010 v kmenovém časopise EULAR Annals of Rheumatic Diseases (1) a stala se také zásadní inspirací pro řadu národních doporučení. Nicméně v letech 2010–2013 byly registrovány nové léky, vznikly nové indikace a byly získány nové strategické poznatky, takže vznikla nutnost tato doporučení inovovat. Ostatně již při publikaci doporučení v roce 2010 bylo odhadnuto, že v intervalu 3 let bude nutné doporučení přepracovat. Při získávání evidence pro nové doporučení byly přidány publikace z let 2009–2013 a navíc abstrakta z EULAR 2012 a 2013 a z ACR z roku 2012 (2).
Při tvorbě nových doporučení EULAR byly aplikovány základní principy, které jsou závazné pro všechny dokumenty s oficiálním označením EULAR. Prvním krokem je jmenování tzv. task force. Členy jmenuje komise EULARu pro výzkum a jejími členy jsou respektovaní evropští akademičtí revmatologové, kteří jsou v dané oblasti experti a publikovali originální výzkum. Kromě revmatologů zde bývá epidemiolog, odborník na infekční nemoci či podle obsahu i revmatochirurg a důležitým faktem je i přítomnost představitele pacientské organizace. Zastoupeno bývá 10–15 evropských států z různých regionů tak, aby byly zohledněný i lokální možnosti léčby. Na prvním setkání komise jsou pak vytyčeny cíle, harmonogram práce a jako nejdůležitější bod určeni dva epidemiologové (obvykle studenti Ph.D. programů z renomovaných center), kteří provedou systematický literární přehled o jednotlivých způsobech léčby. Zvažovány jsou pouze publikované, kvalitní randomizované, kontrolované studie, dále metaanalýzy a systematické přehledy publikované v anglicky píšících časopisech v určitém definovaném období. Je tedy získána evidence o účinnosti a bezpečnosti jednotlivých léků ve smyslu medicíny založené na důkazech. Tato evidence je pak předložena všem členům komise. Na základě této evidence pak jednotliví členové navrhují jednotlivá, konkrétní doporučení. Nastává pak další krok v tvorbě doporučení a to je tzv. delfská metodika. V prvním kole bývá kolem 150 různých návrhů, z nichž do druhého kola postoupí návrhy, které se vyskytly nejčastěji. Následuje dalších 4–5 kol, které vyústí ve formulování závěrečných bodů doporučení, kterých bývá 10–15. U každého doporučení je uvedena hladina evidence (A-D) a tzv. síla doporučení (tzv. SOR). To se získává tím, že u každého doporučení experti hodnotí na 10 cm škále svůj souhlas či nesouhlas. Závěrečnou částí je pak setkání expertů a diskuse, sepsání publikace a její připomínkování členy komise. Publikace je pak normálně předložena k posouzení do časopisu EULAR Annals of Rheumatic Diseases. Celkově je možno hodnotit dokument jako primárně založený na evidenci, ale s prvky konsensuálními (tzv. názor expertů).
Zatímco doporučení 2013 obsahují 3 nadřazené principy a 14 doporučení, doporučení 2010 pak rovněž 3 nadřazené principy a 15 doporučení.
Nadřazené principy
- A. Léčba RA musí obsahovat nejlepší péči a musí být založena na sdíleném rozhodnutí mezi lékařem a pacientem. Toto doporučení bylo v identickém znění v původních doporučeních pod písmenem B, ale nyní bylo posunuto pod A, aby se zdůraznila zásadní důležitost (tab. 1). Sdílené rozhodnutí v sobě zahrnuje potřebu informovat pacienta o účincích, ale i rizicích léčby a o cílech léčby, které je žádoucí dosáhnout. Termín „nejlepší péči“ znamená použití principů uvedených v této publikaci.
- B. Revmatologové jsou primární specializací, která pečuje o pacienty s revmatoidní artritidou. Tento bod byl v identickém znění v původních doporučeních pod bodem A.
- C. Revmatoidní artritida vyvolává individuální, společenské a lékařské náklady, které všechny by měly být zváženy ošetřujícím revmatologem. Toto doporučení bylo jen mírně předefinováno oproti verzi z roku 2010. Obsahuje dvě základní roviny. Prvou je konstatování, že RA je nákladná a to nejen svoji léčbou, ale i svými následky pro společnost jako je invalidita, nemocnost, potřeba ortopedických výkonů a řady dalších tzv. nepřímých nákladů. Druhou rovinou je konstatování, že ošetřující lékař by si měl být vědom nákladů na léčbu v jednotlivých případech. Měl by sledovat výsledky farmakoekonomických studií a hledat ekonomicky nejvýhodnější varianty (jako např. přicházející biosimilární léčiva) (3).
Table 1. Aktualizovaná Doporučení EULAR pro léčbu revmatoidní artritidy 2013. 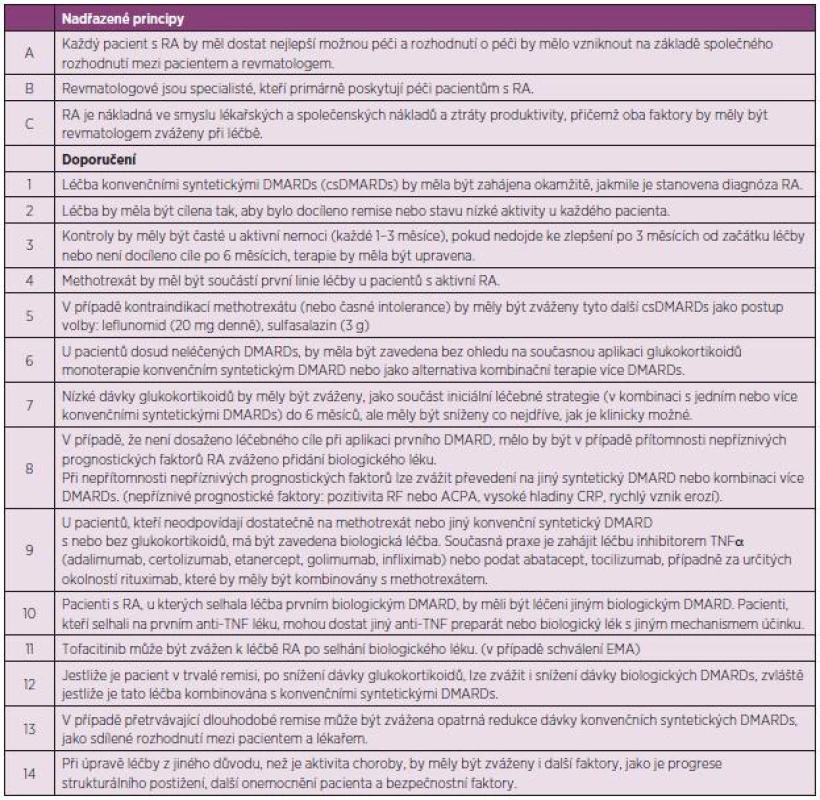
Doporučení
- Léčba csDMARDs by měla být zahájena, jakmile je stanovena diagnóza revmatoidní artritidy. Toto doporučení je téměř identické jako ve verzi z roku 2010. Základním principem je zavedení léčby csDMARDs co nejdříve, neboť i zpoždění několika týdnů může znamenat zhoršení výsledků léčby. Jde o to, jak ale co nejdříve a nejpřesněji diagnostikovat časnou RA. V roce 2010 byla pouze v přípravě nová diagnostická kritéria ACR/ EULAR pro klasifikaci RA, která již byla nyní publikována a existují s nimi již i klinické zkušenosti v klinické praxi (4). Jsou velmi užitečná pro ošetřujícího lékaře k podpoře diagnózy a umožňují nasazení účinné léčby v časnějším průběhu. Stále je ale nutné tato kritéria hodnotit jako klasifikační a nikoliv diagnostická, i když dosavadní zkušenosti z diagnostického procesu jsou pozitivní. Diagnóza u individuálního pacienta v dané fázi vývoje je tedy závislá na rozhodnutí ošetřujícího lékaře po zvážení všech dalších okolností, ale klasifikační kritéria mohou sloužit jako opora diagnózy.
- Cílem léčby je dosažení remise nebo stavu nízké aktivity u každého pacienta. Ve verzi doporučení z roku 2010 byla ještě další část věnovaná monitoringu, ale komise považovala definici cíle léčby za natolik důležitou, že původní doporučení číslo 2 rozdělila do dvou. Komise však také konstatovala, že dosažení stavu nízké aktivity může být pro část pacientů dobrou alternativou, především pak u těch s dlouhotrvající chorobou (obr. 1), kde je šance na dlouhotrvající remisi menší. Stav nízké aktivity je také výhodnější pro zpomalení rentgenové progrese než stav střední nebo vysoké aktivity. I když poněkud horší než remise (5). Komise také doporučuje používat k definici remise nebo stavu nízké aktivity tzv. kompozitní indexy jako je DAS 28 (FW nebo CRP), SDAI, CDAI. V řadě zemí Evropy včetně Česka je nejvíce rozšířené používání DAS 28, kde je remise definována jako hodnota DAS 28 nižší než 2,6 a stav nízké aktivity nižší než 3,2. Remise je však možné definovat i jiným způsobem (tab. 2).
Image 1. Koncept Léčba k cíli 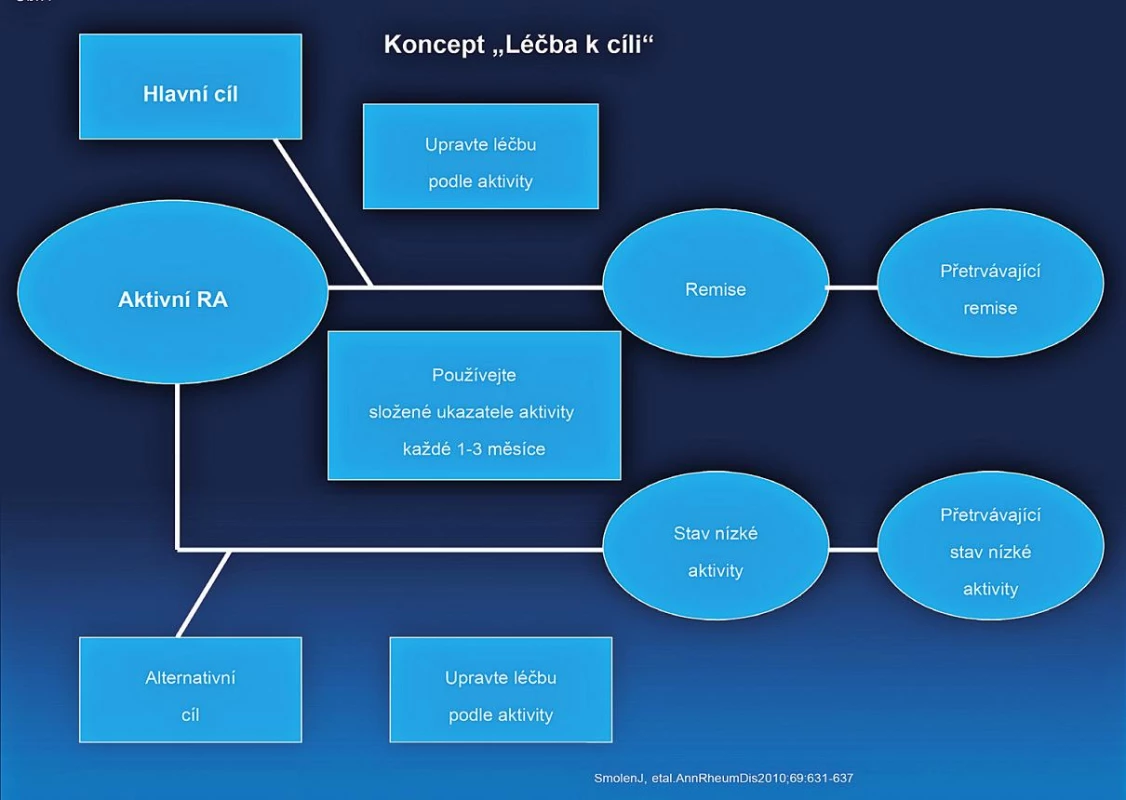
Table 2. Rozsahy aktivity choroby podle nejčastěji používaných kompozitních indexů. 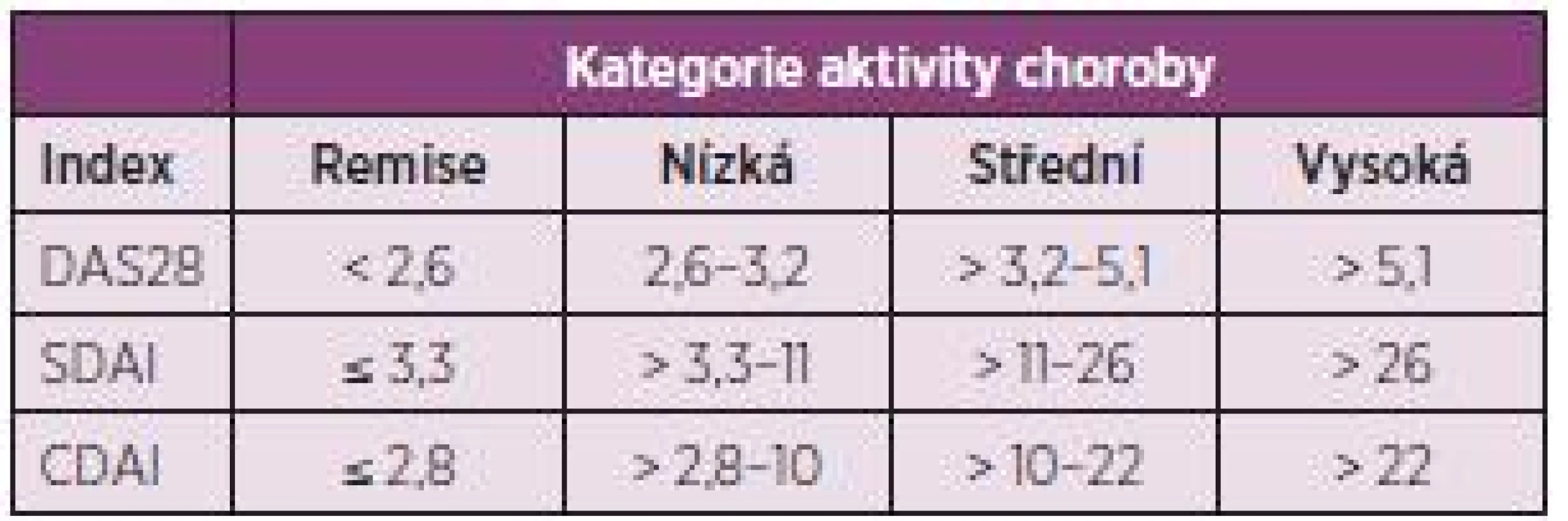
DAS28 se počítá jako: DAS28 = 0,56 x √(TJC28) + 0,28 x √(SJC28) + 0,70 x ln(FW) + 0,014 x GH. TJC28 – počet bolestivých kloubů z 28 kloubů, které zahrnují ramenní, loketní klouby, zápěstí, MCP, PIP klouby rukou a kolena SJC28 – počet oteklých kloubů z 28 FW – sedimentace erytrocytů GH – globální hodnocení aktivity pacientem SDAI = SJC28+TJC28+hodnocení aktivity hodnotitelem+GH+CRP CDAI = SJC28+TJC28+hodnocení aktivity hodnotitelem+GH Hodnocení aktivity hodnotitelem (lékař, sestra) a pacientem (GH) se provádí na 10 cm vizuální analogové škále - Kontroly pacienta by měly být častější u aktivního onemocnění (každé 1–3 měsíce). Jestliže nebylo patrné zlepšení po 3 měsících nebo nebylo cíle dosaženo po 6 měsících, léčba by měla být upravena. Ve verzi z roku 2010 bylo uváděno, že cíle (remise, stavu nízké aktivity) má být dosaženo již po 3 měsících. Nová doporučení se jasně liší, protože požadují dosažení cíle léčby až po 6 měsících, po 3 měsících postačí průkaz odpovědi (zlepšení). Jestliže není po 3 měsících dosaženo alespoň zlepšení, není dosažení cíle v dalším průběhu léčby pravděpodobné a to platí pro všechny typy léčby včetně biologickými DMARDs. Co se myslí úpravou léčby? Může to být zvýšení dávky MTX, změna syntetického csDMARD, kombinace více csDMARDs, použití glukokortikoidů nebo aplikace biologického DMARD. Po dosažení stavu nízké aktivity nebo remise je možné provádět kontroly pacienta jednou za 6–12 měsíců.
- MTX by měl být součástí první léčebné strategie u všech pacientů s aktivní RA. Toto doporučení zůstalo beze změny (ve verzi z roku 2010 bylo pod 3). Komise byla znovu ujištěna o vysoké účinnosti MTX v nedávno dokončeném systematickém přehledu (6). MTX je účinný v monoterapii, v kombinaci s ostatními syntetickými i biologickými DMARDs a s glukokortikoidy a je i nadále tzv. kotevním lékem při léčbě aktivní RA. U pacientů dosud neléčených csDMARDs je dosaženo stavu nízké aktivity (nebo zlepšení ACR 70) u 25–50 % pacientů za 6–12 měsíců. Pacienti by měli dostávat MTX v monoterapii nebo v kombinaci s glukokortikoidy v dostatečné dávce, než se přikročí k více intenzívním způsobům léčby. Optimální stabilní dávka je 25–30 mg týdně s povinnou substitucí foláty. Optimální efekt MTX je dosažen za 5–6 měsíců, s předpokladem minimálně 8 týdnů trvající stabilní léčby.
- V případě kontraindikací léčby MTX (nebo časné intolerance), sulfasalazin nebo leflunomid mohou být považovány za součást (první) léčebné strategie. Ve verzi doporučení z roku 2010 byly tyto léky uváděny, takže jde jen o posun (dříve doporučení 4), v nových doporučeních již není uváděno injekční zlato, které je pouze v textu. Sulfasalazin (SAS) i leflunomid byly ve studiích stejně účinné jako MTX, i když pravděpodobně nebyly používány optimální dávky MTX. SAS a leflunomid mají také určitý vliv na rentgenovou progresi a jsou úspěšně požívány v kombinaci s biologickými DMARDs (7). Optimální terapeutická dávka sulfasalazinu jsou 3 g ve formě tzv. enterosolventních tablet a obvyklá dávka leflunomidu je 20 mg denně. SAS je také možné podávat bezpečně v těhotenství. Předcházející doporučení také uvádělo v tabulce použití injekčního zlata, protože byla dostupná randomizovaná, kontrolovaná studie. Komise nezpochybňuje důkazy o účinnosti injekčního zlata, nicméně konstatuje, že zlato se používá velmi málo a v některých státech není dokonce ani dostupné. Komise také uvádí, že má určité pochybnosti o bezpečnosti léčby solemi zlata. Od staršího systematického přehledu, který sloužil pro rozhodování komise v roce 2009, také nebyla žádná další studie ani přehledná práce provedena. V textu jsou uváděna také antimalarika (chlorochin a hydroxychlorichin). V monoterapii jsou doporučována pouze u velmi mírně aktivních forem RA. Velmi se osvědčují v kombinacích s ostatními syntetickými csDMARDs, především v trojkombinaci s MTX a SAS. Antimalarika mají také řadu dalších příznivých metabolických efektů a mohou být podávána v těhotenství. Nemají však zpomalující vliv na rtg progresi.
- U pacientů, dosud neléčených csDMARDs, nezávisle na tom, zdali jsou aplikovány glukokortikoidy, by měla být zahájena léčba jedním konvenčním syntetickým DMARD nebo kombinací více konvenčních syntetických DMARDs. U tohoto doporučení byla provedena jedna zásadní změna, která může mít vliv na širší klinickou praxi. V původních doporučeních bylo uvedeno, že u nově léčených pacientů zahajujeme léčbu jedním syntetickým csDMARDs (zpravidla methotrexát) a toto doporučení bylo odvozeno od v té době dostupné evidence, která neukazovala, že by kombinace více csDMARDs byla účinnější než monoterapie MTX u těchto pacientů (8). Nicméně v období 2009–2012 bylo provedeno několik studií, které naznačují, že kombinace více konvenčních syntetických DMARDs může být účinnější než monoterapie MTX (obr. 2) (9) a že dokonce může být srovnatelně účinná s biologickými DMARDs (10). U některých těchto studií je ale diskutována metodika provedení. Není zpochybňována účinnost sekvenčního přidání dalšího syntetického konvenčního DMARDs k MTX (tzv. step up). U nově léčených pacientů jsou uváděny obě možné alternativy (monoterapie MTX nebo kombinace MTX s dalším csDMARD). Nutno zdůraznit, že všechny pozitivní zkušenosti s kombinacemi více syntetických DMARDs byly získány, pokud byl součástí této kombinace methotrexát.
Image 2. Srovnání účinnosti iniciální léčby RA kombinací více DMARDs a MTX (studiet REACH). 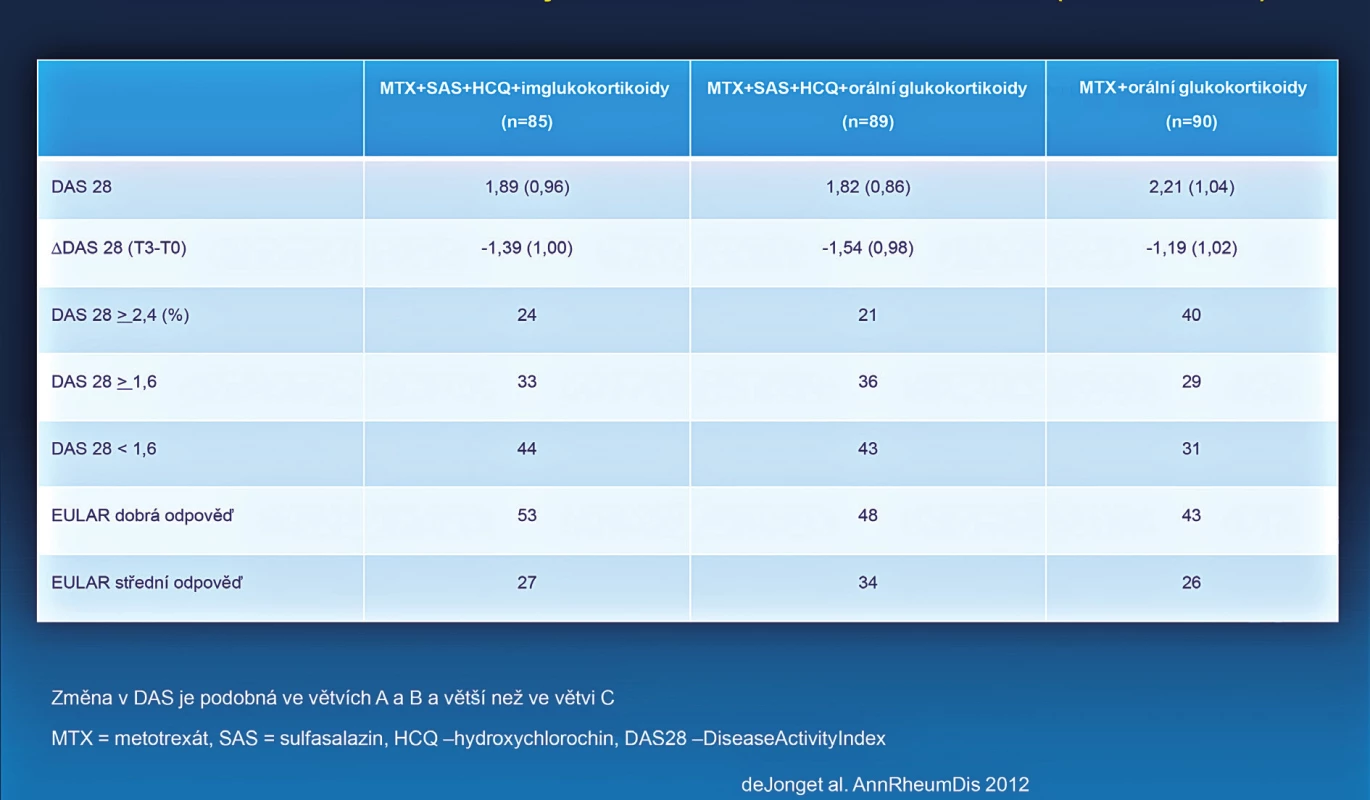
- Glukokortikoidy v nízkých dávkách by měly být zváženy jako součást iniciální léčebné strategie (v kombinaci s jedním nebo více konvenčními syntetickými DMARDs) po dobu 6 měsíců, ale měly by být vysazeny co nejdříve, jak je to klinicky možné. Doporučení pro použití glukokortikoidů u časných pacientů v kombinaci bylo již uvedeno v předcházejících doporučeních, ale nyní je silnější. Zatímco v dřívější verzi „mohlo“ být použití glukokortikoidů uváženo, v nynějším doporučení by „mělo“ být jejich užití zváženo. Silnější doporučení se opírá o nové studie, které ukazují určitý synergismus účinku mezi glukokortikoidy a MTX v kombinaci oproti monoterapii MTX u pacientů dosud neléčených csDMARDs (11). V žádném případě však není u RA doporučována monoterapie glukokortikoidy. V pracovní skupině byla také vedena velká diskuse o nežádoucích účincích glukokortikoidů a tudíž o celkovém poměru benefitu a rizika. Tato diskuse také vedla k formulaci, že léčba glukokortikoidy by měla být ukončena do 6 měsíců. V předcházejících doporučeních délka léčby specifikována nebyla. Je nutné také poukázat na doporučení pro prevenci glukokortikoidy indukované osteoporózy (12). Při aplikaci glukokortikoidů delší než 3 měsíce v dávce vyšší než 5 mg prednisonu nebo jeho ekvivalentu denně by měla být aplikována preventivní opatření ve formě podávání kalcia a vitaminu D.
- Pokud není při aplikaci první léčebné strategie konvenčními syntetickými DMARDs dosaženo terapeutického cíle, měla by se další léčba řídit přítomností či nepřítomností nepříznivých prognostických faktorů onemocnění. V případě jejich přítomnosti by se měl přidat k léčbě biologický DMARD, v případě jejich nepřítomnosti lze užít další csDMARDs do kombinace. Nové znění je téměř identické s původním, ale podstatné změny jsou v průvodním textu. Co se nezměnilo, je definice tzv. nepříznivých prognostických faktorů RA. Konkrétně se uvádí v klinické praxi aplikovatelné ukazatele: vysoká klinická aktivita, pozitivita revmatoidních faktorů nebo ACPA protilátek a dále rychlý vznik erozivních změna na rtg. Dalším bodem, který se nezměnil, je definice léčebného cíle, kterým je dosažení klinické remise nebo u pacientů s dlouhotrvající RA pak alespoň stavu nízké aktivity. EULAR doporučení nestanovuje přesně, jaký ukazatel pro stanovení remise se má používat. Měl by to být ale být jeden z validizovaných kompozitních ukazatelů jako je DAS 28 (verze CRP nebo FW), SDAI nebo CDAI (viz výše). Podle nových doporučení má být cíle léčby dosaženo po 6 měsících a po 3 měsících stačí získat alespoň odpověď na léčbu. U aktivních pacientů, kteří selhávají na léčbě MTX, se jednoznačně doporučovalo použít anti-TNF lék, když řada randomizovaných klinických studií prokázala lepší účinnost kombinace MTX (nebo dalších csDMARDs) s anti-TNF preparátem než monoterapie MTX (nebo csDMARDs). Nicméně v poslední době byly provedeny některé nové studie, které ukázaly podobnou účinnost trojkombinace MTX + sulfasalazin + antimalarika jako kombinace MTX + infliximab (13), nebo stejné trojkombinace jako MTX + etanercept (10). Tyto studie však měly řadu metodologických problémů a jejich výsledky je nutné ověřit v dalších studiích. Navíc kombinace MTX + anti-TNF měla větší vliv na rentgenovou progresi než trojkombinace syntetických DMARDs.
- U pacientů s nedostatečnou odpovědí na léčbu MTX (nebo alternativními csDMARDs) v kombinaci s glukokortikoidy nebo bez glukokortikoidů je doporučeno použít biologický DMARD (inhibitory TNFα, abatacept nebo tocilizumab a za určitých okolností rituximab) v kombinaci s MTX. Toto doporučení se značně odlišuje od původního. Ve verzi z roku 2010 byly v první linii biologické léčby doporučovány pouze anti-TNF léky. Abatacept a tocilizumab (TCZ) byly doporučeny do první linie na úroveň inhibitorů TNFα na základě úspěšných studií v indikaci MTX selhávajících pacientů (14, 15), dále na základě získání mnohem větší evidence o bezpečnosti z registrů a observačních studií a na základě změny licence v SPC léku. Dále bylo konstatováno, že nejsou k dispozici žádná data, která by upřednostňovala některý biologický DMARD před druhým. Rituximab může být rovněž za určitých okolností použit i jako biologický DMARDs první linie. Těmito okolnostmi se míní přítomnost lymfomu nebo malignity v anamnéze, vaskulitida nebo latentní tuberkulóza a nemožnost aplikovat profylaktický režim antituberkulotiky. Protože většina studií ukazuje lepší účinnost kombinace bDMARDs s MTX je tato kombinace preferována oproti monoterapii biologickým DMARD. Pokud není možné aplikovat MTX (nebo jiný csDMARD) a je nutné aplikovat biologický DMARD v monoterapii, je preferován tocilizumab, který má jediný data o tom, že monoterapie TCZ je stejně účinná jako kombinace TCZ s MTX (16). Dalším novým prvkem v tomto doporučení je uvedení biosimilárních léčiv jako možné alternativy aplikace biologických DMARDs. Konkrétně se jedná o CTP-13 (Remsima a Inflectra, obsahující biosimilárnír infliximab). Randomizovaná kontrolovaná studie (PLANETRA) ukázala stejnou účinnost biosimilárního infliximabu (Remsima) jako u originálního infliximabu (3). V době publikace těchto doporučení byl CTP-13 ve schvalovacím řízení EMA a proto bylo doporučení podmíněno schválením EMA, které bylo získáno v říjnu 2013. Komise konstatovala, že biologické léky jsou drahé a zlevnění, které přinášejí biosimilární léky, je vítané a umožní léčit více pacientů s RA biologickými DMARDs. Na druhé straně je konstatováno, že biosimilární léčiva nejsou identické léky jako originální biologické DMARDs a při jejich aplikaci je nutné organizovat pečlivý farmakovigilační program k získání potřebných dat o jejich bezpečnosti. Především nejsou v tuto chvíli k dispozici data o potenciální imunogenitě při záměně originálního biologického léku za biosimilární, a proto tento postup není možné doporučit.
- Pacienti, kteří selhali na prvním biologickém léku, by měli být léčeni jiným biologickým lékem, pacienti, kteří selhali na prvním anti-TNF léku, by měli být léčeni jiným inhibitorem TNFα anebo biologickým DMARD s jiným mechanismem účinku. U tohoto doporučení je oproti starší verzi jen slovně malá, ale významově větší změna. Ve starší verzi bylo uvedeno, že pacient po selhání anti-TNF léčby, může dostat další anti-TNF preparát nebo abatacept, tocilizumab nebo rituximab (příklad – po selhání infliximabu může být aplikován buď etanercept, nebo rituximab či abatacept nebo tocilizumab). Nová verze již říká, že po selhání prvního biologického léku je možné aplikovat biologický lék s jiným mechanismem účinku (příklad po selhání anti-TNF preparátu nebo např. tocilizumabu může být rovnou užit preparát s jiným mechanismem účinku). Pro proces změny léčby biologickým lékem se vžívá anglický výraz switching. Je opět zdůrazněno, že nejsou k dispozici data, která by podporovala použití druhého anti-TNF nebo biologika s jiným mechanismem účinku. Zdůrazněno je opět, že při aplikaci biosimilárního infliximabu nemůže být hovořeno jako o dalším anti-TNF preparátu.
- Tofacitinib může být zvážen poté, co selhala léčba biologickým DMARD. Toto doporučení bylo přijato v dubnu 2013. V té době byl tofacitinib schválen pro léčbu RA v USA, Japonsku a v Rusku. Komise EULAR uznala, že tofacitinib prokázal svoji účinnost a bezpečnost u RA v řadě klinických studií. Bylo také konstatováno, že strukturální efekt byl prokázán pouze při dávce 10 mg denně a nikoliv při schválené dávce 5 mg. Bylo také konstatováno, že bezpečnostní data z dlouhodobé léčby nejsou zatím dostatečná. Byl také zaznamenán zvýšený počet závažných infekcí, především infekcí herpes zoster (17), bylo zaznamenáno několik případů tuberkulózy, lymfocytopenie a zdálo se průkazné, že hladiny hemoglobinu se méně často zvyšují při podobném zlepšení dosaženém při aplikaci csDMARDs a bDMARDs. Proto také komise doporučila, aby tofacitinib byl aplikován až po selhání léčby nejméně jedním bDMARD. Po přijetí tohoto doporučení však přišlo rozhodnutí EMA, která zatím tofacitinib neschválila a vyžádala si další bezpečnostní data. Nicméně toto doporučení zůstalo v publikaci, protože EULAR doporučení má globální charakter (nikoliv pouze pro EU), a proto platí i pro země, kde je tofacitinib schválen. Bylo také konstatováno, že cena, za kterou se tofacitinib prodává v USA, je příliš vysoká.
- Jestliže je dosaženo dlouhodobé remise, po vysazení léčby glukokortikoidy, je možné uvažovat o vysazení biologického DMARD, zvláště pokud je tato léčba kombinována s léčbou konvenčními syntetickými csDMARDs. Toto doporučení se prakticky proti starší verzi nezměnilo, ale nyní je podpořeno mnohem více evidencí z klinických studií. Např. ve studii OPTIMA bylo prokázáno, že po časné indukční léčbě anti-TNF plus MTX je po dosažení stavu nízké aktivity či remise je možné tento stav udržet u většiny pacientů i po vysazení anti-TNF léku (18). Toto platí především při velmi brzkém nasazení anti-TNF plus MTX u časné RA. U dlouhotrvající RA je udržení stavu nízké aktivity či remise obtížnější a je především možné při dosažení hluboké a protrahované remise. Jinou alternativou může být nikoliv vysazení anti-TNF, ale pokračování v redukovaných dávkách. Ve studii PRESERVE po dosažení remise byli pacienti randomizováni do skupin placebo, etanercept 50 mg a 25 mg (19). Zatímco po placebu většina pacientů exacerbovala, normální i redukované dávky etanerceptu byly schopné remisi udržet. Po vzplanutí léčby byl etanercept znovu nasazen a u většiny pacientů bylo možné opět docílit žádoucí odpovědi.
- V případě dlouhotrvající remise, opatrná redukce syntetických konvenčních DMARDs je možná, jako sdílené rozhodnutí mezi lékařem a pacientem. V tomto doporučení byla provedena nepatrná změna, když místo slova „titrace“ syntetických DMARDs bylo použito slovo „redukce“. Toto doporučení se týká pacientů, kteří měli již vysazené glukokortikoidy a případně i biologické DMARDs a jsou stále ve stavu nízké aktivity nebo remise. S pacientem je nutné vysazení MTX ev. dalších csDMARDs diskutovat, protože při jejich vysazení dochází ke vzplanutí nemoci až v 70 %, což je dvakrát častější než při pokračování v léčbě csDMARDs. Zdá se tedy, že nejvýhodnější je praxe pokračování v léčbě csDMARDs např. v redukované dávce. Udržení remise i bez léčby (tzv. drug free remission) je sice optimálním stavem, který je však reálný jen u části pacientů, především s velmi časně zahájenou léčbou.
- Při adjustaci léčby by se kromě ukazatelů aktivity měly hodnotit i další ukazatele jako je strukturální progrese, komorbidity a bezpečnostní ukazatele. Toto doporučení se prakticky nezměnilo. V prvé části se říká, že aktivita nemoci a komorbidity spolu nemusí vždy korelovat a i pacienti s nízkou aktivitou mohou mít závažné komorbidity kardiovaskulární, osteoporózu atd. Hodnocení strukturální progrese je rovněž důležité, protože někteří pacienti mohou i ve stavu nízké aktivity významně rentgenově progredovat a následně se i funkčně zhoršovat.
Table 3. ACR / EULAR definice remise u revmatoidní artritidy v klinických studiích (20). 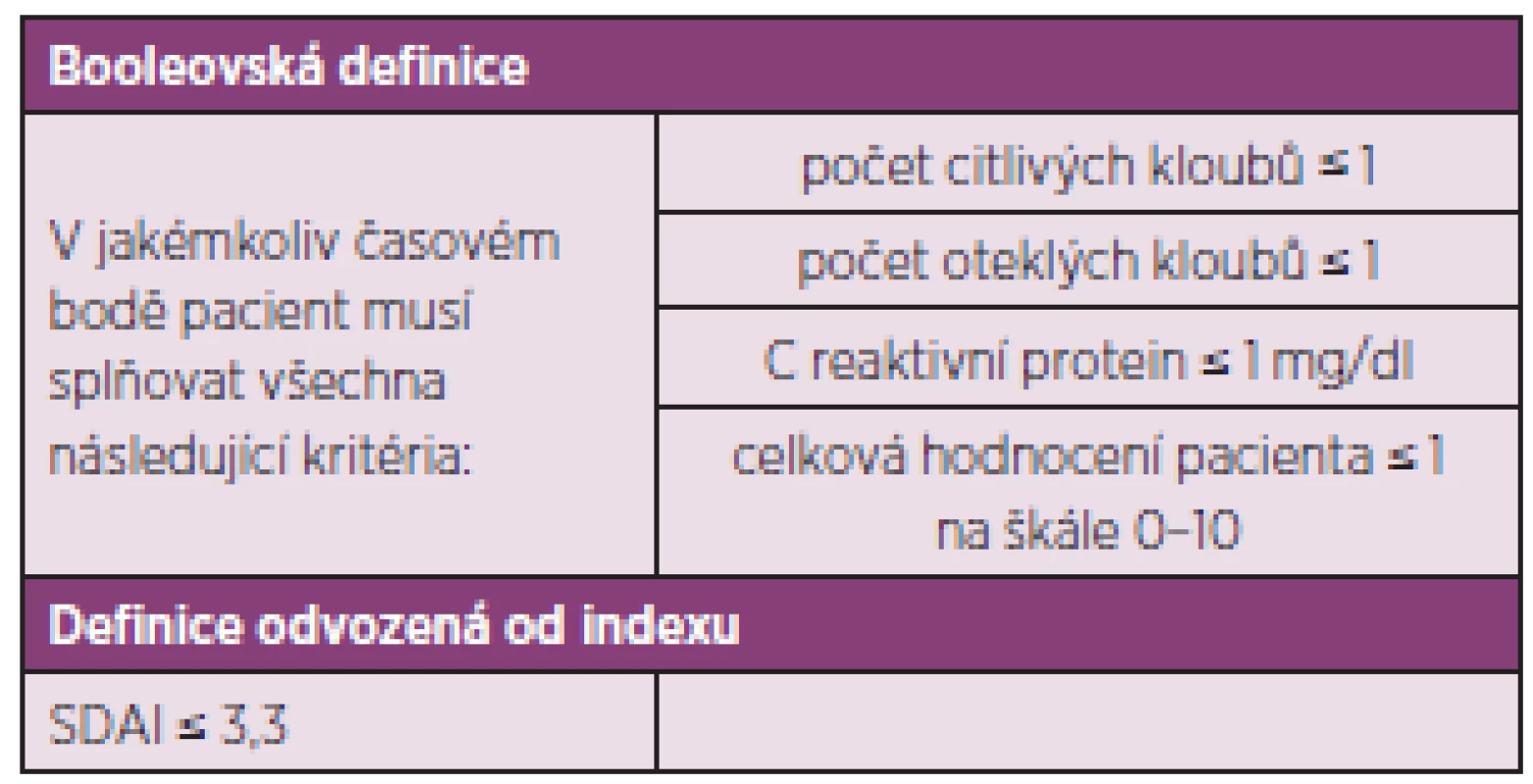
Závěr
Byla vytvořena nová EULAR doporučení pro léčbu revmatoidní artritidy. Schématicky lze léčbu RA rozdělit do tří strategií (studií) (obr. 3, 4, 5). Jako nejdůležitější nové klinické aspekty lze uvést:
- a) Dosažení stavu nízké aktivity nebo remise po 6 měsících, ale získání alespoň odpovědi na léčbu csDMARDs po 3 měsících.
- b) Zahájení léčby MTX buď v monoterapii, nebo v kombinaci více csDMARDs (MTX + SAS + HCQ).
- c) Větší důraz na aplikaci glukokortikoidů u časné RA v kombinaci s MTX (csDMARDs), ale časově omezená aplikace do 6 měsíců.
- d) Jako první biologický lék po selhání MTX jsou doporučovány jednak inhibitory TNFα, tocilizumab a abatacept, za určitých okolností i rituximab.
- e) Jsou uvedena biosimilární léčiva jako alternativa – tč. je již biosimilární infliximab schválen.
- f) Je uveden tofacitinib, který se může aplikovat až po selhání nejméně jednoho anti-TNF léku. EMA v současné době jeho registraci odmítla.
Image 3. EULAR doporučený algoritmus léčby RA. 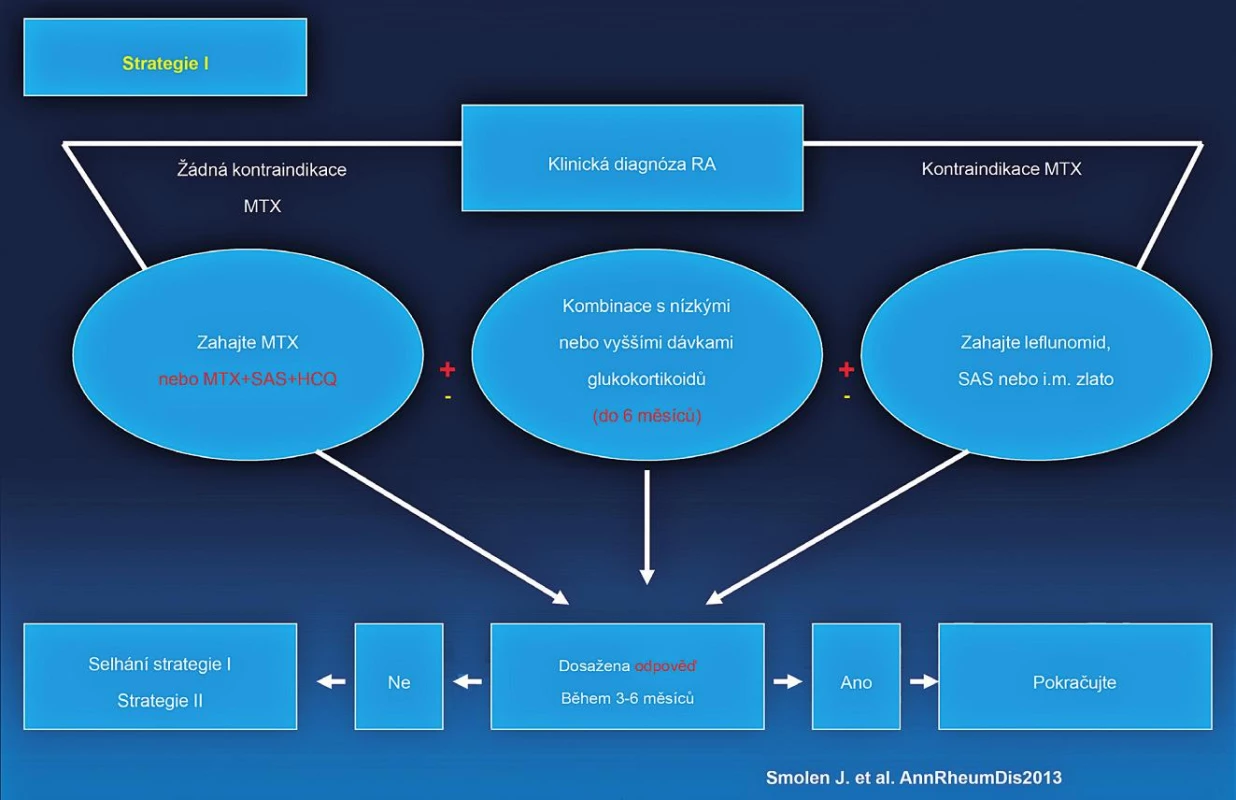
Image 4. EULAR doporučený algoritmus léčby RA. 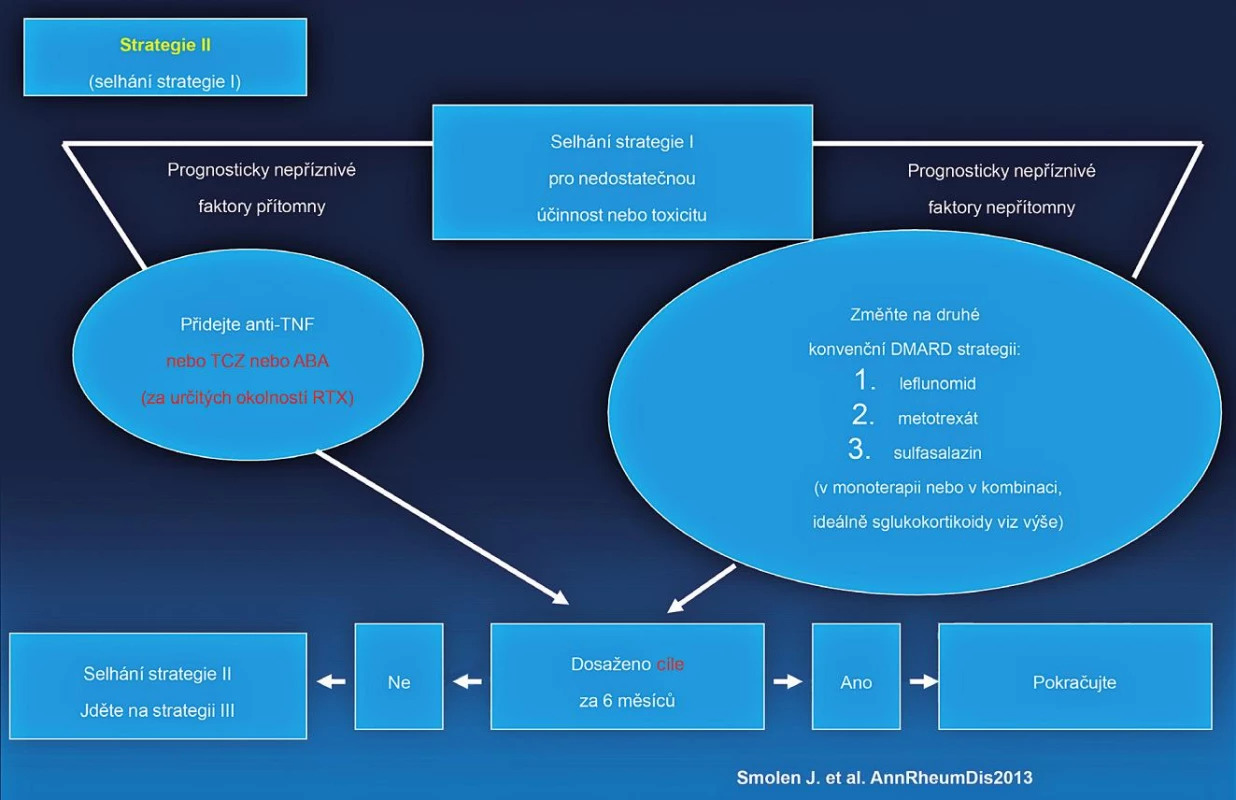
Image 5. EULAR doporučený algoritmus léčby RA. 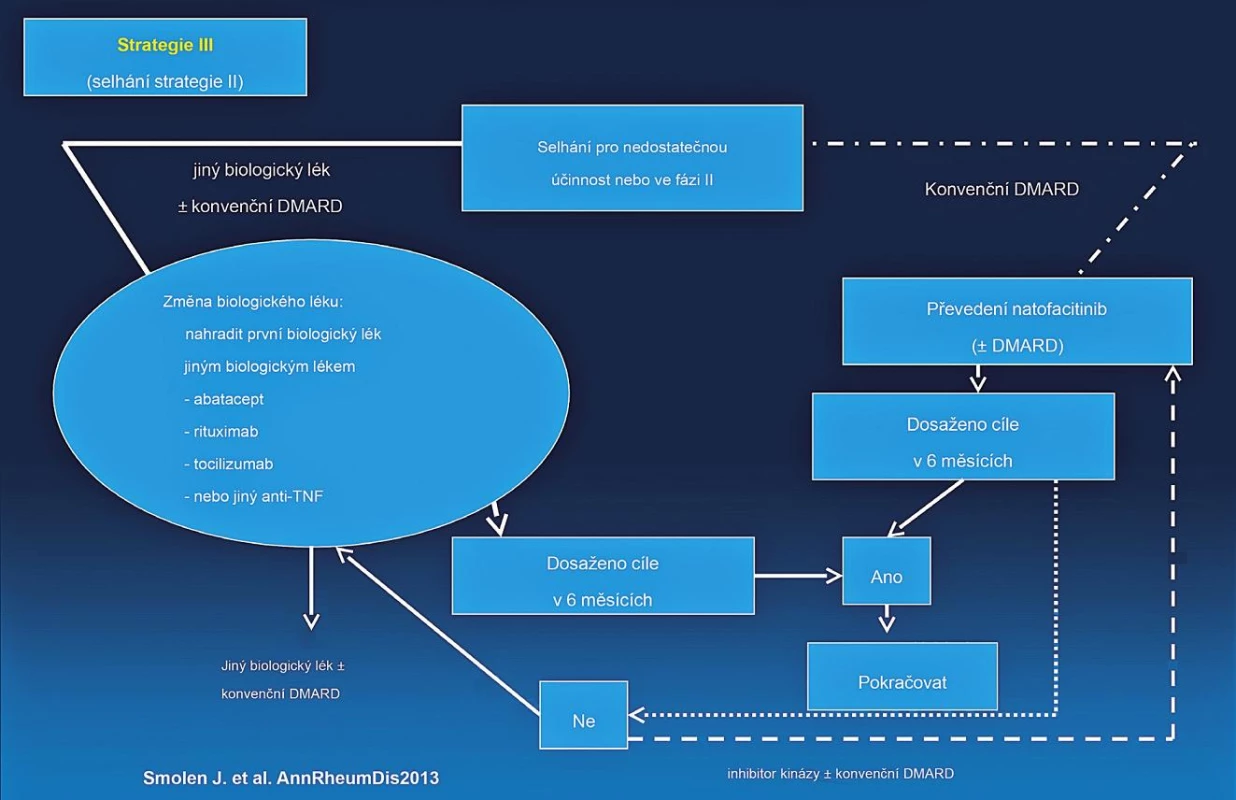
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 023728 (Revmatologický ústav)
Adresa pro korespondenci:
Prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav a 1. lékařská fakulta UK
Na Slupi 4
128 50 Praha
tel. 234 075 244
e-mail: pavelka@revma.cz
Sources
1. Smolen JS, Landewé R, Breedveld FC, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis 2013; doi:10.1136/annrheumdis-2013-204573.
2. Smolen JS, Landewe R, Breedveld FC, Dougados M, Emery P, Gaujoux-Viala C et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis 2010; 69(6): 964–975.
3. Yoo DH, Hrycaj P, Miranda P, Ramiterre E, Piotrowski M, Shevchuk S et al. A randomised, double-blind, parallel-group study to demonstrate equivalence in efficacy and safety of CT-P13 compared with innovator infliximab when coadministered with methotrexate in patients with active rheumatoid arthritis: the PLANETRA study. Ann Rheum Dis 2013;72(10): 1613–20.
4. Radner H, Neogi T, Smolen JS, Aletaha D. Performance of the 2010 ACR/EULAR classification criteria for rheumatoid arthritis: a systematic literature review. Ann Rheum Dis 2013, v tisku.
5. Klarenbeek NB, Koevoets R, Van der Heijde DM, Gerards AH, Ten WS, Kerstens PJ et al. Association with joint damage and physical functioning of nine composite indices and the 2011 ACR/EULAR remission criteria in rheumatoid arthritis. Ann Rheum Dis 2011; 70(10): 1815–1821.
6. Gaujoux-Viala C, Gossec L, et al. Efficacy of conventional synthetic DMARDs, glucocorticoids and tofacitinib - a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2013; submitted.
7. Sharp JT, Strand V, Leung H, Hurley F, Loew-Friedrich I. Treatment with leflunomide slows radiographic progression of rheumatoid arthritis. Results from three randomized controlled trials of leflunomide in patients with active rheumatoid arthritis. Arthritis Rheum 2000; 43 : 495–505.
8. Katchamart W, Trudeau J, Phumethum V, Bombardier C. Efficacy and toxicity of methotrexate (MTX) monotherapy versus MTX combination therapy with non-biological disease-modifying antirheumatic drugs in rheumatoid arthritis: a systematic review and meta-analysis. Ann Rheum Dis 2009; 68(7): 1105–1112.
9. de Jong PH, Hazes JM, Barendregt PJ, Huisman M, van ZD, van der Lubbe PA et al. Induction therapy with a combination of DMARDs is better than methotrexate monotherapy: first results of the tREACH trial. Ann Rheum Dis 2013; 72(1): 72–78.
10. Moreland LW, O'Dell JR, Paulus HE, Curtis JR, Bathon JM, St Clair EW et al. A randomized comparative effectiveness study of oral triple therapy versus etanercept plus methotrexate in early aggressive rheumatoid arthritis: the treatment of Early Aggressive Rheumatoid Arthritis Trial. Arthritis Rheum 2012; 64(9): 2824–2835.
11. Bakker MF, Jacobs JW, Welsing PM, Verstappen SM, Tekstra J, Ton E et al. Low-Dose Prednisone Inclusion in a Methotrexate-Based, Tight Control Strategy for Early Rheumatoid Arthritis: A Randomized Trial. Ann Intern Med 2012; 156(5): 329–339.
12. Canalis E, Mazziotti G, Giustina A, Bilezikian JP: (2007) Glucocorticoid-induced osteoporosis: pathophysiology and therapy. Osteoporos Int 18 : 1319–1328.
13. van Vollenhoven RF, Geborek P, Forslind K, Albertsson K, Ernestam S, Petersson IF et al. Conventional combination treatment versus biological treatment in methotrexate-refractory early rheumatoid arthritis: 2 year follow-up of the randomised, non-blinded, parallel-group Swefot trial. Lancet 2012; 379(9827): 1712–20.
14. Genovese MC, McKay JD, Nasonov EL et al. Interleukin-6 receptor inhibition with tocilizumab reduces disease activity in rheumatoid arthritis with inadequate response to disease-modifying antirheumatic drugs: the tocilizumab in combination with traditional disease-modifying antirheumatic drug therapy study. Arthritis Rheum. 2008; 58 : 2968–80.
15. Schiff M, Keiserman M, Codding C et al. Efficacy and safety of abatacept or infliximab vs placebo in ATTEST: a phase III, multi-centre, randomised, double-blind, placebo-controlled study in patients with rheumatoid arthritis and an inadequate response to methotrexate. Ann Rheum Dis 2008; 67 : 1096–103.
16. Gabay C, Emery P, van VR, Dikranian A, Alten R, Pavelka K et al. Tocilizumab monotherapy versus adalimumab monotherapy for treatment of rheumatoid arthritis (ADACTA): a randomised, double-blind, controlled phase 4 trial. Lancet 2013; 381(9877): 1541–1550.
17. van Vollenhoven RF, Fleischmann R, Cohen S, Lee EB, Garcia Meijide JA, Wagner S et al. Tofacitinib or adalimumab versus placebo in rheumatoid arthritis. N Engl J Med 2012; 367(6): 508–519.
18. Kavanaugh A, Emery P, Felischmann RM, et al.: Withrawal of adalimumab in early rheumatoid arthritis patients who attained stable low disease activity with adalimumab plus methotrexate: esults of a phase 4, double-blind, placebo-controlled trial. Rheumatology (Oxford) 2012; 51 (Suppl 3): iii27.
19. Smolen JS, Nash P, Durez P, Hall S, Ilivanova E, Irazoque-Palazuelos F et al. Maintenance, reduction, or withdrawal of etanercept after treatment with etanercept and methotrexate in patients with moderate rheumatoid arthritis (PRESERVE): a randomised controlled trial. Lancet 2013; 381(9870): 918–929.
20. Felson DT, Smolen JS, Wells G et al. American College of Rheumatology/European League Against Rheumatism Provisional Definition of Remission in Rheumatoid Arthritis for Clinical Trials. Ann Rheum Dis 2011; 70 : 404–413.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2014 Issue 2-
All articles in this issue
- Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie
- Doporučení EULAR pro léčbu revmatoidní artritidy - rozdíly mezi verzí 2013 a 2010
- Metatarzalgie u pacientů s revmatoidní artritidou
- 18F-FDG PET a PET/CT vyšetření u pacientů s obrovskobuněčnou arteritidou – praktický pohled z PET centra
- Periferní ulcerózní keratitida – závažná komplikace revmatoidní artritidy
- Myozitida s inkluzními tělísky asociovaná s revmatoidní artritidou – kazuistika
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metatarzalgie u pacientů s revmatoidní artritidou
- Periferní ulcerózní keratitida – závažná komplikace revmatoidní artritidy
- Doporučení České revmatologické společnosti pro diagnostiku systémové sklerodermie
- 18F-FDG PET a PET/CT vyšetření u pacientů s obrovskobuněčnou arteritidou – praktický pohled z PET centra
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

