-
Medical journals
- Career
Stroncium ranelát nemá při léčení osteoporózy osteoanabolické (duální) účinky
: J. Štěpán
: Revmatologický ústav a 1. lékařská fakulta UK, Praha
: Čes. Revmatol., 22, 2014, No. 1, p. 18-24.
: Comments
Registrační studie SrR u žen s postmenopauzální osteoporózou i u mužů prokázaly významné zvýšení BMD v bederní páteři i v proximálním femuru a snížení relativního rizika zlomenin obratlů a neobratlových zlomenin. Stroncium uložené v kostech však absorbuje rentgenové záření více než vápník a výpověď osteodenzitometrie nekontrolovaně nadhodnocuje. Osteoanabolický, resp. duální účinek SrR nebyl prokázán ani při hodnocení biochemických markerů kostní remodelace, ani v histomorfometrických studiích kostních biopsií u žen s postmenopauzální osteoporózou, léčených doporučenými dávkami SrR. Experimentálně i klinicky dokumentovaný mírný útlum osteoresorpce při léčbě SrR se vysvětluje účinkem stroncia (podobně jako kalcia) na calcium-sensing receptor osteoklastů a osteocytů, ale také příštítných tělísek. Ověření vyžaduje hypotéza, že zvýšení mechanické síly kostní hmoty může být asociováno s převahou distribuce stroncia na kostních površích v nově vytvořených paketech kosti. Stroncium ranelát je tedy lékem s prokázanou účinností na riziko zlomenin, ale mechanismus těchto účinků dosud nebyl jednoznačně objasněn a vyžaduje další studie. Znalost mechanismů účinků stroncium ranelátu (SrR) je důležitá nejen pro vysvětlení účinků SrR na skelet, ale také pro bezpečnost léčby pro jiné tkáně.
Klíčová slova:
Osteoporóza kostního minerálu, duální účinky, stroncium ranelátStroncium ranelát (ATC skupina M05BX03) je v České republice registrován k léčbě osteoporózy prokázané pomocí dvouenergiové rentgenové absorpciometrie (DXA) při hodnotě denzity kostního minerálu (BMD) ≤ -2,5 T-skóre na standardních místech skeletu u žen po menopauze a u mužů, pokud již došlo k nízkotraumatické zlomenině, nebo při kontraindikaci bisfosfonátů či raloxifenu, nebo při nesnášenlivosti jiných antiresorpčních léčiv, nebo při projevech závažných nežádoucích účinků na této léčbě (1). Indikace SrR vycházejí z výsledků o snížení rizika nízkotraumatických zlomenin ve dvou registračních studiích u žen s postmenopauzální osteoporózou a v jedné studii u mužů. V první studii (SOTI, 1649 žen, věk 69 ± 4 let) byly sledovány ženy, které již dříve prodělaly zlomeninu obratle (v průměru dvakrát), třetina žen již dříve prodělala neobratlovou zlomeninu. Během tří let došlo k nové zlomenině obratle významně méně často u žen užívajících SrR (20,9 %), než u žen užívajících placebo (32,8 %) (2). Studie tedy prokázala snížení relativního rizika zlomenin obratle o 41 %, (95% CI 0,48–0,73, p < 0,001). Také v další studii (TROPOS, 4 932 žen, věk 77 ± 5 let, 71 % žen s prodělanou zlomeninou obratle) bylo během 3 let sledování procento žen s novou zlomeninou obratle významně nižší (o 39 %), než u žen užívajících placebo (3). Studie také prokázala snížení relativního rizika neobratlových zlomenin obratle o 16 %, (95% CI 0,70–0,995, p = 0,04). Riziko zlomenin proximálního femuru se významně nesnížilo. Dodatečná analýza ukázala, že pokud se hodnotily jen výsledky u vybrané skupiny žen ve věku ≥ 74 let, které už prodělaly neobratlovou zlomenou a měly velmi nízkou hodnotu BMD v krčku femuru (≤ 3 SD, resp. < -2,4 SD po dalším přepočtu podle NHANES III), bylo při užívání SrR relativní riziko těchto zlomenin hraničně nižší, než v placebové skupině (RR = 0,64, 95% CI 0,412–0,997). Efekt léčby se potvrdil také u 80–100letých pacientek z obou tříletých studií významným snížením rizika zlomenin obratlů o 32 %, neobratlových fraktur o 31 % a klinických fraktur o 22 % (4). Snížení rizika obratlových i neobratlových zlomenin bylo zachováno i po dalších 3–5 letech nezaslepené léčby SrR (5, 6).
Účinky SrR na snížení rizika obratlových i neobratlových zlomenin byly dosud v odborné literatuře nejčastěji vysvětlovány současným útlumem osteoresorpce a zvýšením novotvorby kostní hmoty (7, 8). Na podporu této hypotézy, často interpretované jako „duální efekt“, se však uváděly jen výsledky preklinických studií a o výsledky měření biochemických ukazatelů kostní remodelace v krvi nemocných osteoporózou, léčených v registračních klinických studiích SrR.
Pokud jde o antiresorpční účinky SrR, experimentální studie prokázaly, že stroncium, podobně jako vápník, přímo tlumí diferenciaci osteoklastů z jejich prekursorů, inhibuje osteoklastickou osteoresorpci a podle některých prací také zvyšuje apoptózu osteoklastů. Tyto účinky stroncia se vysvětlují jeho vazbou na calcium-sensing receptor osteoklastů a osteocytů, ale také na calcium-sensing receptor v jiných tkáních, např. v hlavních buňkách příštítných tělísek, kde tlumí sekreci PTH (9–14). Při histomorfometrii párových bioptických vzorků kosti nebyly u žen s postmenopauzální osteoporózou, užívajících SrR, ukazatele osteoresorpce po 6 ani 12 měsících významně sníženy proti výchozím hodnotám (15). V uvedené studii nebyly změny osteoresorpce u žen léčených SrR porovnány s placebovou skupinou, ale se změnami u žen léčených alendronátem. Alendronát měl významně lepší antiresorpční účinek než SrR (15). Při hodnoceném počtu kostních vzorků lze statistickou nevýznamnost rozdílů ukazatelů osteoresorpce před léčbou a po roce léčby očekávat. Histomorfometrické hodnocení osteoresorpce v kostních biopsiích má značnou variabilitu a na rozdíl od hodnocení novotvorby není dynamickým testem. V registračních studiích však bylo opakovaně potvrzeno snížení sérové koncentrace markeru osteoresorpce, C-terminálního telopeptidu kolagenu typu I (βCTX-1) (2, 16). Ve studii SOTI se v prvních 6 měsících léčby snížily sérové koncentrace βCTX-1 u léčených žen o 10 %. Souhlasí to se srovnatelným antiresorpčním účinkem SrR a kalcia, rovněž hodnoceným podle snížení sérové koncentrace βCTX-1 (12). Po roce a v dalších letech však byly v pivotních studiích SrR u léčených i u neléčených žen sérové koncentrace βCTX-1 vyšší, než před léčbou (2). U léčených mužů (16) se sérové koncentrace markeru v prvním roce léčení proti výchozím hodnotám neprůkazně snížily, a během dalšího roku se mírně zvýšily (obr. 1).
1. Změny sérové koncentrace ßCTX-1 (vlevo) a kostní alkalické fosfatázy (vpravo) během 2 let sledování mužů léčených stroncium ranelátem (plně) nebo v placebové skupině (přerušovaně). Průměr a SD *; p < 0,05 v porovnání s výchozí hodnotou. Podle (16). 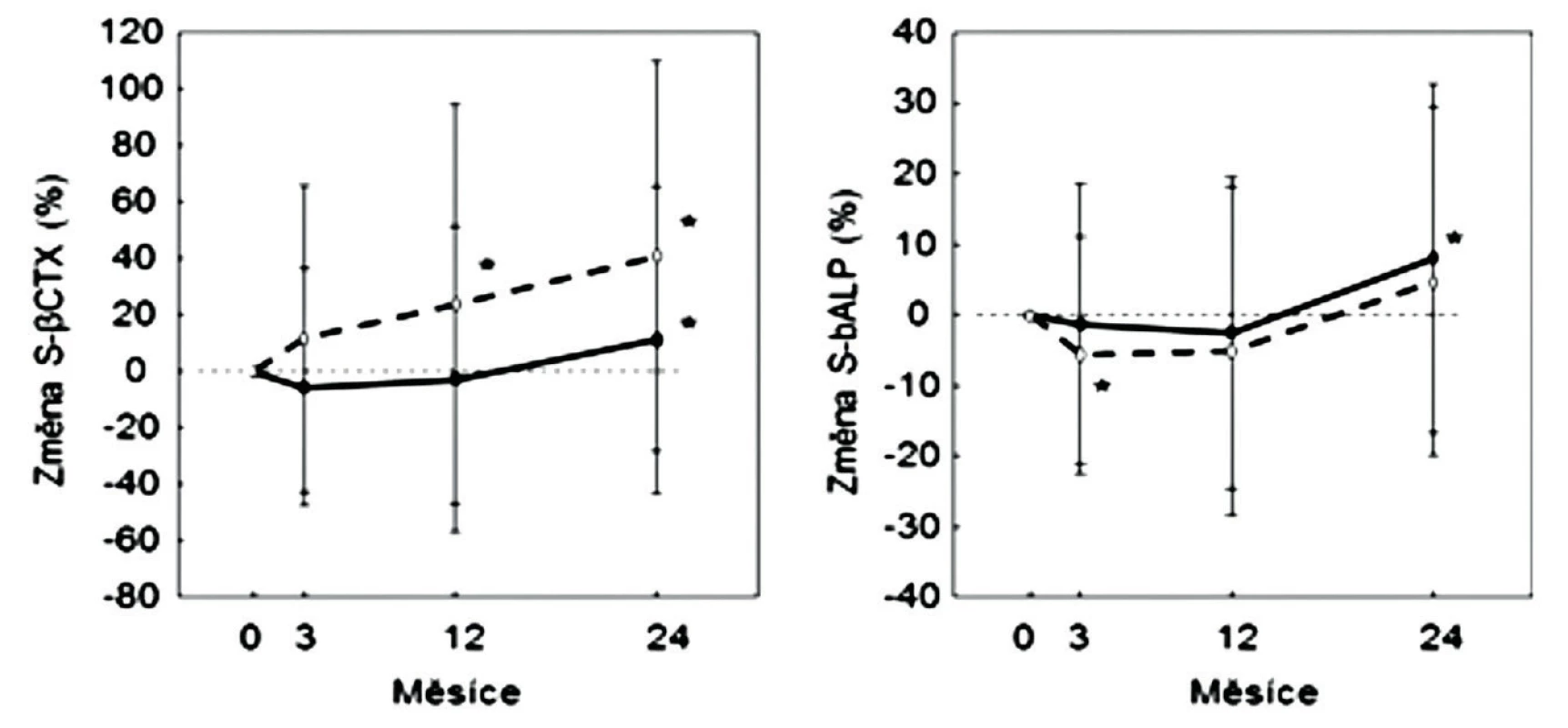
Osteoanabolické účinky stroncium ranelátu
Ve tkáňových kulturách stroncium stimuluje aktivitu osteoblastů (11, 17, 18). Tyto účinky jsou vysvětlovány aktivací calcium-sensing receptoru v osteocytech a v osteoblastech (11). Osteoanabolické účinky se ale podle některých studií při testování na zvířatech významněji uplatňovaly až při vyšších sérových koncentracích stroncia, než jaké jsou v krvi léčených osob. Pokud rostoucí a intaktní krysy dostávaly po dobu 2 let denně 900 mg/kg stroncia (sérové koncentrace stroncia dosahovaly 0,34 nM), zvyšoval se u nich průkazně objem kostních trámců a tloušťka kortikální kosti (19, 20). Pokud ale ovarektomované krysy dostávaly stroncium v denní dávce 25 nebo 150 mg/kg, zvýšení novotvorby kosti prokázáno nebylo (21). Podle autorů posléze uvedené studie bylo při dávce 150 mg/kg dosaženo u krys obdobných sérových koncentrací stroncia (0,125 nM), jako u lidí užívajících denně 2 g SrR (22). Další studie u imobilizovaných krys nepotvrdila zlepšení architektury a mechanické síly kosti ani při podávání 900 mg/kg SrR (23). Účinky stroncia na kost ve tkáňových kulturách nebo v experimentálních modelech na intaktních, ovarektomovaných nebo imobilizovaných krysách tedy nemohou být přímo použity pro vysvětlení mechanismů a účinnosti dávek stroncia, které jsou klinicky užívány při léčení osteoporózy.
Duální účinky předpokládají pokles osteoresorpce a současné zvýšení novotvorby, tedy osteoanabolický účinek léku. Pro posouzení osteoanabolických účinků SrR u pacientů s osteoporózou byly směrodatné výsledky histomorfometrických vyšetření vzorků kosti získaných biopsiemi zpravidla z lopaty kosti kyčelní. Základní z publikovaných histomorfometrických studií účinků SrR posuzovala výsledky nepárových kostních biopsií u žen léčených SrR různou dobu (1–5 let) (24). Kontrolní skupinu tvořily poolované vzorky z obou ramen studie od žen užívajících placebo. V trámčité kosti byla u žen užívajících SrR v porovnání s kontrolami vyšší rychlost apozice minerálu. Větší byly také povrchy kryté osteoblasty. Naopak tloušťka osteoidu na površích trámců a endokortikální kosti byla statisticky významně nižší. Dva ukazatele, obecně považované za průkazné pro hodnocení stupně novotvorby kosti, MS/BS% (mineralizující povrchy) a BFR (rychlost novotvorby kosti) (25), nebyly u žen léčených SrR a u neléčených žen rozdílné (24). Protože nešlo o párové biopsie, nebylo možné uvedená zjištění spolehlivě interpretovat. Odpověď nepřineslo ani přímé srovnání účinků SrR a teriparatidu ve vzorcích nepárových kostních biopsií po 6 měsících léčení žen s postmenopauzální osteoporózou. U žen léčených teriparatidem sice byla endokortikální a periostální novotvorba (MS/BS,%) významně vyšší, než u žen léčených SrR, ale při chybění bazálních hodnot nebylo možné posoudit stupeň a významnost dynamiky změn (26).
Konečné potvrzení negativních výsledků studie nepárových kostních biopsií (24) přinesla až histomorfometrická data vzorků kosti, získaných biopsie kosti před zahájením studie a po 6 nebo 12 měsících (párových biopsií) u žen s postmenopauzální osteoporózou, léčených rok alendronátem (n = 89) anebo SrR (n = 179) (15). Po roce užívání SrR se strukturální parametry kortikální kosti neměnily a některé základní strukturální parametry trámčité kosti se prokazatelně zhoršily (objem trámčité kosti, tloušťka a separace kostních trámců) (obr. 2). Statisticky významně se snížily také podstatné histomorfometrické dynamické ukazatele novotvorby trámčité kosti (MS/BS% a rychlost novotvorby), a významně nižší byla také aktivační frekvence (pravděpodobnost remodelace kostní jednotky) (obr. 3 a 4). Uvedená studie hodnotila dynamickým testem zatím největší počet párových biopsií u žen s postmenopauzální osteoporózou a mohla proto prokázat statistickou významnost změn novotvorby trámčité kostní hmoty. Podle výsledků histomorfometrických vyšetření párových vzorků kosti, získaných opakovanými biopsiemi z lopaty kosti kyčelní u žen léčených rok SrR, nemá SrR v dávkách užívaných při léčbě osteoporózy u lidí dříve uváděný duální efekt.
2. Vlevo: objem kostní hmoty v nepárových biopsiích u 21 žen placebové skupiny a u 20 žen léčených 3 roky stroncium ranelátem. Uprostřed a vpravo: objem trámčité kostní hmoty a separace trámců v párových biopsiích u 89 žen před léčbou a po roce léčby stroncium ranelátem. Podle (15) a (24). 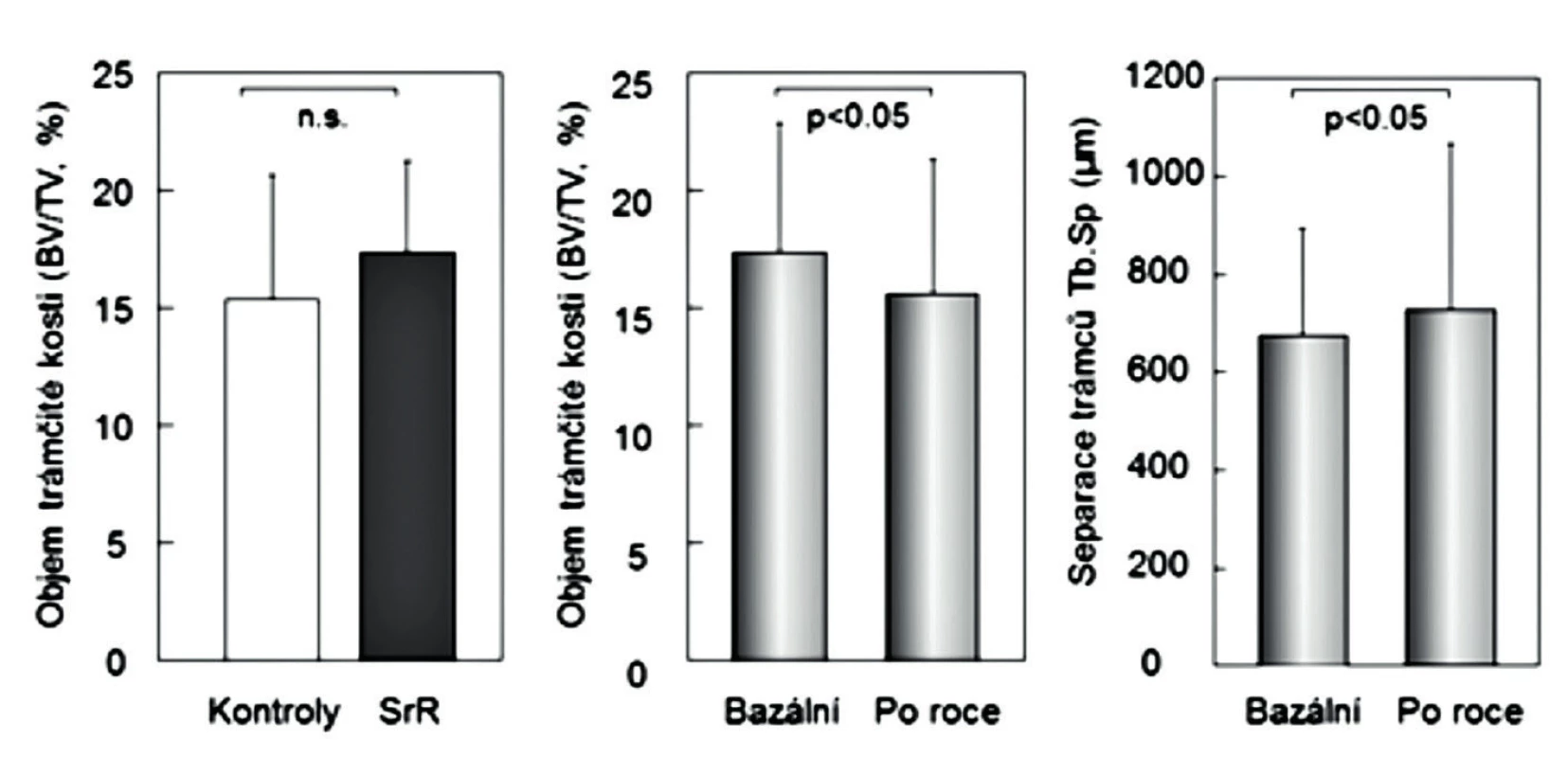
3. Vlevo: novotvorba kosti (MS/BS,%) v nepárových biopsiích u 21 žen placebové skupiny a u 20 žen léčených 3 roky stroncium ranelátem. Vpravo: novotvorba kosti (MS/BS,%) v párových biopsiích u 89 žen před léčbou a po roce léčby stroncium ranelátem. Podle (15) a (24). 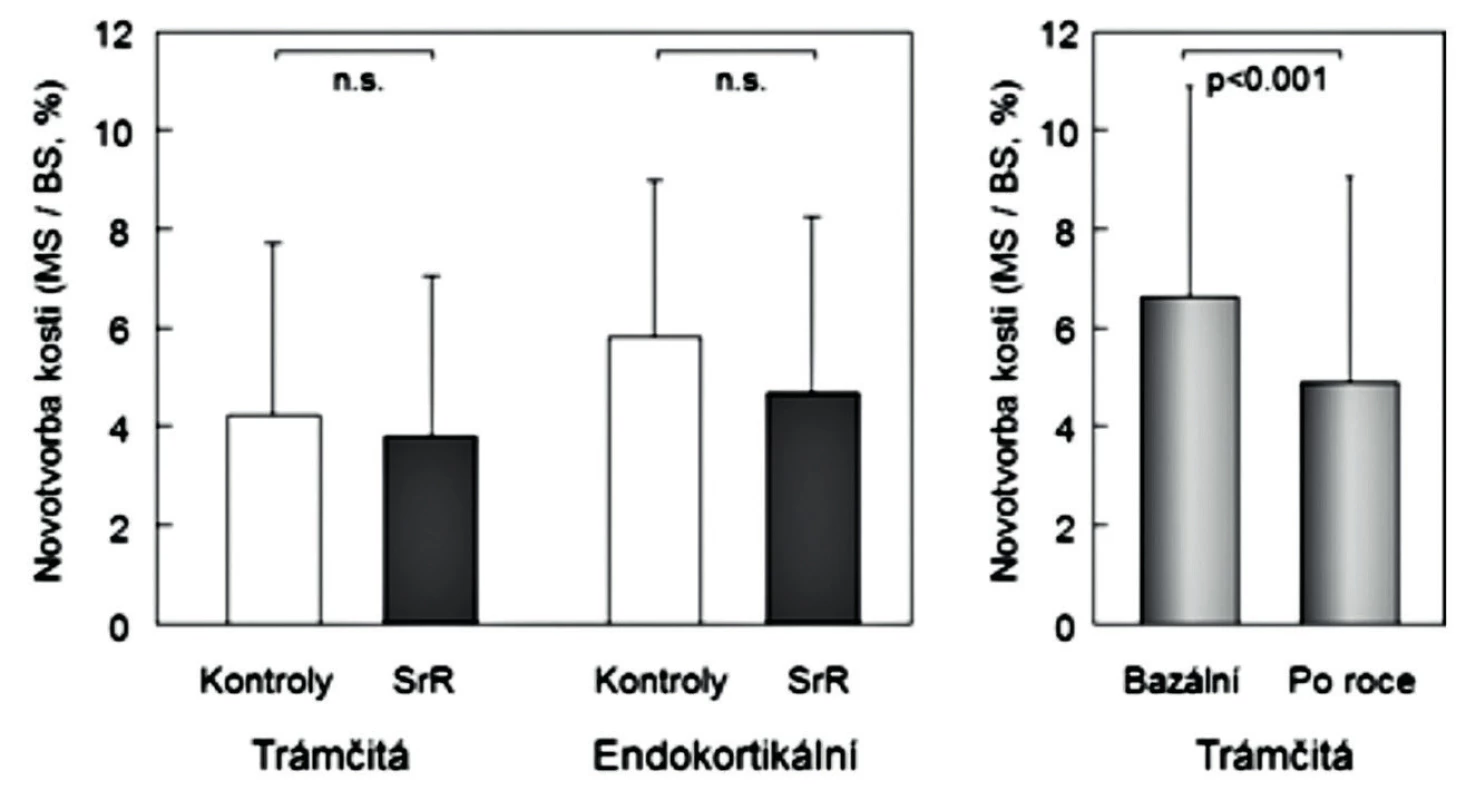
4. Rychlost novotvorby (vlevo) a aktivační frekvence (vpravo) v párových biopsiích u 89 žen před léčbou a po roce léčby stroncium ranelátem. Podle (15). 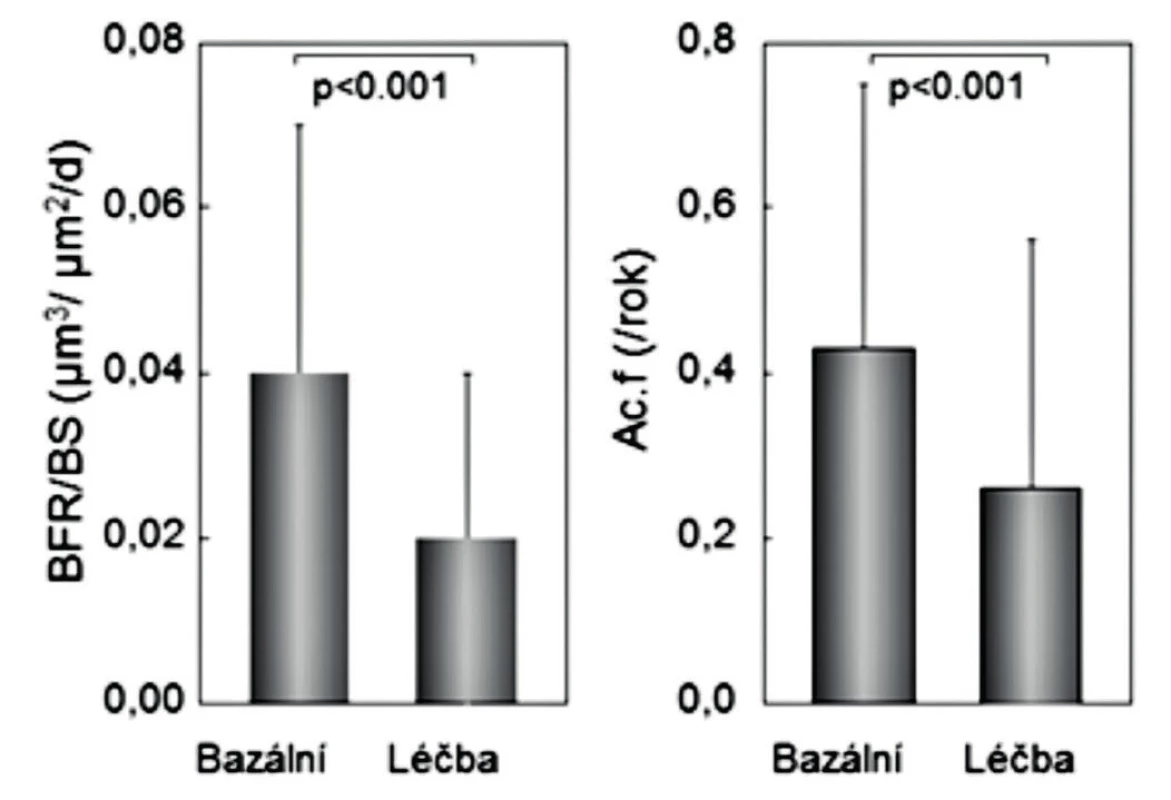
Pro osteoanabolické účinky SrR na kost u pacientů s osteoporózou nelze argumentovat ani změnami sérových koncentrací markerů novotvorby kostní hmoty. V pivotní klinické studii u žen s postmenopauzální osteoporózou byla jako ukazatel funkce osteoblastů měřena kostní ALP. Sérová koncentrace tohoto markeru se po roce podávání SrR zvýšila proti počáteční hodnotě o 16 %, ale stoupla také u žen ve skupině s placebem (o 10 %) (2). U mužů léčených SrR i v placebové skupině sérové koncentrace kostní ALP v prvním roce nevýznamně klesaly (obr. 1). V jiných studiích bylo k hodnocení novotvorby organické kostní matrix u žen léčených SrR užito sérového markeru syntézy kolagenu typu I, PINP (aminoterminální propeptid prokolagenu typu I). Při léčbě SrR se hodnoty PINP statisticky významně snížily (27, 28). Přímé srovnání účinků SrR a teriparatidu (PTH1-34) v randomizované studii u žen s postmenopauzální osteoporózou prokázalo významný pokles PINP po 3 a 6 měsících užívání SrR (28). Pokud by SrR byl osteoanabolickým lékem, očekával by se vzestup PINP, obdobně jako u žen léčených teriparatidem (obr. 5). Naopak, stupeň snížení PINP při léčbě SrR připomíná pokles koncentrace tohoto markeru u žen, které v placebové větvi ve studiích jiných antiresorpčních léků, např. alendronátu, užívaly jen vápník a vitamin D (29). Hodnocení sérových koncentrací PINP a kostní ALP u žen léčených SrR tedy nebylo souhlasné. Kostní ALP je enzymem tvořeným osteoblasty a významným pro mineralizaci kosti (30), ale jeho aktivita nevypovídá o syntéze organické kostní matrix. Pro hodnocení novotvorby organické kostní matrix je doporučen PINP, který je dobře ověřeným markerem syntézy kolagenu typu I, tvořícího kolem 90 % organické hmoty kostí (31). PINP je z oběhu eliminován jaterními endoteliálními buňkami (scavengerový receptor, není ovlivněn pohlavními hormony). PINP je proto vhodnějším markerem než karboxyterminální propeptid prokolagenu typu I PICP, který má krátký poločas (6–8 minut) a v játrech je vychytáván přes manózový receptor (ovlivněn hormony). Současně je třeba zdůraznit, že sérové hodnoty biochemických markerů jsou jen zástupnými ukazateli resorpce a novotvorby kostní hmoty, i když na rozdíl od vzorků kosti získaných biopsií vypovídají o remodelaci v celém skeletu. Histomorfometrie vzorků z lopaty kosti kyčelní je ale také reprezentativní pro skelet, protože remodelace v pánevní kosti je srovnatelná s remodelací v obratlích a v proximálním femuru (32). Pokud se oba typy sérových markerů při léčbě snižují, není převaha hodnot markeru funkce osteoblastů nad markerem osteoresorpce v prvních 6 až 12 měsících antiresorpční léčby výrazem duálního efektu léku, ale vypovídá o dočasně přetrvávající schopnosti osteoblastů vyplňovat dříve vytvořené resorpční kavity organickou kostní matrix (vyplnění remodelačního prostoru).
5. Vlevo: Změny sérových koncentrací PINP (plně, kroužky) a ßCTX-1 (přerušovaně, trojúhelníky) u žen s postmenopauzální osteoporózou, užívajících teriparatid (plné kroužky a trojúhelníky) nebo stroncium ranelát (prázdné kroužky a trojúhelníky). Podle (28). 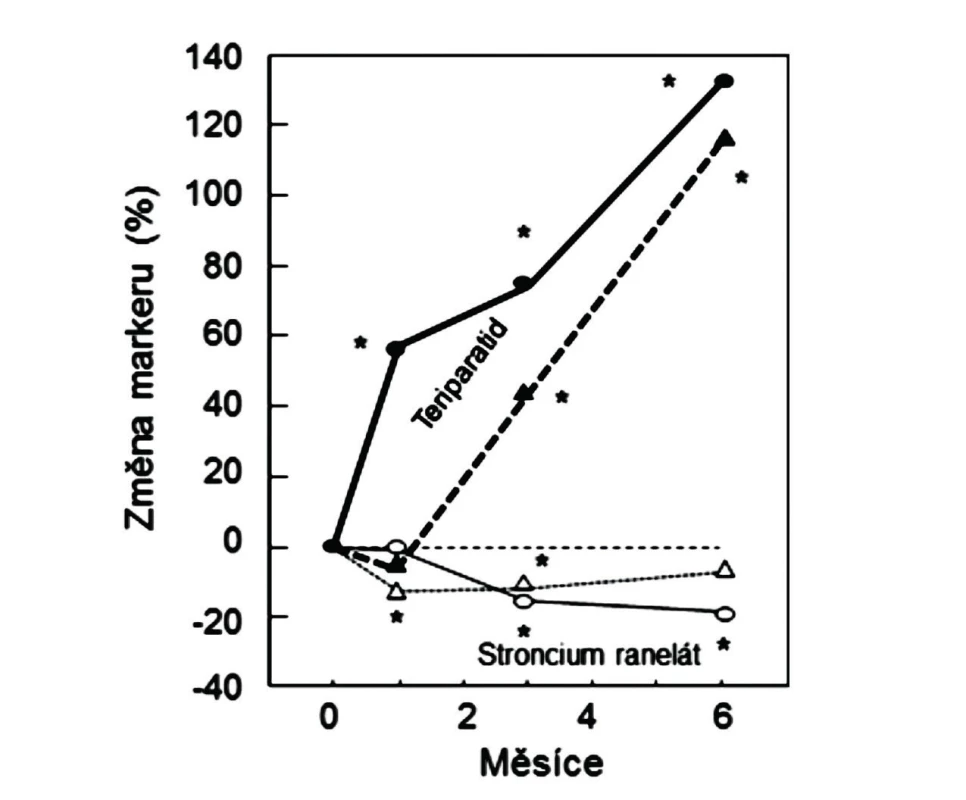
Snížení rizika zlomenin při léčbě osteoporózy stroncium ranelátem
Hypotéza „duálního účinku SrR“ byla v publikacích o léčivu uváděna opakovaně (2–6). Sám výrobce stroncium ranelátu (Servier) však tento mechanismus účinku léku v „Souhrnu charakteristik produktu (SPC)“ zmiňuje výhradně nepřímo, a to jen s odvoláním na výsledky v tkáňových kulturách a u krys, a na změny biochemických markerů v pivotních studiích (1). Jak už bylo uvedeno, účinky stroncia na kost ve tkáňových kulturách nebo v experimentálních modelech na intaktních, ovarektomovaných nebo imobilizovaných krysách nemohou být přímo použity pro vysvětlení mechanismů a účinnost dávek stroncia, klinicky užívaných při léčení osteoporózy. Směrodatné jsou výsledky histomorfometrických vyšetření párových kostních biopsií, které prokázaly pokles novotvorby kostní hmoty. Takto je to uvedeno i v závěru původní práce: „In conclusion, this large controlled paired-biopsy study shows that the bone formation remains higher after SrRan than ALN treatment, but could not demonstrate a significant anabolic action of SrRan on bone remodeling and did not allow explaining the beneficial effect of SrRan on bone strength“ (15). Vysvětlení účinků léčby SrR je tedy třeba teprve hledat.
Především by bylo třeba ověřit samotný design studií. Protože jídlo a přípravky obsahující vápník mohou snížit biologickou dostupnost léku o 60–70 %, podává se suspenze SrR (2 g zrněného prášku s obsahem 0,6 g stroncia) ve sklenici vody večer, alespoň dvě hodiny po jídle. Připomeňme, že stroncium se váže na calcium-sensing receptor. V příštítných tělískách tento receptor reguluje sekreci parathormonu. Během několika hodin po podání SrR klesají sérové koncentrace βCTX-1 i PTH zcela obdobně jako po podání vápníku (12). U žen léčených SrR jsou ranní sérové koncentrace PTH nižší, než u kontrol (1, 2, 14). V registračních studiích však kontrolní skupina nedostávala večer vápník, ale jen placebo, které noční vzestup PTH a osteoresorpce neovlivnilo. Útlum nočního zvýšení sekrece parathormonu a markeru osteoresorpce se tedy projevil pouze ve skupině léčené SrR. Nelze vyloučit, že tím mohl být ovlivněn i rozdíl v poklesu rizika zlomenin v obou sledovaných skupinách. Dlouhodobá léčba kalciem a vitaminem D prokazatelně snižuje riziko zlomenin v oblasti kyčle (33), žádná z dosud publikovaných studií však neporovnala účinnost podávání vápníku během dne a až před ulehnutím.
Změny vlastností kosti na minerálně-organickém rozhraní jsou jiným možným vysvětlením poklesu rizika zlomenin při užívání SrR, kdy se v kostní hmotě zvyšuje obsah stroncia a kdy stoupá BMD. Otázkou vztahu poklesu rizika zlomenin a zvýšení BMD v bederní páteři a v proximálním femuru se zabývala řada studií. U žen po menopauze se v pivotní klinické studii po 3 letech užívání SrR zvýšilo BMD v bederní páteři o 12,7 %, v proximálním femuru o 8,6 % a v krčku femuru o 7,2 % (2). Při pokračujícím podávání přípravku se BMD dále zvyšovala. Obdobné zvýšení BMD bylo zjištěno i při léčení osteoporózy u mužů (obr. 6).
6. Změny BMD u mužů, léčených pro osteoporózu stroncium ranelátem (plně) a u kontrolní skupiny (přerušované). Podle (16). 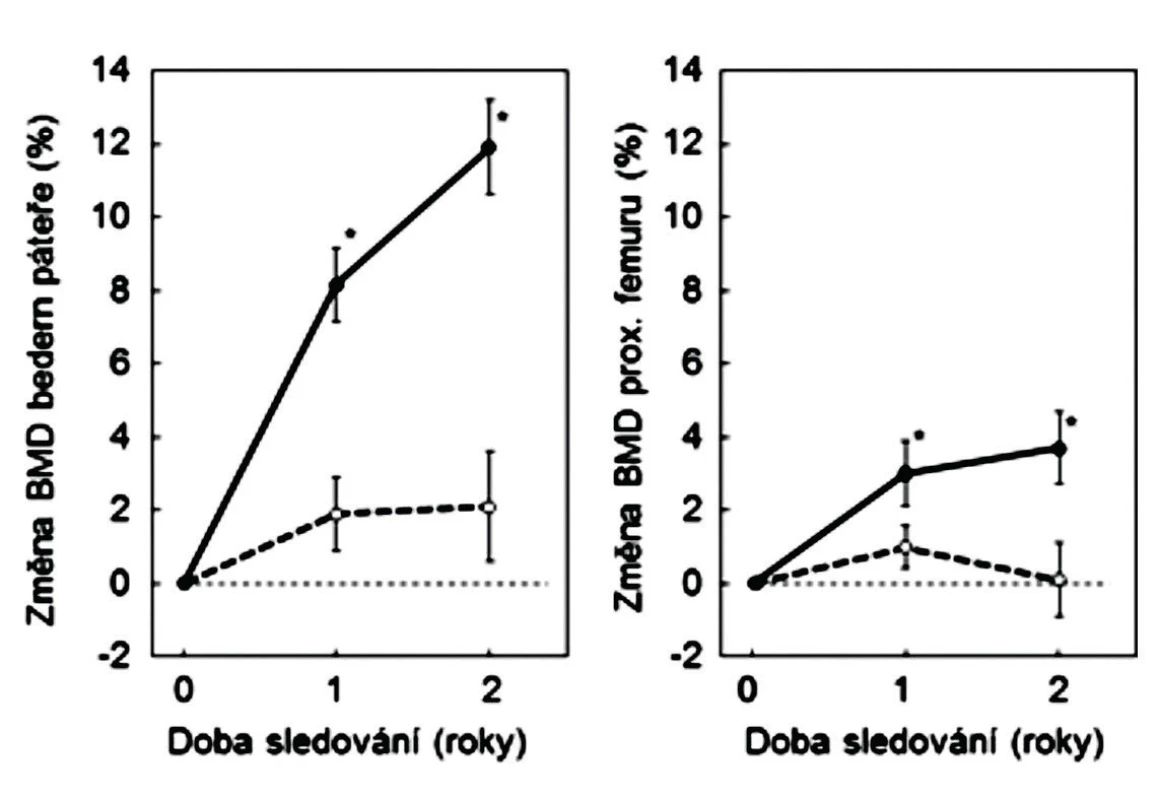
Stupeň snížení rizika zlomenin obratlů (nikoli však neobratlových fraktur) byl u žen užívajících SrR asociován se stupněm zvýšení BMD v krčku proximálního femuru (nikoli však v bederní páteři). Tento efekt však měla léčba SrR pouze v prvním roce (34). Problematické je i samotné hodnocení změny BMD u nemocných léčených SrR. Stroncium, které nahrazuje v kostním minerálu vápník, absorbuje při denzitometrii rentgenové záření více než hydroxyapatit. Pro korigování tohoto fenoménu se v SPC i v některých publikacích doporučuje snížit změnu BMD o 53 % (1, 3). Toto doporučení se odvíjí od měření obsahu stroncia v séru a ve vzorcích kosti z biopsií. Korekční faktor však může být značně rozdílný, pokud se užije biopsií z různých pokusů (35). Rozdílný by byl i korekční faktor pro různé oblasti skeletu, ve kterých se může obsah stroncia značně lišit (36). V klinické praxi není u jednotlivých pacientů obsah stroncia ve standardních místech skeletu, měřených pomocí DXA, vůbec znám. Úpravy BMD u pacientů léčených SrR by tedy byly spekulativní (35). Již uvedené histomorfometrické zjištění, že se při léčbě SrR nezvyšuje množství kostní hmoty (15), potvrdila studie, která v ultradistálním radiu nedominantní ruky hodnotila obsah stroncia, změnu BMD bez korekce na stroncium a změnu BMD po korekci na stroncium u 32 žen léčených SrR po dobu 5 let a pak další 3 roky. Zvyšování obsahu stroncia i BMD pokračovalo po celých 8 let užívání SrR. Obsah samotného hydroxyapatitu se však během léčby nezvyšoval a v posledních třech letech klesal (37).
Jak by mohl SrR měnit vlastností kosti na minerálně-organickém rozhraní? SrR je jen slabým antiresorpčním lékem a zvýšená remodelace kosti může pokračovat i při jeho užívání. Analýza kostního minerálu ve vzorcích získaných biopsií potvrdila, že při léčbě SrR řádově stoupá obsah stroncia právě v nově remodelovaných kostních jednotkách (38). Zvýšení obsahu stroncia v endokortikálních a periostálních površích dokonce může při zobrazení kosti vysokorozlišující kvantitativní výpočetní tomografií imponovat jako ztluštění kompaktní kosti (39, 40). Vysvětlením zvýšené kostní pevnosti by tedy mohla být distribuce stroncia na kostních površích v nově vytvořených paketech kosti, nebo vyšší stabilita krystalů kostního minerálu se zabudovaným stronciem. Podle výsledků vyšetření krysích kosti nanoindentací, která hodnotí mechanické vlastnosti kostního povrchu, se v závislosti na dávce SrR po 2 letech zvyšuje tvrdost obratlů (41). Klinický význam změn vlastností kosti na minerálně-organickém rozhraní při léčbě osteoporózy SrR sice není dobře znám, ale jistě bude předmětem dalšího výzkumu.
Závěr
Stroncium ranelát je lékem s prokázanou účinností na riziko zlomenin, ale mechanismus těchto účinků dosud nebyl jednoznačně objasněn. Osteoanabolický, resp. duální účinek SrR nebyl prokázán v histomorfometrických studiích nepárových, ani párových biopsií u žen s postmenopauzální osteoporózou, léčených doporučenými dávkami SrR. Možný vliv SrR na vlastnosti kosti na minerálně-organickém rozhraní vyžaduje další výzkum. Ověřeným mechanismem účinku SrR je zatím aktivace calcium-sensing receptoru v osteoblastech, osteocytech a v příštítných tělíscích. Calcium-sensing receptor však může být stronciem ovlivněn také v řadě dalších tkání, a znalost mechanismů účinků SrR je proto důležitá při sledování bezpečnosti léčby pro jiné tkáně (42, 44).
Adresa pro korespondenci:
prof. MUDr. Jan Štěpán, DrSc.
Revmatologický ústav a 1. lékařská fakulta UK
Na Slupi 4
128 50 Praha
tel. 234 075 334
e-mail: stepan@revma.cz
Sources
1. Souhrn údajů o přípravku Protelos. http://www.sukl.cz/modules/medication/detail.php?code=0028269&tab=texts].
2. Meunier PJ, Roux C, Seeman E, Ortolani S, Badurski JE, Spector TD, et al. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med 2004; 350(5): 459–68.
3. Reginster JY, Seeman E, De Vernejoul MC, Adami S, Compston J, Phenekos C, et al. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab 2005; 90(5): 2816–22.
4. Seeman E, Vellas B, Benhamou C, Aquino JP, Semler J, Kaufman JM, et al. Strontium ranelate reduces the risk of vertebral and nonvertebral fractures in women eighty years of age and older. J Bone Miner Res 2006; 21(7): 1113–20.
5. Reginster JY, Bruyere O, Sawicki A, Roces-Varela A, Fardellone P, Roberts A, et al. Long-term treatment of postmenopausal osteoporosis with strontium ranelate: results at 8 years. Bone 2009; 45(6): 1059–64.
6. Reginster JY, Kaufman JM, Goemaere S, Devogelaer JP, Benhamou CL, Felsenberg D, et al. Maintenance of antifracture efficacy over 10 years with strontium ranelate in postmenopausal osteoporosis. Osteoporos Int 2012; 23(3): 1115–22.
7. Bonnelye E, Chabadel A, Saltel F, Jurdic P. Dual effect of strontium ranelate: Stimulation of osteoblast differentiation and inhibition of osteoclast formation and resorption in vitro. Bone 2008; 42(1): 129–38.
8. Burlet N, Reginster JY. Strontium ranelate: The first dual acting treatment for postmenopausal osteoporosis. Clin Orthop Relat Res 2006; 443 : 55–60.
9. Hurtel-Lemaire AS, Mentaverri R, Caudrillier A, Cournarie F, Wattel A, Kamel S, et al. The calcium-sensing receptor is involved in strontium ranelate-induced osteoclast apoptosis. New insights into the associated signaling pathways. J Biol Chem 2009; 284(1): 575-84.
10. Caudrillier A, Hurtel-Lemaire AS, Wattel A, Cournarie F, Godin C, Petit L, et al. Strontium ranelate decreases receptor activator of nuclear factor-KappaB ligand-induced osteoclastic differentiation in vitro: involvement of the calcium-sensing receptor. Mol Pharmacol 2010; 78(4): 569–76.
11. Bakker AD, Zandieh-Doulabi B, Klein-Nulend J. Strontium Ranelate affects signaling from mechanically-stimulated osteocytes towards osteoclasts and osteoblasts. Bone 2013; 53(1): 112–9.
12. Maresova KB, Franek T, Vondracek T, Stepan JJ. A comparison of the acute effects of calcium and strontium ranelate on the serum marker of bone resorption. Clin Chem Lab Med 2012; 50(2): 333–5.
13. Marie PJ. The calcium-sensing receptor in bone cells: a potential therapeutic target in osteoporosis. Bone 2010; 46(3): 571–6.
14. Carnevale V, Del Fiacco R, Romagnoli E, Fontana A, Cipriani C, Pepe J, et al. Effects of strontium ranelate administration on calcium metabolism in female patients with postmenopausal osteoporosis and primary hyperparathyroidism. Calcif Tissue Int 2013; 92(1): 15–22.
15. Chavassieux P, Meunier PJ, Roux JP, Portero-Muzy N, Pierre M, Chapurlat R. Bone histomorphometry of transiliac paired bone biopsies after 6 or 12 months of treatment with oral strontium ranelate in 387 osteoporotic women. Randomized comparison to alendronate. J Bone Miner Res 2014; 29(3): 618-28.
16. Kaufman JM, Audran M, Bianchi G, Braga V, Diaz-Curiel M, Francis RM, et al. Efficacy and safety of strontium ranelate in the treatment of osteoporosis in men. J Clin Endocrinol Metab 2013; 98(2): 592–601.
17. Atkins GJ, Welldon KJ, Halbout P, Findlay DM. Strontium ranelate treatment of human primary osteoblasts promotes an osteocyte-like phenotype while eliciting an osteoprotegerin response. Osteoporos Int 2009; 20(4): 653–64.
18. Brennan TC, Rybchyn MS, Green W, Atwa S, Conigrave AD, Mason RS. Osteoblasts play key roles in the mechanisms of action of strontium ranelate. Br J Pharmacol 2009; 157(7): 1291–300.
19. Ammann P, Shen V, Robin B, Mauras Y, Bonjour JP, Rizzoli R. Strontium ranelate improves bone resistance by increasing bone mass and improving architecture in intact female rats. J Bone Miner Res 2004; 19(12): 2012–20.
20. Marie PJ, Hott M, Modrowski D, De Pollak C, Guillemain J, Deloffre P, et al. An uncoupling agent containing strontium prevents bone loss by depressing bone resorption and maintaining bone formation in estrogen-deficient rats. J Bone Miner Res 1993; 8(5): 607–15.
21. Fuchs RK, Allen MR, Condon KW, Reinwald S, Miller LM, McClenathan D, et al. Strontium ranelate does not stimulate bone formation in ovariectomized rats. Osteoporos Int 2008; 19(9): 1331-41.
22. Fuchs RK, Allen MR, Condon KW, Reinwald S, Miller LM, McClenathan D, et al. Calculating clinically relevant drug doses to use in animal studies. Osteoporos Int. 2008;19(12):1815-7.
23. Bruel A, Vegger JB, Raffalt AC, Andersen JE, Thomsen JS. PTH (1–34), but not strontium ranelate counteract loss of trabecular thickness and bone strength in disuse osteopenic rats. Bone 2013; 53(1): 51–8.
24. Arlot ME, Jiang Y, Genant HK, Zhao J, Burt-Pichat B, Roux JP, et al. Histomorphometric and microCT analysis of bone biopsies from postmenopausal osteoporotic women treated with strontium ranelate. J Bone Miner Res. 2008;23(2):215–22.
25. Dempster DW, Compston JE, Drezner MK, Glorieux FH, Kanis JA, Malluche H, et al. Standardized nomenclature, symbols, and units for bone histomorphometry: a 2012 update of the report of the ASBMR Histomorphometry Nomenclature Committee. J Bone Miner Res 2013; 28(1): 2–17.
26. Ma YL, Marin F, Stepan J, Ish-Shalom S, Moricke R, Hawkins F, et al. Comparative effects of teriparatide and strontium ranelate in the periosteum of iliac crest biopsies in postmenopausal women with osteoporosis. Bone 2011; 48(5): 972–8.
27. Anastasilakis AD, Goulis DG, Polyzos SA, Gerou S, Ballaouri I, Efstathiadou Z, et al. No difference between strontium ranelate (SR) and calcium/vitamin D on bone turnover markers in women with established osteoporosis previously treated with teriparatide: a randomized controlled trial. Clin Endocrinol (Oxf) 2009; 70(4): 522–6.
28. Recker RR, Marin F, Ish-Shalom S, Moricke R, Hawkins F, Kapetanos G, et al. Comparative effects of teriparatide and strontium ranelate on bone biopsies and biochemical markers of bone turnover in postmenopausal women with osteoporosis. J Bone Miner Res 2009; 24(8): 1358–68.
29. Seeman E, Delmas PD, Hanley DA, Sellmeyer D, Cheung AM, Shane E, et al. Microarchitectural deterioration of cortical and trabecular bone: differing effects of denosumab and alendronate. J Bone Miner Res 2010; 25(8): 1886–94.
30. Millan JL. The role of phosphatases in the initiation of skeletal mineralization. Calcif Tissue Int 2013; 93(4): 299–306.
31. Vasikaran S, Eastell R, Bruyere O, Foldes AJ, Garnero P, Griesmacher A, et al. Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: a need for international reference standards. Osteoporos Int 2011; 22(2): 391–420.
32. Frost ML, Moore AE, Siddique M, Blake GM, Laurent D, Borah B, et al. (18)F-fluoride PET as a noninvasive imaging biomarker for determining treatment efficacy of bone active agents at the hip: a prospective, randomized, controlled clinical study. J Bone Miner Res 2013; 28(6): 1337–47.
33. Prentice RL, Pettinger MB, Jackson RD, Wactawski-Wende J, Lacroix AZ, Anderson GL, et al. Health risks and benefits from calcium and vitamin D supplementation: Women's Health Initiative clinical trial and cohort study. Osteoporos Int 2013; 24(2): 567–80.
34. Bruyere O, Roux C, Detilleux J, Slosman DO, Spector TD, Fardellone P, et al. Relationship between bone mineral density changes and fracture risk reduction in patients treated with strontium ranelate. J Clin Endocrinol Metab 2007; 92(8): 3076–81.
35. Blake GM, Fogelman I. Long-term effect of strontium ranelate treatment on BMD. J Bone Miner Res 2005; 20(11): 1901–4.
36. Oliveira JP, Querido W, Caldas RJ, Campos AP, Abracado LG, Farina M. Strontium is incorporated in different levels into bones and teeth of rats treated with strontium ranelate. Calcif Tissue Int. 2012;91(3):186–95.
37. Barenholdt O, Kolthoff N, Nielsen SP. Effect of long-term treatment with strontium ranelate on bone strontium content. Bone 2009; 45(2): 200–6.
38. Roschger P, Manjubala I, Zoeger N, Meirer F, Simon R, Li C, et al. Bone material quality in transiliac bone biopsies of postmenopausal osteoporotic women after 3 years of strontium ranelate treatment. J Bone Miner Res 2010; 25(4): 891–900.
39. Rizzoli R, Laroche M, Krieg MA, Frieling I, Thomas T, Delmas P, et al. Strontium ranelate and alendronate have differing effects on distal tibia bone microstructure in women with osteoporosis. Rheumatol Int 2010; 30(10): 1341–8.
40. Rizzoli R, Chapurlat RD, Laroche JM, Krieg MA, Thomas T, Frieling I, et al. Effects of strontium ranelate and alendronate on bone microstructure in women with osteoporosis. Results of a 2-year study. Osteoporos Int 2012; 23(1): 305-15.
41. Ammann P, Badoud I, Barraud S, Dayer R, Rizzoli R. Strontium ranelate treatment improves trabecular and cortical intrinsic bone tissue quality, a determinant of bone strength. J Bone Miner Res. 2007; 22(9): 1419–25.
42. Cacoub P, Descamps V, Meyer O, Speirs C, Belissa-Mathiot P, Musette P. Drug rash with eosinophilia and systemic symptoms (DRESS) in patients receiving strontium ranelate. Osteoporos Int 2013; 24(5): 1751-7.
43. Jonville-Bera AP, Autret-Leca E. [Adverse drug reactions of strontium ranelate(Protelos((R)) in France]. Presse Med 2011; 40(10): e453–62.
44. Lee YY, Yang CH, Chen CH, Hwang JS. Alopecia associated with strontium ranelate use in a 62-year-old woman. Osteoporos Int 2013; 24(3): 1127–9.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2014 Issue 1-
All articles in this issue
- Assessment of utility score EQ-D and estimating the Cost-utility of the first year of treatment by TNF inhibitors in a cohort of patients with Rheumatoid Arthritis during– results from the Czech biologics registry ATTRA
- Strontium ranelate has no bone anabolic (dual) effects in treatment of osteoporosis
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Assessment of utility score EQ-D and estimating the Cost-utility of the first year of treatment by TNF inhibitors in a cohort of patients with Rheumatoid Arthritis during– results from the Czech biologics registry ATTRA
- Strontium ranelate has no bone anabolic (dual) effects in treatment of osteoporosis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

