-
Medical journals
- Career
Multiorgánové selhání a syndrom aktivovaných makrofágů u Stillovy nemoci v dospělosti
: J. Tomš 1; T. Soukup 1; J. Polák 2; P. Bradna 1
: 2. interní klinika, oddělení revmatologie, Lékařská fakulta UK a Fakultní nemocnice Hradec Králové 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, Lékařská fakulta UK a Fakultní nemocnice Hradec Králové 2
: Čes. Revmatol., 20, 2012, No. 3, p. 133-137.
: Case Report
Syndrom aktivovaných makrofágů (MAS) je relativně vzácnou a potencionálně život ohrožující komplikací autoimunitních systémových onemocnění, především systémové formy juvenilní idiopatické artritidy. Je charakterizován perzistující horečkou, cytopenií, dysfunkcí vnitřních orgánů a koagulopatií na podkladě aktivace a proliferace T-lymfocytů a makrofágů s následným nekontrolovaným uvolněním cytokinů (tzv. cytokinová bouře). Autoři prezentují případ 36leté ženy se simultánní manifestací Stillovy nemoci v dospělosti a MAS. Rozvoj multiorgánového selhání si vyžádal několik týdnů trvající komplexní intenzivní péči, díky kombinované imunosupresivní léčbě se podařilo dosáhnout remise obou onemocnění.
Klíčová slova:
syndrom aktivovaných makrofágů, Stillova nemoc v dospělosti, multiorgánové selháníÚVOD
Stillova nemoc (SN) je subsetem juvenilní idiopatické artritidy (JIA), vyznačuje se akutním průběhem a systémovou manifestací. JIA a SN jsou onemocnění dětského věku, ale někdy se mohou projevit až v dospělosti. První popis systémového počátku JIA u dětí pochází od George Stilla již z r. 1896 (1), termín Stillova nemoc v dospělosti (SND) byl použit v 70. letech 20. století u několika dospělých pacientů, kteří nesplňovali kritéria pro revmatoidní artritidu (RA), ale měli příznaky obdobné jako děti se systémovou formou JIA (2). Hlavní klinické projevy SN zahrnují horečku (septického charakteru), artritidu, prchavý exantém (lososové barvy), hepatomegalii, splenomegalii a lymfadenopatii. Diferenciální diagnostika SN je velmi široká, diagnózu je možné stanovit až „per exclusionem“ – po vyloučení infekčních, nádorových nebo jiných autoimunitních onemocnění. Pro SND byla navržena řada diagnostických kritérií, v současné době nejpoužívanější jsou kritéria podle Yamaguchiho (3).
JIA a zejména její systémová forma může být komplikována syndromem aktivovaných makrofágů (MAS), což je velmi závažný, život ohrožující stav, způsobený aktivací T lymfocytů a makrofágů, spojený s nekontrolovaným uvolněním cytokinů (tzv. cytokinová bouře) (4). MAS je charakterizován cytopenií, dysfunkcí vnitřních orgánů a koagulopatií, klinicky se manifestuje perzistující horečkou, purpurou, hepatosplenomeagalií, encefalopatií, při laboratorním vyšetření bývá zjištěna cytopenie (ve dvou nebo třech základních řadách krevních buněk) s významnou neutropenií, prodloužení protrombinového času (PT) a aktivovaného parciálního tromboplastinového času (aPTT), hypofibrinogenémie, elevace jaterních enzymů (transamináz), hypertriacylglyceridémie, nízká hodnota C-reaktivního proteinu (CRP) a sedimentace erytrocytů (SE). Zcela zásadní význam má vyšetření kostní dřeně s průkazem hemofagocytózy. Pomocným vodítkem k diagnóze MAS v kontextu výše uvedených projevů může být velmi vysoká sérová hladina ferritinu, která bývá ovšem přítomná i při samostatné systémové formě JIA.
POPIS PŘÍPADU
36letá žena, která se dosud s ničím závažným neléčila, byla vyšetřena praktickým lékařem pro několik dní trvající vysoké horečky (až 40 °C) bez jiných klinických příznaků. Pro zvýšenou hodnotu CRP (55 mg/l) byla nasazena antibiotika (doxycyklin), po nichž došlo k výsevu exantému (suspektně toxo-alergického), proto byla antibiotická léčba změněna na ciprofloxacin. Následně se objevily bolesti v hrdle a artralgie, vzhledem k perzistujícím febriliím byla pacientka hospitalizována na spádovém interním pracovišti. Během komplexního klinického, laboratorního a zobrazovacího vyšetření (CT mozku, krku, hrudníku a břicha) nebyla zjištěna infekční příčina obtíží, přesto byla pacientka léčena několika antibiotiky (cefuroxim, klaritromycin, vankomycin). Po 2 týdnech hospitalizace došlo k rozvoji akutního renálního selhání (kreatinin 468 μg/l), následně také respiračního selhání a diseminované intravaskulární koagulopatie (DIC) (PT 1,83, aPPT 2,45, fibrinogen 0,73 g/l, D-diméry 20,0). Laboratorní zánětlivé markery byly zvýšené (CRP 175 mg/l, leukocyty 25 x 109/l, 50 % tyčí) stejně jako jaterní enzymy (ALT 1,93 μkat/l, AST 10,4 μkat/l, GMT 2,26 μkat/l, ALP 3,25 μkat/l). Při rentgenovém a CT vyšetření plic se zobrazily oboustranné homogenní infiltráty se vzdušným bronchogramem a oboustranný fluidothorax (cca 600–750 ml) (obr. 1). Současně se objevil celotělový erytém nejasné etiologie a postupně se v krevním obraze projevila bicytopenie (hemoglobin 76 g/l, trombocyty 29 x 109/l).
Léčba multiorgánového selhání si vyžádala pobyt na specializované jednotce intenzivní péče (JIP) - umělá plicní ventilace, mimotělní eliminace, podpora krevního oběhu katecholaminy, substituce koagulačních faktorů, léčba širokospektrými intravenózními antibiotiky. Četná mikrobiologická vyšetření včetně opakovaného odběru hemokultur a vyšetření pátrající po tuberkulóze a dalších oportunních infekcí nepřinesla pozitivní výsledek prokazující infekční etiologii. Při kontrolním CT vyšetření břicha byla popsána suspektní krytá perforace tenkého střeva, proto byla z vitální indikace provedena revize dutiny břišní, která ovšem nepotvrdila předchozí podezření. Za 4 dny po operaci došlo při závažné koagulopatii k rozvoji hemoperitonea s nutností další operační revize (bez průkazu jasného zdroje krvácení). Během 6 týdnů intenzivní péče se podařilo pacientku stabilizovat z hlediska funkcí kardiálních, respiračních i renálních.
Vzhledem k absenci jednoznačné infekční příčiny a příznivému efektu vysokých dávek kortikoidů, které byly použity v rámci komplexního přístupu k suspektně septickému stavu, bylo vyjádřeno podezření na systémové autoimunitní onemocnění. Vždy po podání kortikoidů došlo k snížení až vymizení horečky a celkovému zlepšení stavu pacientky, po přerušení kortikoterapie se vysoké febrilie a erytém poměrně rychle vrátily. Imunologické vyšetření autoprotilátek vyšlo zcela negativně (antinukleární protilátky – ANA, revmatoidní faktor - RF, protilátky proti citrulinovaným peptidům – ACPA, ENA protilátky, protilátky proti dsDNA, ANCA protilátky, antifosfolipidové protilátky). Po odpojení od umělé plicní ventilace a extubaci byla pacientka přeložena na revmatologické oddělení s pokračující perorální léčbou kortikoidy (Prednison 20 mg denně).
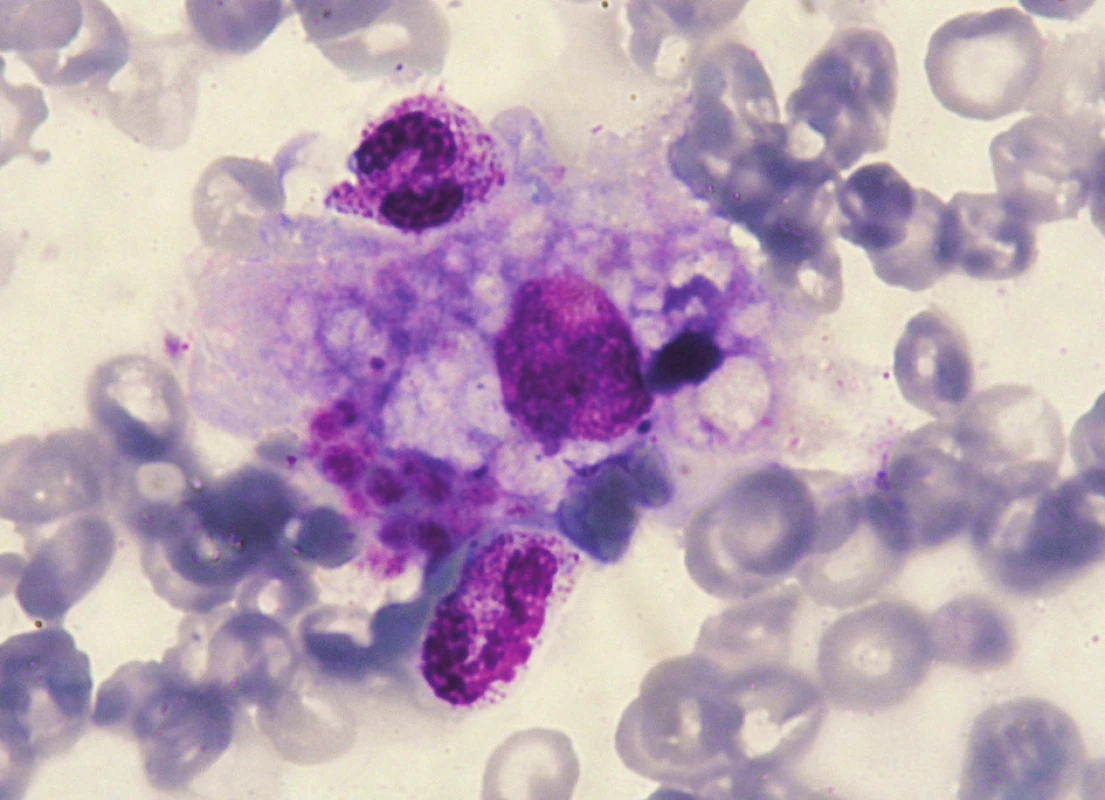
Opakovaně byla potvrzena vysoká hladina sérového ferritinu (4219…5431 μg/l) a při vyšetření kostní dřeně odebrané při sternální punkci byl zjištěn obraz hemofagocytózy (obr. 2). Na rentgenovém snímku rukou bylo patrno několik drobných usurací (os naviculare a capitatum bilaterálně, processus styloideus ulnae bilaterálně), které svědčily pro počínající změny při artritidě. Na základě těchto skutečností (s absencí průkazu infekční, hemato-onkologické, endokrinologické a jiné etiologie) byl případ uzavřen jako Stillova nemoc s počátkem v dospělém věku, komplikovaná syndromem aktivovaných makrofágů. Diagnóza Stillovy nemoci splňovala kritéria podle Yamaguchiho (velká kritéria – horečka, artritida, leukocytóza, exantém; malá kritéria – hepatosplenomegalie, hepatopatie, negativní RF a ANA).
Na revmatologickém oddělení pokračovala léčba glukokortikoidy (Medrol 32 mg/den) s postupnou detrakcí dávky. Po konzultaci imunologa byly současně aplikovány intravenózní imunoglobuliny (IVIG) jednak z důvodů sekundárního protilátkového imunodeficitu s deplecí B-lymfocytů a snížením sérové hladiny imunoglobulinu G (IgG 5,5 g/l) a jednak jako imunomodulační intervence u autoimunitního onemocnění. Následně byla zahájena imunosupresivní terapie cyklosporinem v dávce 3 mg/kg. Při této léčbě byla pacientka afebrilní, bez erytému a bez klinických projevů artritidy. Po zvládnutí akutního stavu do popředí vystoupila péče o komplikace vzniklé po dlouhém pobytu na JIP. Intenzivní několikatýdenní rehabilitační léčbou se podařilo minimalizovat následky neuromyopatie kriticky nemocných (dynamické kontraktury Achillových šlach a omezená mobilita prstů rukou s paresteziemi). Po předchozí intubaci přetrvával chrapot, otorinolaryngologické vyšetření (ORL) prokázalo parézu levé hlasivky (nervus recurrens). Následná hlasová cvičení a elektrostimulace levé hlasivky přinesla jen mírné zlepšení. Závažnou komplikací protrahované intubace, která se začala projevovat až 2 měsíce po extubaci, byly intermitentní ataky klidové dušnosti doprovázané stridorem, bronchoskopické a kontrolní ORL vyšetření zjistilo významnou subglotickou stenózu trachey, jejíž těsný vztah k hlasivkám neumožňoval jiné řešení než zavedení trvalé tracheostomické kanyly. V současné době je pacientka v stabilním stavu, samostatně chodící a ventilující (přes tracheostomickou kanylu), bez klinických a laboratorních známek aktivity SN (ferritin 271 μg/l).
KOMENTÁŘ
MAS je vzácná a velmi závažná komplikace chronických revmatických onemocnění, zejména systémové formy JIA (7–13 %) (5, 6) nebo (juvenilního) systémového lupus erythematodes (SLE) (7). Kromě autoimunitních systémových nemocí se může vyskytnout také u pacientů s nádorovým nebo infekčním onemocněním. O jeho závažnosti vypovídá vysoká mortalita (30–50 %). MAS má mnohé klinické a laboratorní projevy shodné s (familiární) hemofagocytární lymfohistiocytózou (HLH), proto někteří autoři označují MAS za její sekundární (získanou) nebo reaktivní formu (8, 9). Patognomický znak tohoto syndromu je možné najít při vyšetření kostní dřeně, kdy lze pozorovat zvýšené množství morfologicky normálních makrofágů, aktivně fagocytujících hematopoetické buňky (10). Excesivní aktivace a prolifereace T-lymfocytů a makrofágů je doprovázena masivní, nekontrolovanou sekrecí prozánětlivých cytokinů – interleukin (IL) 1β, IL-6, interferon γ a TNFα. V patogenezi hraje zřejmě roli defektní cytotoxická funkce NK (natural killers) buněk, T-lymfocytů a nízká exprese perforinu (protein podílející se na cytotoxické funkci T-lymfocytů, po degranulaci tvoří póry v likvidované buňce) (11). Ačkoliv je TNFα považován za důležitý cytokin při rozvoji tohoto syndromu, byly popsány i případy vzniku MAS u pacientů s JIA, kteří byli léčeni anti TNF preparátem (12).
MAS se může objevit kdykoliv v průběhu JIA a ostatních systémových nemocí, Arlet a spol. uvádí, že simultánní manifestace MAS a SND není výjimkou (13). Prevalence u pacientů s SND se pohybuje v rozmezí 2-12 % (14). Rozpoznání této závažné komplikace u pacientů s revmatologickým onemocněním vyžaduje pečlivé sledování vývoje jednotlivých klinických a laboratorních parametrů, jelikož řada charakteristik je společná pro MAS i základní systémové onemocnění, jako například vysoká sérová hladina ferritinu u systémové JIA nebo cytopenie a dysfunkce centrálního nervového systému u SLE. Zásadní rozdíly klinických a laboratorních parametrů MAS a systémové formy JIA ukazuje tabulka 1.
1. Diferenciální diagnostika klinických a laboratorních projevů systémové formy juvenilní idiopatické artritidy a syndromu aktivovaných makrofágů. 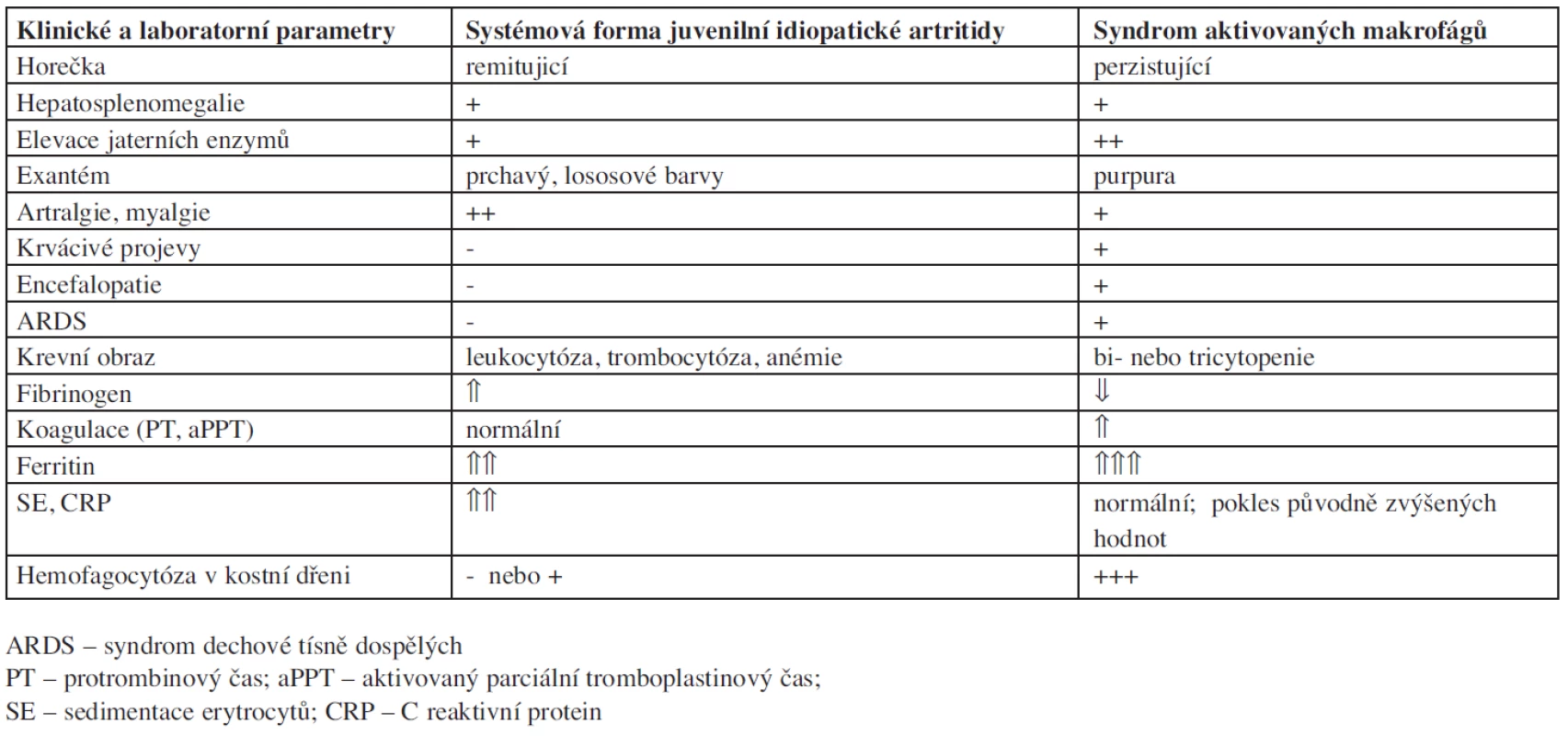
MAS je relativně nedávno rozpoznaný syndrom a dosud neexistují jednoznačně přijímaná a validizovaná klasifikační nebo diagnostická kritéria, předběžná klasifikační kritéria pro MAS komplikující systémovou JIA byla navržena Ravellim a spol. (15). Obdobně stále není k dispozici všeobecně přijatý standard pro léčbu MAS. Terapeutická schémata vychází jednak ze zkušeností u pacientů s primární (familiární) HLH, jednak ze sérií kazuistik, kde byly použity postupy s nejrůznějšími imunosupresivními léky. Na druhé straně některé z použitých preparátů byly v jiných pozorováních dávány do spojitosti s precipitací a manifestací MAS (např. aspirin, nesteroidní antirevmatika, sulfasalazin, methotrexát, etenercept, infliximab, anakinra) (4).
V úvodu léčby je nutné eliminovat možné spouštěcí faktory jako jsou výše uvedené léky, pátrat po infekčním onemocnění (zejména infekce vyvolaná virem Epstein-Barrové nebo cytomegalovirem), nádorovém onemocnění a autoimunitním onemocnění (pokud nebylo dosud známo). Vlastní léčba zahrnuje komplexní podpůrnou péči, podávání mražené plazmy (při závažné koagulopatii), glukokortikoidy a imunosupresiva. Nejvíce zkušeností s dobrým efektem je popisováno při terapii cyklosporinem (16, 17). Cyklosporin vykazuje unikátní účinek u MAS i v případech, u nichž jsou glukokortikoidy neúčinné. Na počátku je většinou aplikován nitrožilně, následně perorálně v denní dávce 2–5 mg/kg. Při kombinaci s kortikoidy se používá prednison v denní dávce 4 mg/kg nebo dexamethason v dávce 6 mg/kg/den. Léčba vede během několika dnů k vymizení horečky a k vzestupu počtu krevních elementů. Rozporná data se týkají využítí biologik, které jsou podávány s úspěchem u rezistentních případů (etanercept, anakinra) (18, 19), ale jak již bylo zmíněno výše, mohou v jiných případech tento syndrom vyvolat. Jestliže uvedená léčba nemá dostatečný účinek, doporučuje se kombinovaný přístup podle „protokolu HLH-2004“ (20), který je standardem v léčbě primární HLH. Protokol je založen na kombinaci intravenózního dexamethasonu, etoposidu, cyklosporinu, dále intrathékalní aplikaci methotrexátu a kortikoidů u CNS (centrální nervový systém) symptomatologie nebo abnormálního nálezu v mozkomíšním moku. Iniciální léčba je následována transplantací kostní dřeně (u primární HLH nebo těžké reaktivní formy).
V refrakterních případech je možné také využít intravenózních imunoglobulinů (1 g/kg).
Bez adekvátní léčby mívá onemocnění většinou fatální průběh, mortalita závisí i na primárním (autoimunitním) onemocnění. Henter a spol. analyzovali 113 dětských pacientů (do věku 15 let), tři roky přežilo 51 % pacientů s primární HLH a 55 % s reaktivní HLH (MAS), všichni pacienti obdrželi léčbu podle „HLH-94 protokolu“ (20).
V prezentovaném případě se podařilo i přes počáteční život ohrožující stav docílit stabilizace funkce životně důležitých orgánů a také remise MAS i SND. Několikatýdenní prodleva v rozpoznání SND komplikované MAS souvisí s diagnostikou „per exclusionem“, zahrnující širokou paletu příčin „septického stavu“. Navíc výskyt MAS u dospělých pacientů je vzácnější než v dětském věku. Významně zvýšená hodnota sérového ferritinu přispěla k posunu diagnostického pátrání směrem k SND a k vyšetření kostní dřeně s následným průkazem fenoménu hemofagocytózy. Hyperferritinémie bývá přítomná u většiny pacientů se SND a zároveň je jedním z kritérií pro diagnózu primární HLH a ostatních reaktivních forem včetně MAS (ferritin > 500 μg/l), dalším pomocným ukazatelem je snížené množství jeho glykosylované formy pod 20 %, zatímco u zdravých osob bývá kolem 50–80 % (4). Kromě diagnostického významu hraje sledování sérové koncentrace ferritinu roli při hodnocení aktivity a odpovědi na léčbu (u pacientů se SND i MAS) (21), jak jsme mohli pozorovat i ve výše uvedené kazuistice.
ZÁVĚR
Prezentovaný případ dokumentuje potencionálně život ohrožující syndrom, který je komplexněji zkoumán teprve v posledních dvou dekádách a jehož znalost je nutností v rámci diferenciální diagnostiky horečky nejasného původu, septických stavů a také autoimunitních systémových onemocnění. MAS je v klinické praxi pravděpodobně stále nedostatečně často diagnostikovaný, kritický stav a orgánová dysfunkce (až selhání) bývají vysvětlovány jinými příčinami. Náhlý začátek MAS, imitující rozvoj septického šoku, by měl být imperativem pro včasné rozpoznání a rychlé zahájení adekvátní léčby, což jsou dva faktory významně ovlivňující prognózu pacientů.
MUDr. Jan Tomš
Oddělení revmatologie a klinické farmakologie
2. interní klinika, Lékařská fakulta UK a Fakultní nemocnice Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: jan.toms@fnhk.cz
Sources
1. Still GF. On a form of chronic joint disease in children. Med Chir Trans 1897; 80 : 47.
2. Bywaters EG. Stillęs disease in the adult. Ann Rheum Dis 1971; 30 : 121.
3. Yamaguchi M, Ohta A, Tsunematsu T. Preliminary criteria for classification of adult Stillęs disease. J Rheumatol 1992; 19 : 424-430.
4. Deane S, Selmi C, Teuber SS, Gershwin ME. Macrophage Activation Syndrome in Autoimmune Disease. Int Arch Allergy Immunol 2010; 153 : 109-120.
5. Sawhney S, Woo P, Murray KJ. Macrophage activation syndrome: A potentially fatal complication of rheumatic disorders. Arch Dis Child 2001; 85 : 421-426.
6. Behrens EM, Beukelman T, Paessler M, Cron RQ. Ocult macrophage activation syndrome in patients with systemic juvenile idiopathic arthritis. J Rheumatol 2007; 34 : 1133-1138.
7. Parodi A, Davi S, Pringe AB, Pistorio A, Ruperto N, Magn-manzoni S, et al. Macrophage Activation syndrome in Juvenile Systemic Lupus Erythematosus. Arthritis Rheum 2009; 60(11): 3388-3399.
8. Athreya BH. Is macrophage activation syndrome a new entity? Clin Exp. Rheumatol 2002; 20 : 121-123.
9. Ramanan AV, Schneider R. Macrophage activation syndrome – whatęs in a name? J Rheumatol 2003; 30 : 2513-2516.
10. Ravelli A, Martini A. macrophage activation syndrome. In: Lehman TH, Cimaz R. Pediatric rheumatology. Amsterdam: Elservier, 2008, str. 55-63.
11. Grom AA, Villanueva J, Lee S, Goldmuntz EA, Passo MH, Filipovich A. natural killer cell dysfunction in patients with systemic onset juvenile rheumatoid arthritis and macrophage activation syndrome. J Pediatr 2003; 142 : 292-296.
12. Ramanan AV, Schneider R. Macrophage activation syndrome following initiation of etanercept in a child with systemic onset juvenile rheumatoid arthritis. J Rheumatol 2003; 30(2): 401-403.
13. Arlet JB, Le Thi Huong D, Marinho A, Amoura Z, Wechsler B, Papo T, Piette JC. Reactive hemophycocytic syndrome in adult-onset Stillęs disease: a report of six patients and a review of the literature. Ann Rheum Dis 2006; 65(12): 1596-1601.
14. Franchini S, Dagna L, Salvo F, Aiello P, Baldissera E, Sabbadini MG. Adult-onset Stillęs disease: clinical presantation in a large cohort of Italian patients. Clin Exp Rheumatol 2010; 28 : 41-48.
15. Ravelli A, Magni-manzoni S, Pistorio A, Besana C, Foti T, Ruperto N et al. Preliminary diagnostic guidelines for macrophage activation syndrome complicating systemic juvenile idiopathic arthritis. J Pediatr 2005; 146 : 598-604.
16. Mouy R, Stephan JL, Pillet P, Haddad E, Hubert P, Prieur AM. Efficacy of cykclosporin A in th treatment of macrophage activation syndrome in juvenile arthritis: report of five cases. J Pediatr 1996; 129(5): 750.-754
17. Ravelli A, De benedetti F, Viola S, Martini A. Macrophage activation syndrome in systemic juvenile rheumatoid arthritis succaessfully treated with cyclosporine. J Pediatr 1996; 128 : 275-278.
18. Cortis E, Insalaco A. Macrophage activation syndrome in juvenile idiopathic arthritis. Acta Paediatr Suppl 2006; 95 : 38-41.
19. Janka GE, Schneider EM. Modern management of children with haemophagocytic lymphohistiocytosis. Br J Haematol 2004; 124 : 4-14.
20. Henter JI, Samuelsson-Horne A, Arico M, Egeler RM, Elinder G, Filipovich AH, et al. Treatment of hemophagocytic lymphohistocytosis with HLH-94 immunochemotherapy and bone marrow transplantation. Blood 2002; 100 : 2367-2373.
21. Ravelli A. Macrophage activation syndrome. Curr Opin Rheumatol 2002; 14(5): 548-552.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2012 Issue 3
Most read in this issue- Multiorgan failure and macrophage activation syndrome in adult-onset Still´s disease
- Treatment of osteoarthritis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career