-
Medical journals
- Career
Proteíny tepelného šoku – dôležitá súčasť imunitnej odpovede
: M. Remáková; P. Novota
: Revmatologický ústav Praha
: Čes. Revmatol., 17, 2009, No. 4, p. 206-212.
: Overview Reports
Autoimunitné ochorenia postihujú približne 5–7 % ľudskej populácie. Ich charakteristickým prejavom je rozoznávanie a deštrukcia vlastných buniek, tkanív a orgánov. Medzi najdôležitejšie gény, ktoré súvisia so vznikom autoimunitných ochorení patria gény hlavného histokompatibilného komplexu (MHC). Funkcia MHC molekúl I./II. triedy pri rozvoji autoimunitných chorôb je v súčasnosti dobre preštudovaná, vplyv ostatných génov MHC však nie je dostatočne preskúmaný. Do skupiny MHC génov patrí aj oblasť približne 150 „non Class I/II MHC“ génov. Tieto gény sú majoritne zastúpené v imunitnej a zápalovej reakcii organizmu a sú preto zaujímavé
z hľadiska asociácie so vznikom autoimunitných ochorení. V tejto časti MHC, medzi génmi I. a II. triedy, sú lokalizované tri gény pre proteíny tepelného šoku (HSP) o veľkosti 70kDa. Experimentálne a klinické štúdie potvrdili, že HSP proteíny sú zahrnuté do regulácie niektorých autoimunitných ochorení. Ich vysoká evolučná konzervovanosť, ďalej ich nepostrádateľná úloha vo vnútrobunkových procesoch, a zároveň inducibilita ich expresie počas bunkového stresu upozorňujú na ich významnú úlohu v udržiavaní homeostázy. Táto práca popisuje úlohu týchto molekúl v procese etiopatogenézy autoimunitných ochorení.Kľúčové slová:
autoimunita, hlavný histokompatibilný komplex (MHC), rizikový faktor, heat-shock proteín (HSP).Úvod
Proteíny tepelného šoku patria medzi najrozšírenejšie polypeptidy a je pre ne charakteristická takmer nezmenená štruktúra počas celého evolučného vývoja. Zohrávajú významnú úlohu v imunitnej odpovedi organizmu. Z pohľadu etiológie autoimunitných ochorení, je cytotoxická i špecifická protilátková imunitná odpoveď častokrát namierená proti epitopom molekúl HSP a spôsobuje deštrukciu infikovaných buniek, tým ohraničujú miesto infekcie a chránia jedinca. Keďže rovnaké epitopy sú aj v molekulách HSP zdravých buniek, zvyšuje sa pri imunitnej odpovedi, kde cieľom sú epitopy HSP, riziko autoimunitnej reakcie. Molekuly HSP majú však aj ďalšie funkcie, z ktorých najdôležitejšie a zároveň najlepšie preskúmané sú celulárne protektívna funkcia a úloha pri prezentácii antigénu na MHC molekulách.
Hlavný histokompatibilný komplex (MHC – major histocompatibility complex) – komplex génov s najvýznamnejšou úlohou v imunitnej reakcii
Hlavný histokompatibilný komplex človeka sa nachádza na krátkom ramene 6. chromozómu v oblasti p21 a zahŕňa úsek dlhý približne 4000 kilobáz (kb) (1). Humánny hlavný histokompatibilný komplex sa označuje ako Human Leukocyte Antigens – HLA a pozostáva z viacerých lokusov. Medzi HLA-antigény I. triedy patria lokusy HLA-F, -G, -A, -E, -C a -B. HLA antigény I. triedy ležia telomericky. Gény lokusov umiestnených centromericky – HLA-DR, DQ, DP – kódujú HLA-antigény II. triedy. Génová oblasť nachádzajúca sa medzi HLA antigénmi I. a II. triedy je niekedy označovaná ako III. trieda. Gény MHC I. a II. triedy patria medzi transmembránové glykoproteíny a zohrávajú dôležitú úlohu v regulácii imunitnej odpovede tým, že sa podieľajú na prezentácii antigénu. Gény III. triedy tvoria heterogénnu skupinu génov, ktoré sú z veľkej časti zapojené do imunitnej odpovede organizmu (2). Štúdie porovnávajúce polymorfizmy HLA-antigénov u pacientov a zdravých kontrol odhalili, že polymorfizmus génov HLA komplexu je asociovaný s viac ako 40 rôznymi autoimunitnými ochoreniami. V niektorých prípadoch sa so vznikom autoimunitných porúch črtá priama účasť produktov génov I. a II. triedy, ako aj menej variabilných produktov génov III. triedy. Avšak v mnohých prípadoch kvôli silnej väzbovej nerovnováhe alel v týchto oblastiach nie je jasné, či sú za silnú asociáciu zodpovedné priamo polymorfizmy génov jednotlivých lokusov I., II. alebo III. triedy, alebo sa jedná o väzbu s iným génom v HLA, ktorý môže byť priamo zapojený do etiopatogenézy daného ochorenia (1).
Prezentácia antigénov MHC molekulami I. a II. triedy
Základnou funkciou molekúl MHC je viazať imunogénne peptidy a prezentovať ich T-lymfocytom. Molekuly MHC I. triedy viažu endogénne peptidy dlhé 8–11 aminokyselín a prezentujú ich CD8+ T-lymfocytom. Molekuly MHC II. triedy viažu peptidy exogénneho pôvodu zložené z 10–34 aminokyselín a prezentujú ich CD4+ T-lymfocytom. V procese prezentácie antigénov existujú jasné dôkazy, ktoré potvrdzujú kritickú úlohu HSP v transporte peptidov k molekulám MHC (3). Molekuly I. triedy viažu peptidy v endoplazmatickom retikule (ER). Tieto peptidy vznikajú proteolýzou proteínov v proteozómoch cytoplazmy, odkiaľ sú transportované do ER pomocou heterodimerických prenášačov tvorených molekulami TAP1 a TAP2 (transporter associated with processing). Predĺžené N-konce prekurzorových peptidov sú tu štiepené aminopeptidázou ERAAP (aminopeptidáza spojená s vývojom antigénov v ER) a takto upravené peptidy sa viažu na MHC molekuly I. triedy prítomné v ER. Komplexy sú spoločne transportované na bunkový povrch cez Golgiho aparát (4).
Proteíny tepelného šoku sa v procese prezentácie endogénneho peptidu podieľajú na selekcii proteínov, ktoré sú určené na proteolýzu a na transporte proteínov z proteozómu do ER (3). Pri tomto transporte HSP70 viaže proteín z proteozómu, odovzdáva ho HSP90, ktorý ho prenáša k molekulám TAP. Po prechode do lumenu ER ho zachytáva HSP96 a prenáša ho k MHC molekulám I. triedy (4) (obr. 1a).
1. Obr. 1. ER – endoplazmatické retikulum,TAP– prenášač spojený so spracovaním antigénu,ERAAP – aminopeptidáza spojená s vývojom antigénov v ER, HSP – proteíny tepelného šoku, GA – Golgiho aparát, TCR – T-bunkový receptor A: Prezentácia peptidov na antigénoch MHC I. triedy MHC molekuly I. triedy prezentujú za fyziologických podmienok peptidy endogénneho pôvodu. Proteíny sú štiepené na peptidy proteolýzou v proteazóme, odkiaľ sú transportované do ER pomocou prenášačov tvorených molekulami TAP. V ER sú peptidy štiepené aminopeptidázou ERAAP a vytvárajú komplexy s MHC molekulami I. triedy. Komplex MHC I. + peptid prechádza cez Golgiho aparát a ďalej je transportovaný na bunkový povrch, kde je peptid prezentovaný CD8+ T-bunkám. Proteíny tepelného šoku sa v procese prezentácie endogénneho peptidu podieľajú na selekcii proteínov určených na prezentáciu, stabilizujú proteín až po spracovanie v proteazóme, ďalej vytvárajú komplexy s peptidmi poštiepenými v proteazóme a konečne, účastnia sa transportu do ER. Pri transporte peptidov z proteazómu ako prvý viaže peptid HSP70, následne ho odovzdáva HSP90 a ten ho prenáša k molekulám TAP. Po prechode do lumenu ER peptid zachytáva HSP96 a prenáša ho k MHC molekulám I. triedy. B: Prezentácia peptidov na antigénoch MHC II. triedy MHC molekuly II. triedy prezentujú väčšinou peptidy exogénneho pôvodu, ktoré vstupujú do bunky endocytózou alebo fagocytózou. MHC molekuly II. triedy sú vezikulami prenášané z ER smerom k membráne bunky. Tieto vezikuly sa spájajú s endozómom za vzniku endolyzozómu. Exogénne peptidy sú tu proteolyticky štiepené proteázami na peptidy. Tieto sa viažu na MHC molekuly II. triedy a sú transportované na membránu bunky a prezentované CD4+ T-bunkám. Úloha HSP pri tomto type prezentácie antigénov nie je presne známa. Predpokladá sa však, že HSP môžu byť zahrnuté do internalizácie exogénnych proteínov do endozómu a stabilizujú proteíny pri štiepení proteázami v endolyzozóme. C: Cross-prezentácia MHC molekuly I. triedy môžu za určitých podmienok okrem peptidov endogénneho pôvodu prezentovať aj peptidy exogénneho pôvodu procesom, ktorý sa nazýva cross-prezentácia. Exogénne proteíny vstupujú do bunky fagocytózou za vzniku fagozómu. Predpokladá sa, že sa fagozóm následne spája s vezikulou pochádzajúcou z ER a vzniká ER-fagozóm. Proteíny sú z ER-fagozómu – zatiaľ neznámym spôsobom – transportované do proteazómu a tu sú proteolyticky štiepené za vzniku peptidov. Vzniknuté peptidy sú transportované do ER pomocou prenášačov tvorených molekulami TAP. V Endoplazmatickom retikule sú peptidy štiepené aminopeptidázou ERAAP a vytvárajú komplexy sMHC molekulami I. triedy. Tieto molekuly sú ďalej za účasti GA spracované a transportované na bunkový povrch . Na bunkovom povrchu sú prezentované CD8+ T-bunkám. Úloha HSP pri tomto type prezentácie antigénov nie je presne známa. Predpokladá sa však dôležitá úloha pri internalizácii exogénnych peptidov do fagozómu a úloha pri prenose proteínov z ER-fagozómu do proteozómu. 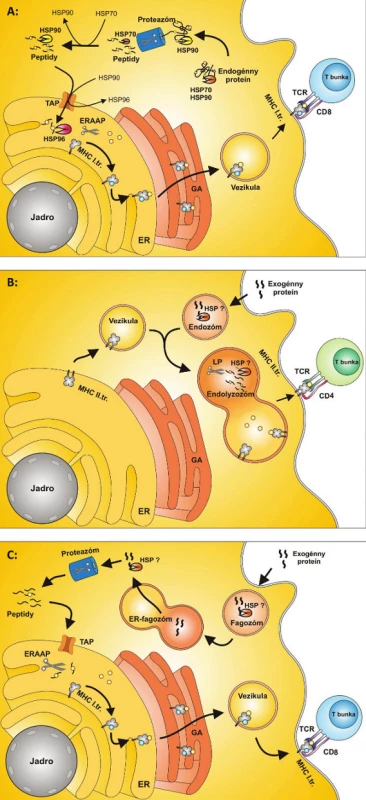
MHC molekuly II. triedy prezentujú peptidy exogénneho pôvodu, ktoré vstupujú vo forme proteínov do bunky pomocou membránových vezikúl, najčastejšie fagoocytózou. Tieto vezikuly sa zlučujú s lyzozómom a vzniknutý útvar sa nazýva fagolyzozóm. Fagolyzozóm obsahuje proteázy, ktoré rozkladajú a degradujú proteíny. Tieto sú následne viazané na molekuly II. triedy a sú transportované na membránu bunky (5). Úloha HSP pri tomto type prezentácie antigénov nie je presne známa. Vzhľadom k štruktúre a základnej funkcii HSP však do úvahy prichádza ich úloha pri foldingu a transporte peptidov z endozómu smerom k membráne antigén prezentujúcej bunky (APC) (obr. 1b).
Exogénna cesta prezentácie peptidov aktivuje CD4+ T-lymfocyty, ale CD8+ T-lymfocyty, typické pre anti-vírovú a anti-nádorovú imunitnú odpoveď, nie sú touto cestou aktivované. Pre aktiváciu CD8+ T-lymfocytov exogénnymi antigénmi je potrebná cross-prezentácia (6). Medzi antigén prezentujúce bunky schopné cross-prezentácie, patria dendritické bunky (DC) a ďalej v menšej miere makrofágy a B-lymfocyty. Dendritická bunka fagocytuje vírusom infikovanú, alebo nádorovú bunku a antigén sa po spracovaní dostáva na povrch bunky. Celý intracelulárny proces cross-prezentácie je zatiaľ neznámy, predpokladá sa však, že peptidy sú transportované do ER molekulami TAP, kde sa spájajú s MHC molekulami I. triedy (7). Po väzbe s MHC molekulami I. triedy a exponovaní na povrchu membrány je komplex MHC I. triedy a imunogénny fragment rozpoznávaný CD8+ T-lymfocytom a dochádza k jeho aktivácii (obr. 1c).
Molekulárna štruktúra proteínov tepelného šoku a ich úloha v imunitnej odpovedi
HSP predstavujú skupinu molekulárnych šaperónov, ktoré sa zachovali v organizmoch počnúc prokaryotmi až po eukaryoty (8). Sú rozdelené do niekoľkých rodín podľa ich molekulovej hmotnosti: malé HSP (12-43kDa), HSP40, HSP60, HSP70, HSP90 a veľké HSP (100-110 kDa) (9).
Bunky stavovcov obsahujú najmenej 12 rôznych génov pre proteíny HSP70 (10), z ktorých tri sú kódované v MHC oblasti medzi génmi MHC I. triedy a MHC II. triedy. Sú to HSP70-1 (HSPA1A) a HSP70-2 (HSPA1B) kódujúce dve izoformy stresom indukovateľného proteínu, a HSP70–HOM (HSPA1L). Expresia HSP70-HOM je tkanivovo špecifická a je exprimovaný konštitutívne (11).
Štruktúra HSP70 a HSP90 je známa. HSP90 má tri štruktúrne domény: 1) N-terminálna nukleotidová väzobná doména (NBD – nucleotid binding domain), na ktorú sa môže viazať inhibítor HSP90 (12) alebo môže viazať aj peptidy (13); 2) stredný segment, ktorý interaguje s peptidom a 3) C-terminálny koniec, ktorý sa zúčastňuje homodimerizácie (14). HSP70 má dve domény: NBD a substrát viažucu doménu (SBD – substrate binding domain). N-terminálna NBD doména veľkosti 44-kDa má ATPázovú aktivitu a spája sa s DnaJ – košaperónom HSP70. C-terminálny koniec veľkosti 27-kDa sa skladá z SBD domény a z úseku s typickou štruktúrou zvanou príklop (15). Tieto dve domény sa spájajú konzervovaným úsekom, ktorý je dôležitý na komunikáciu medzi doménami (16). Štruktúrny základ naviazania proteínu je najpodrobnejšie preštudovaný u HSP70. Je známa kryštalická štruktúra jeho SBD domény (17) ako aj štruktúra SBD domény v roztoku (18) pri interakcii s modelovým peptidom. Dôležitým poznatkom je, že HSP70 interaguje hlavne s neposkladanými polypeptidovými reťazcami, s výnimkou tumor supresorového génu p53 (19).
Molekulárne šaperóny HSP70 tvoria vysoko konzervovanú rodinu konštitutívnych aj stresom indukovateľných proteínov. Za normálnych podmienok reprezentujú najpočetnejšiu skupinu intracelulárnych proteínov, ktoré sú zodpovedné za naviazanie a stabilizáciu vznikajúceho proteínového reťazca, udržiavanie správnej konformácie za import proteínu do bunkových kompartmentov, skladanie a rozkladanie proteínových komplexov a reguláciu degradácie proteínov v lyzozómoch (20). Z imunologického hľadiska sú HSP zahrnuté do imunitnej odpovede. Sú schopné stimulovať vrodený a adaptívny imunitný systém. Nové biochemické štúdie a analýzy štruktúry nedávno potvrdili úlohu HSP u niektorých experimentálnych modelov prezentácie antigénov (21).
Štruktúrny základ naviazania peptidu a dynamické modely interakcie ligandov sú známe u niektorých členov rodiny HSP, hlavne u HSP70 a HSP90. Kritickú úlohu pri navodení adaptívnej imunity zohrávajú HSP v naviazaní antigénov a v ich doručení APC bunkám (22). Pre rôzne stresové proteíny, hlavne HSP70, HSP90 a gp96, existujú popísané 3 hlavné stupne aktivácie imunitného systému. Prvý stupeň zahŕňa lokalizáciu proteínov HSP70 a HSP90 na povrchu niektorých nádorových alebo vírusom infikovaných buniek, druhý zahŕňa schopnosť stresových proteín-peptidových komplexov vyvolať cytotoxickú odpoveď T-lymfocytov proti bunkám, ktoré produkujú tieto peptidy. Tretí stupeň aktivácie imunity zahŕňa HSP-sprostrekovanú produkciu cytokínov (23).
HSP proteíny sú evolučne vysoko konzervované, čo poukazuje na ich významnú úlohu vo vnútrobunkových procesoch. Spoločne s ich inducibilitou počas bunkového stresu upozorňujú na ich významnú úlohu pri rozpoznávaní antigénov imunitným systémom (24). HSP sa uvoľňuje z mikroorganizmov, ktoré sú vystavené stresu, z autológneho zapáleného alebo nekrotizujúceho tkaniva. Molekuly HSP sú identifikované povrchovými receptormi buniek hostiteľského imunitného systému (Toll-like receptor – TLR-4, TLR-2, CD14, CD19, CD91, LOX-1, SR-A). Za účasti HSP proteínov je imunitný systém informovaný o vnútorných patologických procesoch. HSP sú exprimované na povrchu bunky počas zápalovej reakcie, keď je bunka vystavená celulárnemu stresu, a aj vďaka prítomnosti HSP70 na povrchu bunky je takáto poškodená bunka rozpoznávaná imunitným systémom (25). Vďaka svojej konzervovanosti a indukovateľnosti stresom, sa HSP môžu stať terčom imunitnej odpovede, ktorá v konečnom dôsledku môže viesť ku vzniku chorôb imunitného systému, ako napríklad autoimunitná artritída, ateroskleróza, autoimunitný diabetes, autoimunitná demyelinizácia alebo juvenilná dermatomyozitída (26). Navodenie humorálnej a/alebo bunkovej imunitnej odpovede proti mikrobiálnym alebo vlastným HSP, predstavuje kritickú zložku pri imunitných procesoch spojených s týmito chorobami. Mechanizmus, ktorým imunitná odpoveď proti HSP vedie k imunopatológii, zatiaľ nie je známy, sú však popísané tri možné mechanizmy.
- Aktivácia vrodenej imunity
Makrofágy a dendritické bunky reagujú na nadexpresiu HSP počas bunkového stresu uvoľňovaním príslušných pro-zápalových cytokínov (27). Táto skorá, vrodená imunitná odpoveď môže vyvolať adaptívnu imunitnú odpoveď proti HSP. Okrem toho, protilátky proti HSP a imunitné komplexy obsahujúce HSP a anti-HSP protilátky môžu spustiť potenciálny efektorový mechanizmus aktiváciou komplementového systému.
- Expresia stresom indukovateľného HSP a zámena prezentovaného epitopu
Expresia endogénneho HSP sa významne zvýši, ak v bunke prebieha zápalová reakcia, alebo je vystavená inému typu celulárneho stresu. Tieto procesy môžu ovplyvniť prezentáciu antigénu HSP. Takto môže dochádzať k odkrývaniu kryptického epitopu (28) a ten môže následne vyvolať imunitnú odpoveď vedúcu k imunitnej patológii.
- Molekulárne mimikry
Skupina proteínov HSP65 vykazuje viac ako 70% homológie medzi prokaryotickými a ľudskými molekulami. Mikrobiálne HSP65 obsahujú B - a T-bunkové epitopy, ktoré majú schopnosť krížovej reakcie s vlastnými HSP65 (29). Preto T-bunky indukované mikrobiálnymi HSP môžu napadnúť bunky nesúce vlastné HSP a spôsobiť tým poškodenie tkaniva pomocou cytotoxickej reakcie. Protilátky namierené proti mikrobiálnym HSP môžu rozpoznávať vlastné HSP, a tým sa podieľať na imunitnej reakcii. Tento mechanizmus je označovaný ako molekulárne mimikry. Príkladom sú protilátky anti-mikrobiálnych HSP65, ktoré sú krížovo reaktívne s vlastnými HSP65 a môžu sa tak podieľať na patogenéze aterosklerózy (30).
2. Obr. 2. Génová mapa MHC: Hlavný histokompatibilný komplex človeka sa nazýva Human Leukocyte Antigens. Delí sa na oblasti MHC molekúl I. a II. triedy (u človeka HLA-antigény I. triedy a II. triedy) a tzv. “non class I/II MHC“ molekuly. Medzi MHC antigény I. triedy patria gény, ktoré sú zapojené do endogénnej cesty prezentácie antigénu a smerom od teloméry umiestnené v poradí: HLA-F, -G, -A, -E, -C a –B. Gény lokusov umiestnených centromericky – HLA-DR, DQ, DP – kódujú MHC antigény II. triedy, ktoré sú zapojené do exogénnej cesty prezentácie antigénu. Gény oblasti nachádzajúcej sa medzi MHC antigénmi I. a II. triedy, sú označované ako gény “non classI/II MHC” gény. V tejto oblasti sanachádzajú okrem iných tri gény pre proteíny HSP70 (heat shock protein) – HSP70-1, HSP70-2 a HSP70-3. 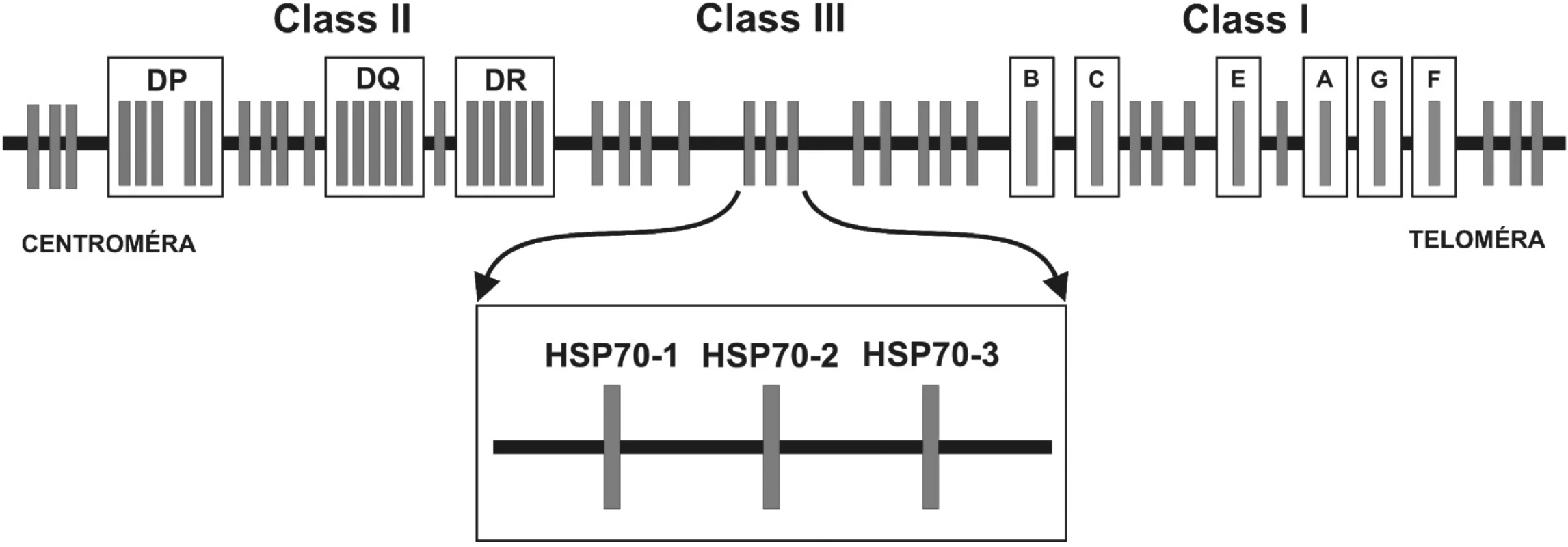
Molekuly proteínov tepelného šoku zohrávajú dôležitú úlohu v procese autoimunity
Protilátky proti rôznym členom rodiny HSP sú detekovateľné v normálnych zdravých sérach. Tieto protilátky sú súčasťou fyziologickej imunitnej odpovede organizmu a sú považované za protektívne z pohľadu rozvoja autoimunitných chorôb (31). Množstvo protilátok proti HSP alebo transmembránovým molekulám T-buniek pôsobiacich s HSP môže byť zvýšené aj v sérach pacientov s autoimunitnými chorobami (32). Napríklad autoprotilátky proti ľudskému HSP60 boli nájdené u pacientov s reumatoidnou artritídou – RA (33) a s diabetes mellitus I. typu – T1DM (34), protilátky proti mykobakterálnemu HSP65 boli detekované u pacientov s RA, systemickým lupus erythematodes - SLE (35), primárnou biliárnou cirhózou (36), Crohnovou chorobou alebo s ulceróznou kolitídou (37). Úlohu HSP v regulácii týchto autoimunitných ochorení potvrdili experimentálne a klinické pozorovania. Schopnosť proteínu HSP70 vyvolať prirodzenú a adaptívnu imunitnú odpoveď proti antigénom viazaným s HSP70 podporuje tvrdenie, že regulácia expresie HSP70 môže byť zahrnutá do iniciácie vzniku autoimunity (38). Takáto neprimeraná expresia HSP môže tiež vyvolať zápalové reakcie.
Reumatoidná artritída – RA je systémové zápalové autoimunitné ochorenie, ktoré sa prejavuje hlavne zápalom a bolestivosťou kĺbov a ich degeneratívnym postihnutím. Synoviálna tekutina u pacientov s RA obsahuje bunky, ktoré exprimujú zvýšené množstvo HSP70 a prejavujú zvýšenú aktivitu transkripčného faktora HSP (heat-shock trascription factor - HSF) (39). Dendritické bunky zo synoviálnej tekutiny pacientov s RA exprimujú povrchové HSP70. Reumatoidné ako aj zdravé DC majú schopnosť viazať HSP nachádzajúce sa v synoviálnej tekutine ako aj purifikované HSP70 (40). Experimentálne štúdie potvrdzujú, že HSP70 v kĺboch pacientov s RA môže byť zahrnutý do aktivácie APC, prezentácie vlastných antigénov a krížovej reakcie autoreaktívnych T-lymfocytov spojených s chronickým zápalom kĺbov.
Diabetes mellitus I. typu (type I diabetes mellitus – T1DM) je ťažká metabolická porucha definovaná úplným nedostatkom inzulínu. Je dôsledkom progresívnej deštrukcie inzulín produkujúcich pankreatických ß-buniek (41). HSP má dôležitú úlohu v indukcii imunity ovplyvnenej ß-bunkami a vo vývoji diabetes mellitus I. typu. HSP70 vykazuje zvýšenú reguláciu pri odpovedi na bunkový stres (42). V kultivovaných langerhansových ostrovčekoch a ß-bunkách, ktoré boli vystavené podmienkam bunkového stresu – napríklad hypertermii (tepelný šok) – sa zvýšila expresia HSP70. Zvýšená expresia potom viedla k účinnej ochrane pred poškodením ß-buniek (43). V periférnych mononukleárnych krvných bunkách (PBMCs) pacientov s novodiagnostikovaným T1DM, bola odhalená porucha odpovede HSP70 na tepelný šok. Stimulácia HSP70 bola v tomto prípade pod kontrolou zápalových cytokínov (IFNγ a ďalšie cytokíny Th1-buniek), čo bolo preukázané znížením expresie HSP70 v PBMCs. Avšak, ak boli tieto bunky vystavené pôsobeniu TGFß (cytokíny Th2-buniek), expresia HSP70 sa nezmenila. (44).
Perschinka et al. (2003) potvrdili účasť proteínu HSP65 pri ateroskleróze, keď u pacientov s touto chorobou zistili vysokú koncentráciu sérových protilátok proti chlamýdiovým (CHSP65) a ľudským HSP65 (HHSP65) (29). Okrem toho, T-lymfocyty izolované z ľudských aterosklerotických lézií odhalili významnú reaktivitu proti CHSP65 a HHSP65 (45). Štúdie u pacientov s RA a juvenilnou idiopatickou artritídou – JIA odhalili prítomnosť T-buniek v synoviálnej tekutine, ktoré sú takisto reaktívne proti mikrobiálnym HSP65 a vylučujú pro-zápalové cytokíny (46). Na základe týchto štúdií môžeme vysloviť hypotézu o úlohe HSP v iniciácii a vývoji autoimunitných artritíd. V porovnaní s patogénnou funkciou HSP65, predovplyvnenie myší proteínom HSP65 spomalilo nástup aterosklerózy, poukazujúc tým na regulačné vlastnosti imunity proti HSP65 (47). Indukovaná artritída – IA sa používa ako model pre RA a JIA. U kmeňov potkanov susceptibilných na indukovanú artritídu je možné indukovať artritídu imunizáciou usmrtnenými M. tuberculosis. U jedincov s indukovanou artritídou sú hlavným cieľom imunitnej odpovede mykobakteriálne HSP65 (48). Výsledky štúdií odhalili, že včasná predaplikácia humánneho HSP65 kmeňom potkanov susceptibilných k indukovateľnej artritíde redukuje riziko vzniku IA (49).
Molekuly HSP hrajú teda dôležitú ochrannú funkciu a zároveň majú silný imunoregulačný potenciál. HSP proteíny prítomné na bunkovom povrchu alebo v medzibunkovom priestore poskytujú účinné stimulačné signály bunkám vrodenej imunity, a tým indukujú ich pro-zápalovú aktivitu (50). Imunoregulačná funkcia HSP70 prispieva k aktivácii hostiteľského protinádorového a protimikrobiálneho obranného mechanizmu (51). Ďalej môže byť zahrnutá v udržiavaní tolerancie (52), ale aj v indukcii autoimunity (53). Výsledky štúdií zameraných na meranie množstva protilátok proti HSP u pacientov s autoimunitnými chorobami sú však kontroverzné. Niektorí autori úspešne pozorovali zvýšené hladiny protilátok anti-HSP65 u pacientov s SLE a RA (35), zatiaľ čo ostatní nepozorovali žiadne významné rozdiely koncentrácií anti-HSP65 v sérach zdravých kontrol v porovnaní s pacientmi s SLE (54). Vo všeobecnosti, protilátky proti HSP60, HSP70 a HSP90 boli nájdené u rôznych autoimunitných chorôb, ale frekvencia týchto protilátok sa líši u rôznych štúdií a významne závisí od metód detekcie (32).
Záver
Proteíny HSP zohrávajú dôležitú úlohu v procese imunitnej odpovede organizmu. Evolučná konzervovanosť a vysoký stupeň medzidruhovej sekvenčnej homológie v HSP predurčuje tieto molekuly na to aby sa stali „chybným“ terčom protilátok produkovaných proti HSP molekulám patogénov. Zároveň zohrávajú HSP proteíny nezastupiteľnú úlohu pri imunoregulácii a pri ochrane organizmu, kedy sú zodpovedné za stabilizáciu, folding, ochranu a transport iných proteínov v bunke. Preto by nám komplexné poznanie faktorov, ktoré určujú ich patogénne resp. ochranné vlastnosti, v budúcnosti pomohlo skôr odhaliť vznik imunologických porúch, lepšie pochopiť ich etiológiu, a tým uľahčiť vývoj nových imunoregulačných prostriedkov na ich liečbu.
Táto práca bola podporená výskumným zámerom MZ ČR 000 000 23728.
RNDr. Peter Novota, Ph.D.
Revmatologický ústav
Odd. molekulární biologie a imunogenetiky
Na Slupi 4
128 50 Praha 2
e-mail: novota@revma.cz
Sources
1. Sargent CA, Dunham I, Trowsdale J, Campbell RD. Human major histocompatibility complex contains genes for the major heat shock HSP70. Proc Natl Acad Sci USA 1989; 86 : 1968–72.
2. Lie BA, Thorsby E. Several genes in the extended human MHC contribute to predisposition to autoimmune diseases. Current Opinion in Immunology 2005; 17 : 526–31.
3. Udono H, Ichiyanagi T, Mizukami S, Imai T. Heat shock protein in antigen trafficking – Implications on antigen presentation to T cells. International Journal of Hyperthermia 2009; 1-9.
4. Hickman-Miller H, Hildebrand WH. The immune response under stress: the role of Hsp-derived peptides. Trends in Immunology 2004; 25 : 427–33.
5. Schmid D, Münz C. Immune surveillance of intracellular pathogens via autophagy. Cell Death and Differentiation 2005; 12 : 1519–27.
6. Rock KL. Exiting the outside world for cross presentation. Immunity 2006; 25 : 523-25.
7. Creswell P, Ackerman AL, Giodini A, Peaper DR, Wearsch PA. Mechanisms of MHC class I-restricted antigen processing and cross-presentation. Immunol Rev 2005, 207 : 145–57.
8. Lindquist S, Craig EA. The heat-shock proteins. Annu Rev Genet 1988; 22 : 631–37.
9. Weigl E, Kopeček P, Raška M, Hradilová Š. Heat shock proteins in immune reactions. Folia Microbiologica 1999; 44 : 561–6.
10. Tavaria M, Gabriele T, Kola I, Anderson RL. A hitchhiker’s guide to the human Hsp70 family. Cell Stress Chaperones 1996; 1 : 23–8.
11. Milner C, Campbell RD. Structure and expression of the three MHC-linked Hsp70 genes. Immunogenetics. 1990; 32 : 242–51.
12. Prodromou C, Roe SM, O’Brien R, Ladbury JF, Piper PW, Pearl LH. Identification and structural characterization of the ATP/ADP-binding site in the Hsp90 molecular chaperone. Cell 1997; 90 : 65–75.
13. Gidalevitz T, Biswas C, Diag H, Schneidman-Duhovny D, Wolfson HJ, Stevens F, et al. Identification of the N-terminal peptide binding site of glukose-regulated protein 94. J Biol Chem 2004; 279 : 16543–52.
14. Harris SF, Shiau AK, Agard DA. The crystal structure of the carboxy-terminal dimerization domain of htpG, the Escherichia coli Hsp90, reveals a potential substrate binding site. Structure 2004; 12 : 1087–97.
15. Bertelsen EB, Zhou H, Lowry DF, Flynn GC, Dahlquist FW. Topology and dynamics of the 10 kDa C-terminal domain of DnaK in solution. Protein Sci 1999; 8 : 343-54.
16. Jiang J, Prasad K, Lafer EM, Sousa R. Structural basis of interdomain communication in the Hsc70 chaperone. Mol Cell 2005; 20 : 513–24.
17. Zhu X, Zhao X, Burkholder WF, Gragerov A, Ogata CM, Gottesman ME. Structural analysis of substrate binding by the molecular chaperone DnaK. Science 1996; 272 : 1606–14.
18. Stevens SY, Cai S, Pellecchia M, Zuiderweg ER. The solution structure of the bacterial Hsp70 chaperone protein domain DnaK(393–507) in complex with the peptide NRLLLTG. Protein Sci 2003; 12 : 2588–96.
19. Pinhasi-Kimhi O, Michalovitz D, Ben-Zeev A, Oren M. Specific interaction between the p53 cellular tumour antigen and major heat shock proteins. Nature. 1986; 320 : 182–4.
20. Becker J, Craig EA. Heat-shock proteins as molecular chaperones. Eur J Biochem 1994; 219 : 11–23.
21. Javid B, MacAry PA, Lehner PJ. Structure and function: heat shock proteins and adaptive immunity. The Journal of Immunology. 2007; 179 : 2035–40.
22. Blond-Elguindi S, Cwirla SE, Dower WJ, Lipshutz RJ, Sprang SR, Sambrook JF. Affinity panning of a library of peptides displayed on bacteriophages reveals the binding specificity of BiP. Cell 1993; 75 : 717–28.
23. Moseley P. Stress proteins and the immune response. Immunopharmacology 2000; 48 : 299–302.
24. Basu S, Binder RJ, Ramalingam T, Srivastava PK. CD91 is a common receptor for heat shock proteins gp96, hsp90, hsp70 and calreticulin. Immunity 2001; 14 : 303–13.
25. van Eden W, van der Zee R, Prakken B. Heat shock proteins induce T-cell regulation of chronic inflammation. Nat Rev Immunol 2005; 5 : 318–30.
26. Granja C, Moliterno RA, Ferreira MS, Fonseca JA, Kalil J, Coelho V. T-cell autoreactivity to Hsp in human transplantation may involve both proinflammatory and regulatory functions. Hum Immunol 2004; 65 : 124–34.
27. Flohe SB, Bruggemann J, Lendemans S, Nikulina M, Meierhoff G, Flohe S, et al. Human heat shock protein 60 induces maturation of dendritic cells versus a Th1-promoting phenotype. J Immunol 2003; 170 : 2340–8.
28. Moudgil KD, Durai M. Regulation of autoimmune arthritis by self-heatshock proteins. Trends Immunol 2008; 29 : 412–18.
29. Perschinka H, Mayr M, Millonig G, Mayerl C, van der Zee R, Morrison SG, et al. Cross-reactive B-cell epitopes of microbial and human heat shock protein 60/65 in atherosclerosis. Arterioscler Thromb Vasc Biol 2003; 23 : 1060–5.
30. Alard JE, Dueymes M, Youinou P, Jamin C. Modulation of endothelial cell damages by anti-Hsp60 autoantibodies in systemic autoimmune diseases. Autoimmun Rev 2007; 6 : 438–43.
31. Cohen IR. The cognitive paradigm and the imunological homunculus. Immunol Today. 1992; 13 : 490-4.
32. Horváth L, Czirják L, Fekete B, Jakab L, Prohászka Z, Cervenak L, et al. Levels of antibodies against C1q and 60 kDa family of heat shock proteins in the sera of patients with various autoimmune diseases. Immunology Letters 2001; 75 : 103–9.
33. Hirata D, Hirai I, Iwamoto M, Yoshio T, Takeda A, Masuyama JI, et al. Preferential binding with Escherichia coli hsp60 of antibodies prelevant in sera from patients with rheumatoid arthritis. Clin Immunol Immunopathol 1997; 82 : 141–8.
34. Ozawa Y, Kasuga A, Nomaguchi H, Maruyama T, Kasatani T, Shimada A, et al. Detection of autoantibodies to the pancreatic islet heat shock protein 60 in insulin-dependent diabetes mellitus. J Autoimmunol 1996; 9 : 517–24.
35. Panchapakesan J, Daglis M, Gatenby P. Antibodies to 65 kDa and 70 kDa heat shock proteins an rheumatoid arthritis and systemic lupus erythematosus. Immunol Cell Biol 1992; 70 : 295–300.
36. Vilagut L, Parés A, ViĖas O, Vila J, Jiménez de Anta MT, Rodés J. Antibodies to mycobacterial 65-kD heat shock protein cross-react with the main mitochondrial antigens in patients with primary biliary cirrhosis. Eur J Clin Invest 1997; 27 : 667–72.
37. Stevens TR, Winrow VR, Blake DR, Rampton DS. Circulating antibodies to heat-shock protein 60 in Crohn’s disease and ulcerative colitis. Clin Exp Immunol 1992; 90 : 271–4.
38. Millar DG, Ohashi PS. Hsp70 family members, danger signals and autoimunity. In: Asea AAA, De Maio A (eds). Heat shock proteins: potent mediators of inflammation and imunity. Springer Netherlands 2007; 189–211.
39. Martin CA, Carson SE, Kowalewski R, Bernstein D, Valentino M, Santiago-Schwarz F. Abberant extracellular and dendritic cell (DC) surface expression of the heat shock protein (hsp)70 in the rheumatoid joint: possible mechanism of hsp/DC-mediated cross-priming. J Immunol 2003; 171 : 5736–42.
40. Santiago-Schwarz F, Anand P, Liu S, Carsons SE. Dendritic cells (DCs) in rheumatoid arthritis (RA): progenitor cells and soluble factors contained in RA synovial fluid yield a subset of myeloid DCs that preferentially activate Th1 inflammatory-type responses. J Immunol 2001; 167 : 1758–68.
41. Jahromi MM, Eisenbarth GS. Cellular and molecular pathogenesis of type 1A diabetes. Cell Mol Life Sci 2007; 64 : 865–72.
42. Bellmann K, Wenz A, Radons J, Burkart V, Kleemann R, Kolb H. Heat shock induces resistance in rat pancreatic islet cells against nitric oxide, oxygen radicals and streptozotocin toxicity in vitro. J Clin Invest 1995; 95 : 2840–5.
43. Kutlu B, Cardozo AK, Darville MI, Kruhoffer M, Magnusson N, Orntoft T. Discovery of gene networks regulating cytokine-induced dysfunction and apoptosis in insulin-producing INS-1 cells. Diabetes 2003; 52 : 2701–19.
44. Burkart V, Germaschewski L, Schloot NC, Bellmann K, Kolb H. Deficient heat shock protein 70 response to stress in leukocytes at onset of type 1 diabetes. Biochemical and Biophysical Research Communications 2008; 369 : 421–5.
45. Rossmann A, Henderson B, Heidecker B, Seiler R, Fraedrich G, Singh M, et al. T-cells from advanced atherosclerotic lesions recognize hHsp60 and have a restricted T-cell receptor repertoire. Exp Gerontol 2008; 43 : 229–37.
46. van Roon JA, van EdenW, van Roy JL, Lafeber FJ, Bijlsma JW. Stimulation of suppressive T cell responses by human but not bacterial 60-kD heatshock protein in synovial fluid of patients with rheumatoid arthritis. J Clin Invest 1997; 100 : 459–63.
47. Harats D, Yacov N, Gilburd B, Shoenfeld Y, George J. Oral tolerance with heat shock protein 65 attenuates Mycobacterium tuberculosis-induced and high-fat-diet-driven atherosclerotic lesions. J Am Coll Cardiol 2002; 40 : 1333–8.
48. Prakken BJ, Roord S, Ronaghy A,Wauben M, Albani S, van Eden W. Heat shock protein 60 and adjuvant arthritis: a model for T cell regulation in human arthritis. Springer Semin Immunopathol 2003; 25 : 47–63.
49. Quintana FJ, Carmi P, Mor F, Cohen IR. Inhibition of adjuvant arthritis by a DNA vaccine encoding human heat shock protein 60. J Immunol 2002; 169 : 3422–8.
50. Multhoff G. Heat shock proteins in imunity. Handb Exp Pharmacol. 2006; 172 : 279–304.
51. Radons J, Multhoff G. Immunostimulatory functions of membranebound and exported heat shock protein 70. Exerc Immunol Rev 2005; 11 : 17–33.
52. Galazka G, Jurewicz A, Orlowski W, Stasiolek M, Brosnan CF, Raine CS, et al. EAE tolerance induction with Hsp70-peptide complexes depends on H60 and NKG2D aktivity. J Immunol 2007; 179 : 4503–12.
53. Millar DG, Garza KM, Odermatt B, Elford AR, Ono N, Li Z, et al. Hsp70 promotes antigen-presenting cell function and converts T-cell tolerance to autoimmunity in vivo. Nat Med 2003; 9 : 1469–76.
54. Gruber R, Lederer S, Bechtel U, Lob S, Riethmüller G, Feucht HE. Increased antibody titers against mycobacterial heat-shock protein 65 in patients with vasculitis and arteriosclerosis. Int Arch Allergy Immunol 1996; 110 : 95–8.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2009 Issue 4-
All articles in this issue
- Serum level of hyaluronic acid – a marker with a predictive value for radiographic progression of hand osteoarthritis
- Leflunomide in the current treatment algorithm for rheumatoid arthritis
- Anti-PM-Scl antibodies in myositis
- Heat shock proteins – an important component of immune response
- Massive gastrointestinal bleeding in a female patient with Wegener‘s granulomatosis – case report
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Anti-PM-Scl antibodies in myositis
- Heat shock proteins – an important component of immune response
- Leflunomide in the current treatment algorithm for rheumatoid arthritis
- Serum level of hyaluronic acid – a marker with a predictive value for radiographic progression of hand osteoarthritis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

