-
Medical journals
- Career
Význam vybraných biomakerů v hodnocení a patogenezi osteoartrózy a revmatoidní artritidy. Souhrn doktorské dizertační práce
: L. Šenolt
: Revmatologický ústav Praha
: Čes. Revmatol., 15, 2007, No. 1, p. 13-24.
: Summaries of Doctoral Dissertations
Revmatoidní artritida (RA) a osteoartróza (OA) představují nejčastější svalově kloubní onemocnění, postihují diartrodiální klouby a často vedou k disabilitě. Diagnóza obou chorob je podložena konvenčním rentgenovým vyšetřením. Ireverzibilní rentgenové změny se často vyskytují až v pozdější fázi onemocnění, což platí zejména pro OA. Současný výzkum postupně odhaluje potenciální využití molekulárních markerů od pochopení patogeneze onemocnění až k předpovědi progrese či monitorování efektu léčby. Molekulární markery by měly odrážet poškození kloubu, zánět nebo imunitní odpověď. Cílem této dizertační práce byla analýza vybraných biomarkerů v séru, synoviální tekutině a synoviální tkáni u pacientů s RA a OA a vyhodnocení jejich diagnostické a prediktivní hodnoty, včetně patogenetického významu. U pacientů s OA kolenních kloubů jsme prokázali zvýšené hladiny sérového pentosidinu, což mělo prediktivní význam progrese choroby ve smyslu zúžení kloubní štěrbiny. Pozitivní korelace mezi pentosidinem a oligomerním proteinem chrupavkové matrix (COMP) v synoviální tekutině navíc poukázala na pentosidin jako na jeden z dalších potenciálních biomarkerů OA. Hladiny COMP v séru byly srovnatelné u pacientů s OA, RA i zdravé kontrolní skupiny. V naší práci COMP v séru nevykazoval prediktivní význam progrese OA kolenních kloubů, ani žádnou asociaci se zánětlivými ukazateli u pacientů s OA i RA. Zvýšené koncentrace COMP v synoviální tekutině pacientů s OA oproti RA ukazovaly na druhé straně na odlišný patogenetický mechanismus degradace chrupavky během OA. Vztah mezi modulátorem metabolismu kosti osteoprotegerinem (OPG) a ukazatelem kostního obratu deoxypyridinolinem v séru u pacientů s OA může představovat rovnováhu mezi ochrannou úlohou OPG ve vztahu ke kosti a vlastní resorpcí kosti. U pacientů s RA jsme neprokázali asociaci zvýšených koncentrací pentosidinu s CRP ani s aktivitou onemocnění. Pozitivní vztah mezi COMP a protilátkami proti cyklickému citrulinovanému peptidu (anti-CCP) v séru, COMP a OPG v synoviální tekutině může odrážet asociaci systémové degradace kloubní chrupavky a imunitní odpovědi, lokální destrukci kloubní chrupavky a metabolismu kosti u RA. Snížené hladiny OPG u pacientů s RA mohou být odpovědné za vznik periartikulární osteoporózy, kostních destrukcí a mohou tak naznačovat nedostatečnou ochrannou úlohu OPG ve smyslu kostních ztrát u chronických zánětlivých chorob. Dále jsem prokázali zvýšenou expresi proteinu indukujícího metastázy – S100A4 RA synoviální tkání v místech kloubní invaze. Navíc exogenní S100A4 ovlivňoval expresi a tvorbu několika matrixových metaloproteináz (MMP) synoviálními fibroblasty. Protože mezi RA a malignitami existuje podobnost, můžeme předpokládat, že S100A4 přispívá k agresivnímu, invazivnímu a tumorům podobnému chování RA synoviální tkáně. Na závěr lze shrnout, že pentosidin může představovat nový biochemický marker progrese OA. Zvýšená koncentrace COMP v synoviální tekutině u pacientů s OA může být odrazem rozdílné patogeneze destrukce kloubní chrupavky u RA a OA. Vztah mezi ukazateli destrukce chrupavky, kosti a imunitní odpovědi u RA poukazuje na komplexní charakter onemocnění. S100A4 může představovat novou molekulu, která může být součásti patogeneze RA.
Klíčová slova:
revmatoidní artritida, osteoartróza, pentosidin, oligomerní protein chrupavkové matrix, osteoprotegerin, protilátky proti cyklickému citrulinovanému peptidu, S100A4ÚVOD
Osteoartróza (OA) a revmatoidní artritida (RA) patří mezi nejčastější kloubní onemocnění. Téměř 15 % dospělé populace je postiženo OA a přibližně 0,5–1 % populace RA (1). Přestože se jedná o onemocnění způsobující úbytek kloubní chrupavky, patogenetický mechanismus tohoto je odlišný. OA je heterogenní onemocnění postihující především váhonosné klouby, páteř a drobné klouby rukou. Na patogenezi OA se podílí kloub jako celek, dochází k narušenému metabolismu kloubní chrupavky, subchondrální kosti (2), ovlivněny jsou také měkké tkáně včetně kloubní výstelky a úponů. Vedle ztráty chrupavky vzniká subchondrální kostní skleróza a tvoří se osteofyty. U RA je naopak kostní tkáň postižena destrukcí na rentgenu se typicky projevující kostními usuracemi. RA se manifestuje často extraartikulárně, počínaje revmatoidními uzly a konče život ohrožující vaskulitidou. V současné době je za klíčovou tkáň vzniku OA považována kloubní chrupavka a tkáň kloubní výstelky je pokládána za primární místo vzniku RA. Synoviální membrána kloubu během RA podléhá hyperplazii, je infiltrována zánětlivými buňkami, což vede k tvorbě agresivní vaskularizované granulační tkáně (panu) (3).
Diagnóza obou onemocnění se opírá o kombinaci klinického a rentgenového nálezu. Stanovení diagnózy RA navíc napomáhá autoimunitní aktivita v podobě přítomnosti specifických protilátek. Rentgenový snímek často vypovídá o poměrně pokročilém stadiu choroby. Mezi mírou obtíží a rentgenovým nálezem často existuje významná diskrepance. Při sledování progrese choroby je třeba opakovat rentgenová vyšetření s odstupem několika měsíců, často i let. Tento poměrně dlouhý interval by bylo vhodné zkrátit, k čemuž by měly sloužit nové biologické markery. Stanovením biomarkerů bychom měli být schopni zachytit časná stadia onemocnění nebo včas určit prognózu dalšího vývoje choroby (4). Rozvíjející se výzkum v oblasti biomarkerů by měl dále přispět k jejich využití pro diagnostiku, hodnocení efektu léčby a pochopení patogeneze obou kloubních onemocnění.
V klinické praxi a při hodnocení lékových studií existuje v současné době několik prediktivních ukazatelů rentgenové progrese. Při hodnocení RA jde jednak o klinické a funkční známky aktivity choroby, laboratorní ukazatele zánětu, genetické markery a rentgenový nález. Nicméně tyto ukazatele mají svá omezení a nízkou senzitivitu. Kostní eroze a destrukce chrupavky mohou totiž probíhat nezávisle na zánětlivém postižení kloubního aparátu a mohou progredovat i navzdory nízké aktivitě nemoci a klinickému zlepšení (5). Mezi nové potenciální markery pro hodnocení RA patří některé nové autoprotilátky, zánětlivé parametry, ukazatele kloubního metabolismu a dědičné faktory. Při hodnocení progrese OA je stále zlatým standardem rentgenový snímek a měření zúžení kloubní štěrbiny. Experimentálně se začínají uplatňovat také různé modifikace magnetické rezonance. Jako náhradní ukazatele slouží biologické markery OA, které by měly reflektovat metabolismus kloubní tkáně, tj. hyalinní chrupavky, kosti nebo synoviální membrány.
Hypotéze této práce se opírala o předpoklad, že molekulární markery odrážejí patologický stav kloubního aparátu. Cílem tak bylo stanovení vybraných potenciálních biologických markerů v séru a synoviální tekutině u pacientů s OA a RA, zhodnocení jejich vztahu k zánětlivým parametrům, klinické aktivitě choroby a morfologickému postižení kloubů. Jednalo se o ukazatele metabolického obratu chrupavky, kosti, markery imunologické aktivity a parametry systémového a lokálního zánětu. Zásadním cílem bylo zhodnocení jejich diagnostického a prognostického potenciálu. Dalším cílem bylo bližší pochopení patogenetických mechanismů na podkladě vzájemných vztahů mezi jednotlivými markery, které odrážejí odlišné metabolické pochody. Vybrané markery jsme hodnotili v longitudinální studii a v řadě průřezových prací. Dalším cílem bylo zjistit, je-li protein podporující tvorbu metastáz S100A4 (metastasin) tvořen RA synoviální tkání a má-li význam v patogenezi RA s ohledem na tvorbu enzymů degradujících extracelulární matrix.
PACIENTI A METODY
Pacienti a kontrolní skupina
Do této práce byli zařazeni pacienti s revmatoidní artritidou a osteoartrózou kolenních kloubů splňující daná kritéria onemocnění podle Americké revmatologické asociace. Kontrolní skupinu tvořili zdraví jedinci. V longitudinální studii bylo celkově vyšetřeno 89 pacientů s OA kolenních kloubů. V průřezových studiích byl vyšetřen různý počet pacientů (n=32–48).
Synoviální tkáň a synoviální fibroblasty
Synoviální tkáň byla získána během operačního zákroku od pacientů s RA, OA a od zdravých jedinců po traumatické události (Ortopedická klinika, Schulthess Hospital Zürich). Synoviální fibroblasty použité k experimentu na tkáňových kulturách byly získány ze 4–8 pasáže. Synoviální fibroblasty byly stimulovány oligomerní frakcí proteinu S100A4. Koncentrace S100A4 v experimentu v závislosti na dávce byla 0.1 až 4,0 μg/ml. Pro experimenty v závislosti na čase (6, 12 a 24 hodin) byla použita koncentrace 0,5 μg/ml. Buňky byly sesbírány a mRNA izolována v každém z uvedených časů. Buněčný supernatant byl získán za 24 hodin po stimulaci proteinem S100A4.
Měření vybraných biologických markerů
Tělní tekutiny (sérum a synoviální tekutina) a supernatant byly po odběru skladovány při teplotě -70 ľC. Většina biomarkerů byla měřena pomocí ELISA; COMP sendvičovou metodou ELISA, matrixové metaloproteinázy pomocí komerčně dostupných kitů (Biotrak Amersham Biosciences Company), OPG a solubilní RANKL pomocí sendvičové ELISA (Biomedica, Wienna). Absorpce byla měřena při 450 nm (Dynex Technologies). Pentosidin byl měřen pomocí vysoce účinné kapalinové chromatografie (HPLC).
Imunohistochemie
Protein S100A4 byl analyzován imunohistochemicky na řezech synoviální tkáně zalitých v parafínu. Po odstranění parafínu z tkáně a blokování nespecifických vazeb byla použita myší monoklonální protilátka anti-S100A4 v ředění 1 : 300. Inkubace tkáně s myší biotynilovanou protilátkou (1 : 1000) a streptavidin alkalickou fosfatázou byla následována barvením tkáňových řezů pomocí DAKO Fast Red Substrátu (DAKO Corporation, Carpinteria, USA). Myší specifický IgG byl použit jako negativní kontrola.
Real-time polymerázová řetězová reakce (PCR)
Ribonukleová kyselina (RNK) byla izolována ze synoviálních fibroblastů za použití Rneasy kitu (Qiagen) podle standardního protokolu. Komplementární DNA (cDNA) byla získána reverzní transkripcí za použití Random hexameru a MultiScribe reverzní transkriptázy (Applied Biosystems). Komplementární DNA byla skladována při -20 °C do zpracování. Real-time PCR byla provedena pomocí přístroje ABI Prism 7700 Sequence Detection system (Applied Biosystems). K reakci byly použity předem připravené komerčně dostupné primery a próby pro MMP-1, MMP-3, MMP-9, MMP-13 a MMP-14. Amplifikační reakce byla následována 40 cykly dvoustupňového PCR, denaturací, ztužovací a extenzivní reakcí.
Inhibice NF-κB signální dráhy
Syntetický peptid NF-κB SN50 (Cell-Permeable Inhibitor Peptide, Calbiochem) tlumící translokaci aktivního komplexu NF-κB do jádra byl použit k inhibici signální dráhy NF-κB. NF-B SN50 byl přidán k synoviálním fibroblastům 30 minut před stimulací proteinem S100A4. Pro zhodnocení funkční aktivity NF-κB byla použita transfekce synoviálních fibroblastů DNA vektorem IBM pCMV (BD Bioscience) za použití nukleofekčního kitu (Amaxa, Switzerland). Synoviální fibroblasty byly stimulovány po dobu 6 hodin proteinem S100A4. MMP-1 a MMP-3 byly měřeny pomocí Rel-time PCR.
Klinické a rentgenové vyšetření
Aktivita obou chorob byla hodnocena pomocí speciálních dotazníků. Pro RA byl použit dotazník DAS 28 (Disease Activity Score), který se vypočítá podle vzorce 0,56 x √ (počet bolestivých kloubů) + 0,28 x √ (počet oteklých kloubů) + 0,7 ln (FW) + 0,012 x (pacientovo globální hodnocení stavu) (6). Funkční aktivita RA byla určena podle dotazníku zdravotního stavu HAQ (Health Activity Questionnaire) (7). Bolest a funkční stav u pacientů s OA byly hodnoceny pomocí indexu WOMAC (Western Ontario and McMaster Universities osteoarthritis index) (8).
Rentgenové snímky u pacientů s OA byly provedeny v předozadní projekci podle standardního protokolu s koleny v plné extenzi a patami u sebe. Při hodnocení průřezových studií byly vyhodnoceny podle Kellgrena a Lawrence (9). Pro longitudinální sledování progrese choroby byly snímky hodnoceny modifikací metody podle Lequesena a šířka kloubní štěrbiny byla měřena v nejužším místě mediálního kompartmentu tibiofemorálního kloubu podle Altmanova atlasu (10). Snímky rukou a nohou u pacientů s RA byly provedeny v předozadní a šikmé projekci a byly hodnoceny podle Steinbrockera (11).
Statistické zpracování
Všechny hodnoty byly vyjádřeny jako průměr nebo medián ± směrodatná odchylka. Mann-Whitney U-test byl použit pro porovnání dvou nepárových hodnot, Wilcoxonův test pro porovnání dvou párových hodnot a metoda lineární regrese při analýze vztahu mezi dvěma proměnnými a statistická významnost byla vyjádřena Spearmanovým koeficientem. Analýza rozptylu byla použita pro adaptaci hodnoty sledovaných veličin k více proměnným. Hodnoty p menší než 0,05 byly považovány za statisticky významné.
VÝSLEDKY
Pentosidin u pacientů s osteoartrózou a revmatoidní artritidou
Do průřezové studie bylo zařazeno 38 pacientů s OA kolenních kloubů (13 mužů a 25 žen, průměrný věk 64,1 let). Ve skupině pacientů s RA bylo 39 jedinců (7 mužů a 32 žen, průměrný věk 53,0 let). Kontrolní skupinu tvořilo 38 jedinců bez anamnézy kloubních obtíží (15 mužů a 23 žen, průměrný věk 58,3 let). Do longitudinální studie se z celkového počtu 100 pacientů ke konečnému vyšetření po 2 letech dostavilo 89 pacientů (tab. 1). Jednalo se o pacienty s relativně časným začátkem choroby, jehož délka nepřesáhla 3 roky. Jedinci s diabetem mellitus či renální insuficiencí nebyli zařazeni do žádné ze studií.
1. Demografická data jedinců longitudinální studie hodnotící prediktivní význam pentosidinu při hodnocení progrese osteoartrózy (OA) kolenních kloubů během 2letého sledování. 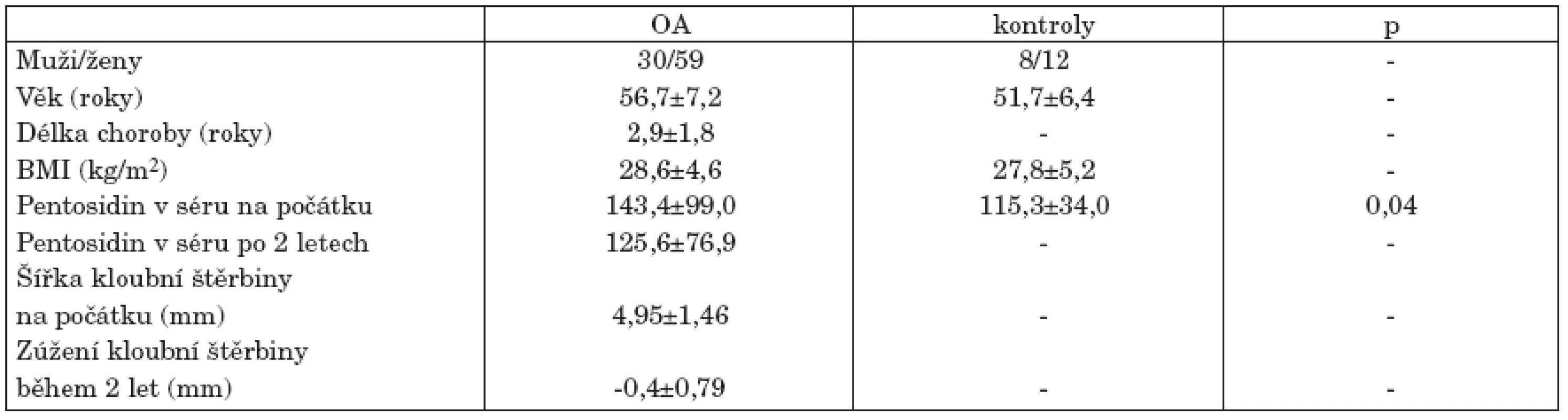
OA, osteoartróza; BMI, body mass index. Zvýšená hladina pentosidinu u pacientů s osteoartrózou kolenních kloubů
U pacientů s OA kolenních kloubů jsme v porovnání s kontrolní skupinou pozorovali významně vyšší sérové hladiny pentosidinu (132,1 ± 56,2 vs 97,7 ± 24,0 nmol/l, p<0,01) (obr. 1A). Pentosidin byl vyšší v séru než v synoviální tekutině (132,1 ± 56,2 vs 70,7 ± 22,8, p<0,001) a mezi koncentracemi pentosidinu v obou kompartmentech byl statisticky významný vztah (r2 = 0,56, p<0,001).
Vztah pentosidinu k ukazateli destrukce kloubní chrupavky oligomernímu proteinu chrupavkové matrix (COMP) u pacientů s osteoartrózou kolenních kloubů
Zjistili jsme statisticky významný vztah mezi pentosidinem a COMP v synoviální tekutině (r2=0,11, p<0,05) (obr. 1B), přičemž tento vztah platil i pro pentosidin v séru a COMP v synoviální tekutině (r2=0,12, p<,05). Nepozorovali jsme žádný vztah mezi COMP a pentosidinem v séru (r2=0,01).
1. Porovnání sérové hladiny pentosidinu u pacientů s osteoartrózou (OA) kolenních kloubů s kontrolní skupinou (A) a korelace pentosidinu s ukazatelem destrukce chrupavky COMP v synoviální tekutině pacientů s OA kolenních kloubů (B). 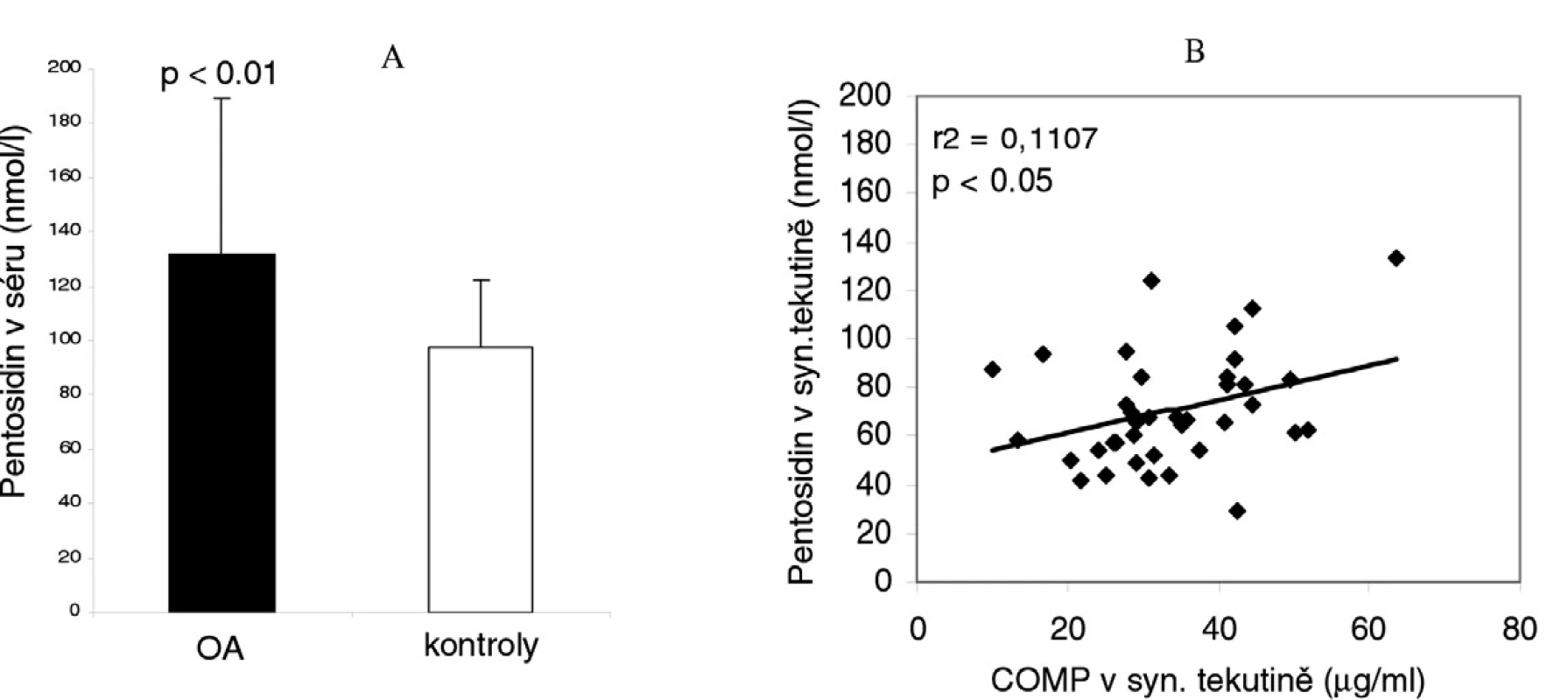
Vztah pentosidinu ke klinickému stavu a rentgenovému stadiu osteoartrózy
U jedinců s OA kolenních kloubů i kontrolní skupiny jsme nepozorovali závislost pentosidinu na věku. Pentosidin nevykazoval vztah k míře kloubní bolesti, ani ke klinickému stavu (dotazník WOMAC). Neshledali jsme významný rozdíl mezi pentosidinem u pacientů s unilaterální či bilaterální OA kolenních kloubů, hladiny pentosidinu nebyly také ovlivněny rentgenovým stadiem OA.
Vztah pentosidinu k rentgenové progresi osteoartrózy kolenních kloubů
Během 2 let studie došlo k průměrnému zúžení kloubní štěrbiny o 0,4 ± 0,79 mm. Koncentrace pentosidinu byly na začátku studie vyšší v porovnání s kontrolní skupinou (143,4 ± 99,0 vs 115,3 ± 34,3 ± nmol/l, p=0,04). Vstupní (r=0,30, p<0,05) i konečné (r=0,34, p<0,05) hodnoty pentosidinu měly významný vztah k progresi choroby ve smyslu zúžení kloubní štěrbiny (obr. 2).
2. Vztah sérového pentosidinu k progresi osteoartrózy (OA) kolenních kloubů ve smyslu zúžení kloubní štěrbiny během 2letého sledování. Koncentrace pentosidinu byly stanoveny na počátku a po dvou letech sledování. 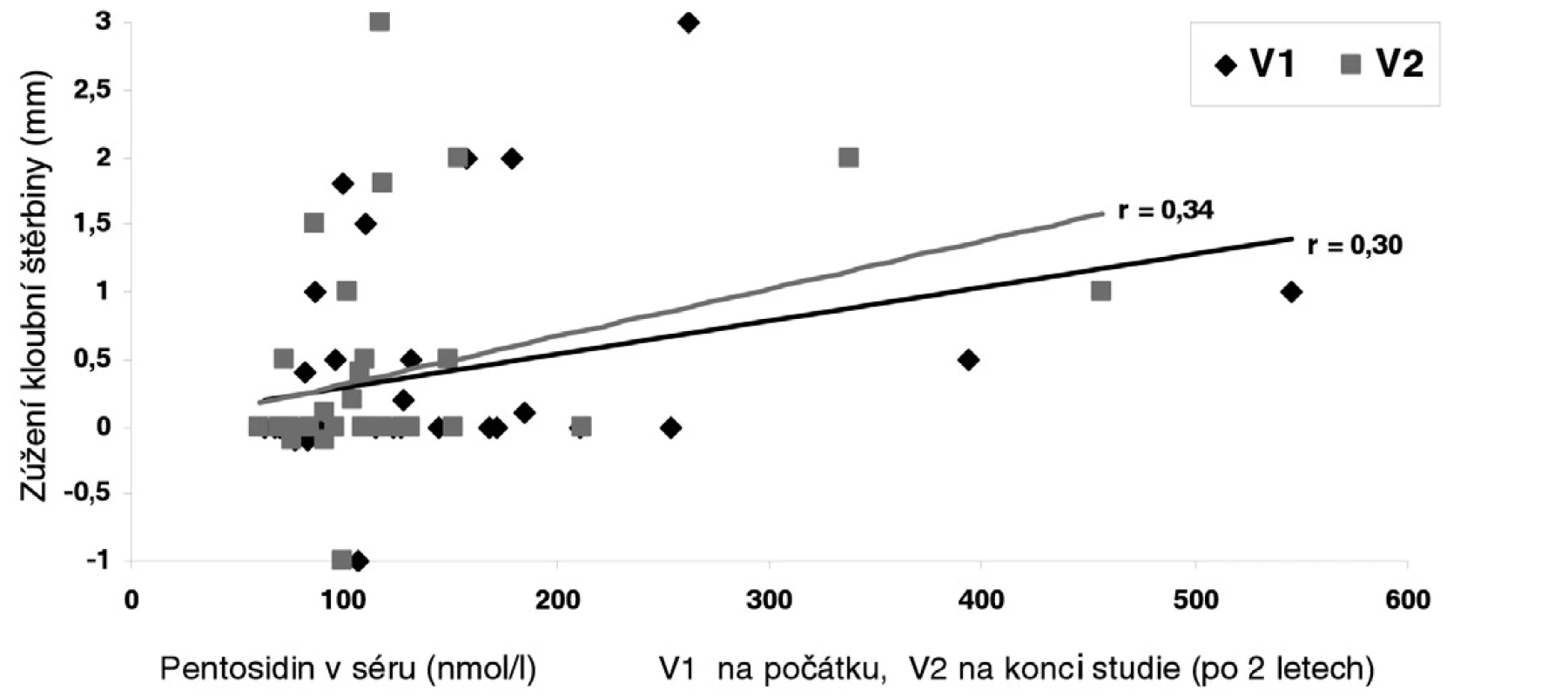
Zvýšená hladina pentosidinu u pacientů s revmatoidní artritidou
Hodnoty pentosidinu byly významně vyšší u pacientů s RA oproti kontrolní skupině (156,0 ± 124,0 vs 97,7 ± 24,0 nmol/l, p<0,02). Pentosidin byl významně vyšší v séru než v synoviální tekutině (156,0 ± 124,0 vs 83,1 ± 68,6 nmol/l, p<0,001) a jako u pacientů s OA byla pozorována významná korelace pentosidinu mezi oběma tělními tekutinami (r2=0,9, p<0,001). Pentosidin v séru a synoviální tekutině se statisticky příliš nelišil mezi pacienty s RA a OA. Koncentrace pentosidinu v tělních tekutinách nebyla ovlivněna věkem ani délkou choroby.
Vztah pentosidinu ke klinické aktivitě a rentgenovému postižení u pacientů s revmatoidní artritidou
Koncentrace pentosidinu v séru korelovaly se sedimentací erytrocytů (r2=0,44, p<0,03), nikoli však s CRP (r=0,04). Neshledali jsme korelaci pentosidinu s leukocyty v synoviální tekutině (r=0,02). Pentosidin v séru (r=0,06) i synoviální tekutině (r=0,007) nekoreloval s koncentracemi autoprotilátek anti-CCP v daných tělních tekutinách. Nebyla také zjištěna asociace mezi aktivitou choroby (DAS28, HAQ) a koncentracemi pentosidinu v séru či synoviální tekutině. Rentgenové stadium RA také nemělo vliv na hladinu pentosidinu v tělních tekutinách.
OLIGOMERNÍ PROTEIN CHRUPAVKOVÉ MATRIX (COMP) U PACIENTŮ S OSTEOARTRÓZOU A REVMATOIDNÍ ARTRITIDOU
Do této průřezové studie bylo zařazeno 32 pacientů s aktivní RA (6 mužů a 26 žen, průměrný věk 51,3 let) a 48 pacientů s OA kolenních kloubů (13 mužů a 25 žen, průměrný věk 66,1 let).
COMP v séru a synoviální tekutině
U jedinců s OA a RA i zdravých kontrol vzrůstaly významně sérové koncentrace COMP s věkem (p<0,001). Koncentrace COMP v séru adaptované k věku se nelišily mezi pacienty s RA (3,8 ± 1,0 μg/ml), OA (3,8 ± 1,3 μg/ml) a kontrolami (3,5 ± 1,4 μg/ml). COMP v séru byl vyšší u jedinců mužského pohlaví ve všech sledovaných skupinách, nicméně pozorovaný rozdíl nebyl statisticky významný. Koncentrace COMP byly významně vyšší v synoviální tekutině než v séru u pacientů s RA (19,1 ± 12,6 vs 3,3 ± 1,0 μg/ml, p<0,001) i u pacientů s OA (32,5 ± 11,4 vs 3,9 ± 1,3 μg/ml, p<0,001). Koncentrace COMP v synoviální tekutině u OA pacientů byla významně vyšší než u RA pacientů (p<0,001). Hladina COMP v synoviální tekutině nebyla ovlivněna věkem ani pohlavím jedinců v žádné ze sledovaných skupin.
Vztah COMP k aktivitě a rentgenovému stadiu choroby
Průměrná koncentrace CRP u pacientů s RA byla významně vyšší než u pacientů s OA (35,8 ± 37,1 vs 5,8 ± 9,3 mg/ml, p<0,001). Průměrná hodnota sedimentace erytrocytů u pacientů s RA dosahovala 38,4 ± 19,7 mm/h. Počet leukocytů v synoviální tekutině byl vyšší u RA pacientů oproti OA pacientům (7581 ± 6066 vs 402 ± 1045 v 1 ml). Žádný z těchto ukazatelů zánětlivé aktivity nevykazoval vztah ke COMP v tělních tekutinách. Aktivita choroby RA pacientů hodnocená dle HAQ či DAS 28 a OA pacientů hodnocená dle WOMAC neměla také vliv na hladiny COMP v tělních tekutinách. Stejně tak nebyly hodnoty COMP ovlivněny časnějším začátkem choroby u RA pacientů (do 4 roků) oproti pacientům s delším průběhem choroby (více než 5 let). Sérové hodnoty COMP u RA a OA pacientů nevykazovaly žádný vztah k rentgenovému stadiu choroby. Totéž platilo pro COMP v synoviální tekutině OA pacientů. U pacientů s RA byla nalezena korelace sérového COMP s koncentrací anti-CCP protilátek (p=0,05).
LIGAND PRO RECEPTOR AKTIVUJÍCÍ TRANSKRIPČNÍ FAKTOR NF-κB A OSTEOPROTEGERIN U PACIENTŮ S OSTEOARTRÓZOU A REVMATOIDNÍ ARTRITIDOU
Do této průřezové studie bylo zařazeno 45 pacientů s RA (9 mužů a 36 žen, průměrný věk 54,0 let) a 46 pacientů s OA kolenních kloubů (15 mužů a 31 žen, průměrný věk 66,0 let).
Ligand pro receptor aktivující transkripční faktor NF-κB (RANKL)
Sérové koncentrace solubilního RANKL byly u většiny jedinců (více než 80 %) pod detekčním limitem (<0,4 pmol/l). Koncentrace RANKL v synoviální tekutině byly vyšší oproti příslušným hodnotám v séru a nelišily se mezi skupinami RA a OA (3,36 ± 2,7 vs 3,41 ± 1,4 pmol/l). Nezávisle na diagnóze byl zjištěn negativní vztah RANKL k CRP (p<0,05). RANKL v synoviální tekutině nevykazoval žádný vztah k aktivitě RA.
Osteoprotegerin
Koncentrace OPG byla významně vyšší v synoviální tekutině než v séru (p<0,001) a v obou tělních tekutinách OPG navzájem koreloval u sledovaných skupin (p<0,005). OPG v synoviální tekutině pacientů s OA byl významně vyšší než u pacientům s RA (8,4 ± 2,9 vs 3,9 ± 2,4 pmol/l, p<0,001). Totéž platilo i pro OPG v séru (2,40,8 vs 1,9 ± 1,0 pmol/l, p<0,03) (obr. 3). Poměr OPG:RANKL v synoviální tekutině byl významně menší u pacientů s RA než u pacientům s OA (p<0,001). Koncentrace OPG v synoviální tekutině a séru se nelišila mezi jednotlivými rentgenovými stadii OA. U pacientů s OA vzrůstala koncentrace sérového OPG s věkem (p<0,03). OPG v synoviální tekutině u pacientů s OA a v obou tělních tekutinách u pacientů s RA nebyl věkem ovlivněn.
3. Porovnání koncentrace OPG v séru a synoviální tekutině u pacientů s osteoartrózou (OA) a revmatoidní artritidou (RA). 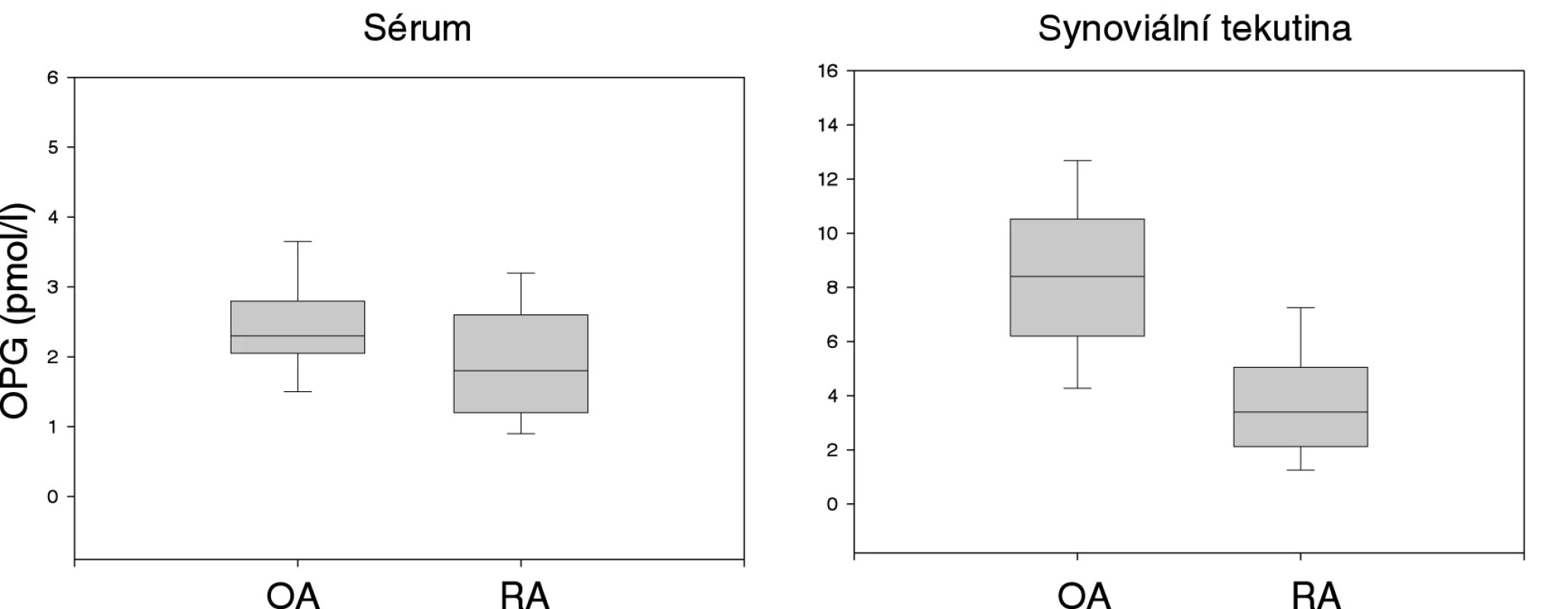
U pacientů s RA velmi významně korelovaly hodnoty OPG a COMP v synoviální tekutině (p=0,005). To neplatilo u pacientů s OA, kde OPG v séru významně koreloval s ukazatelem resorpce kosti deoxypyridinolinem (p=0,05) a jistý trend byl pozorován také pro pyridinolin (p=0,06), což platilo i po adaptaci OPG k věku. Tento pozitivní vztah mezi OPG a markery metabolického obratu kosti nebyl pozorován u pacientů s RA.
VÝZNAM S100A4 V PATOGENEZI REVMATOIDNÍ ARTRITIDY
Exprese proteinu S100A4 synoviální tkání
S100A4 protein byl exprimován všemi RA synoviálními tkáněmi (10/10), byl lokalizován v oblastech synoviální intimy, intersticia a kolem synoviálních cév. Navíc byl přítomen v oblastech agresivního panu u 4/4 pacientů s RA. S100A4 se nacházel i v extracelulárním prostoru. Podle morfologické charakteristiky buněk tvoří S100A4 synoviální fibroblasty i makrofágy. Synoviální tkáň pacientů s OA (5/7) vykazovala podobný charakter barvení na protein S100A4, nicméně jeho intenzita byla slabší a extracelulární lokalizace S100A4 nebyla pozorována. U kontrolní synoviální tkáně jedinců po traumatu (3/3) nebyla tvorba S100A4 pozorována vůbec.
S100A4 zvyšuje expresi MMP mRNA synoviálními fibroblasty
Po stimulaci RA synoviálních fibroblastů proteinem S100A4 byla pozorována zvýšená exprese MMP-1 a MMP-3 (obr. 4A), dále MMP-9 a MMP-13 mRNA již po 6 hodinách stimulace v závislosti na dávce proteinu. Mírná indukce exprese MMP byla pozorována při stimulaci RA synoviálních fibroblastů nejnižší koncentrací S100A4 (0,1 μg/ml) –2,9x, 2,3x, 1,3x, a 1,1x vzestup). Při vyšších koncentracích S100A4 byla pozorována významně vyšší exprese MMP. Pro nejvyšší použitou koncentraci S100A4 (4,0 μg/ml) byl pozorován 5,8x, 5,6x, 4,7x, a 5,2x vzestup exprese MMP. Na druhé straně nedošlo ke zvýšené expresi MMP-14 mRNA. Podobné výsledky byly pozorovány u synoviálních fibroblastů OA pacientů. Při stimulaci RA synoviálních fibroblastů v závislosti na čase (6, 12 a 24 hodin) jsme použili 0,5 μg/ml S100A4 proteinu. Indukce exprese MMP-3 mRNA (obr. 4B) byla zjištěna ve všech časových intervalech s nejvyššími hodnotami po 6 hodinách (4,8x, 4,2x, a 3,7x vzestup). Po stimulaci proteinem S100A4 byla zvýšena také exprese MMP-1, MMP-9 ± MMP-13, nicméně s různou kinetikou. Významná korelace byla nalezena mezi indukcí exprese MMP-1 a MMP-3 mRNA (p<0,05).
4. Indukce exprese MMP-3 mRNA synoviálními fibroblasty od pacientů s revmatoidní artritidou (RA) stimulovanými různými koncentracemi proteinu S100A4 po dobu 6 hodin (A). Indukce exprese MMP-3 mRNA RA synoviálními fibroblasty stimulovanými 0,5 μg/ml S100A4 po dobu 6, 12 a 24 hodin (B). 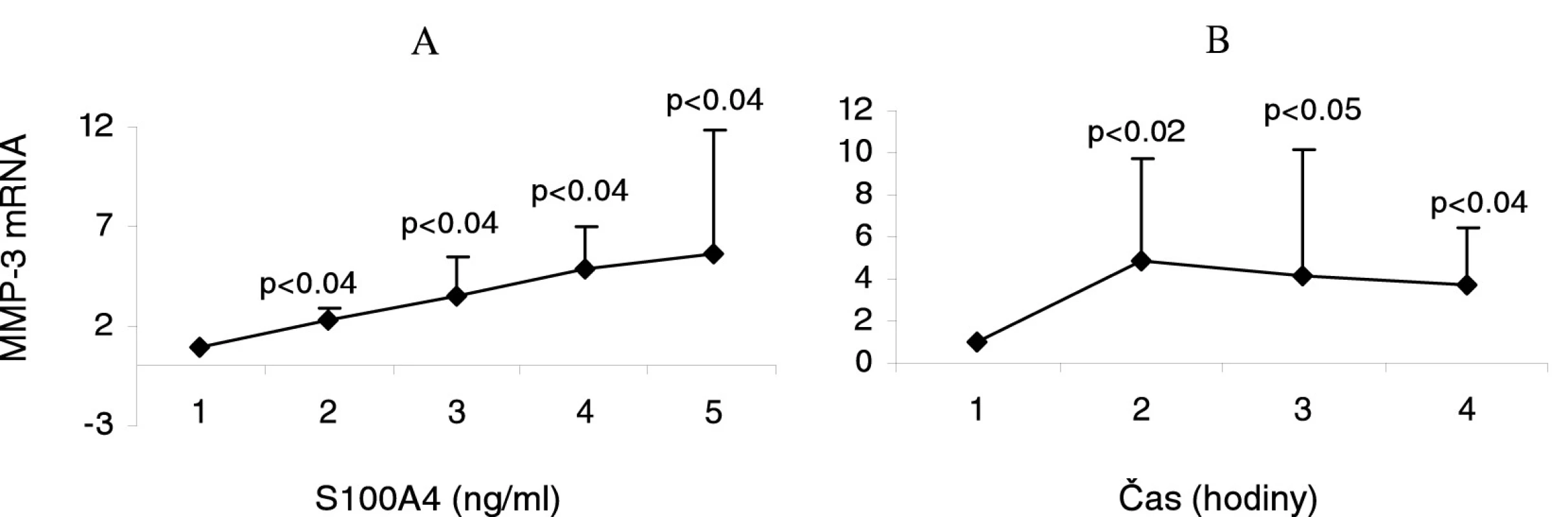
Uvolnění MMP ze stimulovaných synoviálních fibroblastů
Zvýšená exprese MMP na úrovni mRNA byla potvrzena na proteinové úrovni. Došlo ke zvýšenému uvolnění proteinů MMP-1 (180 %, p<0,03) a MMP-3 (160 %, p<0,05) do buněčného supernatantu z RA synoviálních fibroblastů stimulovaných proteinem S100A4 po 24 hodinách.
Význam NF-κB signální dráhy v indukci tvorby MMP synoviálními fibroblasty stimulovanými S100A4
Význam transkripčního faktoru NF-κB v indukci MMP synoviálními fibroblasty byl určen pomocí NF-κB SN50 – inhibitoru translokace aktivního komplexu NF-κB do jádra. RA synoviální fibroblasty předem inkubované s molekulou NF-κB SN50 vykazovaly sníženou expresi genů pro MMP-1 a MMP-3 (26 ± 17 a 55 ± 23 % pokles). Funkční aktivita NF-κB potvrzena transfekcí synoviálních fibroblastů vektorem IκBαM pCMV. Transfekované synoviální fibroblasty vykazovaly také sníženou indukci exprese MMP-1 a MMP-3 (34 ± 14 a 46 ± 3 % pokles) oproti fibroblastům transfekovaným prázdným vektorem.
DISKUSE
Pentosidin a osteoartróza
U pacientů s OA kolenních kloubů jsme zjistili zvýšené sérové hladiny pentosidinu v porovnání se zdravou skupinou dobrovolníků. Pozorovali jsme významnou asociaci pentosidinu s ukazatelem metabolického obratu kloubní chrupavky COMP v synoviální tekutině (a). Navíc jsme u jedinců s časným začátkem choroby pozorovali pozitivní vztah sérového pentosidinu s progresí zúžení kloubní štěrbiny po 2 letech sledování (b).
5. Imunohistochemie proteinu S100A4 v synoviální tkáni u pacienta s revmatoidní artritidou – oblast synoviální intimy a intersticia (A), destrukce kosti (B), dále u pacienta s osteoartrózou – oblast synoviálního intersticia (C) a u kontrolního jedince s poúrazovou etiologií (D). Jako negativní kontrola byl použit myší imunoglobulin (Ig) G (a´, b´, c´, d´). Originální zvětšení 400x. 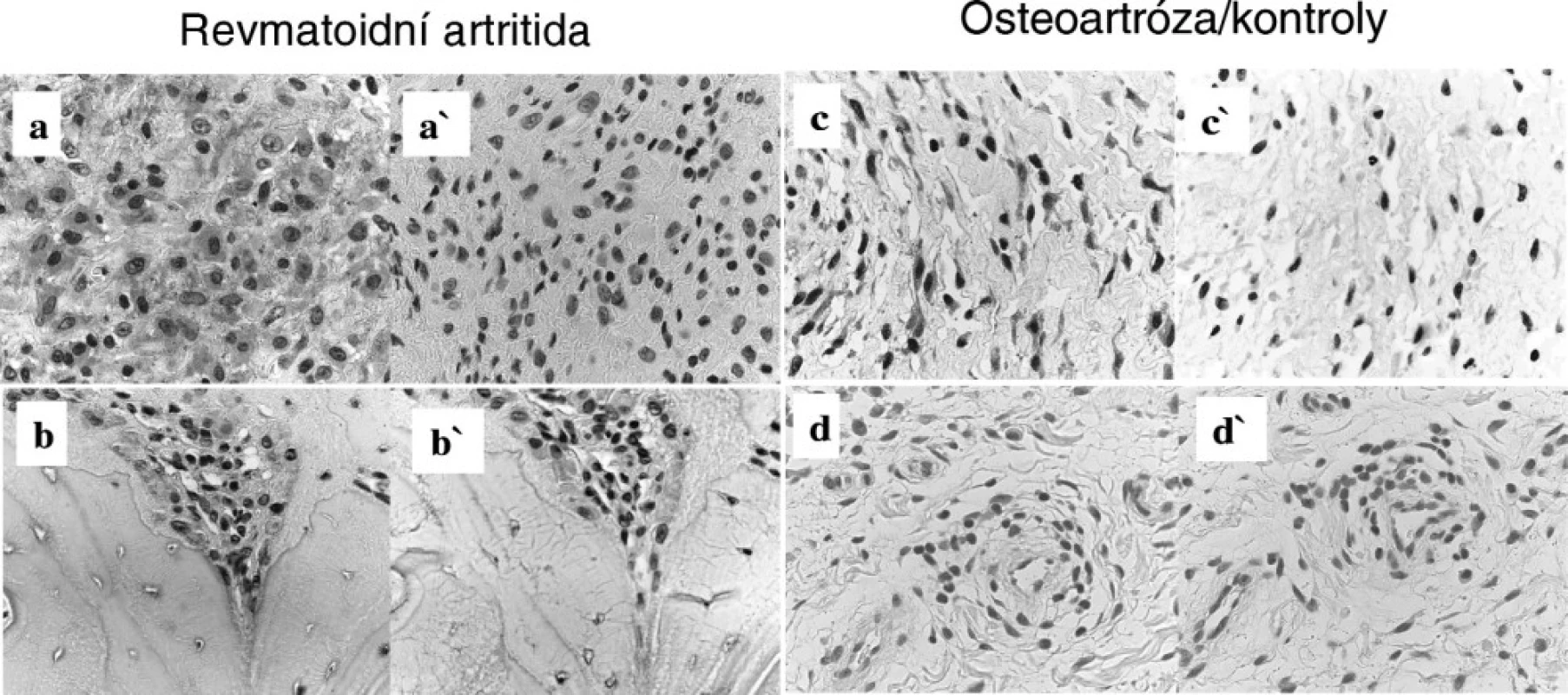
Zvýšené hladiny pentosidinu v séru nebyly v minulosti u pacientů s OA pozorovány (12). Nicméně náš soubor pacientů byl větší a výsledky jsou v souladu s nálezem vyšší koncentrace pentosidinu v moči u pacientů s OA (13). Močový pentosidin měl dokonce určující význam přítomnosti OA. Podle našich předpokladů se na zvýšené koncentraci pentosidinu mohou podílet dva základní mechanismy: vyšší metabolický obrat s progresivní destrukcí hyalinní chrupavky a oxidační stres. Vyšší metabolický obrat a progresivní destrukce hyalinní chrupavky během OA může vést k pozorované ztrátě fluorescence glykačních produktů v blízkosti povrchu kloubní chrupavky a předpokládanému uvolnění proteinů modifikovaných pentosidinem do tělních tekutin (14). V posledních letech se na OA pohlíží jako na zánětlivé postižení kloubní tkáně (15), jež může být provázeno nízkou hladinou systémového zánětu v podobě lehce zvýšeného sérového C-reaktivního proteinu (16). Důležitou komponentou a zároveň významným ukazatelem metabolismu hyalinní chrupavky je COMP (17). Předpokládáme, že námi pozorovaná vyšší koncentrace pentosidinu a korelace pentosidinu s COMP v synoviální tekutině může odrážet lokální zánětlivě-destruktivní proces OA.
Monitorování biologických markerů OA má více pozitivních výsledků při hodnocení progrese dalšího vývoje choroby ve smyslu zúžení kloubní štěrbiny. Pozdním produktům pokročilé glykace je v posledních letech věnováno stále více pozornosti. Jejich množství v organismu vzrůstá v souvislosti se stárnutím a přítomností některých patologických stavů. Navíc působením na některé buňky mohou zvyšovat tvorbu prozánětlivých cytokinů (18). Věk patří mezi základní rizikový faktor primární OA a v kloubní chrupavce vzrůstá množství AGE právě během stárnutí organismu (19). Zvýšená akumulace AGE v kloubní chrupavce negativně ovlivňuje kvalitu, metabolický obrat a reparační kapacitu hyalinní chrupavky (13, 19, 20). Po provedení totální endoprotézy postiženého kloubu u pacientů s OA kolenních kloubů významně poklesly hladiny zvýšeného pentosidinu v moči (21). V naší práci jsme pozorovali zvýšené hladiny pentosidinu v séru a jejich vztah k progresi zúžení kloubní štěrbiny u pacientů s OA kolenních kloubů. Předpokládáme tak, že pentosidin může představovat nový potenciální biomarker hodnocení OA, který může odrážet zánětlivě-degradační proces choroby.
Pentosidin a revmatoidní artritida
U pacientů s RA jsme prokázali významně vyšší hladiny pentosidinu v séru oproti kontrolám. Pentosidin vykazoval vztah k sedimentaci erytrocytů, nikoli však k CRP, autoprotilátkové či klinické aktivitě choroby.
U pacientů s RA byla již dříve popsaná zvýšená akumulace AGE v kloubních tkáních a tělních tekutinách (22, 23). Předpokládá se, že zvýšená tvorba a akumulace AGE má příčinu ve zvýšené tvorbě reaktivních kyslíkových radikálů během chronického zánětu. Pentosidin v séru je považován za indikátor aktivity onemocnění, ukazatel chronického zánětu a oxidačního stresu u pacientů s RA (23). V rozporu s tímto jsme nepozorovali asociaci zvýšeného pentosidinu s CRP či aktivitou choroby. Pentosidin vykazoval vztah pouze k sedimentaci erytrocytů. Je obtížné vysvětlit diskrepanci našeho pozorování s předchozí studií. Tento rozdíl může být způsoben například použitím odlišného dotazníku na hodnocení aktivity choroby. Náš nález je v rozporu s tvrzením, že pentosidin představuje marker odrážející zánětlivou aktivitu RA. Při porovnání hladin pentosidinu v séru a synoviální tekutině u pacientů s RA bylo zjištěno pouze nevýznamné zvýšení oproti pacientům s OA. Příčinou může být vyšší věk pacientů s OA, ačkoli jsme nepozorovali závislost pentosidinu na věku v žádné ze sledovaných skupin.
Nepodařilo se prokázat, že by hladiny pentosidinu měly vztah k ukazateli metabolického obratu kloubní chrupavky COMP v séru či synoviální tekutině u jedinců s RA. V patogenezi RA sehrává významnou úlohu citrulinace proteinů synoviální tkáně a tvorba protilátek proti těmto modifikovaným proteinům (anti-CCP) má vysokou specificitu pro diagnózu RA (24). Detekce anti-CCP protilátek má navíc prediktivní význam strukturálního postižení u jedinců s časným začátkem choroby (25). Také se nepodařilo prokázat asociaci pentosidinu s protilátkovou aktivitou anti-CCP. Narozdíl od OA, kde pentosidin koreloval s COMP v synoviální tekutině, u RA pravděpodobně zvýšené hladiny pentosidinu odrážejí oxidační stres, nikoli destrukci kloubní chrupavky či autoprotilátkovou aktivitu choroby. Je známo, že k destrukci kloubu může docházet i bez přítomnosti prokazatelné zánětlivé aktivity.
Oligomerní protein chrupavkové matrix u pacientů s osteoartrózou a revmatoidní artritidou
COMP představuje významný ukazatel metabolismu kloubní tkáně, zejména degradace hyalinní chrupavky (17). Vedle pohlaví, rasy a fyzické aktivity, patří věk mezi důležitý faktor ovlivňující koncentraci COMP v séru (26). Závislost na věku nebyla pozorována pro COMP v synoviální tekutině, který může přímo odrážet metabolismus tkáně postiženého kloubu. COMP v séru má systémový charakter odrážející metabolismus ostatních kloubních struktur a tkání organismu, což představuje jeden z limitujících faktorů použití sérového COMP při hodnocení postižení jednoho kloubu u chorob, jež mají často polyartikulární charakter. Muži ze všech sledovaných skupin měli vyšší koncentrace sérového COMP oproti ženám, což je v souladu s nedávnou studií zabývající se závislostí COMP na etnické příslušnosti a pohlaví (26). Vyšší sérové hodnoty COMP u mužů je možno vysvětlit větší tělesnou konstitucí mužů oproti ženám a tudíž větším množstvím pojivové tkáně obsahující COMP.
V synoviální tekutině jsme pozorovali významně vyšší COMP u pacientů s OA oproti RA, což by mohlo odrážet odlišně probíhající metabolismus a destrukci artrotické chrupavky v průběhu OA (c, d). COMP spíše představuje lokální ukazatel destrukce artrotické chrupavky než-li systémový ukazatel metabolismu revmatické kloubní tkáně. Pokročilost rentgenové destrukce kolenních kloubů u OA pacientů neměla vliv na hodnoty COMP v séru ani synoviální tekutině. Systémové hodnoty COMP také nevykazovaly závislost na pokročilosti RA vyjádřené rentgenovou destrukcí drobných ručních a nožních kloubů. U pacientů s časnou OA kolenních kloubů jsme nepozorovali prediktivní význam sérového COMP na vývoj choroby ve smyslu rentgenové progrese, který byl popisovaný v minulosti (27). Jedním z vysvětlení může být jednak odlišný průběh a délka choroby nebo kratší doba sledování pacientů v našem souboru.
Předpokládá se, že COMP může představovat marker reflektující časný zánět v průběhu nadměrného přetěžování kloubních struktur. V patogenezi RA sehrává významnou roli systémový zánětlivý proces a nedávno byla v časné fázi RA pozorována korelace COMP se zánětlivou aktivitou choroby, počtem oteklých kloubů a CRP (28). Nicméně v prospektivní 5leté studii neodrážel COMP ani zánětlivou aktivitu, ani destruktivní aspekt RA (29). Stejně tak i naše práce nepodporuje vztah COMP k rentgenovému postižení kloubů, klinické, či laboratorní aktivitě RA. Pozorovali jsme však významný vztah sérového COMP s hladinami anti-CCP protilátek u pacientů s RA, což může ukazovat na asociaci imunitní aktivity a destrukce kloubní tkáně u RA.
Osteoprotegerin a ligand pro receptor aktivující NF-κB u pacientů s osteoartrózou a revmatoidní artritidou
Osteoprotegerin a RANKL sehrávají významnou úlohu při regulaci kostního obratu a vedle kostních buněk či synoviálních fibroblastů se na jejich tvorbě podílí řada imunokompetentních buněk. To je důvod proč jsme pozorovali vyšší hladiny těchto molekul v místech probíhajícího zánětu, tj. v synoviální tekutině. Nižší koncentrace OPG v tělních tekutinách u pacientů s RA svědčí pro teorii nedostatečné protektivní úlohy OPG před kostní resorpcí u systémového zánětlivého onemocnění.
V porovnání se zdravými a stejně starými ženami byly vyšší sérové koncentrace OPG pozorovány u žen s postmenopauzální osteoporózou (30). U těchto pacientek byly koncentrace OPG vyšší u žen, které měly nižší denzitu kostního minerálu a navíc korelovaly s močovým pyridinolinem a deoxypyridinolinem. Korelaci s markery kostní resorpce jsme pozorovali také v naší práci u pacientů s OA kolenních kloubů. Důležitou charakteristikou RA je lokální úbytek kostní denzity a vznik kostních erozí, což je provázeno nižší tvorbou OPG synoviální tkání (31). V souladu s tímto jsme zjistili nižší koncentraci OPG v synoviální tekutině u pacientů s RA a navíc korelaci OPG s COMP v synoviální tekutině. Jedná se o dosud nepopsaný moment, který je pravděpodobně odrazem asociace lokální destrukce hyalinní chrupavky a metabolismu kosti u pacientů s RA. Tento vztah nebyl pozorován u pacientů s OA, což je pravděpodobným vysvětlením odlišného patogenetického mechanismu postižení kloubních struktur u obou chorob.
V porovnání s nadměrnou tvorbou RANKL lymfocyty a makrofágy v RA synoviální tkáni (32) jsme nepozorovali vyšší koncentraci volného RANKL v synoviální tekutině u pacientů s aktivní RA oproti jedincům s OA. Dá se tak předpokládat, že na lokální osteoresorpci se nepodílí volný, ale na buňky vázaný RANKL. Nízké koncentrace měřeného volného RANKL, zejména nedetekovatelné hodnoty v séru, mohou být způsobeny vazbou RANKL na OPG in vivo. ELISA metoda pro detekci RANKL totiž využívá princip potažených jamek molekulou OPG, což umožní vazbu volného RANKL, ale ne RANKL vázaného na OPG.
Nižší lokální produkce markeru regulace metabolického obratu kosti OPG v synoviální tekutině představuje sníženou ochranu zánětem postižené tkáně před destrukcí kosti. Navíc, významný vztah OPG s ukazatelem destrukce chrupavky COMP svědčí pro asociaci lokálního postižení kosti a hyalinní chrupavky u aktivní RA.
Význam S100A4 v patogenezi revmatoidní artritidy
Jako první jsme prokázali intracelulární i extracelulární přítomnost proteinu S100A4 v synoviální tkáni RA pacientů. Protein S100A4 byl přítomen i v oblastech agresivní synoviální tkáně (panu). Dále jsme zjistili, že extracelulární S100A4 indukuje zvýšenou tvorbu několika MMP synoviálními fibroblasty, což ukazuje na význam S100A4 v procesu kloubní destrukce během RA (e, f).
Na různých typech tumorů byly zjištěny účinky intracelulárního i extracelulárního proteinu S100A4 podporující tvorbu metastáz (33, 34). Invazivní chování buněk je nejdůležitějším znakem zakládání metastáz, přispívá k neovaskularizaci a šíření nádorových buněk. Na tomto procesu se významně podílí zvýšená tvorba MMP. Enzymy degradující matrix jsou hlavními strůjci kloubní destrukce u RA. Hlavním zdrojem těchto enzymů jsou fibroblasty synoviální intimy a agresivního panu (35). Protože jsme pozorovali extracelulární lokalizaci S100A4, lze uvažovat o významu secernovaného S100A4 u RA. Objevili jsme, že exogenní S100A4 stimuluje tvorbu několika MMP synoviálními fibroblasty, což bylo nedávno pozorováno též u endotelových a nádorových buněk (34). Invazivní chování agresivních synoviálních fibroblastů tak připomíná zvýšený metastatický potenciál nádorových buněk v přítomnosti S100A4.
NF-κB představuje klíčový nitrobuněčný regulátor zánětu a jeho tvorba u RA synoviální tkáně byla pozorována v místech panu, kde dochází k destrukci kloubu (35). Při inhibici NF-κB signální dráhy byla o polovinu redukována syntéza MMP-3 synoviálními fibroblasty stimulovanými proteinem S100A4. Úloha NF-κB při expresi MMP fibroblasty stimulovanými proteinem S100A4 je v souladu s nedávnou prací na endotelových buňkách, které vedle synoviálních fibroblastů či makrofágů mohou také produkovat S100A4 a podporovat angiogenezi popsanou u tumorů (34, 37). Zvýšená vaskularizace RA synoviální tkáně představuje důležitý moment choroby, a tak lze spekulovat, že S100A4 tvořený endotelovými buňky cév synoviální tkáně může podporovat zánětlivou aktivitu RA. Byla popsána interakce S100A4 s tumor supresorovým proteinem p53, což může ovlivnit délku buněčného přežívání (38). Nedávno bylo popsáno, že zvýšená exprese S100A4 působí jako negativní regulátor mineralizace extracelulární matrix. Podílí se na tom ovlivnění diferenciace osteoblastů a potlačení tvorby osteoblastických genů (39). Jestli protein S100A4 ovlivňuje regulaci apoptózy či snižuje kostní kvalitu u RA by mělo být předmětem dalších výzkumů.
ZÁVĚR
V této disertační práce se pojednává o využití vybraných biomarkerů při hodnocení OA a RA. Dále řeší vzájemné vztahy těchto markerů, což přispívá k bližšímu pochopení patogeneze obou chorob. Z vybraných markerů jsme hodnotili ukazatele oxidačního stresu a zánětlivé aktivity (pentosidin, CRP), parametry degradace kloubní chrupavky (COMP), metabolického obratu kosti (OPG, RANKL, deoxypyridinolin, pyridinolin), markery imunity (anti-CCP) a protein asociovaný s metastázami S100A4.
U pacientů s OA kolenních kloubů jsme prokázali zvýšené hladiny pentosidinu a jejich pozitivní vztah k ukazateli destrukce kloubní chrupavky COMP v synoviální tekutině. Navíc jsme zjistili prediktivní význam pentosidinu při hodnocení progrese OA kolenních kloubů u časné formy OA, kdy jedinci s časným začátkem choroby a s vyššími koncentracemi pentosidinu vykazovali rychlejší rentgenovou progresi postiženého kloubu. Naše výsledky tak poukazují na asociaci oxidačního zatížení organismu a degradaci kloubní chrupavky, a staví pentosidin mezi několik nových potenciálních biologických markerů OA. Vyšší rozptyl sérových hodnot pentosidinu u pacientů s OA a u kontrolní skupiny však představuje limitující faktor pro diagnostické využití pentosidinu. V porovnání s pacienty s RA jsme u pacientů s OA kolenních kloubů pozorovali vyšší koncentraci COMP v synoviální tekutině, což pravděpodobně odráží odlišný patogenetický mechanismus lokálně probíhající degradace a metabolismu artrotické chrupavky. Sérové hladiny COMP odráží systémový charakter metabolismu hyalinní chrupavky, nikoli postižení jednoho kloubu. Na úrovni jednotlivců navíc koncentrace COMP neodliší zdravé jedince od pacientů s kloubním postižením. Pozitivní vztah regulační molekuly kostního obratu OPG s deoxypyridinolinem v séru u pacientů s OA poukazuje na určitou rovnováhu protektivního mechanismu kostního metabolismu a resorpce kosti. Nepodařilo se nám prokázat, že by vyšší hodnoty OPG měly vztah k rentgenovému stadiu u pacientů s OA.
U pacientů s RA jsme v souladu s předchozími studiemi pozorovali vyšší hladiny pentosidinu v porovnání se zdravými kontrolami, nicméně jen nevýznamné zvýšení oproti pacientům s OA. Navíc jsme nepotvrdili pozitivní asociaci pentosidinu s klinickou aktivitou choroby, ani s markerem destrukce chrupavky COMP či imunologickým prediktivním ukazatelem anti-CCP. Naopak pozitivní vztah sérového COMP s anti-CCP u pacientů s RA poukazuje na možnou asociaci imunitní aktivity a destruktivního postižení kloubní tkáně. Pacienti s RA měli v synoviální tekutině i v séru nízké hladiny regulační molekuly metabolického obratu kosti OPG, což je v souladu s pozorovaným úbytkem kostní hmoty a destrukcí kloubu. Pozitivní korelace COMP a OPG v synoviální tekutině může ukazovat na přirozenou asociaci lokálních změn destrukce kloubní chrupavky a kosti. Dále jsme zjistili zvýšenou tvorbu proteinu stimulujícího tvorbu metastáz S100A4 buňkami synoviální tkáně u pacientů s RA, zejména pak v oblastech agresivního panu. Tento objev poukazuje v určitém ohledu na podobnost RA s nádorovými chorobami. Zjistili jsme, že obdobně jako nádorové buňky, synoviální fibroblasty vystavené vlivu proteinu S100A4 zvýšeně tvoří enzymy degradující extracelulární matrix (MMP), což představuje jeden z důležitých momentů patogeneze revmatoidní artritidy. Tvorba proteinu S100A4 RA synoviální tkání a uplatnění S100A4 v patogenezi této choroby přispělo k rozšíření spektra prozánětlivých mediátorů podobných cytokinům, které mohou nalézt uplatnění v hodnocení či budoucí léčbě RA.
MUDr. Ladislav Šenolt
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: seno@revma.cz
Sources
1. Lawrence RC, Helmick GG, Arnett DF, et al. Estimates of the prevalence of arthritis and selected musculosceletal disorders in the United States. Arthritis Rheum 1998; 41 : 778–788.
2. Lajeunesse D, Reboul P. Subchondral bone in osteoarthritis: a biologic link with articular cartilage leading to abnormal remodeling. Curr Opin Rheumatol 2003; 15 : 628–33.
3. Zvaifler NJ, Firestein GS. Pannus and pannocytes. Alternative models of joint destruction in rheumatoid arthritis. Arthritis Rheum 1994; 37 : 783–9.
4. Garnero P. Osteoarthritis: biological markers for the future? Joint Bone Spine 2002; 69 : 525–30.
5. Mulherin D, Fitzgerald O, Bresnihan B. Clinical improvement and radiological deterioration in rheumatoid arthritis: evidence that the pathogenesis of synovial inflammation and articular erosion may differ. Br J Rheumatol 1996; 35 : 1263–8.
6. Prevoo ML, van ‘t Hof MA, Kuper HH, van Leeuwen MA, van de Putte LB, van Riel PL. Modified disease activity scores that include twenty-eight-joint counts. Development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthritis Rheum 1995; 38 : 44–8.
7. Ramey DR, Raynauld JP, Fries JF. The health assessment questionnaire 1992: status and review. Arthritis Care Res 1992; 5 : 119–29.
8. Angst F, Aeschlimann A, Steiner W, Stucki G. Responsiveness of the WOMAC osteoarthritis index as compared with the SF-36 in patients with osteoarthritis of the legs undergoing a comprehensive rehabilitation intervention. Ann Rheum Dis 2001; 60 : 834–40.
9. Kellgren JH, Lawrence JS. Radiological assessment of osteoarthritis. Ann Rheum Dis 1957; 16 : 494–501.
10. Altman R, Asch E, Bloch D, et al. Development of criteria for the classification and reporting of osteoarthritis. Classification of osteoarthritis of the knee. Diagnostic and Therapeutic Criteria Committee of the American Rheumatism Association. Arthritis Rheum 1986; 29 : 1039–49.
11. Steinbrocker O, Traeger CH, Batterman RC. Therapeutic criteria in rheumatoid arthritis JAMA 1949; 140 : 659–62.
12. Chen JR, Takahashi M, Suzuki M, Kushida K, Miyamoto S, Inoue T. Comparison of the concentrations of pentosidine in the synovial fluid, serum and urine of patients with rheumatoid arthritis and osteoarthritis. Br J Rheumatol 1999; 38 : 1275–78.
13. Verzijl N, Bank RA, TeKoppele JM, DeGroot J. AGEing and osteoarthritis: a different perspective. Curr Opin Rheumatol 2003; 15 : 616–22.
14. Gibson GJ, Verner JJ, Nelson FR, Lin DL. Degradation of the cartilage collagen matrix associated with changes in chondrocytes in osteoarthrosis. Assessment by loss of background fluorescence and immunodetection of matrix components. J Orthop Res 2001; 19 : 33–42.
15. Pelletier JP, Pelletier JM, Abramson SB. Osteoarthritis, an Inflammatory Disease. Arthritis Rheum 2001; 44 : 1237–1247.
16. Sturmer T, Brenner H, Koenig W, Gunther KP. Severity and extent of osteoarthritis and low grade systemic inflammation as assessed by high sensitivity C reactive protein. Ann Rheum Dis 2004; 63 : 200–5.
17. Saxne T, Heinegard D. Cartilage oligomeric matrix protein: a novel marker of cartilage turnover detectable in synovial fluid and blood. Br J Rheumatol 1992; 31 : 583–91.
18. Pertynska-Marczewska M, Kiriakidis S, Wait R, Beech J, Feldmann M, Paleolog EM. Advanced glycation end products upregulate angiogenic and pro-inflammatory cytokine production in human monocyte/macrophages. Cytokine 2004; 28 : 35–47.
19. Verzijl N, DeGroot J, Oldehinkel E, et al. Age-related accumulation of Maillard reaction products in human articular cartilage collagen. Biochem J 2000; 350 : 381–387.
20. DeGroot J, Verzijl N, Wenting-van Wijk MJ, et al. Accumulation of advanced glycation end products as a molecular mechanism for aging as a risk factor in osteoarthritis. Arthritis Rheum 2004; 50 : 1207–15.
21. Špaček P, Adam M. HPLC method for pentosidine determination in urine, serum, and tissues as a marker of glycation and oxidation loading of the organism. J Liq Chrom.Rel.Technol 2002; 25 : 1807–20.
22. Takahashi M, Kushida K, Ohishi T, et al. Quantitative analysis of crosslinks pyridinoline and pentosidine in articular cartilage of patients with bone and joint disorders. Arthritis Rheum 1994; 37 : 724–8.
23. Chen JR, Takahashi M, Suzuki M, Kushida K, Miyamoto S, Inoue T. Comparison of the concentrations of pentosidine in the synovial fluid, serum and urine of patients with rheumatoid arthritis and osteoarthritis. Br J Rheumatol 1999; 38 : 1275–78.
24. Vincent C, Nogueira L, Clavel C, Sebbag M, Serre G. Autoantibodies to citrullinated proteins: ACPA. Autoimmunity 2005; 38 : 17–24.
25. Vencovský J, Macháček S, Šedová L, et al. Autoantibodies can be prognostic markers of an erosive disease in early rheumatoid arthritis. Ann Rheum Dis 2003; 62 : 427–30.
26. Jordan JM, Luta G, Stabler T, et al. Ethnic and sex differences in serum levels of cartilage oligomeric matrix protein: the Johnston County Osteoarthritis Project. Arthritis Rheum 2003; 48 : 675–81.
27. Vilím V, Olejárová M, Macháček S, Gatterová J, Kraus VB, Pavelka K. Serum levels of cartilage oligomeric matrix protein (COMP) correlate with radiographic progression of knee osteoarthritis. Osteoarthritis cartilage 2002; 10 : 707–13.
28. Soderlin MK, Kastbom A, Kautiainen H, Leirisalo-Repo M, Strandberg G, Skogh T. Antibodies against cyclic citrullinated peptide (CCP) and levels of cartilage oligomeric matrix protein (COMP) in very early arthritis: relation to diagnosis and disease activity. Scand J Rheumatol 2004; 33 : 185–8.
29. Roux-Lombard P, Eberhardt K, Saxne T, Dayer JM, Wollheim FA. Cytokines, metalloproteinases, their inhibitors and cartilage oligomeric matrix protein: relationship to radiological progression and inflammation in early rheumatoid arthritis. A prospective 5-year study. Rheumatology (Oxford) 2001; 40(5): 544–51.
30. Yano K, Tsuda E, Washida N, et al. Immunological characterization of circulating osteoprotegerin/osteoclastogenesis inhibitory factor: increased serum concentrations in postmenopausal women with osteoporosis. J Bone Miner Res 1999; 14 : 518–27.
31. Haynes DR, Barg E, Crotti TN, et al. Osteoprotegerin expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathies and osteoarthritis and normal controls. Rheumatology (Oxford) 2003; 42 : 123–34.
32. Crotti TN, Smith MD, Weedon H, et al. Receptor activator NF-kappaB ligand (RANKL) expression in synovial tissue from patients with rheumatoid arthritis, spondyloarthropathy, osteoarthritis, and from normal patients: semiquantitative and quantitative analysis. Ann Rheum Dis 2002; 61 : 1047–54.
33. Helfman DM, Kim EJ, Lukanidin E, Grigorian M. The metastasis associated protein S100A4: role in tumour progression and metastasis. Br J Cancer 2005; 92 : 1955–8.
34. Schmidt-Hansen B, Klingelhofer J, Grum-Schwensen B, et al. Functional significance of metastasis-inducing S100A4(Mts1) in tumor-stroma interplay. J Biol Chem 2004; 279 : 24498–504.
35. Cunnane G, Fitzgerald O, Beeton C, Cawston TE, Bresnihan B. Early joint erosions and serum levels of matrix metalloproteinase 1, matrix metalloproteinase 3, and tissue inhibitor of metalloproteinases 1 in rheumatoid arthritis. Arthritis Rheum 2001;44 : 2263–74.
36. Benito MJ, Murphy E, Murphy EP, van den Berg WB, FitzGerald O, Bresnihan B. Increased synovial tissue NF-kappa B1 expression at sites adjacent to the cartilage-pannus junction in rheumatoid arthritis. Arthritis Rheum 2004; 50 : 1781-7.
37. Ambartsumian N, Klingelhofer J, Grigorian M, et al. The metastasis-associated Mts1(S100A4) protein could act as an angiogenic factor. Oncogene 2001; 20 : 4685–95.
38. Grigorian MS, Tulchinsky EM, Zain S, et al. The mts1 gene and control of tumor metastasis. Gene 1993;135 : 229–38.
39. Kato C, Kojima T, Komaki M, et al. S100A4 inhibition by RNAi up-regulates osteoblast related genes in periodontal ligament cells. Biochem Biophys Res Commun 2005; 326 : 147–53.
Literatura autora
a) Šenolt L, Braun M, Olejárová M, Forejtová Š, Gatterová J, Pavelka K. Increased pentosidine, an Advanced Glycation Endproduct, in serum and synovial fluid from patients with knee osteoarthritis and its relation with cartilage oligomeric matrix protein. Ann Rheum Dis 2005; 64 : 886–90.
b) Pavelka K, Forejtova S, Olejarova M, Gatterova J, Senolt L, Spacek P, Braun M, Hulejova M, Stovickova J, Pavelkova A. Hyaluronic acid levels may have predictive value for the progression of knee osteoarthritis. Osteoarthritis Cartilage 2004; 12 : 277–83.
c) Šenolt L, Gatterová J, Pavelka K. Oligomerní protein chrupavkové matrix (COMP) v séru a synovialní tekutině u pacientů s revmatoidní artritidou a osteoartrózou 2005; Rheumatologia 2005; 19 : 123–128.
d) Vilím V, Vobůrka Z, Vytášek R, Šenolt L, Tchetverikov I, Kraus VB, Pavelka K. Monoclonal antibodies to human cartilage oligomeric matrix protein: epitope mapping and characterization of sandwich ELISA. Clin chim acta 2003; 328 : 59–69.
e) Šenolt L, Grigorian M, Lukanidin E, Michel BA, Gay RE, Gay S, Pavelka K, Neidhart M. S100A4 (Mts1): is there any relation to the pathogenesis of rheumatoid arthritis? Autoimmun Rev 2006; 5 : 129–31.
f) Šenolt L, Grigorian M, Lukanidin E, Simmen B, Michel BA, Pavelka K, Gay RE, Gay S, Neidhart M. S100A4 is expressed at site of invasion in rheumatoid arthritis synovium and modulates production of matrix metalloproteinases. Ann Rheum Dis 2006; v tisku
Další práce autora
1. Forejtová Š, Pavelka K, Gatterová J, Šenolt L. Rychle progredující osteoartróza a metody hodnocení progrese osteoartrózy. Čes Revmatol 2002; 1 : 11–18.
2. Šenolt L, Braun M, Pavelka K. Konečné produkty pokročilé glykace u pacientů s osteoartrózou a revmatoidní artritidou a jejich potenciální úloha v patogenezi těchto onemocnění. Čes Revmatol 2003; 3 : 146–56.
3. Šenolt L, Pavelka K. Oxid dusnatý (NO), intermediární produkty NO a jejich vliv na patogenezi osteoartrózy. Čes Revmatol 2003; 1 : 42–50.
4. Olejárová M, Seidl Z, Vaněčková M, Gatterová J, Forejtová Š, Šenolt L, Pavelka K. Longitudinální sledování progrese MR obrazu kolenních kloubů u gonartrózy. Výsledky dvouleté studie. Čes Revmatol 2003; 4 : 169–73.
5. Šenolt L, Pavelka K. Význam subchondrální kosti v patogenezi osteoartrózy. Osteologický Bulletin 2004; 9 : 54–58.
6. Šenolt L, Vencovský J, Pavelka K. Transdukční signální dráhy – cíl terapie revmatoidní artritidy budoucnosti? Čes. Revmatol 2005; 2 : 58–66.
7. Šenolt L, Pavelka K. Molecular markers of osteoarthritis. Acta Chir Orthop Traumatol Cech 2005; 72 : 191–6.
7. Šenolt L. Význam synoviálních fibroblastů v patogenezi revmatoidní artritidy. Čes Revmatol 2006; 2 : 65–70.
Labels
Dermatology & STDs Paediatric rheumatology Rheumatology
Article was published inCzech Rheumatology

2007 Issue 1-
All articles in this issue
- Possibilities of immunochemical detection of cartilage type II collagen degradation
- Potentional role of selected biomarkers in the evaluation and pathogenesis of osteoarthritis and rheumatoid arthritis
- Immunogenetic aspects of etiopathogenesis of rheumatoid arthritis: the role of - 308 G/A tumor necrosis factor α promoter polymorphism
- Muscle inflammatory processes and their clinical manifestations in patients with polymyositis and dermatomyositis
- Czech Rheumatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Muscle inflammatory processes and their clinical manifestations in patients with polymyositis and dermatomyositis
- Possibilities of immunochemical detection of cartilage type II collagen degradation
- Potentional role of selected biomarkers in the evaluation and pathogenesis of osteoarthritis and rheumatoid arthritis
- Immunogenetic aspects of etiopathogenesis of rheumatoid arthritis: the role of - 308 G/A tumor necrosis factor α promoter polymorphism
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

