-
Medical journals
- Career
Asistovaná aktivace oocytů
Authors: P. Trávník 1-3; Michal Ješeta 1,4,5; R. Hűttelová 1,6; R. Křen 1,7; L. Landsmann 1,8; A. Nesvadbová 1,9,10; G. Tauwinklová 1,2,11
Authors‘ workplace: Výbor Asociace reprodukční embryologie z. s. 1; Repromeda s. r. o., Brno 2; IPVZ, Praha 3; Gynekologicko-porodnická klinika LF MU a FN Brno 4; FAPPZ ČZU, Praha 5; IVF Cube SE, Praha 6; GENNET s. r. o., Praha 7; UNICA Prague s. r. o., Praha 8; IVF Clinic a. s., Olomouc 9; Přírodovědecká fakulta UP, Olomouc 10; Ústav histologie a embryologie, LF MU, Brno 11
Published in: Ceska Gynekol 2023; 88(6): 459-462
Category:
Overview
Cíl: V současné době rychle přibývá nových studií o asistované aktivaci oocytů, která může výrazně zefektivnit celý proces in vitro fertilizace. Oplození oocytů konvenční metodou i pomocí intracytoplazmatické injekce spermie může selhat z důvodu nedostatečné aktivace oocytu. Důvodem bývají zejména odchylky v enzymovém vybavení spermií nebo oocytů či nefunkční aktivační kaskáda. V řadě případů lze oplození dosáhnout užitím umělé aktivace oocytů pomocí aplikace donorů vápníkových iontů na oocyty po mikroinjekci spermie. Názory na bezpečnost a spolehlivost této metody však nejsou jednotné. Cílem práce je prezentovat současné poznatky o asistované aktivaci oocytů a o jejím dopadu nejen na in vitro fertilizaci, ale také na následný embryonální a fetální vývoj. Metodika: Rešerše relevantní literatury v databázích Web of Science, Scopus a PubMed/Medline. Výsledky a závěr: Z literárních údajů i vlastních zkušeností autorů vyplývá, že je tato metoda účinná a z hlediska dalšího vývoje embrya, plodu i postnatálního vývoje bezpečná. Byly provedeny rozsáhlé metaanalýzy zaměřené na tuto metodu, které nezjistily negativní dopad nejen na embryonální a fetální vývoj jedince, ale tato metoda neměla negativní dopad ani na psychosomatický vývoj narozených dětí.
Klíčová slova:
umělá aktivace oocytů
Úvod
Intracytoplazmatická injekce spermií (ICSI) je nejúspěšnější metodou léčby mužského faktoru neplodnosti, prakticky nezávislou na parametrech spermií. Selhání fertilizace u neplodných párů po ICSI nastává u 1–3 % párů [1]. Toto selhání fertilizace nastává v důsledku neúspěšné aktivace oocytů, jejíž původ může být jak ve spermiích, tak i v oocytech [2].
Asistovaná aktivace oocytů (AOA – assisted oocyte activation) byla postupně aplikována v lidské asistované reprodukci k obnově fertilizace u párů s historií selhání fertilizace [1]. Nejužívanější metodou je aktivace pomocí donorů vápníkových iontů (Ca ionoforu A23187 nebo ionomycinu) krátce po provedení ICSI. První dítě se narodilo po jejím použití v kombinaci s ICSI v roce 1995 [3].
Použití kalciových ionoforů vede ke statisticky významnému zlepšení fertilizace s úspěšnou blastulací, implantací, otěhotněním a porodem živých dětí, což dokládá významně pozitivní vliv použití kalciových ionoforů [4].
Byl studován vliv AOA na expresi genů, která se nelišila od exprese genů po in vitro fertilizaci (IVF) a ICSI [5,6].
Nebyl prokázán významný rozdíl mezi typem a frekvencí chromozomových aberací a malformací ve srovnání mezi skupinami, kde bylo provedeno ICSI bez aktivace, nebo s aktivací [7]. Nebyly zjištěny signifikantní rozdíly týkající se porodní hmotnosti, termínu porodu a pohlaví dítěte [8]. Neonatologické charakteristiky a neuropsychický vývoj dětí ve věku 3–10 let počatých pomocí asistované aktivace oocytů byl normální [1]. Účinky této metody na lidská embrya jsou pečlivě sledovány a předpoklad, že použití AOA bude spojeno se změnami genové exprese, se v zásadě nepotvrdil. Ve srovnání konvenční IVF a kombinace ICSI s AOA byla genová exprese po AOA překvapivě blíže klasickému IVF než samotnému ICSI [5].
Bezpečnost z hlediska možného vzniku vrozených vad prokázala řada dalších publikací [9–12]. V roce 2022 byla zveřejněna rozsáhlá metaanalýza zaměřená na hodnocení aktivace lidských oocytů kalciovým ionoforem. Tato práce zahrnula 22 studií a zkoumala především účinnost a bezpečnost AOA s kalciovým ionoforem. Výsledky ukázaly, že AOA s kalciovým ionoforem nejenže významně zvýšila efektivitu fertilizace, blastulaci, implantaci, klinické těhotenství a počet živě narozených dětí, ale také neovlivnila výskyt potratů, vrozených vad a poměr pohlaví novorozenců [13]. Při sledování výsledků analýz PGT-A byla porovnávána skupina embryí vzniklých po ICSI a embryí, kdy byla společně s metodou ICSI použita i metoda AOA. Bylo zjištěno, že použití kalciového ionoforu (jako aktivátoru pro AOA) nezhoršilo časný embryonální vývoj a nezpůsobilo zvýšení podílu embryí s aneuploidiemi [7].
Možné obavy z epigenetických modifikací v důsledku asistované aktivace oocytů nebyly v praxi potvrzeny, navíc v průběhu časného embryonálního vývoje dochází k reprogramování genomu [14] a případné chyby v epigenetické informaci na stadiu gamet a zygoty by byly během reprogramování odstraněny.
Aktivace oocytů ionoforem je považována za legitimní možnost pro páry se selháním fertilizace [8].
Image 1. Na obrázku je znázorněn oocyt v metafázi I s jedním pólovým tělískem (PB). Při normální aktivaci oocytu se ze spermie vpravené do oocytu uvolní fosfolipáza Cζ (PLCζ), která štěpí fosfatidylinositol-4,5-bisfofát (PIP2) na diacylglycerol (DAG) a inositol-1,3,5-trisfosfát (IP3). IP3 se váže na receptor (IP3R), což uvolní z endoplazmatického retikula (ER) vápníkové ionty (Ca2+), které oocyt aktivují. Při umělé aktivaci, kde chybí fosfolipáza Cζ, jsou kalciové ionty uvolněny pomocí dodaného donátoru kalcia, např. vápníkového ionoforu A23187 (Ca ionofor A23187). 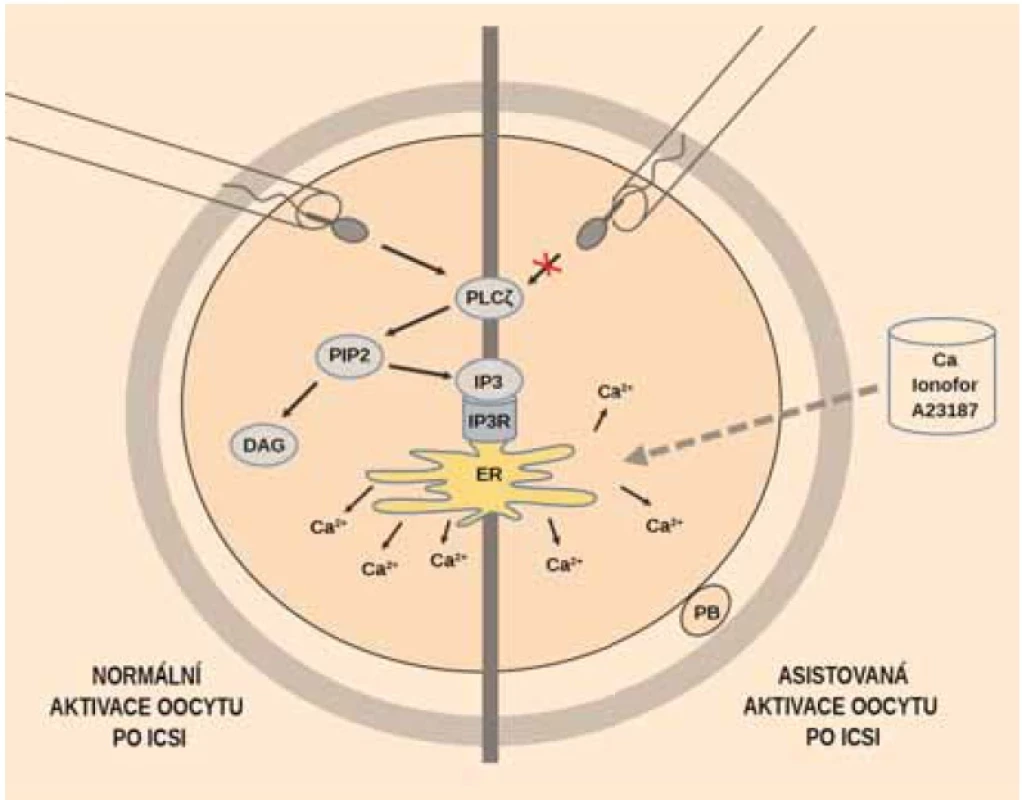
Fig. 1. The fi gure shows an oocyte in metaphase I with one polar body (PB). During normal oocyte activation, phospholipase Cζ (PLCζ) is released from sperm injected into the oocyte, which splits phosphatidylinositol-4,5-bisphosphate (PIP2) into diacylglycerol (DAG) and inositol-1,3,5-trisphosphate (IP3). IP3 binds to a receptor (IP3R), which releases calcium ions (Ca2+) from the endoplasmic reticulum (ER) to activate the oocyte. In artifi cial activation where phospholipase Cζ is absent, calcium ions are released using a supplied calcium donor, for example calcium ionophore A23187 (Ca ionophore A23187). Mechanizmus přirozené aktivace oocytu
Normální spermie uvolní fosfolipázu C zeta (PLCζ) do cytoplazmy oocytu (obr. 1). Ta hydrolyzuje fosfatidylinositol-4,5-bisfosfát (PIP2) na inositol-1,4,5-trifosfát (IP3) a diacylglycerol (DAG). IP3 potom stimuluje uvolnění kalciových iontů z endoplazmatického retikula oocytu do cytoplazmy a vyvolá oscilace koncentrace kalciových iontů. Zvýšená hladina vápníkových iontů v cytoplazmě je důležitá pro aktivaci Ca dependentních kináz nezbytných pro prolomení meiotického bloku, vydělení druhého pólového tělíska a následnou aktivaci oocytu [15]. Pokud spermie neobsahuje dostatečnou koncentraci PLCζ nebo není schopna aktivovat Ca dependentní signální dráhu, k aktivaci oocytu a k vývoji zygoty nedojde.
Mechanizmus asistované aktivace oocytu
Na rozdíl od přirozené aktivace, tedy při AOA, není navozena oscilace kalciových iontů, ale je indukován jeden influx vápníkových iontů (obr. 1). Ten je dostatečný pro aktivaci Ca dependentní signální dráhy vedoucí k efektu na Ca/kalmodulin dependentní proteinkinázy II (CAMKII). Lidské oocyty mohou tedy reagovat na široké rozpětí změn intracelulárního CA2+ a mají vysoký stupeň tolerance ke změnám koncentrace vápníku v cytosolu.
Indikace
Indikací pro primární provedení aktivace oocytů je buď empiricky zjištěné selhání fertilizace v předchozích pokusech o oplození pomocí ICSI, nebo oprávněný předpoklad, že k aktivaci oocytu nedojde z bio logických příčin daných zjištěnými vadami spermií nebo oocytů. Je to např. identifikace alespoň jedné potenciálně patogenní varianty v genu PLCζ1 v gDNA spermie po selhání fertilizace v předchozím cyklu ICSI [16].
Další indikací je použití intracytoplazmatické injekce kulatých spermatid (ROSI) získaných chirurgickým výkonem z varlat (TESA, TESE). Spermatidy nejsou schopny oocyt aktivovat, a proto je tato metoda nezbytná [17]. Aktivace oocytů může zlepšit podíl oplozených oocytů i tam, kde po TESE elongovaných spermatid/spermií v předchozích cyklech fertilizace selhala [18].
Další indikací je oplození spermiemi mužů s globozoospermií. Spermie pacientů s globozoospermií buď vůbec nemají, nebo mají výrazně snížený obsah klíčového aktivačního faktoru – PLCζ [19]. Efektivita metody ICSI je u těchto pacientů velice nízká a použití této metody je často jediným řešením neúspěšné fertilizace [20].
Metoda byla rovněž aplikována při použití spermií mužů s Kartagenerovým syndromem, kde bez použití aktivace nedošlo k oplození po intracytoplazmatické injekci spermií, kdežto při použití aktivace byly oocyty těmito spermiemi oplozeny [21].
Vedle primárního provedení aktivace oocytů byla publikována i metoda záchranné aktivace oocytů (RAOA – rescue assisted oocyte activation), indikovaná v případech neočekávaného úplného selhání fertilizace bez primárního provedení asistované aktivace [22,23]. U této techniky je ale důležité vhodně zvolit čas, kdy po neúspěšném ICSI použít RAOA. Pokud by RAOA proběhlo příliš brzy, může to být zbytečné, a naopak to může narušit normální vývoj prvojader. Pokud by to bylo příliš pozdě, může již dojít ke stárnutí oocytu a je riziko, že celý proces selže.
Metodika
K provedení asistované aktivace je vhodné použít komerčního aktivačního média s ionoforem A23187 (GM508 Cult-Active Gynemed), případně jiného aktivačního média dodávaného pro účely aktivace lidských oocytů.
Pokud je k aktivaci používán preparát GM508 Cultactive, je postup následující [24]:
- Roztok ionoforu je intenzivně protřepán po dobu 30 s.
- Následuje ekvilibrace při 37 °C v atmosféře používané ke kultivaci embryí po dobu 4 hod.
- Pro každý oocyt je připravena kapka obsahující 30 µl roztoku ionoforu a 60 µl kultivačního média neobsahujícího HEPES (4 - (2-hydroxyethyl) -1-piperazinethansulfonová kyselina) ani MOPS (3 - (N-morpholino) propansulfonová kyselina). Kapky jsou kryty minerálním olejem.
- Bezprostředně po provedení intracytoplazmatické injekce spermie jsou oocyty inkubovány po jednom v těchto kapkách po dobu 15 min.
- Po skončení inkubace jsou oocyty opláchnuty 2krát v kultivačním médiu neobsahujícím MOPS ani HEPES.
- Poté jsou oocyty kultivovány obvyklým způsobem.
- Výsledek oplození je vyhodnocen detekcí dvou prvojader a dvou pólocytů po 18 hod kultivace.
Pokud je používán jiný přípravek určený k aktivaci oocytů, je třeba se řídit návodem výrobce.
Záchranná aktivace oocytů (RAOA) je prováděna v případě, že nedošlo k očekávanému oplození oocytů. K vydělení druhého pólového tělíska dochází nejčastěji mezi 2 a 3 hod po ICSI. Pokud tedy po více než 3 hod od ICSI stále není vydělené druhé pólové tělísko, může mít pozitivní efekt ROAO, které by ovšem nemělo být provedeno později než za 6 hod od ICSI [25].
Pokud dojde k aktivaci, je třeba u ROAO počítat s posunem vývoje zygot, proto nejsou vzniklá embrya vhodná k čerstvému transferu a vždy mají být vitrifikována.
Závěr
Metoda AOA je celosvětově používaná metoda asistované reprodukce. Je založena na principu aktivace oocytů pomocí vápníkových iontů. Tato metoda se používá dlouhodobě a dosud publikované studie nezjistily negativní vliv této metody na embryonální vývoj lidských embryí, podíl chromozomových aberací či zdravotní stav narozených dětí.
ORCID autorů
P. Trávník 0000-0002-2966-923X
M. Ješeta 0000-0003-1778-3454
R. Hüttelová 0009-0001-1877-1060
R. Křen 0009-0002-3534-7816
L. Landsmann 0000-0001-5984-1232
A. Nesvadbová 0000-0001-7854-4268
G. Tauwinklová 0009-0001-3024-6357
Doručeno/Submitted: 22. 8. 2023
Přijato/Accepted: 1. 9. 2023prof. MUDr. Pavel Trávník, DrSc.
REPROMEDA s. r. o.
Studentská 812/6
625 00 Brno
ptravnik@repromeda.cz
Sources
1. Vanden Meerschaut F, Nikiforaki D, Heindryckx B et al. Assisted oocyte activation following ICSI fertilization failure. Reprod Biomed Online 2014; 28 (5): 560–571. doi: 10.1016/ j.rbmo.2014.01.008.
2. Tesarik J, Rienzi L, Ubaldi F et al. Use of a modified intracytoplasmic sperm injection technique to overcome sperm-borne and oocyte-borne oocyte activation failures. Fertil Steril 2002; 78 (3): 619–624. doi: 10.1016/s0015-0282 (02) 03 291-0.
3. Hoshi K, Yanagida K, Yazawa H et al. Intracytoplasmic sperm injection using immobilized or motile human spermatozoon. Fertil Steril 1995; 63 (6): 1241–1245. doi: 10.1016/00 20-7292 (96) 88083-0.
4. Murugesu S, Saso S, Jones BP et al. Does the use of calcium ionophore during artificial oocyte activation demonstrate an effect on pregnancy rate? A meta-analysis. Fertil Steril 2017; 108 (3): 468.e3–482.e3. doi: 10.1016/j.fertnstert. 2017.06.029.
5. Bridges PJ, Jeoung M, Kim H et al. Methodology matters: IVF versus ICSI and embryonic gene expression. Reprod Biomed Online 2011; 23 (2): 234–244. doi: 10.1016/j.rbmo.2011.04.007.
6. Ferrer-Buitrago M, Tilleman L, Thys V et al. Comparative study of preimplantation development following distinct assisted oocyte activation protocols in a PLC-zeta knockout mouse model. Mol Hum Reprod 2020; 26 (11): 801–815. doi: 10.1093/molehr/gaaa060.
7. Zhang J, Yao G, Zhang T et al. Effect of calcium ionophore (A23187) on embryo development and its safety in PGT cycles. Front Endocrinol (Lausanne) 2023; 13 : 979248. doi: 10.3389/fendo.2022.979248.
8. Miller N, Biron-Shental T, Sukenik-Halevy R et al. Oocyte activation by calcium ionophore and congenital birth defects: a retrospective cohort study. Fertil Steril 2016; 106 (3): 590.e2–596.e2. doi: 10.1016/j.fertnstert.2016.04.025.
9. Yoon HJ, Bae IH, Kim HJ et al. Analysis of clinical outcomes with respect to spermatozoan origin after artificial oocyte activation with a calcium ionophore. J Assist Reprod Genet 2013; 30 (12): 1569–1575. doi: 10.1007/s10815-013-0110-2.
10. Deemeh MR, Tavalaee M, Nasr-Esfahani MH. Health of children born through artificial oocyte activation: a pilot study. Reprod Sci 2015; 22 (3): 322–328. doi: 10.1177/1933719114542017.
11. Li B, Zhou Y, Yan Z et al. Pregnancy and neonatal outcomes of artificial oocyte activation in patients undergoing frozen-thawed embryo transfer: a 6-year population-based retrospective study. Arch Gynecol Obstet 2019; 300 (4): 1083–1092. doi: 10.1007/s00404-019-052 98-3.
12. Long R, Wang M, Yang QY et al. Risk of birth defects in children conceived by artificial oocyte activation and intracytoplasmic sperm injection: a meta-analysis. Reprod Biol Endocrinol 2020; 18 (1): 123. doi: 10.1186/s12958-020-006 80-2.
13. Shan Y, Zhao H, Zhao D et al. Assisted oocyte activation with calcium ionophore improves pregnancy outcomes and offspring safety in infertile patients: a systematic review and meta-analysis. Front Physiol 2022; 12 : 751905. doi: 10.3389/fphys.2021.751905.
14. Morgan HD, Santos F, Green K et al. Epigenetic reprogramming in mammals. Hum Mol Genet 2005; 14 (1): R47–R58. doi: 10.1093/hmg/ddi114.
15. Zafar MI, Lu S, Li H. Sperm-oocyte interplay: an overview of spermatozoon’s role in oocyte activation and current perspectives in diagnosis and fertility treatment. Cell Biosci 2021; 11 (1): 4. doi: 10.1186/s13578-020-00520-1.
16. Martínez M, Durban M, Santaló J et al. Assisted oocyte activation effects on the morphokinetic pattern of derived embryos. J Assist Reprod Genet 2021; 38 (2): 531–537. doi: 10.1007/s10815-020-02025-9.
17. Niu X, Ruan Q, Witz CA et al. Comparison of human oocyte activation between round-headed sperm injection followed by calcium ionophore treatment and normal sperm injection in a patient with globozoospermia. Front Endocrinol (Lausanne) 2020; 11 : 183. doi: 10.3389/fendo.2020.00183.
18. Kang HJ, Lee SH, Park YS et al. Artificial oocyte activation in intracytoplasmic sperm injection cycles using testicular sperm in human in vitro fertilization. Clin Exp Reprod Med 2015; 42 (2): 45–50. doi: 10.5653/cerm.2015.42. 2.45.
19. Alvarez Sedó C, Rawe VY, Chemes HE. Acrosomal bio genesis in human globozoospermia: immunocytochemical, ultrastructural and proteomic studies. Hum Reprod 2012; 27 (7): 1912–1921. doi: 10.1093/humrep/des126.
20. Bechoua S, Chiron A, Delcleve-Paulhac S et al. Fertilisation and pregnancy outcome after ICSI in globozoospermic patients without assisted oocyte activation. Andrologia 2009; 41 (1): 55–58. doi: 10.1111/j.1439-0272.2008.008 84.x.
21. Ebner T, Maurer M, Oppelt P et al. Healthy twin live-birth after ionophore treatment in a case of theophylline-resistant Kartagener syndrome. J Assist Reprod Genet 2015; 32 (6): 873–877. doi: 10.1007/s10815-015-0486-2.
22. Economou KA, Christopikou D, Tsorva E et al. The combination of calcium ionophore A23187 and GM-CSF can safely salvage aged human unfertilized oocytes after ICSI. J Assist Reprod Genet 2017; 34 (1): 33–41. doi: 10.1007/s10815-016-0823-0.
23. Xu Z, Yao G, Niu W et al. Calcium ionophore (A23187) rescues the activation of unfertilized oocytes after intracytoplasmic sperm injection and chromosome analysis of blastocyst after activation. Front Endocrinol (Lausanne) 2021; 12 : 692082. doi: 10.3389/fendo.2021.692082.
24. Gebrauchsanweisung_GM508_CultActive_Multi_440X520_55x65_Rev01_00.pdf. 2023 [online]. Available from: https: //gynemed.de/wp-content/uploads/2019/03.
25. Shibahara T, Fukasaku Y, Hayashi N et al. Early rescue oocyte activation for activation-impaired oocytes with no second polar body extrusion after intracytoplasmic sperm injection. J Assist Reprod Genet 2021; 38 (5): 1061–1068. doi: 10.1007/s10815-021-02089-1.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2023 Issue 6-
All articles in this issue
- Je rozdíl mezi akutní appendicitou u těhotných a netěhotných žen?
- Jsou sérový neutrofilní delta index a systémový zánětlivý index užitečné jako prediktivní parametry preeklampsie a HELLP syndromu?
- Umělé ukončení těhotenství farmakologickou metodou (UUT-F) v I. trimestru – význam stanovení lidského choriového gonadotropinu a ultrazvukového vyšetření při diagnostice těhotenství a hodnocení výsledku UUT-F
- Indikace a výsledky ukončení těhotenství před 24. týdnem těhotenství – série případů
- Nový pohľad na diagnostiku a liečbu idiopatickej granulomatóznej mastitídy
- Ojedinělý případ živého abdominálního těhotenství u ženy s následnou graviditou v děloze
- Triandrická monogynická tetraploidia ako výsledok DNA analýzy parciálnej moly hydatidózy
- Výsledok pacientky s Herlyn-Werner-Wunderlichovým syndrómom liečenej balónikovou septostómiou – pred- a pooperačný ultrazvukový nález
- Metody a techniky ochrany reprodukce u pacientek s endometriózou
- Asistovaná aktivace oocytů
- Vliv stavu pánevního dna na výsledek operačního řešení sestupu pánevních orgánů
- Preeklampsie a diabetes mellitus
- Diagnostika komplikovaných gynekologických zánětů pomocí výpočetní tomografie – zkušenosti jednoho centra
- Emergentní hysterektomie pro spektrum placenta accreta – některé další techniky
- Diagnostika a léčba endometriózy: Doporučený postup Sekce pro léčbu endometriózy ČGPS ČLS JEP
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostika a léčba endometriózy: Doporučený postup Sekce pro léčbu endometriózy ČGPS ČLS JEP
- Preeklampsie a diabetes mellitus
- Asistovaná aktivace oocytů
- Je rozdíl mezi akutní appendicitou u těhotných a netěhotných žen?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

