-
Medical journals
- Career
Efektivita stanovení KEL a RHCE genotypu plodu u aloimunizovaných žen minisekvenací
Authors: V. Durdová 1; J. Böhmová 2; T. Kratochvílová 1; R. Vodička 2; I. Holusková 3; K. Langová 4; M. Lubušký 1
Authors‘ workplace: Porodnicko-gynekologická klinika LF UP a FN, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 1; Ústav lékařské genetiky LF UP a FN, Olomouc, přednosta prof. MUDr. M. Procházka, Ph. D. 2; Transfuzní oddělení FN, Olomouc, vedoucí oddělení MUDr. D. Galuszková, Ph. D., MBA 3; Ústav lékařské biofyziky LF UP, Olomouc, přednostka prof. RNDr. H. Kolářová, CSc. 4
Published in: Ceska Gynekol 2020; 85(3): 164-173
Category: Original Article
Overview
Cíl studie: Zhodnotit efektivitu stanovení KEL a RHCE genotypu plodu u aloimunizovaných těhotných žen minisekvenací.
Typ studie: Prospektivní kohortová studie.
Název a sídlo pracoviště: Porodnicko-gynekologická klinika LF UP a FN Olomouc; Ústav lékařské genetiky LF UP a FN Olomouc; Transfuzní oddělení FN Olomouc; Ústav lékařské biofyziky LF UP Olomouc.
Materiál a metodika: V letech 2001–2019 byl celkem u 366 těhotných žen v prvním a druhém trimestru stanoven KEL (n = 327) nebo RHCE (n = 39) genotyp plodu z volné fetální DNA cirkulující v periferní krvi pomocí minisekvenace. Genotyp plodu byl ověřen bukálním stěrem u novorozence.
Výsledky: U 327 žen byl stanoven KEL genotyp (stanovení přítomnosti alely KEL1, která odpovídá přítomnosti erytrocytárního antigenu “K“), ve 2 případech analýza selhala (2/327), dále bylo vyloučeno 16 heterozygotních žen (KEL1/KEL2) a u 309 homozygotních žen (KEL2/KEL2) byl stanoven KEL genotyp u plodu. U 95,8 % plodů (296/309) a u 95,5 % novorozenců (295/309) byl stanoven genotyp KEL2/KEL2 a u 4,2 % plodů (13/309) a u 4,5 % novorozenců (14/309) genotyp KEL1/KEL2. Senzitivita byla 92,86 % a specificita 100 %.
U 39 žen byl stanoven RHCE genotyp.
U 22 žen byla stanovena přítomnost varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “C“/“c“. Bylo vyloučeno 5 heterozygotních žen(C/c).
U 11 homozygotních žen (C/C) byl stanoven RHCE genotyp u plodu. U 64 % (7/11) plodů i novorozenců byl stanoven genotyp C/c, u 36 % (4/11) genotyp C/C.
U 6 homozygotních žen (c/c) byl stanoven RHCE genotypu u plodu. U 67 % (4/6) plodů i novorozenců byl stanoven genotyp C/c, u 33 % (2/6) genotyp c/c. Senzitivita i specificita byla 100 %.
U 17 žen byla stanovena varianta genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “E“/“e“. Byla vyloučena jedna heterozygotní žena (E/e). U 16 homozygotních žen (e/e) byla stanoven RHCE genotypu u plodu. U 75 % (12/16) plodů i novorozenců byl stanoven genotyp e/e, u 25 % (4/16) genotyp E/e. Senzitivita i specificita byla 100 %.
Závěr: Minisekvenace s využitím kapilarni elektroforézy umožnila spolehlivou detekci KEL a RHCE genotypu plodu z periferní krve těhotné ženy.
Klíčová slova:
těhotenství – aloimunizace – volná fetální DNA – KEL a RHCE genotyp plodu
ÚVOD
V České republice (ČR) je u všech těhotných žen v I. trimestru prováděn screening nepravidelných antierytrocytárních protilátek. Pozitivní výsledek screeningu je asi u 5 % žen (v ČR ročně 5000 žen), jen u cca 1,5 % (1500 žen) se jedná o klinicky významnou aloprotilátku.
Mezi klinicky významné antierytrocytární aloprotilátky patří i anti-K/k, anti C/c, anti-E/e. Je-li diagnostikována klinicky významná antierytrocytární aloprotilátka, jedná se o těhotenství s rizikem rozvoje hemolytické nemoci plodu a novorozence (HDFN, hemolytic disease of the fetus and newborn, hemolytická nemoc plodu a novorozence) [1].
Plod je však ohrožen rozvojem hemolytické nemoci pouze v případě, že má na povrchu svých erytrocytů přítomen komplementární antigen, jedná se přibližně o 0,5 % plodů (500 ročně). Přítomnost komplementárního antigenu lze vyšetřit neinvazivně stanovením genotypu plodu z volné fetální DNA cirkulující v periferní krvi těhotné ženy.
Závažná forma hemolytické nemoci plodu vyžadující podání intrauterinní transfuze do 35. týdne se však rozvine jen asi u 5–10 % z nich (25–50 plodů ročně). Rozvoj anémie u plodu lze diagnostikovat neinvazivně pomocí ultrazvukové dopplerometrie, stanovením maximální průtokové rychlosti v arteria cerebri media (MCA-PSV, Middle Cerebral Artery Peak Systolic Velocity). Kordocentéza by měla být provedena pouze v indikovaných případech [14].
Cílem práce bylo zhodnotit efektivitu stanovení KEL a RHCE genotypu plodu u aloimunizovaných těhotných žen minisekvenací.
MATERIÁL A METODIKA
V letech 2001–2019 ve spolupráci Porodnickogynekologické kliniky, Ústavu lékařské genetiky a Transfuzního oddělení FNOL byl stanoven KEL genotyp plodu z volné fetální DNA cirkulující v periferní krvi u 327 těhotných žen (stanovení přítomnosti alely KEL1, která odpovídá přítomnosti erytrocytárního antigenu “K“) nebo RHCE genotyp plodu u 39 žen (stanovení přítomnost varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “C“, “c“, “E“, “e“).
Stanovení genotypu plodu bylo provedeno v 7. až 30. týdnu těhotenství (průměr 12,5; medián 12), věk těhotných žen byl 18–43 let (průměr 30,0, medián 30), BMI byl 17–36 (průměr: 24,3, medián: 23). Genotyp plodu byl ověřen bukálním stěrem u novorozence (tab. 1).
Table 1. Charakteristika sledovaného souboru těhotných žen. Celkem bylo vyšetřeno 366 těhotných žen, u 327 byl stanoven KEL genotyp plodu a u 39 RHCE genotyp plodu. 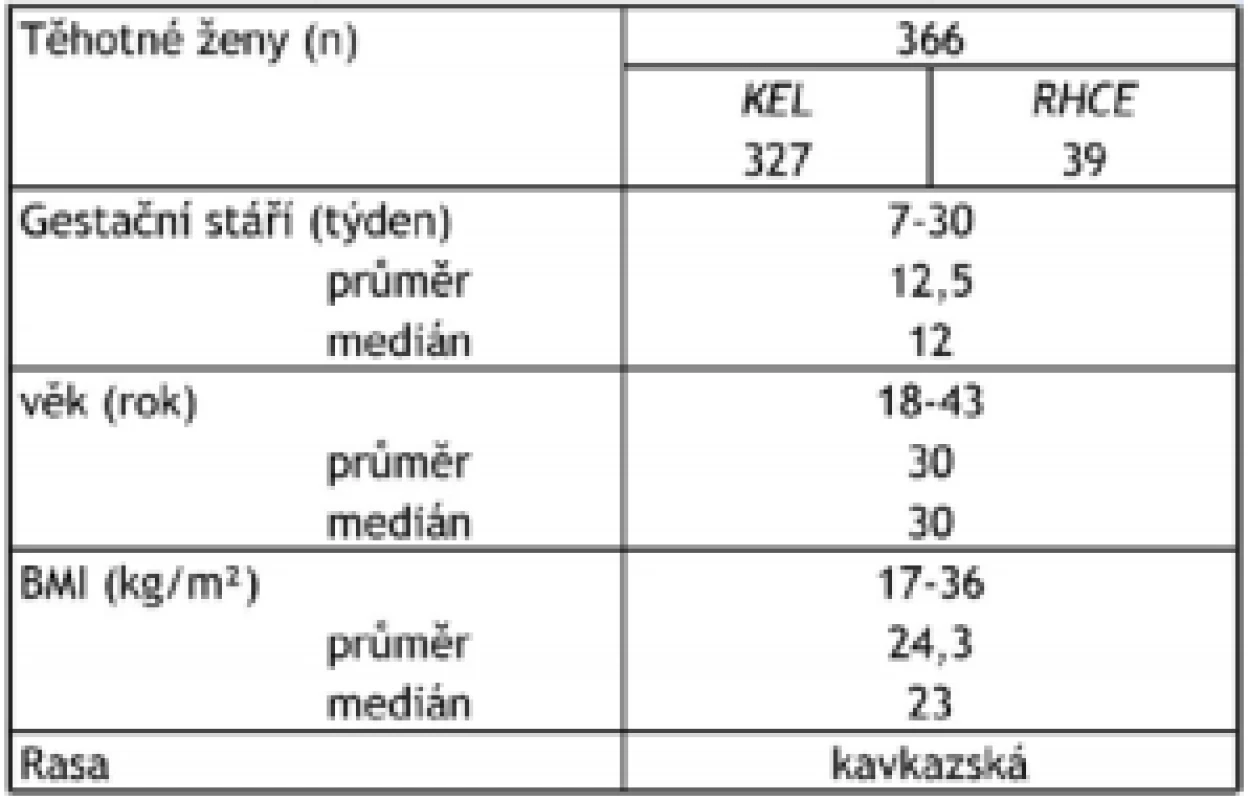
Pro stanovení KEL genotypu byla využita námi vyvinutá detailně popsaná a validovaná metodika pomocí minisekvenace [2]. Pro stanovení RHCE genotypu byla adaptována výše uvedená metodika.
K statistickému zpracování byl použit MedCalc Version 19.1.7 statistical package for biomedical research.
VÝSLEDKY
KEL genotyp plodu byl stanoven u 327 žen, bylo vyloučeno 16 heterozygotních žen (KEL1/KEL2). Bylo vyšetřeno 311 homozygotních žen (KEL2/KEL2), ve dvou případech selhala analýza volné fetální DNA z důvodu nízké fetální frakce. U 309 homozygotních žen (KEL2/KEL2) byl stanoven genotyp plodu minisekvenací a následně ověřen stanovením genotypu u novorozence. U 95,8 % plodů (296/309) a u 95,5 % novorozenců (295/309) byl stanoven genotyp KEL2/KEL2 a u 4,2 % plodů (13/309) a u 4,5 % novorozenců (14/309) genotyp KEL1/KEL2. Senzitivita byla 92,9 % a specificita 100 % (schéma 1).
Schéma 1 Stanovení přítomnosti alely KEL1 plodu u KEL1 negativních žen – výsledky a parametry screeningového testu.
Stanovení přítomnosti alely KEL1 plodu má klinický význam u aloimunizovaných žen s přítomnou aloprotilátkou anti-K. Aloprotilátku anti-K si může vytvořit pouze KEL1 negativní žena (genotyp k/k) po kontaktu s KEL1 pozitivními erytrocyty (krevní transfuze, fetomaternální hemoragie). Plod je však ohrožen rozvojem hemolytické nemoci pouze v případě, že má na povrchu svých erytrocytů přítomen komplementární antigen “K“ (genotyp K/k).
Celkem bylo vyšetřeno 327 těhotných žen, KEL genotyp těhotné ženy byl stanoven z leukocytů v periferní žilní krvi a KEL genotyp plodu z volné fetální DNA v plazmě. KEL genotyp plodu byl následně ověřen stanovením KEL genotypu novorozence z bukálního stěru. KEL genotyp ženy/plodu/novorozence byl stanoven minisekvenací. Celkem se podařilo získat 309 „tripletů“ (KEL genotyp ženy/plodu/ novorozence).
CI (confidence interval) – interval spolehlivosti.
RHCE genotyp plodu byl stanoven u 39 žen.
U 22 žen bylo provedeno stanovení přítomnosti varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “C“/“c“. Bylo vyloučeno pět heterozygotních žen (C/c). U 11 homozygotních žen (C/C) byla stanovena přítomnost varianty genu RHCE plodu, která odpovídá přítomnosti erytrocytárního antigenu “c“ minisekvenací a následně ověřena stanovením genotypu u novorozence. U 64 % (7/11) plodů i novorozenců byl stanoven genotyp C/c, u 36 % (4/11) genotyp C/C. U 6 homozygotních žen (c/c) byla stanovena přítomnost varianty genu RHCE plodu, která odpovídá přítomnosti erytrocytárního antigenu “C“ minisekvenací a následně ověřena stanovením genotypu u novorozence. U 67 % (4/6) plodů i novorozenců byl stanoven genotyp C/c, u 33 % (2/6) genotyp c/c. Senzitivita i specificita byla 100 % (Schéma 2 a 3).
Schéma 2 Stanovení přítomnosti varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “c“ u plodu u c negativních žen – výsledky a parametry screeningového testu.
Stanovení přítomnosti varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “c“ u plodu má klinický význam u aloimunizovaných žen s přítomnou aloprotilátkou anti-c. Aloprotilátku anti-c si může vytvořit pouze c negativní žena (genotyp C/C) po kontaktu s c pozitivními erytrocyty (krevní transfuze, fetomaternální hemoragie). Plod je však ohrožen rozvojem hemolytické nemoci pouze v případě, že má na povrchu svých erytrocytů přítomen komplementární antigen “c“ (genotyp C/c).
Celkem bylo vyšetřeno 39 těhotných žen, RHCE genotyp těhotné ženy byl stanoven z leukocytů v periferní žilní krvi a RHCE genotyp plodu z volné fetální DNA v plazmě. RHCE genotyp plodu byl následně ověřen stanovením RHCE genotypu novorozence z bukálního stěru. RHCE genotyp ženy/plodu/novorozence byl stanoven minisekvenací. Celkem se podařilo získat 33 „tripletů“ (RHCE genotyp ženy/ plodu/novorozence).
CI (confidence interval) – interval spolehlivosti.
Schéma 3 Stanovení přítomnosti varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “C“ u plodu u C negativních žen – výsledky a parametry screeningového testu.
Stanovení přítomnosti varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “C“ u plodu má klinický význam u aloimunizovaných žen s přítomnou aloprotilátkou anti-C. Aloprotilátku anti-C si může vytvořit pouze C negativní žena (genotyp c/c) po kontaktu s C pozitivními erytrocyty (krevní transfuze, fetomaternální hemoragie). Plod je však ohrožen rozvojem hemolytické nemoci pouze v případě, že má na povrchu svých erytrocytů přítomen komplementární antigen “C“ (genotyp C/c).
Celkem bylo vyšetřeno 39 těhotných žen, RHCE genotyp těhotné ženy byl stanoven z leukocytů v periferní žilní krvi a RHCE genotyp plodu z volné fetální DNA v plazmě. RHCE genotyp plodu byl následně ověřen stanovením RHCE genotypu novorozence z bukálního stěru. RHCE genotyp ženy/plodu/novorozence byl stanoven minisekvenací. Celkem se podařilo získat 33 „tripletů“ (RHCE genotyp ženy/ plodu/novorozence).
CI (confidence interval) – interval spolehlivosti.
U 17 žen bylo provedeno stanovení přítomnosti varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “E“/“e“. Byla vyloučena jedna heterozygotní žena (E/e). U 16 homozygotních žen (e/e) byla stanovena přítomnost varianty genu RHCE plodu, která odpovídá přítomnosti erytrocytárního antigenu “E“/“e“ minisekvenací a následně ověřena stanovením genotypu u novorozence. U 75 % (12/16) plodů i novorozenců byl stanoven genotyp e/e, u 25 % (4/16) genotyp E/e. Senzitivita i specificita byla 100 % (schéma 4).
Schéma 4 Stanovení přítomnosti varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “E“ u plodu u E negativních žen – výsledky a parametry screeningového testu.
Stanovení přítomnosti varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “E“ u plodu má klinický význam u aloimunizovaných žen s přítomnou aloprotilátkou anti-E. Aloprotilátku anti-E si může vytvořit pouze E negativní žena (genotyp e/e) po kontaktu s E pozitivními erytrocyty (krevní transfuze, fetomaternální hemoragie). Plod je však ohrožen rozvojem hemolytické nemoci pouze v případě, že má na povrchu svých erytrocytů přítomen komplementární antigen “E“ (genotyp E/e).
Celkem bylo vyšetřeno 39 těhotných žen, RHCE genotyp těhotné ženy byl stanoven z leukocytů v periferní žilní krvi a RHCE genotyp plodu z volné fetální DNA v plazmě. RHCE genotyp plodu byl následně ověřen stanovením RHCE genotypu novorozence z bukálního stěru. RHCE genotyp ženy/plodu/novorozence byl stanoven minisekvenací. Celkem se podařilo získat 33 „tripletů“ (RHCE genotyp ženy/ plodu/novorozence).
CI (confidence interval) – interval spolehlivosti.
DISKUSE
Je-li u těhotné ženy zjištěna klinicky významná antierytrocytární aloprotilátka, je plod a novorozenec ohrožen rozvojem HDFN pouze v případě, že má na svých erytrocytech přítomen komplementární antigen [4]. Přítomnost komplementárního erytrocytárního antigenu lze zjistit neinvazivně z volné fetální DNA cirkulující v periferní krvi těhotné ženy. Výhodou je možnost vyloučit plody, které na svých erytrocytech přítomen antigen nemají. Naopak plody, které antigen přítomen mají (asi 500 ročně) lze sledovat neinvazivně pomocí ultrazvukové dopplerometrie, stanovením MCA-PSV. Kordocentéza by měla být provedena pouze v indikovaných případech [14].
Mezi klinicky nejvýznamnější aloprotilátky patří i anti-E, anti-K, anti-C, anti-c, anti-e a anti - -k; seřazeno podle incidence [11]. V České republice je u aloimunizovaných žen dostupné stanovení RHD a RHCE genotypu plodu pomocí Real time PCR [12]. Našim cílem bylo zhodnotit efektivitu stanovení KEL a RHCE genotypu plodu u žen minisekvenací.
Aloprotilátku anti-E si může vytvořit pouze “E“ negativní žena (genotyp e/e) po kontaktu s “E“ pozitivními erytrocyty (krevní transfuze, fetomaternální hemoragie). Může však vznikat i přirozeně bez erytrocytárního antigenního podnětu; takto vzniklá protilátka není aloprotilátkou a je otázkou, zda vůbec může způsobit rozvoj HDFN [13]. Incidence aloprotilátky anti-E u těhotných žen je 5,7 ‰ [11]. V ČR se jedná ročně přibližně o 600 žen. Jedná se o nejčastěji diagnostikovanou aloprotilátku [17, 18, 20]. Incidence antigenu “E“ je u bělošské populace asi 30 % [10, 15]. “E“ negativní žena (genotyp e/e – 70 %) má proto 30% pravděpodobnost, že její partner bude “E“ pozitivní (genotyp E/e – 28 %, E/E – 2 %) a tudíž má 16% pravděpodobnost, že bude mít “E“ pozitivní plod (genotyp E/e). Můžeme tedy předpokládat asi 96 ohrožených plodů ročně. Stanovením RHCE genotypu plodu, dokážeme vyloučit až 84 % plodů (504 plodů ročně), u kterých není přítomna varianta genu RHCE, která odpovídá přítomnosti antigenu “E“ [13] (obr. 1). V našem souboru bylo 25 % (4/16) “E“ pozitivních plodů (genotyp E/e) a 75 % (12/16) “E“ negativních (genotyp e/e). Výsledky korespondují s publikovanými daty, jsou však ovlivněny malým počtem vzorků.
Image 1. Klinický význam stanovení varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “E“/ “e“ u plodu
V České republice je u všech těhotných žen v I. trimestru prováděn screening nepravidelných antierytrocytárních protilátek. Klinicky významná aloprotilátka anti-E je diagnostikována nejčastěji, asi u 0,6 % žen (v ČR ročně 600 žen). Navíc přibližně 84 % plodů (504 plody ročně) nemá přítomen komplementární antigen, a tudíž nejsou ohroženy rozvojem HDFN. Přítomnost komplementárního antigenu lze vyšetřit neinvazivně stanovením RHCE genotypu plodu z volné fetální DNA cirkulující v periferní krvi těhotné ženy. Naproti tomu klinicky významná aloprotilátka anti-e je diagnostikována jen u přibližně 0,02 % žen (v ČR ročně 20 žen) a komplementární antigen je přítomen u většiny plodů, asi u 84 % plodů (17 plodů ročně). Vyšetření přítomnosti komplementárního antigenu neinvazivně stanovením RHCE genotypu plodu tudíž nemá klinický význam v managementu těhotenství s rizikem rozvoje HDFN (hemolytic disease of the fetus and newborn – hemolytická nemoc plodu a novorozence).
Upraveno podle Holusková I. [11], Kratochvílová T. [13] a Reid M. [19]![Klinický význam stanovení varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “E“/ “e“ u plodu<br>
V České republice je u všech těhotných žen v I. trimestru prováděn screening nepravidelných antierytrocytárních protilátek. Klinicky
významná aloprotilátka anti-E je diagnostikována nejčastěji, asi u 0,6 % žen (v ČR ročně 600 žen). Navíc přibližně 84 % plodů (504 plody
ročně) nemá přítomen komplementární antigen, a tudíž nejsou ohroženy rozvojem HDFN. Přítomnost komplementárního antigenu lze
vyšetřit neinvazivně stanovením RHCE genotypu plodu z volné fetální DNA cirkulující v periferní krvi těhotné ženy. Naproti tomu klinicky
významná aloprotilátka anti-e je diagnostikována jen u přibližně 0,02 % žen (v ČR ročně 20 žen) a komplementární antigen je přítomen
u většiny plodů, asi u 84 % plodů (17 plodů ročně). Vyšetření přítomnosti komplementárního antigenu neinvazivně stanovením RHCE
genotypu plodu tudíž nemá klinický význam v managementu těhotenství s rizikem rozvoje HDFN (hemolytic disease of the fetus and
newborn – hemolytická nemoc plodu a novorozence).<br>
Upraveno podle Holusková I. [11], Kratochvílová T. [13] a Reid M. [19]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3ed1268277d1d1e169bf3b7d4cc0c8e3.jpeg)
Aloprotilátku anti-K si může vytvořit pouze “K“ negativní žena (genotyp k/k) po kontaktu s “K“ pozitivními erytrocyty (krevní transfuze, fetomaternální hemoragie) [8]. Aloprotilátka anti-K může způsobovat závažnou formu HDFN [16]. Závažnost HDFN lze jen obtížně předpovědět, protože korelace mezí hladinou aloprotilátky a stupněm fetální anémie je jen velmi malá [21]. Kromě hemolýzy inkompatibilních erytrocytů může způsobovat i útlum krvetvorby jejich prekurzorů v kostní dřeni [5, 6, 7]. Incidence aloprotilátky anti-K u těhotných žen je asi 1,2 ‰ [11]. V ČR se jedná ročně přibližně o 100 žen. Incidence antigenu “K“ je u bělošské populace asi 10 % [15]. “K“ negativní žena (genotyp KEL2/KEL2 – 90 %), má proto 10% pravděpodobnost, že její partner bude “K“ pozitivní (většinou heterozygot na lokusu K, genotyp KEL1/ KEL2), a tudíž má 5% pravděpodobnost, že bude mít “K“ pozitivní plod (genotyp KEL1/KEL2). Můžeme tedy předpokládat asi pět ohrožených plodů ročně. Stanovením KEL genotypu plodu, dokážeme vyloučit až 95 % plodů (95 plodů ročně), u kterých není přítomna alela KEL1 odpovídající přítomnosti erytrocytárního antigenu “K“ [8] (obr. 2). V našem souboru bylo 95,5 % (295/309) “K“ negativních plodů (genotyp KEL2/KEL2) a 4,5 % (14/309) “K“ pozitivních (genotyp KEL1/KEL2). Výsledky korespondují s publikovanými daty.
Image 2. Klinický význam stanovení KEL genotypu plodu u aloimunizovaných žen
V České republice je u všech těhotných žen prováděn screening nepravidelných antierytrocytárních aloprotilátek. Klinicky významná aloprotilátka anti-K je diagnostikována asi u 0,1 % žen (v ČR ročně asi 100 žen). Plod je však ohrožen rozvojem HDFN pouze v případě, že má na povrchu erytrocytů přítomen komplementární antigen, jedná se asi o 5 % plodů (5 plodů ročně), naopak 95 % plodů (95 plodů ročně) komplementární antigen přítomen nemá, a tudíž nejsou ohroženy rozvojem HDFN. Přítomnost komplementárního antigenu lze vyšetřit neinvazivně stanovením KEL genotypu plodu pomocí minisekvanace. Naproti tomu klinicky významná aloprotilátka anti-k je diagnostikována jen asi u 0,01 % žen (v ČR ročně 10 žen) a komplementární antigen je přítomen u většiny plodů, u přibližně 95 % plodů (9 plodů ročně). Vyšetření přítomnosti komplementárního antigenu neinvazivně stanovením KEL genotypu plodu tudíž nemá klinický význam v managementu těhotenství s rizikem rozvoje HDFN (hemolytic disease of the fetus and newborn – hemolytická nemoc plodu a novorozence).
Upraveno podle Holusková I. [11], Durdová V. [8] a McKenna D. S.[16].![Klinický význam stanovení KEL genotypu plodu u aloimunizovaných žen<br>
V České republice je u všech těhotných žen prováděn screening nepravidelných antierytrocytárních aloprotilátek. Klinicky významná
aloprotilátka anti-K je diagnostikována asi u 0,1 % žen (v ČR ročně asi 100 žen). Plod je však ohrožen rozvojem HDFN pouze v případě,
že má na povrchu erytrocytů přítomen komplementární antigen, jedná se asi o 5 % plodů (5 plodů ročně), naopak 95 % plodů (95 plodů
ročně) komplementární antigen přítomen nemá, a tudíž nejsou ohroženy rozvojem HDFN. Přítomnost komplementárního antigenu lze
vyšetřit neinvazivně stanovením KEL genotypu plodu pomocí minisekvanace.
Naproti tomu klinicky významná aloprotilátka anti-k je diagnostikována jen asi u 0,01 % žen (v ČR ročně 10 žen) a komplementární antigen
je přítomen u většiny plodů, u přibližně 95 % plodů (9 plodů ročně). Vyšetření přítomnosti komplementárního antigenu neinvazivně
stanovením KEL genotypu plodu tudíž nemá klinický význam v managementu těhotenství s rizikem rozvoje HDFN (hemolytic disease of
the fetus and newborn – hemolytická nemoc plodu a novorozence).<br>
Upraveno podle Holusková I. [11], Durdová V. [8] a McKenna D. S.[16].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/57e29a6a9e450a27a3ecbb10ab5d730e.jpeg)
Aloprotilátku anti-C si může vytvořit pouze “C“ negativní žena (genotyp c/c) po kontaktu s “C“ pozitivními erytrocyty (krevní transfuze, fetomaternální hemoragie) [13]. Incidence aloprotilátky anti-C u těhotných žen je 1,2 ‰ [11, 19]. V ČR se jedná ročně asi o 100 žen. Incidence antigenu “C“ je u bělošské populace přibližně 68 % [15].“C“ negativní žena (genotyp c/c – 32 %) má proto 68% pravděpodobnost, že její partner bude “C“ pozitivní (genotyp C/c – 48 %, C/C – 20 %) a tudíž má 44% pravděpodobnost, že bude mít “C“ pozitivní plod (genotyp C/c). Můžeme tedy předpokládat asi 44 ohrožených plodů ročně. Stanovením RHCE genotypu plodu, dokážeme vyloučit až 65 % plodů (56 plodů ročně), u kterých není přítomna varianta genu RHCE, která odpovídá přítomnosti antigenu “C“ [13] (obr. 3).
Image 3. Klinický význam stanovení varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “C“/“c“ u plodu
V České republice je u všech těhotných žen v I. trimestru prováděn screening nepravidelných antierytrocytárních protilátek. Klinicky významná aloprotilátka anti-C je diagnostikována asi u 0,1 % žen (v ČR ročně 100 žen), asi 56 % plodů (56 plodů ročně) však nemá přítomen komplementární antigen, a tudíž není ohroženo rozvojem HDFN. Rovněž klinicky významná aloprotilátka anti-c je diagnostikována u přibližně 0,1 % žen (v ČR ročně 100 žen) a asi 44 % plodů (44 plodů ročně) nemá přítomen komplementární antigen. Přítomnost komplementárního antigenu lze vyšetřit neinvazivně stanovením RHCE genotypu plodu z volné fetální DNA cirkulující v periferní krvi těhotné ženy.
HDFN (hemolytic disease of the fetus and newborn – hemolytická nemoc plodu a novorozence). Upraveno podle Holusková I. [11], Kratochvílová T. [13] a Reid M. [19]![Klinický význam stanovení varianty genu RHCE, která odpovídá přítomnosti erytrocytárního antigenu “C“/“c“ u plodu<br>
V České republice je u všech těhotných žen v I. trimestru prováděn screening nepravidelných antierytrocytárních protilátek. Klinicky
významná aloprotilátka anti-C je diagnostikována asi u 0,1 % žen (v ČR ročně 100 žen), asi 56 % plodů (56 plodů ročně) však nemá přítomen
komplementární antigen, a tudíž není ohroženo rozvojem HDFN. Rovněž klinicky významná aloprotilátka anti-c je diagnostikována
u přibližně 0,1 % žen (v ČR ročně 100 žen) a asi 44 % plodů (44 plodů ročně) nemá přítomen komplementární antigen. Přítomnost
komplementárního antigenu lze vyšetřit neinvazivně stanovením RHCE genotypu plodu z volné fetální DNA cirkulující v periferní krvi
těhotné ženy.<br>
HDFN (hemolytic disease of the fetus and newborn – hemolytická nemoc plodu a novorozence).
Upraveno podle Holusková I. [11], Kratochvílová T. [13] a Reid M. [19]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b8881112308ea38edb31caa0126ae96b.jpeg)
V našem souboru bylo 66,7 % (4/6) “C“ pozitivních plodů (genotyp C/c) a 33,3 % (2/6) “C“ negativních (genotyp c/c). Výsledky nekorespondují s publikovanými daty, jsou však ovlivněny velmi malým počtem vzorků.
Aloprotilátku anti-c si může vytvořit pouze “c“ negativní žena (genotyp C/C) po kontaktu s “c“ pozitivními erytrocyty (krevní transfuze, fetomaternální hemoragie) [13]. Jde o klinicky významnou aloprotilátku, která je schopna způsobit závažnou formu HDFN. Velmi často jde o opožděnou hemolýzu. Její hemolytický potenciál je velmi podobný aloprotilátce anti-D [9, 22]. Incidence aloprotilátky anti-c u těhotných žen je 0,8–1,0 ‰ [11, 19]. V ČR ročně se jedná asi o 100 žen. Incidence antigenu “c“ je u bělošské populace přibližně 80 % [15], “c“ negativní žena (genotyp C/C – 20 %) má proto 80% pravděpodobnost, že její partner bude “c“ pozitivní (genotyp c/C – 48 %, c/c – 32 %) a tudíž má 56% pravděpodobnost, že bude mít “c“ pozitivní plod (genotyp c/C, c/c). Můžeme tedy předpokládat asi 56 ohrožených plodů ročně. Stanovením RHCE genotypu plodu, dokážeme vyloučit až 44 % plodů (44 plodů ročně), u kterých není přítomna varianta genu RHCE, která odpovídá přítomnosti antigenu “c“ [13] (obr. 3). V našem souboru bylo 63,6 % (7/11) “c“ pozitivních plodů (genotyp c/C) a 36,3 % (4/11) “c“ negativních (genotyp C/C). Výsledky korespondují s publikovanými daty.
Aloprotilátku anti-e si může vytvořit pouze “e“ negativní žena (genotyp E/E) po kontaktu s “e“ pozitivními erytrocyty (krevní transfuze, fetomaternální hemoragie) [13]. Incidence aloprotilátky anti-e u těhotných žen je asi 0,2 ‰ [11, 19]. V ČR se jedná ročně o přibližně 20 žen. Komplementární antigen je přítomen u většiny plodů, u 84 % plodů (17 plodů ročně). Vyšetření přítomnosti komplementárního antigenu neinvazivním stanovením RHCE genotypu plodu tudíž nemá klinický význam v managementu těhotenství s rizikem rozvoje HDFN (obr. 1).
Aloprotilátku anti-k si může vytvořit pouze “k“ negativní žena (genotyp K/K) po kontaktu s “k“ pozitivními erytrocyty (krevní transfúze, fetomaternální hemoragie). Incidence aloprotilátky anti-k (Celano, KEL2) u těhotných žen je asi 0,1 ‰ [11, 19]. V ČR se jedná ročně asi o 10 žen. Komplementární antigen je přítomen u většiny plodů, u 95 % plodů (9 plodů ročně). Vyšetření přítomnosti komplementárního antigenu neinvazivním stanovením KEL genotypu plodu tudíž nemá klinický význam v managementu těhotenství s rizikem rozvoje HDFN [3] (obr. 2).
ZÁVĚR
Minisekvenace s využitím kapilarni elektroforézy umožnila spolehlivou detekci KEL a RHCE genotypu plodu z periferní krve těhotné ženy. Klinický význam má stanovení genotypu plodu u aloimunizovaných žen s přítomnou antierytrocytární aloprotilátkou anti-E, anti-K, anti-C a anti-c.
Podpořeno grantem IGA MZ ČR NT-12225-4/2011. Podpořeno MZ ČR – RVO (FNOl, 00098892).
MUDr. Veronika Durdová
Porodnicko-gynekologická klinika LF UP a FN Olomouc,
I. P. Pavlova 6,
775 20 Olomouc
e-mail: VeronikaDurdova@seznam.cz
Sources
1. Basu, S., Kaur, R., Kaur, G. Hemolytic disease of the fetus and newborn: Current trends and perspectives. Asian J Transfusion Sci, 2011, 5, p. 3–7.
2. Bohmova, J., Vodicka, R., Lubusky, M., et al. Clinical potential of effective noninvasive exclusion of KEL1-positive fetuses in KEL1-negative pregnant women. Fetal Diag Ther, 2016, 40, p. 48–53.
3. Bowman, JM., Harman, CR., Manning, FA., Pollock, JM. Erythroblastosis fetalis produced by anti-k. Vox Sang,1989, 56, 3, p. 187–189, Erratum in: Vo. Sang, 1990, 58, 2, p. 139.
4. British Committee for Standards in Haematology. Milkins, C., Berryman, J., et al. Guidelines for pre-transfusion compatibility procedures in blood transfusion laboratories. British Committee for Standards in Haematology. Transfus Med, 2013, 23, p. 3–35.
5. Daniels, G., Bromilow, I. Essential Guide to Blood Groups. 1th ed. Oxford: Blackwell Publishing, 2007.
6. Daniels, G., Green, C. Expression of red cell surface antigens during erythropoesis. Vox Sang, 2000, 78 (Suppl. 2), p. 149–153.
7. Daniels, G., Hadley, A., Green, C. Fetal anemia due to anti - -K may result from immune destruction of early erythroid progenitors. Transfus Med, 1999, 9 (suppl. 1), p. 16 (abstract).
8. Durdová, V., Holusková, I., Kratochvílová, T., et al. Klinický význam neinvazívního stanovení KEL genotypu plodu v managementu těhotenství s rizikem rozvoje hemolytické nemoci plodu a novorozence. Postgrad Med, 2016, 18, s. 358–361.
9. Hackney, DN., Knudtson, EJ., Rossi, KQ., et al. Management of pregnancies complicated by anti-c isoimmunization. Obstet Gynecol, 2004, 103, p. 24–30.
10. Holuskova, I., Lubusky, M., Studnickova, M., et al. Erytrocytární aloimunizace u těhotných žen, klinický význam a laboratorní diagnostika. Ces Gynek, 2013, 78, s. 89–99.
11. Holuskova, I., Lubusky, M., Studnickova, M., et al. Incidence of erythrocyte alloimmunization in pregnant women in olomouc region. Ces Gynek, 2013, 78, s. 56–61.
12. Hromadnikova, I., Vechetova, L., Vesela, K., et al. Noninvasive fetal RHD and RHCE genotyping using real-time PCR testing of maternal plasma in Rh-negative pregnancies. J Histochemistry Cytochemistry, 2005, 53, p. 1–5.
13. Kratochvilova, T., Durdova, V., Strasilova, P., et al. Klinický význam neinvazívního stanovení RHD a RHCE genotypu plodu v managementu těhotenství s rizikem rozvoje hemolytické nemoci plodu a novorozence. Postgrad Med, 2016, 18, s. 362–369.
14. Ľubušký, M., Procházka, M., Hálek, J., Klásková, E. Management těhotenství s rizikem rozvoje hemolytické nemoci plodu a novorozence. Postgrad Med, 2016, 18, s. 352–357.
15. Masopust, J., Písačka, M. Praktická imunohematologie. Erytrocyty. Praha: Mladá fronta, 2016, 1. vyd.
16. McKenna, DS., Nagaraja, HN., O’Shaughnessy, RW. Management of pregnancies complicated by anti-Kell isoimmunization. Obstet Gynecol, 1999, 93, p. 667–673.
17. Moinuddin, I., Fletcher, C., Millward, P. Prevalence and specificity of clinically significant red cell alloantibodies in pregnant women – a study from a tertiary care hospital in Southeast Michigan. Journal of blood medicine 2019, 10, p. 283–289
18. Pal, M., Williams, B. Prevalence of maternal red cell alloimmunisation: a population study from Queensland, Australia. Pathology, 2015, 47, p. 151–155.
19. Reid, M., Lomas-Francis, C. The blood group antigen facts. 2nd ed, New York: Elsevier Academic Press, 2004.
20. Smith, HM., Shirey, RS., Thoman, SK., et al. Prevalence of clinically significant red blood cell alloantibodies in pregnant women at a large tertiary-care facility. Immunohematology, 2013, 29, p. 127–130.
21. van Wamelen, DJ., Klumper, FJ., de Hass, M., et al. Obstetric history and antibody titer in estimating severity of Kell alloimmunization in pregnancy. Obstet Gynecol, 2007, 109, p. 1093–1098.
22. Wenk, RE., Goldstein, P., Felix, JK. Alloimmunization by hr‘(c), hemolytic disease of newborns, and perinatal management. Obstet Gynecol, 1986, 67, p. 623–626.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2020 Issue 3-
All articles in this issue
- Screening RHD genotypu plodu u RhD negativních žen
- Efektivita stanovení KEL a RHCE genotypu plodu u aloimunizovaných žen minisekvenací
- miRNA profil luminálnych podtypov karcinómu prsníka v súbore slovenských žien
- Dotazníková studie prevalence inkontinence moči v těhotenství a v raném šestinedělí
- Koincidence obrovské děložní myomatózy a prvozáchytu dvou pokročilých malignit u 77leté pacientky
- Náhodný nález pánevní splenózy při gynekologické operaci
- Prodloužená gravidita: nezvyklý případ
- Disekující leiomyom dělohy s neobvyklými klinickými a patologickými rysy
- Nativní IVF cyklus u 46leté pacientky s následnou klinickou graviditou rysy
- Role neutrofilů u preeklampsie
- Cirkulujúca HPV DNA u pacientok s cervikálnymi prekancerózami a rakovinou krčka maternice
- Prof. MUDr. Adolf Štafl, Ph.D. (1931–2020)
- Nový, estrogeny neobsahující přípravek perorální hormonální antikoncepce (Estrogene free pill-EFP)
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nativní IVF cyklus u 46leté pacientky s následnou klinickou graviditou rysy
- Prodloužená gravidita: nezvyklý případ
- Nový, estrogeny neobsahující přípravek perorální hormonální antikoncepce (Estrogene free pill-EFP)
- Disekující leiomyom dělohy s neobvyklými klinickými a patologickými rysy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

