-
Medical journals
- Career
Screening RHD genotypu plodu u RhD negativních žen
Authors: T. Kratochvílová 1; J. Böhmová 2; V. Durdová 1; R. Vodička 2; I. Holusková 3; K. Langová 4; M. Lubušký 1
Authors‘ workplace: Porodnicko-gynekologická klinika LF UP a FN, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 1; Ústav lékařské genetiky LF UP a FN, Olomouc, přednosta prof. MUDr. M. Procházka, Ph. D. 2; Transfuzní oddělení FN, Olomouc, vedoucí oddělení MUDr. D. Galuszková, Ph. D., MBA 3; Ústav lékařské biofyziky LF UP, Olomouc, přednosta prof. RNDr. H. Kolářová, CSc. 4
Published in: Ceska Gynekol 2020; 85(3): 156-163
Category: Original Article
Overview
Úvod: V České republice se stanovuje na začátku těhotenství RhD krevní skupina, cílem screeningu je diagnostikovat RhD negativní těhotné ženy, které mohou být ohroženy rozvojem RhD aloimunizace, to nastává pouze v případě, že plod je RhD pozitivní. V současné době se prevence RhD aloimunizace provádí bez ohledu na znalost RHD statutu plodu. Již na začátku těhotenství je možné stanovit RHD genotyp plodu neinvazivně z volné fetální DNA cirkulující v mateřské periferní krvi. Problematika screeningového vyšetření RHD genotypu plodu je celosvětově řešena. V některých evropských zemích je vyšetření již rutinně zavedeno, a přispívá tak k optimalizaci prenatální péče o RhD negativní těhotné, aplikace imunoglobulinu je cílená pouze u těhotenství s RhD pozitivním plodem.
Cílem naší práce je zhodnotit klinickou a laboratorní efektivitu screeningu RHD genotypu plodu u RhD negativních žen metodou TaqMan Real-time PCR.
Typ studie: Prospektivní kohortová studie.
Název a sídlo pracoviště: Porodnicko-gynekologická klinika LF UP a FN Olomouc; Ústav lékařské genetiky LF UP a FN Olomouc; Transfuzní oddělení FN Olomouc; Ústav lékařské biofyziky LF UP Olomouc.
Materiál a metodika: V letech 2011–2015 ve Fakultní nemocnici Olomouc bylo provedeno 337 vyšetření RHD genotypu plodu u těhotných žen v I. a II. trimestru a hodnoceno pomocí TaqMan Real-time PCR. Výsledek byl poté ověřen na RHD genotypu novorozence.
Výsledky: Metodika vyšetření RHD genotypu plodu je přesná, spolehlivá a využitelná v klinické praxi. Senzitivita byla 97,8 %, specificita byla 98,7 %. Při hodnocení efektivity zavedení neinvazivního screeningu RHD genotypu plodu u RhD negativních žen je nutné současně hodnotit hledisko medicínské, organizační i ekonomické. Důslednější provádění prevence RhD aloimunizace ve skutečně indikovaných případech může vést ke snížení incidence RhD aloimunizace.
Závěr: Z medicínského hlediska je stanovení RHD genotypu plodu u všech RhD negativních žen na začátku těhotenství jednoznačně efektivní. Umožní diagnostikovat přibližně 40 % RhD negativních plodů, kdy ženě není třeba podat IgG anti-D. Stanovení RHD genotypu plodu pomocí metodiky TaqMan Real-time PCR genotypu plodu je využitelné v klinické praxi.
Klíčová slova:
těhotenství – RhD negativní žena – volná fetální DNA – TaqMan Real-time polymerázová řetězová reakce – RHD genotyp plodu – prevence RhD aloimunizace – imunglobulin (Ig) G anti-D
ÚVOD
V České republice (ČR) se u všech těhotných žen v I. trimestru provádí stanovení krevní skupiny RhD. Cílem screeningu je diagnostikovat asi 15 % RhD negativních žen (v ČR ročně asi 15 000 žen), které mohou být v průběhu těhotenství a při porodu ohroženy rozvojem RhD aloimunizace [2]. Provádění prevence RhD aloimunizace u RhD negativních žen přehledně zobrazuje schéma 1 [15]. RhD negativní žena je však ohrožena rozvojem RhD aloimunizace pouze v případě, že plod má na povrchu svých erytrocytů přítomen antigen “D“ (je-li RhD pozitivní), jedná se přibližně o 10 % plodů (10 000 ročně). Přítomnost antigenu “D“ lze vyšetřit neinvazivně stanovením genotypu plodu z volné fetální DNA cirkulující v periferní krvi těhotné ženy. Znalost RHD genotypu plodu má klinický význam v prenatální péči o RhD negativní ženy, protože 40 % z nich bude mít RhD negativní plod a preventivní podání IgG anti-D by u nich nemělo být indikováno (schéma 2).
Schéma 1 Prevence RhD aloimunizace u RhD negativních žen 
Doporučený postup České gynekologické a porodnické společnosti České lékařské společnosti Jana Evangelisty Purkyně [15] Schéma 2 Prevence RhD aloimunizace u RhD negativních žen při nejčastějších potenciálně senzibilizujících událostech v České republice 
A. Předpokládaný počet indikací ročně k podání imunoglobulinu (Ig) G anti-D těhotné ženě a ke stanovení krevní skupiny RhD u novorozence, není-li na začátku těhotenství u všech RhD negativních žen stanoven RHD genotyp plodu.
B. Předpokládaný počet indikací ročně, kdy není nutné podat IgG anti-D těhotné ženě a kdy není nutné stanovit krevní skupinu RhD u novorozence, je-li na začátku těhotenství u všech RhD negativních žen stanoven RHD genotyp plodu.Možnosti stanovení RHD genotypu plodu jsou různé. Vyšetření genetického materiálu plodu získaného invazivním odběrem (odběr plodové vody, odběr choriových klků) se ke stanovení RHD genotypu plodu nevyužívají. Podle nově publikovaného systematického přehledu je sice riziko potratu velmi nízké, nicméně přetrvává zvýšené riziko rozvoje aloimunizace [21]. S objevem neinvazivního vyšetření volné fetální DNA v roce 1997 v plazmě těhotné ženy nastává nový trend na poli medicíny [14]. Již na začátku těhotenství je možné u RhD negativní ženy stanovit RHD genotyp plodu z volné fetální DNA cirkulující v mateřské periferní krvi. Procentuální zastoupení volné fetální DNA v plazmě těhotných žen je velmi variabilní a pohybuje se nejčastěji v rozmezí 5–10 % v závislosti na délce těhotenství, velikosti placenty, hmotnosti ženy, rizikovém těhotenství atd. [7]. Díky takto nízké fetální frakci je nutné použít citlivou metodu, kterou je např. Real-time PCR (PCR, polymerase chain reaction, polymerázová řetězová reakce). Problematika neinvazivního stanovení RHD genotypu plodu je řešena celosvětově. Incidence RhD inkompatibility se liší v závislosti na etnickém původu. Přibližně 15 % bělošské populace je RhD negativní, tato vysoká incidence v populaci souvisí s rozšířením screeningu RHD genotypu plodu zejména v Evropě [5]. Dosud publikované práce v ČR byly jen na malém souboru pacientek [10, 25].
Cílem naší práce bylo zhodnotit klinickou a laboratorní efektivitu screeningu RHD genotypu plodu u RhD negativních žen metodou TaqMan Real-time PCR na rozsáhlém souboru pacientek.
MATERIÁL A METODIKA
V letech 2011–2015 ve Fakultní nemocnici Olomouc ve spolupráci Porodnicko-gynekologické kliniky, Ústavu lékařské genetiky a transfúzního oddělení bylo na rozsáhlém souboru RhD negativních žen provedeno neinvazivní stanovení RHD genotypu plodu z periferní krve a dále konfirmační vzorky bukálních stěrů novorozenců. Všechny RhD negativní těhotné byly nealoimunizované, kavkazské rasy, průměrný věk žen byl 29 let (nejmladší měla 18 let, nejstarší 40 let), 80 % vyšetření bylo v I. trimestru, medián 12. týden, 20 % vyšetření bylo ve II. trimestru, medián 15. týden. Charakteristiky sledovaného souboru těhotných žen přehledně zobrazuje tabulka 1.
Table 1. Charakteristiky sledovaného souboru těhotných žen. 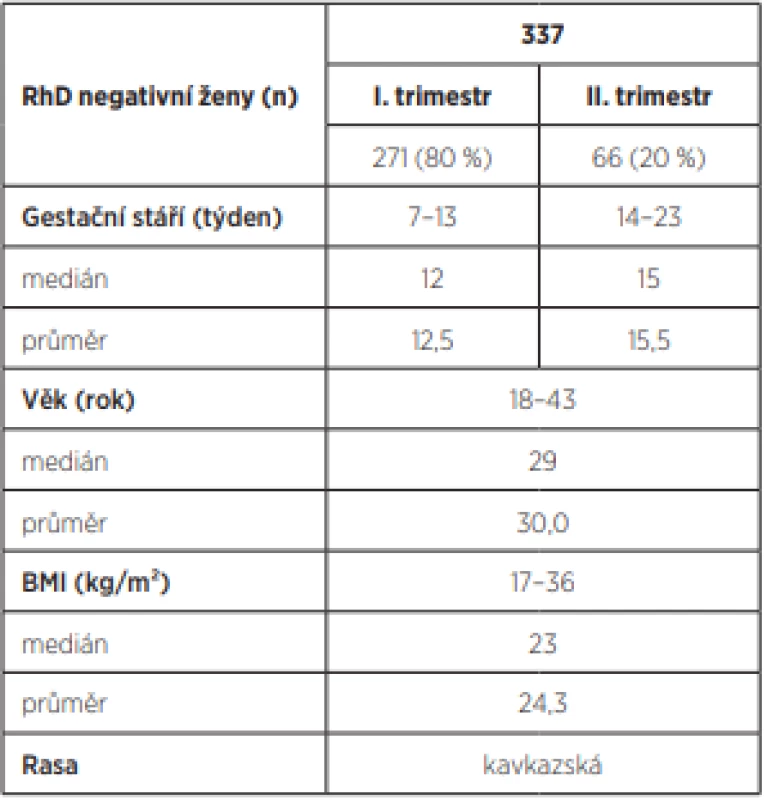
Celkem bylo vyšetřeno 337 RhD negativních těhotných žen v prvním nebo druhém trimestru těhotenství Celkem bylo vyšetřeno 337 RhD negativních těhotných žen, DNA izolovaná z 1 ml plazmy periferní krve těhotné ženy byla izolována pomocí kitu QiaAmp DNA Mini Kit (Qiagen). RHD genotyp těhotné ženy byl stanoven z leukocytů v periferní žilní krvi a RHD genotyp plodu z volné fetální DNA v plazmě. RHD genotyp plodu byl následně ověřen stanovením RHD genotypu novorozence z bukálního stěru. Všechny analýzy (RHD genotyp ženy/plodu/novorozence) byly provedeny metodikou TaqMan Real Time PCR s vnitřní kontrolou amplifikace, která je založena na detekci exonu 7 RHD genu a pro vnitřní kontrolu amplifikace byla použita sekvence β-globinu [1].
Statistická analýza
Prediktivní síla proměnných byla kvantifikována na základě standardního souboru statistik: senzitivity, specificity, falešné pozitivity, falešné negativity a celkové přesnosti. Analýzy byly vypočteny pomocí SPSS 23.0.0.1 (IBM Corporation, 2015).
VÝSLEDKY
Celkem se podařilo získat k vyhodnocení 333 „tripletů” (RHD genotyp ženy/plodu/novorozence). Analýza selhala u dvou plazmatických vzorků, pravděpodobně pro nízkou koncentraci volné fetální DNA zřejmě následkem její degradace, intenzita signálu PCR u plodu nebyla detekovatelná. U dvou vzorků nebylo možné stanovit RHD genotyp plodu z důvodu opakovaného RHD pozitivního nálezu u maternální DNA. Při izolaci a manipulaci s volnou fetální DNA hrozí riziko její kontaminace RHD pozitivní exogenní DNA. Tato kontaminace by vzhledem k malému množství volné fetální DNA mohla být interpretována jako falešně pozitivní výsledek při stanovení RHD genotypu plodu. Avšak falešná pozitivita nepředstavuje zvýšené riziko rozvoje erytrocytární aloimunizace. Zvýšené riziko chybného klinického managementu představuje jen falešná negativita, která v našich výsledcích byla velmi nízká, pouze čtyři plody byly falešně označeny jako RHD pozitivní. Z tohoto důvodu je nutné používat sérii kontrol amplifikace a kontaminace.
Ná základě vyhodnocení základních statistických parametrů posuzujících prediktivní sílu lze metodu stanovení RHD genotypu vyhodnotit jako velmi přesnou, spolehlivou a využitelnou v klinické praxi.
Výsledky a parametry screeningového testu přehledně zobrazuje schéma 3.
Schéma 3 Stanovení RHD genotypu plodu u RhD negativních žen – výsledky a parametry screeningového testu
Celkem bylo vyšetřeno 337 RhD negativních těhotných žen, RHD genotyp těhotné ženy byl stanoven z leukocytů v periferní žilní krvi a RHD genotyp plodu z volné fetální DNA v plazmě. RHD genotyp plodu byl následně ověřen stanovením RHD genotypu novorozence z bukálního stěru. RHD genotyp ženy/plodu/novorozence byl stanoven metodikou TaqMan RealTime PCR. Celkem se podařilo získat 333 „tripletů“ (RHD genotyp ženy/plodu/novorozence).
CI (confidence interval) – interval spolehlivosti DISKUSE
Při hodnocení efektivity zavedení screeningu RHD genotypu plodu u RhD negativních žen je nutné současně hodnotit hledisko medicínské, organizační i ekonomické.
Z medicínského hlediska je stanovení RHD genotypu plodu u všech RhD negativních žen na začátku těhotenství jednoznačně efektivní. Umožní tak diagnostikovat přibližně 40 % RHD negativních plodů, v ČR se jedná ročně asi o 5000 RhD negativních těhotných žen, kterým není nutné podávat IgG anti-D. IgG anti-D by mělo být podáno pouze v indikovaných případech, protože se vyrábí z plazmy senzibilizovaných dárců, objem produkce je tudíž limitován a občasné výpadky IgG anti-D na trhu mohou být příčinou, že prevence RhD aloimunizace není prováděna adekvátně, což může zvýšit incidenci aloimunizovaných žen. Důslednější provádění prevence RhD aloimunizace ve skutečně indikovaných případech může vést ke snížení incidence RhD aloimunizace a následně i ke snížení incidence hemolytické nemoci plodu a novorozence [18]. V souvislosti s aplikací tohoto krevního produktu se mohou objevit nežádoucí reakce, a ani přes důsledná opatření není vyloučeno riziko přenosu virových onemocnění. V 80. letech bylo v souvislosti s podáním imunoglobulinu nakaženo 704 žen virem hepatitidy C [12]. V současné době je plazma senzibilizovaných dárců vyšetřována na HBsAg, anti HIV a HCV protilátky, ale možný je i přenos nemocí, na které není dosud žádné testování (priony). Anafylaktická reakce se popisuje na 1 : 100 000 podání [19].
Rutkowski uvádí tři kazuistiky hypersenzitivity po podání imunoglobulinu a navrhuje vhodný management v péči o těhotné se známou hypersenzitivitou na imunoglobulin [20]. Podle SmPC (souhrn údajů o léčivém přípravku) registrovaných přípravků v ČR je doporučeno sledovat pacientku nejméně 20 minut po podání, může dojít k alergické reakci na IgG anti-D. Příznaky zahrnují kožní projevy, a to i generalizovaný exantém, tlak na hrudníku, dušnost, hypotenzi a anafylaxi [24]. Přípravky obsahují malé množství IgA. Jedinci s nedostatkem IgA mají potenciál ke vzniku IgA protilátek a anafylaktických reakcí po podání krevních složek obsahujících IgA. Vzácně může aplikace vyvolat pokles krevního tlaku s anafylaktickým šokem i u pacientek, které předchozí léčbu lidským imunoglubulinem snášely. Medicínský význam screeningového vyšetření RHD genotypu plodu je tedy nesporný.
V některých zemích je screeningové neinvazivní vyšetření RHD genotypu zavedeno do klinické praxe. Pouze RhD negativní matky RhD pozitivních plodů dostávají rutinní antenatální anti-D profylaxi. Jedná se o státy v Evropě, což souvisí s vysokou incidencí RhD negativních žen v populaci. Přehled zemí a publikovaných výsledků screeningu RHD genotypu plodu u RhD negativních žen v rámci strategie provádění prevence RhD aloimunizace zobrazuje tabulka 2.
Table 2. Screening RHD genotypu plodu u RhD negativních žen 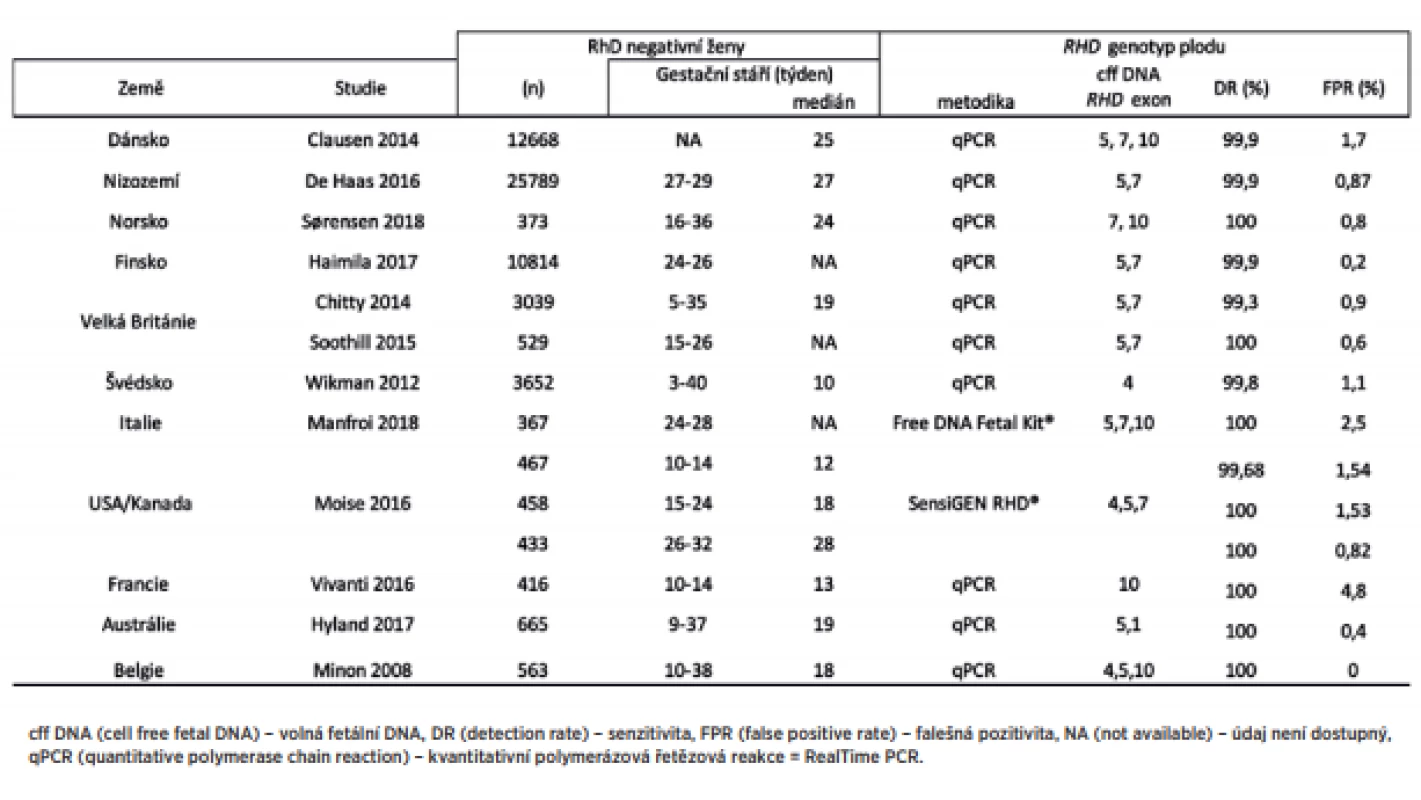
Přehled zemí a publikovaných výsledků screeningu RHD genotypu plodu u RhD negativní ženy v rámci strategie provádění prevence RhD aloimunizace. V Dánsku a Nizozemsku je již screeningové neinvazivní vyšetření RHD genotypu plodu implematováno do klinické praxe. Vyšetření se provádí ve 27. týdnu těhotenství, v případě RhD pozitivního plodu není imunoglobulin G anti-D těhotné ženě podán [4, 8]. V Norsku bylo zavedeno neinvazivní stanovení do rutinního používání od září 2016. Aby se snížil počet RhD aloimunizovaných, odběr se provádí ve 24. týdnu těhotenství, vyšetřuje se exon 7 a 10 [23]. Rutinní užití je i ve Finsku od roku 2014, kdy cílenou profylaxi dostávají pouze ženy nesoucí RhD pozitivní plod [9]. Ve Švédsku se od roku 2016 provádí screening již v prvním trimestru, což umožňuje dále i cílené použití imunoglobulinu G anti-D po invazivních výkonech v časném těhotenství a pozdních potratech [28]. V ostatních zemích Evropy, například Belgii, Irsku, Velké Británii, ČR, Francii a Německu, je dostupné prenatální vyšetření RHD genotypu jen v určitých regionech [3, 6, 16, 22, 27]. V USA je na trhu komerční vyšetření SensiGen RhD od firmy Sequenom [17]. V Kanadě byly v roce 2017 zahájeny kroky k implementaci screeningového vyšetření RHD genotypu [11]. V naší práci bylo 80 % vyšetření provedeno právě v I. trimestru. V zemích se zavedeným screeningem je, kromě Švédska, vyšetření prováděno až ve II. trimestru, vhodné je přesunout vyšetření do časného stadia těhotenství (I. trimestr), a využít tak znalost RHD genotypu plodu k optimální péči o RhD negativní těhotné, což potvrzují mnohé studie [9]. Podle mnohých populačních studií stanovení RHD genotypu plodu je spolehlivé, přesné a využitelné v klinické praxi, což je ve shodě s našimi výsledky. Z hlediska organizačního a ekonomického by mělo být vyšetření dostupné pro všechny RhD negativní těhotné ženy [18, 26].
ZÁVĚR
Trend screeningového stanovení RHD genotypu plodu v jednotlivých evropských zemích je zjevný, přispívá k optimalizaci prenatální péče o RhD negativní těhotné, aplikace IgG anti-D je cílená pouze u těhotenství s RhD pozitivním plodem a u 40 % těhotenství (plod RhD negativní) není těhotné ženě třeba podat IgG anti-D. Podle naší práce je stanovení RHD genotypu plodu s využitím exonu 7 pomocí TaqMan Real-time PCR přesné a využitelné v klinické praxi.
Podpořeno grantem IGA MZ ČR NT-12225-4/2011. Podpořeno MZ ČR – RVO (FNOl, 00098892).
MUDr. Tereza Kratochvílová
Porodnicko-gynekologická klinika LF UP a FN
I. P. Pavlova 6
775 20 Olomouc
e-mail: terka.dolezalova@seznam.cz
Sources
1. Böhmová, J., Vodička, R., Lubušký, M., et al. Stanovení RHD genotypu plodu z plazmy periferní krve těhotné ženy a posouzení citlivosti nových diagnostických postupů pro zavedení do klinické praxe. Čes Gynek, 2013, 78(1), s. 32-40.
2. ČGPS ČLS JEP. Zásady dispenzární péče v těhotenství. Doporučený postup. 2019.
3. Chitty, LS., Finning, K., Wade, A., et al. Diagnostic accuracy of routine antenatal determination of fetal RHD status across gestation: population based cohort study. BMJ, 2014, 349, p. 5243 – 5243.
4. Clausen, FB., Christiansen, M., Steffensen, R., et al. Report of the first nationally implemented clinical routine screening for fetal RHD in D-pregnant women to ascertain the requirement for antenatal RhD prophylaxis. Transfusion, 2012, 52, p. 752–758.
5. Daniels, G., Bromilow, I. Essential guide to blood group. Blackwell Publishing, 2009.
6. Darlington, M., Carbonne, B., Mailloux, A., et al. Effectiveness and costs of non-invasive foetal RHD genotyping in rhesus-D negative mothers: a French multicentric two-arm study of 850 women. BMC Pregnancy Childbirth, 2018, 18, p. 496.
7. Gregg, AR., Skotko, BG., Benkendorf, JL., et al. Noninvasive prenatal screening for fetal aneuploidy, 2016 update: a position statement of the American College of Medical Genetics and Genomics. Genet Med, 2018, 18, p. 1056–1065.
8. de Haas, M., Thurik, FF., van der Ploeg, CPB., et al. Sensitivity of fetal RHD screening for safe guidance of targeted anti-D immunoglobulin prophylaxis: prospective cohort study of a nationwide programme in the Netherlands. BMJ, 2016, 355.
9. Haimila, K., Sulin, K., Sainio, S., et al. Targeted antenatal anti-D prophylaxis program for RhD-negative pregnant women – outcome of the first two years of a national program in Finland. Acta Obstet Gynecol Scand, 2017, 96, p. 1228–1233.
10. Hromadnikova, I., Vechetova, L., Vlk, R., et al. Non-invasive fetal RHD and RHCE genotyping using real-time PCR testing of maternal plasma in RhD-negative pregnancies. J Histochem Cytochem, 2005, 53, p. 301–305.
11. Johnson, JA., MacDonald, K., Skoll, A., et al. No. 343 Routine non-invasive prenatal prediction of fetal RHD genotype in Canada: The time is here. J Obstet Gynaecol Canada, 2017, 39, p. 366–373.
12. Kenny-Walsh, E. Clinical outcomes after hepatitis C infection from contaminated anti-D immune globulin. Irish Hepatology Research Group. N Engl J Med, 1998, 340, p. 1228–1233.
13. Kent, J., Farrell, AM., Soothill, P. Routine administration of Anti-D: the ethical case for offering pregnant women fetal RHD genotyping and a review of policy and practice. BMC Pregnan Childbirth, 2014, 14, p. 87.
14. Lo, D., Corbetta, N., Wainscoat, JS., et al. Presence of fetal DNA in maternal plasma and serum. Lancet, 1997, 350, p. 485 – 487.
15. Lubušký, M., Procházka, M., Šimetka, O, Holusková I. Doporučení k provádění prevence RhD aloimunizace u RhD negativních žen. Doporučený postup ČGPS ČLS JEP. Čes Gynek, 2013, 78(2), s. 132–133.
16. Minon, JM., Gerard, C., Foidart, JM., et al. Routine fetal RHD genotyping with maternal plasma: a four-year experience in Belgium. Transfusion, 2008, 48, p. 373–381.
17. Moise, K., Gandhi, M., Paladino, T., et al. Circulating cell-free DNA to determine the fetal RHD status in all three trimesters of pregnancy. Obstet Gynecol, 2016, 128, p. 1340–1346.
18. Neovius, M., Tiblad, E., Wikman, A., et al. Cost-effectiveness of first trimester non-invasive fetal RHD screening for targeted antenatal anti-D prophylaxis in RhD-negative pregnant women: a model-based analysis. BJOG, 2016, 12, p. 1337–1346.
19. O’Brien, K., Siassakos, D., Bidgood, K., et al. Reaction to anti-D immunoglobulin – can we manage it? Obstet Med, 2009 2, p. 38–39.
20. Rutkowski, K., Nasser, SM. Management of hypersensitivity reactions to anti-D immunoglobulin preparations. Allergy, 2014, 69, p. 1560–1563.
21. Salomon, LJ., Sotiriadis, A., Wulff, CB., et al. Risk of miscarriage following amniocentesis or chorionic villus sampling: systematic review of literature and updated meta-analysis. Ultrasound Obstet Gynecol, 2019.
22. Soothill, PW., Finning, K., Daniels,G., et al. Use of cffDNA to avoid administration of anti-D to pregnant women when the fetus is RhD-negative: implementation in the NHS. BJOG, 2015, 122, p. 1682–1686.
23. Sørensen, K., Kjeldsen-Kragh, J., Akkök, ÇA., et al. Determination of fetal RHD type in plasma of RhD negative pregnant women. Scand J Clin Laboratory Investigation, 2018, 78, p. 411–416.
24. Sulakvelidze, I., Evans, S., Dolovich, J., et al. Urticaria from allergy to a purified human anti-Rh antibody preparation. Allergy, 1995, 50, p. 981–983.
25. Svobodová, I., Pazourková E., Korabečná, M., et al. Performance of Droplet Digital PCR in Non-Invasive Fetal RHD Genotyping – comparison with a Routine Real-Time PCR based approach. PLOS One, 2015, 10.
26. Teitelbaum, L., Metcalfe, A., Johnson, JM., et al. Costs and benefits of non-invasive fetal RhD determination. Ultrasound Obstet Gynecol, 2015, 45, p. 84–88.
27. Vivanti, A., Benachi, A., Costa, JM., et al. Diagnostic accuracy of fetal rhesus D genotyping using cell-free fetal DNA during the first trimester of pregnancy. Amer J Obstet Gynecol, 2016, 215, p. 606.e1-606.e5.
28. Wikman, AT., Tiblad, E., Reilly, M., et al. Noninvasive single - -exon fetal RHD determination in a routine screening program in early pregnancy: Obstet Gynecol, 2012, 120, p. 227–234.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2020 Issue 3-
All articles in this issue
- Screening RHD genotypu plodu u RhD negativních žen
- Efektivita stanovení KEL a RHCE genotypu plodu u aloimunizovaných žen minisekvenací
- miRNA profil luminálnych podtypov karcinómu prsníka v súbore slovenských žien
- Dotazníková studie prevalence inkontinence moči v těhotenství a v raném šestinedělí
- Koincidence obrovské děložní myomatózy a prvozáchytu dvou pokročilých malignit u 77leté pacientky
- Náhodný nález pánevní splenózy při gynekologické operaci
- Prodloužená gravidita: nezvyklý případ
- Disekující leiomyom dělohy s neobvyklými klinickými a patologickými rysy
- Nativní IVF cyklus u 46leté pacientky s následnou klinickou graviditou rysy
- Role neutrofilů u preeklampsie
- Cirkulujúca HPV DNA u pacientok s cervikálnymi prekancerózami a rakovinou krčka maternice
- Prof. MUDr. Adolf Štafl, Ph.D. (1931–2020)
- Nový, estrogeny neobsahující přípravek perorální hormonální antikoncepce (Estrogene free pill-EFP)
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nativní IVF cyklus u 46leté pacientky s následnou klinickou graviditou rysy
- Prodloužená gravidita: nezvyklý případ
- Nový, estrogeny neobsahující přípravek perorální hormonální antikoncepce (Estrogene free pill-EFP)
- Disekující leiomyom dělohy s neobvyklými klinickými a patologickými rysy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

