-
Medical journals
- Career
Přeměna mezenchymálních a epiteliálních buněk – vliv na funkci a receptivitu endometria
Authors: K. Crha 1; P. Ventruba 1; J. Žáková 1; M. Ješeta 1; R. Pilka 2; J. Vodička 2; P. Serpa 1
Authors‘ workplace: Gynekologicko-porodnická klinika Lékařské fakulty Masarykovy univerzity a FN, Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA 1; Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 2
Published in: Ceska Gynekol 2019; 84(5): 371-375
Category:
Overview
Cíl studie: V reprodukčním období ženy dochází k opakovaným a častým strukturálním a funkčním proměnám endometria. Schopnost regenerace, remodelace a diferenciace je předpokladem receptivity endometria, implantace a vývoje embrya. Důležitým faktorem těchto procesů je vzájemná přeměna mezenchymálního a epiteliálního fenotypu endometriálních buněk – epiteliálně-mezenchymální transice (EMT = epitelial-mesenchymal transition) a mezenchymálně-epiteliální transice (MET = mesenchymal-epithelial transition). Cílem práce je prezentovat současné poznatky o vzájemné přeměně epiteliálních a mezenchymální buněk děložní sliznice a jejich možném vlivu na poruchy plodnosti.
Typ studie: Přehledová práce.
Název a sídlo pracoviště: Gynekologicko-porodnická klinika Lékařské fakulty Masarykovy univerzity a FN Brno; Porodnicko-gynekologická klinika FN a LF UP Olomouc.
Metodika: Literární rešerše databáze PubMed publikované do února 2019 s termíny zaměřenými na „endometrial receptivity“, „embryo implantation“, „endometrial regeneration“, „mesenchymal–epithelial transition/transformation“.
Výsledky: Bylo prokázáno, že stromální buňky se podílejí na regeneraci nejen stromatu, ale také epitelu endometria. V průběhu decidualizace působením ovariálních steroidů a dalších faktorů probíhá MET, fibroblasty stromatu získávají postupně vlastnosti epiteliálních buněk – morfologicky i funkčně (sekreční endoplazmatické retikulum, pevné intercelulární spoje). V průběhu implantace embrya vlivem interakce trofoblastu s decidualizovaným endometriem dochází k přeměně epiteliálních buněk na mezenchymální (EMT), které jsou schopny migrace a regulace pronikajícího trofoblastu.
Závěr: Vzájemná přeměna stromálních a epiteliálních buněk endometria je nezbytná pro fyziologickou funkci děložní sliznice včetně implantace a vývoje embrya.
Klíčová slova:
endometrium – receptivita endometria – implantace embrya – regenerace endometria – mezenchymálněepiteliální transformace buněk
ÚVOD
V reprodukčním období ženy dochází k opakovaným a častým strukturálním a funkčním proměnám endometria – v menstruačním cyklu, v těhotenství nebo po nitroděložních operačních výkonech. Schopnost regenerace, remodelace a diferenciace je základním předpokladem receptivity endometria, implantace a vývoje embrya [16]. Důležitým faktorem těchto procesů je vzájemná přeměna mezenchymálního a epiteliálního fenotypu endometriálních buněk – epiteliálně-mezenchymální transice (EMT – epitelial-mezenchymal transition) a mezenchymálně-epiteliální transice (MET – mesenchymal-epithelial transition) [13]. Tyto přeměny byly zkoumány především v souvislosti s maligními nádory endometria, nové poznatky ukazují, že jsou nezbytné pro fyziologickou implantaci a správný vývoj embrya.
Cílem této práce je prezentovat současné poznatky o vzájemné přeměně epiteliálních a mezenchymálních buněk děložní sliznice a jejich možný vliv na poruchy plodnosti.
VZÁJEMNÁ PŘEMĚNA MEZENCHYMÁLNÍCH A EPITELIÁLNÍCH BUNĚK ENDOMETRIA
Důkazy o vzájemné přeměně mezenchymálních a epiteliálních buněk v embryu přinesla série prací koncem 20. století, např. diferenciace dělohy a proximální části pochvy je podmíněna MET [3, 7]. Následně byl tento proces prokázán také v plně diferencovaných tkáních v souvislosti s hojením ran a vznikem zhoubných nádorů [15, 19]. Epiteliální a mezenchymální buňky mají své charakteristické znaky. Pro epiteliální buňky je typická exprese cytokeratinu, vazba na bazální membránu extracelulární matrix (ECM – extracellular matrix) a formace intercelulárních junkcí. Pro mezenchymální buňky je charakteristický protáhlý, vřetenovitý tvar, exprese vimentinu a schopnost pohybu v ECM pomocí pseudopodií plazmatické membrány. Přehled jednotlivých buněčných markerů je uveden v tabulce 1. Proces EMT a MET je definován jako schopnost buněk změnit charakteristické znaky jednoho typu buněk na znaky typu druhého. Je důležité si uvědomit, že tento proces probíhá postupně v určitém čase. V průběhu EMT/MET je možné detekovat buňky „hybridního fenotypu“, které mají současně znaky typické pro epiteliální i mezenchymální buňky. Tyto buňky se mohou podílet na vzniku a rozvoji epiteliálních zhoubných nádorů [12].
Table 1. Charakteristické vlastnosti a buněčné markery epiteliáních a mezenchymálních buněk 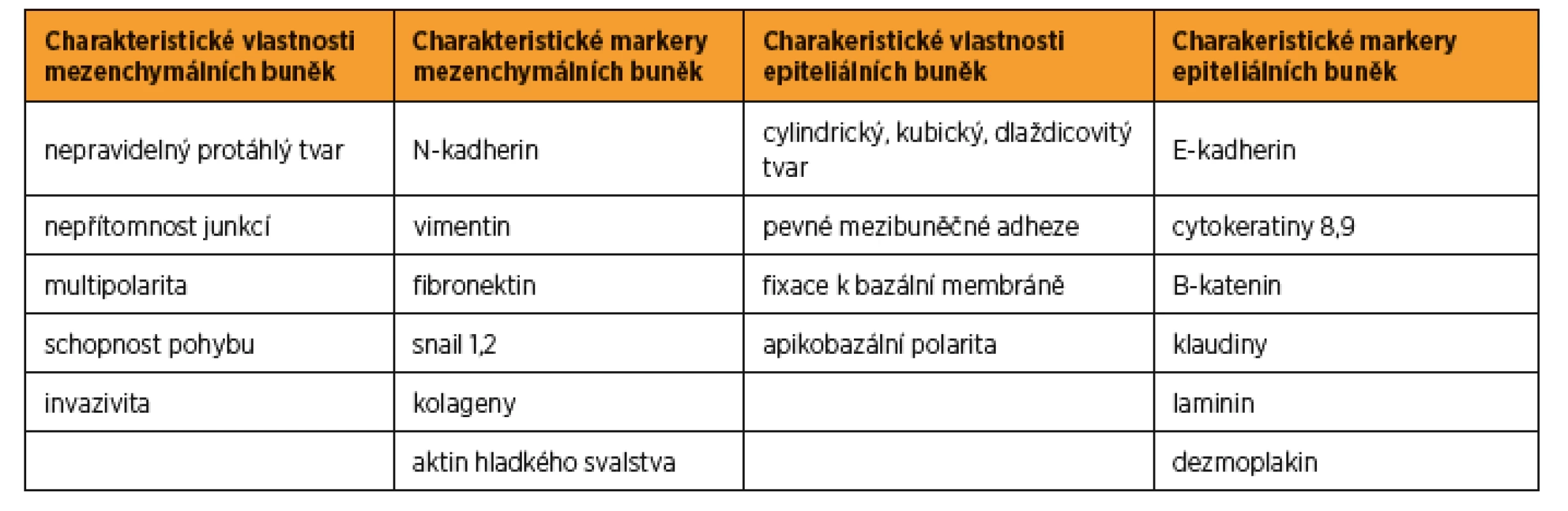
EMT/MET PŘI VÝVOJI REPRODUKČNÍHO TRAKTU ŽENY
Přeměna mezenchymálních a epiteliálních buněk nastává při embryonálním vývoji dělohy a pochvy z Müllerových vývodů. Mezenchymální buňky mezodermu se diferencují na epiteliální buňky nefritického duktu. Spojení kaudální části ductus Mülleri, při kterém se vytváří děloha a proximální část pochvy, je výsledkem zániku a absorpce centrálního septa. Při těchto procesech se uplatňuje EMT/MET [10].
EMT/MET PŘI REGENERACI ENDOMETRIA
Endometrium v reprodukčním období ženy má zcela výjimečnou schopnost opakované regenerace a diferenciace, ke které dochází při menstruačním cyklu, těhotenství, porodu nebo traumatizaci při operačních výkonech. Bylo prokázáno, že obnovu děložní sliznice a její struktury zajišťují kmenové buňky. Endometriální mezenchymální kmenové buňky (eMSCs – endometrial mezenchymal stem cells) se nacházejí v bazální vrstvě endometria při hranici s myometriem, další populace multipotentních eMSCs se nachází perivaskulárně ve funkční i bazální vrstvě endometria. Byly nalezeny také v postmenopauzálním endometriu, ve kterém si zachovávají svoji aktivitu [16]. Kmenové buňky eMSCs se diferencují na fibroblasty stromatu, diferenciace na epiteliální buňky nebyla prokázána. V bazální vrstvě endometria byla nalezena další linie progenitorových buněk s N-kadherinem, které se diferencují v buňky epiteliální [11].
EMT/MET PŘI DECIDUALIZACI ENDOMETRIA
V ovulačních cyklech dochází k přípravě endometria na těhotenství – decidualizaci. Při této transformaci probíhají změny morfologické, biochemické a funkční nejen v buňkách epiteliálních, ale také v buňkách stromálních, endotelu cév a buňkách imunitního systému. V sekreční fázi cyklu je navozuje souhra mnoha faktorů – k nejznámějším patří progesteron a relaxin, byl prokázán také vliv prostaglandinů, gonadotropinů, estrogenu a androgenů. Intracelulárně se uplatňuje signální dráha cyklického adenosinmonofosfátu (cAMP) a protein kinázy A, která zvyšuje citlivost endometriálních buněk na progesteron [13]. Deciduální reakce imunitního systému chrání buňky děložní sliznice před oxidativním stresem a je důležitá pro regulaci invaze trofoblastu, rozpoznání a eliminaci abnormních embryí. U žen dochází k decidualizaci cyklicky nezávisle na přítomnosti nebo nepřítomnosti embrya, bez těhotenství se při menstruaci odloučí.
Morfologické změny deciduálních buněk endometria
K nejvýraznějším morfologickým změnám při decidualizaci děložní sliznice dochází ve fibroblastech stromatu – charakteristický protáhlý vřetenovitý tvar se mění na typický tvar epiteloidních buněk, přibývá cytoplazmy, zakulacuje se jádro. Intracelulárně se zvyšuje obsah glykogenu, lipidů, expanduje hrubé endoplazmatické retikulum, mění se aktinová mikrofilamenta cytoskeletu, přibývá fagozomů a lyzozomů. Ke změnám dochází nejdříve v oblasti terminálních spirálních arterií, postupně se šíří do celého stromatu [4].
Biochemické změny deciduálních buněk endometria
Charakteristickým znakem decidualizovaných buněk endometria je schopnost specifické sekrece. Hlavními markery jsou prolaktin a IGFBP-1 (insuline-like growth factor binding protein). Prolaktin stimuluje růst trofoblastu a jeho invazi, inhibuje expresi prozánětlivých cytokinů a brání jeho rejekci. IGFBP-1 reguluje buněčné dělení endometriálních buněk a stimuluje invazi trofoblastu především přes integriny. V řadě studií byla prokázána korelace mezi morfologickými změnami MET a vzestupem prolaktinu a IGFBP-1 [4, 22].
Intercelulární komunikace deciduálních buněk
Při decidualizaci stromálních buněk endometria dochází ke zvýšené expresi junkčních proteinů, což posiluje mezibuněčnou komunikaci. Mezibuněčné spoje jsou proteinové komplexy, které fungují také jako aktivační faktory několika signálních drah. Typickým proteinem těchto spojů je beta-katenin a E-kadherin. Bylo prokázáno, že při decidualizaci lidských stromálních buněk vlivem estrogenu a progesteronu se signifikantně zvyšuje exprese beta-kateninu i E-kadherinu [20]. Tyto proteinové komplexy zajišťují také bariérovou funkci epitelu, regulují permeabilitu a udržují apiko-bazální polaritu epiteliálních buněk. V plazmatické membráně endometriálních stromálních buněk přítomny nejsou. Jejich přítomnost je tak spolehlivým průkazem MET. Další důležitou složkou mezibuněčných spojů jsou claudiny, které regulují velikost a specifitu molekul mezi buňkami procházejících [6]. Bylo prokázáno, že se podílejí na změnách epiteliálních buněk při implantaci embrya a deciduálních změnách stromatu. Zvýšená buněčná exprese junkčních proteinů posiluje epiteliální fenotyp buněk, jejich polaritu a mezibuněčnou komunikaci.
Molekulárně genetické aspekty decidualizace
Molekulárně genetické analýzy prokázaly změny exprese genů v souvislosti s MET a EMT. Celogenomové analýzy nalezly v průběhu decidualizace zvýšení nebo snížení exprese více než 3000 genů. Důležitou úlohu mají především signální dráhy Wnt a Snail [20]. Signální dráhy Wnt (= wingless/integrated) se objevují již v počátku evoluce, uplatňují se v embryonálním vývoji, při regeneraci buněk, homeostáze a při onkogenezi. Kanonická dráha Wnt reguluje transkripci v jádru buňky, nekanonická dráha působí na stavbu cytoskeletu a apiko-bazální polaritu epiteliálních buněk. V průběhu EMT snižuje tvorbu E-kadherinu a podporuje migraci buněk. Protein Snail1 je kódován stejnojmenným genem, patří do skupiny transkripčních faktorů, které regulují tvorbu adhezních molekul E-kadherinu a uplatňují se při EMT. Snail1 je markerem mezenchymálních buněk. Při epitelizaci endometriálních stromálních buněk byla prokázána downregulace genu Snail1 a zvýšená produkce E-kadherinu [21].
EMT/MET PŘI IMPLANTACI EMBRYA
Buňky lidské blastocysty jsou diferencovány na vnitřní embryoblast (ICM – inner cell mass) a trofektoderm tvořící stěnu blastocysty. Trofektoderm má podobné vlastnosti jako typické epiteliální buňky – apikobazální polaritu, exprimují E-kadherin, laterální mezibuněčné junkce, adheruje k bazální membráně tvořené fibronektinem, lamininem a kolagenem. EMT trofektodermálních buněk umožní jejich potřebnou invazivitu nezbytnou pro implantaci do endometria, a má tak zcela zásadní význam pro další vývoj embrya [13].
Po uvolnění ze zóny pellucidy se v povrchové vrstvě trofektodermu vytváří cestou EMT obří invazivní buňky (ITGC – invasive trophoblastic giant cells) důležité pro vznik placenty. Morfologické změny jsou provázeny ztrátou polarity a změnami v rozložení integrinů v buňce. Ty reagují s integriny buněk a mezibuněčné matrix endometria, uvolňuje se osteopontin, fibronektin. V buňkách klesá množství kadherinu, zvyšuje se jejich motilita a schopnost tvorby protruzí. Tyto ITGC pronikají do deciduy a vytvářejí placentu [1].
Při implantaci embrya dochází v decidualizovaném endometriu k další tranzici morfologie a funkce epiteliálních a stromálních buněk včetně změn mezibuněčné matrix. Klíčovou úlohu má vzájemná signalizace mezi embryonálním a mateřským kompartmentem. Již dříve byly prokázány změny markerů receptivity – integrinů. Jejich expresi v endometriálních buňkách dokázala indukovat pouze rostoucí embrya [14]. V novějších studiích byl sledován také vliv miRNA na proces EMT/MET v místě implantace. Bylo prokázáno, že snížení nebo zvýšení exprese miRNA-429 reguluje geny pro kadherin – důležitou molekulu mezibuněčných vazeb a morfologie [9]. Různé miRNA tak mohou regulací genů v místě implantace účinně řídit EMT/MET.
Do přeměny epiteliálního nebo mezenchymálního fenotypu buňky se zapojují také Ras proteiny – např. RhoA, Rac, které působí jako přepínače a regulují aktinový cytoskelet. Ovlivňují tak buněčnou migraci, diferenciaci, zánět a metastazování nádorových buněk [5]. V experimentálních studiích bylo prokázáno, že vyřazení proteinů RhoA a Rac1 v endometriálních buňkách vedlo k signifikantním změnám v invazi trofoblastu. Vyřazení Rac1 omezilo migraci stromálních buněk a inhibovalo průnik trofoblastu. Vyřazení RhoA naopak zvýšilo mobilitu stromálních buněk, a tak podpořilo invazi trofoblastu [4, 5].
EMT/MET ENDOMETRIA V KONTEXTU DALŠÍHO VÝZKUMU A KLINICKÉ PRAXE
Z uvedených poznatků o vzájemné přeměně EMT/MET buněk trofoblastu a endometria jasně vyplývá, že příčina selhání implantace může být v mnoha případech způsobena abnormitami v signálních drahách, které tyto tranzice řídí. Kromě vlivu hormonů [18, 17], imunitního systému, mikrobiomu endometria [2] nebo endokrinních disruptorů [8] je to další oblast, o které bychom měli mít přesnější informace. Nové poznatky v této oblasti by mohly přinést možnost jejich modulace nebo volby léčebného postupu.
V širším kontextu by poznatky o molekulárních mechanismech zcela výjimečného opakovaného cyklického hojení endometria bez tvorby jizev a při plném zachování funkce mohly přinést nové technologie pro hojení ran a poškozených tkání v jiných oblastech.
ZÁVĚR
Vzájemná přeměna stromálních a epiteliálních buněk endometria je nezbytná pro fyziologickou funkci děložní sliznice včetně implantace a vývoje embrya.
Práce vznikla za podpory MZ ČR – RVO (FNBr, 65269705), projektu MŠMT LTC-18059 a projektu MZ ČR reg. č. NV18-08-00291.
Korespondující autor
Ing. Michal Ješeta, Ph.D.
Gynekologicko-porodnická klinika
LF MU a FN
Obilní trh 11
602 00 Brno
e-mail: jeseta.michal@fnbrno.cz
Sources
1. Aplin, JD., Ruane, PT. Embryo-epithelium interactions during implantation at a glance. J Cell Sci, 2017, 130, p. 15–22.
2. Crha, I., Ventruba, P., Žáková, J., et al. Děložní mikrobiom jako faktor receptivity endometria. Čes Gynek, 2019, 84(1), p. 49–54.
3. Fitchett, JE., Hay, ED. Medial edge epithelium transforms to mesenchyme after embryonic palatal shelves fuse. Dev Biol, 1989, 131, p. 455–474.
4. Gellersen, B., Reimann, K., Samalecos, A., et al. Invasiveness of human endometrial stromal cells is promoted by decidualization and by trophoblast-derived signals. Hum Reprod, 2010, 25, p. 862–873.
5. Grewal, S., Carver, J., Ridley, AJ., et al. Human endometrial stromal cell rho GTPases have opposing roles in regulating focal adhesion turnover and embryo invasion in vitro. Biol Reprod, 2010, 83, p. 75–82.
6. Gupta, IR., Ryan, AK. Claudins: unlocking the code to tight junction function during embryogenesis and in disease. Clin Genet, 2010, 77, p. 314–325.
7. Hay, ED. Extracellular matrix, cell skeletons, and embryonic development. Am J Med Genet, 1989, 34, p.14–29.
8. Ješeta, M., Crha, T., Žáková, J., et al. Bisfenoly v patologii reprodukce. Čes Gynek, 2019, 84(2), p. 161–165.
9. Liang, J., Wang, S., Wang, Z. Role of microRNAs in embryo implantation. Reprod Biol Endocrinol, 2017, 15, p. 90.
10. Mullen, RD., Behringer, RR. Molecular genetics of müllerian duct formation, regression and differentiation. Sex Dev, 2014, 8, p. 281–296.
11. Nguyen, HPT., Xiao, L., Deane, JA., et al. N-cadherin identifies human endometrial epithelial progenitor cells by in vitro stem cell assays. Hum Reprod, 2017, 32, p. 2254–2268.
12. Nieto, MA., Huang, RY., Jackson, RA., et al. EMT: 2016. Cell, 2016, 166, p. 21–45.
13. Owusu-Akyaw, A., Krishnamoorthy, K., Laura, T. Goldsmith, LT., et al. The role of mesenchymal-epithelial transition in endometrial function. Hum Reprod Update, 2019, 25(1), p. 114–133.
14. Simón, C., Mercader, A., Garcia-Velasco, J., et al. Coculture of human embryos with autologous human endometrial epithelial cells in patients with implantation failure. J Clin Endocrinol Metab, 1999, 84, p. 2638–2646.
15. Thiery, JP., Acloque, H., Huang, RYJ., Nieto, MA. Epithelial-mesenchymal transitions in development and disease. Cell, 2009, 139, p. 871–890.
16. Ulrich, D., Tan, KS., Deane, J., et al. Mesenchymal stem/stromal cells in post-menopausal endometrium. Hum Reprod, 2014, 29, p. 1895–1905.
17. Ventruba, P., Žáková, J., Ješeta, M., et al. Současná témata reprodukční medicíny v České republice. Čes Gynek, 2016, 81(3), p. 234–240.
18. Vodička, J., Dvořan, M., Smékalová, K., et al. Možnosti přípravy endometria ke kryotransferu. Čes Gynek, 2018, 83(1), p. 24–28.
19. Yang, J., Weinberg, RA. Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis. Dev Cell, 2008, 14, p. 818–829.
20. Yu, L., Hu, R., Sullivan, C., et al. MFGE8 regulates TGF-β-induced epithelial mesenchymal transition in endometrial epithelial cells in vitro. Reproduction, 2016, 152, p. 225–233.
21. Zhang, XH., Liang, X., Liang, XH., et al. The mesenchymal-epithelial transition during in vitro decidualization. Reprod Sci, 2013, p. 354–360.
22. Zhang, Q., Yan, J. Update of Wnt signaling in implantation and decidualization. Reprod Med Biol, 2016, 15, p. 95–105.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2019 Issue 5-
All articles in this issue
- Účinnost dienogestu v terapii klinických symptomů endometriózy rektovaginálního septa
- Profylaktická oboustranná balonková okluze ilických arterií během císařského řezu u Svědkyně Jehovovy
- Akutní apendicitida v šestinedělí
- Ruptura dělohy v graviditě
- Heterotopická gravidita Vitální intrauterinní gravidita týden 12+4, vitální tubární gravidita týden 11+4
- Screening preeklampsie v I. trimestru těhotenství
- Přeměna mezenchymálních a epiteliálních buněk – vliv na funkci a receptivitu endometria
- ERAS protokol u onkogynekologických operací
- Syndrom Mayer-Rokitansky-Küster-Hauser – ageneze dělohy a pochvy: aktuální znalosti a terapeutické možnosti
- Současné možnosti predikce předčasného porodu
- Anatomie a biomechanika musculus levator ani
- Deložní leiomyomy s bizarními jádry: analýza 37 prípadu po laparoskopické ci otevrené myomektomii
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndrom Mayer-Rokitansky-Küster-Hauser – ageneze dělohy a pochvy: aktuální znalosti a terapeutické možnosti
- ERAS protokol u onkogynekologických operací
- Screening preeklampsie v I. trimestru těhotenství
- Ruptura dělohy v graviditě
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

