-
Medical journals
- Career
Cévní endotelový růstový faktor u pacientek s karcinomem ovaria
Authors: I. Sedláková 1; J. Tošner 1; O. Kopecký 2; V. Vroblová 2; A. Řezáč 1; P. Škapinec 1; C. Andrýs 2
Authors‘ workplace: Porodnická a gynekologická klinika LF UK a FN, Hradec Králové, přednosta doc. MUDr. J. Tošner, CSc. 1; Ústav klinické imunologie a alergologie FN, Hradec Králové, přednosta prof. MUDr. J. Krejsek, CSc. 2
Published in: Ceska Gynekol 2012; 77(5): 415-420
Overview
Cíl studie:
Cílem této práce je zhodnocení cévního endotelového růstového faktoru (VEGF) u pacientek s karcinomem ovaria, pacientek s benigní cystou ovaria a zdravých žen. Zjištění změn plazmatických hodnot VEGF v průběhu další léčby v závislosti na přítomnosti základního onemocnění.Typ studie:
Prospektivní klinická studie.Název a sídlo pracoviště:
Porodnická a gynekologická klinika, LF UK a FN Hradec Králové. Ústav klinické imunologie a alergologie, LF UK a FN Hradec Králové.Metodika:
Stanovení koncentrací VEGF jsme provedli metodou ELISA s využitím reagencií firmy R&D Systems.Výsledky:
Zjistili jsme závislost plazmatických hodnot VEGF na stadiu onemocnění (FIGO I+II, n=8), Med = 425,53 pg/ml (min. 142,30 pg/ml, max. 982,40 pg/ml) a u pacientek s pokročilým ovariálním karcinomem (FIGO III+IV, n=29), Med = 941,48 pg/ml (min. 202,10 pg/ml, max. 2857,80 pg/ml) (p=0,03). Zaznamenali jsme nejvyšší hodnotu VEGF u pacientek s nově diagnostikovaným ovariálním karcinomem, Med = 829,93 pg/ml (min. 142,30 pg/ml, max. 2857,80 pg/ml). Nižší hodnotu VEGF jsme prokázali u pacientek s benigní cystou ovaria, Med = 426,28 pg/ml (min. 32,00 pg/ml, max. 922,20 pg/ml). Nejnižší hodnotu VEGF jsme zjistili u žen zdravých, Med = 283,13 pg/ml (min. 80,50 pg/ml, max. 735,20 pg/ml) (p=0,0003). Nezaznamenali jsme rozdíl hodnot VEGF v aktivní fázi či remisi onemocnění u pacientek s odběrem periferní krve v průběhu další léčby. Hodnota VEGF byla nižší v periferní krvi (n=79), Med = 575,49 pg/ml (min. 55,80 pg/ml, max. 2185,00 pg/ml) než v ascitu (n=37), Med = 745,74 pg/ml (min. 142,30 pg/ml, max. 2185,00 pg/ml) (p=0,04).Závěr:
Stanovení VEGF před zahájením primární léčby a sledování změn jeho plazmatických hodnot v průběhu další léčby by mělo přispět k lepšímu pochopení angiogeneze u pacientek s karcinomem ovaria. VEGF koreluje s pokročilostí nově diagnostikovaného ovariálního karcinomu.Klíčová slova:
karcinom ovaria, VEGF, bevacizumab, cílená léčba.ÚVOD
Ovariální karcinom je šestým nejčastějším karcinomem u žen v České republice, reprezentuje 1,7 % ze všech nově diagnostikovaných neoplazmat (3,7 % u žen). Je odpovědný za 2,7 % všech úmrtí na rakovinu (6,2 % u žen). V roce 1988 byla incidence karcinomu ovaria v České republice 12,53 a mortalita 7,98 a o dvacet let později v roce 2008 incidence 12,24 a mortalita 6,66 na 100 000 žen. Mortalita karcinomu ovaria se v České republice s menšími výkyvy prakticky nezměnila od roku 1981 (7,58) až do roku 2006 (7,39), mírné snížení je patrné v letech 2007 (6,55) a 2008 (6,66) (zdroj dat: ÚZIS ČR, www.svod.cz). Přestože byla léčbě zhoubných nádorů ovaria věnována velká pozornost, výsledky přežití pacientek se za posledních 20 let zlepšily minimálně, a to spíše v důsledku centralizace péče do center [3].
Primárním faktorem řídícím angiogenezi je nedostatek kyslíku (hypoxie). Nízká tenze kyslíku aktivuje sekreci proangiogenních faktorů, především cévního endotelového růstového faktoru (vascular endothelial growth factor, VEGF), které stimulují formaci nových cév, aby bylo cévní zásobení dostatečné. Jakmile je tenze kyslíku dostatečná, produkce proangiogenních faktorů se zastaví, vyzrálé cévy přežívají a nezralé regredují. Mezi hlavní proangiogenní regulátory patří růstové faktory VEGF, bazický růstový faktor fibroblastů (BEGF) a transformační růstové faktory alfa a beta (TGF ∂ a TGFß) [5]. Aktivita všech těchto faktorů je zprostředkována vazbou na specifické receptory, které jsou přítomny na endotelových buňkách. Tyto receptory jsou tvořeny transmembránovým proteinem s tyrozinkinázovou doménou uvnitř buňky. VEGF se váže na VEGF-receptor-2, VEGF-receptor-1 a neurofilin-1. Přesná úloha těchto receptorů ještě nebyla zcela objasněna. Některé výsledky naznačují, že vazba VEGF na NRP-1 může podporovat nádorovou angiogenezi a progresi [11, 12].
VEGF je klíčovým regulátorem vaskulogeneze a angiogeneze [9, 10, 20]. Mechanismus angiogeneze je složitý vícestupňový proces označovaný jako angiogenní kaskáda, který je regulován větším počtem humorálních působků, zejména cytokinů, integrinů, adhezních molekul, proteolytických enzymů a nízkomolekulárních látek. Za fyziologických okolností jsou faktory stimulující krvetvorbu (angiogenní faktory) v rovnováze s faktory antiangiogenními. V průběhu času v nádoru vznikají různé typy krevních cév. Nejprve se vytvářejí „mateřské cévy“ (během 1–5 dnů), krev jimi protéká pomalu nebo stagnuje [4]. Exprimují VEGF – receptory-1 a 2, jsou závislé na VEGF. Z mateřských cév vznikají „přemostěné mateřské cévy“ (3–10 dnů) jako důsledek přemostění lumina cév endotelovými buňkami, jsou závislé na VEGF. Z nich se nakonec během několika dní až týdnů formují kapiláry, které přestávají být závislé na VEGF [14]. V první avaskulární fázi jsou léze latentní a jejich průměr nepřesahuje 1 až 2 mm. Jejich růst je ve vyváženém stavu, když proliferace a apoptóza jsou v rovnováze. K progresi nad tento stav je nutná vaskularizace, která umožní exponenciální růst nádoru [1]. Tento přechod se označuje jako „angiogenní přepnutí“. Jakmile nádor překročil tuto hranici, nové cévy se tvoří po celou dobu růstu nádoru.
Na základě výsledků studií GOG-0218 a ICON 7 byl v České republice dne 22. 12. 2011 bevacizumab doporučen do primární léčby ovariálního karcinomu ke stávající chemoterapii karboplatina + paklitaxel. Bevacizumab se váže na protein zvaný vaskulární endoteliální růstový faktor (VEGF), klíčový mediátor vaskulogeneze a angiogeneze, a tím inhibuje vazbu VEGF na jeho receptory (VEGFR-1, VEGFR-2) na povrchu endotelových buněk (viz souhrn údajů o přípravku).
Cílem této práce je zhodnocení VEGF u pacientek s karcinomem ovaria, pacientek s benigní cystou ovaria a zdravých žen. Zjištění změn plazmatických hodnot VEGF v průběhu další léčby v závislosti na přítomnosti základního onemocnění.
METODIKA A SOUBOR PACIENTEK
Vzorky séra pacientek s ovariálním karcinomem ke stanovení markerů angiogeneze odebrané před operací, před zahájením chemoterapie první linie, v průběhu léčby či po skončení primární léčby byly nejdříve uloženy při -70 st.C do okamžiku zpracování. Stejně tak vzorky periferní krve od pacientek kontrolní skupiny s benigním onemocněním vaječníku a zdravých kontrol. Stanovení sérových koncentrací VEGF bylo provedeno metodou ELISA s využitím reagencií firmy R&D Systems. Odebrané vzorky periferní krve byly po 1 hodině po odběru centrifugovány při 3000 rpm po dobu 10 minut, séra zmražena při -70 °C a takto uchována až do doby jejich zpracování.
Před vlastním zpracováním byly vzorky rozmraženy při pokojové teplotě. Do mikrojamky destičky bylo přidáno 100 μl ředícího roztoku a k němu 100 μl vzorku. Po dvouhodinové inkubaci při pokojové teplotě a následném promytí roztokem bylo přidáno 200 μl konjugátu a znovu inkubováno 2 hodiny při pokojové teplotě. Po promytí a přidání 200 μl substrátu byly vzorky bez přístupu světla za pokojové teploty inkubovány po dobu 25 minut. Reakce byla zastavena 50 μl stop roztoku a barevné změny odečítány při vlnové délce 450 nm.
VEGF jsme stanovili ze 37 vzorků plazmy pacientek s nově diagnostikovaným karcinomem ovaria a 72 vzorků plazmy pacientek s karcinomem ovaria odebraných v průběhu další léčby – léčených na Porodnické a gynekologické klinice Fakultní nemocnice Hradec Králové letech 2006–2009. Bližší charakteristiku souboru viz v tabulce 1. Dále pak bylo VEGF stanoveno u 15 pacientek s benigní cystou ovaria a u 21 žen zdravých. Odběry krve před primární operací na stanovení VEGF byly odebírány den před plánovanou primární operací pro karcinom ovaria u pacientek, které před danou operací neprodělaly chemoterapii ani žádnou jinou léčbu ovariálního karcinomu. Šlo o pacientky s nově zjištěným karcinomem ovaria. Dále jsme odebírali periferní krev v průběhu další léčby pro stanovení VEGF v aktivní fázi tumoru (tj. při přítomnosti nádorového onemocnění) a krev odebranou v remisi onemocnění (tj. ve fázi bez známek nádoru). Rozdělení do skupin pacientek v aktivní fázi onemocnění a remisi onemocnění bylo na základě výsledků zobrazovacích metod, Ca125 a fyzikálního vyšetření. Všechny pacientky z tohoto souboru dostaly podle současných doporučených postupů v rámci chemoterapie první linie kombinaci paklitaxel + karboplatina. Průměrný věk sledovaných pacientek byl 61,8 roku. Všechny pacientky měly před operací podepsaný informovaný souhlas s odběrem vzorků krve a ascitu schválený Etickou komisí FN HK.
Table 1. Charakteristika souboru pacientek s nově diagnostikovaným karcinomem ovaria 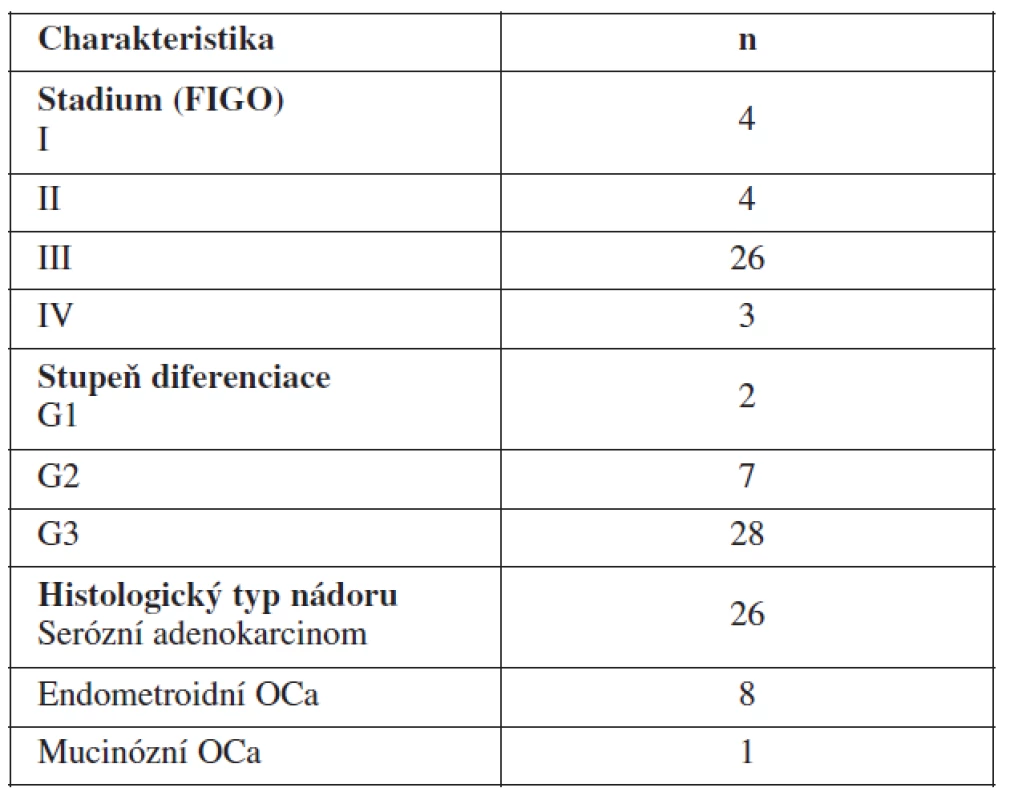
Pro popis souboru byly použity deskriptivní metody statistiky. Při porovnání jednotlivých faktorů neparametrický Mannův-Whitneyho a Kolmogorovův-Smirnovův test. Za statisticky významnou jsme považovali hladinu významnosti p < 0,05 a na hranici statistické významnosti p = 0,05–0,1.
VÝSLEDKY
VEGF a FIGO stadium onemocnění, stupeň diferenciace a histologický typ nádoru
Zjistili jsme korelaci hodnot VEGF stanovených z periferní krve odebrané před primární operací s pokročilostí onemocnění na hranici statistické významnosti (p=0,08). U pacientek s ovariálním karcinomem ve stadiu I (n=4) jsme zaznamenali hodnotu VEGF ze vzorku periferní krve odebrané před zahájením jakékoli léčby Med = 389,78 pg/ml (min. 219,50 pg/ml, max. 597,20 pg/ml), ve stadiu II (n=4) Med = 461,28 pg/ml (min. 142,30 pg/ml, max. 982,40 pg/ml), u pacientek se stadiem III (n=26) Med = 897,11 pg/ml (min. 202,10 pg/ml, max. 2857,80 pg/ml) a u pacientek se stadiem IV (n=3) Med=1326,10 pg/ml (min. 597,20 pg/ml, max. 2105,80 pg/ml). Při zhodnocení VEGF z periferní krve, odebrané od pacientek s ovariálním karcinomem před primární operací, jsme rozdělili pacientky s časným onemocněním – stadium I+II (n=8) a pokročilým onemocněním – stadium III+IV (n=29). Zde jsme prokázali statisticky významný rozdíl hodnot VEGF (p=0,031). U pacientek s časným ovariálním karcinomem jsme zjistili Med = 425,53 pg/ml (min. 142,30 pg/ml, max. 982,40 pg/ml) a u pacientek s pokročilým ovariálním karcinomem Med = 941,48 pg/ml (min. 202,10 pg/ml, max. 2857,80 pg/ml). Tento výsledek jednoznačně prokázal závislost hodnot VEGF z periferní krve odebrané před zahájením léčby na pokročilosti ovariálního karcinomu.
V případě vztahu VEGF v periferní krvi odebrané před primární operací a stupněm diferenciace jsme neprokázali výraznější rozdíly (p=0,21).
Při sledování závislosti hodnot VEGF z periferní krve odebrané před primární operací a histologickým typem ovariálního karcinomu jsme nejvyšší hodnotu zaznamenali u pacientek se serózním ovariálním karcinomem (n=26), Med = 854,45 pg/ml (min. 142,30 pg/ml, max. 2185,00 pg/ml) a nejnižší hodnotu u pacientek s endometroidním ovariálním karcinomem (n=8), Med = 490,53 pg/ml (min. 219,50 pg/ml, max. 837,7 pg/ml) (p=0,17).
Porovnání hodnot VEGF u pacientek s karcinomem ovaria, benigní cystou ovaria a zdravými ženami
Statisticky významný rozdíl (p=0,0003) jsme prokázali při porovnání průměrných hodnot VEGF z periferní krve u pacientek s karcinomem ovaria (n=37) s odběrem periferní krve před primární operací bez jakékoli předchozí léčby, u pacientek s histologicky prokázanou benigní cystou ovaria (n=15) a zdravými ženami (n=21). Průměrná hodnota VEGF v periferní krvi byla signifikantně nejvyšší u pacientek s nově diagnostikovaným karcinomem ovaria, Med = 829,93 pg/ml (min. 142,30 pg/ml, max. 2857,80 pg/ml). Nižší hodnotu VEGF jsme prokázali u pacientek s benigní cystou ovaria, Med = 426,28 pg/ml (min. 32,00 pg/ml, max. 922,20 pg/ml). Nejnižší průměrnou hodnotu VEGF jsme zjistili u žen zdravých, Med = 283,13 pg/ml (min. 80,50 pg/ml, max. 735,20 pg/ml).
Dále jsme porovnávali průměrné hodnoty VEGF v periferní krvi u pacientek v remisi základního onemocnění (n=30) a pacientek se vzorky periferní krve odebranými v aktivní fázi ovariálního karcinomu, tj. pacientek s odběrem v průběhu další léčby za podmínky přítomnosti základního onemocnění (n=42). Hodnota VEGF z periferní krve odebrané u pacientek v průběhu další léčby při přítomnosti ovariálního karcinomu byla Med = 463,49 pg/ml (min. 105,40 pg/ml, max. 1796,10 pg/ml) a u pacientek v remisi základního onemocnění (n=30) Med = 421,59 pg/ml (min. 68,8 pg/ml, max. 1294,3 pg/ml) (p=0,37).
Graph 1. Závislost hodnot VEGF z periferní krve odebrané před primární operací a s FIGO stadiem onemocnění (p=0,03) (st. I+II, n=8) (st. III+IV, n=29) 
Table 2. Průměrné hodnoty VEGF z periferní krve odebrané před primární operací v závislosti na pokročilosti onemocnění (stadium I+II a stadium III+IV), stupni diferenciace (G1 – dobře diferencovaný ovariální karcinom, G2 – středně diferencovaný ovariální karcinom, G3 – málo diferencovaný ovariální karcinom) a histologickém typu nádoru (SOC – serózní ovariální karcinom, MOC – mucinozní ovariální karcinom, EOC – endometroidní ovariální karcinom), p = statistická hladina významnosti 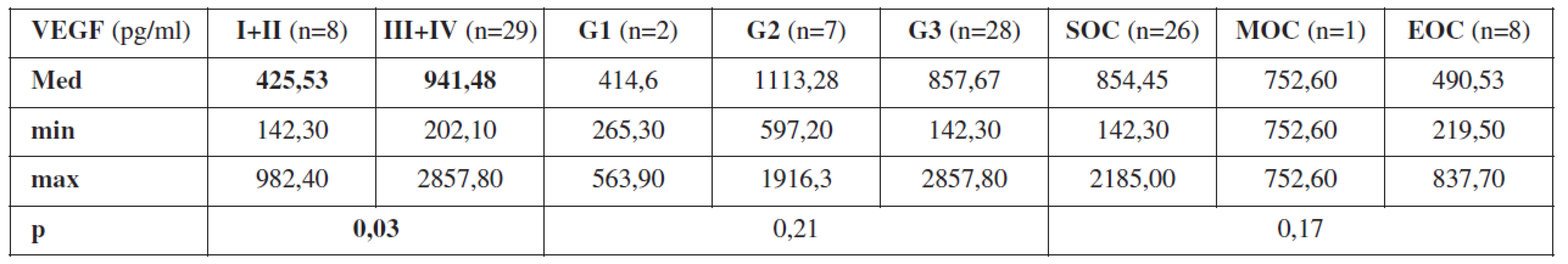
Table 3. Průměrné hodnoty VEGF z periferní krve odebrané před primární operací u pacientek s karcinomem ovaria, benigní cystou ovaria a zdravých žen 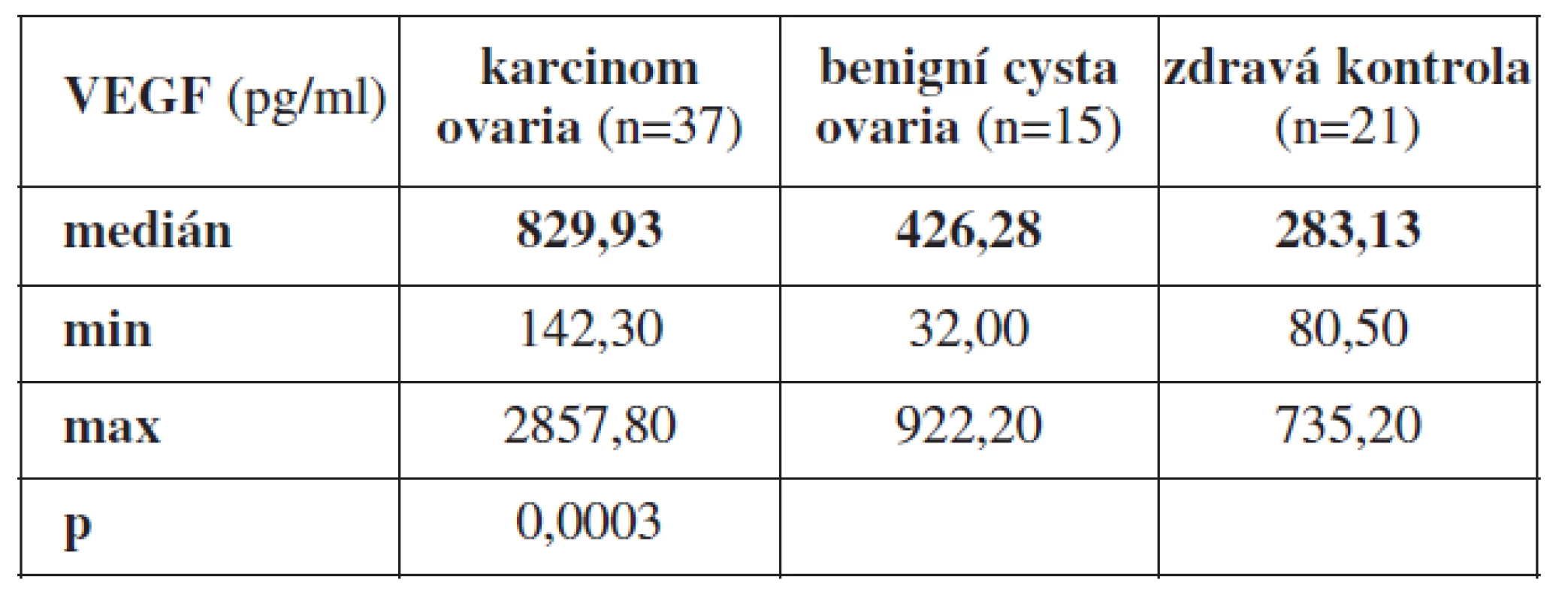
Table 4. Průměrné hodnoty VEGF z periferní krve odebrané u pacientek s karcinomem ovaria v průběhu další léčby v aktivní fázi nádorového onemocnění a remisi základního onemocnění 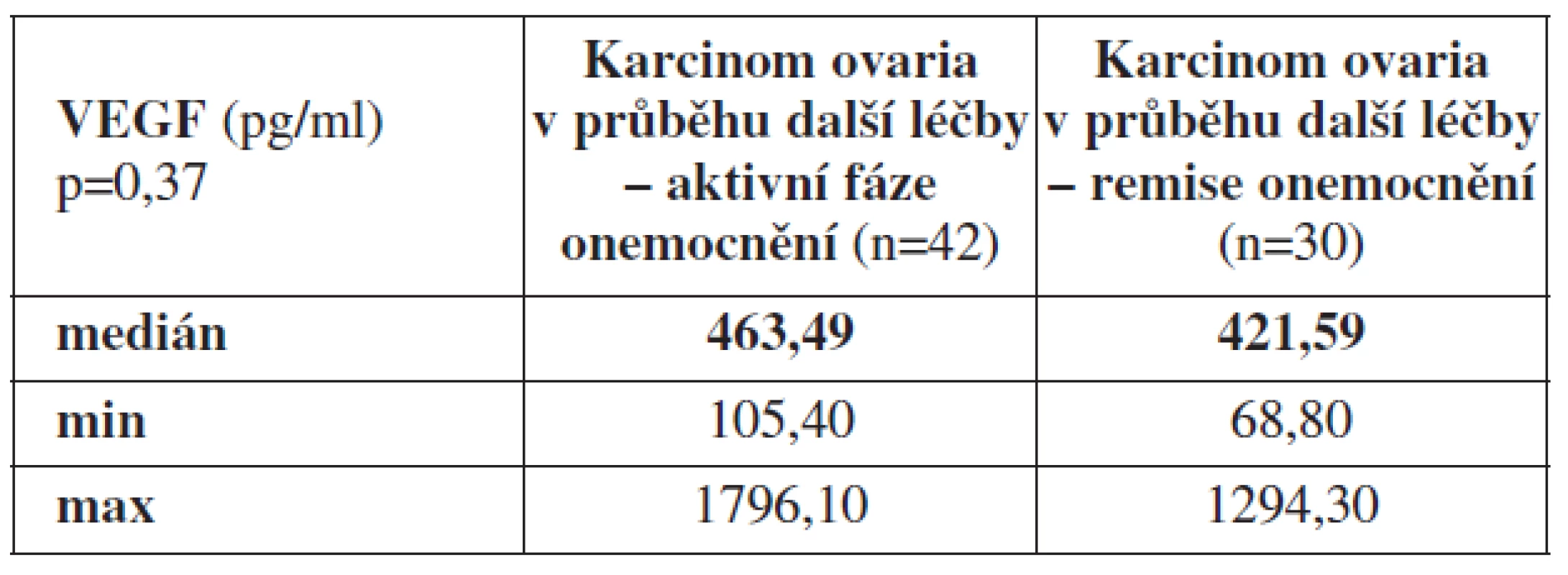
Porovnání hodnot VEGF z periferní krve a ascitu pacientek s ovariálním karcinomem
Zhodnotili jsme VEGF stanovené v periferní krvi pacientek s ovariálním karcinomem odebrané před primární operací nebo v průběhu další léčby v době aktivní fáze nádorového onemocnění (n=79) a z ascitu odebrané buď při primární operaci, nebo v průběhu další léčby (n=37). Hodnoty VEGF jsme zaznamenali nižší v periferní krvi, Med = 575,49 pg/ml (min. 55,80 pg/ml, max. 2185,00 pg/ml), než v ascitu, Med = 745,74 pg/ml (min. 142,30 pg/ml, max. 2185,00 pg/ml). Šlo o statisticky významný rozdíl (p=0,04).
DISKUSE
Angiogeneze má mimořádný význam pro růst nádoru a jeho metastazování. Hlavním angiogenním faktorem je VEGF. Jedna z prvních prací sledující VEGF u ovariálního karcinomu prokázala špatnou prognózu u pacientek s epiteliálním ovariálním karcinomem při vysoké expresi VEGF. Vzorky nádoru zde byly odebrány při primární operaci 18 pacientkám s ovariálním karcinomem bez předchozí léčby. Medián přežití byl 60 měsíců u pacientek s negativním VEGF na rozdíl od pouze 28 měsíců u pacientek s pozitivním VEGF ve vzorku nádoru (p=0,058) [8]. Paley et al. předpokládají VEGF expresi v nádorových buňkách jako nezávislý prognostický faktor u pacientek s časným ovariálním karcinomem a prokázali kratší DFI u pacientek s ovariálním karcinomem s výraznou expresí VEGF [15]. Gadducci et al. analyzovali sérum hladin VEGF u pacientek s epiteliálním ovariálním karcinomem a nalezli signifikantní elevaci VEGF u stadia III a IV, ale už ne u stadia I a II [6]. Práce věnovaná expresi VEGF a VEGF receptorů neprokázala vztah mezi hodnotou VEGF a délkou „disease free intervalu“ ani délkou celkového přežití. Zhodnoceno zde bylo 67 vzorků ovariálních nádorů u pacientek s pokročilým ovariálním karcinomem bez předchozí léčby (p=0,21) [1]. Při porovnání hodnot VEGF z 10 vzorků benigní ovariální cysty a 45 vzorků serózních ovariálních karcinomů, byla u 6 pacientek z 10 pacientek s benigní cystou ovaria prokázána exprese VEGF [2]. Sowter et al. publikovali silnou expresi VEGF u ovariálních serózních karcinomů, ale nedetekovali VEGF u benigních cyst a ani v normálním ovariálním epitelu [18]. Garzetti et al. prokázali signifikantně vyšší VEGF u ovariálních serózních karcinomů v porovnání s borderline tumory nebo benigními lézemi [7].
Zajímavým výsledkem naší práce jsou statisticky významné rozdíly hodnot VEGF v periferní krvi odebrané den před primární operací u pacientek s nově diagnostikovaným karcinomem ovaria, v porovnání s pacientkami s benigní cystou ovaria a zdravými ženami. Nejvyšší hodnoty VEGF v periferní krvi jsme zjistili u pacientek s nově diagnostikovaným karcinomem ovaria, a to v závislosti na stadiu onemocnění. Nezaznamenali jsme rozdíly plazmatických hodnot VEGF u pacientek s benigní cystou ovaria a pacientek s karcinomem ovaria v aktivní fázi s odběrem v průběhu další léčby po primární operaci a pacientek s karcinomem ovaria v remisi onemocnění. Pozorovali jsme výrazný pokles hodnot plazmatického VEGF u pacientek s karcinomem ovaria s odběrem po primární operaci v průběhu další léčby. Je otázkou, do jaké míry současné hodnocení odpovědi na léčbu vypovídá o reálném stavu nádorového onemocnění. V současnosti mluvíme pouze o minimálně měřitelné lézi, o makroskopickém nádoru, ale nehodnotíme tím mikrometastázy, mikroprostředí nádoru či stav dormantních nádorových buněk.
ZÁVĚR
Prokázali jsme statisticky významný rozdíl hodnot VEGF u pacientek s nově diagnostikovaným karcinomem ovaria bez jakékoli předchozí léčby v porovnání s pacientkami s benigní cystou ovaria a ženami zdravými. Zjistili jsme závislost VEGF na pokročilosti onemocnění. Nezaznamenali jsme rozdíly hodnot VEGF z plazmy v dalším průběhu onemocnění v závislosti na přítomnosti, či nepřítomnosti nádorového onemocnění v daném čase. Hodnoty VEGF byly u pacientek v aktivní fázi onemocnění podobné hodnotám VEGF z plazmy odebrané v remisi onemocnění či u pacientek s benigní cystou ovaria. Podle našich dosavadních výsledků VEGF koreluje s pokročilostí nově diagnostikovaného ovariálního karcinomu. Vztah VEGF se stavem onemocnění v průběhu další léčby po primární operaci není jasný. Stanovení VEGF před zahájením primární léčby a sledování změn jeho plazmatických hodnot v průběhu další léčby by mohlo přispět k lepšímu pochopení angiogeneze u pacientek s karcinomem ovaria. Vzhledem k zařazení bevacizumabu do primární léčby ovariálního karcinomu by byly vhodné další studie ke sledování plazmatických hodnot VEGF, a to zejména ve vztahu k odpovědi na tuto léčbu.
Tato práce vznikla za podpory grantu IGA MZ ČR 8768-3.
MUDr. Iva Sedláková, Ph.D.
Porodnická a gynekologická klinika
Fakultní nemocnice
Sokolská 581
500 05 Hradec Králové 5
e-mail: sedlakiva@seznam.cz
Sources
1. Brown, LF., Guidi, AJ., Schnitt, SJ., et al. Vascular stroma formation in carcinoma in situ, invasive carcinoma, and metastatic carcinoma of the breast. Clin Cancer Res, 1999, 5, p. 1041–1056.
2. Brustman, H., Naudé, S. Vascular endothelial growth factor expression in serous ovarian carcinoma: relationship with high mitotic activity and high FIGO stage. Gynec Oncol, 2002, 84, p. 47–52.
3. Cibula, D., Petruželka, L., a kol. Onkogynekologie. Praha: Grada Publishing, 2009, p. 508.
4. Dvorak, HF. Vascular permeability factor/vascular endothelial growth factor: a critical cytokine in tumor angiogenesis and a potential target for diagnosis and therapy. J Clin Oncol, 2002, 20, p. 4368–4380.
5. Ferrara, N., Gerber, HP., LeCouter, J. The biology of VEGF and its receptors. Nat Med, 2003, 9, p. 669–676.
6. Gadducci, A., Ferdeghini, M., Fanucchi, A., et al. Serum preoperative vascular endothelial growth factor in epithelial ovarian cancer: relationship with prognostic variables and clinical outcome. Anticancer Res, 1999, 19, p. 1401–1405.
7. Garzetti, GG., Ciavattini, A., Goteri, G., et al. Ki67 antigen immunostaining in serous ovarian tumors: index of proliferative activity, with prognostic significance. Gynec Oncol, 1995, 56, p. 169–174.
8. Hartenbach, EM., Olson, TA., Goswitz, JJ., et al. Vascular endothelial growth factor (VEGF) expression and survival in human epithelial ovarian carcinomas. Cancer Letters, 1997, 121, p. 169–175.
9. Jain, RK. Molecular regulativ of vessel maturation. Nat Med, 2003, 9, p. 685–693.
10. Lewis, NL., Meropol, NJ. Development of new agents for the treatment of advanced colorectal cancer. Clin Colorectal Cancer, 2003, 3, p. 154–164.
11. Miao, HQ., Lee, P., Lin, H., et al. Neuropilin-1 expression by tumor cells promotes tumor angiogenesis and progression. FASEB J, 2000, 14, p. 2532–2539.
12. Miao, HQ., Klagsbrun, M. Neuropilin is a mediator of angiogenesis. Cancer Metastasis Rev, 2000, 19, p. 29–37.
13. Muggia, FM., Braly, PS., Brady, MF., et al. Phase III randomized study of cisplatin versus paclitaxel versus cisplatin and paclitaxel in patients with suboptimal stage III or IV ovarian cancer: a gynecologic oncology group study. J Clin Oncol, 2000, 18, p. 106–115.
14. Ozawa, CR., Banfi, A., Glazer, NL., et al. Microenvironmental VEGF concentration, not total dose, determines a threshold between normal and aberrant angiogenesis. J Clin Invest, 2004, 113, p. 516–527.
15. Paley, PJ., Staskus, KA., Gebhard, K., et al. Vascular endothelial growth factor expression in early stage ovarian carcinoma. Cancer, 1997, 80, p. 98–106.
16. Reck, M., Pawel, J., Zatloukal, P., et al. and BO17704 Study Group. Overall survival with cisplatin-gemcitabine and bevacizumab or placebo as first-line therapy for nonsquamous non-small-cell lung cancer: results from a randomised phase III trial (AVAil). Ann Oncol, 2010, 21, p. 1804–1809.
17. Secord, AA., Darcy, KM., Hutson, A., et al. Co-expression of angiogenic markers and associations with prognosis in advanced epithelial ovarian cancer. A Gynecologic Oncology Group study. Gynec Oncol, 2007, 106, p. 221–232.
18. Sowter, HM., Corps, AN., Evans, AL., et al. Expression and localization of the vascular endothelial growth factor family in ovarian epithelial tumors. Lab Invest, 1997, 77, p. 607–614.
19. Tewari, SK., Mehta, SK., Burger, AR., et al. Conservation of in vitro drug resistence patterns in epithelial ovarian carcinoma. Gynec Oncol, 2005, 98, p. 360–368.
20. Yancopoulos, GD., Davis, S., Gale, NW., et al. Vascular-specific growth factors and blood vessel formativ. Nature, 2000, 407, p. 242–248.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2012 Issue 5-
All articles in this issue
- Chromozom 21 – specifické mikroRNA v mateřské cirkulaci: zhodnocení jejich významu pro screening Downova syndromu u plodu
- Srovnání různých typů pásek v léčbě inkontinence moči u gerontologických pacientek
- Výsledky operační léčby sestupu přední poševní stěny s použitím polypropylenové síťky
- Ektopická gravidita při IUS (Mirena) – kazuistika
- Cévní endotelový růstový faktor u pacientek s karcinomem ovaria
- Gitelmanův syndrom v těhotenství - těžká hypokalémie s příznivou perinatální prognózou
- Vývoj a změny incidencí vrozených vad u narozených dětí v České republice
- Prenatální diagnostika vrozených vad v ČR – patnáctileté období
- HE4 - biomarker ovariálního karcinomu
- Obezita a mužská neplodnost
- Rodičky užívající alkohol, tabák a nelegální drogy
- Nová možnost v léčbě pokročilého ovariálního karcinomu
- Srovnání hladin prolaktinu, fT3 a fT4 ve folikulární tekutině žen s poruchou plodnosti a zdravých plodných dárkyň oocytů
- Výskyt Chlamydia trachomatis při léčbě neplodnosti
- Metoda redukce odlesku v kolposkopii
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Výsledky operační léčby sestupu přední poševní stěny s použitím polypropylenové síťky
- HE4 - biomarker ovariálního karcinomu
- Ektopická gravidita při IUS (Mirena) – kazuistika
- Výskyt Chlamydia trachomatis při léčbě neplodnosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

