-
Medical journals
- Career
Prognostický význam klinickopatologických a vybraných imunohistochemických faktorů u karcinomu endometria
Authors: I. Marková 1; R. Pilka 2; M. Dušková 3; J. Zapletalová 4; Milan Kudela 2
Authors‘ workplace: Ústav genetiky a fetální medicíny, FN a LF UP, Olomouc, přednosta prof. MUDr. J. Šantavý, CSc. 1; Porodnicko-gynekologická klinika, FN a LF UP, Olomouc, přednosta doc. MUDr. R. Pilka, Ph. D. 2; Ústav patologické anatomie, FN a LF UP, Olomouc, přednosta doc. MUDr. M. Tichý, CSc. 3; Ústav lékařské biofyziky, pracoviště biometrie, LF UP, Olomouc, přednostka doc. RNDr. H. Kolářová, CSc. 4
Published in: Ceska Gynekol 2010; 75(3): 193-199
Overview
Cíl studie:
Zjistit pomocí imunohistochemického vyšetření expresi p53, bcl-2, c-erbB-2, Ki-67, estrogenového (ER) a progesteronového (PR) receptoru u pacientek s karcinomem endometria. Stanovení prognostického významu klinickopatologických a imunohistochemických markerů pro přežití pacientek s karcinomem endometria.Typ studie:
Experimentální prospektivní studie.Název a sídlo pracoviště:
Porodnicko-gynekologická klinika, Ústav lékařské genetiky, Ústav patologie, Ústav lékařské biofyziky FN a LF UP Olomouc.Metodika:
Studovali jsme 144 případů primárně neléčeného karcinomu endometria, u nichž jsme pomocí imunohistochemického vyšetření stanovovali přítomnost p53, bcl-2, c-erbB-2, Ki-67, ER a PR. Ve skupině 122 pacientek jsme hodnotili disease free survival (DFS) v závislosti na klinickopatologických a imunohistochemických faktorech.Výsledky:
Z celkové skupiny 144 pacientek s karcinomem endometria byly pro analýzu přežití použity vzorky 122 pacientek, u nichž v 15 (12,3 %) případech byla zaznamenána recidiva základního onemocnění a 107 (87,7 %) pacientek bylo bez zjištěné recidivy. Průměrný věk pacientek byl 64,5 let (rozmezí 34-88 let). Z imunohistochemických markerů byly v této skupině pozitivní p53 ve 29 (23,8 %), bcl-2 v 87 (71,3 %), c-erbB-2 ve 34 (27,9 %), Ki-67 v 56 (45,9 %), ER v 97 (79,5 %) a PR ve 106 (86,9 %) případech. V analýze přežití byl signifikantně kratší DFS zaznamenán u nádorů s horší diferenciací (G3), dále u nádorů s hlubší invazí (M2) a u případů s pozitivní lymfoinvazí (N).Závěr:
Významnými nezávislými faktory pro predikci délky DFS a rizika recidivy jsou pouze nádory s horší diferenciací (G3) a hlubší invazí (M2).Klíčová slova:
endometriální karcinom, imunohistochemie, prognostický faktor, recidiva.ÚVOD
Gynekologické zhoubné nádory představují přibližně 15 % všech nádorových onemocnění ženské populace v České republice. Endometriální karcinom je po zhoubných nádorech prsu nejčastější gynekologickou malignitou. Stejně jako v ostatních vyspělých krajinách má jeho incidence v ČR neustále stoupající trend. Odhaduje se, že každým rokem onemocní celosvětově tímto onemocněním asi 170 000 žen [1]. V roce 2005 dosáhla v ČR incidence poměru 33,2/100 000 žen, což v absolutních číslech znamená, že onemocnělo 1739 žen [36].
Příčiny rostoucí incidence jsou multifaktoriální, v určitém smyslu lze proto hovořit o nemoci civilizační. Mezi nejdůležitější rizikové faktory patří prolongovaná stimulace endometria vlivem estrogenů neoponovaná gestageny, obezita, věk, nuliparita, diabetes mellitus, hypertenze a léčba tamoxifenem. V mnoha případech je patrné jejich současné spolupůsobení [2, 3, 10, 30].
Ačkoliv většina případů endometriálního karcinomu je sporadickým onemocněním, na hereditárním podkladě jich vzniká přibližně 5-10 %. Naprostá většina těchto pacientek nese mutaci v některém z genů tzv. mismatch-repair systému (geny MLH1, MSH2, MSH6, PMS2), a je tak nosičkou Lynchova syndromu, označovaného také jako HNPCC (hereditary non-polyposis colorectal cancer syndrom) [17].
Prognostické faktory lze obecně vymezit jako fenotypické charakteristiky jedince i samotného nádoru, korelující s celkovým přežitím. Z klinického hlediska se používají k posouzení prognózy onemocnění. Pro zlepšení léčby a dispenzarizace pacientek s endometriálním karcinomem byla studována řada klinickopatologických prognostických faktorů. Mezi tradičně uváděné prognostické faktory patří věk, parita, stadium onemocnění, histologický typ, histologický grade, hloubka myometriální invaze, vaskulární invaze a postižení lymfatických uzlin [2, 15, 30].
U endometriálního karcinomu dosud nebyl nalezen žádný specifický sérový tumor marker. V současné době je velká snaha o přesnější identifikaci vysoce rizikových skupin, která by umožnila jednak konzervativní léčbu u pacientek s dobrou prognózou a také rezervovat účinnou a radikálnější léčbu pro nemocné s agresivnějšími typy nádorů. Proto jsou v poslední době intenzivně studovány další faktory, které by mohly vést k lepšímu pochopení molekulárních základů endometriální kancerogeneze a následně ke zlepšení klasifikace, prognózování a individualizaci léčby těchto nádorů.
Abnormální zvýšená exprese p53 tumor supresorového genu u karcinomu endometria koreluje s agresivními histologickými typy, pokročilým stadiem onemocnění a kratší dobou přežití [9, 16, 25].
Bcl-2 je onkogen, který inhibuje apoptózu a prodlužuje přežití buňky. Zvýšená exprese je popisována u hyperplazie endometria, kdežto ztráta exprese je spojována s horší prognózou, větší hloubkou myometriální invaze, pokročilejším stupněm onemocnění a vyšší pravděpodobností výskytu lymfatických metastáz [4, 25, 31, 37].
Amplifikace a zvýšená exprese onkogenu c-erbB-2 (lidský celulární onkogen identický s krysím HER 2/neu) se vyskytuje u 10-40 % karcinomů endometria a koreluje s horší prognózou a agresivnějším chováním nádoru [18, 20].
Klinické využití tohoto faktoru zůstává zatím nejednoznačné, protože negativní prognostický dopad nebyl potvrzen ve všech studiích [18, 28].
Mezi jeden z nejznámějších markerů buněčné proliferace patří Ki-67. Většina endometriálních karcinomů exprimuje nízký proliferační index Ki-67 a má příznivou prognózu, zatímco většina serózních a jasně buněčných tumorů má vysoký proliferační index. Korelace s gradingem, stadiem onemocnění a histopatologickým typem tumoru byla potvrzena v mnoha studiích [5, 33, 34].
Endometrium je cílovou tkání steroidních hormonů produkovaných ovarii. Jak v epitelových, tak ve stromálních buňkách endometria jsou přítomné estrogenové (ER) a progesteronové (PR) receptory. Zdá se, že exprese ER a PR hraje významnou roli v endometriální kancerogenezi. Podle výsledků řady studií je exprese těchto receptorů spojena s dobře diferencovanými tumory, koreluje se stadiem nádoru a přežitím [11, 14, 21].
Význam různých imunohistochemických parametrů pro prognózu pacientek s karcinomem endometria dosud nebyl jednoznačně stanoven. Snahou je použitím informací získaných ze změn exprese nádorových biomarkerů přispět ke snížení radikality chirurgické a radiační terapie. Cílem naší práce bylo imunohistochemické stanovení exprese molekulárně biologických markerů a stanovení prognostického významu klinickopatologických a imunohistochemických markerů pro přežití pacientek s karcinomem endometria.
SOUBOR PACIENTEK A METODIKA
Charakteristika souboru
V období od září 2001 do března 2009 jsme na Porodnicko-gynekologické klinice FN Olomouc studovali 144 případů primárně neléčeného karcinomu endometria.
Follow-up data byla k dispozici u 122 pacientek s endometriálním karcinomem. U zbývajících 22 pacientek nebylo možné vzhledem k nedodrženým doporučeným kontrolám dohledat jakákoli další data o jejich stavu. Jako recidiva byla definována jakákoli blízká nebo vzdálená metastáza prokazatelně související se základním onemocněním.
Z celkové skupiny 144 pacientek s karcinomem endometria byly pro analýzu přežití použity vzorky 122 pacientek, u nichž v 15 (12,3 %) případech byla zaznamenána recidiva základního onemocnění a 107 (87,7 %) pacientek bylo bez zjištěné recidivy.
Průměrný věk pacientek byl 64,5 let (rozmezí 34-88 let). Skupinu pacientek s věkem pod 65 let tvořilo 69 (56,6 %) pacientek, nad 65 let 53 (43,4 %) pacientek.
Do skupiny FIGO I–II bylo zařazeno 108 (88,5 %), do skupiny III–IV 14 (11,5 %) pacientek.
Do skupiny grading G1–G2 bylo zařazeno 101 (82,8 %) pacientek, skupinu G3 tvořilo 21 (17,2 %) pacientek.
Nádory bez myometriální invaze nebo nádory s invazí do méně než poloviny tloušťky myometria (M0 a M1) tvořilo skupinu 76 (62,3 %) pacientek, invaze přesahující polovinu tloušťky myometria (M2) tvořilo 46 (37,7 %) případů.
Metastatické šíření bylo u 105 (86,1 %) pacientek nepřítomno (N), u 17 (13,9 %) případů byly metastázy přítomny (M).
S ohledem na výrazně lepší prognózu jsme pro statistické zpracování sloučili skupiny pacientek s lepšími klinickopatologickými parametry (klinická stadia FIGO I a II, grade 1 a 2 a skupiny s hloubkou myometriální invaze M0 a M1).
Z imunohistochemických markerů byly v této skupině pozitivní p53 ve 29 (23,8 %), bcl-2 v 87 (71,3 %), c-erbB-2 ve 34 (27,9 %), Ki-67 v 56 (45,9 %), ER v 97 (79,5 %) a PR ve 106 (86,9 %) případech (tab. 1).
Table 1. Popisná charakteristika souboru pro analýzu přežití 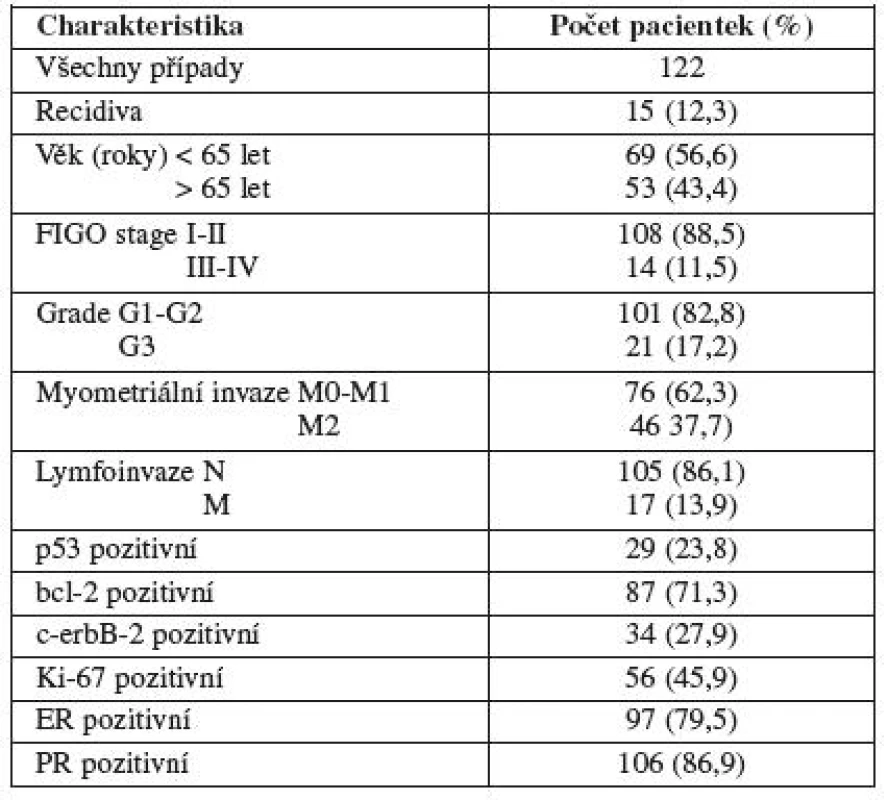
Imunohistochemické zpracování
Zpracovaný materiál tvořily karcinomy endometria získané od pacientek jednak z diagnostické kyretáže, jednak z následné hysterektomie. Obojí typ vzorků byl standardně rutinně zpracován po 24hodinové fixaci 10% formaldehydem a zalit do parafinových bloků s následným rutinním barvením hematoxylin-eozinem pro světelnou mikroskopii ke stanovení histopatologické diagnózy. Pro následnou sérii imunohistologických vyšetření byly vybrány vzorky s dostatečným množstvím dobře zachované nádorové struktury a zpracovány ve tkáňových řezech o síle 5 až 8 μm na sklíčkách potažených Vectabondem (Vector). Pro detekci jednotlivých markerů byla použita standardní nepřímá imunohistochemická technika se souborem králičích nebo myších protilátek (pro p53, c-erbB-2, Ki-67, ER a PR – DAKO, pro bcl-2 – BIOGENEX).Vyšetření byla prováděna s pozitivní kontrolou.
Kvantifikace pozitivity byla vyjadřována v procentech. Jako hranice pozitivity p53, bcl-2, c-erbB-2 a Ki-67 byla stanovena hodnota mediánu. Jako p53 a bcl-2 pozitivní byly hodnoceny vzorky s jaderným barvením 20 % nádorových buněk a více, jako Ki-67 pozitivní s barvením 40 % a více. Vzorky s membránovou pozitivitou c erbB-2 byly hodnoceny jako pozitivní v 10 % a více. Hranice pozitivity ER a PR byla na základě četných předchozích studií stanovena na 5 %.
Statistické vyhodnocení
V analýze přežívání pacientek byl k posouzení korelace recidiv s věkem použit Studentův dvouvýběrový t test.
Disease free survival (DFS) je doba od data operace do data recidivy, u pacientek bez recidivy se registruje doba od data operace do data poslední negativní kontroly. Pro zhodnocení DFS v závislosti na klinickopatologických a imunohistochemických proměnných byla použita Kaplanova-Meierova analýza a Log-rank test. Proměnné, které v této univariační analýze dosáhly signifikantní významnosti, byly dále zpracovány pomocí Coxovy regresní analýzy. Jde o multivariační metodu, která se používá k analýze cenzorovaných dat a je možné díky ní vyhledat nezávislé prediktory, které mají vliv na délku přežití a riziko recidivy. Hladina statistické významnosti byla stanovena pro p<0,05.
Ke zpracování všech údajů a závislostí byl použit statistický program SPSS verze 15 (SPSS Inc., Chicago, USA).
VÝSLEDKY ANALÝZY PŘEŽITÍ
Průměrná doba sledování pacientek byla 2,6 roku, směrodatná odchylka (SD) 1,75 roku. Medián délky sledování byl 2 roky. Ve skupině s recidivami byla průměrná doba disease free survival (DFS) 2,03 roku, SD 1,01 roku a medián 1,76 roku.
Z výsledku Studentova dvouvýběrového t-testu, který byl použit pro věkové porovnání skupiny pacientek s recidivou a skupiny bez recidivy, vyplývá, že pacientky s recidivou a pacientky bez recidivy se signifikantně ve věku neliší. Důvodem použití tohoto testu je fakt, že se nepracovalo s dobou do recidivy (tedy délkou DFS).
Kaplanova-Meierova univariační analýza (Log rank test) mezi klinickopatologickými faktory prokázala, že signifikantně kratší DFS je zaznamenán u nádorů s horší diferenciací (G3) (při hladině signifikance testu p=0,002), dále u nádorů s hlubší invazí (M2) (p=0,001) a u případů s pozitivní lymfoinvazí (N) (p=0,007). U nádorů s grade 1 a 2 byl DFS 6,4 let ve srovnání s nádory s grade 3, kde byl DFS pouze 4,8 let (graf 1).
Graph 1. Délka přežití (disease free survival – DFS) v závislosti na grade Log rank test prokázal signifikantní delší DFS u pacientek s grade G1, G2 (6,4 roku) ve srovnání s pacientkami s grade G3 (4,8 roku). Sign. testu p = 0,002. 
Nádory s nepřítomnou invazí nebo s invazí do méně než poloviny tloušťky myometria (M0 a M1) měly DFS 6,8 let ve srovnání s nádory přesahující polovinu tloušťky myometria (M2), kde byl DFS jen 5,0 let (graf 2). Podobně případy s negativní lymfoinvazí (N) měly DFS delší – 6,6 let – než případy s pozitivní lymfoinvazí (M) – 4,1 let (graf 3).
Graph 2. Délka přežití (DFS) v závislosti na hloubce invaze Log rank test prokázal signifikantní delší DFS u pacientek s hloubkou invaze M0, M1(6,8 roku) ve srovnání s pacientkami s hloubkou invaze M2 (5 let). Signifikance testu p = 0,001. 
Graph 3. Délka přežití (DFS) v závislosti na postižení lymfatických uzlin Log rank test prokázal signifikantní delší DFS u pacientek s lymfoinvazí N (6,6 roku) ve srovnání s pacientkami s lymfoinvazí M (4,1 roku). Signifikance testu p = 0,007. 
U zbývajících klinickopatologických parametrů (věk a FIGO stadium) a všech imunohistochemických parametrů (p53, bcl-2, c-erbB-2, Ki-67, ER a PR) nebyla prokázána signifikantní závislost mezi DFS a pozitivou jednotlivých parametrů.
Následujícím krokem bylo provedení Coxovy multivariační regresní analýzy k vyhledání nezávislých prediktorů majících vliv na délku DFS a riziko recidivy. Výsledkem Coxovy regrese je závěr, že významnými nezávislými faktory pro predikci délky DFS a rizika recidivy jsou pouze tumory s grade 3 a hloubka invaze M2 (nad polovinu tloušťky myometria). Nález G3 u pacientek tedy zvyšuje riziko recidivy 3,9krát (vzhledem k riziku v případě grade 1 a 2), RR = 3,96, 95% CI: 1,42–11,01. Hloubka invaze M2 zvyšuje riziko recidivy 5,4krát (vzhledem k riziku v případě hloubky invaze M0 a M1), RR = 5,36, 95%CI: 1,7–16,92 (tab. 2).
Table 2. Coxova regresní multivariační analýza 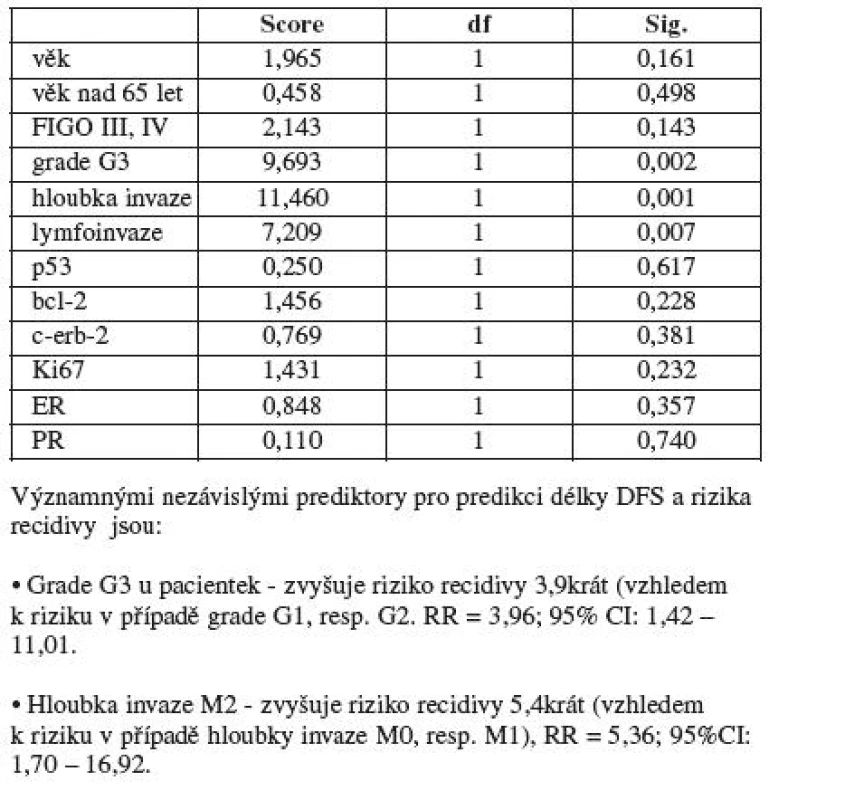
DISKUSE
Největší procento recidiv je zaznamenáno v prvních 2–3 letech po chirurgické léčbě. Ačkoliv se předpokládá, že časná detekce recidiv zlepšuje šance na jejich léčbu, je jejich léčba stále kontroverzní a její vliv na přežití pacientek nebyl jednoznačně prokázán [26, 29].
Špatná histologická diferenciace, hluboká myometriální invaze, nonendometroidní karcinomy, lymfovaskulární invaze a přítomnost extrauterinních metastáz byly v mnoha studiích popsány jako signifikantní tradiční histopatologické faktory predikující výskyt recidiv a vzdálených metastáz [20].
Podle výsledků několika studií z 90. let je také možné tyto faktory rozdělit na skupinu uterinních faktorů (histologický typ, histologický grade, hloubka myometriální invaze, přítomnost atypické endometriální hyperplazie, vaskulární invaze, šíření do cervixu a DNA ploidita) a skupinu extrauterinních faktorů (pozitivní peritoneální cytologie, šíření do adnex, pozitivní nález v pelvických a paraaortálních lymfatických uzlinách a peritoneální metastázy) [23]. Nicméně zásadním faktorem ovlivňujícím prognózu karcinomu endometria je jeho TNM a FIGO staging. Rozdělení stadií a podstadií komplexně zahrnující hloubku invaze do myometria, postižení děložního hrdla a extrauterinní šíření nádoru podle FIGO klasifikace je obecně známé. Pětileté přežití pro stadium I je 90 %, pro stadium II 83 %, pro stadium III 43 %. Univariační analýzou lze dále rozlišit pětileté přežití pro stadium IA přibližně 93,8 %, pro stadium IB 95,4 % a pro stadium IC 75 % [19]. U karcinomů s nízkým stadiem je možné myometriální invazi považovat za nezávislý prognostický faktor [23, 39].
Problémem může asi ve 25 % být chybná pozitivní diagnóza ve smyslu „naddiagnostikování“ při negativní myoinvazi, ale na druhé straně „poddiagnostikování“ patologem při existenci skutečné myoinvaze je velmi vzácné. Pětileté přežití u nádorů bez invaze je 94 %, při invazi do poloviny tloušťky myometria je 91 % a při invazi nad polovinu 59 % [39]. Podobně je vyjádřeno riziko recidivy u nádorů bez myometriální invaze, které je asi jen 1 %, při invazi do poloviny tloušťky myometria 7,7 % a při invazi nad polovinu asi 15 % [23]. S horší prognózou je spojena lokalizace tumoru v dolním děložním segmentu a istmu dělohy i velikost tumoru nad 2 cm, které ve stagingu zahrnuty nejsou. Zásadní význam myoinvaze pro prognózu žen s karcinomem endometria potvrzují i naše výsledky.
Rovněž důležitým prognostickým faktorem je histologický typ nádoru a grading. S horší prognózou jsou spojeny zejména serózně-papilární typ karcinomu, clear cell karcinom a nediferencovaný karcinom, uváděn bývá i adenoskvamózní karcinom (ne však adenoakantom). Pětileté přežití u těchto nádorů se pohybuje pouze od 30 do 70 %. Zatímco nonendometroidní karcinomy jsou považovány za vysoce rizikové samy o sobě a grading se pro ně nepoužívá, u endometroidních karcinomů je stupeň diferenciace pro prognózu pacientek velmi důležitý. Většina endometroidních karcinomů je podle architektonických a nukleárních znaků řazena do skupiny grade 1, které mají nejlepší prognózu – pětileté přežití v této skupině je asi 94 %. Pětileté přežití u pacientek s tumory grade 2 je 84 % a u tumorů grade 3 pouze 72 % [38]. Navíc se zdá, že G1/G2 tumory se od tumorů G3 liší i v jiných parametrech. G3 tumory se častěji vyskytují u starších žen, nebývá zde souvislost s endometriální hyperplazií, mívají hlubší myometriální invazi a celkově se dá říci, že mají histologicky daleko blíže k serózně papilárnímu a clear cell karcinomu než k endometroidnímu karcinomu [11, 12]. Horší prognóza pacientek s nádory histopatologicky špatně diferencovanými potvrzená naší studií odpovídá literárním údajům.
Negativními faktory jsou dále extrauterinní šíření nádoru, s horší prognózou je spojen rovněž vyšší věk pacientek a parita. Věk nad 60 let pozitivně koreluje se špatně diferencovanými nádory [30]. Nulipary mají vyšší riziko výskytu endometriálního karcinomu než ženy, které rodily. Studie Salvesenové et al. poukazuje na 5leté přežití 57 % u nulipar ve srovnání s 5letým přežitím 81 % u pacientek s jedním nebo více porody [32]. Nejistý prognostický význam má samotná cytologická pozitivita laváže peritoneální dutiny. Nebylo zároveň potvrzeno zhoršení prognózy (možnou diseminací nádorových buněk transtubárně do peritoneální dutiny) hysteroskopií provedenou běžným způsobem a za nízkého tlaku distenčního média. Naopak za prognosticky příznivý faktor je považována výrazná lymfoplazmocytární infiltrace tumoru a jeho okolí [2].
Prognózu dále zásadně ovlivňuje postižení lymfatických uzlin – pánevních a paraaortálních – jejich počet a velikost metastáz (stadium FIGO IIIC). Téměř 33 % pacientek s pozitivitou pelvických uzlin má zároveň pozitivní i paraaortální uzliny, přičemž prognóza pacientek s pozitivními pánevními uzlinami se zdá být lepší než u pacientek s uzlinovou pozitivitou obou lokalit. Pětileté přežití pacientek s pozitivitou aortálních uzlin je zhruba 36 % ve srovnání s 5letým přežitím 85 % u pacientek s negativními aortálními uzlinami, ačkoli všechny patří do stadia FIGO IIIC [23]. Rovněž v naší studii měly ženy s postižením lymfatických uzlin horší naději na přežití.
Ačkoli u endometriálního karcinomu dosud nebyl nalezen žádný specifický sérový tumor marker, nedávné studie naznačují negativní prognostický dopad overexprese c-erbB-2 onkogenu, pozitivním naopak pozitivita estrogenových a zejména progesteronových receptorů [5, 11, 18, 20].
Nadějné výsledky z poslední doby byly zaznamenány ze studií, kdy např. Santin et al. studoval účinky trastuzumabu in vivo u dvou pacientek s progresivním nebo recidivujícím endometriálním karcinomem vykazujícím nadměrnou expresi receptoru HER2/neu. Klinická odpověď na trastuzumab, který působil buď samostatně, nebo v kombinaci s chemoterapií, byla potvrzena u obou pacientek – bylo docíleno zmírnění symptomů a prodloužení života bez závažných toxických účinků tohoto léčivého přípravku [35].
Četné studie dokládají schopnost nezávisle predikovat recidivy např. u markerů p53 nebo c-erbB-2 [8, 27]. Mariani et al. prokázali, že marker p53 může fungovat jako nezávislý prediktor vzdálených metastáz a recidiv nezávisle na dalších faktorech [20]. Průkaz zvýšené exprese c-erbB-2 jako nezávislého prognostického faktoru, který koreluje s horším přežitím, podal Morrison et al., podobně také Gates et al. prokázal, že černošská rasa, vysoký stupeň exprese c-erbB-2, pokročilé stadium a nedostatek ER a PR jsou spojeny s výrazně nižší šancí na přežití [7, 22]. Na druhé straně v dalších studiích nebyla prokázána signifikantní korelace s přežitím u markerů bcl-2 a Ki-67 [5, 25].
V každém případě výsledky četných studií se v hodnocení korelací exprese různých imunohistochemických faktorů s jejich dopadem na přežití pacientek liší. V naší studii nebyla prokázána signifikantní závislost mezi délkou přežívání a pozitivitou jednotlivých sledovaných imunohistochemických parametrů.
ZÁVĚR
Pro efektivní léčbu malignit je nezbytná časná a přesná diagnóza s možností optimalizace terapie a minimalizace nežádoucích účinků. Časná diagnóza nádorového onemocnění spolu s individuální terapií „na míru“ mohou snížit úmrtnost a zlepšit perspektivu a kvalitu života pacienta. Gynekologické zhoubné nádory představují skupinu chorob, u kterých je prognóza závislá na subtilních genomických, epigenetických a proteomických změnách. Užití molekulárně biologických technik, včetně analýzy metylací a acetylací a technik proteomických, se stává důležitým nástrojem nejen v základním výzkumu, ale i v rozhodování o vhodné terapii.
Cílem naší práce bylo imunohistochemické stanovení exprese molekulárně biologických markerů a vyhodnocení analýzy přežití pacientek léčených pro karcinom endometria. Význam různých imunohistochemických parametrů pro prognózu pacientek s karcinomem endometria dosud nebyl jednoznačně stanoven. Snahou je použitím informací získaných ze změn exprese nádorových biomarkerů přispět ke snížení radikality chirurgické a radiační terapie. Cílem do budoucna by mělo být další rozdělení podtypů endometriálního karcinomu v závislosti na jejich genetických alteracích, a to zejména těch, které mají prognostický význam. Je pravděpodobné, že budoucí histologické klasifikace budou více spočívat na molekulární bázi. Z výsledků naší práce vyplývá, že kromě klinickopatologických faktorů mohou molekulárně biologické prognostické faktory přispět k lepší charakteristice nádorů, a přispět tak k přesnějšímu stanovení jejich klinického chování. Pro případné praktické diagnosticko-terapeutické využití molekulárně biologických faktorů bude potřeba dalších zpřesňujících studií.
Tato studie byla podpořena grantem IGA MZ ČR NR 9098-4/2006.
MUDr. Ivana Marková
Ústav genetiky a fetální medicíny
FN a LF UP
I. P. Pavlova 6
775 00 Olomouc
Sources
1. World cancer research fund: American Institute for Cancer Research: Food, Nutrition and the Prevention of Cancer: A global Perspective. Washington, DC, 1997.
2. Ascher, SM., Reinhold, C. Imaging of cancer of the endometrium. Radiol Clin North Am, 2002, 40, p. 563-576.
3. Canavan, TP., Doshi, NR. Endometrial cancer. Am Fam Physician, 1999, 59, p. 3069-3077.
4. Erdem, O., Erdem, M., Dursun, A., et al. Angiogenesis, p53, and bcl-2 expression as prognostic indicators in endometrial cancer: comparison with traditional clinicopathologic variables. Int J Gynecol Pathol, 2003, 22, p. 254-260.
5. Ferrandina, G., Ranelletti, FO., Gallotta, V., et al. Expression of cyclooxygenase-2 (COX-2), receptors for estrogen (ER), and progesterone (PR), p53, ki67, and neu protein in endometrial cancer. Gynecol Oncol, 2005, 98. p. 383-389.
6. Fitzgibbons, PL., Page, DL., Weaver, D., et al. Prognostic factors in breast cancer. College of American Pathologists Consensus Statement 1999. Arch Pathol Lab Med, 2000, 124, p. 966-978.
7. Gates, EJ., Hirschfield, L., Matthews, RP., et al. Body mass index as a prognostic factor in endometrioid adenocarcinoma of the endometrium. J Natl Med Assoc, 2006, 98, p. 1814-1822.
8. Geisler, JP., Geisler, HE., Wiemann, MC., et al. p53 expression as a prognostic indicator of 5-year survival in endometrial cancer. Gynecol Oncol, 1999, 74. p. 468-4671.
9. Geisler, JP., Wiemann, MC., Zhou, Z., et al. p53 as a prognostic indicator in endometrial cancer. Gynecol Oncol, 1996, 61, p. 245-248.
10. Goodman, MT., Wilkens, LR., Hankin, JH., et al. Association of soy and fiber consumption with the risk of endometrial cancer. Am J Epidemiol, 1997, 146, p. 294-306.
11. Halperin, R., Zehavi, S., Habler, L., et al. Comparative immunohistochemical study of endometrioid and serous papillary carcinoma of endometrium. Eur J Gynaecol Oncol, 2001, 22, p. 122-126.
12. Inoue, M. Current molecular aspects of the carcinogenesis of the uterine endometrium. Int J Gynecol Cancer, 2001, 11, p. 339-348.
13. Jalava, P., Kuopio, T., Huovinen, R., et al. Immunohistochemical staining of estrogen and progesterone receptors: aspects for evaluating positivity and defining the cutpoints. Anticancer Res, 2005, 25, p. 2535-2542.
14. Kadar, N., Malfetano, JH. , Homesley, HD. Steroid receptor concentrations in endometrial carcinoma: effect on survival in surgically staged patients, Gynecol Oncol, 1993, 50, p. 281-286.
15. Kodama, S., Kase, H., Tanaka, K., et al. Multivariate analysis of prognostic factors in patients with endometrial cancer. Int J Gynaecol Obstet, 1996, 53, p. 23-30.
16. Lax, SF., Pizer, ES., Ronnett, BM., et al. Clear cell carcinoma of the endometrium is characterized by a distinctive profile of p53, Ki-67, estrogen, and progesterone receptor expression. Hum Pathol, 1998, 29, p. 551-558.
17. Lu, KH., Broaddus, RR. Gynecologic cancers in Lynch syndrome/HNPCC. Fam Cancer, 2005, 4, p. 249-254.
18. Lukes, AS., Kohler, MF., Pieper, CF., et al. Multivariable analysis of DNA ploidy, p53, and HER-2/neu as prognostic factors in endometrial cancer. Cancer, 1994, 73, p. 2380-2385.
19. Maneschi, M., Maneschi, F., Geraci, P., et al. Surgical pathological staging of endometrial carcinoma and results of treatment. Eur J Gynaecol Oncol, 1992, 13, p. 30-35.
20. Mariani, A., Sebo, TJ., Webb, MJ., et al. Molecular and histopathologic predictors of distant failure in endometrial cancer. Cancer Detect Prev, 2003, 27, p. 434-441.
21. Morris, PC., Anderson, JR., Anderson, B., et al. Steroid hormone receptor content and lymph node status in endometrial cancer. Gynecol Oncol, 1995, 56, p. 406-411.
22. Morrison, C., Zanagnolo, V., Ramirez, N., et al. HER-2 is an independent prognostic factor in endometrial cancer: association with outcome in a large cohort of surgically staged patients. J Clin Oncol, 2006, 24, p. 2376-2385.
23. Morrow, CP., Bundy, BN., Kurman, RJ., et al. Relationship between surgical-pathological risk factors and outcome in clinical stage I and II carcinoma of the endometrium: a Gynecologic Oncology Group study. Gynecol Oncol, 1991, 40, p. 55-65.
24. Ogawa, Y., Moriya, T., Kato, Y., et al. Immunohistochemical assessment for estrogen receptor and progesterone receptor status in breast cancer: analysis for a cut-off point as the predictor for endocrine therapy. Breast Cancer, 2004, 11, p. 267-275.
25. Ohkouchi, T., Sakuragi, N., Watari, H., et al. Prognostic significance of bcl-2, p53 overexpression, and lymph node metastasis in surgically staged endometrial carcinoma. Am J Obstet Gynecol, 2002, 187, p. 353-359.
26. Owen, P., Duncan, ID. Is there any value in the long term follow up of women treated for endometrial cancer? Br J Obstet Gynaecol, 1996, 103, p. 710-713.
27. Pijnenborg, JM., van de Broek, L., Dam de Veen, GC., et al. TP53 overexpression in recurrent endometrial carcinoma. Gynecol Oncol, 2006, 100, p. 397-404.
28. Pisani, AL., Barbuto, DA., Chen, D., et al. HER-2/neu, p53, and DNA analyses as prognosticators for survival in endometrial carcinoma. Obstet Gynecol, 1995, 85, p. 729-734.
29. Podczaski, E., Kaminski, P., Gurski, K., et al. Detection and patterns of treatment failure in 300 consecutive cases of “early” endometrial cancer after primary surgery. Gynecol Oncol, 1992, 47, p. 323-327.
30. Rose, PG. Endometrial carcinoma. N Engl J Med, 1996, 335, p. 640-649.
31. Sakuragi, N., Ohkouchi, T., Hareyama, H., et al. Bcl-2 expression and prognosis of patients with endometrial carcinoma. Int J Cancer, 1998, 79, p. 153-158.
32. Salvesen, HB., Akslen, LA., Albrektsen, G., et al. Poorer survival of nulliparous women with endometrial carcinoma. Cancer, 1998, 82, p. 1328-1333.
33. Salvesen, HB., Iversen, OE., Akslen, LA. Identification of high-risk patients by assessment of nuclear Ki-67 expression in a prospective study of endometrial carcinomas. Clin Cancer Res, 1998, 4, p. 2779-2785.
34. Salvesen, HB., Iversen, OE., Akslen, LA. Prognostic significance of angiogenesis and Ki-67, p53, and p21 expression: a population-based endometrial carcinoma study. J Clin Oncol, 1999, 17, p. 1382-1390.
35. Santin, AD., Bellone, S., Roman, JJ., et al. Trastuzumab treatment in patients with advanced or recurrent endometrial carcinoma overexpressing HER2/neu, Int J Gynaecol Obstet, 2008, 102, p. 128-131.
36. ÚZIS, Novotvary ČR, 2005.
37. Yamauchi, N., Sakamoto, A., Uozaki, H., et al. Immunohistochemical analysis of endometrial adenocarcinoma for bcl-2 and p53 in relation to expression of sex steroid receptor and proliferative activity. Int J Gynecol Pathol, 1996, 15, p. 202‑208.
38. Zaino, RJ., Kurman, R., Herbold, D., et al. The significance of squamous differentiation in endometrial carcinoma. Data from a Gynecologic Oncology Group study. Cancer, 1991, 68, p. 2293‑2302.
39. Zaino, RJ., Kurman, RJ., Diana, KL., et al. Pathologic models to predict outcome for women with endometrial adenocarcinoma: the importance of the distinction between surgical stage and clinical stage – a Gynecologic Oncology Group study. Cancer, 1996, 77, p. 1115-1121.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2010 Issue 3-
All articles in this issue
- Porovnání exprese imunohistochemických markerů ve vzorcích z hysteroskopie a hysterektomie u pacientek s karcinomem endometria
- Sexuální morbidita po chirurgické léčbě zhoubných gynekologických nádorů
- Technika radioterapie s modulovanou intenzitou záření v léčbě gynekologických malignit
- Rezistence/senzitivita in vitro u pacientek s karcinomem ovaria
- Některé charakteristiky žadatelek o umělé ukončení těhotenství
- Prognostický význam klinickopatologických a vybraných imunohistochemických faktorů u karcinomu endometria
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- G bod – mýty a realita
- Německý gynekolog a porodník Christian Gerhard Leopold (1846-1911)
- Incidence vrozených srdečních vad v České republice – aktuální data
- Průběh a výsledky 34 těhotenství komplikovaných syndromem HELLP
- Burkittův lymfom v těhotenství – kazuistika
- Detekce placentárně specifických mikroRNA v mateřské cirkulaci
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- G bod – mýty a realita
- Incidence vrozených srdečních vad v České republice – aktuální data
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

