-
Medical journals
- Career
Technika radioterapie s modulovanou intenzitou záření v léčbě gynekologických malignit
Authors: I. Sirák; L. Kašaová; J. Petera; M. Vošmik; Z. Zoul
Authors‘ workplace: Klinika onkologie a radioterapie, Fakultní nemocnice Hradec Králové, vedoucí pracoviště prof. MUDr. J. Petera, Ph. D.
Published in: Ceska Gynekol 2010; 75(3): 177-181
Overview
Cíl studie:
Popis techniky radioterapie s modulovanou intenzitou záření (IMRT) a možností jejího využití v léčbě zhoubných gynekologických nádorů.Typ studie:
Přehledový článek.Název a sídlo pracoviště:
Klinika onkologie a radioterapie, Fakultní nemocnice Hradec Králové.Metodika:
Obecné vysvětlení principu, výhod a nevýhod techniky IMRT a přehledné shrnutí publikovaných literárních údajů o jejím využití v léčbě karcinomu endometria, děložního hrdla a vulvy.Závěr:
IMRT je dobře dostupnou a vysoce konformní technikou zevní radioterapie, která přináší možnost významného šetření zdravých tkání, a tím i snížení nežádoucích účinků léčby zářením oproti předchozím konvenčním a konformním technikám. Další výhodou IMRT je možnost eskalace léčebné dávky záření při zachování nízké toxicity. Její uplatnění lze nalézt v terapii nejčastějších gynekologických nádorů, zejména karcinomu endometria, hrdla dělohy a vulvy.Klíčová slova:
IMRT, radioterapie s modulovanou intenzitou záření, karcinom endometria, karcinom hrdla dělohy, karcinom vulvy.ÚVOD
Chirurgická léčba je stále nejdůležitější léčebnou modalitou v terapii zhoubných onemocnění ženských reprodukčních orgánů, v mnoha případech však vykazuje lepší výsledky až v kombinaci s radioterapií. V případě pokročilých karcinomů děložního hrdla a vulvy pak účinnost radioterapie, popřípadě v kombinaci s chemoterapií, předčí léčbu chirurgickou. V uplynulém desetiletí zaznamenala radioterapie výrazných změn jak po stránce technického vývoje a vybavenosti onkologických pracovišť, tak i po stránce klinického výzkumu díky studiím prokazujícím přínos nových technologií v zlepšení léčebných výsledků. Cílem tohoto přehledového článku je popsat techniku radioterapie s modulovanou intenzitou záření (intensity modulated radiation therapy; IMRT) a aktualizované možnosti jejího využití v léčbě gynekologických malignit.
TECHNIKY ZEVNÍ RADIOTERAPIE
Konvenční radioterapie
Ještě koncem 20. století byla na většině pracovišť v České republice standardem radioterapie pánve u gynekologických malignit, tak zvaná „konvenční radioterapie“. Plánování konvenční radioterapie vycházelo především z anatomicko-topografických znalostí uložení ženských reprodukčních orgánů vzhledem ke kostěným strukturám pánve. Například při adjuvantním ozařování pánve u pacientek po hysterektomii pro karcinom endometria si lékař plánující radioterapii zvolil oblast pro ozařování pomocí předozadního rtg snímku pánve následujícím způsobem: kraniální hranice ozařovaného pole v oblasti přechodu obratlů L4/L5, kaudální hranice ozařovaného pole na dolním okraji sedacích hrbolů, zevní hranice pole oboustranně 1–2 cm od vnitřních okrajů pánve v diameter transverza. Výsledné pole pak mělo tvar obdélníku nebo čtverce a spojením dvou takovýchto protilehlých polí (předozadního AP a zadopředního PA) pak vznikl ozařovaný objem ve tvaru kvádru, uvnitř kterého se nacházely struktury plánované k ozařování; tj. zevní, vnitřní a společné ilické uzliny, presakrální uzliny, parametria a proximální úsek poševního pahýlu. Vzhledem k uniformní intenzitě svazků záření však byly stejnou dávkou jako rizikové struktury ozářeny i ostatní tkáně, které se v ozařovaném objemu nacházely; zejména pak tenké střevo, rektum, močový měchýř a pánevní kosti s objemnou zásobou kostní dřeně. Nemalou dávku záření absorbovaly také struktury kůže a podkožní pojivové tkáně v místě vstupu svazku záření. Určitého omezení dávky na kůži a v podkoží šlo dosáhnout přidáním dvou bočních polí (pravého a levého), jejichž hranice byly opět stanoveny na základě bočního rtg snímku pánve; tj. ventrální hranice pole uprostřed kosti stydké a dorzální okraj pole do vyhloubení kosti křížové v místě přechodu obratlů S2 a S3. Takto vzniklý ozařovaný objem pak měl tvar pravidelného osmiúhelníku (krychle nebo kvádru), na základě kterého se této technice začalo říkat „BOX technika“ (obr. 1). K výraznému šetření ostatních zdravých tkání však touto technikou nedocházelo, neboť ty byly uloženy uvnitř ozařovaného objemu jako v krabici (pozn. box = anglicky krabice).
Image 1. Radioterapie pánve konvenční BOX technikou 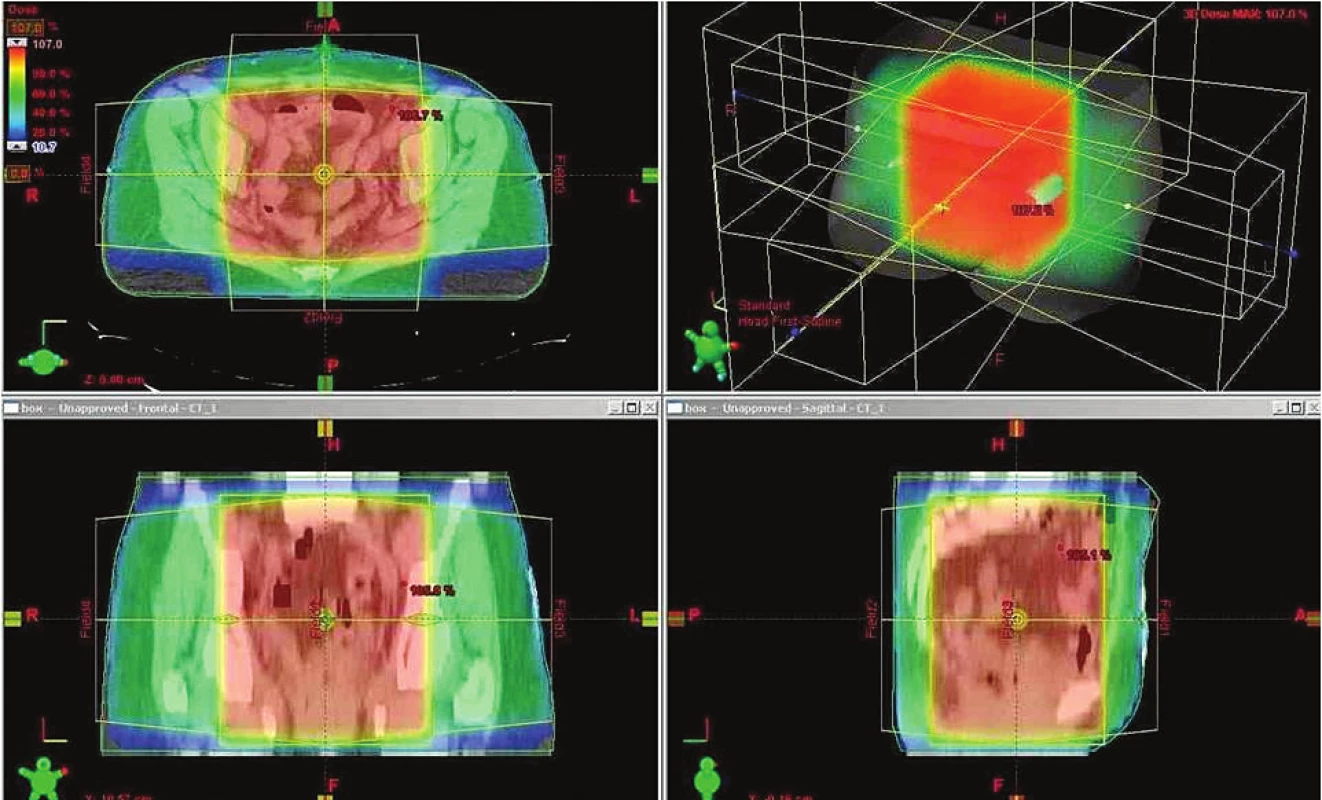
Konformní radioterapie
Na přelomu tisíciletí se začala v Čechách rozmáhat nová technika ozařování, takzvaná „3D-konformní radioterapie“ (3D-Conformal Radiation Therapy; 3D CRT). Hlavní výhodou této techniky je plánování radioterapie pomocí výpočetní tomografie (computed tomography; CT), kde lze v jednotlivých transverzálních CT řezech definovat na jedné straně cílové objemy určené k radioterapii, na druhé straně zdravé tkáně, kterým se chceme při ozařování co možná nejvíce vyhnout. Technika 3D-CRT dále využívá automatických vícelistových kolimátorů (multi-leaf collimator; MLC) k přesnému (konformnímu) tvarování ozařovaných polí na základě tvaru cílových objemů (obr. 2). Takto vzniklá ozařovaná pole pak již nemají podobu čtverců či obdélníků, ale odpovídají svým tvarem anatomickým reliéfům rizikových objemů určených k radioterapii. Tvar pole vytvořený prostřednictvím MLC je během samotné aplikace radioterapie stacionární, tj. neměnný v čase. Tímto individuálním tvarováním svazků lze dosáhnout snížení dávky záření na zdravé tkáně především v oblasti konvexit (tj. „na povrchu“) cílového objemu (obr. 3). V oblasti konkavit (tj. „uvnitř“) cílového objemu však tato technika žádanou redukci dávek nepřináší.
Image 2. Lamely vícelistového kolimátoru 
Image 3. Radioterapie pánve 3D-konformní BOX technikou 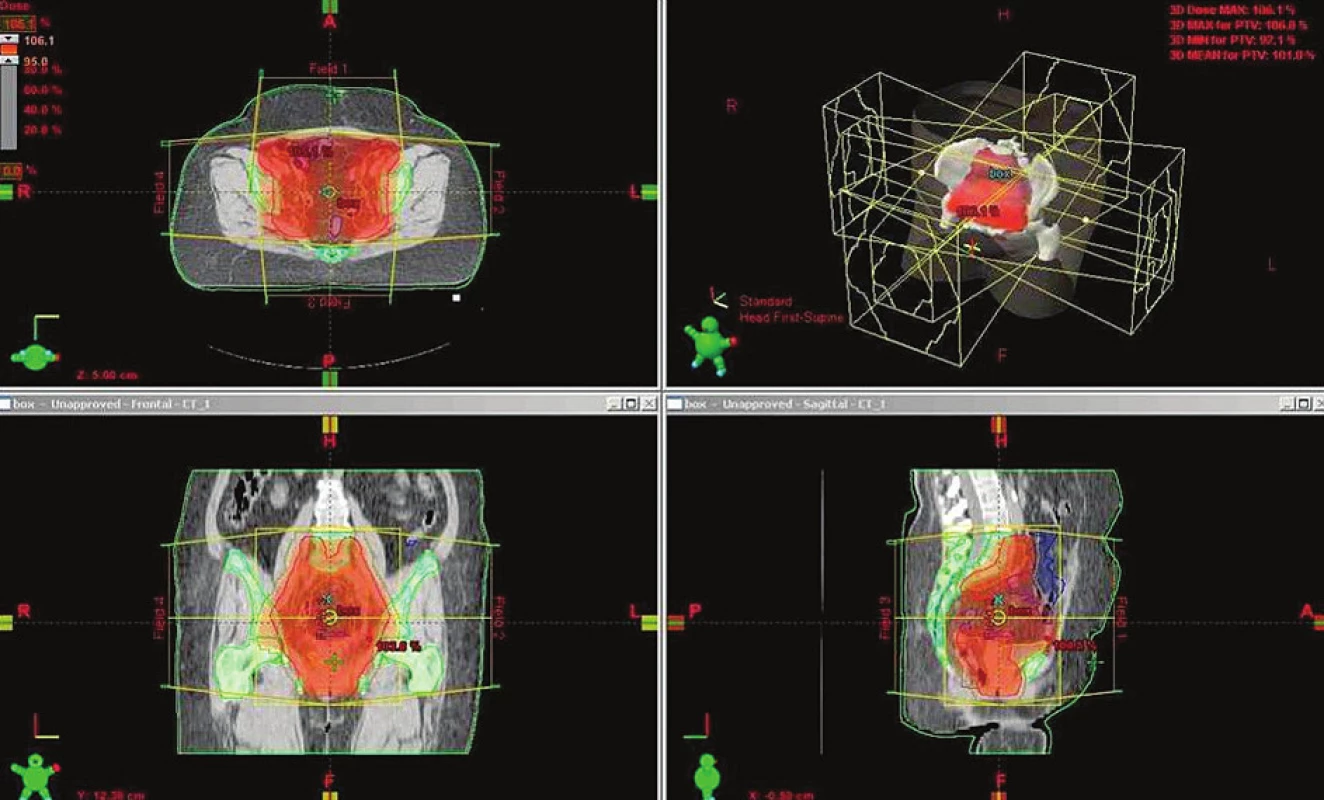
Radioterapie s modulovanou intenzitou záření
Moderní technika radioterapie s modulovanou intenzitou záření (IMRT) byla rozvíjena od roku 1982 díky publikaci Karolínského institutu ve Stockholmu [7]. Při zrodu této techniky byla potřeba dosáhnout optimální dávkové distribuce kolem cílových objemů konkávního tvaru v rizikových oblastech (např. u paraspinálních lézí, nádorů nosohltanu, paranazálních dutin, karcinomu prostaty aj.).
Základním předpokladem pro IMRT je plánování radioterapie pomocí transverzálních CT řezů s přesným zakreslením cílových a rizikových struktur obdobně jako u 3D-CRT. První výhodou IMRT oproti 3D-CRT je však možnost tzv. „inverzního plánování“, při kterém lékař ještě před kalkulací rozložení dávky zadá do optimalizačního systému dávkové limity pro jednotlivé zakreslené struktury. Při kalkulaci dávkového rozložení jednotlivých polí tak systém předem ví, že musí cílové struktury radioterapie pokrýt minimálně 95 % předepsané dávky, a současně že např. dávkou vyšší než 40 Gy nesmí být ozářeno více než 10 % objemu zakresleného tenkého střeva, nebo že maximální dávka na míchu v jakémkoliv jejím místě nesmí přesáhnout 45 Gy. Plánovací systém si pak rozdělí ozařované pole na miniaturní subjednotky (pixely) a do jednotlivých pixelů určí rozdílnou intenzitu záření tak, aby to vyhovovalo předem zadaným kritériím. Jednotlivá ozařovaná pole (většinou 5-9 polí) tím získají svou „fluenci“, čili rozložení intenzity dávky popřípadě i dávkového příkonu v jednotlivých pixelech v čase. Fluence polí je na pacienta během samotné radioterapie přenesena prostřednictvím již zmíněného vícelistového kolimátoru, jehož lamely se během aplikace každého svazku záření dynamicky mění v čase. Díky zmíněným výhodám a cílenému rozložení dávky dosahuje IMRT oproti 3D-CRT vysoké konformity i v oblastech konkavit, čili „uvnitř“ cílového objemu (obr. 4).
Image 4. Radioterapie pánve technikou IMRT 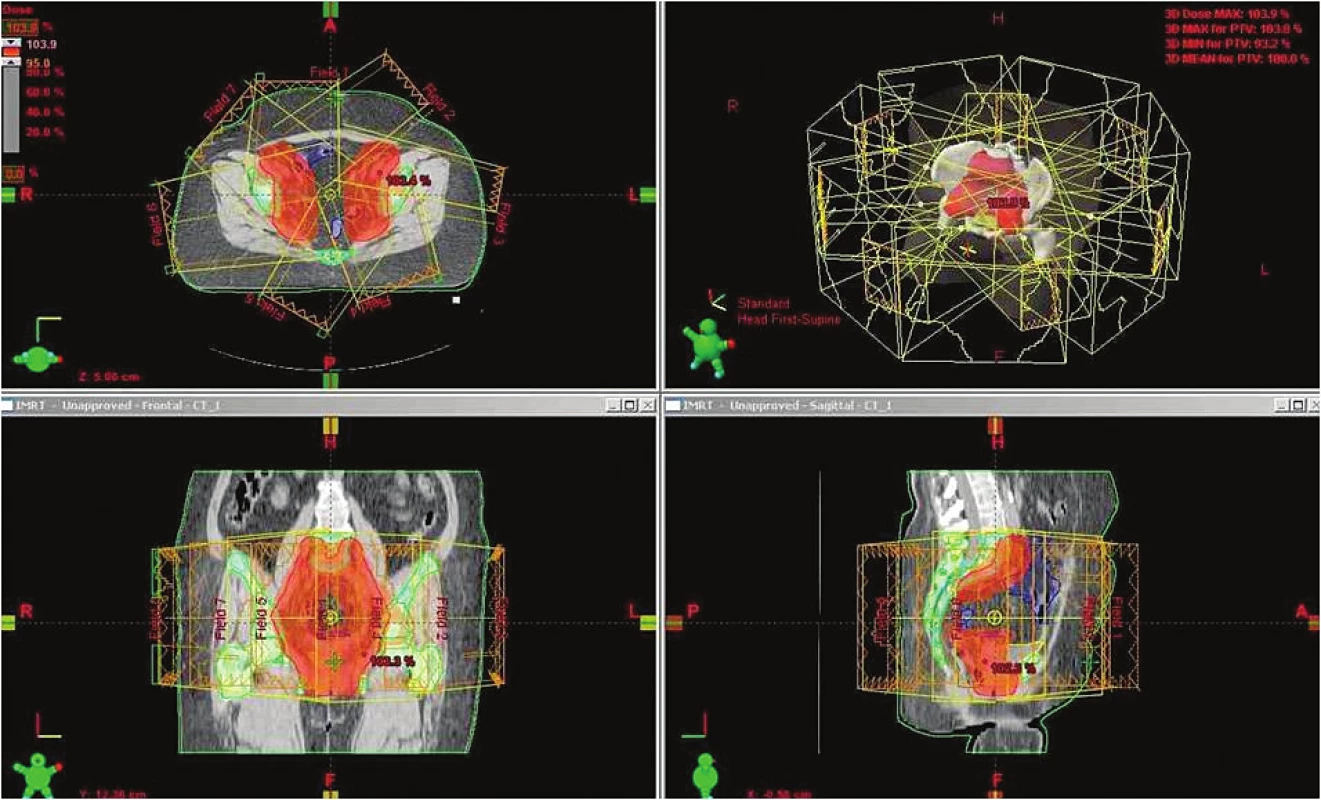
Technikou IMRT tak lze dosáhnout jednak redukce dávek záření na zdravé tkáně při zachování vysokých dávek na cílové struktury; má ale také potenciál v případné eskalaci dávky záření na cílové oblasti, při zachování nízkých dávek na zdravé tkáně. Výhodou IMRT oproti konvenční a konformní radioterapii je tedy vyšší terapeutický index, tj. nižší toxicita léčby při současně aplikované stejné dávce záření, nebo stejná toxicita léčby při současně aplikované vyšší dávce záření.
Nevýhodou IMRT je zejména nutnost přesného a snadno reprodukovatelného nastavení pacienta před aplikací každé frakce radioterapie kvůli vysoce cílenému rozložení dávky v prostoru a prudkému spádu dávkového gradientu v periferii cílového objemu. Další nevýhodou IMRT je technická a časová náročnost plánování léčby, kdy příprava ozařovacího plánu zabere zkušenému lékaři 1-2 hodiny práce (oproti asi 15-30 minutám plánování konformní terapie). I samotná aplikace každé frakce záření pak trvá asi dvojnásobně déle, tj. asi 20 minut. Aplikace IMRT navíc vyžaduje větší závislost na počítačem řízených pohybech, a přináší tudíž i vyšší riziko poruch a chyb [17]. Radiobiologické nevýhody prolongované aplikace záření a zvýšené riziko indukce sekundárních malignit jsou, zdá se, faktory zanedbatelné, nicméně nesmíme na ně zapomínat zejména u mladých pacientek [11].
IMRT U GYNEKOLOGICKÝCH MALIGNIT
Karcinom endometria
Adjuvantní radioterapie pánve u karcinomu endometria je doposud nejčastější indikací ozáření u gynekologických nádorů. Standardem radioterapie na většině pracovišť u nás i ve světě je 3D-konformní radioterapie; konkrétně nejrozšířenější BOX technika čtyř polí individuálně tvarovaných MLC. Tato léčba je vzhledem k pozměněné anatomii pánve po radikálním chirurgickém zákroku často doprovázena významnou gastrointestinální toxicitou.
První dozimetrická studie srovnávající IMRT a 3D--CRT v adjuvantní radioterapii karcinomu endometria pochází z roku 2000 [18]. Tato studie naznačila možnost redukce průměrné dávky na střevo o 50 % a na rektum o 25 % při použití techniky IMRT. Obdobné výsledky přinesla i další dozimetrická studie, která ukázala, že pomocí IMRT můžeme snížit objem zdravých tkání ozářených dávkou nad 30 Gy průměrně o 52 % u tenkého střeva, až o 66 % u konečníku, a o 36 % u močového měchýře [12]. Při cíleném šetření kostní dřeně lze navíc technikou IMRT významně redukovat objem ozářené kostní dřeně ve vyšších dávkách, což by mohlo vést ke snížení hematologické toxicity radioterapie u rizikových pacientek [13]. Míra šetření střeva a rizikových orgánů u IMRT však inverzně koreluje s body mass indexem (BMI), proto je nutné použití této techniky pečlivě zvažovat zejména u obézních pacientek [1]. Dozimetrická měření však naznačují pouze teoretické výhody nových technik radioterapie, naměřená data musí být následně ověřena také studiemi klinickými.
První klinická studie hodnotící přínos IMRT v adjuvantní terapii karcinomu endometria pochází z roku 2002. Tato práce prokázala významnou (p = 0,02) redukci akutní gastrointestinální toxicity (zejména 2. stupně) při použití IMRT oproti konformní terapii; současně prokázala signifikantně nižší spotřebu antidiaroik v průběhu radioterapie [14]. Ve stejném roce jiní autoři zaznamenali, že IMRT doprovází také hraničně významně nižší akutní hematologická toxicita (p = 0,08) zejména ve smyslu 2. stupně leukopenií [8]. Delší sledování pacientek po IMRT pak prokázalo signifikantní redukci také chronické gastrointestinální toxicity (11 % vs. 50 %, p = 0,001), nicméně medián sledování těchto pacientek činil pouze 30 měsíců, což je pro hodnocení pozdní toxicity zatím příliš krátká doba [15]. Nízkou pozdní toxicitu při současné excelentní kontrole onemocnění zaznamenala i nejaktuálnější studie z roku 2006 [6].
Z právě probíhajících studií budou zajímavé zejména výsledky studie RTOG 0418, která zkoumá účinnost a toxicitu adjuvantní IMRT u high-risk karcinomu endometria společně s chemoterapií nebo bez ní.
Karcinom děložního hrdla
S radioterapií pánve u karcinomu děložního hrdla se setkáme buďto v indikaci adjuvantní, kdy po radikální gynekologické operaci zaznamená histopatolog přítomnost rizikových faktorů zvyšujících pravděpodobnost pánevního relapsu onemocnění; nebo v indikaci radikální, kdy je operační zákrok již technicky nemožný nebo rizikový. V adjuvantním podání je terapeutická i anatomická situace téměř totožná s adjuvantní radioterapií karcinomu endometria, čili lze zde implementovat výsledky výše zmíněných studií. Jediným rozdílem u karcinomu hrdla dělohy je časté používání konkomitantní chemoterapie společně s radioterapií, což může způsobit vyšší frekvenci nežádoucích účinků. Klinickou studií však již i zde byla prokázána lepší tolerance adjuvantní chemoradioterapie pomocí IMRT se signifikantně nižší akutní gastrointestinální a genitourinární toxicitou oproti chemoradioterapii konformní [9].
Radikální (chemo)radioterapie již oproti adjuvantní radioterapii přináší zcela nové pojetí léčby, kdy hlavním terapeutickým záměrem je definitivní zničení nádorových buněk v místě primárního tumoru, pánevních, nebo paraaortálních lymfatických uzlinách, což vyžaduje aplikaci vyšších dávek záření, a je tudíž obvykle spojeno s vyšší toxicitou léčby. Ozařování paraaortální lymfadenopatie pak sebou přináší také vyšší dávky záření i mimo pánev, a tedy i vyšší riziko postižení zejména tenkého střeva. První dozimetrická studie srovnávající dávky při radikálním ozařování karcinomu děložního hrdla včetně paraaortálních uzlin prokázala, že pomocí IMRT lze dosáhnout statisticky významné redukce dávky na střeva (p < 0,05), rektum (p < 0,001) i močový měchýř (p < 0,05), oproti konvenčním AP/PA a BOX technikám [16]. Podle dozimetrických výpočtů lze pomocí IMRT dosáhnout také eskalace dávky na oblast paraaortální lymfadenopatie až do 60 Gy s významnou redukcí dávky na míchu a kostní dřeň oproti konvenčním technikám [2]. Podobné výpočty platí také pro radioterapii pánve samotné, kdy lze pomocí IMRT při zachování tolerančních dávek na rizikové orgány eskalovat zevní příspěvek dávky na nádor do 54 Gy [10].
V klinických studiích byla zkoumána zejména reálná míra tolerance eskalace dávky na oblast postižení paraaortálních uzlin. Salma et al. popsali v roce 2006 dobrou toleranci radikální radioterapie s ozařováním celé oblasti paraaortálních uzlin do konvenční dávky 45 Gy s následným navýšením dávky do 54 Gy na oblast lymfadenopatie. Celkem bylo takto léčeno 13 pacientek (8 pacientek s pokročilým karcinomem endometria, 5 pacientek s karcinomem hrdla dělohy): u jedné se vyskytl 4. stupeň a u další 3. stupeň akutní hematologické toxicity; jednou byl zaznamenán 3. stupeň akutní gastrointestinální toxicity, ostatní akutní nežádoucí účinky byly mírné, čili 1. a 2. stupně; jedna pacientka musela podstoupit resekci části tenkého střeva pro pozdní postiradiační obstrukci [19]. Podobně dobrou toleranci eskalované dávky na paraaortální lymfadenopatii u karcinomu děložního hrdla publikovali o rok později Beriwal et al, kteří po konvenčních 45 Gy na oblast paraaortálních uzlin eskalovali dávku do 55–60 Gy na uzliny postižené podle vstupního PET/CT. Celkem takto léčili 36 pacientek: jednou se objevil 3. stupeň akutní gastrointestinální toxicity; jednou 3. stupeň akutní genitourinární toxicity; celkem desetkrát 3. stupeň akutní hematologické toxicity; zatímco 4. stupeň akutní toxicity zaznamenán nebyl; stejně tak nebyly popsány závažnější pozdní nežádoucí účinky [3].
Karcinom vulvy
Publikované údaje o využití IMRT v terapii karcinomu vulvy jsou prozatím sporé. Pocházejí převážně ze zkušeností onkologického centra Univerzity v Pittsbourghu. První srovnání IMRT a konvenční radioterapie karcinomu vulvy pochází z roku 2006. Tato studie srovnávala IMRT s technikou dvou protilehlých polí (AP/PA) s dvěma přímými elektronovými poli na oblast ingvinálních uzlin u 15 pacientek: sedmi předoperačních a osmi pooperačních. Medián sledování pacientek po radioterapii byl v této studii 12 měsíců. Podle dozimetrického srovnání ozařovacích plánů se technikou IMRT dosáhlo redukce objemu tkání ozářených dávkou vyšší než 30 Gy o 27 % u tenkého střeva (p = 0,03), o 41 % u rekta (p = 0,01) a o 26 % u močového měchýře (p = 0,004) [5]. O dva roky později publikovali stejní autoři své klinické zkušenosti s předoperační hyperfrakcionovanou chemoradioterapií technikou IMRT u 18 pacientek stadia II-IVA. Medián doby sledování činil 22 měsíců. Radikální operační řešení bylo plánováno s odstupem 6–8 týdnů po ukončení chemoradioterapie. Z 18 pacientek jich 9 dosáhlo patologické kompletní remise, u žádné z těchto žen navíc nebyla zaznamenána rekurence onemocnění; 5 pacientek mělo patologickou parciální odpověď, 3 z nich s následnou rekurencí; celkem 4 pacientky nebyly v závěru operovány: 1 zemřela týden po chemoradioterapii na infarkt myokardu a dvě ze tří zbývajících neoperovaných žen měly následnou recidivu onemocnění. V celé skupině nebyl zaznamenán žádný 3. stupeň akutní toxicity [4]. Autoři podle svých zkušeností konstatují, že technika IMRT by měla představovat moderní standard radioterapie karcinomu vulvy.
PRACOVIŠTĚ DISPONUJÍCÍ TECHNIKOU IMRT V ČESKÉ REPUBLICE
Prvním pracovištěm v České republice, kde byla zavedena technika IMRT, je Klinika onkologie a radioterapie Fakultní nemocnice v Hradci Králové v roce 1992. V roce 2010 budou touto technikou disponovat již všechna česká komplexní onkologická centra. Přiložený obrázek znázorňuje mapu a seznam pracovišť provádějících techniku IMRT v České republice v roce 2010 (obr. 5).
Image 5. Mapa a seznam pracovišť v ČR disponujících IMRT v roce 2010 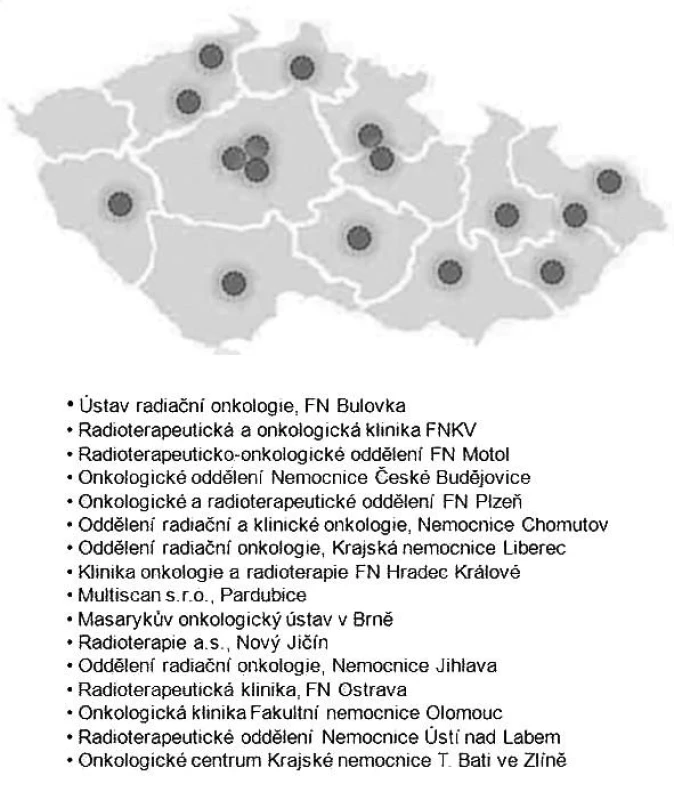
ZÁVĚR
IMRT je dobře dostupnou a vysoce konformní technikou zevní radioterapie, která přináší možnost významného šetření zdravých tkání, a tím i snížení nežádoucích účinků léčby zářením oproti konvenčním a konformním technikám. Další výhodou IMRT je možnost eskalace léčebné dávky záření při zachování nízké toxicity. Její uplatnění lze nalézt v terapii gynekologických nádorů, zejména karcinomu endometria, hrdla dělohy a vulvy.
Práce byla podpořena výzkumným projektem 00179906 Ministerstva zdravotnictví České republiky.
MUDr. Igor Sirák, Ph.D.
Klinika onkologie a radioterapie FN
Sokolská 581
500 05 Hradec Králové
Sources
1. Ahamad, A., D’Souza, W., Salehpour, M., et al. Intensity-modulated radiation therapy after hysterectomy: comparison with conventional treatment and sensitivity of the normal-tissue-sparing effect to margin size. Int J Radiat Oncol Biol Phys, 2005, 62(4), p. 1117-1124.
2. Ahmed, RS., Kim, RY., Duan, J., et al. IMRT dose escalation for positive para-aortic lymph nodes in patients with locally advanced cervical cancer while reducing dose to bone marrow and other organs at risk. Int J Radiat Oncol Biol Phys, 2004, 60(2), p. 505-512.
3. Beriwal, S., Gan, GN., Heron, DE., et al. Early clinical outcome with concurrent chemotherapy and extended-field, intensity-modulated radiotherapy for cervical cancer. Int J Radiat Oncol Biol Phys, 2007, 68(1), p. 166-171.
4. Beriwal, S., Coon, D., Heron, DE., et al. Preoperative intensity-modulated radiotherapy and chemotherapy for locally advanced vulvar carcinoma. Gynecol Oncol, 2008, 109(2), p. 291-295.
5. Beriwal, S., Heron, DE., Kim, H., et al. Intensity-modulated radiotherapy for the treatment of vulvar carcinoma: a comparative dosimetric study with early clinical outcome. Int J Radiat Oncol Biol Phys, 2006, 64(5), p. 1395-1400.
6. Beriwal, S., Jain, SK., Heron, DE., et al. Clinical outcome with adjuvant treatment of endometrial carcinoma using intensity-modulated radiation therapy. Gynecol Oncol, 2006, 102(2), p. 195-199.
7. Brahme, A., Roos, JE., Lax, I. Solution of an integral equation encountered in rotation therapy. Phys Med Biol, 1982, 27(10), p. 1221-1229.
8. Brixey, CJ., Roeske, JC., Lujan, AE., et al. Impact of intensity--modulated radiotherapy on acute hematologic toxicity in women with gynecologic malignancies. Int J Radiat Oncol Biol Phys, 2002, 54(5), p. 1388-1396.
9. Chen, MF., Tseng, CJ., Tseng, CC., et al. Clinical outcome in posthysterectomy cervical cancer patients treated with concurrent Cisplatin and intensity-modulated pelvic radiotherapy: comparison with conventional radiotherapy. Int J Radiat Oncol Biol Phys, 2007, 67(5), p. 1438-1444.
10. D’Souza, WD., Ahamad, AA., Iyer, RB., et al. Feasibility of dose escalation using intensity-modulated radiotherapy in posthysterectomy cervical carcinoma. Int J Radiat Oncol Biol Phys, 2005, 61(4), p. 1062-1070.
11. Hall, EJ. Intensity-modulated radiation therapy, protons, and the risk of second cancers. Int J Radiat Oncol Biol Phys, 2006, 65(1), p. 1-7.
12. Heron, DE., Gerszten, K., Selvaraj, RN., et al. Conventional 3D conformal versus intensity-modulated radiotherapy for the adjuvant treatment of gynecologic malignancies: a comparative dosimetric study of dose-volume histograms small star, filled. Gynecol Oncol, 2003, 91(1), p. 39-45.
13. Lujan, AE., Mundt, AJ., Yamada, SD., et al. Intensity-modulated radiotherapy as a means of reducing dose to bone marrow in gynecologic patients receiving whole pelvic radiotherapy. Int J Radiat Oncol Biol Phys, 2003, 57(2), p. 516-521.
14. Mundt, AJ., Lujan, AE., Rotmensch, J., et al. Intensity-modulated whole pelvic radiotherapy in women with gynecologic malignancies. Int J Radiat Oncol Biol Phys, 2002, 52(5), p. 1330-1337.
15. Mundt, AJ., Mell, LK., Roeske, JC. Preliminary analysis of chronic gastrointestinal toxicity in gynecology patients treated with intensity-modulated whole pelvic radiation therapy. Int J Radiat Oncol Biol Phys, 2003, 56(5), p. 1354-1360.
16. Portelance, L., Chao, KS., Grigsby, PW., et al. Intensity-modulated radiation therapy (IMRT) reduces small bowel, rectum, and bladder doses in patients with cervical cancer receiving pelvic and para-aortic irradiation. Int J Radiat Oncol Biol Phys, 2001, 51(1), p. 261-266.
17. Randall, ME., Ibbott, GS. Intensity-modulated radiation therapy for gynecologic cancers: pitfalls, hazards, and cautions to be considered. Semin Radiat Oncol, 2006, 16(3), p. 138-143.
18. Roeske, JC., Lujan, A., Rotmensch, J., et al. Intensity-modulated whole pelvic radiation therapy in patients with gynecologic malignancies. Int J Radiat Oncol Biol Phys, 2000, 48(5), p. 1613-1621.
19. Salama, JK., Mundt, AJ., Roeske, J., Mehta, N. Preliminary outcome and toxicity report of extended-field, intensity-modulated radiation therapy for gynecologic malignancies. Int J Radiat Oncol Biol Phys, 2006, 65(4), p. 1170-1176.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2010 Issue 3-
All articles in this issue
- Porovnání exprese imunohistochemických markerů ve vzorcích z hysteroskopie a hysterektomie u pacientek s karcinomem endometria
- Sexuální morbidita po chirurgické léčbě zhoubných gynekologických nádorů
- Technika radioterapie s modulovanou intenzitou záření v léčbě gynekologických malignit
- Rezistence/senzitivita in vitro u pacientek s karcinomem ovaria
- Některé charakteristiky žadatelek o umělé ukončení těhotenství
- Prognostický význam klinickopatologických a vybraných imunohistochemických faktorů u karcinomu endometria
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- G bod – mýty a realita
- Německý gynekolog a porodník Christian Gerhard Leopold (1846-1911)
- Incidence vrozených srdečních vad v České republice – aktuální data
- Průběh a výsledky 34 těhotenství komplikovaných syndromem HELLP
- Burkittův lymfom v těhotenství – kazuistika
- Detekce placentárně specifických mikroRNA v mateřské cirkulaci
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- G bod – mýty a realita
- Incidence vrozených srdečních vad v České republice – aktuální data
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

