-
Medical journals
- Career
Porovnání exprese imunohistochemických markerů ve vzorcích z hysteroskopie a hysterektomie u pacientek s karcinomem endometria
Authors: R. Pilka 1; I. Marková 2; M. Dušková 3; J. Zapletalová 4; M. Tozzi 1; Milan Kudela 1
Authors‘ workplace: Porodnicko-gynekologická klinika, FN a LF UP, Olomouc, přednosta doc. MUDr. R. Pilka, Ph. D. 1; Ústav genetiky a fetální medicíny, FN a LF UP, Olomouc, přednosta prof. MUDr. J. Šantavý, CSc. 2; Ústav patologické anatomie, FN a LF UP, Olomouc, přednosta doc. MUDr. M. Tichý, CSc. 3; Ústav lékařské biofyziky, pracoviště biometrie, LF UP, Olomouc, přednostka doc. RNDr. H. Kolářová, CSc. 4
Published in: Ceska Gynekol 2010; 75(3): 165-170
Overview
Cíl studie:
Zjistit pomocí imunohistochemického vyšetření expresi p53, bcl-2, c-erbB-2, Ki-67, estrogenového (ER) a progesteronového receptoru (PR), MMP-7, MMP-26 ve vzorcích z diagnostické hysteroskopie a následné hysterektomie u pacientek s karcinomem endometria.Typ studie:
Experimentální prospektivní studie.Název a sídlo pracoviště:
Porodnicko-gynekologická klinika, Ústav lékařské genetiky, Ústav patologie LF UP a FN Olomouc.Metodika:
Studovali jsme 43 případů primárně neléčeného karcinomu endometria, u nichž jsme vyhodnocovali grade a expresi imunomarkerů pomocí histoskóre v materiálu získaném z hysteroskopie a následné hysterektomie.Výsledky:
Do skupiny grading G1 bylo na základě hysteroskopie zařazeno 31 (72,1 %), do G2 to bylo 7 (16,3 %) a do G3 5 (11,6 %) pacientek. V grade 1 byla míra shody v 77,4 % případů, v grade 2 to bylo ve 14,3 % případů a v grade 3 byla míra shody v 80,0 % případů.
V materiálu z diagnostické hysteroskopie jsme zjistili u p53 expresi ve 23 případech (53,5 %), u bcl-2 v 37 (86,0 %), u c-erbB-2 ve 20 (46,5 %), u Ki-67 ve 29 (67,4 %), u ER ve 37 (86,0 %), u PR v 36 (83,7 %), u MMP-7 ve 25 (58,1 %) a u MMP-26 ve 23 případech (53,5 %).
Exprese jednotlivých imunomarkerů v materiálu z hysterektomie byla u p53 pozitivní ve 13 (30,2 %), u bcl-2 pozitivní v 33 (76,7 %), u c-erbB-2 pozitivní ve 24 (55,8 %), u Ki-67 pozitivní ve 25 (58,1 %), u ER pozitivní ve 36 (83,7 %), u PR pozitivní ve 40 (93,0 %), u MMP-7 pozitivní ve 27 (62,8 %) a u MMP-26 pozitivní ve 23 (53,5 %) z celkem 43 případů.Závěr:
Výsledky naší práce potvrzující shodu v expresi p53, bcl-2, PR a MMP-7 v materiálu z diagnostické hysteroskopie a následné hysterektomie u pacientek s karcinomem endometria, která by mohla být využita pro terapeutický algoritmus u karcinomu endometria.Klíčová slova:
karcinom endometria, imunohistochemie, prognostické faktory, hysteroskopie.ÚVOD
Endometriální karcinom je v současné době nejčastěji se vyskytujícím pánevním maligním onemocněním u žen [33]. Vzhledem k tomu, že až v 90 % případů je prvním příznakem děložní krvácení, je časná detekce tohoto onemocnění pomocí kyretáže nebo hysteroskopie s cílenou biopsií relativně snadná a jen malá část případů zůstává asymptomatických [3]. Ve skutečnosti je v 75 % diagnostikováno v klinickém stadiu I [18]. Karcinom endometria je velmi dobře léčitelným onemocněním s 83% 5letým přežitím. Nicméně počet pacientek, které ročně zemřou v důsledku tohoto onemocnění, je velmi vysoký a převyšuje počet úmrtí u onemocnění karcinomem děložního hrdla [1].
Chirurgický staging je podle doporučení Mezinárodní federace gynekologie a porodnictví (FIGO) nejdůležitějším momentem při stanovování prognózy pacientek [46]. Revidovaný systém FIGO stagingu rozlišuje tři stupně histologické diferenciace: dobře diferencovaný adenokarcinom (G1), obsahující méně než 5 % ne-skvamózní ne-morulární solidní složky; středně diferencovaný adenokarcinom (G2), u něhož solidní část může tvořit 6–50% podíl; špatně diferencovaný adenokarcinom (G3) s více než 50 % solidní složky. Stupeň histologické diferenciace je nepochybně známkou specifické agresivity nádoru a jako takový je všeobecně považován za klíčový prognostický faktor. Literární údaje srovnávající stupeň histologické diferenciace v materiálu získaném při hysteroskopii nebo kyretáži a následné hysterektomii svědčí o značné neshodě [5, 7, 31, 34, 37, 41].
Nejen z tohoto důvodu, ale i pro určitou omezenou vypovídací schopnost dalších klinicko-patologických faktorů z hlediska prognózy onemocnění byla studována celá řada molekulárně biologických markerů. Abnormální zvýšená exprese p53 tumor supresorového genu u karcinomu endometria koreluje s agresivními histologickými typy, pokročilým stadiem onemocnění a kratší dobou přežití [13, 21, 30]. Bcl-2 je onkogen, který inhibuje apoptózu a prodlužuje přežití buňky. Zvýšená exprese je popisována u hyperplazie endometria, kdežto ztráta exprese je spojována s horší prognózou, větší hloubkou myometriální invaze, pokročilejším stupněm onemocnění a vyšší pravděpodobností výskytu lymfatických metastáz [9, 30, 38, 47].
Amplifikace a zvýšená exprese onkogenu c-erbB-2 (lidský celulární onkogen identický s krysím HER 2/neu) se vyskytuje u 10–40 % karcinomů endometria a koreluje s horší prognózou a agresivnějším chováním nádoru [25]. Klinické využití tohoto faktoru zůstává zatím nejednoznačné, protože negativní prognostický dopad nebyl potvrzen ve všech studiích [36].
Mezi jeden z nejznámějších markerů buněčné proliferace patří Ki-67. Korelace s gradingem, stadiem onemocnění a histopatologickým typem tumoru byla potvrzena v mnoha studiích [10, 39, 40].
Jak v epiteliálních, tak ve stromálních buňkách endometria jsou přítomné estrogenové (ER) a progesteronové (PR) receptory. Zdá se, že exprese ER a PR hraje významnou roli v endometriální kancerogenezi. Podle výsledků řady studií je exprese těchto receptorů spojena s dobře diferencovanými tumory, koreluje se stadiem nádoru a přežitím [14, 16, 27].
Matrix metaloproteináza (MMP-7) byla imunolokalizována v nádorových buňkách 73 % případů endometriálního karcinomu a vyšší hladina její exprese byla spojena s pokročilejším stupněm onemocnění a přítomností metastáz v lymfatických uzlinách [44].
Vysoké hladiny matrix metaloproteinázy 26 (MMP 26) byly popsány v hyperplastickém endometriu, zatímco s histologickou dediferenciací její exprese v endometriálním karcinomu klesá. Podobně jako MMP-7 je i tento enzym omezen pouze na epiteliální a nádorové buňky endometria [35].
Endometriální nádory jsou snadno diagnostikovatelné pomocí hysteroskopie nebo kyretáže. Přesnější identifikace vysoce rizikových pacientek před primární radikální chirurgií by umožnila individualizaci léčby, zpřesnění plánování chirurgického zákroku, umožnila by převést rizikové pacientky do specializovaných center a potenciálně snížit morbiditu extenzivní lymfadenektomie u nízce rizikových pacientek.
Cílem studie bylo porovnat výsledky vyhodnocení grade a imunohistochemickou expresi p53, bcl-2, c-erbB-2, Ki-67, ER, PR, MMP-7 a MMP-26 ve vzorcích endometriálních tumorů získaných z hysteroskopie nebo kyretáže a následné hysterektomie u identických pacientek.
SOUBOR PACIENTEK A METODIKA
Charakteristika souboru
V období od srpna 2005 do března 2009 jsme na Porodnicko-gynekologické klinice FN Olomouc studovali 43 případů primárně neléčeného karcinomu endometria. U všech pacientek byla provedena diagnostická hysteroskopie (HSK) s následnou abdominální či vaginální hysterektomií (HY) a oboustrannou adnexektomií. Systematická pánevní lymfadenektomie byla provedena u 32 (74,4 %) pacientek. Průměrný věk pacientek byl 64,0 let (rozmezí 34-88). Pooperační staging byl proveden podle FIGO klasifikace (1988). Do stadia I dle FIGO klasifikace bylo zařazeno 34 (79,0 %) pacientek, do stadia II 3 (7,0 %) pacientky a do stadia III a IV 6 (14,0 %) pacientek. Histologickým typem nádoru byl ve všech případech endometriální karcinom.
Imunohistochemické zpracování
Zpracovaný materiál tvořily vždy dva vzorky od každé pacientky. Jednalo se o karcinomy endometria získané od pacientek z abdominální hysterektomie po potvrzení diagnózy z předchozí diagnostické hysteroskopie. Vzorky byly standardně rutinně zpracovány po 24hodinové fixaci 10% formaldehydem a zality do parafinových bloků s následným rutinním barvením hematoxylin-eosinem pro světelnou mikroskopii ke stanovení histopatologické diagnózy. Pro následnou sérii imunohistologických vyšetření byly vybrány vzorky s dostatečným množstvím dobře zachované nádorové struktury a zpracovány ve tkáňových řezech o síle 5 až 8 μm na sklíčkách potažených Vectabondem (Vector). Pro detekci jednotlivých markerů byla použita standardní nepřímá imunohistochemická technika se souborem králičích nebo myších protilátek (pro p53, c-erbB-2, Ki-67, ER a PR – DAKO, pro bcl-2 – BIOGENEX, pro MMP 7 a MMP-26 ABCAM).Vyšetření byla prováděna s pozitivní kontrolou.
Kvantifikace pozitivity byla vyjadřována v procentech. Jako hranice pozitivity p53, bcl-2, c-erbB-2, Ki-67, MMP-7 a MMP-26 byla stanovena hodnota mediánu. Jako p53 a bcl-2 pozitivní byly hodnoceny vzorky s jaderným barvením 20 % nádorových buněk a více, jako Ki-67 pozitivní s barvením 40 % a více. Vzorky s membránovou pozitivitou c-erbB-2 byly hodnoceny jako pozitivní v 10 % a více, hranice pozitivity MMP-7 byla stanovena na 65 % a více, MMP-26 40 % a více. Hranice pozitivity ER a PR byla na základě četných předchozích studií stanovena na 5 %.
Statistické vyhodnocení
K posouzení vztahu grade a imunohistochemických markerů ze vzorků z hysteroskopie a z hysterektomie byly použity χ2 test a Fisherův exaktní test. Hladina statistické významnosti byla stanovena pro p<0,05. Ke zpracování byl použit statistický program SPSS verze 15 (SPSS Inc., Chicago, USA).
VÝSLEDKY
Do skupiny grading (G) 1 bylo na základě hysteroskopie zařazeno 31 (72,1 %), do G2 7 (16,3 %) a do G3 5 (11,6 %) pacientek. Skupinu G1 na základě definitivního histopatologického vyšetření materiálu z hysterektomie tvořilo 29 (67,4 %), skupinu G2 2 (4,7 %) a skupinu G3 12 (27,9 %) pacientek resp. (tab. 1).
Table 1. Porovnání grade z hysteroskopie a hysterektomie 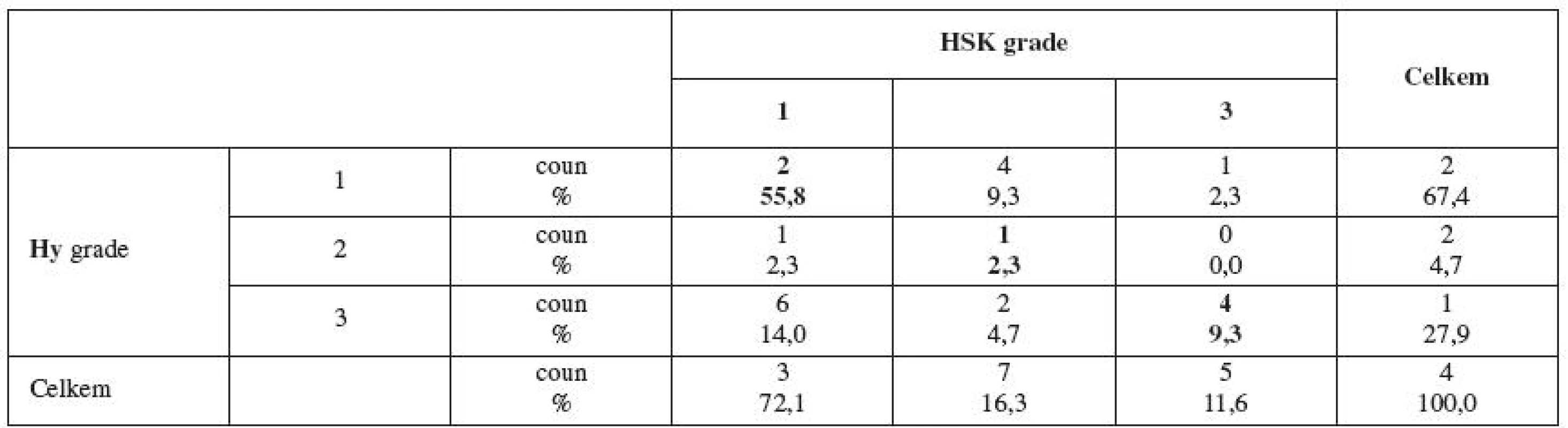
K podhodnocení grade došlo u 5 pacientek (11,6 %), u 4 pacientek byl z kyretáže stanoven grade 1 a po hysterektomii byl určen grade 2, u jedné pacientky s grade 1 byl po hysterektomii určen grade 3.
K nadhodnocení grade došlo u 9 pacientek (20,9 %), u jedné pacienky s grade 2 po kyretáži byl po hysterektomii stanoven grade 1, u 6 pacientek s grade 3 byl po hysterektomii stanoven grade 1 a u 2 pacientek grade 2.
V grade 1 byla míra shody v 77,4 % případů, v grade 2 to bylo ve 14,3 % případů a v grade 3 byla míra shody v 80,0 % případů (tab. 2).
Table 2. Míra shody hysteroskopie vs hysterektomie – grade 
Celková přesnost při stanovení grade z hysteroskopie byla 67,4 % (29 z 43), 95% CI: 51,5–80,9 %. (tj. 95% interval spolehlivosti pro přesnost).
V materiálu z diagnostické hysteroskopie jsme zjistili u p53 expresi ve 23 (53,5 %), u bcl-2 v 37 (86,0 %), u c-erbB-2 ve 20 (46,5 %), u Ki-67 ve 29 (67,4 %), u ER ve 37 (86,0 %), u PR v 36 (83,7 %), u MMP-7 ve 25 (58,1 %) a u MMP-26 ve 23 (53,5 %) případů.
Exprese jednotlivých imunomarkerů v materiálu z hysterektomie byla u p53 pozitivní ve 13 případech (30,2 %), u bcl-2 byla pozitivní v 33 (76,7 %), u c erbB 2 pozitivní ve 24 (55,8 %), u Ki-67 pozitivní ve 25 (58,1 %), u ER pozitivní ve 36 (83,7 %), u PR pozitivní ve 40 (93,0 %), u MMP-7 pozitivní ve 27 (62,8 %) a u MMP-26 pozitivní ve 23 (53,5 %) z celkem 43 případů.
Přehled shody výsledků vyšetření imunomarkerů p53, bcl-2, c-erbB-2, Ki-67, ER, PR, MMP-7 a MMP-26 v materiálu z hysteroskopie a hysterektomie je uveden v tabulkách 3, 4 a 5.
Table 3. Shoda u sledovaných markerů (hysteroskopie vs. hysterektomie) 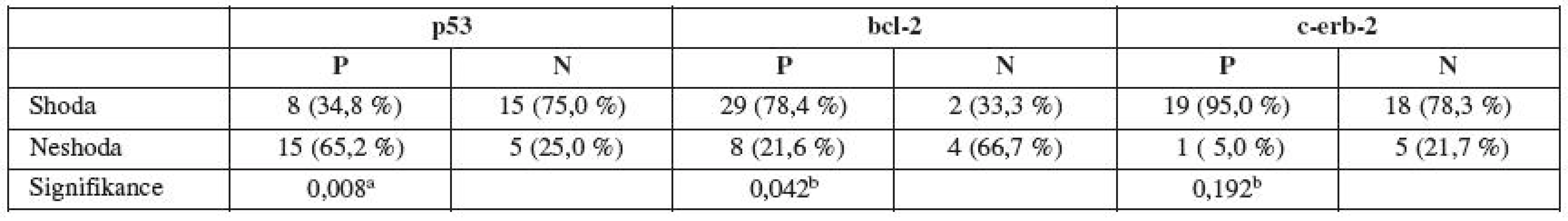
a ... χ2 test, b ... Fisherův exaktní test Table 4. Shoda sledovaných imunomarkerů (hysteroskopie vs. hysterektomie) 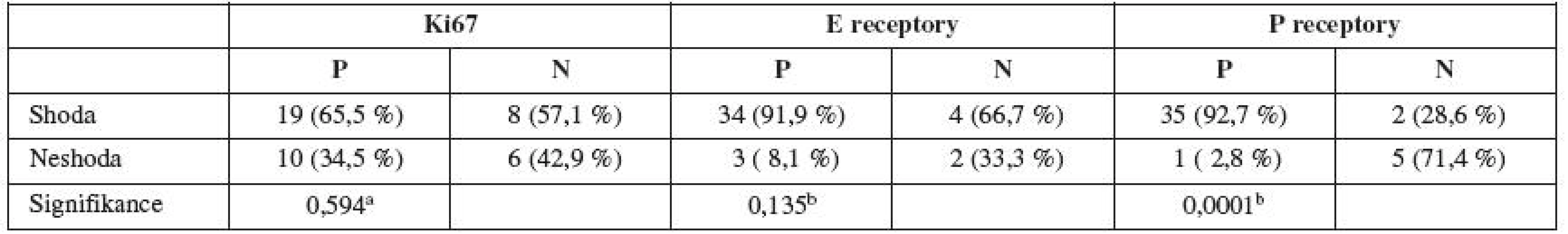
a ... χ2 test, b ... Fisherův exaktní test Table 5. Shoda sledovaných imunomarkerů 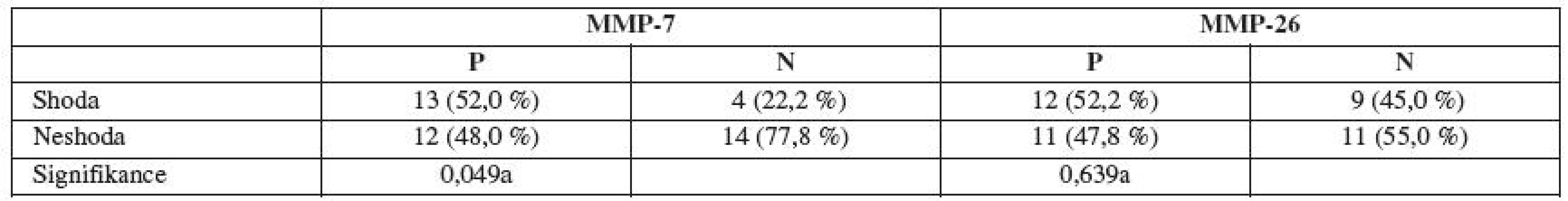
a ... χ2 test, b ... Fisherův exaktní test U p53 negativní skupiny byla zjištěna signifikantně vyšší míra shody (75,0 %) ve srovnání s p53 pozitivní skupinou (34,8 %), p = 0,008 (χ2 test).
Signifikantně vyšší míra shody byla prokázána u bcl 2 pozitivní skupiny (78,4 %) ve srovnání s bcl-2 negativní skupinou (33,3 %), p = 0,042.
Fisherův exaktní test prokázal signifikantně vyšší míru shody u skupiny s pozitivními P receptory (92,7 %) ve srovnání se skupinou s negativními PR (28,6 %), p = 0,0001.
U MMP-7 pozitivní skupiny (52 %) prokázal Fisherův exaktní test signifikantně vyšší míru shody ve srovnání s MMP-7 negativní skupinou (22,2 %), p = 0,049 (rozdíl je na hranici významnosti).
DISKUSE
Chirurgie zůstává stále základní metodou léčby endometriální karcinomu a obvykle sestává z hysterektomie a oboustranné adnexektomie. Sampling pánevních uzlin byl doporučen u žen s invazí přesahující 50 % tloušťky myometria, infiltrací cervikálního stromatu, mimoděložním šířením, nepříznivým histopatologickým typem (serózně papilární, karcinom z jasných buněk) a nízkou diferenciací tumoru [2, 4]. Vzhledem k tomu, že postižení lymfatických uzlin ve stadiu I endometriálního karcinomu je udáváno až v 11 %, doporučují někteří autoři provádět pánevní lymfadenektomii systematicky u všech pacientek, zejména s ohledem na zlepšení prognózování a individualizaci léčby [6, 12, 17, 24, 43]. Žádná ze studií však dosud neprokázala jednoznačný přínos lymfadenektomie, z hlediska přežití je tedy její benefit nejistý.
Předoperační identifikace vysoce rizikových pacientek s karcinomem endometria není v současné době optimální. Ačkoliv klinický staging koreluje velmi dobře s přežitím, je nepřesný z pohledu identifikace metastatického šíření až u jedné třetiny pacientek [22]. Věk pacientek, FIGO stadium, histologický typ a grade prokazatelně ovlivňují přežití, ale prognostický význam histologického typu nádoru, grade a postižení cervikálního stromatu získané na základě hysteroskopie nebo kyretáže je velmi omezený [2]. Špatně diferencované tumory jsou u hysteroskopií nebo kyretáží chybně diagnostikovány v 10 až 26 % a agresivní histologické typy nejsou rozpoznány v 36 až 54% případů [19, 20].
Identifikace spolehlivých markerů v materiálu z diagnostické operace, které by umožnily predikovat mimoděložní šíření onemocnění a prognózu, by výrazně usnadnilo terapeutické rozhodování.
Naše studie potvrdila diskrepance mezi grade nádoru endometria získaného z hysteroskopie a následné hysterektomie. Podobně jako v již publikovaných pracích jsme potvrdili vyšší shodu u grade 3 než u grade 1. Neprokázali jsme však postupně rostoucí trend shody od grade 1 ke grade 3, což je možné zřejmě vysvětlit malým počtem pacientek v grade 2. Celková přesnost hysteroskopie ve výši 67,4 % odpovídala z hlediska stanovení grade diagnostickou operací publikovaným údajům [26, 28, 34, 45]. Důvodů pro diskrepanci ve stanovení grade u diagnostické a definitivní operace může být několik. Mezi jinými může rozhodovat velikost vzorku, zkušenost chirurga, časování abnormního krvácení a výběr patologa.
Imunomarker p53 byl v našem materiálu z hysteroskopie exprimován ve 23 případech (53,5 %), což se blíží výsledku publikovanému Silvermanem et al., ale převyšuje výrazně výsledky dalších tří publikovaných studií [8, 23, 32, 42]. Silná korelace mezi expresí p53 v materiálu z diagnostického a terapeutického zákroku odpovídá údajům publikovaným v literatuře [8, 32].
Relativně vysoké hladiny exprese dosáhl v našem materiálu z hysteroskopie i antiapoptotický protein bcl-2, u kterého jsme současně zaznamenali i vysokou míru shody exprese s materiálem z hysterektomie. V literatuře provedli podobnou analýzu pouze Wang et al., kteří na menším souboru podobnou shodu nenalezli [45].
Pro onkogen c-erbB-2 jsme shodu exprese mezi hysteroskopií a hysterektomií nezjistili. V dostupné literatuře jsme podobné údaje nenalezli.
Velmi těsnou korelaci v expresi Ki-67 v diagnostickém a terapeutickém materiálu reportují Oreskovic et al. Je to v rozporu s našimi výsledky, kde stejně jako pro ER konkordanci nenalézáme. Naopak, velmi těsnou shodu v expresi PR potvrzují jak naše výsledky, tak výsledky Oreskovice et al. [32]. To je však v protikladu s údaji prezentovanými Wangem et al. [45].
Porovnání exprese matrix metaloproteináz MMP-7 a MMP-26 v materiálu z hysteroskopie a následné hysterektomie pro karcinom endometria dosud nebylo publikováno. Námi prokázaná shoda v expresi MMP-7 v tomto materiálu je tak prioritní.
ZÁVĚR
Výsledky naší práce potvrzující shodu v expresi p53, bcl-2, PR a MMP-7 v materiálu z diagnostické hysteroskopie a následné hysterektomie u pacientek s karcinomem endometria. Tato vysoká míra korelace naznačuje možnost klinického využití imunohistochemické analýzy materiálu z diagnostické operace u karcinomu endometria při rozhodování o dalším terapeutickém postupu. Dalším krokem by mělo být stanovení kritických hranic jednotlivých biomarkerů před jejich eventuálním zařazením do diagnosticko terapeutického algoritmu.
Tato studie byla podpořena grantem IGA MZ ČR NR 9098-4/2006.
Doc. MUDr. Radovan Pilka, Ph.D.
Gynekologicko-porodnická klinika
FN a LF UP
I. P. Pavlova 6
775 20 Olomouc
Sources
1. American Cancer Society, in Cancer facts and figures, 1995. Atlanta: American Cancer Society, 1995.
2. Amant, F., Moerman, P., Neven, P., et al. Endometrial cancer. Lancet, 2005, 366, p. 491–505.
3. Archer, DF., McIntyre-Seltman, K., Wilborn, WW. Jr., et al. Endometrial morphology in asymptomatic postmenopausal women. Am J Obstet Gynecol, 1991, 165. p. 317-20; discussion 320-322.
4. Barakat, R. Principles and practice of gynecologic oncology, 2nd ed. Philadelphia: Lippincott-Raven, 1997.
5. Cowles, TA., Magrina, JF., Masterson, BJ., et al. Comparison of clinical and surgical-staging in patients with endometrial carcinoma. Obstet Gynecol, 1985, 66, p. 413-416.
6. Creasman, WT., Morrow, CP., Bundy, BN., et al. Surgical pathologic spread patterns of endometrial cancer. A Gynecologic Oncology Group Study. Cancer, 1987, 60. p. 2035-2041.
7. Dzvincuk, P., Pilka, R., Kudela, M., et al. [Histological grade in management of carcinoma of endometrium]. Ces Gynek, 2005, 70, p. 201-205.
8. Engelsen, IB., Stefansson, I., Akslen, LA., et al. Pathologic expression of p53 or p16 in preoperative curettage specimens identifies high-risk endometrial carcinomas. Am J Obstet Gynecol, 2006, 195, p. 979-986.
9. Erdem, O., Erdem, M., Dursun, A., et al. Angiogenesis, p53, and bcl-2 expression as prognostic indicators in endometrial cancer: comparison with traditional clinicopathologic variables. Int J Gynecol Pathol, 2003, 22, p. 254-260.
10. Ferrandina, G., Ranelletti, FO., Gallotta, V., et al. Expression of cyclooxygenase-2 (COX-2), receptors for estrogen (ER), and progesterone (PR), p53, ki67, and neu protein in endometrial cancer. Gynecol Oncol, 2005, 98, p. 383-389.
11. Fitzgibbons, PL., Page, DL., Weaver, D., et al. Prognostic factors in breast cancer. College of American Pathologists Consensus Statement 1999. Arch Pathol Lab Med, 2000, 124, p. 966-978.
12. Frumovitz, M., Singh, DK., Meyer, L., et al. Predictors of final histology in patients with endometrial cancer. Gynecol Oncol, 2004, 95, p. 463-468.
13. Geisler, JP., Wiemann, MC., Zhou, Z., et al. p53 as a prognostic indicator in endometrial cancer. Gynecol Oncol, 1996, 61, p. 245-248.
14. Halperin, R., Zehavi, S., Habler, L., et al. Comparative immunohistochemical study of endometrioid and serous papillary carcinoma of endometrium. Eur J Gynaecol Oncol, 2001, 22, p. 122-126.
15. Jalava, P., Kuopio, T., Huovinen, R., et al. Immunohistochemical staining of estrogen and progesterone receptors: aspects for evaluating positivity and defining the cutpoints. Anticancer Res, 2005, 25, p. 2535-2542.
16. Kadar, N., Malfetano, JH., Homesley, HD. Steroid receptor concentrations in endometrial carcinoma: effect on survival in surgically staged patients. Gynecol Oncol, 1993, 50, p. 281-286.
17. Kirby, TO., Leath, CA. 3rd, Kilgore, LC. Surgical staging in endometrial cancer, Oncology (Williston Park). 2006, 20, p. 45-50; discussion p. 50, 53-54, 63.
18. Kudela, M., Pilka, R. Is there a real risk in patients with endometrial carcinoma undergoing diagnostic hysteroscopy (HSC)? Eur J Gynaecol Oncol, 2001, 22, p. 342-344.
19. Lampe, B., Kurzl, R., Hantschmann, P. Reliability of tumor typing of endometrial carcinoma in prehysterectomy curettage. Int J Gynecol Pathol, 1995, 14, p. 2-6.
20. Larson, DM., Johnson, KK., Broste, SK., et al. Comparison of D&C and office endometrial biopsy in predicting final histopathologic grade in endometrial cancer, Obstet Gynecol, 1995, 86, p. 38-42.
21. Lax, SF., Pizer, ES., Ronnett, BM., et al. Clear cell carcinoma of the endometrium is characterized by a distinctive profile of p53, Ki-67, estrogen, and progesterone receptor expression. Hum Pathol, 1998, 29, p. 551-558.
22. Mangioni, C., De Palo, G., Marubini, E., et al. Surgical pathologic staging in apparent stage I endometrial carcinoma. Int J Gynecol Cancer, 1993, 3, p. 373-384.
23. Mariani, A., Sebo, TJ., Katzmann, JA., et al. Pretreatment assessment of prognostic indicators in endometrial cancer. Am J Obstet Gynecol, 2000, 182, p. 1535-1544.
24. Mariani, A., Sebo, TJ., Katzmann, JA., et al. Endometrial cancer: can nodal status be predicted with curettage? Gynecol Oncol, 2005, 96, p. 594-600.
25. Mariani, A., Sebo, TJ., Webb, MJ., et al. Molecular and histopathologic predictors of distant failure in endometrial cancer. Cancer Detect Prev, 2003, 27, p. 434-441.
26. Mitchard, J., Hirschowitz, L. Concordance of FIGO grade of endometrial adenocarcinomas in biopsy and hysterectomy specimens. Histopathology, 2003, 42, p. 372-378.
27. Morris, PC., Anderson, JR., Anderson, B., et al. Steroid hormone receptor content and lymph node status in endometrial cancer. Gynecol Oncol, 1995, 56, p. 406-411.
28. Oakley, G., Nahhas, WA. Endometrial adenocarcinoma: therapeutic impact of preoperative histopathologic examination of endometrial tissue. Eur J Gynaecol Oncol, 1989, 10, p. 255-260.
29. Ogawa, Y., Moriya, T., Kato, Y., et al. Immunohistochemical assessment for estrogen receptor and progesterone receptor status in breast cancer: analysis for a cut-off point as the predictor for endocrine therapy. Breast Cancer, 2004, 11, p. 267-275.
30. Ohkouchi, T., Sakuragi, N., Watari, H., et al. Prognostic significance of Bcl-2, p53 overexpression, and lymph node metastasis in surgically staged endometrial carcinoma. Am J Obstet Gynecol, 2002, 187, p. 353-359.
31. Onnis, A., Marchetti, M., Maggino, T., et al. Clinical experience in gynecological cancer management. Endometrial cancer: report from the gynecological institutes of Padua university (1963-1989). Eur J Gynaecol Oncol, 1990, 11, p. 1-11.
32. Oreskovic, S., Babic, D., Kalafatic, D., et al. A significance of immunohistochemical determination of steroid receptors, cell proliferation factor Ki-67 and protein p53 in endometrial carcinoma. Gynecol Oncol, 2004, 93, p. 34-40.
33. Parkin, DM. Cancers of the breast, endometrium and ovary: geographic correlations. Eur J Cancer Clin Oncol, 1989, 25, p. 1917-1925.
34. Petersen, RW., Quinlivan, JA., Casper, GR., et al. Endometrial adenocarcinoma – presenting pathology is a poor guide to surgical management. Aust N Z J Obstet Gynaecol, 2000, 40, p. 191-194.
35. Pilka, R., Norata, GD., Domanski, H., et al. Matrix metalloproteinase-26 (matrilysin-2) expression is high in endometrial hyperplasia and decreases with loss of histological differentiation in endometrial cancer. Gynecol Oncol, 2004, 94, p. 661-670.
36. Pisani, AL., Barbuto, DA., Chen, D., et al. HER-2/neu, p53, and DNA analyses as prognosticators for survival in endometrial carcinoma. Obstet Gynecol, 1995, 85, p. 729-734.
37. Piver, MS., Lele, SB., Barlow, JJ., et al. Paraaortic lymph node evaluation in stage I endometrial carcinoma. Obstet Gynecol, 1982, 59, p. 97-100.
38. Sakuragi, N., Ohkouchi, T., Hareyama, H., et al. Bcl-2 expression and prognosis of patients with endometrial carcinoma. Int J Cancer, 1998, 79, p. 153-158.
39. Salvesen, HB., Iversen, OE., Akslen, LA. Identification of high-risk patients by assessment of nuclear Ki-67 expression in a prospective study of endometrial carcinomas. Clin Cancer Res, 1998, 4, p. 2779-2785.
40. Salvesen, HB., Iversen, OE., Akslen, LA. Prognostic significance of angiogenesis and Ki-67, p53, and p21 expression: a population-based endometrial carcinoma study. J Clin Oncol, 1999, 17, p. 1382-1390.
41. Sant Cassia, LJ., Weppelmann, B., Shingleton, H., et al. Management of early endometrial carcinoma. Gynecol Oncol, 1989, 35, p. 362-366.
42. Silverman, MB., Roche, PC., Kho, RM., et al. Molecular and cytokinetic pretreatment risk assessment in endometrial carcinoma. Gynecol Oncol, 2000, 77, p. 1-7.
43. Trimble, EL., Kosary, C. , Park, RC. Lymph node sampling and survival in endometrial cancer. Gynecol Oncol, 1998, 71, p. 340-343.
44. Ueno, H., Yamashita, K., Azumano, I., et al. Enhanced production and activation of matrix metalloproteinase-7 (matrilysin) in human endometrial carcinomas. Int J Cancer, 1999, 84, p. 470-477.
45. Wang, X., Huang, Z., Di, W., et al. Comparison of D&C and hysterectomy pathologic findings in endometrial cancer patients. Arch Gynecol Obstet, 2005, 272, p. 136-141.
46. Wolfson, AH., Sightler, SE., Markoe, AM., et al. The prognostic significance of surgical staging for carcinoma of the endometrium. Gynecol Oncol, 1992, 45, p. 142-146.
47. Yamauchi, N., Sakamoto, A., Uozaki, H., et al. Immunohistochemical analysis of endometrial adenocarcinoma for bcl-2 and p53 in relation to expression of sex steroid receptor and proliferative activity. Int J Gynecol Pathol, 1996, 15, p. 202-208.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2010 Issue 3-
All articles in this issue
- Porovnání exprese imunohistochemických markerů ve vzorcích z hysteroskopie a hysterektomie u pacientek s karcinomem endometria
- Sexuální morbidita po chirurgické léčbě zhoubných gynekologických nádorů
- Technika radioterapie s modulovanou intenzitou záření v léčbě gynekologických malignit
- Rezistence/senzitivita in vitro u pacientek s karcinomem ovaria
- Některé charakteristiky žadatelek o umělé ukončení těhotenství
- Prognostický význam klinickopatologických a vybraných imunohistochemických faktorů u karcinomu endometria
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- G bod – mýty a realita
- Německý gynekolog a porodník Christian Gerhard Leopold (1846-1911)
- Incidence vrozených srdečních vad v České republice – aktuální data
- Průběh a výsledky 34 těhotenství komplikovaných syndromem HELLP
- Burkittův lymfom v těhotenství – kazuistika
- Detekce placentárně specifických mikroRNA v mateřské cirkulaci
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- G bod – mýty a realita
- Incidence vrozených srdečních vad v České republice – aktuální data
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

