-
Medical journals
- Career
Detekce placentárně specifických mikroRNA v mateřské cirkulaci
Authors: I. Hromadníková 1; K. Kotlabová 1; J. E. Jirásek 3; J. Doucha 2
Authors‘ workplace: Oddělení molekulární biologie a patologie buňky, Gynekologicko-porodnická klinika 3. LF UK a FN KV, Praha, vedoucí pracoviště doc. MUDr. B. Svoboda, CSc. 1; Gynekologicko-prorodnická klinika, 2. LF UK a FN Motol, Praha, přednosta prof. MUDr. L. Rob, CSc. 2; Ústav péče o matku a dítě, Praha, ředitel doc. MUDr. J. Feyereisl, CSc. 3
Published in: Ceska Gynekol 2010; 75(3): 252-256
Overview
Cíl studie:
Zaměřili jsme se na detekci mikroRNA v mateřské cirkulaci v průběhu fyziologického těhotenství. Do studie jsme zahrnuli mikroRNA (miR-135b a miR-517a), jejichž přítomnost byla již dříve popsána v mateřské cirkulaci, mikroRNA (miR-518b, miR-517a) se zvýšenou expresí v placentách pacientek v době klinické manifestace preeklampsie a dále všechny mikroRNA, které byly dle databáze miRNAMap placentárně specifické (vykazovaly významnou expresi v placentě a nulovou nebo minimální expresi v ostatních tkáních).Typ studie:
Pilotní studie.Název a sídlo pracoviště:
Oddělení molekulární biologie a patologie buňky, Gynekologicko-porodnická klinika, 3. lékařská fakulta Univerzity Karlovy, Praha.Metodika:
Z 1 ml mateřské plazmy získané ve 12., 16. a 36. gestačním týdnu a 200 μl periferní krve zdravých žen bez známek těhotenství byla izolována RNA obohacená o frakci malých RNA (včetně mikroRNA). Následně byla příslušná mikroRNA přepsána do cDNA pomocí specifického stem-loop primeru a detekována pomocí PCR v reálném čase.Výsledky:
Ze souboru testovaných mikroRNA byly vyloučeny mikroRNA, které nebyly detekovány v mateřské cirkulaci v průběhu těhotenství (miR-136, miR-519a) a rovněž mikroRNA, které byly detekovány v periferní krvi zdravých žen bez známek těhotenství (miR-34c, miR-224, miR-512-5p, miR-515-5p, miR-516-5p, miR-518f*, miR-519d, miR-519e).Závěr:
Pro další sledování přítomnosti placentárně specifických mikroRNA v mateřské cirkulaci v průběhu gravidity a pro diferenciaci mezi fyziologickým a patologickým průběhem gravidity (preeklampsie, IUGR) ve stejném gestačním stáří bylo na základě těchto výsledků vybráno 6 mikroRNA (miR-517*, miR-518b, miR-520a*, miR-520h, miR-525, miR-526a).Klíčová slova:
mikroRNA, těhotenství, placenta, plazma, PCR v reálném čase.ÚVOD
MikroRNA (mikroRNA, miRNA) jsou krátké jednořetězcové molekuly, které patří do rodiny tzv. nekódujících ribonukleových kyselin, jejichž velikost se pohybuje v rozmezí 18 až 25 nukleotidů [13, 14]. Vznikají kaskádou dějů z primárního vlásenkového transkriptu (pri-miRNA) [5, 9, 16, 19, 24] a v cytoplazmě buněk se stávají součástí miRISC (microRNA-induced silencing comlex) komplexu [10], který se přes miRNA váže na 3’UTR (untranslated region) oblast cílové mRNA a ovlivňuje její další funkce v organismu [22]. Nedávné experimentální práce upozornily na významnou roli mikroRNA v posttranskripční regulaci exprese genů [7, 8, 11, 14]. Primárním úkolem mikroRNA v organismu je regulace genové exprese klíčových biologických dějů, nejčastěji inhibicí translace mRNA [8] s následným útlumem proteosyntézy, méně obvykle přímou degradací mRNA [10, 18, 20, 23]. Vliv mikroRNA byl prokázán v mnoha fyziologických a patologických procesech (např. buněčný vývoj, diferenciace, proliferace, apoptóza, mezibuněčná komunikace, karcinogeneze, rozvoj kardiovaskulárních onemocnění atd.) [2, 3, 12, 21].
V lidském organismu bylo doposud identifikováno přibližně 750 různých mikroRNA, přičemž tento počet není pravděpodobně konečný [13, 15, 17]. Každý typ mikroRNA reguluje genovou expresi desítek až stovek genů, přičemž se předpokládá, že mikroRNA se podílejí na mechanismu kontroly genové exprese zhruba jednou třetinou. Vzhledem k široké paletě dějů, které mikroRNA v organismu ovlivňují, je věnována velká pozornost výzkumu identifikace charakteristických profilů mikroRNA u jednotlivých onemocnění a jejich potenciální využití pro diagnosticko-prognostické a terapeutické účely. Za objev mechanismu RNA interference (indukce degradace mRNA transkriptů pomocí dvoušroubovicové krátké RNA molekuly) u C. elegans byla v roce 2006 udělena Nobelova cena za fyziologii a medicínu (Andrew Z. Fire; Craig C. Mello) [1, 6, 22].
Nedávno publikované pilotní studie [4] popsaly přítomnost některých mikroRNA v periferní krvi těhotných žen (miR-141, miR-149, miR-299-5p, miR-135b a miR-517a), které byly po porodu v mateřské cirkulaci nedetekovatelné.
V naší pilotní studii jsme se zaměřili na detekci mikroRNA v mateřské cirkulaci v průběhu fyziologického těhotenství. Do studie jsme zahrnuli některé mikroRNA (miR-135b a miR-517a), jejichž přítomnost byla již dříve popsána v mateřské cirkulaci [4], mikroRNA (miR-518b, miR-517a) se zvýšenou expresí v placentách pacientek v době klinické manifestace preeklampsie [25] a dále všechny mikroRNA, které podle databáze miRNAMap (http://mirnamap.mbc.nctu.edu.tw) byly placentárně specifické (vykazovaly významnou expresi v placentě a nulovou nebo minimální expresi v ostatních tkáních) (tab. 1).
Table 1. Charakteristika mikroRNA testovaných v mateřské cirkulaci u fyziologických gravidit 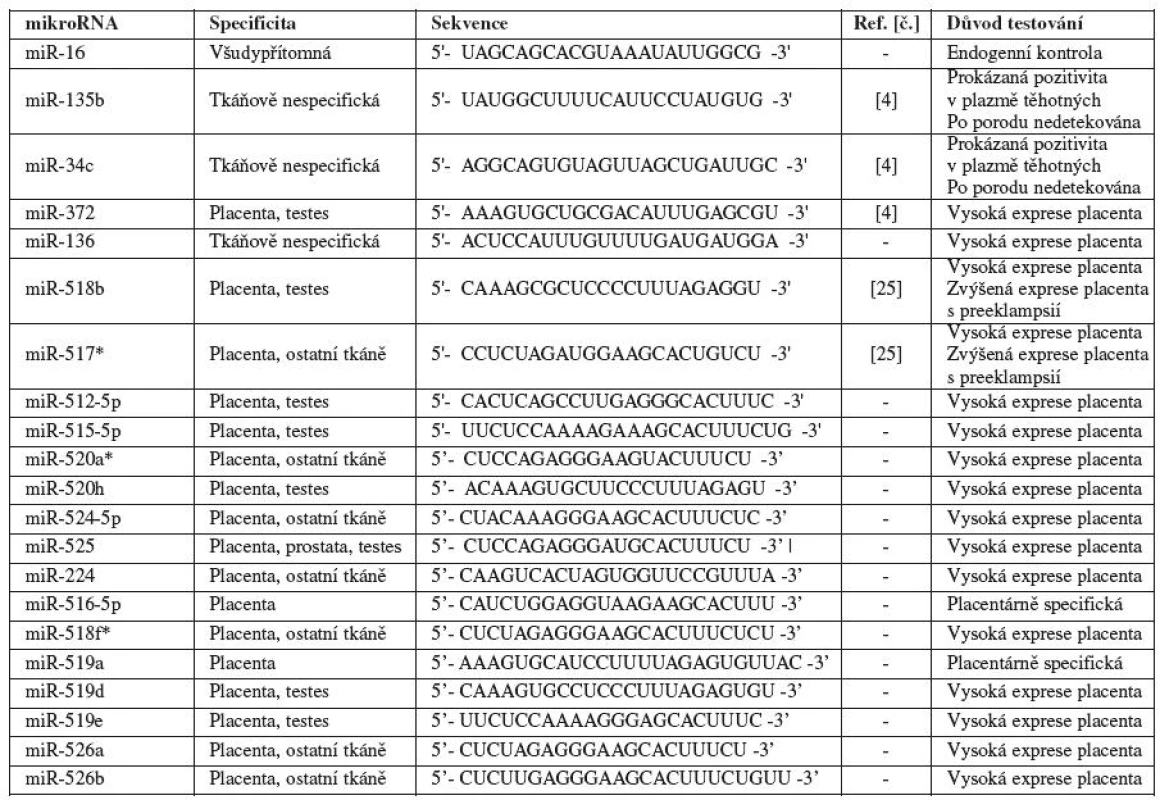
SOUBOR A METODIKA
Soubor pacientek
Celkem bylo testováno 23 těhotných žen v 12., 16. a 36. gestačním týdnu s fyziologickým průběhem gravidity a 5 zdravých žen bez známek těhotenství. Všechny pacientky poskytly informovaný souhlas s odběrem periferní krve pro toto vyšetření.
Metodika
Izolace plazmy z periferní krve matky
Plazma byla připravena z 5 ml nesrážlivé periferní krve (EDTA) nejpozději 24 hodin po odběru centrifugací při 1200 g po dobu 10 minut. Poté byla plazma stočena znovu a skladována při –80 °C až do dalšího zpracování.
Abychom minimalizovali riziko kontaminace vzorků, prováděli jsme veškeré zpracování biologického materiálu v laminárním boxu třídy II. a pro pipetaci jsme používali aerosol resistentní špičky.
Izolace mikroRNA z mateřské plazmy a přepis do cDNA
1 ml mateřské plazmy byl inkubován s 3 ml Trizol LS Reagent (Invitrogen, Carlsbad, Kalifornia, USA) po dobu 5 minut při pokojové teplotě. Po 10minutové inkubaci při pokojové teplotě s 0.8 ml chloroformu následovala 15minutová centrifugace při 12 000 g a 4 °C. Vodná fáze byla přenesena do nové zkumavky a RNA byla vysrážena po přidání 1/3 násobku objemu 100 % ethanolu. Následně byla získána RNA obohacená o frakci malých RNA pomocí mirVanaTM miRNA Isolation Kitu (Ambion, Austin, Texas, USA) dle originálního protokolu výrobce. RNA byla eluována 100 μl elučního pufru. Reziduální DNA byla odstraněna pomocí 5 μl DNAázy (Dnase I, Fermentas International, Ontario, Canada).
16,7 μl eluátu bylo použito pro přepis RNA do cDNA s využitím specifického komerčního „stem-loop“ primeru pro konkrétní mikroRNA a TaqMan MicroRNA Reverse Transcription kitu (Applied Biosystem, Branchburg, New Jersey, USA) za následujících podmínek 30 minut 16 °C, 30 minut 42 °C, 5 minut 85 °C a 15 minut 4 °C na 7500 real-time PCR system (Applied Biosystem, Branchburg, New Jersey, USA). Koncentrace a čistota celkové RNA a RNA obohacené o frakci malých RNA byla stanovena na spektrofotometru NanoDrop ND-1000 (NanoDrop Technologies, Wilmington, DE, USA).
Detekce mikroRNA v mateřské plazmě pomocí PCR v reálném čase
Detekce byla provedena na 7500 real-time PCR system (Applied Biosystem, Branchburg, New Jersey, USA) s využitím TaqMan Universal PCR Master Mixu a komerčních setů pro jednotlivé mikroRNA obsahujících specifické primery a 5’ - FAM, 3’ - MGB značenou sondu (Applied Biosystem, Branchburg, New Jersey, USA) v reakčním objemu 35 μl s 15 μl cDNA. Podmínky PCR reakce byly nastaveny podle manuálu výrobce [10-min preinkubace při 95 °C nutná pro aktivaci AmpliTaq Gold DNA polymerázy; dále 40 cyklů při 95 °C 15 s (denaturace DNA) a 60 °C 1 min (anelace a syntéza DNA)]. Každý vzorek byl analyzován v 8jamkových stripech ve 3 replikátech. Pozitivní výsledek byl hodnocen jako detekce fluorescenčního signálu v jamce před 40. cyklem (Ct < 40). Jako pozitivní kontrola byla využita frakce RNA obohacená o mikroRNA izolovaná z fetální části placenty. Každá analýza zahrnovala negativní kontroly (bez přítomnosti cDNA templátu a/nebo reverzní transkriptázy).
VÝSLEDKY
Intra - a inter-assay variabilita pro jednotlivé mikroRNA systémy
Koeficient variability pro jednotlivé mikroRNA systémy v rámci jedné analýzy se pohyboval v rozmezí 0 % – 1,6 % (intra-assay variabilita). Koeficient variability pro jednotlivé mikroRNA systémy v rámci různých analýz provedených v různých dnech dosahoval hodnot 0,4 % – 6,8 % (inter-assay variabilita).
Detekce jednotlivých mikroRNA v mateřské cirkulaci u těhotenství s fyziologickým průběhem a kontrolní skupiny (zdravé ženy bez známek těhotenství)
Metodika izolace a detekce mikroRNA v placentě a mateřské plazmě byla zavedena a optimalizována s využitím všudypřítomné tkáňově nespecifické miR-16, kterou jsme dále používali jako kontrolu pro ověření přítomnosti mikroRNA v RNA obohacené o frakci malých RNA.
Všechny testované mikroRNA byly spolehlivě detekovány ve fetální části placenty v rozmezí 16,2 – 35,2 cyklu. MikroRNA (miR-136 a miR-519a) s pozdější amplifikací v placentární tkáni (Ct 31,0 a 35,2) nebyly detekovatelné v mateřské cirkulaci v průběhu gravidity.
Některé mikroRNA (miR-34c, miR-224, miR-512-5p, miR-515-5p, miR-516-5p, miR-518f*, miR-519d a miR-519e), které vykazovaly podle databáze miRNAMap významnou expresi v placentě a nulovou nebo minimální expresi v ostatních tkáních, byly detekovány i v periferní krvi zdravých žen bez známek těhotenství. Tyto mikroRNA jsme se rozhodli dále netestovat, přestože mateřská plazma vykazovala vyšší koncentrace některých mikroRNA (miR-512-5p, miR-515-5p, miR-516-5p a miR-519d) v plazmách těhotných žen (zejména ve 3. trimestru gravidity) než v periferní krvi zdravých žen bez známek těhotenství.
Pouze 6 mikroRNA (miR-517*, miR-518b, miR-520a*, miR-520h, miR-525 a miR-526a) nebylo detekováno v periferní krvi zdravých žen bez známek těhotenství a současně byly spolehlivě detekovány v plazmách těhotných žen (pozitivní signál amplifikace ve většině replikátů v dřívějších amplifikačních cyklech Ct) v průběhu těhotenství.
Z hodnot amplifikačních cyklů je zřejmé, že množství některých z těchto mikroRNA (miR-517*, miR-518b, miR-520a*, miR-520h a miR-525) se kontinuálně zvyšuje v mateřské cirkulaci s postupujícím těhotenstvím, neboť nejvyšší koncentrace byly nalezeny právě v 36. týdnu těhotenství (obr. 1). Mir-135b byla spolehlivě detekovatelná v mateřské cirkulaci pouze ve 3. trimestru gravidity. Výsledky analýzy jsou shrnuty v tabulce 2.
Image 1. Detekce mikroRNA ve fetální části placenty a v mateřské cirkulaci u těhotenství s fyziologickým průběhem, miR-520h (12., 16. a 36. týden gravidity) 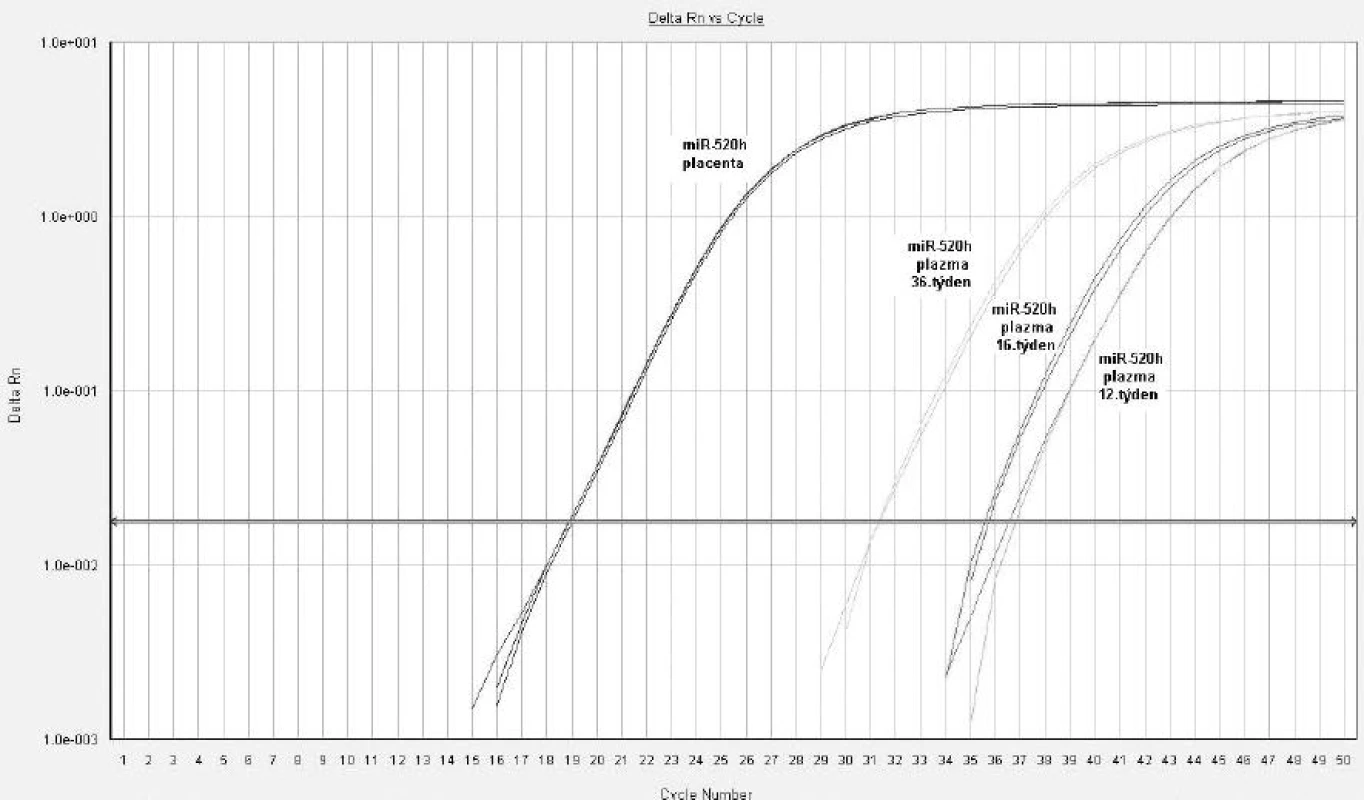
Table 2. Detekce jednotlivých mikroRNA v mateřské cirkulaci u těhotenství s fyziologickým průběhem a kontrolní skupiny (zdravé ženy bez známek těhotenství) 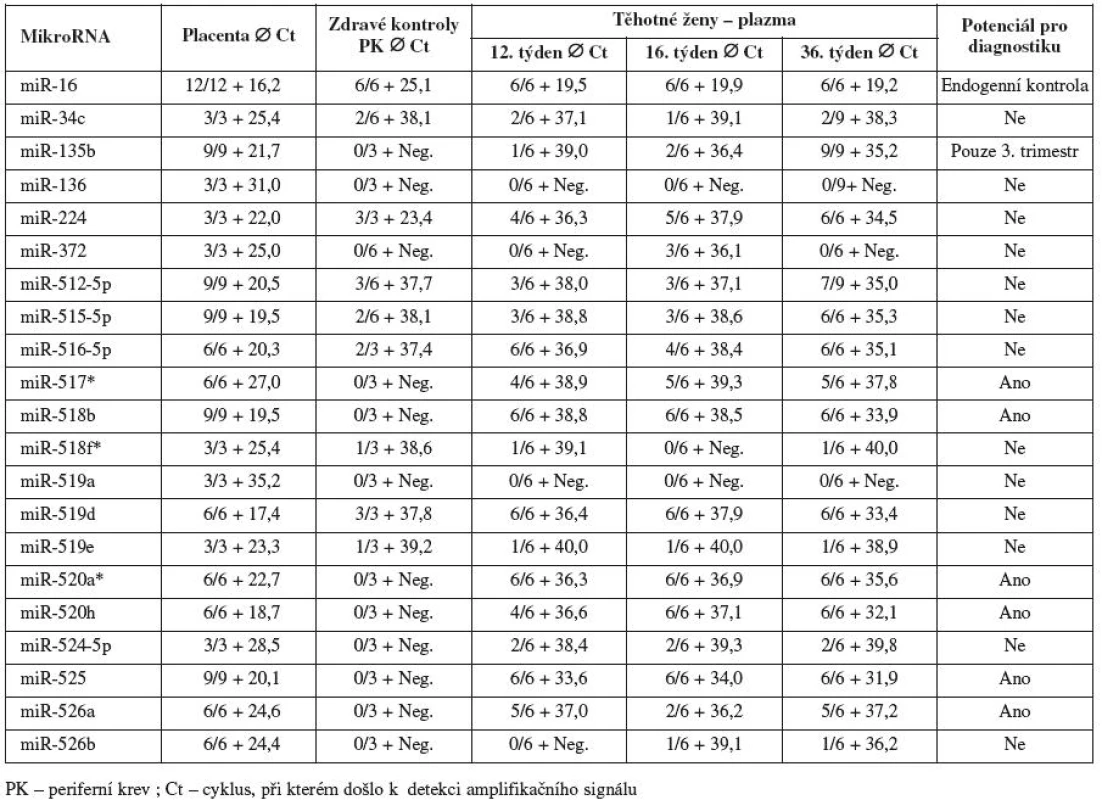
DISKUSE
Metodika byla optimalizována tak, aby bylo možné vyšetřit z 1 ml mateřské plazmy alespoň 6 různých mikroRNA. Pouze ty mikroRNA (miR-517*, miR-518b, miR-520a*, miR-520h, miR-525 a miR-526a), které nebyly detekovatelné v periferní krvi zdravých žen bez známek těhotenství a současně byly spolehlivě detekovány v plazmách těhotných žen, byly vybrány pro další sledování kvantitativních změn v průběhu gravidity a jako potenciální markery pro diferenciaci mezi fyziologickým a patologickým průběhem gravidity souvisejícím s placentární insuficiencí (preeklampsie a/nebo intrauterinní růstová retardace).
Vycházíme z předpokladu, že těhotenské komplikace související s placentární insuficiencí (preeklampsie a intrauterinní růstová retardace - IUGR) lze charakterizovat unikátním profilem up-regulovaných a down-regulovaných placentárně specifických mikroRNA, které lze detekovat v mateřské cirkulaci jako součást apoptotických tělísek trofoblastu. Předpokládáme, že přítomnost a koncentrace jednotlivých placentárně specifických mikroRNA v mateřské cirkulaci se mohou významně lišit mezi těhotenstvím s fyziologickým a patologickým průběhem ve stejném gestačním stáří. Předpokládáme, že by bylo v budoucnu možné sledovat profil a koncentrace placentárně specifických mikroRNA v mateřské cirkulaci u těhotných žen s rizikem pozdějšího rozvoje závažné preeklampsie a IUGR.
Tato práce vznikla za podpory výzkumného záměru MŠMT MSM 0021620806 a projektu specifického vysokoškolského výzkumu grantové agentury UK 260707/SVV/2010.
Doc. RNDr. Ilona Hromadníková, Ph.D.
Oddělení molekulární biologie a patologie buňky
3. lékařská fakulta Univerzity Karlovy
Ruská 87
100 00 Praha 10
e-mail: ilona.hromadnikova@lf3.cuni.cz
Sources
1. Bernstein, E., Caudy, AA., Hammond, SM., Hannon, GJ. Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature, 2001, 409(6818), p. 363-366.
2. Calin, GA., Dumitru, CD., Shimizu, M., et al. Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci USA, 2002, 99(24), p. 15524-15529.
3. Chen, CZ., Li, L., Lodish, HF., et al. MicroRNAs modulate hematopoietic lineage differentiation. Science, 2004, 303(5654), p. 83-86.
4. Chim, SSC., Shing, TKF., Hung, ECW., et al. Detection and characterization of placenta microRNAs in maternal plasma. Clin Chem, 2008, 54(3), p. 482-490.
5. Elbashir, SM., Harborth, J., Lendeckel, W., et al. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature, 2001, 411, p. 494-498.
6. Fire, A., Xu, S., Montgomery, MK., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature, 1998, 391, p. 806-811.
7. Grishok, A., Pasquinelli, AE., Conte, D., et al. Genes and mechanisms related to RNA interference regulate expression of the small temporal RNAs that control C. elegans developmental timing. Cell, 2001, 106, p. 23-34.
8. Hammond, SM., Bernstein, E., Beach, D., et al. An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells. Nature, 2000, 404, p. 293-296.
9. Hutvágner, G., McLachlan, J., Pasquinelli, AE., et al. A cellular function for the RNA-interference enzyme Dicer in the maturation of the let-7 small temporal RNA. Science, 2001, 293, p. 834-838.
10. Hutvágner, G., Zamore, PD. A microRNA in a multiple-turnover RNA enzyme complex. Science, 2002, 297, p. 2056-2060.
11. Ketting, RF., Fischer, SE., Bernstein, E., et al. Dicer functions in RNA interference and in synthesis of small RNA involved in developmental timing in C. elegans. Genes Dev, 2001, 15, p. 2654-2659.
12. Krichevsky, AM., King, KS., Donahue, CP., et al. A microRNA arrays reveals extensive regulation of microRNAs during brain development. RNA, 2003, 9(10), p. 1274-1281.
13. Lagos-Quintana, M., Rauhut, R., Lendeckel, W., Tuschl, T. Identification of novel genes coding for small expressed RNAs. Science, 2001, 294(5543), p. 853-858.
14. Lau, NC., Lim, LP., Weinstein, EG., Bartel, DP. An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans. Science, 2001, 294, p. 858-862.
15. Lee, PL., Glasner, ME., Yekta, S., et al. Vertebrate microRNA genes. Science, 2003, 299(5612), p.1540.
16. Lee, Y., Jeon, K., Lee, TJ., et al. MicroRNA maturation : stepwise procesing and subcellular localization. EMBO J, 2002, 21, p. 4663-4670.
17. Lewis, BP., Shih, IH., Jones-Rhoades, MW., et al. Prediction of mammalian microRNA targets. Cell, 2003, 115(7), p. 787-798.
18. Llave, C.,Xie, Z., Kasschau, KD., Carrington JC. Cleavage of Scarecrow-like mRNA targets directed by a class of Arabidopsis miRNA. Science, 2002, 297, p. 2053-2056.
19. Lund, E., Güttinger, S., Calado, A., et al. Nuclear export of microRNA precursors. Science, 2004, 303(5654), p. 95-98.
20. Martinez, J., Patkaniowska, A., Urlaub, H., et al. Single-stranded antisense siRNAs guide target RNA cleavage in RNAi. Cell, 2002, 110, p. 563-574.
21. Michael, MZ., O’Connor, SM., van Holst Pellekaan, NG., et al. Reduced accumulation of specific microRNAs in colorectal neoplasia. Mol Cancer Res., 2003, 1(12), p. 882-891.
22. Wightman, B., Ha, I., Ruvkun, G. Posttranscriptional regulation of the heterochromatic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans. Cell, 1993, 75, p. 855-862.
23. Zamore, PD., Tuschl, T., Sharp, PA., Bartel, DP. RNAi : double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals. Cell, 2000, 101(1), p. 25-33.
24. Zhang, H., Kolb, FA., Brondani, V., et al. Human Dicer preferentially cleaves dsRNAs at their termini without a requirement for ATP. EMBO J, 2002, 21, p. 5875-5885.
25. Zhu, XM., Han, T., Sargent, IL., et al. Differential expression profile of microRNAs in human placenta from preeclamptic pregnancies vs normal pregnancies. Am J Obstet Gynecol, 2009, 200, p. 661.e1-661.e7.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2010 Issue 3-
All articles in this issue
- Porovnání exprese imunohistochemických markerů ve vzorcích z hysteroskopie a hysterektomie u pacientek s karcinomem endometria
- Sexuální morbidita po chirurgické léčbě zhoubných gynekologických nádorů
- Technika radioterapie s modulovanou intenzitou záření v léčbě gynekologických malignit
- Rezistence/senzitivita in vitro u pacientek s karcinomem ovaria
- Některé charakteristiky žadatelek o umělé ukončení těhotenství
- Prognostický význam klinickopatologických a vybraných imunohistochemických faktorů u karcinomu endometria
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- G bod – mýty a realita
- Německý gynekolog a porodník Christian Gerhard Leopold (1846-1911)
- Incidence vrozených srdečních vad v České republice – aktuální data
- Průběh a výsledky 34 těhotenství komplikovaných syndromem HELLP
- Burkittův lymfom v těhotenství – kazuistika
- Detekce placentárně specifických mikroRNA v mateřské cirkulaci
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- G bod – mýty a realita
- Incidence vrozených srdečních vad v České republice – aktuální data
- Výskyt preperitoneálního tuku a hernia obturatoria v canalis obturatorius
- Modifikovaná klasifikace mikroskopického hodnocení poševních infekcí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

