-
Medical journals
- Career
Progesteron a jeho neuroaktivní metabolity v mechanismu porodu
: M. Klímková 1; A. Pařízek 1; M. Velíková 3; M. Hill 2; A. Pašková 1; Z. Žižka 1; R. Kancheva 3; M. Kalousová 3; M. Koucký 1; A. Germanová 1; Z. Hájek 1; L. Stárka 3
: Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc. 1; Endokrinologický ústav, Praha, ředitel doc. MUDr. V. Hainer, CSc. 2; Ústav klinické biochemie a laboratorní diagnostiky, 1. LF UK a VFN, Praha, přednosta prof. MUDr. T. Zima, DrSc., MBA 3
: Ceska Gynekol 2010; 75(1): 9-15
Cíl studie:
Přehledový článek o roli neuroaktivních a neuroprotektivních steroidů v lidském těhotenství.Typ studie:
Přehledový článek.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika 1. lékařské fakulty UK a Všeobecné fakultní nemocnice, Praha.Závěr:
Porod je multifaktoriální proces. Bylo zkoumáno již mnoho mechanismů iniciace porodu. Hladina estrogenů vzrůstá ke konci těhotenství, což pravděpodobně způsobuje zvýšená aktivita fetálních nadledvin. Tato zóna je stimulována postupným zvyšováním produkce placentárního kortikoliberinu, což způsobuje nadměrnou produkci konjugovaného 3β-hydroxy-5-en-steroidů, které jsou transportovány cirkulací do placenty a následně metabolizovány na aktivní hormony. Některé metabolity progesteronu pravděpodobně působí v těhotenství udržováním modulace ligandů iontových kanálů v CNS a periferii. Otázkou v této studii bylo, jestli katabolismus těhotenství udržujících metabolitů progesteronu urychluje podobně jako estrogeny.Klíčová slova:
neuroaktivní steroidy, iniciace porodu, těhotenství.ÚVOD
Role progesteronu na začátku oplození spočívá v jeho zásadním ovlivnění přeměny endometria v deciduu a v podpoře nidace oplodněného vejce. U člověka se významně podílí i na celém průběhu těhotenství. Relaxací myometria udržuje délku těhotenství. Vedle progesteronu mohou být ale biologicky aktivní i jeho metabolity.
Tyto metabolity se vážou prostřednictvím receptorů γ aminomáselné kyseliny na extracelulární neurotransmiterové receptory buněčných membrán a ovlivňují jejich propustnost pro ionty. Obecně se označují jako neuroaktivní steroidy. V případě progesteronu jde konkrétně o neuroaktivní steroidy pregnanového typu. Mechanismus působení neuroaktivních steroidů je negenomový, a jejich účinek je proto oproti běžně genomově fungujícím steroidům velmi rychlý. Neuroaktivní steroidy jsou u těhotné ženy produkovány v řádově vyšším množství proti stavu mimo těhotenství. Na jejich produkci se v těhotenství podílí zejména nadledviny plodu a placenta a také játra plodu i matky. Placentární a fetální kompartmenty jsou velice těsně propojeny, i z hlediska tvorby a účinku neuroaktivních steroidů tvoří fetomaternální jednotku. Neuroaktivní steroidy existují ve volné i konjugované formě. Volné i konjugované neuroaktivní steroidy placentou procházejí do mateřského oběhu. Jejich funkce v těle těhotné ženy/rodičky však není dosud zcela objasněna. Očekává se, že mají podíl na stabilizaci těhotenství, a na druhé straně mohou být i jedním z mediátorů začátku porodního mechanismu. Neuroaktivní steroidy se zřejmě účastní i neurohumorální stresové reakce ženy během porodu a s vysokou pravděpodobností se podílejí i na změnách poporodního duševního chování matky. V peripartálním období budou mít pravděpodobně i ochranný účinek proti hypoxii CNS plodu.
ROZDĚLENÍ STEROIDNÍCH HORMONŮ
Steroidní hormony jsou deriváty cholesterolu. Odštěpením izokaproaldehydu (C6) z molekuly cholesterolu, kterou katalyzuje cytochrom P450 dependentní enzym odštěpující postranní řetězec vzniká pregnenolon. To platí i pro cholesterol konjugovaný. Pregnelonon a jeho sulfát jsou prekurzory všech steroidních hormonů. K přeměně pregnenolonu na steroidní hormony dochází v endoplazmatickém retikulu, v mitochondriích a v cytoplazmě buněk. Steroidní hormony nejsou ukládány v endokrinních žlázách, proto, jsou - li vytvořeny, vylučují se ihned do oběhu. Volné steroidy jsou významně lipofilní, a proto snadno procházejí lipoproteinovými strukturami. Krevní transport molekul steroidních hormonů probíhá pomocí přenašečových proteinů (albumin, kortikosteroidy vázající globulin, pohlavní hormony vázající globulin apod.). V případě genomových účinků je pouze volná frakce steroidů biologicky aktivní. Ta však obvykle činí méně než 10 % z jejich celkového množství. Naproti tomu právě vazba na přenašečové proteiny způsobuje relativně dlouhý poločas života většiny steroidů, řádově hodiny. V rámci degradace a exkrece steroidní hormony podléhají převážně redukci a dále pak konjugaci hydroxy-skupin (na C3) s glukosiduronátem nebo se sulfátem. Ke konjugaci dochází zejména v játrech, ale i v ledvinách. Konjugací významně klesá lipofilie steroidů, a naopak se zvyšuje jejich rozpustnost ve vodě a snáze se vylučují. Okolo 70 % konjugovaných steroidů se vylučuje močí, 20 % stolicí a zbytek kůží.
Steroidní hormony můžeme dělit podle místa vzniku nebo podle místa jejich účinku.
Podle místa syntézy se dělí na tři skupiny, první z nich jsou vylučovány kůrou nadledvin (aldosteron, kortizol), druhá skupina pohlavními žlázami (progesteron, testosteron, estradiol) a třetí skupinu tvoří steroidy produkované během těhotenství v placentě.
Podle místa účinku se dělí steroidní hormony na steroidy s intracelulárním a extracelulárním účinkem. Intracelulárně účinné steroidy, malé lipofilní molekuly, snadno procházejí buněčnou membránou a vstupují do cytoplazmy, kde se vážou na intracelulární receptory, buď v cytoplazmě, nebo přímo, po prostupu nukleární membránou, v jádře na DNA cílových buněk. Komplex hormon-receptor působí jako transkripční faktor, aktivuje nebo potlačuje expresi genů. V případě aktivace genů dochází k syntéze proteinů, které vyvolávají příslušnou biologickou odpověď. Vzhledem k tomu, že intracelulárně účinné steroidy zasahují do exprese genů, nastupují jejich účinky ve srovnání s ostatními hormony pomaleji, ale zato dlouhodobě. V minulosti byla již dostatečně prozkoumána steroidní regulace metabolismu, osmotické rovnováhy a sexuálních funkcí. Účinek druhé skupiny steroidních hormonů probíhá prostřednictvím membránových receptorů. Od předchozí skupiny steroidů se tyto látky odlišují svým extracelulárním, negenomovým účinkem. Vytváří vazby s neurotransmiterovými receptory v buněčných stěnách, které ovlivňují propustnost iontových kanálů. Proto se tyto látky obecně označují jako neuroaktivní steroidy. Jejich účinek je velmi rychlý.
NEUROAKTIVNÍ STEROIDY
Poznání o neuroaktivních účincích steroidů je poměrně nedávné. Začátkem 70. let minulého století nalezl Backström souvislost mezi premenstruální tenzí a změnami hladin estradiolu a progesteronu [2]. V této době se také objevily první systematické studie sledující biosyntézu i katabolismus progesteronových metabolitů ve tkáních spojených s lidským těhotenstvím [21]. V roce 1980 uvádí v české literatuře Schreiber, z celosvětového hlediska poprvé, termín „neurosteroid“ a o rok později je tento termín poprvé použit v zahraniční literatuře v souvislosti s experimentem podloženou hypotézou o přímé biosyntéze steroidů v mozku, a to nezávisle na periferii [4, 31]. Pozdější nález biosyntézy neuroaktivních steroidů přímo v CNS se stal důležitým mezníkem jejich výzkumu [3, 15, 33]. Bylo prokázáno, že neurosteroidy v CNS jsou syntetizovány nejen v mitochondriích neuronů, ale i v gliových buňkách [32]. Později vychází práce, ve které Harrison a Simmonds publikují mechanismus anestetického účinku syntetického pregnanového steroidu ganaxalonu působícího prostřednictvím stimulace receptorů kyseliny γ-aminomáselné, GABA-r [8]. V následujícím roce publikuje Majewska první práci o modulačním účinku endogenních steroidů na GABA-r, a zahajuje tak intenzivní výzkum v oblasti mechanismů účinku neuroaktivních steroidů, který dosud probíhá [17].
Biosyntéza neuroaktivních steroidů (schéma 1) vykazuje velmi výrazné rozdíly v závislosti na pohlaví a věku. U netěhotných žen v reprodukčním věku je největší podíl neuroaktivních steroidů pregnanového typu (C21 steroidy). Zahrnují metabolity progesteronu syntetizovaného v corpus luteum, zejména v luteální fázi menstruačního cyklu [24] (tab.1). Dominantním metabolitem je allopregnanolon. tj. 3α-hydroxy-5α-pregnan-20-on, následují izopregnanolon, pregnanolon a epipregnanolon [12].
Schéma 1. Zjednodušené schéma biosyntézy neuroaktivních metabolitů progesteronu 
1. Sérové hladiny neuroaktivních pregnanolonových izomerů a příbuzných steroidů u premenopauzálních žen 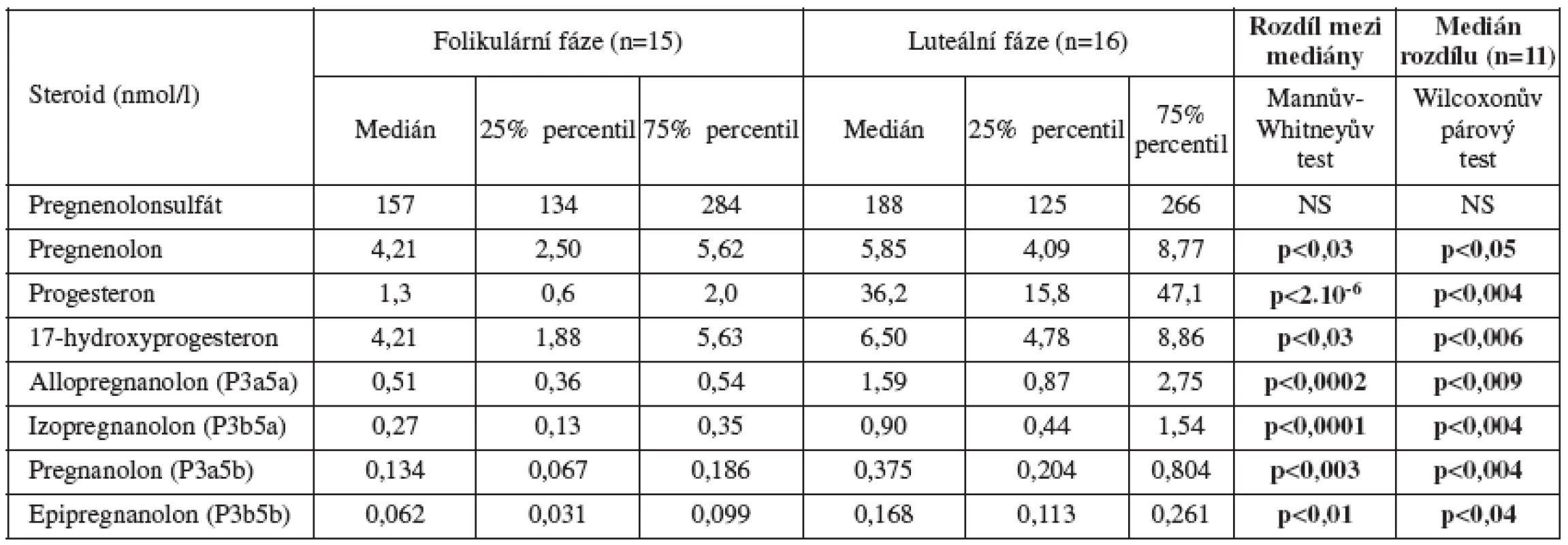
Podobně jako progesteron, také jeho redukované metabolity klesají u žen s věkem a kvalitativně se mění po menopauze [6].
Většinu prekurzorů neuroaktivních steroidů mimo těhotenství nebo luteální fázi menstruačního cyklu tvoří kůra nadledvin. Největší produkce pochází ze zona fasciculata řízené osou CRH-ACTH, menší v zona glomerulosa řízené osou renin-angiotenzin. Poslední ze zón kůry nadledvin, která je méně závislá na stimulaci ACTH, zona reticularis, produkuje spíše androgenní prekurzory a určité množství testosteronu. Tyto látky jsou ovšem substráty pro tvorbu 5α - a 5β-dihydrotestosteronu a dále neuroaktivních androstanových metabolitů.
Progesteronové nekonjugované metabolity převážně pozitivně modulují GABAA receptory a způsobují, že dochází k uvolnění jejich chloridových kanálů. Výsledkem je účinek endogenně analgetický až hypnotický. Konjugované metabolity progesteronu modulují GABAA receptory také, ale s opačným účinkem. Řada neurosteroidů, především jejich sulfátů (ale ne všech), působí jako pozitivní modulátory NMDA receptorů, uvolňující kalciové kanály s účinkem endogenně excitačním. Na tvorbě a metabolismu neurosteroidů se podílí řada steroidogenních enzymů, jejichž změněná aktivita může mít za následek, nebo alespoň přispět ke vzniku patologických stavů, jako je například premenstruační syndrom, různé druhy deprese, některé formy epilepsie. Již dnes lze předvídat, že po dokonalém poznání tvorby, možnosti ovlivnění metabolismu a působení neurosteroidů, vznikne časem možnost jejich dalšího terapeutického využití, ať už k prevenci, nebo k léčbě řady i velmi závažných onemocnění.
PREGNANOVÉ STEROIDY V TĚHOTENSTVÍ
Výsledky studií u laboratorních zvířat ukazují významnou roli pregnanových steroidů v rovnováze zajištující trvání těhotenství. Pregnanové steroidy na jedné straně napomáhají těhotenství stabilizovat, ale na druhé straně, změny jejich hladin mohou vyvolat nástup děložních kontrakcí a přispět k ukončení těhotenství. I když u mnoha druhů savců je mechanismus začátku porodu do značné míry objasněn, u člověka tomu tak není. Lidský porod je výrazně druhově specifický a dosud není znám prvotní impuls k jeho spuštění. V mechanismu začátku porodu primátů se zřejmě významně uplatňuje kortikoliberin (CRH), jehož výrazná placentární produkce je charakteristická pouze pro primáty. V časovém vývoji sérového profilu CRH dochází, v důsledku specifické placentární up-regulace genové exprese, kolem 30. týdne těhotenství k exponenciálnímu nárůstu CRH až do doby porodu [10, 11]. Směrem k termínu porodu současně klesá hladina CRH-vazebného proteinu (CRH-BH) [2]. Sekrece CRH v placentě je na rozdíl od tvorby CRH v hypothalamu pravděpodobně řízena pouze cirkulujícími a lokálně produkovanými humorálními faktory, mezi něž patří neurotransmitery, cytokiny, prostaglandiny, peptidové hormony a steroidy [2, 3]. Na rozdíl od netěhotné ženy, kdy je zpětnovazebně prostřednictvím osy hypothalamus-hypofýza-nadledviny udržována rovnováha v produkci glukokortikoidů, v těhotenství zvyšují glukokortikoidy tvorbu CRH v placentě, kde indukují expresi příslušné mRNA, tj. dochází k vytvoření pozitivní zpětné vazby [12,14]. Přes hyperprodukci CRH v období těhotenství však tento placentární hormon významněji nezasahuje do systému hypofýza--nadledvina u matky [2].
Lidský plod má již ve II. trimestru fungující hypofyzárně-adrenální osu a placentární CRH stimuluje produkci ACTH v hypofýze plodu a parakrinně i přímo v placentě [15]. ACTH, a zejména samotný CRH dále stimulují steroidogenezi ve fetální nadledvině, jejímiž hlavními produkty jsou pregnenolon sulfát, DHEAS, DHEA a kortizol [34, 35]. Zdá se, že právě CRH je příčinou hypertrofie fetální zóny nadledviny plodu během těhotenství, což naznačuje fakt, že fetální zóna nadledviny zaniká po porodu. Produkce steroidů ve fetální zóně nadledvin plodu je s největší pravděpodobností významně spojena s iniciací porodu.
CRH kromě pozitivní zpětné vazby s kortizolem vytváří také pozitivní zpětnou vazbu s prostaglandiny [1, 13, 27]. Přes tato fakta objasňující do určité míry mechanismus spuštění porodu však stále není jasné, jaký podnět slouží k zahájení kaskády těchto pozitivních zpětných vazeb vedoucích k děložní činnosti. Hlavní otázkou zůstává mechanismus spojení mezi tvorbou CRH a kontraktilitou hladké svaloviny myometria [19].
Pokud jde o mimořádně hojný neuroaktivní steroid v maternálním, a zejména fetálním kompartmentu, pregnenolonsulfát, produkovaný fetální zónou fetální nadledviny, jeho role není jednoznačná. Tento konjugát může vystupovat jako aktivátor jak nervové činnosti prostřednictvím aktivace NMDA-r, nebo negativní modulace GABAA-r, ale zároveň je i prekurzorem progesteronu, a tedy i aktivátorů GABAA-r, a navíc může v některých případech sám působit i jako aktivátor GABAA-r.
Autoři Pařízek A., Hill M. a kol. popsali trendy v koncentraci neuroaktivních steroidů v průběhu fyziologického těhotenství (graf 1).
1. Hladiny neuroaktivních pregnanolonových izomerů v séru těhotných žen od počátku do konce těhotenství 
Na rozdíl od hlodavců nebyly u lidí většinou zjištěny výrazné změny hladin gestagenů v období před nástupem porodu. V minulosti se však objevila i práce dokumentující pokles hladin progesteronu v pupečníkové arteriální i venózní krvi mezi 36. a 40. týdnem těhotenství a růst poměru estradiol/progesteron v tomto období [9].
Inaktivace progesteronu, který udržuje v klidu dělohu a současná aktivace estrogenů, je u lidí zajišťována především zvýšením exprese A-izoformy progesteronového receptoru (PR-A) a estrogenního receptoru typu α (ERα). Progesteron inhibuje expresi ERα a mRNA pro ERα. ERα pak mimo porod pozitivně koreluje s myometriální cyklooxygenázou typu 2 i mRNA pro oxytocin. Tyto výsledky naznačují aktivaci genů odpovědných za kontrakční činnost myometria [20]. Sulfáty některých steroidů ve fetálních membránách stimulují i fosfolipázovou aktivitu a podporují uvolňování kyseliny arachidonové jako substrátu pro tvorbu prostaglandinů [29]. V této souvislosti přichází v úvahu možnost ovlivnění receptorů kontrolujících propustnost membránových iontových kanálů pro vápenaté ionty prostřednictvím interakce se sulfáty některých steroidů. Jak ukazují studie na hlodavcích, v regulaci děložní kontraktility jsou zřejmě zapojeny i GABAA receptory, které mohou být modulovány steroidy v obou směrech, přičemž pro výsledný efekt by mohly být důležité poměry sulfatovaných a nesulfatovaných forem steroidních GABAA modulátorů stejně jako poměr 3α - a 3β-hydroxylovaných metabolitů progesteronu [18, 28].
Ve druhé polovině devadesátých let byla publikována studie zabývající se biosyntézou a transportem neuroaktivních steroidů mezi fetálním a mateřským kompartmentem. Autoři této studie navrhli následující mechanismus. Progesteron vstupuje do fetální cirkulace z místa jeho syntézy v syncytiotrofoblastu a je metabolizován plodem na allopregnanolon (P3α5α) a izopregnanolon (P3β5α), tj. na 5α-pregnanolonové izomery a jejich sulfáty. Tyto látky jsou pak zpětně konvertovány na 5α-dihydroprogesteron v trofoblastu, odkud pak přednostně vstupují do mateřského kompartmentu. Zde jsou opět metabolizovány na 5α-pregnanolonové izomery a jejich sulfáty a to nezávisle na hladinách progesteronu v mateřském kompartementu [5]. Druhý, nejhojnější volný pregnanový steroid v těhotenství pregnanolon (P3α5β), vykazuje u těhotných žen hladiny téměř srovnatelné s hladinami nejhojnějšího endogenního pozitivního modulátoru GABAA-r allopregnanolonu, zatímco u žen mimo těhotenství jsou tyto hladiny téměř o řád nižší [10, 12, 25, 26]. 5β-pregnanové steroidy přitom vyvolávají rychlou relaxaci uteru i prostřednictvím nukleárního pregnanového receptoru X [22]. Z hlediska iniciace porodu je rovněž zajímavé, že exprese m-RNA pro enzym 5β-reduktázu, která je nutná pro syntézu pregnanolonu pravděpodobně v závěru těhotenství, významně klesá v placentě i myometriu, což má vliv i na vývoj hladin příslušných neuroaktivních metabolitů progesteronu [7, 25, 30]. 5β-reduktáza je aktivní převážně v játrech, ale například i v dásních, mozku a ve tkáních spojených s těhotenstvím [14, 16]. Jedna ze současných studií uvádí vzrůst hladin pregnanolonových steroidů a jejich prekurzorů od 10. do 36. týdne těhotenství s výjimkou 5β-dihydroprogesteronu (DHP) a pregnanolonu, jejichž profily se významně neměnily. Zatímco poměr 5α-DHP/progesteron odrážející aktivitu 5α-reduktázy byl během těhotenství konstantní, poměr 5β-DHP/progesteron odrážející aktivitu 5β-reduktázy se snižoval v závěru těhotenství. Konverze 5α-DHP a 5β-DHP na produkty s hydroxylem v poloze 3α - během těhotenství rostly, avšak v poslední fázi před porodem hodnoty uvedeného poměru v případě allopregnanolonu poklesly. Šest týdnů po porodu byly hladiny uvedených steroidů podstatně nižší proti hodnotám před porodem [7].
Již v roce 1989 publikovala Majewska hypotézu o úloze steroidních modulátorů GABA-r v patogenezi poporodních depresí. Uvedená hypotéza byla o pět let později podpořena prací italských autorů [23]. Skupina 38 primipar, po porodu zdravého novorozence, byla rozdělena podle odpovědi na dotazník „Stein Questionnaire for symptoms of the “blues”“ na podskupinu pociťující příznaky poporodní deprese (n=18) a skupinu bez těchto příznaků (n=20). Hlavním ukazatelem subjektivních příznaků poporodní deprese bylo tzv. Hamiltonovo skóre. U skupiny žen s příznaky nebyla nalezena na rozdíl od zbývajících žen korelace mezi allopregnanolonem a progesteronem. Hladiny allopregnanolonu postpartum byly nižší u skupiny žen s příznaky, ačkoliv ve hladinách progesteronu obdobný rozdíl nalezen nebyl. Navíc byla nalezena negativní korelace mezi Hamiltonovým skóre a hladinami allopregnanolonu postpartum.
Dosavadní poznatky ukazují, neuroaktivní metabolity progesteronu mohou významně ovlivňovat jak mechanismus začátku porodu, tak i jeho průběh.
ZÁVĚR
Neuroaktivní steroidy pregnanového typu ovlivňují v těhotenství a s největší pravděpodobností i v šestinedělí celou řadu reakcí matky i dítěte. Z hlediska perinatologické praxe lze očekávat, že by tyto steroidní látky mohly pomoci v predikci nástupu děložních kontrakcí a předčasného porodu. K tomu je třeba vypracovat nejprve metodiku multikomponentní analýzy neuroaktivních steroidů, estrogenů, gestagenů, jejich prekurzorů a metabolitů. Další krok by studoval steroidní metabolity společně s proteohormony a vazebnými proteiny u žen během těhotenství a při porodu, a to jak u předčasných porodů, tak u porodů v termínu. Na základě získaných údajů bude třeba vybrat nejvhodnější kombinace ukazatelů pro predikci termínu porodu. Nakonec budou pravděpodobně navrženy a validovány příslušné predikční modely.
Práce byla podporována GAČR -303/04/1086 Neuroaktivní steroidy a iniciace porodu u člověka.
MUDr. Michaela Klímková
Gynekologicko-porodnická klinika
1. LF UK a VFN
Apolinářská 18
128 08 Praha 2
e-mail:mklim@centrum.cz
Sources
1. Angioni, S., Petralgia, F., Gallinelli, A., et al. Corticotropin-releasing hormone modulates cytokines release in cultured human peripheral blood mononuclear cells. Life Sci,1993, 53, p. 1735-1742.
2. Backstrom, T., Mattsson, B. Correlation of symptoms in pre-menstrual tension to oestrogen and progesterone concentrations in blood plasma. A preliminary study. Neuropsychobiology, 1975, 1, p. 80-86.
3. Corpechot, C., Leclerc, P., Baulieu, E., et al. Neurosteroids: regulatory mechanisms in male rat brain during heterosexual exposure. Steroids, 1985, p. 229-234.
4. Corpechot, C., Robel, P., Axelson, M., et al. Characterization and measurement of dehydroepiandrosterone sulfate in rat brain. Proc Natl Acad Sci USA, 1981, 78, p. 4704-4707.
5. Dombroski, RA., Casey, ML., Macdonald, PC. 5-alpha-dihydroprogesterone formation in human placenta from 5alpha-pregnan-3beta/alpha-ol-20-ones and 5-pregnan-3beta-yl-20-one sulfate. J Steroid Biochem Mol Biol, 1997, 63, p. 155-163.
6. Genazzani, AR., Petraglia, F., Bernardi, F., et al. Circulating levels of allopregnanolone in humans: gender, age, and endocrine influences. J Clin Endocrinol Metab, 1998, 83, p. 2099-2103.
7. Gilbert Evans, SE., Ross, LE., Sellers, EM., et al. 3alpha-reduced neuroactive steroids and their precursors during pregnancy and the postpartum period. Gynecol Endocrinol, 2005, 21, p. 268-279.
8. Harrison, NL., Simmonds, MA. Modulation of the GABA receptor complex by a steroid anaesthetic. Brain Res, 1984, 323, p. 287-292.
9. Hercz, P. Quantitative changes in steroid and peptide hormones in the maternal-fetoplacental system between the 28th-40th weeks of pregnancy. Acta Med Hung, 1985, 42, p. 29-39.
10. Hill, M., Bicikova, M., Parizek, A., et al. Neuroactive steroids, their precursors and polar conjugates during parturition and postpartum in maternal blood: 2. Time profiles of pregnanolone isomers. J Steroid Biochem Mol Biol, 2001, 78, p. 51-57.
11. Hill, M., Parizek, A., Bicikova, M., et al. Neuroactive steroids, their precursors, and polar conjugates during parturition and postpartum in maternal and umbilical blood: 1. Identification and simultaneous determination of pregnanolone isomers. J Steroid Biochem Mol Biol, 2000, 75, p. 237-244 .
12. Hill, M., Popov, P., Havlikova, H., et al. Altered profiles of serum neuroactive steroids in premenopausal women treated for alcohol addiction. Steroids, 2005, 70, p. 515-524.
13. Jones, SA., Challis, JR. Local stimulation of prostaglandin production by corticotropin-releasing hormone in human fetal membranes and placenta. Biochem Biophys Res Commun, 1989, 159, p. 192-199.
14. Kawahara, FS., Berman, ML., Green, OC. Conversion of progesterone-1,2-3-H to 5beta-pregnane-3,20-dione by brain tissue. Steroids, 1975, 25, p. 459-463.
15. Le Goascogne, C., Robel, P., Gouezou, M., et al. Neurosteroids: cytochrome P-450 scc in rat brain. Science, 1987, 237, p. 1212-1215.
16. Lisboa, BP., Holtermann, M. Metabolism of 20beta-hydroxy-4-pregnen-3-one in uterine tissue of non-pregnant rats in vitro. Acta Endocrinol (Copenh), 1976, 83, p. 604-620.
17. Majewska, MD., Bisserbe, JC., Eskay, RL. Glucocorticoids are modulators of GABA receptors in brain. Brain Res, 1985, 339, p. 178-182.
18. Majewska, MD., Vaupel, DB. Steroid control of uterine motility via gamma-aminobutyric acidA receptors in the rabbit: a novel mechanism? J Endocrinol, 1991, 131, p. 427-434.
19. Mclean, M., Smith, R. Corticotrophin-releasing hormone and human parturition. Reproduction, 2001, 121, p. 493-501.
20. Mesiano, S., Chan, EC., Fitter, JT., et al. Progesterone withdrawal and estrogen activation in human parturition are coordinated by progesterone receptor A expression in the myometrium. J Clin Endocrinol Metab, 2002, 87, p. 2924-2930.
21. Milewich, L., Gant, NF., Schwarz, BE., et al. Initiation of human parturition. IX. Progesterone metabolism by placentas of early and late human gestation. Obstet Gynecol, 1978, 51, p. 278-280.
22. Mitchell, BF., Mitchell, JM.,Chowdhury, J., et al. Metabolites of progesterone and the pregnane X receptor: a novel pathway regulating uterine contractility in pregnancy? Am J Obstet Gynecol, 2005, 192, p. 1304-1313, discussion 1313-1315.
23. Nappi, C., Meo, R., Di Carlo, C., et al. Reduced fertility and neuroendocrine dysfunction in women with epilepsy. Gynecol Endocrinol, 1994, 8, p. 133-145.
24. Ottander, U., Poromaa, IS., Bjurulf, E., et al. Allopregnanolone and pregnanolone are produced by the human corpus luteum. Mol Cel Endocrinol, 2005, 239, p. 37-44.
25. Parizek, A., Hill, M., Kancheva, M., et al. Neuroactive pregnanolone isomers during pregnancy. J Clin Endocrinol Metab, 2005, 90, p. 395-403.
26. Pearson Murphy, BE., Allison, CM. Determination of progesterone and some of its neuroactive ring A-reduced metabolites in human serum. J Steroid Biochem Mol Biol, 2000, 74, p. 137-142.
27. Petraglia, F., Florio, P., Nappi, C., et al. Peptide signaling in human placenta and membranes: autocrine, paracrine, and endocrine mechanisms. Endocr Rev, 1996, 17, p. 156-186.
28. Putnam, CD., Brann, DW., Kolbeck, RC., et al. Inhibition of uterine contractility by progesterone and progesterone metabolites: mediation by progesterone and gamma amino butyric acidA receptor systems. Biol Reprod, 1991, 45, p. 266-272.
29. Saitoh, H., Hirato, K., Tahara, R., et al. Enhancement of human amniotic phospholipase A2 activity by steroid-sulphate derived from the foeto-placental unit. Acta Endocrinol (Copenh), 1984, 107, p. 420-424.
30. Sheehan, PM., Rice, GE., Moses, EK., et al. 5beta-dihydroprogesterone and steroid 5 beta-reductase decrease in association with human parturition at term. Mol Hum Reprod, 2005, 11, p. 495-501.
31. Schreiber, V. Neuropeptides and neurosteroids. Čas Lék čes, 1980, 119, p.656-659.
32. Schumacher, M., Akwa, Y., Guennoun, R., et al. Steroid synthesis and metabolism in the nervous system: trophic and protective effects. J Neurocytol, 2000, 29, p. 307-326.
33. Schumacher, M., Weill-Engerer, S., Liere, P., et al. Steroid hormones and neurosteroids in normal and pathological aging of the nervous system. Prog Neurobiol, 2003, 71, p. 3-29.
34. Sirrianni, R., Mayhew, BA., Carr, BR., et al. Corticotropin-releasing hormone (CRH) and urocortin act through type 1 CRH receptors to stimulate dehydroepiandrosterone sulfate production in human fetal adrenal cells. J Clin Endocrinol Metab, 2005, 90, p. 5393-5400.
35. Sirrianni, R., Rehman, KS., Carr, BR., et al. Corticotropin-releasing hormone directly stimulates cortisol and the cortisol biosynthetic pathway in human fetal adrenal cells. J Clin Endocrinol Metab, 2005, 90, p. 279-285.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2010 Issue 1-
All articles in this issue
- Screening of cervical cancer – theoretical background
- Screening of cervical cancer – update
- Non-steroidal anti-inflammatory drugs in pregnancy
- Abdominal obesity
- Delivery, and anal incontinence later in life
- Progesterone neuroactive metabolites in human pregnancy
- Birth defects in births in the Czech Republic regions in 1994 - 2007
- Prevention of early-onset neonatal group B streptococcal infection: neonatal outcome after introduction of national screening guideline
- Registry of the urogynaecologic procedures involving implant in the Czech Republic during the year 2007
- Primary sebaceous carcinoma of the breast; three casuistic reports
-
Angiolipoleiomyóm maternice.
Kazuistika a prehľad literatúry - Doc. MUDr. Antonín Černoch and his original technical surgery modifications
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Non-steroidal anti-inflammatory drugs in pregnancy
- Progesterone neuroactive metabolites in human pregnancy
- Delivery, and anal incontinence later in life
- Abdominal obesity
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

