-
Medical journals
- Career
Nechirurgické ošetrenie peri-implatitídy pomocou mikroabrazívneho pieskovača s celkovou antibiotickou terapiou alebo bez nej
Authors: M. Štefanatný 1,2; M. Starosta 3; R. Žižka 2; J. Štefanatná 1
Authors‘ workplace: Blanc Dental Studio, Žilina 1; Stomatologická klinika, Lékařská fakulta Univerzity Palackého v Olomouci, a Fakultní nemocnice Olomouc 2; Stomatologická klinika, Univerzita Karlova, 1. lékařská fakulta, a Všeobecná fakultní nemocnice v Praze 3
Published in: Česká stomatologie / Praktické zubní lékařství, ročník 123, 2023, 4, s. 95-103
Category: Original articles
Overview
Úvod a cieľ: Peri-implantitída je závažné ochorenie postihujúce tkanivá v okolí dentálneho implantátu (DI). Dôležité postavenie v manažmente tohto ochorenia hrá nechirurgická terapia (NCHT). Jednou z efektívnych možností NCHT je mikroabrazívne pieskovanie (MAP). Cieľom tejto prospektívnej, randomizovanej kontrolovanej klinickej štúdie bolo porovnať účinnosť MAP pri NCHT peri-implantitídy v kombinácii s celkovou antibiotickou (ATB) terapiou alebo bez antibiotickej terapie.
Metodika: Súbor obsahoval 33 pacientov (15 mužov
a 18 žien) s priemerným vekom v čase prvého ošetrenia 55,4 rokov a s celkovým počtom 88 dentálnych implantátov (DI) s diagnostikovaným ochorením peri-implantátových tkanív. Pacienti boli vyšetrení a boli zaznamenané hodnoty klinických parametrov hĺbky sondáže (PD),
krvácania po sondáži (BOP) a supurácie po sondáži (SOP). Pacienti boli následne náhodne rozdelení do dvoch skupín. Prvá, testovacia skupina podstúpila ošetrenie v ATB clone a následne pokračovala v užívaní ATB po dobu siedmich dní od terapie. Druhá, kontrolná skupina podstúpila rovnakú terapiu, len bez podpornej ATB liečby. Terapia samotná bola vykonaná s Airflow plus práškom s erythritolovými kryštálmi aplikovaného pomocou MAP Perioflow® s dýzou Perioflow (EMS; Nyon, Švajčiarsko). Pacienti boli následne volaní na kontrolné vyšetrenie za 1, 3, 6, 12 a 24 mesiacov po ošetrení.Výsledky: V rámci kontrolných vyšetrení došlo ako v testovacej, tak v kontrolnej skupine k výraznému zníženiu parametru PD oproti východiskovému stavu. U testovacej skupiny došlo po šiestich mesiacoch (p = 0,003) a 12 mesia-
coch (p < 0,0001) k signifikantne väčším zmenám v hodnotách PD suma než u pacientov bez ATB terapie.Záver: Zníženie hodnôt klinických parametrov (BOP, SOP, PD) je možné s použitím MAP a erythritolového prášku, a to bez ohľadu na systémové podanie ATB.
Systémové užívanie ATB ako podporná terapia pri NCHT peri-implantitídy však výrazne znižuje PD aj BOP v porovnaní so skupinou pacientov bez systémových ATB.Klíčová slova:
peri-implantitída, nechirurgická terapia, mikroabrazívny pieskovač, antibiotiká
ÚVOD
Peri-implantitída je patologický stav vyskytujúci sa v tkanivách okolo dentálneho implantátu (DI). Charakterizovaná je zápalom sliznice okolo DI a súčasne progresívnou stratou okolitej kosti [1–3]. Prevalencia peri-implantitídy na úrovni pacienta sa pohybuje od 18 do 33 % [4–10]. Hlavným dôvodom jej vzniku je nerovnováha medzi bakteriálnou záťažou a obranou hostiteľa na rozhraní suprakrestálnych mäkkých tkanív a DI, ktorá je spojená s prevažne gramnegatívnou anaeróbnou bakteriálnou mikroflórou [11]. Najvýznamnejším etiologickým faktorom vzniku a progresie ochorení peri-implantátových tkanív stále ostáva akumulácia biofilmu na povrchu DI alebo jeho protetických komponentov [2, 12, 13]. Aby sme navodili stav zdravia v tkanivách okolo DI, musí každá terapia týchto ochorení zahŕňať dekontamináciu povrchu DI a odstránenie biofilmu ako primárnej príčiny [14, 15].
Dekontaminačné postupy pozostávajú z rôznych chirurgických alebo nechirurgických výkonov, ktoré využívajú sériu rôznych zariadení, či už s mechanickou zložkou (napr. kyrety, ultrazvukové koncovky, titánové kefy alebo mikrobarazívne pieskovanie – MAP), alebo nemechanické prístupy (napr. lasery, chlórhexidín, systémové alebo lokálne ATB alebo fotodynamická terapia). Žiadny z nich však neprináša výraznejšie benefity oproti ostatným a doteraz nemáme štandardizované protokoly a postupy pri terapii peri-implantitídy [14, 16].
Nechirurgická terapia (NCHT) má v procese ošetrenia svoje miesto najmä pri ošetrení menej rozvinutých peri-implantitíd alebo tiež ako príprava pred plánovanou chirurgickou terapiou [17–19]. MAP alebo lasery sa ukázali ako veľmi efektívne v odstraňovaní biofilmu z titánových povrchov DI [18, 20–22]. S ohľadom na lepšiu finančnú dostupnosť MAP oproti laserom sú tieto populárnejšie v ambulanciách zubných lekárov. Ako samostatná terapeutická metóda však častokrát neposkytuje definitívne riešenie ochorení peri-implantátových tkanív [21, 23]. Aj z tohto dôvodu sa použitie MAP s obľubou kombinuje s ďalšou, podpornou terapiou. Antibiotiká ako doplnková terapia pri liečbe peri-implantitídy ukazujú veľmi sľubné výsledky a je popísané výraznejšie zlepšenie hodnôt klinických indexov v porovnaní s mechanickou terapiou samotnou [24–26].
Cieľom tejto prospektívnej, randomizovanej kontrolovanej klinickej štúdie bolo porovnať účinnosť MAP pri NCHT peri-implantitídy v kombinácii s celkovou antibiotickou (ATB) terapiou alebo bez nej.
METODIKA
Štúdia bola navrhnutá ako paralelná randomizovaná kontrolovaná štúdia. Metodika bola schválená etickou komisiou Lékařské fakulty Univerzity Palackého v Olomouci (No. 12/17). Získavanie pacientov, ich klinické vyšetrenia a ošetrenia boli robené v parodontologickej ambulancii Kliniky zubního lékařství Univerzity Palackého v Olomouci v období od februára 2017 do apríla 2022. Všetky klinické vyšetrenia a ošetrenia boli robené jedným zubným lekárom (M. Š.). Pred účasťou bol každý pacient podrobne poučený o postupe a podpísal formuláre informovaného súhlasu. Štúdia bola v súlade s Helsinskou deklaráciou z roku 1975, revidovanou v roku 2000.
Table 1. Vstupné demografické dáta. Tab. 1 Input demographic data. 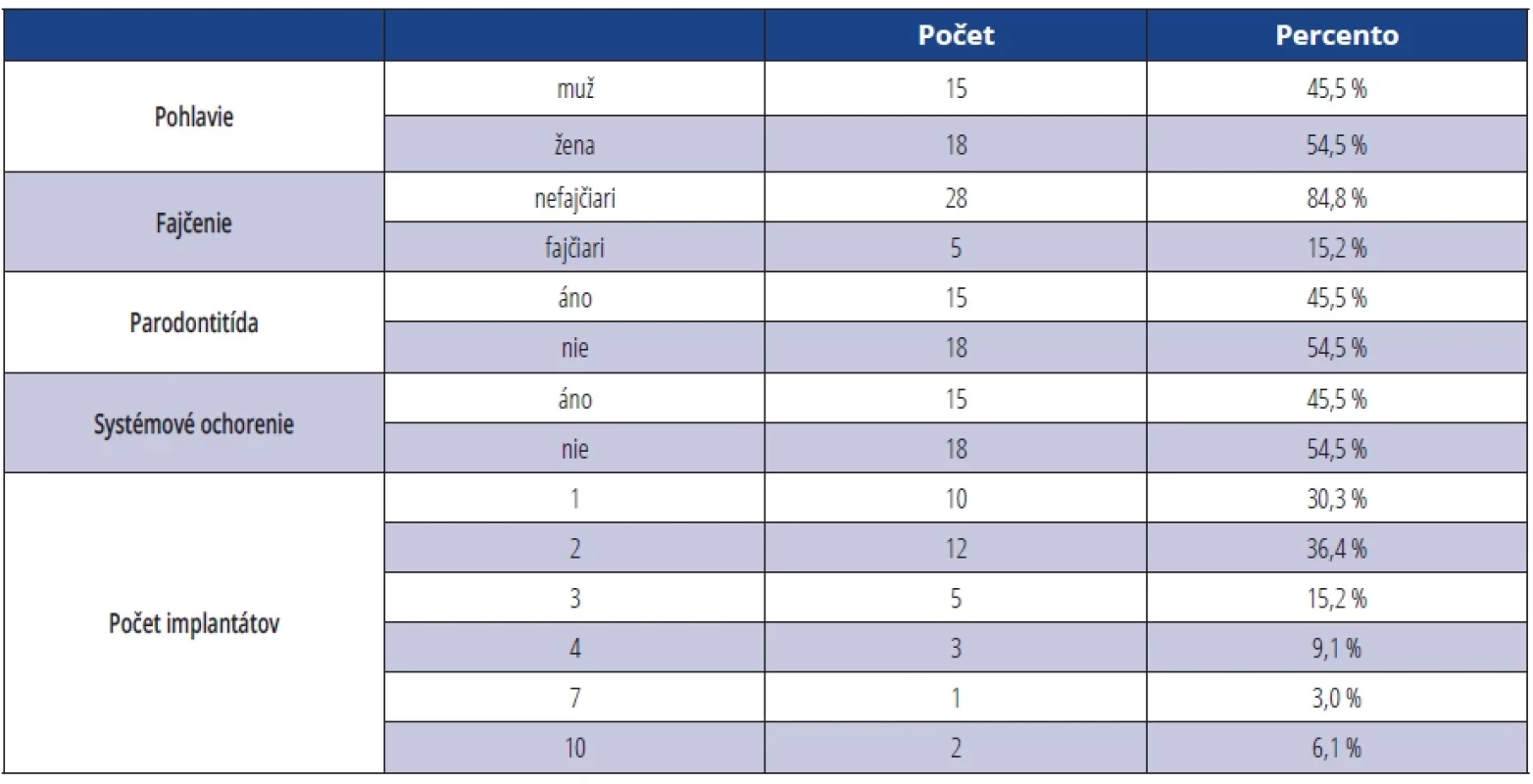
Vysvetlenie k počtu implantátov: 10 pacientov malo jeden implantát, 12 pacientov malo dva implantáty atd. Zaradenie do štúdie
Do štúdie boli zaradení účastníci, ktorí mali aspoň jeden zubný implantát s klinickými a rádiografickými príznakmi peri-implantitídy, ktoré boli definované ako hĺbka sondáže (angl. probing depth, PD) ≥ 5 mm so sprievodným krvácaním (angl. bleeding on probing, BOP) a/alebo hnisaním po sondovaní (angl. suppuration on probing, SOP).
Všetky vhodné implantáty pacientov boli zahrnuté do klinického výskumu.
Pacient bol vylúčený, ak bolo splnené jedno z nasledujúcich kritérií:
– anamnéza lokálnej rádioterapie hlavy a krku,
– gravidita a/alebo laktácia,
– užívanie ATB do troch mesiacov pred vstupným vyšetrením,
– dlhodobé užívanie protizápalových liekov,
– neschopnosť vykonávať bazálnu ústnu hygienu,
– implantáty s pohyblivosťou,
– ak bol pacient v priebehu posledných šiestich mesiacov podrobený predchádzajúcej regeneratívnej alebo resektívnej chirurgickej liečbe alebo podstúpil NCHT peri-implantitídy.
Študijná populácia
Študijná populácia pozostávala z 33 čiastočne ozubených alebo úplne bezzubých pacientov, (15 mužov a 18 žien) s priemerným vekom v čase prvého vyšetrenia 55,4 rokov, s celkovým počtom 88 DI. Pacientov sme rozdelili náhodným výberom (metóda zaslepených obálok) do dvoch skupín. Zo štatistického súboru 33 pacientov a 88 DI na začiatku štúdie sa na meranie po 12 mesiacoch dostavilo 24 pacientov s celkový počtom 60 DI. Po 24 mesiacoch to bolo len 15 pacientov s celkovým počtom 27 DI. Informácie o východiskových demografických dátach pacientov sú zhrnuté v tab. 1.
Klinické merania
Nasledujúce klinické merania boli vykonané bezprostredne pred zahájením terapie, ako aj za 6, 12 a 24 mesiacov (obr. 1). Merania boli vykonané s použitím parodontálnej sondy (PCPUNC 156, Hu-Friedy; Chicago, IL, USA):
– BOP, vyhodnotené ako prítomné, ak krvácanie bolo evidentné do 30 s po sondáži, alebo neprítomné, ak nebolo spozorované žiadne krvácanie do 30 s po sondáži;
– SOP, vyhodnotená ako prítomná, ak supurácia bola evidentná do 30 s po sondáži, alebo neprítomná, ak nebola spozorovaná žiadna supurácia do 30 s po sondáži;
– PD meraná od okraja marginálnej sliznice po dno parodontálneho vačku.
Všetky merania sa uskutočnili v šiestich polohách okolo DI: mezio-vestibulárne (mv), vestibulárne (v), disto-vestibulárne (dv), mezio-orálne (mo), orálne (o) a disto-orálne (do).
Taktiež bolo pred samotným ošetrením poznačené, či je protetická práca cementovaná, alebo skrutkovaná a či je pacient fajčiar, alebo nefajčiar. Databáza bola udržiavaná pomocou tabuľky Excel (Microsoft, Redmond, Washington, USA).
Image 1. Klinické vyšetrenie pred zahájením terapie. Fig. 1 Clinical examination before the beginning of the treatment. 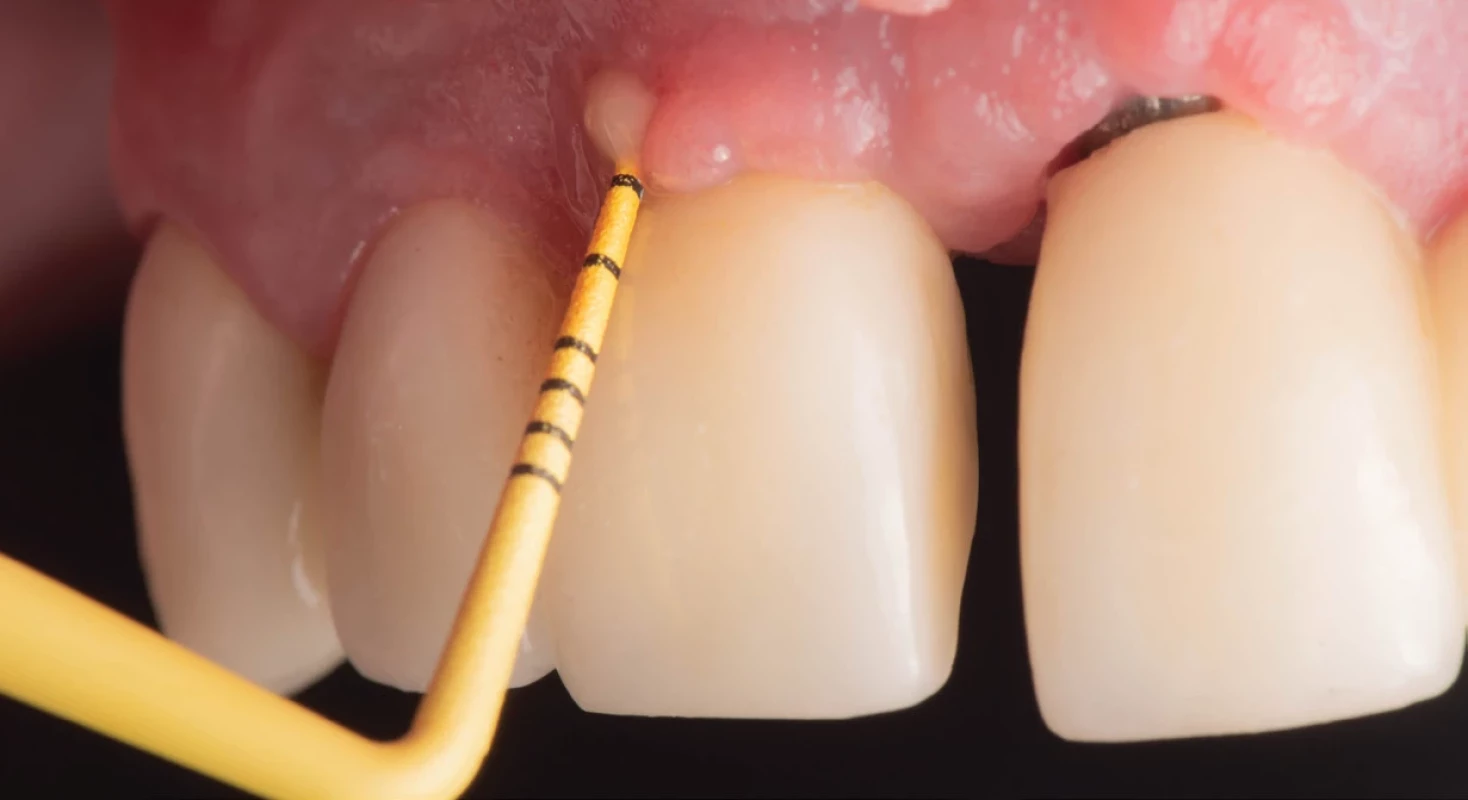
Autor obrázku/ Author of ilustration:MDDr. Michal Štefanatný Ošetrenie
U všetkých pacientov bolo ošetrenie vykonané v lokálnej anestézii (Ubistesin, 3M Deutschland GmbH). V prvej, testovacej skupine sme jednu hodinu pred terapiou pacientovi podali 250 mg metronidazolu (1× Entizol 250 mg, Pharmaceutical Works Polpharma S. A.) a 500 mg amoxicilínu s kyselinou klavulánovou (1× Amoksiklav 625 mg, Sandoz Pharmaceuticals d. d. (SVN)). Títo pacienti následne užívali danú dvojkombináciu ATB každých osem hodín po dobu siedmich dní od terapie. V druhej, kontrolnej skupine sme terapiu aplikovali bez prídavných systémových ATB.
Pred terapiou bol okraj protetickej práce vizuálne skontrolovaný na prebytky fixačného materiálu, prípadne zubného kameňa a následne odstránený pomocou ručných nástrojov. Pri samotnej terapii bol použitý MAP Perioflow® s dýzou Perioflow (EMS; Nyon, Switzerland). Airflow plus (EMS; Nyon, Switzerland) prášok s erythritolovými kryštálmi o priemernom rozmere 14 µm sme subgingiválne aplikovali po dobu 10 s na jednu plochu DI (vestibulárne – orálne – meziálne – distálne). Po zavedení trysky na dno peri-implantátového defektu sme po aktivácii pomocou šliapacieho pedála trysku vyťahovali smerom koronárnym za súčasných miernych horizontálnych pohybov v amplitúde max. 30°. Po ukončení pieskovania sme okolie DI vypláchli 0,2% roztokom CHX a aplikovali sme 1% CHX gél (Corsodyl 1% gél, Purna Pharmaceuticals N. V.) (obr. 2).
Po terapii bola pacientom spravená hygienická inštruktáž s medzizubnou kefkou a jednozväzkovou kefkou. Následne boli pacienti volaní na kontrolné vyšetrenie za jeden a tri mesiace, kde sme sledovali správne používanie pomôcok dentálnej hygieny. Na kontrolnom vyšetrení za šesť mesiacov sme prvýkrát od ošetrenia zmerali hodnoty BOP, SOP a PD a prebehla tiež hygienická inštruktáž. Tieto merania a hygienickú inštruktáž sme zopakovali ešte za 12 a 24 mesiacov po ošetrení.
Štatistická analýza
K analýze dát bol použitý software IBM SPSS Statistics verzia 23 (Armonk, NY: IBM Corp.). K posúdeniu vplyvu fajčenia, ATB terapie, parodontitídy, typu konštrukcie a prítomnosti systémového ochorenia na parameter PD suma, bol použitý Mannov-Whitneyho U test. Testy boli robené na hladine signifikancie 0,05.
Image 2. Priebeh terapie. Course of therapy. 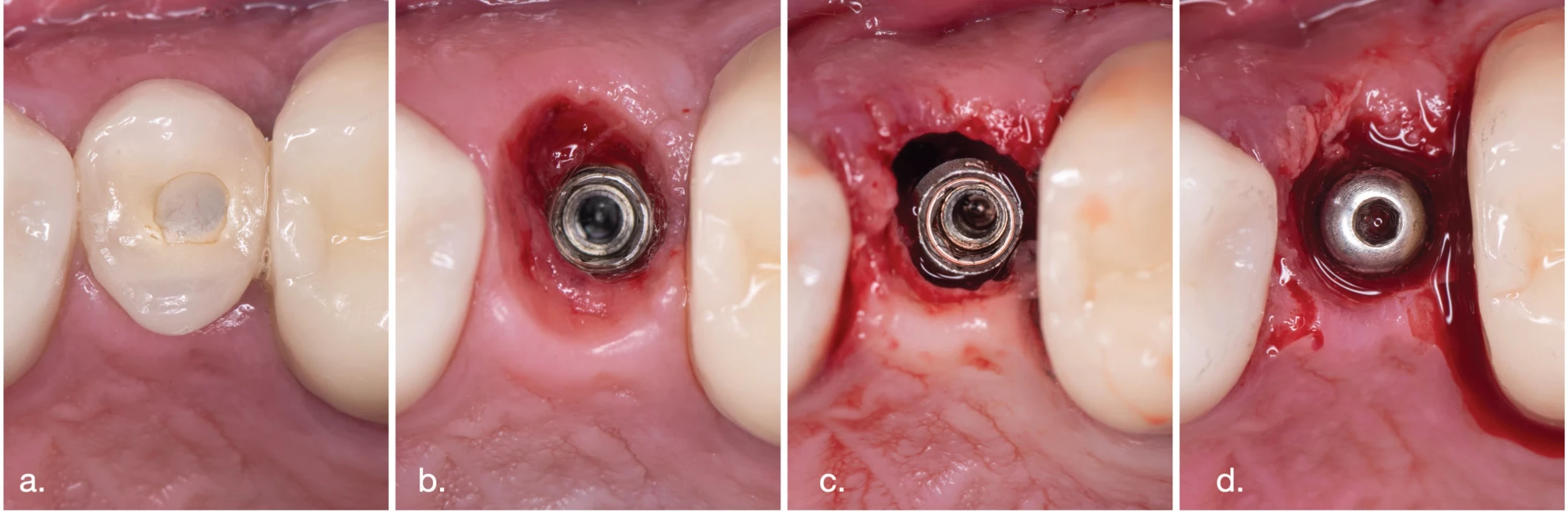
(a) Skrutkovaná práca in situ;
(b) Po sňatí protetickej práce;
(c) Po ošetrení s MAP;
(d) Po zavedení vhojovacieho valčeka.
(a) Screw retained crown in situ;
(b) After removing the crown;
(c) After using MAP;
(d) After placing gingival healing abutment.
Autor obrázku / Author of ilustration: MDDr. Michal ŠtefanatnýVÝSLEDKY
Priemerná maximálna PD u všetkých ošetrených DI pred terapiou bola 6,7 mm, po 6 a 12 mesiacoch bola 4,5 mm respektíve 3,9 mm (tab. 2). Priemerný súčet hodnôt hĺbky sondáže (PD suma) v okolí DI pred terapiou bol 31,1 mm, po 6, 12 a 24 mesiacoch tieto hodnoty klesli na 19,7 mm respektíve 17,1 mm respektíve 18,7 mm (tab. 3). Po šiestich mesiacoch, jednom roku a dvoch rokoch došlo k signifikantnému zníženiu parametra PD v porovnaní s hodnotou pred terapiou u všetkých DI (tab. 4).
V hodnotení BOP pred terapiou vyšlo 98,9 % vyšetrovaných DI s výsledkom krvácania po sondáži. Za šesť mesiacov po terapii klesol počet DI s pozitívnym BOP na 78,5 %. Najväčšia zmena oproti stavu pred terapiou bola sledovaná za 12 mesiacov, kde bolo BOP prítomné len u 40 % vyšetrených implantátov (tab. 5).
Pri hodnotení SOP sme zistili, že supuráciu po sondáži sa nám podarilo úplne eliminovať u 94,7 % ošetrených DI u pacientov, ktorí sa dostavili na kontrolné vyšetrenie po jednom roku. Na kontrole po dvoch rokoch toto číslo kleslo na 88,9 % (tab. 6).
PD suma pred terapiou bola signifikantne vyššia u fajčiarov (p < 0,0001), u pacientov s ATB terapiou a u pacientov so skrutkovanou protetickou prácou (p = 0,001). PD suma po 12 mesiacoch bola signifikantne vyššia u pacientov bez ATB terapie (p = 0,018) (tab. 7).
U pacientov s ATB terapiou došlo po šiestich mesiacoch (p = 0,003) a 12 mesiacoch (p < 0,0001) k signifikantne väčším zmenám v hodnotách PD suma než u pacientov bez ATB terapie.
Pri výskyte BOP v závislosti na sledovaných parametroch (fajčenie, parodontitis, ATB terapia, typ suprakonštrukcie, systémové ochorenia) sme zistili signifikantne vyšší výskyt BOP po šiestich mesiacoch u fajčiarov (p = 0,014) (tab. 8). U osôb bez ATB terapie bol dokázaný signifikantne vyšší výskyt BOP po 12 mesiacoch od terapie (p = 0,027) (tab. 9).
Table 2. Priemerná maximálna PD (maximálna hĺbka peri-implantátového sulku – maximum z PD). Tab. 2 Average maximum PD (maximal depth of peri-implant sulcus - maximum of PDs). 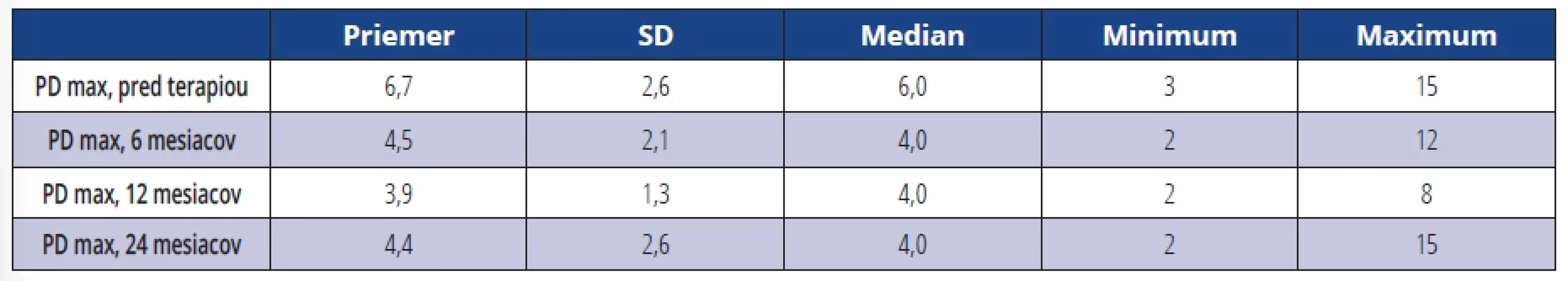
Table 3. Súčet hodnôt PD v okolí DI (suma všetkých PD). Tab. 3 Sum of PD values around DI (sum of all PDs). 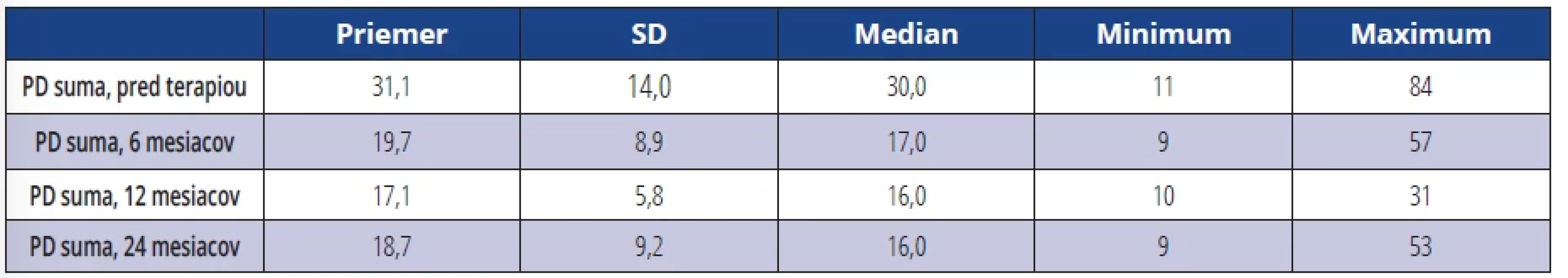
Table 4. Vyhodnotenie významnosti zmeny súčtu hodnôt PD. Tab. 4 Evaluation of the significance of the change in the PD values sum. 
Table 5. BOP pred terapiou a po terapii (BOP = prítomnosť krvácania áno/nie). Tab. 5 BOP before and after therapy (BOP = presence of bleeding yes/no). 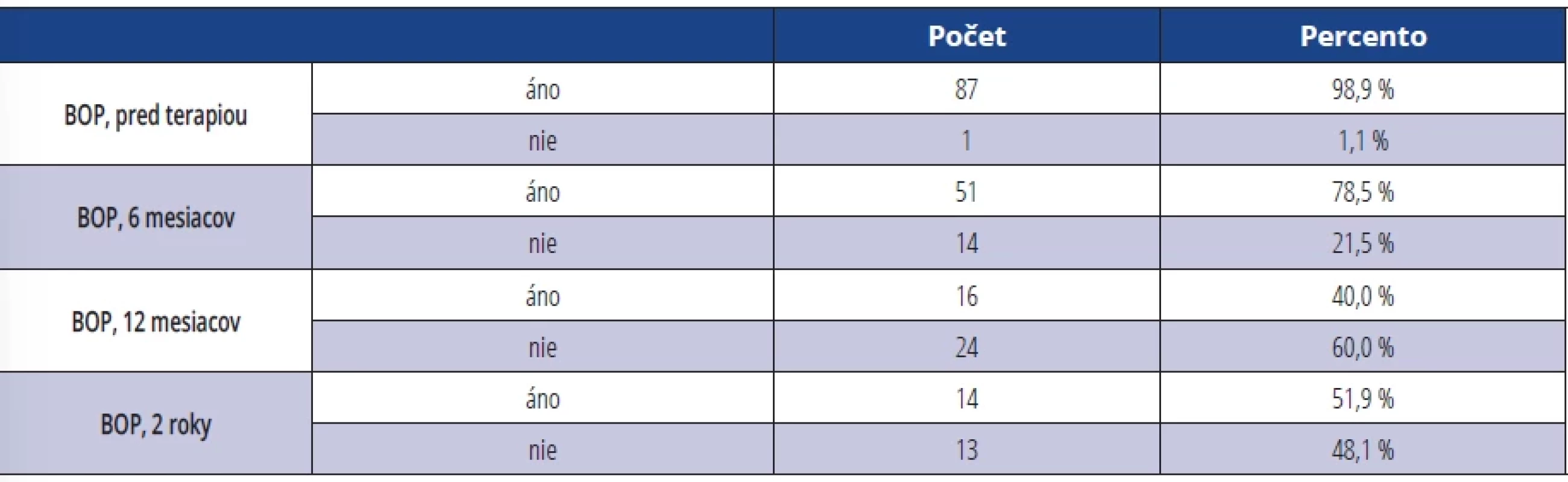
Table 6. SOP pred terapiou a po terapii (SOP = prítomnosť supurácie áno/nie). Tab. 6 SOP before therapy and after therapy (SOP = presence of suppuration yes/no). 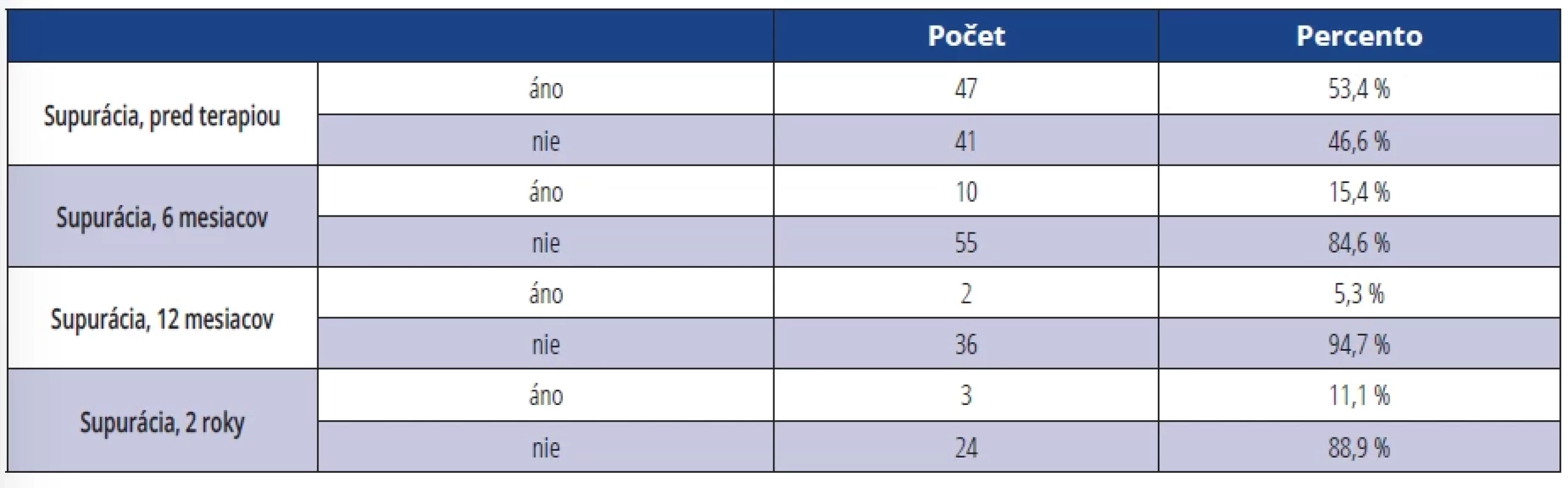
Table 7. Hodnoty signifikancie pre porovnanie jednotlivých skupín v hodnotách parametra PD suma. Tab. 7 Significance values for the comparison of individual groups in the values of the parameter PD sum. 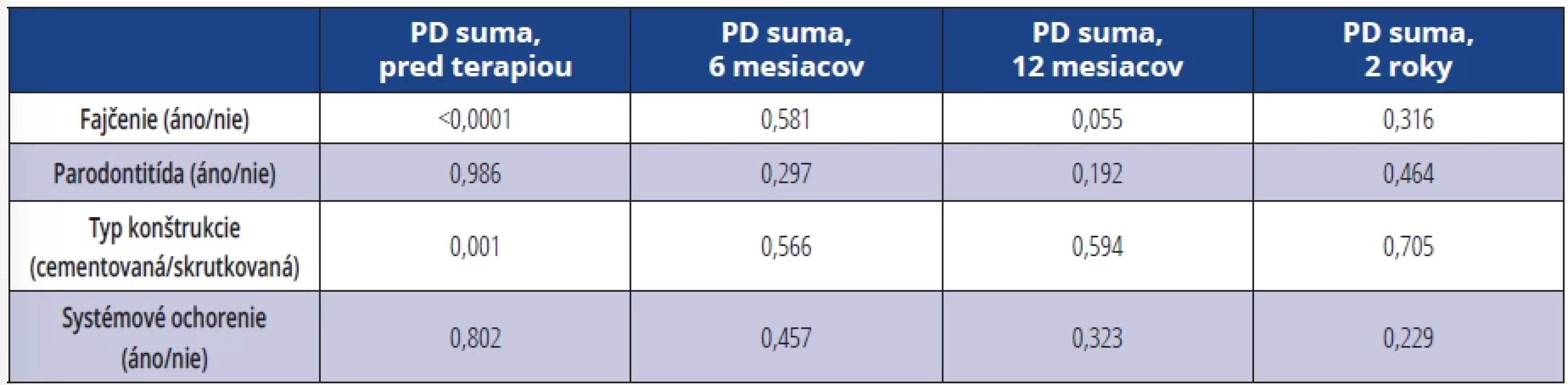
Table 8. Výskyt BOP v závislosti na sledovaných parametroch šesť mesiacov po terapii. Tab. 8 Presence of BOP depending on monitored parameters six months after the therapy. 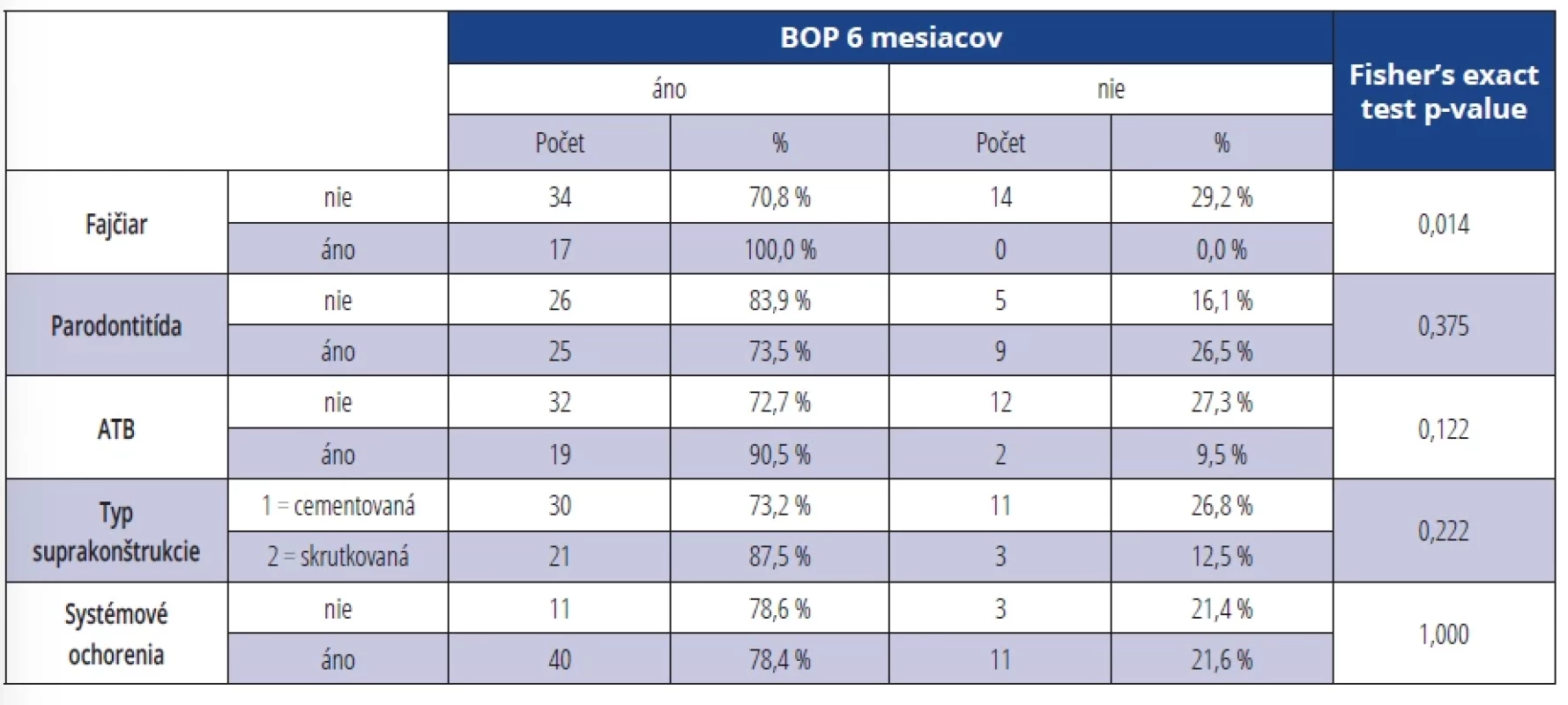
Table 9. Výskyt BOP v závislosti na sledovaných parametroch 12 mesiacov po terapii. Tab. 9 Presence of BOP depending on monitored parameters 12 months after the therapy. 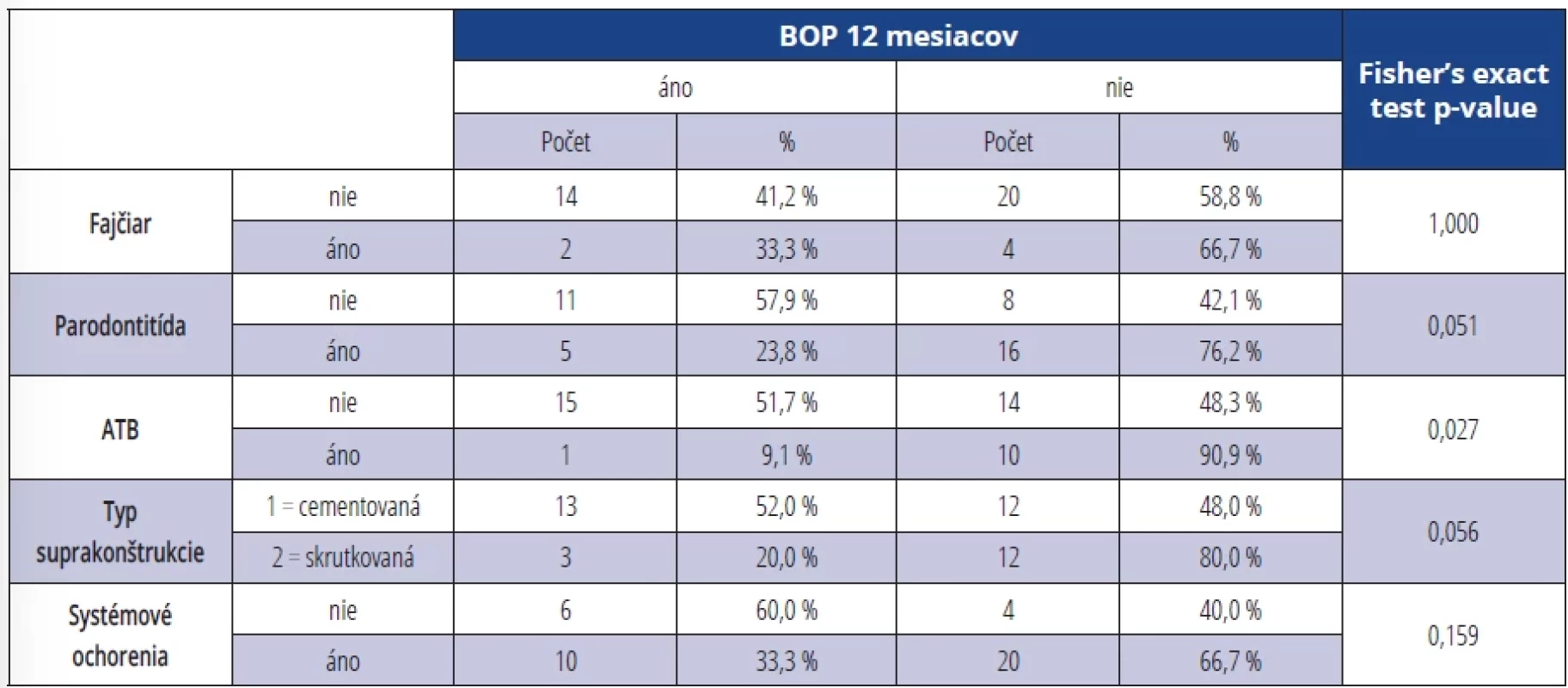
DISKUSIA
V čase začatia výskumu nebola autorovi známa žiadna štúdia, ktorá by hodnotila MAP s použitím erythritolového prášku ako monoterapiu na liečbu peri-implantitídy. V dvoch predchádzajúcich štúdiách sa hodnotila monoterapia s pomocou MAP, v oboch prípadoch bol však použitý glycínový prášok, nie erythritolový [27, 28]. Renvertovi a kol. pri hodnotení zmeny BOP pred terapiou a šiestich mesiacov po nej vyšiel rozdiel až 75 %. Zo 100 % pred terapiou na 25 % po terapii glycínovým práškom [27]. John a kol. skúmali zmenu BOP až za 12 mesiacov po iniciálnej terapii. V tomto prípade bola zmena hodnoty 41,2 % [28]. V roku 2021 vyšla aj jedna randomizovaná kontrolná štúdia, v ktorej Hentenaar a kol. porovnávali MAP s erythritolovým práškom a ošetrenie povrchu DI pomocou ultrazvuku. V jejich výsledkoch môžeme vidieť zníženie BOP z 95,7 % pred terapiou na 73,9 % za 12 mesiacov po terapii [29]. V tomto prípade je však hodnota po 12 mesiacoch kombináciou hodnôt BOP v oboch testovaných skupinách. V porovnaní s vyššie uvedenými výskumami vychádzajú naše hodnoty podobne, keď sme sa z BOP pred terapiou vo výške 98,9 % dostali za šesť mesiacov na BOP 78,5 % a po 12 mesiacoch to bolo už len 40 %. Treba však podotknúť, že aj keď bola zmena veľká, bolo to len u pacientov, ktorí sa dostavili na kontrolu po 1, 3, 6 aj 12 mesiacoch a na týchto kontrolách vždy prebehla reinštruktáž pacienta s pomôckami na dentálnu hygienu. Situácia po dvoch rokoch bola z pohľadu tohto indexu mierne zhoršená (51,9 %), čo môže byť dôsledok toho, že pacienti neboli už volaní na recall tak často a mohlo dôjsť k poľaveniu v domácej starostlivosti o DI. Malý nedostatok nášho merania BOP môžeme vidieť aj v tom, že sme hodnotili len či miesto krváca alebo nekrváca. Karlsson a kol. však ukázali, že môže byť rozdiel v tom, či je krvácanie na ≥ 1 alebo ≥ 3 zo 4 hodnotených miest okolo DI [30]. Čím viac miest je totiž hodnotených pozitívne pri vyšetrení BOP, tým je vyššie riziko progresie peri-implantačnej mukozitídy do peri-implantitídy. V závislosti na sledovaných parametroch sme zistili, že u fajčiarov nedošlo k tak výraznému poklesu BOP po šiestich mesiacoch ako u nefajčiarov. To je v korelácii s inými štúdiami, ktoré poukazujú na fajčenie ako jeden z rizikových faktorov vzniku peri-implantačnej mukozitídy [31, 32]. Taktiež v kontrolnej skupine osôb bez celkovej ATB terapie bol signifikantne vyšší výskyt BOP po 12 mesiacoch.
Pri hodnotení parametru PD suma sme zistili, že došlo k signifikantnému zmenšeniu tohto parametru po šiestich aj 12 mesiacov od terapie v celkovej vzorke pacientov. Môžeme teda povedať, že NCHT pomáha pri redukcii PD. K podobným záverom dospeli viacerí autori [18, 33, 34]. Z pohľadu hodnotených skupín pacientov môžeme povedať, že u fajčiarov došlo po šiestich a 12 mesiacoch k signifikantne väčším zmenám v hodnote PD suma ako u nefajčiarov, čo je dané z veľkej miery tým, že u fajčiarov boli vyššie hodnoty PD už pred terapiou a po nej teda došlo k výraznejšej zmene ako u nefajčiarov. V našej vzorke pacientov teda môžeme fajčenie považovať za rizikový faktor zvyšujúci hodnotu PD v okolí DI. Po terapii sa však nedokázalo, že by fajčenie malo negatívny vplyv na hojenie a výsledky boli porovnateľné s nefajčiarmi po šiestich aj 12 mesiacoch. U pacientov s ATB terapiou došlo po šiestich mesiacoch (p = 0,003) a 12 mesiacoch (p < 0,0001) k signifikantne väčším zmenám v hodnotách PD suma než u pacientov bez ATB terapie. Podobne ako ukázali Blanco a kol., vo všetkých meraných parametroch došlo v skupine s ATB k výraznejším zmenám [25]. U pacientov so skrutkovanou konštrukciou došlo po dvoch rokoch k výraznejšej redukcii PD suma ako u pacientov s konštrukciou cementovanou. Tento fakt je pravdepodobne daný tým, že viacerým týmto pacientom sme suprakonštrukcie pri terapii sňali a mali sme teda lepší prístup pri ošetrení DI (obr. 3).
Pri interpretácii výsledkov tejto štúdie by sa mali zohľadniť nasledujúce obmedzenia. Po prvé, počas tejto štúdie nebola odstránená väčšina suprakonštrukcií, čo mohlo viesť k nedostatočnej dostupnosti vyšetrenia peri-implantátových tkanív a neadekvátnym klinickým meraniam. Okrem toho sťažený prístup (napr. v dôsledku nadmerne tvarovaných suprakonštrukcií) mohol skomplikovať zavedenie subgingiválnej koncovky MAP, a teda viesť k nedostatočnému terapeutickému účinku. Po druhé, tejto štúdii môže chýbať skutočná kontrolná terapia. Neporovnávali sme totiž naše výsledky s mechanickou dekontamináciou povrchu DI pomocou ultrazvuku alebo kyriet, čo sa stále považuje za primárny prostriedok v NCHT peri-implantitídy [35]. V súčasnosti sa však žiadna metóda NCHT nepovažuje za lepšiu od ostatných. Preto bol zvolený dizajn štúdie, v ktorom sa porovnávalo použitie MAP s ATB alebo bez systémových ATB. To preto, aby sme analyzovali, či by vyššie uvedené liečebné zásahy mohli viesť k určeniu kvalitnejšej štandardnej terapie. Na potreby tejto štúdie nám však tieto merania stačili, pretože diagnostiku sme doplnili o namerané hodnoty PD. Po tretie, zahrnutí pacienti vykazovali veľké rozdiely v závažnosti peri-implantitídy (od miernej až po ťažkú) a tiež u nich bola značná variabilita v motivácii podstúpiť terapiu a dodržiavať naplánované kontroly. Takáto heterogénna skupina pacientov a implantátov síce môže predstavovať skutočný prierez spoločnosti, veľmi však sťažuje porovnanie účinku terapií v špecifických podskupinách pacientov. Napríklad fajčiari oproti nefajčiarom alebo pacienti s ľahkou a ťažkou peri-implantitídou. Na to, aby sme mohli vyvodiť skutočne relevantné závery, by sme potrebovali oveľa väčšiu vzorku pacientov s takouto heterogenitou. Na vyhodnotenie účinku terapie v týchto špecifických skupinách prípadov sú potrebné ďalšie štúdie.
Image 3. Porovnanie štyroch intraorálnych röntgenových snímok v horizonte dvoch rokov. Fig. 3 Comparison of four intraoral X-rays in two-years period. 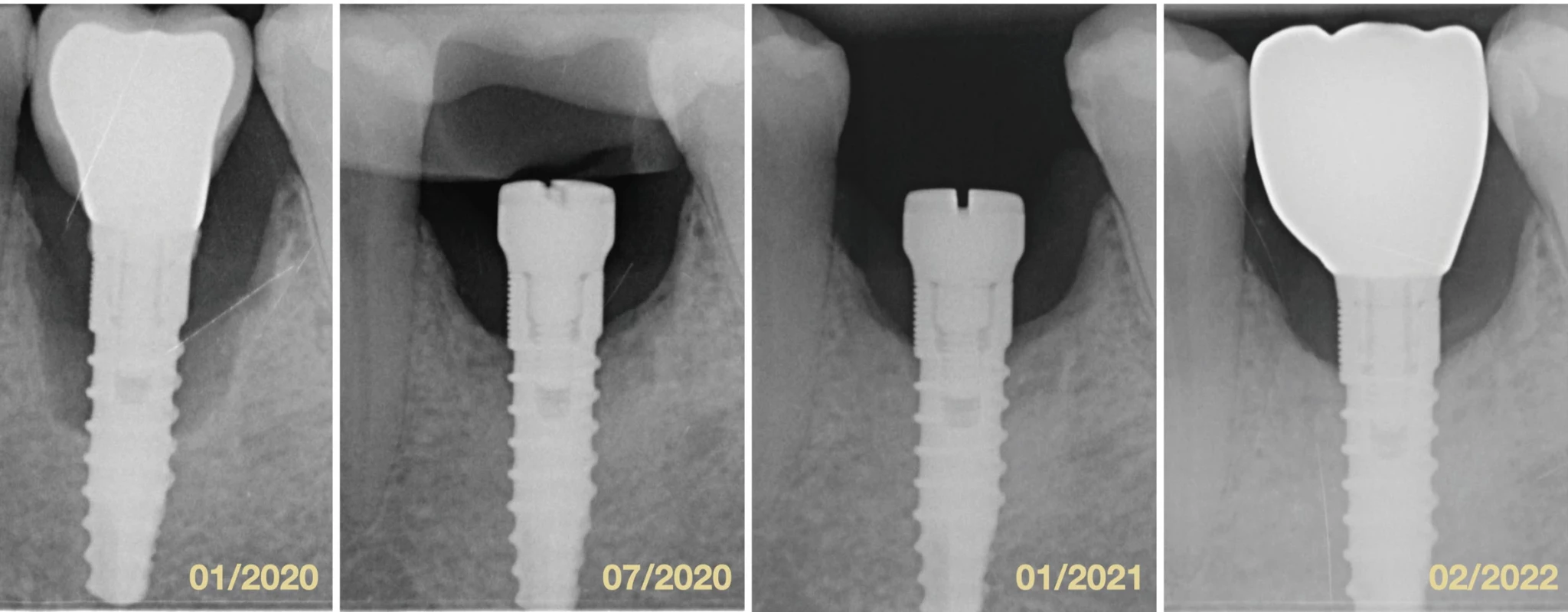
Autor obrázku / Author of ilustration: MDDr. Michal Štefanatný ZÁVER
Zníženie hodnôt klinických parametrov (BOP, SOP, PD) je možné s použitím MAP a erythritolového prášku, a to bez ohľadu na systémové podanie ATB. Zistili sme ale, že systémové užívanie ATB ako podporná terapia pri NCHT peri-implantitídy výrazne znižuje PD aj BOP v porovnaní so skupinou pacientov bez systémových ATB. Pri použití terapeutických postupov v kombinácii so systémovými ATB by však lekári mali brať do úvahy rezistenciu baktérií.
MDDr. Michal Štefanatný
Blanc Dental Studio
Obchodná 8985
010 08 Žilina
Slovensko
e-mail: michal.stefanatny@gmail.com
Sources
1. Berglundh T, Armitage G, Araujo MG, Avila-Ortiz G, Blanco J, Camargo PM, et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 2018; 89(S1): 313–318.
2. Schwarz F, Derks J, Monje A, Wang HL. Peri-implantitis. J Periodontol. 2018; 89(S1): 267–290.
3. Lindhe J, Meyle J. Peri-implant diseases: Consensus report of the Sixth European Workshop on Periodontology. J Clin Periodontol. 2008; 35(S8): 282–285.
4. Atieh MA, Alsabeeha NHM, Faggion Jr. CM, Duncan WJ. The frequency of peri-implant diseases: A systematic review and meta-analysis. J Periodontol. 2013; 84(11): 1586–1598.
5. Derks J, Tomasi C. Peri-implant health and disease. A systematic review of current epidemiology. J Clin Periodontol. 2015; 42(16): 158–171.
6. Lee CT, Huang YW, Zhu L, Weltman R. Prevalences of peri-implantitis and peri-implant mucositis: systematic review and meta-analysis. J Dent. 2017; 62(1): 1–12.
7. Doornewaard R, Jacquet W, Cosyn J, De Bruyn H. How do peri-implant biologic parameters correspond with implant survival and peri-implantitis? A critical review. Clin Oral Implants Res. 2018; 29(S18): 100–123.
8. Hashim D, Cionca N, Combescure C, Mombelli A. The diagnosis of peri-implantitis: A systematic review on the predictive value of bleeding on probing. Clin Oral Implants Res. 2018; 29(S16): 276–293.
9. Rodrigo D, Sanz-Sánchez I, Figuero E, Llodrá JC, Bravo M, Caffesse RG, et al. Prevalence and risk indicators of peri-implant diseases in Spain. J Clin Periodontol. 2018; 45(12): 1510–1520.
10. Cosgarea R, Sculean A, Shibli JA, Salvi GE. Prevalence of peri-implant diseases – a critical review on the current evidence. Braz Oral Res. 2019; 33(S1): e063.
11. Mombelli A, Lang NP. The diagnosis and treatment of peri-implantitis. Periodontol 2000. 1998; 17 : 63–76.
12. Štefanatný M, Starosta M, Žižka R, Štefanatná J, Belák Š. Peri-implantitída: klasifikácia, etiológia a prevencia. Čes stomatol Prakt zubní lék. 2023; 123(1): 19-28.
13. Pontoriero R, Tonelli MP, Carnevale G, Mombelli A, Nyman SR, Lang NP. Experimentally induced peri-implant mucositis. A clinical study in humans. Clin Oral Implants Res. 1994; 5(4): 254–259.
14. Esposito M, Grusovin MG, Worthington HV. Treatment of peri-implantitis: what interventions are effective? A Cochrane systematic review. Eur J Oral Implantol. 2012; (S5): S21-S41.
15. Heitz-Mayfield LJA, Mombelli A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 2014; (S29): 325–345.
16. Mahato N, Wu X, Wang L. Management of peri-implantitis: a systematic review, 2010–2015. Springerplus. 2016; 5 : 105.
17. Suárez-López Del Amo F, Yu SH, Wang HL. Non-surgical therapy for peri-implant diseases: a systematic review. J Oral Maxillofac Res. 2016; 7(3): e13.
18. Muthukuru M, Zainvi A, Esplugues EO, Flemmig TF. Non-surgical therapy for the management of peri-implantitis: a systematic review. Clin Oral Implants Res. 2012; 23(S6): 77–83.
19. Yan M, Liu M, Wang M, Yin F, Xia H. The effects of Er:YAG on the treatment of peri-implantitis: a meta-analysis of randomized controlled trials. Lasers Med Sci. 2015; 30(7): 1843–1853.
20. Sahm N, Becker J, Santel T, Schwarz F. Non-surgical treatment of peri-implantitis using an air-abrasive device or mechanical debridement and local application of chlorhexidine: a prospective, randomized, controlled clinical study. J Clin Periodontol. 2011; 38(9): 872–878.
21. Schwarz F, Becker K, Renvert S. Efficacy of air polishing for the non-surgical treatment of peri-implant diseases: a systematic review. J Clin Periodontol. 2015; 42(10): 951–959.
22. Renvert S, Lindahl C, Roos Jansåker AM, Persson GR. Treatment of peri-implantitis using an Er:YAG laser or an air-abrasive device: a randomized clinical trial. J Clin Periodontol. 2011; 38(1): 65–73.
23. Moharrami M, Perrotti V, Iaculli F, Love RM, Quaranta A. Effects of air abrasive decontamination on titanium surfaces: A systematic review of in vitro studies. Clin Implant Dent Relat Res. 2019; 21(2): 398–421.
24. Grusovin MG, Pispero A, Del Fabbro M, Sangiorgi M, Simion M, Stefanini M, et al. Antibiotics as adjunctive therapy in the non-surgical treatment of peri-implantitis: A systematic review and meta-analysis. Antibiot (Basel, Switzerland). 2022;
11(12): 1766.25. Blanco C, Pico A, Dopico J, Gándara P, Blanco J, Liñares A. Adjunctive benefits of systemic metronidazole on non-surgical treatment of peri-implantitis. A randomized placebo-controlled clinical trial. J Clin Periodontol. 2022; 49(1): 15–27.
26. Faggion CMJ, Listl S, Frühauf N, Chang HJ, Tu YK. A systematic review and Bayesian network meta-analysis of randomized clinical trials on non-surgical treatments for peri-implantitis.
J Clin Periodontol. 2014; 41(10): 1015–1025.27. Renvert S, Lindahl C, Roos Jansåker AM, Persson GR. Treatment of peri-implantitis using an Er:YAG laser or an air-abrasive device: a randomized clinical trial. J Clin Periodontol. 2011; 38(1): 65–73.
28. John G, Sahm N, Becker J, Schwarz F. Nonsurgical treatment of peri-implantitis using an air-abrasive device or mechanical debridement and local application of chlorhexidine. Twelve-month follow-up of a prospective, randomized, controlled clinical study. Clin Oral Investig. 2015; 19(8): 1807–1814.
29. Hentenaar DFM, De Waal YCM, Stewart RE, Van Winkelhoff AJ, Meijer HJA, Raghoebar GM. Erythritol airpolishing in the non-surgical treatment of peri-implantitis: A randomized controlled trial. Clin Oral Implants Res. 2021; 32(7): 840–852.
30. Karlsson K, Derks J, Håkansson J, Wennström JL, Petzold M, Berglundh T. Interventions for peri-implantitis and their effects on further bone loss: A retrospective analysis of a registry-based cohort. J Clin Periodontol. 2019; 46(8): 872–879.
31. Roos-Jansåker AM, Renvert H, Lindahl C, Renvert S. Nine - to fourteen-year follow-up of implant treatment. Part III: Factors associated with peri-implant lesions. J Clin Periodontol. 2006; 33(4): 296–301.
32. Heitz-Mayfield LJA. Peri-implant diseases: diagnosis and risk indicators. J Clin Periodontol. 2008; 35(8): 292–304.
33. Renvert S, Roos-Jansåker AM, Claffey N. Non-surgical treatment of peri-implant mucositis and peri-implantitis: a literature review. J Clin Periodontol. 2008; 35(S8): 305–315.
34. Cosgarea R, Roccuzzo A, Jepsen K, Sculean A, Jepsen S, Salvi GE. Efficacy of mechanical/physical approaches for implant surface decontamination in non-surgical submarginal instrumentation of peri-implantitis. A systematic review. J Clin Periodontol. 2022; doi: 10.1111/jcpe.13762
35. Renvert S, Hirooka H, Polyzois I, Kelekis-Cholakis A, Wang HL. Diagnosis and non-surgical treatment of peri-implant diseases and maintenance care of patients with dental implants – Consensus report of working group 3. Int Dent J. 2019; 69 Suppl 2(S2): 12–17.
Labels
Maxillofacial surgery Orthodontics Dental medicine
Article was published inCzech Dental Journal

2023 Issue 4-
All articles in this issue
- Editorial
- K životnímu jubileu MUDr. Věry Bartákové, CSc.
- Poděkování recenzentům
- Non-surgical treatment of peri-implantitis using air abrasive device with or without adjunctive use of systematic antibiotics
- Ohlédnutí za kongresem Pražské dentální dny 2023
- XXVII. Sazamův den
- Methodological approaches for the bacteriome analysis of the root canal system of a tooth affected by apical periodontitis
- Podmínky pro publikaci v časopisu ČSPZL
- Rejstřík ČSPZL 2023
- Czech Dental Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Methodological approaches for the bacteriome analysis of the root canal system of a tooth affected by apical periodontitis
- K životnímu jubileu MUDr. Věry Bartákové, CSc.
- Non-surgical treatment of peri-implantitis using air abrasive device with or without adjunctive use of systematic antibiotics
- XXVII. Sazamův den
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

