-
Medical journals
- Career
Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť I
Authors: Ladislav Habala; Jindra Valentová
Published in: Čes. slov. Farm., 2018; 67, 182-191
Category: Review Article
Overview
Kovy a ich zlúčeniny boli využívané v medicíne od úsvitu dejín a v súčasnosti predstavujú perspektívnu oblasť vývoja nových druhov liečiv. Všetky kovy (resp. ich zlúčeniny) vykazujú rôzne druhy biologickej aktivity. Koordinačné zlúčeniny majú v porovnaní s liečivami na báze organických molekúl množstvo unikátnych vlastností, súvisiacich s prítomnosťou centrálneho atómu kovu a so špecifickými možnosťami usporiadania ligandov okolo tohoto centrálneho atómu. Tento stručný prehľad má za cieľ poskytnúť základnú orientáciu v tejto problematike pre farmaceutov i chemikov, ako aj ostatných záujemcov o danú oblasť z radov odbornej verejnosti. Prvá časť prehľadu sa zaoberá historickým vývojom a aktuálnym využitím zlúčenín kovov v terapii infekčných ochorení, ako aj princípmi použitia komplexov kovov v diagnostike a ich súčasným významom, predovšetkým v moderných tomografických metódach.
Klíčová slova:
bioanorganická chémia – metalofarmaká – komplexy kovov – chemoterapia
Úvod
Bioanorganická chémia je interdisciplinárny vedný odbor na rozhraní anorganickej chémie a biochémie1–3). V súčasnosti je známych približne 26 prvkov, ktoré sú súčasťou živých organizmov a sú nevyhnutné pre ich existenciu. Okrem prvkov tvoriacich základné organické molekuly k nim patria aj anorganické prvky (kovy aj nekovy), z ktorých väčšina sa vyskytuje len v malom množstve, sú však nevyhnutné (esenciálne) pre fungovanie týchto organizmov. Mnohé z nich sú kovy a sú súčasťou biologických katalyzátorov – enzýmov, pričom majú zásadný význam pre ich katalytickú funkciu. Kovy však môžu byť pre organizmus aj toxické, najmä pri vyšších koncentráciách. Nedostatok, ale aj nadbytok týchto prvkov môže teda mať negatívny vplyv na organizmus4, 5). V prípade nedostatku esenciálnych prvkov je teda nevyhnutné zabezpečiť ich prísun formou výživových doplnkov. Napr. nedostatočný prísun železa v potrave môže viesť až k príznakom anémie a je potrebné doplniť tento prvok podávaním železa formou jeho komplexných zlúčenín. Naopak, nadbytok železa môže viesť k jeho ukladaniu v tkanivách (napr. v pľúcach) a vzniku ochorení (sideróza, resp. hemochromatóza).
Medicínska anorganická chémia sa zaoberá štúdiom zlúčenín esenciálnych a neesenciálnych prvkov s využitím v diagnostike a terapii chorôb6–8). Pokiaľ v začiatkoch farmácie jednoznačne dominovali liečivá na báze anorganických zlúčenín, neskôr dochádza k ich nahrádzaniu organickými molekulami. V súčasnosti je však možné pozorovať obnovený záujem o terapiu komplexmi kovov (metalofarmaká), vzhľadom k ich unikátnym chemickým a farmakologickým vlastnostiam, odlišným od čisto organických zlúčenín. Metalofarmaká pritom nachádzajú uplatnenie ako v terapii najrozličnejších ochorení (najmä v chemoterapii), ako aj v moderných diagnostických technikách.
Kovy a ich zlúčeniny boli medzi prvými látkami aplikovanými ako liečivá. Antimikróbna aktivita striebra či medi našla využitie už v staroveku (vide infra)9). Železo vo forme oxidu železitého (či už ako minerál hematit alebo ako hrdza) bolo známe pre svoju adstringentnú aktivitu. Grécky lekár Hippokratés aplikoval soli železa na zastavenie krvácania. V roku 1681 identifikoval anglický lekár Thomas Sydenham nedostatok železa ako príčinu „chlorózy“ (anémie spôsobenej nedostatočným prísunom tohto kovu) a ako terapiu navrhol použitie železných pilín rozpustených vo víne10). V 19. storočí bol v liečbe anémie zavedený síran železnatý (francúzsky lekár Pierre Blaud) a neskôr aj iné soli dvojmocného železa. Použitie kovového zlata v terapii siaha až do staroveku, hoci po dlhú dobu bolo ovplyvnené magickými predstavami. Od 14. storočia sa presadzuje „pitné zlato“ (aurum potabile), vodný roztok chloridu zlatitého, ako liečivo proti horúčke, epilepsii, depresii, palpitáciám a mnohým ďalším stavom11). Na prelome 19. a 20. storočia zaznamenalo použitie zlata krátky rozkvet v terapii tuberkulózy, po tom ako bol Robertom Kochom objavený tuberkulostatický účinok kyanidových komplexov zlata in vitro12). Napriek neuspokojivým in vivo testom sa antituberkulózna terapia zlúčeninami zlata (napr. zlatný komplex kyseliny 4-amino-2-sulfanylbenzénkarboxylo - vej, Krysolgan) udržala až do 30. rokov 20. storočia. V modernej medicíne sa komplexy zlata presadili najmä v liečbe zápalových ochorení, akým je napr. reumatoidná artritída.
V súčasnosti sú kovy vzhľadom k ich pestrému spektru biologickej aktivity predmetom širokého vedeckého záujmu napriek tomu, že zatiaľ len málo zlúčenín našlo cestu do klinickej praxe. Potenciálne možnosti nasadenia zlúčenín kovov (metalofarmák) vo farmácii sú rôznorodé, patria k nim také odlišné oblasti ako terapia rakoviny, mikrobiálnych či vírusových infekčných chorôb, diabetes a rôznych zápalových ochorení. K týmto liečivám sa radí aj cisplatina (cis-diammin-dichloridoplatnatý komplex), v súčasnosti jedno z najúspešnejších metalofarmák, patriace k „zlatému štandardu“ v oblasti terapie rakoviny. Vzhľadom k tomu, že zlúčeniny všetkých kovov vykazujú v tej či onej miere rozličné druhy biologickej aktivity, sa tento prehľad obmedzuje na typické príklady pre jednotlivé typy biologickej aktivity, ako aj metalofarmaká etablované v klinickej praxi. Popri stručnom náčrte historického vývoja bioanorganickej chémie (oblasti metalofarmácie) sa zameriava na súčasný stav využitia komplexov kovov v medicíne a farmácii, ako aj na aktuálne smery ďalšieho výskumu. Pre detailnejšie informácie odkazujeme čitateľa na podrobné štúdie, pričom sme uprednostnili prehľadnú literatúru so širším záberom oproti úzko špecializovaným štúdiám.
Komplexy kovov v terapii infekčných ochorení
Zlúčeniny viacerých kovov (ako sú meď a striebro) či polokovov (napr. arzén, antimón) sú už v nízkych koncentráciách mimoriadne aktívne voči baktériám a iným mikróbom (biocídna aktivita)13). Hoci boli tieto ich vlastnosti známe už v staroveku, ich uplatnenie v terapii bolo sporadické a čisto empirické, bez znalosti podstaty ochorení a princípov ich liečby. Prvé moderné antimikróbne chemoterapeutiká boli pripravené až na začiatku 20. storočia po identifikácii mikróbov ako pôvodcov infekčných chorôb. Mnohé z týchto aplikácií majú dnes už iba historický význam, avšak v poslednom období dochádza k renesancii záujmu o antimikróbnu chemoterapiu komplexnými zlúčeninami kovov. Takéto zlúčeniny majú viaceré výhody oproti etablovaným, čisto organickým liečivám. Ich aktivita je často zachovaná aj v prípade multirezistentných baktérií, keďže sú schopné rozrušiť bakteriálne biofilmy, spájané so vznikom rezistencie u baktérií. Mechanizmus biologického účinku iónov kovov je komplexný, zahrňujúci tvorbu radikálov (reaktívnych foriem kyslíka), inhibíciu bunkových enzýmov väzbou na špecifické aminokyselinové zvyšky, narušenie normálnej funkcie bunkovej membrány v súvislosti so zvýšenou peroxidáciou lipidov a pod.14)
Ortuť
Ortuť a jej zlúčeniny boli známe už v staroveku, predovšetkým vo forme sulfidu ortutnatého (minerál cinabarit) z najväčšieho náleziska v Almadéne v dnešnom Španielsku9). Zároveň boli už v tomto období rozpoznané ich toxické účinky na živé organizmy, preto sa snahy o ich využitie v medicíne spočiatku nestretli s výraznou odozvou (grécky lekár Galén, po mnoho storočí autoritatívny zdroj lekárskych znalostí, odrádza od použitia ortuti vo farmácii vzhľadom k jej nežiaducim účinkom)15). V prostredí arabského stredoveku boli známe prípravky obsahujúce ortuť ako emulziu v živočíšnych tukoch, s použitím ako liečivé masti pri kožných prípadne očných infekciách (známe napr. zo spisov jedného z klasikov stredovekej medicíny, perzského lekára Avicennu). K rozsiahlejšiemu nástupu ortuti v terapii dochádza až na prahu novoveku, v súvislosti s epidémiou syfilisu, sexuálne prenosnej choroby spôsobenej baktériou Treponema pallidum. Jedným z hlavných priekopníkov tejto terapie bol švajčiarsky lekár a alchymista Paracelsus. Za týmto účelom bola ortuť najčastejšie aplikovaná externe v podobe mastí (emulzia elementárnej ortuti), neskôr aj interne ako zriedený roztok chloridu ortutnatého. Napriek tomu, že vzhľadom k svojej značnej toxicite bolo využitie ortute v terapii od počiatku kontroverzné, udržalo sa až do modernej doby. Obzvlášť 19. storočie zaznamenalo mimoriadny nárast popularity rôznych prípravkov na báze ortute, v mnohých prípadoch aplikovanej ako panacea (všeliek) pri najrôznejších druhoch ochorení. Ešte v roku 1959 uvádza britská farmakopea (British Pharmaceutical Codex) masť s obsahom 30 % kovovej ortute. Podobne až do polovice 20. storočia sa udržalo použitie chloridu ortutného (kalomelu), okrem iného v práškoch používaných pri prerezávaní prvých zubov u detí. Farmaceutické prípravky s obsahom ortute sa používali i pri zápale očných spojiviek, napríklad vo forme masti s obsahom 12,5 % HgO, prípadne ako očné kvapky – zriedený vodný roztok kyanidu-oxidu ortutnatého (oxokyanidu ortutnatého). Koncom 19. storočia boli do farmaceutickej praxe uvedené liečivá na báze organokovových zlúčenín ortute.
V dôsledku nástupu účinnejších a menej toxických antibiotík však dochádza v nasledujúcom období k jej postupnému vylúčeniu z terapeutickej praxe. Prvotnou oblasťou aplikácie týchto zlúčenín bola antimikrobiálna terapia, avšak v roku 1919 bola u jedného z týchto liečiv, merbafénu, zistená výrazná diuretická aktivita (typická aktivita pre mnohé ortutnaté zlúčeniny). Na základe týchto zistení prebiehal rozsiahly výskum aplikácie týchto látok v medicíne, predovšetkým v terapii edému a kongestívneho srdcového zlyhania. Väčšie rozšírenie zaznamenal najmä mersalyl (obr. 1). Tieto zlúčeniny sa udržali v praxi až do nástupu nových účinných diuretík na báze tiazidov.
Image 1. Štruktúrny vzorec liečiva mersalylu 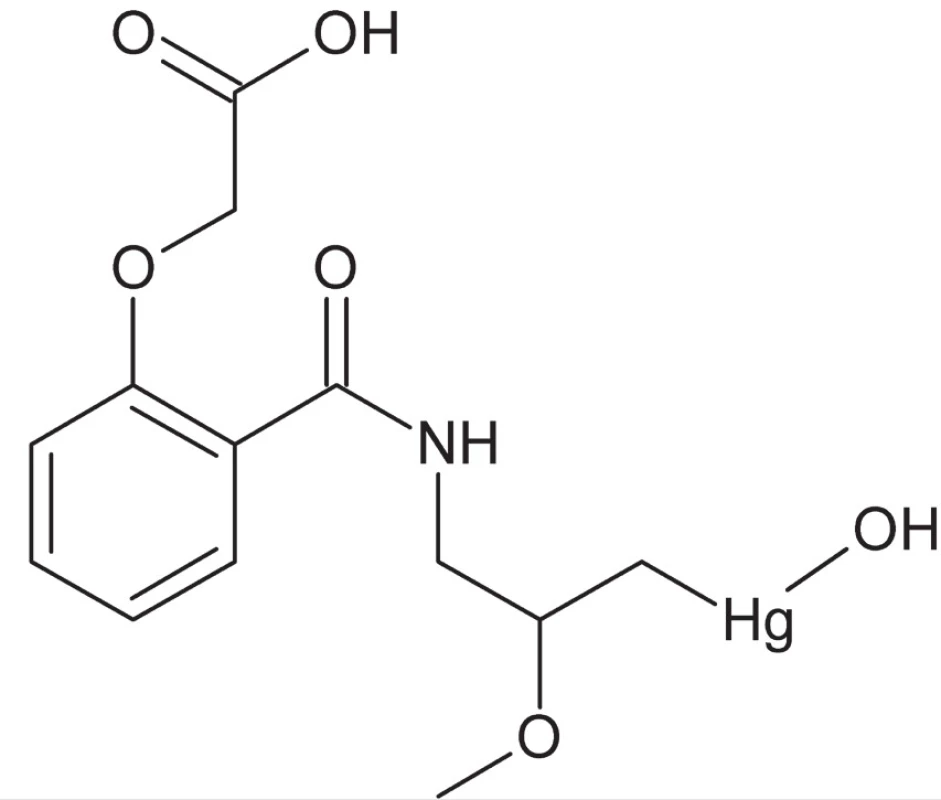
Arzén
Za počiatok dejín modernej chemoterapie sa všeobecne považuje uvedenie zlúčenín arzénu do klinickej praxe na prelome 19. a 20. storočia16). Arzén bol známy vo forme svojich zlúčenín (oxidu a sulfidu) od staroveku a po stáročia používaný ako jed, vzhľadom k svojej vysokej toxicite. Sulfidy arzénu – realgar (As4S4) a auripigment (As2S3), vyskytujúce sa v prírode ako minerály, doporučuje už grécky lekár Galén pri liečbe lepry a rôznych kožných ochorení17). Prípravky s obsahom arzénu boli a čiastočne aj stále sú súčasťou tradičnej čínskej medicíny.
V Európe sa použitie arzénu v terapii rôznych ochorení presadilo koncom stredoveku. Veľké rozšírenie zaznamenal od konca 18. storočia tzv. Fowlerov roztok, vodný roztok arzenitanu draselného pripravený zahrievaním As2O3 s roztokom KHCO3, pomenovaný podľa svojho vynálezcu, anglického lekára Thomasa Fowlera. Tento roztok bol v nasledujúcom období používaný pre celý rad indikácií, napr. v liečbe malárie, syfilisu, migrény, žalúdočných vredov a pod. Známy škótsky cestovateľ David Livingstone zverejnil v roku 1858 správu, v ktorej odporúča Fowlerov roztok proti spavej chorobe (africkej trypanozomiáze) spôsobovanej prvokmi Trypanosoma brucei. Fowlerov roztok a podobné prípravky zostali v používaní až do polovice 20. storočia, kedy boli nahradené modernými antibiotikami.
Najväčšie úspechy liečiv na báze arzénu sú spojené s menom nemeckého lekára Paula Ehrlicha, zakladateľa modernej chemoterapie, ktorý sa ako jeden z prvých zaoberal exaktným štúdiom vzťahu medzi chemickou štruktúrou zlúčenín a ich biologickou aktivitou. V rámci výskumu biologického účinku chemických zlúčenín voči patogénnym organizmom testoval stovky vzoriek, medzi nimi aj liečivo atoxyl, sodnú soľ kyseliny 4-aminofenylarzeničnej. Spolu s nemeckým bakteriológom Robertom Kochom potvrdil účinnosť tejto látky voči trypanozómam a neskôr aj proti baktérii Treponema pallidum (pôvodcovi syfilisu).
Následne bolo skúmané množstvo derivátov atoxylu, v snahe pripraviť liečivá s vyššou účinnosťou a najmä nižšou toxicitou (ktorá je u zlúčenín arzénu všeobecne značná). Najúspešnejším spomedzi nich sa ukázal byť derivát označovaný Ehrlichom ako zlúčenina č. 606, neskôr známy pod obchodným názvom Salvarsan18). Z chemického hľadiska sa jedná o zmes troj - a päťčlenných kruhov tvorených arzénom a organickými substituentmi19, 20). Objav salvarsanu (arzfenamínu) bol rozhodujúcim krokom pri vzniku chemoterapie ako vedy a zároveň znamenal prielom v terapii syfilisu. Napriek tomu, že v súčasnosti sa pri tejto indikácii zlúčeniny arzénu už nepoužívajú, udržali sa v niektorých afrických krajinách ako liečivá v terapii pokročilého štádia spavej choroby (predovšetkým melarsoprol) (obr. 2). Mechanizmus účinku arzénu zahrňuje inhibíciu a inaktiváciu viacerých bunkových enzýmov väzbou na ich sulfanylové skupiny (SH), predovšetkým enzýmu pyruvátkináza, v bunkách prvokov zapojeného do produkcie ATP. Terapia melarsoprolom, podobne ako aj inými liečivami na báze arzénu, je komplikovaná silnými nežiadúcimi účinkami, najmä výraznou neurotoxicitou (poškodenie mozgu a zrakového nervu). V posledných desaťročiach dochádza k renesancii terapie arzénom v liečbe určitých druhov rakoviny, predovšetkým akútnej promyelocytickej leukémie21).
Image 2. Štruktúrny vzorec melarsoprolu 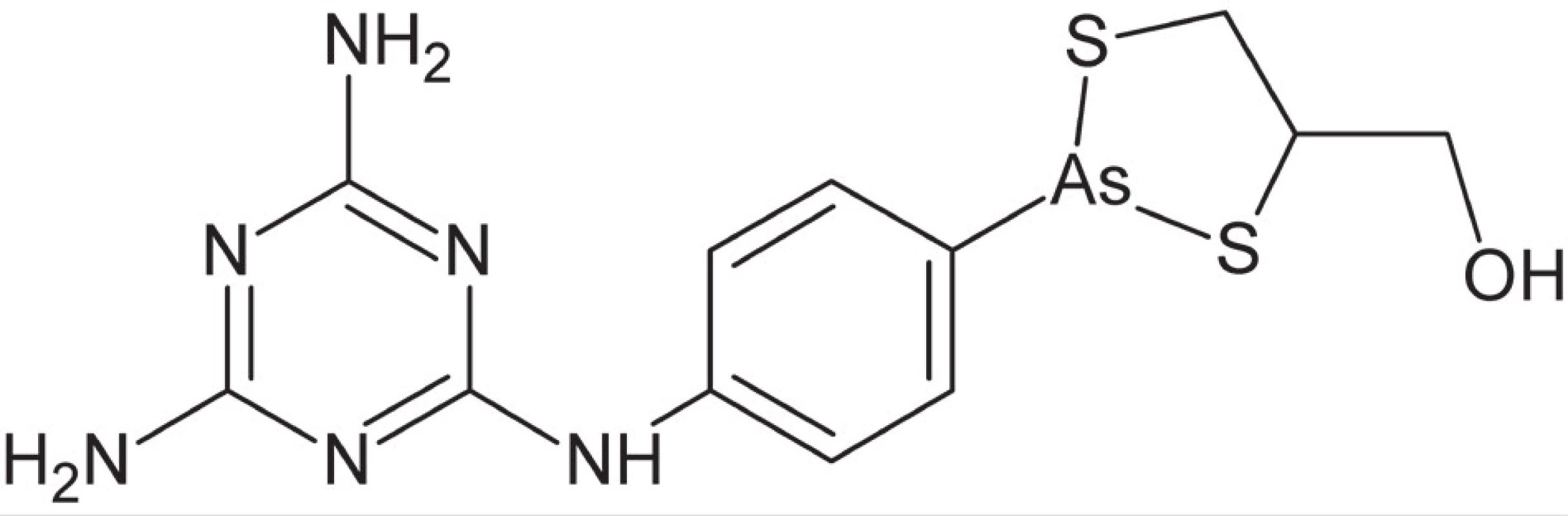
Striebro
Už v staroveku bolo známe, že voda a iné nápoje uchovávané v strieborných nádobách si dlhšie udržia svoju čerstvosť. Rôzne prípravky obsahujúce striebro boli v antickom Grécku a Ríme využívané na urýchlenie hojenia rán. V neskorších dobách sa rozšírilo využitie striebra pri terapii rôznych ochorení, napr. vo forme nádob, fólií, roztokov a suspenzií (dusičnan, oxid, chlorid strieborný)9, 22). V prvej polovici 20. storočia získalo popularitu striebro vo forme koloidného roztoku („koloidné striebro“), až do zavedenia antibiotík zrejme jedna z najrozšírenejších foriem antimikróbnej terapie23).
Koncom 19. storočia sa v lekárstve začal presadzovať dusičnan strieborný ako prostriedok na dezinfekciu rán a popálenín. Veľmi úspešnou sa ukázala byť tiež aplikácia tejto zlúčeniny vo forme 1% vodného roztoku ako očných kvapiek pre novorodencov (prevencia ochorenia ophthalmia neonatarum)22).
Na takmer univerzálnej účinnosti striebra voči najrôznejším druhom baktérií je založené i použitie striebra v modernej farmácii. Zlúčeniny striebra sú súčasťou chirurgických obväzov24, 25) a textílií určených na liečbu akútnej dermatitídy26). Úprava povrchu katétrov a chirurgických nástrojov vrstvou striebra pôsobí preventívne voči mikrobiálnej kontaminácii. Dinukleárny komplex striebra so sulfadiazínom, sulfónamidovým antibiotikom, je účinné antiseptikum, aplikované napr. vo forme krému proti rôznym kožným infekciám spôsobeným baktériami alebo hubami. Pri aplikácii dochádza – podobne ako aj v prípade elementárneho či koloidného striebra – k postupnému uvoľňovaniu katiónov striebra do okolitého prostredia. Antiseptická aktivita strieborných iónov je navyše umocnená antibiotickým účinkom sulfonamidového ligandu. Strieborné ióny interagujú s povrchom bunky mikroorganizmu (s bunkovou stenou/membránou), pričom dochádza k väzbe na záporne nabité skupiny makromolekúl, predovšetkým na sulfanylové skupiny enzýmov. Inhibícia či denaturácia enzýmov zodpovedných za udržiavanie integrity bunkovej steny, ako aj za transportné procesy medzi bunkou a okolím, môže viesť k narušeniu štruktúrnej integrity bunky alebo jej funkcií. Ďalší možný mechanizmus účinku zahrňuje internalizáciu iónov striebra naviazaných na povrchové štruktúry bunky (napr. pomocou pinocytózy) a následnú interakciu s vnútrobunkovými komponentmi, čo má za následok narušenie normálneho bunkového metabolizmu – inhibíciu enzýmov bunkovej respirácie, tvorbu reaktívnych foriem kyslíka, väzbu na molekuly DNA/RNA a inhibíciu ich replikácie27).
Zásadným problémom pri terapii zlúčeninami striebra je vznik argýrie, najmä pri dlhodobej internej aplikácii. Jedná sa o ukladanie striebra v rôznych tkanivách organizmu, predovšetkým v pokožke a očnej rohovke. Patologické zmeny spojené s takouto depozíciou sú síce minimálne, avšak pokročilé štádium argýrie sa vyznačuje nepríjemnými kozmetickými následkami, keďže pri ukladaní striebra v pokožke dochádza k zmene jej sfarbenia (modrasto-sivá farba).
V súčasnosti je badateľný stály nárast záujmu o antimikróbne vlastnosti striebra a jeho zlúčenín, najmä v súvislosti s hľadaním alternatív k tradičným antibiotikám, čoraz častejšie trpiacim stratou účinnosti v dôsledku vývinu rezistencie u cieľových mikroorganizmov. Pozitívnou vlastnosťou striebra je jeho relatívne nízka toxicita. V poslednej dobe tiež dochádza k renesancii záujmu o použitie strieborných nanočastíc v najrôznejších oblastiach medicíny27). Zlúčeniny striebra, ako aj nanočastice, nachádzajú využitie v mnohých komerčných aplikáciách, pri ktorých je dôležité antiseptické prostredie, ako napr. obaly na potraviny, zariadenia na čistenie vzduchu či vody, antibakteriálne textílie a pod.28) Zaujímavú aplikáciu predstavuje diammin-fluoridokomplex striebra v prevencii paradentózy a terapii zubnej hypersenzitivity29).
Meď
Meď, podobne ako striebro, vykazuje výrazný nešpecifický biocídny účinok, hoci slabší, než v prípade striebra30). Tieto jej vlastnosti (antibakteriálna, antifungálna aj antivirálna aktivita) sa prejavujú nielen v ionizovanom stave, ale aj v elementárnej forme (vrátane nanočastíc), čo otvára perspektívy pre jej použitie pri antiseptickej povrchovej úprave rôznych materiálov. Antibakteriálny účinok medi a jej zlúčenín bol využívaný už od staroveku31), napr. je zdokumentované použitie medi v starovekom Egypte na čistenie pitnej vody a ošetrovanie rán (2200–2600 pred n. l.)32). V súčasnosti sa meď využíva spolu so striebrom v systémoch na dezinfekciu vody, obzvlášť voči rezistentným patogénom (napr. Staphylococcus aureus, Clostridium difficile či Legionella). Predmetom záujmu sú aj výrazné fungicídne vlastnosti meďnatých zlúčenín33).
Bizmut
Počínajúc 18. storočím sa v tradičnej liečbe rôznych gastrointestinálnych ochorení presadzujú zlúčeniny trojmocného bizmutu34). Najstarším liečivom tohoto typu bol bázický dusičnan bizmutitý (magisterium bismuthi), v skutočnosti viacjadrový komplex bizmutu s komplikovanou štruktúrou, používaný v minulosti napr. na dezinfekciu tráviaceho traktu. Využitie našlo i viacero zlúčenín bizmutu s organickými ligandmi, okrem iného v terapii ochorení ako diarea, konstipácia, dyspepsia, žalúdočný vred, zápal sliznice žalúdka (gastritída) a v modernej medicíne najmä pri liečení infekcie baktériou Helicobacter pylori. Patria medzi ne zásadité soli, ako napr. vínan, citran či salicylan bizmutitý. Zo štruktúrneho hľadiska sa jedná o koordinačné zlúčeniny bizmutu v oxidačnom stupni tri, pričom ich štruktúra je silne závislá od pH prostredia35).
Terapeutický efekt zlúčenín bizmutu je spájaný predovšetkým s ich antibakteriálnou aktivitou, najmä voči baktérii Helicobacter pylori, považovanou za príčinu viacerých závažných ochoreniach tráviaceho traktu, ako sú peptický vred či karcinóm žalúdka36). Mechanizmus účinku týchto látok nie je úplne jasný, avšak predpokladá sa ochranný účinok na povrch epitelu žalúdka, vplyv oxidačného stresu vyvolávaného zlúčeninami bizmutu na rast baktérií, ako aj inhibícia enzýmu ureáza, nevyhnutného pre kolonizácia tráviaceho traktu týmito baktériami37). Ich výhodou je i relatívne nízka toxicita.
Antimón
Zlúčeniny antimónu, relatívne vzácneho prvku, boli známe už v staroveku a využívané aj v medicíne, napr. proti horúčke alebo pri liečbe rôznych kožných ochorení. V 17. a 18. storočí získali popularitu nádoby na víno z antimónu, pričom účinkom vína na antimón dochádzalo k tvorbe komplexu antimónu s kyselinou vínnou ako silného emetika9).Tento komplex bol tiež ako prvá zo zlúčenín antimónu počiatkom 20. storočia zavedený do terapie infekčných ochorení spôsobených prvokmi Leishmania a Trypanosoma – leishmaniózy, spavej choroby (africkej trypanozomiázy) a Chagasovej choroby (americkej trypanozomiázy). V liečbe leishmaniózy sú zlúčeniny antimónu dodnes v prvej línii terapie. V súčasnosti sa jedná o komplexy antimoničné, vykazujúce nižšiu toxicitu než zodpovedajúce zlúčeniny antimónu v oxidačnom stupni +3. Dve najrozšírenejšie liečivá tohoto typu sú stiboglukonát sodný (obr. 3) a meglumin antimonát38). Mechanizmus účinku zlúčenín antimónu nie je zatiaľ dostatočne preskúmaný, avšak významnú úlohu v ňom hrá inhibícia trypanotiónreduktázy, enzýmu prvokov zodpovedného za potlačenie imunitnej reakcie buniek hostiteľského organizmu39).
Image 3. Štruktúra stiboglukonátu sodného 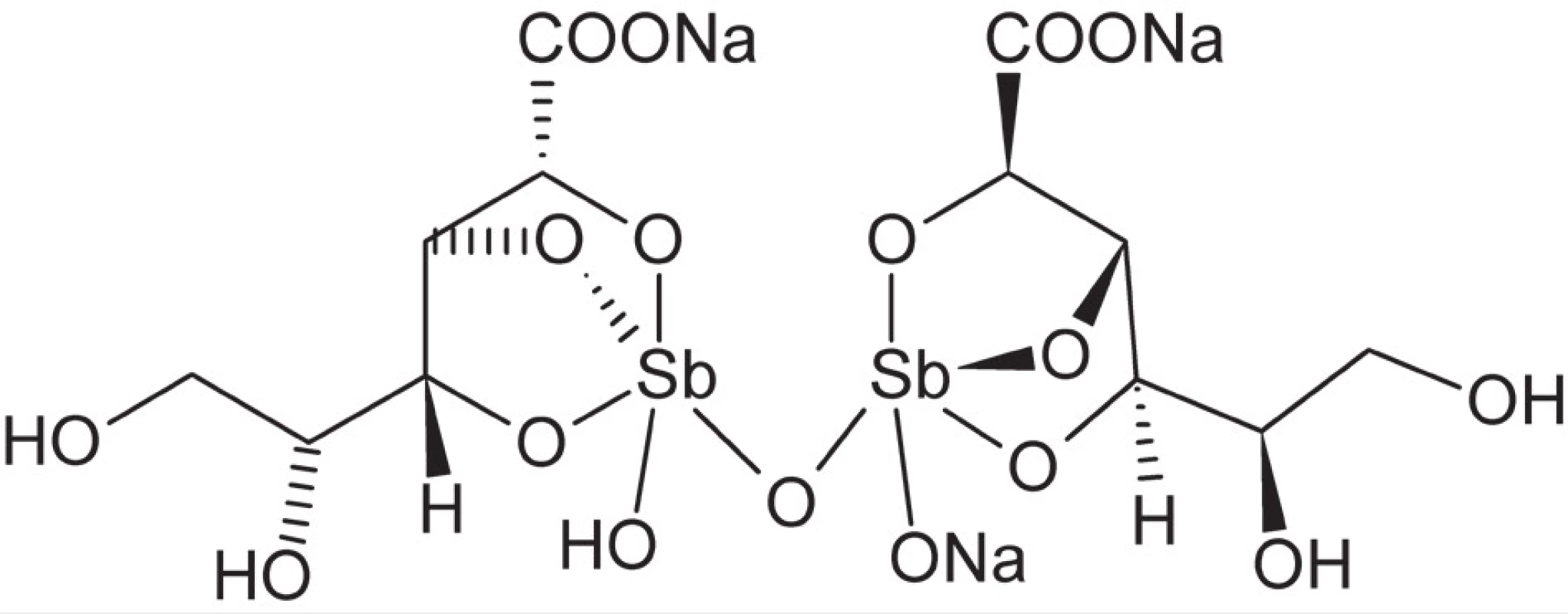
Ruténium
K perspektívnym liečivám v boji s protozoálnymi infekciami patria popri zlúčeninách antimónu a bizmutu aj komplexy ruténia40). Ruténium vykazuje istú chemickú podobnosť so železom a dokáže železo nahradiť napr. pri väzbe s transportným proteínom transferínom, čo vedie k zvýšenej resorpcii ruténia bunkami. Bunky parazitných prvokov (podobne ako mnohé rakovinové bunky) vykazujú zvýšený príjem železa, čo predstavuje možnosť vnútrobunkovej akumulácie nielen ruténia, ale aj bioaktívnych ligandov naviazaných na tento kov (ruténium ako nosič). Koordinácia liečiv s antiprotozoálnou aktivitou k centrálnemu atómu ruténia umožňuje využitie synergického efektu (bioaktivita výsledného komplexu je vyššia než suma aktivít jednotlivých zložiek – ligandov a centrálneho atómu), vzhľadom k tomu, že u organického ligandu a iónov ruténia môžeme predpokladať rozličný mechanizmus účinku41). Pravdepodobný mechanizmus účinku ruténia spočíva predovšetkým vo väzbe na DNA, avšak boli pozorované aj interakcie s enzýmami, ako sú acetylcholínesteráza a proteínkinázy, ktorých inhibícia má vplyv na signálne kaskády v bunke42).
Zlúčeniny ruténia vykazujú aktivitu voči viacerým tropickým chorobám spôsobeným prvokmi – rôznym typom leishmaniázy a trypanozomiázy, ako aj proti malárii (Plasmodium). Napríklad koordinácia chlorochínu, etablovaného liečiva proti malárii, k atómu ruténia (obr. 4) vedie k až 5-násobnému nárastu aktivity in vivo v porovnaní s voľným ligandom43).
Image 4. Komplex ruténia s chlorochínom 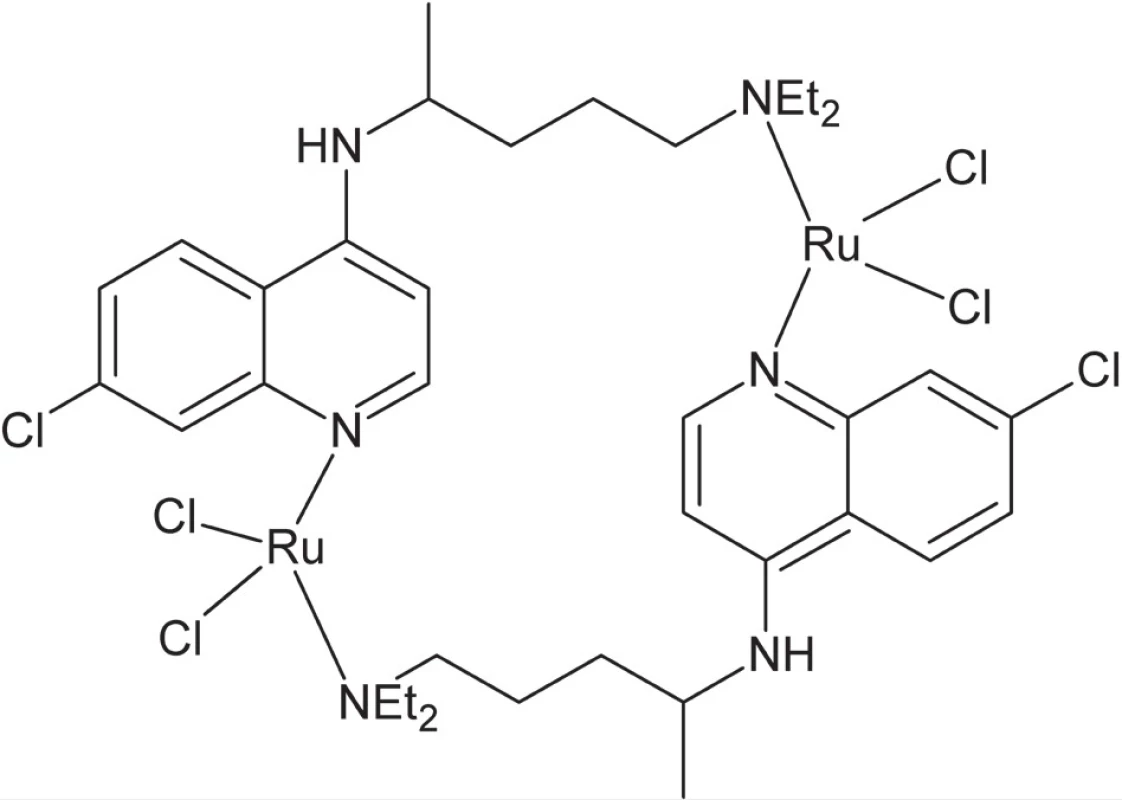
Okrem zvýšenej resorpcie využitím bunkových transportných mechanizmov železa spôsobuje koordinácia k centrálnemu atómu ruténia aj modifikáciu elektrónovej hustoty v molekule chlorochínu, čo má za následok zmeny lipofilnosti a bázicity molekuly, a tým pádom aj odlišnú odozvu rezistenčných mechanizmov patogénnych mikróbov.
V nasledujúcom období bol pripravený celý rad rôznych komplexov ruténia s antimikróbnou aktivitou. Zo štruktúrneho hľadiska sa jedná v zásade o typy komplexov analogické zlúčeninám ruténia s aktivitou voči rakovinovým bunkám (napr. podobne ako bunky prvokov vykazujú mnohé typy rakoviny zvýšený príjem železa do buniek). Výrazná antiprotozoálna aktivita bola pozorovaná tiež u komplexov substituovaného chlorochínu so železom (tzv. ferrochín)44).
Komplexné zlúčeniny kovov v diagnostike
Využitie komplexov kovov v diagnostike sa zakladá na ich schopnosti koncentrovať sa v určitých orgánoch, tkanivách či typoch buniek. Táto ich afinita je podmienená špecifickými interakciami s biomolekulami a zapojením do rôznych biochemických dejov v organizme, čo umožňuje získavať informácie o fyziologických i patofyziologických procesoch v organizme45). Úloha samotného centrálneho atómu kovu sa často (hoci nie vždy) obmedzuje na funkciu indikátora, ktorý pomocou vhodnej fyzikálnej metódy umožňuje lokalizovať daný atóm v priestore, a určiť tým pádom oblasti zvýšenej akumulácie diagnostického komplexu v organizme. Pritom afinita k určitému druhu tkaniva (buniek, receptorov, biochemického procesu) súvisí s typom ligandov, ako aj s celkovou štruktúrou komplexu. Pri prvých diagnostikách na báze komplexov kovov boli tieto dve funkcie – bioafinita a koordinačná väzba iónu kovu ako indikátora – vzájomne úzko spojené, kým pri modernom cielenom dizajne sú často priestorovo oddelené: časť komplexu, ktorej funkciou je zabezpečovať čo najpevnejšiu väzbu s centrálnym atómom kovu (tvorba chelátu), je spojená spojovacím článkom (linker) s časťou ligandu vykazujúcou bioafinitu (obr. 5). Vysoká stabilita komplexu (termodynamická, kinetická) je pri metalodiagnostikách kľúčová, keďže mnohé ióny kovov sú vo svojej voľnej (hydratovanej) forme toxické46).
Image 5. Schématické znázornenie cieleného dizajnu diagnostických komplexov (targeting) 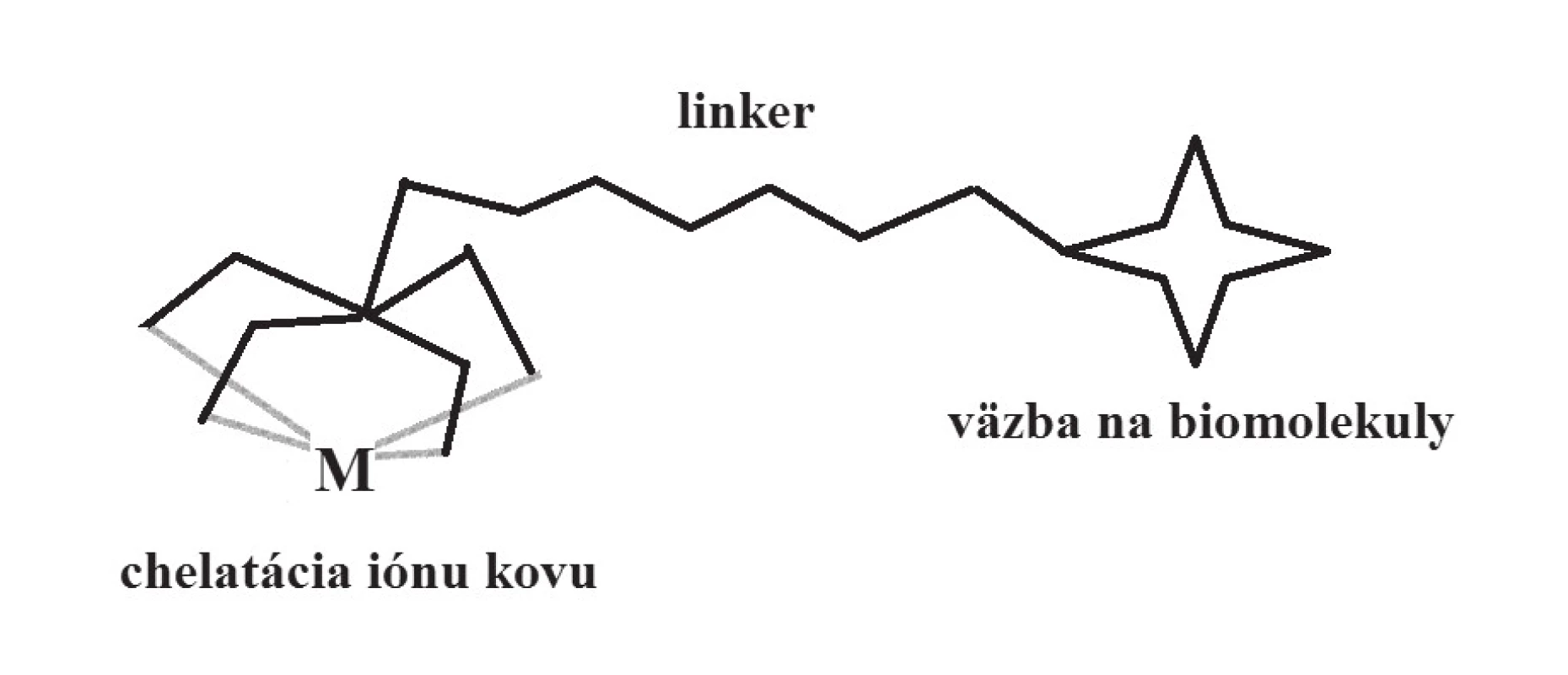
Druh indikátora (centrálneho atómu kovu) je daný predovšetkým požadovaným typom fyzikálnej interakcie a spôsobom jej indikácie. Jedná sa najčastejšie o meranie rádioaktivity (SPECT, PET) alebo absorpcie rádiofrekvenčného žiarenia jadrami atómov (MRI) pomocou rôznych typov počítačovej tomografie, poskytujúcich trojrozmerný obraz distribúcie daného indikátora v živom organizme. V tomto zmysle sa jedná o tzv. kontrastné látky (contrast agents – CA) umožňujúce indikáciu danej látky pomocou vhodnej detekčnej metódy, resp. zvýšenie kontrastu (priestorového rozlíšenia) tejto metódy45).
Rádiofarmaká
Prvou a najjednoduchšou formou využitia takejto kontrastnej látky je aplikácia málo rozpustného síranu bárnatého v röntgenografii, predovšetkým pre zobrazovanie gastrointestinálneho traktu. Pokročilejšie techniky nukleárnej medicíny (rádiofarmácie) sú založené na detekcii rádioaktívneho žiarenia (γ-žiarenie), emitovaného centrálnym atómom kovu (rádiofarmaká)47, 48). Spočiatku umožňovali len vytvorenie dvojrozmerného obrazu (scintigrafia), až zavedenie výkonných počítačových systémov umožnilo rekonštruovať zo série meraní priestorový obraz49).
Klasickým, avšak i dnes najviac rozšíreným variantom je technika SPECT – jednofotónovej emisnej počítačovej tomografie50). Ako centrálny atóm je v tomto prípade použitý vhodný rádionuklid, emitujúci γ-žiarenie určitej energie, pričom tento musí spĺňať viacero požiadaviek. Energia emitovaného žiarenia je určená použitou technikou detekcie v tomografickom prístroji. Polčas premeny by mal byť dostatočne vysoký, aby mohlo dochádzať k účinnému ustanoveniu rovnováhy (akumulácii rádiofarmaka v cieľovom orgáne či tkanive), nie však príliš vysoký, aby sa zabránilo nadmernej radiačnej záťaži pacienta. Množstvo rádionuklidov je vhodných na tento účel (napr. 111In, 67Ga), avšak najrozšírenejším rádionuklidom pre oblasť SPECT je už po desaťročia izotop technécia 99mTc. Tento rádionuklid kombinuje viacero priaznivých vlastností – primerane krátky polčas premeny (6 h), vhodnú energiu emitovaného γ-žiarenia (141 keV), vysokú špecifickú aktivitu, ako aj výhodné koordinačno-chemické vlastnosti51, 52). Pri rádioaktívnej premene vzniká 99Tc ako máloaktívny β–-žiarič. Jedným z rozhodujúcich faktorov všeobecného rozšírenia tohoto rádionuklidu v nukleárnej medicíne je i jeho dostupnosť. 99mTc sa získava pomocou generátorového systému 99Mo/99mTc, ktorý umožňuje kontinuálny odber technécia vznikajúceho rádioaktívnou premenou 99Mo. Samotný nuklid 99Mo je dostupný ožarovaním 235U neutrónmi v jadrovom reaktore. Molybdén je v generátorovom systéme adsorbovaný ako MoO42– na chromatografickej kolóne naplnenej oxidom hlinitým. Cez túto kolónu počas odberu 99mTc prechádza fyziologický roztok NaCl a selektívne vymýva vznikajúci rádionuklid vo forme technecistanu (99mTcO4–). Takto pripravený roztok technecistanu je možné použiť priamo pre niektoré aplikácie (napr. zobrazovanie štítnej žľazy a mozgu), avšak vo väčšine prípadov je potrebná jeho komplexácia vhodnými ligandmi. Za týmto účelom je technécium najprv redukované redukčným činidlom (napr. SnCl2) za vzniku niektorého z jeho nižších oxidačných stupňov a následne komplexované. Výber ligandov súvisí s konkrétnym typom aplikácie a požadovanou bioafinitou. V súčasnosti sú možnosti aplikácie komplexov 99mTc v klinickej diagnostike i vo výskume početné a využívajú sa pri zobrazovaní množstva rôznych orgánov a ich funkcií. Ako príklady možno uviesť (obr. 6) 99mTc-HMPAO pre zobrazenie lokálnej perfúzie mozgu, 99mTc-tetrofosmin pre diagnostiku perfúzie myokardu, 99mTc-MAG3 pre zobrazenie obličiek, prípadne značenie celých červených krviniek pre zobrazovanie krvného obehu. Najnovšie bifunkčné komplexy technécia umožňujú cielenú väzbu na rôzne receptory, ako príklad uveďme 99mTc-TRODAT pre zobrazenie dopamínového transportéra.
Image 6. Štruktúra diagnostických komplexov technécia (zľava do prava): 99mTc-HMPAO, 99mTc-tetrofosmin, 99mTc-MAG3 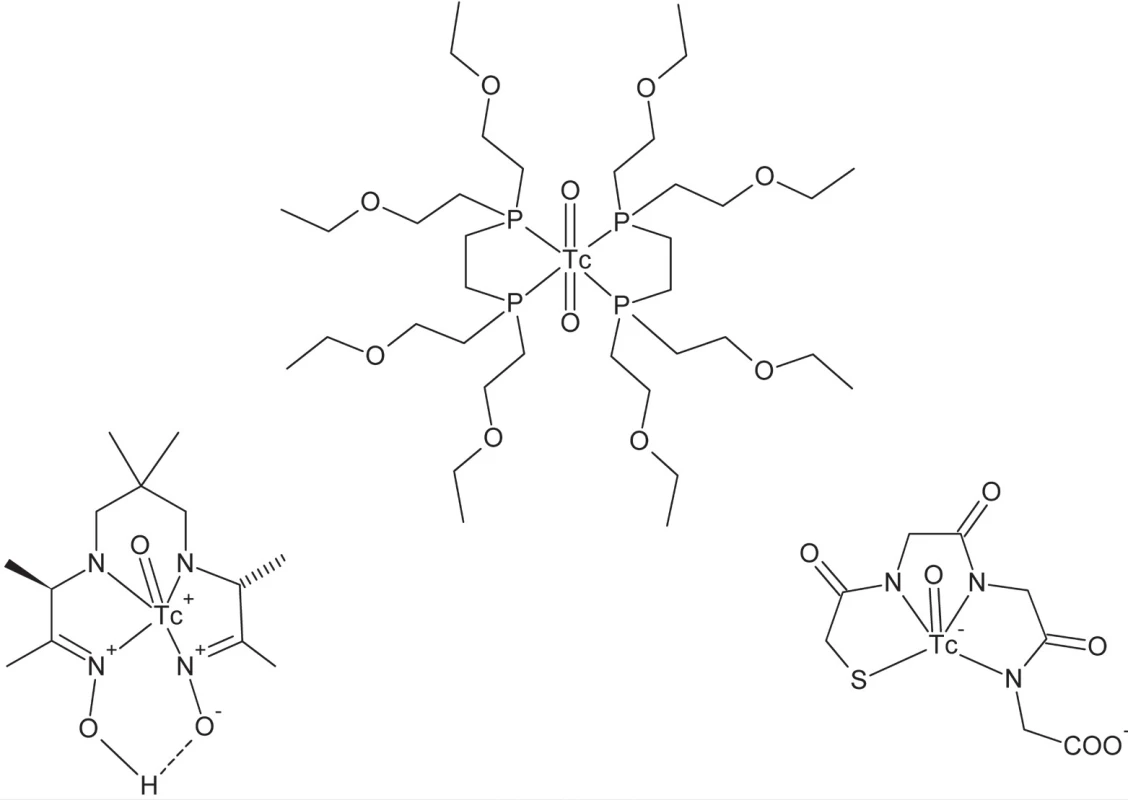
Napriek tomu, že vzhľadom k svojej dostupnej cene aj relatívnej jednoduchosti aplikácie v súčasnosti stále dominuje technika SPECT, využívajúca rádiofarmaká (γ-žiariče) na báze koordinačných zlúčenín technécia, postupne sa v diagnostike čoraz viac presadzuje metóda pozitrónovej emisnej tomografie (PET)53). Táto diagnostická metóda využíva rádionuklidy, ktoré podliehajú β+-premene. Vznikajúce pozitróny reagujú s elektrónmi z okolitého tkaniva, pričom dochádza k vzniku dvoch fotónov (kvánt γ-žiarenia) pohybujúcich sa opačným smerom. Na základe takejto priestorovej orientácie vznikajúceho žiarenia je potom možné pomocou systému detektorov a počítačového spracovania údajov získať trojrozmerný obraz distribúcie daného rádionuklidu v tele. Podobne ako pri technike SPECT je základnou požiadavkou na použitý rádionuklid optimálna hodnota polčasu premeny – dostatočne dlhá pre izoláciu rádionuklidu, prípravu rádioaktívne značenej zlúčeniny a jej aplikáciu in vivo, zároveň však dostatočne krátka, aby sa znížila radiačná záťaž organizmu. Medzi pozitrónovými žiaričmi vhodnými pre PET sú i viaceré kovové prvky, napríklad 67Ga, 82Rb, 64Cu a 89Zr. K novším príkladom PET rádiofarmák patrí 64Cu-ATSM (obr. 7), selektívne akumulované v hypoxických tkanivách (tkanivách s nedostatkom kyslíka – stav častý v tumoroch)54).
Image 7. Štruktúra komplexu 64Cu-ATSM 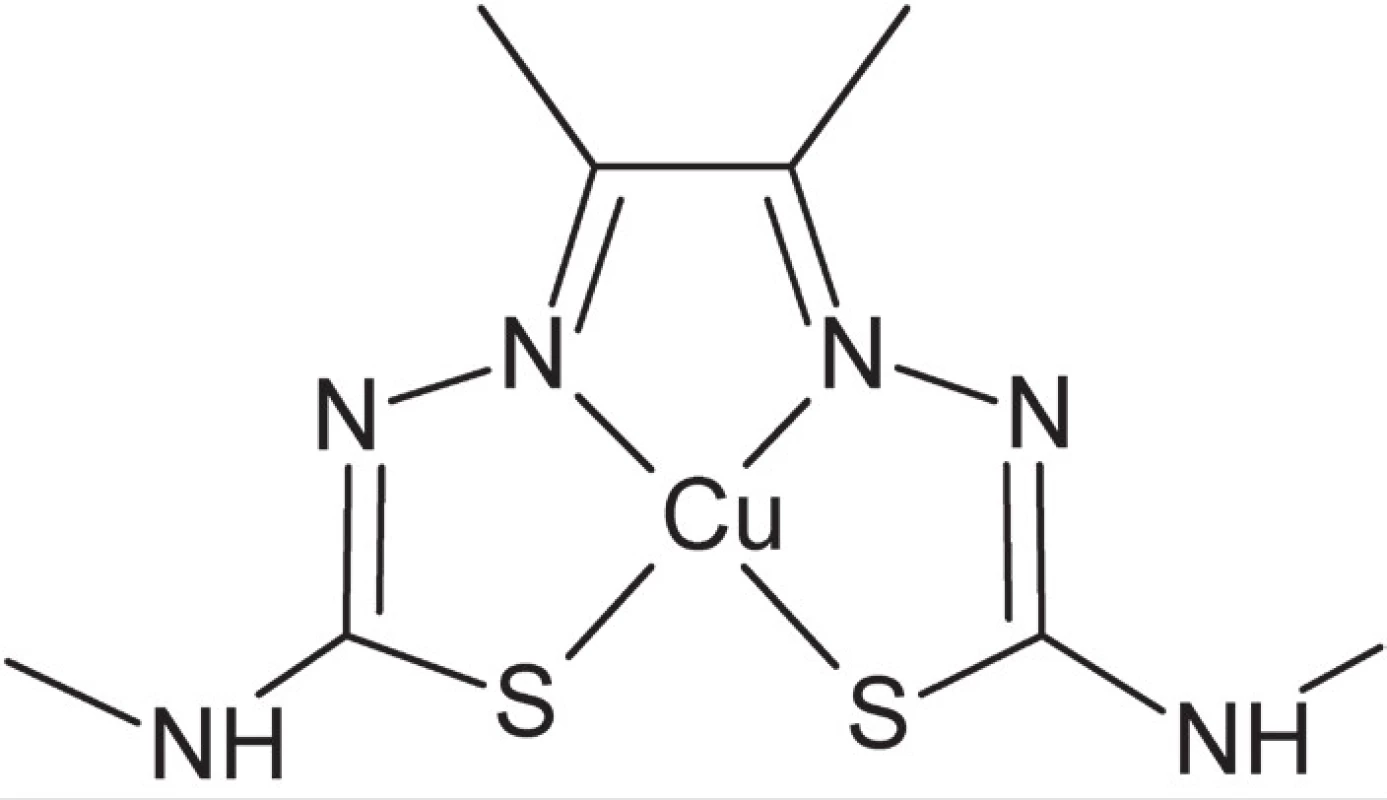
Metalodiagnostiká pre MRI
Na odlišnom princípe než rádiofarmaká sú založené kontrastné látky v magnetickej rezonančnej tomografii (MRI/MRT). Táto metóda spočíva v rozdielnej intenzite 1H-NMR signálov vody obsiahnutej v rôznych tkanivách55). Pacient je umiestnený v silnom magnetickom poli spôsobujúcom orientáciu jadrových magnetických momentov jadier atómov vodíka (protónov) v smere tohoto vonkajšieho poľa, ktoré potom interagujú s rádiofrekvenčným žiarením. Lokálna intenzita signálu v MRI závisí nielen od počtu protónov (molekúl vody) v danom tkanive, ale aj od ich relaxačného času. Spinové relaxačné časy (longitudinálna. resp. transverzálna relaxácia) sú výrazne ovplyvnené prítomnosťou magneticky aktívnych častíc (kontrastných látok v MRI) v detegovanej oblasti. Rôzna dĺžka relaxačných časov v rôznych tkanivách napomáha zvýšeniu kontrastu, kontrastné látky (paramagnetické i feromagnetické) tým pádom umožňujú rozlišovať medzi týmito tkanivami a vytvárať pomocou vhodného technického vybavenia trojrozmerný obraz.
V súčasnej klinickej praxi jednoznačne dominujú paramagnetické CA obsahujúce gadolínium (Gd3+), hoci vo vývoji sú i komplexy iných paramagnetických iónov (napr. Mn), ako aj feromagnetické nanočastice (oxidy železa a mangánu)56). Gadolínium ako jeden z lantanoidov vykazuje vlastnosti obzvlášť vhodné pre použitie ako súčasť kontrastných látok, najmä vysoký počet nespárovaných elektrónov a z toho vyplývajúci vysoký magnetický moment57, 58). K ďalším dôležitým charakteristikám patria vysoká miera akumulácie CA v danom tkanive, dostatočne dlhý biologický polčas v organizme, ako aj vysoká stabilita komplexu (resp. jeho kinetická inertnosť), aby sa zabránilo uvoľňovaniu toxických iónov Gd3+ z CA. Komplex gadolínia by navyše mal obsahovať aspoň jednu molekulu vody koordinovanú priamo na centrálny atóm, čo umožňuje efektívnu spinovú interakciu medzi gadolíniom a okolitými molekulami vody.
Ako ligandy sa najčastejšie používajú dvanásťčlánkové makrocyklické deriváty cyklénu (1,4,7,10-tetraazacyklododekánu), napr. Gd-DOTA (Dotarem®), alebo acyklické chelatujúce ligandy, najmä polyaminopolykarboxylátového typu, napr. Gd-DTPA (Magnevist®) (obr. 8). Koordinačné číslo gadolínia v týchto komplexoch je spravidla 9, pričom ligand je oktadentátny, čo ponecháva jedno koordinačné miesto k dispozícii pre naviazanie molekuly vody.
Image 8. Štruktúra diagnostických komplexov gália (zľava do prava): Gd-DOTA, Gd-DTPA 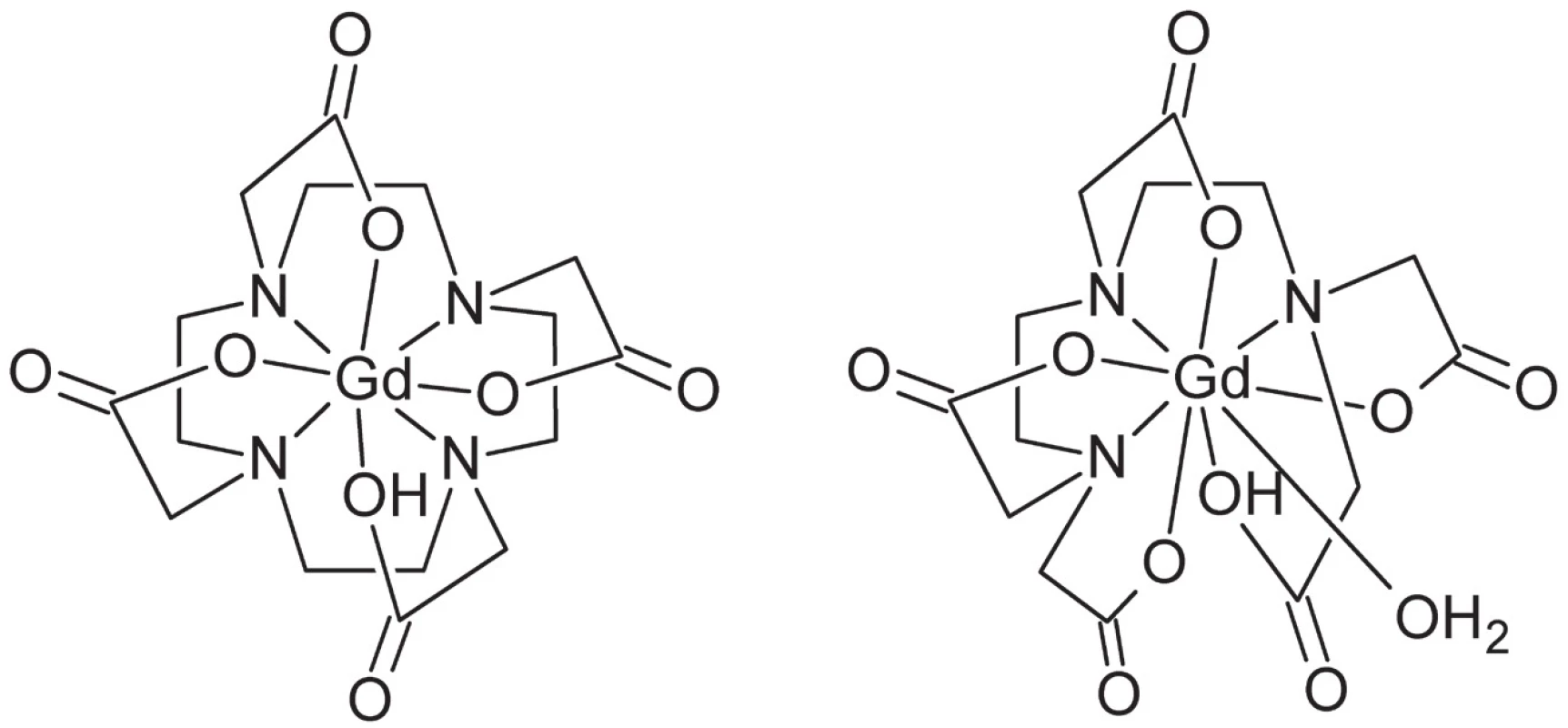
Oblasť vývoja nových CA pre MRI je v súčasnosti predmetom intenzívneho výskumu59, 46). Pokroky v prístrojovej technike tomografie spolu s novými CA umožňujú dosahovať čoraz vyšší kontrast v kombinácii s podstatne nižšími nežiadúcimi účinkami pre pacienta v porovnaní s metódami používajúcimi rádioaktívne žiarenie. Podobne ako v pripade rádiofarmák je možné väzbou na ligandy so špecifickou bioafinitou dosiahnuť zobrazenie fyziologických či patologických procesov v organizme60, 61). V rámci vývoja nových CA prevláda snaha o prípravu CA so zníženými relaxačnými časmi, čo možno docieliť viacerými spôsobmi. Okrem variácií v zložení ligandov je tiež možné zvýšiť počet molekúl vody (akva ligandov) priamo viazaných koordinačnou väzbou na centrálny atóm kovu, čo má za následok zvýšenú rýchlosť výmeny vody medzi vnútornou a vonkajšou koordinačnou sférou komplexu, efektívnejšiu spinovú interakciu s okolitým prostredím, a tým pádom aj zvýšenie kontrastu62). Priaznivý vplyv má aj zväčšenie rozmerov molekuly (komplexu), buď použitím objemných ligandov alebo makromolekúl viazaných na atóm kovu. Iným prístupom môže byť použitie nanočastíc (feromagnetické/superparamagnetické nanočastice), napr. nanočastíc na báze oxidov železa s povrchovo viazanými makromolekulovými látkami, ako sú polyetylénglykol, dextrán či albumín.
CA na báze lantanoidov sú všeobecne považované v klinickej praxi za bezpečné, napriek tomu dochádza v určitých prípadoch k vzniku nežiadúcich vedľajších účinkov. Tieto sú spravidla spojené s disociáciou komplexu CA in vivo na ligand a voľné katióny lantanoidu, ktoré sa pri dlhšom biologickom polčase môžu akumulovať v rôznych orgánoch a poškodiť ich (napr. akumulácia Gd v mozgu). Takéto komplikácie sú pravdepodobnejšie u pacientov so zníženou renálnou funkciou63).
V súčasnosti sa čoraz viac presadzuje kombinácia viacerých diagnostických techník, umožňujúca spájať prednosti jednotlivých metód, napr. kombinácia PET a MRI kombinuje vysokú citlivosť metód rádiofarmácie s dobrým priestorovým rozlíšením magnetickej rezonancie. Moderným smerom výskumu v oblasti kontrastných látok je tiež vývoj CA umožňujúcich prepojenie diagnostiky a terapie, čo umožňuje priestorovú lokalizáciu patologických zmien v organizme, ich terapiu a zároveň monitorovanie priebehu liečby, a tým pádom aj individualizovanú terapiu u jednotlivých pacientov (tzv. teranostika64)).
Záver
Zlúčeniny kovov a polokovov predstavujú perspektívnu oblasť vývoja nových liečiv, čo je možné pozorovať na náraste počtu publikácií zaoberajúcich sa metalofarmakami v posledných desaťročiach. Aplikácia niektorých kovov vo farmácii má dnes už skôr význam historický, avšak aj tu dochádza v mnohých prípadoch k obnove záujmu o ich bioaktivitu a využitie v nových oblastiach terapie. Koordinačné zlúčeniny vykazujú unikátne chemické a fyzikálno-chemické vlastnosti v porovnaní s organickými molekulami a poskytujú tak nové možnosti cieleného ovplyvňovania farmakologických vlastností takýchto liečiv. Využitie liečiv na báze kovov v antimikróbnej chemoterapii získava mimoriadny význam najmä v súvislosti s potrebou vývoja nových antimikróbnych látok s odlišným mechanizmom aktivity, účinných aj voči rezistentným kmeňom mikroorganizmov. Použitie komplexov kovov v diagnostike (rádiofarmácii aj nukleárnej magnetickej rezonancii) otvára nové možnosti pre čoraz presnejšie zobrazenie anatomických štruktúr, ako aj fyziologických a patofyziologických procesov v organizme.
Práca bola podporovaná Vedeckou grantovou agentúrou MŠVVaŠ SR a SAV, grant VEGA 1/0346/16.
Konflikt záujmov: žiadny.
Ing. Ladislav Habala, PhD. (∗)
J. Valentová
Katedra chemickej teórie liečiv, Farmaceutická fakulta UK
Odbojárov 10, 832 32 Bratislava, Slovak Republic
e-mail: habala@fpharm.uniba.sk
Sources
1. Kaim W., Schwederski B., Klein A. Bioinorganic chemistry: inorganic elements in the chemistry of life. Chichester: John Wiley & Sons Ltd 2013.
2. Crichton R. R. Biological inorganic chemistry. A new introduction to molecular structure and function. Amsterdam: Elsevier 2012.
3. Bertini I., Gray H. B., Stiefel E. I., Valentine J. S. Biological inorganic chemistry: structure and reactivity. Sausalito: University Science Books 2007.
4. Taylor D. M., Williams D. R. Trace element medicine and chelation therapy. Cambridge: The Royal Society of Chemistry 1995.
5. Frieden E. (ed.) Biochemistry of the essential ultratrace elements. New York: Plenum Press 1984.
6. Jones C., Thornback J. Medicinal applications of coordination chemistry. Cambridge: The Royal Society of Chemistry 2007.
7. Gielen M., Tiekink E. R. T. Metallotherapeutic drugs and metal-based diagnostic agents – the use of metals in medicine. Chichester: John Wiley & Sons Ltd 2005.
8. Mjos K. D., Orvig C. Metallodrugs in medicinal inorganic chemistry. Chem. Rev. 2014; 114, 4540–4563.
9. Sneader W. Drug discovery. A history. Chichester: John Wiley & Sons 2005.
10. Beutler E. History of iron in medicine. Blood Cells Mol. Dis. 2002; 29, 297–308.
11. Higby G. J. Gold in medicine. A review of its use in the West before 1900. Gold Bull. 1982; 15, 130–140.
12. Benedek T. G. The history of gold therapy for tuberculosis. J. Hist. Med. Allied Sci. 2004; 59, 50–89.
13. Lemire J. A., Harrison J. J., Turner R. J. Antimicrobial activity of metals: mechanisms, molecular targets and applications. Nat. Rev. Microbiol. 2013; 11, 371–384.
14. Riegel-Futyra A., Dąbrowski J. M., Mazuryk O., Śpiewak K., Kyzioł A., Pucelik B., Brindell M., Stochel G. Bioinorganic antimicrobial strategies in the resistance era. Coord. Chem. Rev. 2017; 351, 76–117.
15. Farrar W. V., Williams A. R. A history of mercury. In: McAuliffe C. A. (ed.) The chemistry of mercury. London: The Macmillan Press 1977.
16. Lykknes A., Kvittingen L. Arsenic: not so evil after all? J. Chem. Ed. 2003; 80, 497–500.
17. Riethmiller S. From atoxyl to salvarsan: searching for the magic bullet. Chemotherapy 2005; 51, 234–242.
18 . Williams K. J. The introduction of ‘chemotherapy’ using arsphenamine – the first magic bullet. J. Royal Soc. Med. 2009; 102, 343–348.
19. Levinson A. S. The structure of salvarsan and the arsenic-arsenic double bond. J. Chem. Ed. 1977; 54, 98–99.
20. Lloyd N. C., Morgan H. W., Nicholson B. K., Ronimus R. S. The composition of Ehrlich’s salvarsan: resolution of a century-old debate. Angew. Chem. Int. Ed. 2005; 44, 941–944.
21. Rao Y., Li R. H., Zhang D. Q. A drug from poison: how the therapeutic effect of arsenic trioxide on acute promyelocytic leukemia was discovered. Sci. China Life Sci. 2013; 56, 495–502.
22. Alexander J. W. History of the medical use of silver. Surg. Infect. 2009; 10, 289–292.
23. Nowack B., Krug H. F., Height M. 120 years of nanosilver history: implications for policy makers. Environ. Sci. Technol. 2011; 45, 1177–1183.
24 . Vosmanská V., Kolářová K., Švorčík V. Porovnání antibakteriální aktivity krytů ran dotovaných stříbrem. Chem. Listy 2017; 111, 804–808.
25. Stathopoulou M. K., Banti C. N., Kourkoumelis N., Hatzidimitriou A. G., Kalampounias A. G., Hadjikakou S. K. Silver complex of salicylic acid and its hydrogel-cream in wound healing chemotherapy. J. Inorg. Biochem. 2018; 181, 41–55.
26. Klasen H. J. A historical review of the use of silver in the treatment of burns. II. Renewed interest for silver. Burns 2000; 26, 131–138.
27. Chernousova S., Epple M. Silver as antibacterial agent: ion, nanoparticle, and metal. Angew. Chem. Int. Ed. 2013; 52, 1636–1653.
28. Möhler J. S., Sim W., Blaskovich M. A. T., Cooper M. A., Ziora Z. M. Silver bullets: a new lustre on an old antimicrobial agent. Biotechnol. Adv. 2018; 36, 1391–1411.
29. Hendre A. D., Taylor G. W., Chávez E. M., Hyde S. A systematic review of silver diamine fluoride: effectiveness and application in older adults. Gerodontology 2017; 34, 411–419.
30. Hordyjewska A., Popiołek Ł., Kocot J. The many ‘faces’ of copper in medicine and treatment. Biometals 2014; 27, 611–621.
31. Vincent M., Hartemann P., Engels-Deutsch M. Antimicrobial applications of copper. Int. J. Hyg. Environ. Health 2016; 219, 585–591.
32 . O’Gorman J., Humphreys H. Application of copper to prevent and control infection. Where are we now? J. Hosp. Infect. 2012; 81, 217–223.
33. Borkow G., Gabbay J. Copper as a biocidal tool. Curr. Med. Chem. 2005; 12, 2163–2175.
34. Li H., Sun H. Recent advances in bioinorganic chemistry of bismuth. Curr. Opin. Chem. Biol. 2012; 16, 74–83.
35. Yang N., Sun H. Biocoordination chemistry of bismuth: Recent advances. Coord. Chem. Rev. 2007; 251, 2354–2366.
36. Keogan D. M., Griffith D. M. Current and potential applications of bismuth-based drugs. Molecules 2014; 19, 15258–15297.
37. Habala L., Devínsky F., Egger A. Metal complexes as urease inhibitors. J. Coord. Chem. 2018; 71, 907–940.
38. Frézard F., Demicheli C., Ribeiro R. R. Pentavalent antimonials: New perspectives for old drugs. Molecules 2009; 14, 2317–2336.
39. Tamás M. J. Cellular and molecular mechanisms of antimony transport, toxicity and resistance. Environ. Chem. 2016; 13, 955–962.
40. Li F., Collins J. G., Keene F. R. Ruthenium complexes as antimicrobial agents. Chem. Soc. Rev. 2015; 44, 2529–2542.
41. Navarro M., Gabbiani C., Messori L., Gambino D. Metal-based drugs for malaria, trypanosomiasis and leishmaniasis: recent achievements and perspectives. Drug Discov. Today 2010; 15, 1070–1078.
42. Zhang L., Carroll P., Meggers E. Ruthenium complexes as protein kinase inhibitors. Org. Lett. 2004; 6, 521–523.
43. Mishra A. K., Mishra L. (eds.) Ruthenium chemistry. Singapore: Pan Stanford Publishing Pte. Ltd. 2018.
44. Amolegbe S. A., Akinremi C. A., Adewuyi S., Lawal A., Bamigboye M. O., Obaleye J. A. Some nontoxic metal‑based drugs for selected prevalent tropical pathogenic diseases. J. Biol. Inorg. Chem. 2017; 22, 1–18.
45. Kotek J., Lukeš I. Cheláty pro využití v biomedicínských oborech. Chem. Listy 2010; 104, 1163–1174.
46. Caschera L., Lazzara A., Piergallini L., Ricci D., Tuscano B., Vanzulli A. Contrast agents in diagnostic imaging: present and future. Pharmacol. Res. 2016; 110, 65–75.
47. Vallabhajosula S. Molecular imaging. Radiopharmaceuticals for PET and SPECT. Berlin – Heidelberg: Springer-Verlag 2009.
48. Saha G. B. Fundamentals of nuclear pharmacy. New York: Springer Science 2010.
49. Zanzonico P. Principles of nuclear medicine imaging: Planar, SPECT, PET, multi-modality, and autoradiography systems. Radiat. Res. 2012; 177, 349–364.
50. Khalil M. M., Tremoleda J. L., Bayomy T. B., Gsell W. Molecular SPECT imaging: An overview. Int. J. Mol. Imaging 2011; Article ID 796025.
51. Kohlíčková M., Jedináková-Křížová V., Melichar F. Komplexní sloučeniny technecia – jejich využití v přípravě radiofarmak a některé farmakokinetické vlastnosti. Chem. Listy 1998; 92, 643–655.
52. Schwochau K. Technetium: chemistry and radiopharmaceutical applications. Weinheim: Wiley-VCH Verlag GmbH 2000.
53. Saha G. B. Basics of PET imaging. Physics, chemistry, and regulations. New York: Springer Science 2010.
54. Vāvere A. L., Lewis J. S. Cu-ATSM: A radiopharmaceutical for the PET imaging of hypoxia. Dalton Trans. 2007; 43, 4893–4902.
55. Westbrook C. MRI at a glance. Chichester: John Wiley & Sons Ltd 2016.
56. Laurent S., Henoumont C., Stanicki D., Boutry S., Lipani E., Belaid S., Muller R. N., Elst L. V. MRI contrast agents. From molecules to particles. Singapore: Springer Nature 2017.
57. Kim H.-K., Lee G. H., Chang Y. Gadolinium as an MRI contrast agent. Future Med. Chem. 2018; 10, 639–661.
58. Zhang Z., Shrikumar A. N., McMurry T. J. Gadolinium meets medicinal chemistry: MRI contrast agent development. Curr. Med. Chem. 2005; 12, 751–778.
59. Giovenzana G. B., Lattuada L., Negri R. Recent advances in bifunctional paramagnetic chelates for MRI. Isr. J. Chem. 2017; 57, 825–832.
60. Bonnet C. S., Tóth É. Smart contrast agents for magnetic resonance imaging. Chimia 2016; 70, 102–108.
61. Lux J., Sherry A. D. Advances in gadolinium-based MRI contrast agent designs for monitoring biological processes in vivo. Curr. Opin. Chem. Biol. 2018; 45, 121–130.
62. Sherry A. D., Wu Y. The importance of water exchange rates in the design of responsive agents for MRI. Curr. Opin. Chem. Biol. 2013; 17, 167–174.
63. Pullicino R., Das K. Is it safe to use gadolinium-based contrast agents in MRI? J. R. Coll. Physicians Edinb. 2017; 47, 243–246.
64. Kelkar S. S., Reineke T. M. Theranostics: combining imaging and therapy. Bioconjugate Chem. 2011; 22, 1879–1903.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2018 Issue 5-6-
All articles in this issue
- Pivo se sníženým obsahem cukru a alkoholu vhodné pro diabetiky
- The beginnings of health libraries of the Czech Brothers Hospitallers in the 18th century
- Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť I
- Zapojení klinického farmaceuta do managementu pádů u polymorbidního geriatrického pacienta s opakovanými pády v anamnéze
- Společně zpracované pomocné látky pro přímé lisování tablet
- Nevyužívaná léčiva a jejich finanční dopad na zdravotní systém v České republice
- NMR a IR analýza přírodních látek izolovaných z léčivých hub Cordyceps
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pivo se sníženým obsahem cukru a alkoholu vhodné pro diabetiky
- Komplexy kovov v medicíne a farmácii – minulosť a súčasnosť I
- Společně zpracované pomocné látky pro přímé lisování tablet
- Zapojení klinického farmaceuta do managementu pádů u polymorbidního geriatrického pacienta s opakovanými pády v anamnéze
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

