-
Medical journals
- Career
Genisteín: sľubná molekula modulujúca rast nádorov a hojenie rán?
Authors: Petra Mitrengová; Pavel Mučaji; Vlasta Peržeľová; Erik Dosedla; Peter Gál
Published in: Čes. slov. Farm., 2018; 67, 3-13
Category: Review Articles
Overview
Aj keď bola v rôznych štúdiách popísaná stimulácia hojenia rán po estrogénovej substitučnej terapii, mnohé vedľajšie účinky tejto hormonálnej suplementácie zabraňujú jej výraznému rozšíreniu v klinickej praxi. Na druhej strane sa fytoestrogén genisteín (selektívny modulátor estrogénových receptorov patriaci do skupiny izoflavónov) dostal už do klinického skúšania pri liečbe nádorových ochorení a experimenty naznačujú, že by mohol mať pozitívny vplyv aj na hojenie rán. Medzi hlavné a doteraz objasnené mechanizmy účinku patrí indukcia apoptózy, zastavenie bunkového cyklu, inhibícia angiogenézy a tyrozín kinázovej aktivity, ako aj chemoprevencia nádorových ochorení a zmiernenie klimakterických ťažkostí. Žiaľ nie všetky mechanizmy jeho pôsobenia pri biologických procesoch zapojených do hojenia rán a rastu nádorov sú plne objasnené. Z tohto dôvodu táto prehľadová práca sumarizuje doposiaľ známe vplyvy genisteínu na biologické procesy sledované na rôznych modeloch hojenia rán a na jednotlivých nádoroch.
Kľúčové slová:
genisteín • tkanivová reparácia a regenerácia • karcinóm • koža
Úvod
Vzhľadom na niektoré negatívne účinky hormonálnej substitučnej terapie sa v poslednom období zvyšuje dopyt po alternatívnych produktoch založených na prírodnej báze. Tu sa uplatňujú fytoestrogény (FE), nesteroidné zlúčeniny rastlinného pôvodu, ktoré štruktúrou a funkciou napodobňujú účinky ľudských estrogénov a pripisujú sa im mnohé prospešné vlastnosti v prevencii a terapii nádorových a kardiovaskulárnych ochorení, ako aj menopauzálnych príznakov a osteoporózy1). FE vykazujú estrogénne aj antiestrogénne účinky (podobne ako selektívne modulátory estrogénových receptorov (SERM – selective estrogen receptor modulator), v závislosti na koncentrácii cirkulujúcich endogénnych estrogénov a expresii estrogénových receptorov (ER)2). Veľkou prednosťou SERM-ov je možnosť dosiahnuť prospešný efekt estrogénov v cieľovom tkanive a zároveň minimalizovať ich škodlivé/nežiadúce účinky na ostatné orgány/tkanivá3). Podobne ako estrogény, aj FE sa viažu na ER a zvyšujú syntézu globulínu viažuceho sexuálne hormóny (SHBG – sex hormone binding globuline) v pečeni4), ale ako antiestrogény napr. inhibujú aromatázovú aktivitu a proliferáciu nádorových buniek prsníka2). Klinicky najznámejším predstaviteľom FE je genisteín (GEN). GEN sa zaraďuje medzi prírodné SERM a môže mať napríklad pozitívny vplyv na hojenie rán u postmenopauzálnych žien bez nežiadúcich estrogénnych účinkov na prsník a/alebo maternicu5). Okrem toho sa ukázalo, že GEN vykazuje aj antioxidačné vlastnosti reguláciou aktivity antioxidačných enzýmov ako superoxiddizmutázy (SOD), heme oxygenase-1 (HO-1) a glutatiónperoxidázy (GPx)6), čím sa podieľa na neutralizácii reaktívnych kyslíkových radikálov (ROS).
Genisteín
GEN (4`,5,7-trihydroxyizoflavón) patrí medzi polyfenoly-izoflavóny7). Je to lipofilný žltkastobiely svetlocitlivý kryštalický prášok horkej chuti8), s nízkou solubilitou vo vode, avšak dobrou rozpustnosťou v metanole, etanole7, 9, 10) a dimetylsulfoxide7). GEN sa v najvyššej koncentrácii nachádza v sóji a sójových produktoch (okrem sójovej omáčky), a to najmä vo forme glykozidických konjugátov11). Najčastejšie sa vyskytuje vo forme biologicky aktívneho β-glukozidu genistínu, pričom fermentáciou alebo trávením sóje a sójových produktov sa z neho uvoľňuje molekula sacharidu a vzniká samotný GEN11). Základnú štruktúru jeho planárnej molekuly12) tvorí flavónové jadro zložené z dvoch benzénových kruhov spojených cez heterocyklický pyránový kruh13).
Molekula GEN je podobná štruktúre 17-β-estradiolu (E2) (obr. 1)14). Presná pozícia a počet hydroxylových substituentov v molekule izoflavónu determinuje väzbovú aktivitu k ER. Príkladom môže byť vysoká väzbová afinita GEN k ER-β, avšak eliminácia jednej hydroxylovej skupiny (daidzeín, biochanín A) alebo dvoch hydroxylových substituentov (formononetín) spôsobuje veľkú stratu väzbovej aktivity15). Na druhej strane adícia acetylovaných sacharidových hydroxylov s C=C väzbou v molekule sacharidu a α-glykozidickou väzbou v polohe C7 GEN je dôležitá pre cytotoxickú aktivitu voči nádorovým bunkám16). Ak je prítomná dvojitá väzba v molekule sacharidu viazaného priamo k aglykónu, zvyšuje sa toxicita, ale keď je prítomný v disacharidovej forme, aktivita a aj selektivita k nádorovým bunkám sa zlepšuje17). Zmeny štruktúry a následnej funkčnosti molekuly GEN sú schematicky zobrazené na obrázku 2.
Image 1. Štruktúra estradiolu (E2) a genisteínu (GEN) 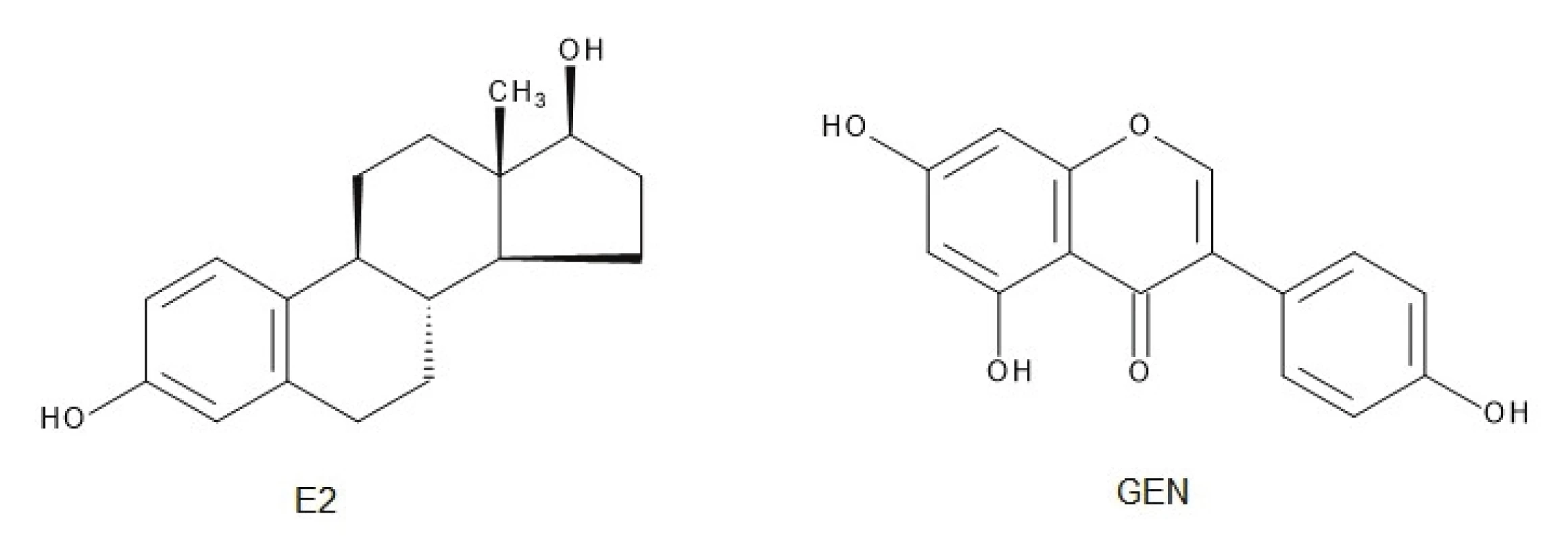
Image 2. Zmeny v štruktúre molekuly genisteínu (GEN) vedú k zmenám funkčnosti/účinnosti 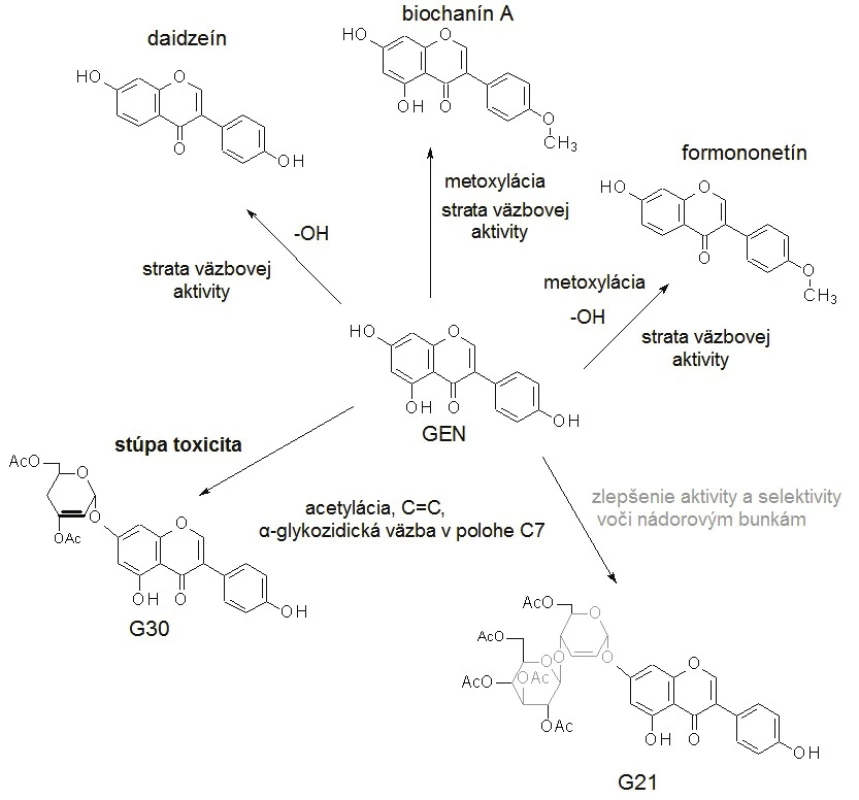
Biologická dostupnosť
Hoci je GEN rýchlo absorbovaný v tenkom čreve, má nízku biologickú dostupnosť kvôli zlej rozpustnosti vo vode18) a efektívne nie je ani zvýšenie dávky9). Miesto najintenzívnejšieho metabolizmu GEN je tenké črevo a pečeň, pričom jeho hlavnými metabolickými dráhami sú glukuronidácia a v menšom rozsahu sulfonácia9, 18, 19). Niektoré ďalšie tkanivá (obličky, srdce, pľúca) majú takisto vysokú hladinu expresie glukuronyltransferázy a sulfotransferázy, čo umožňuje jeho metabolizovanie9). Z uvedených dôvodov je preto efektívnejšie podávať GEN parenterálne20).
Signalizácia
Hlavný farmakologický mechanizmus účinku GEN je kompetitívna väzba k ER. V in vitro podmienkach sa ukázalo, že GEN inhibuje tyrozín kinázy, topoizomerázu II, trombocyty aktivujúci faktor (PDGF) a EGF (epidermálny rastový faktor) indukovanú expresiu c-fos, diacylglycerol syntézu a angiogenézu12, 21). Mechanizmus účinku GEN ďalej spočíva v indukcii apoptózy a zastavení bunkového cyklu v G2/M fáze v nádorových bunkách21) a ochrane LDL cholesterolu pred jeho oxidáciou a následný ateroprotektívny účinok22). Zaujímavá je koncentračná závislosť účinku, pričom GEN pri vyšších koncentráciách napr. inhibuje aktivitu tyrozín-špecifických proteínových kináz (PTK) spojených s EGF receptorom23), no na druhej strane pri nižších koncentráciách vykazuje estrogénne účinky24). Medzi dôležité protinádorové účinky GEN patrí aj indukcia diferenciácie malígnych nádorových buniek, vychytávanie voľných kyslíkových a dusíkových radikálov25) a prevencia aktivácie NF-κB transkripčného faktora v nádorových bunkách26).
Genisteín a angiogenéza
Angiogenéza je tvorba ciev z už existujúcich ciev pučaním. Tento biologický proces je kľúčový pri tvorbe nového tkaniva či už pri raste nádorov, alebo hojení rán. GEN moduluje rast a pučanie endotelových buniek, tvorbu kapilár a niektoré signálne dráhy zapojené do angiogenézy27). Vaskulárny endotelový rastový faktor (VEGF) je dôležitý regulátor angiogenézy a inhibícia jeho sekrécie alebo blokáda jeho receptorov sa spája s potlačením tvorby krvných ciev27). Ukázalo sa, že GEN28) inhibuje expresiu VEGF v závislosti od dávky, a to za hypoxických aj normoxických podmienok. V inej štúdii29) zase GEN v dávkach 10–50 µM tlmil rast endotelových buniek izolovaných z pupočníka po stimulácii s VEGF a inhiboval ako bazálnu, tak aj hypoxiou-indukovanú (cez HIF-1 – hypoxiou indukovaný faktor) expresiu VEGF v nádorovýh a endotelových bunkách27).
Na druhej strane v in vivo experimentoch aplikácia GEN výrazne redukovala tvorbu mikrokapilár30–32). Tieto antiangiogénne vlastnosti sa pripisujú inhibícii proangiogénnych faktorov ako rastový faktor odvodený od trombocytov (PDGF), tkanivový faktor (TF), urokináza (uPA), matrix metaloproteinázy-2 a -9 (MMP-2, a MMP-9)28) a up regulácii antiangiogénnych faktorov (inhibítor aktivátora plazminogénu-1, endostatín, angiostatín a thrombospondín-1)28). Avšak publikovaná bola aj práca, ktorá ukázala, že GEN neblokuje aktivitu MMP-2 a -933).
Genisteín a rakovina prsníka
Viac ako 50 % nádorov prsníka sa vyskytuje v rozvinutých krajinách, najmä v Severnej Amerike a Európe, kým v Ázii, kde je vysoká konzumácia sójových produktov už od útleho veku, je dlhodobo pozorovaná najnižšia incidencia34). Toto pozorovanie je dnes vysvetľované tzv. chemoprevenciou. Táto teória je podložená aj skutočnosťou, že ázijské ženy, ktoré sa presťahovali do USA, majú v druhej generácii už podobnú incidenciu rakoviny prsníka ako americké ženy35). Chemopreventívne účinky GEN sú založené na zvýšení maturácie/diferenciácie buniek prsníka s následnou redukciou proliferácie buniek prsnej žľazy, a tým aj nižším rizikom rozvoja rakoviny prsníka, predovšetkým v dospelosti34–36). Tento proces môžeme pozorovať napr. aj pri pôsobení tehotenských hormónov34). Na animálnom modeli nedospelých potkanov GEN upreguloval expresiu receptorov pre EGF (EGFR), čo mohlo indukovať skorú diferenciáciu buniek mliečnej žľazy. Výsledkom je pravdepodobne menej aktívna EGF signálna dráha v dospelosti, čo vedie k potlačeniu rozvoja rakoviny prsníka34). Dôležité je však správne načasovanie podávania terapie. Keď je estrogén podávaný ešte pred maturáciou prsnej žľazy a iniciáciou karcinogenézy, počet nádorov bude pravdepodobne nižší, avšak keď je estrogén podávaný po rozvoji estrogén-dependentného nádoru, jeho rast bude stimulovaný36).
V nadväznosti na účinky GEN závislé od jeho koncentrácie sa ukázalo, že GEN pri nízkych koncentráciách (< 10 μM) stimuluje rast buniek v ER-pozitívnych nádoroch prsníka in vitro, ako aj v xenografických zvieracích modeloch35–38), pričom tieto in vivo účinky sú inhibované tamoxifénom (TAM)39). Na druhej strane pri koncentráciách nad 10 μM GEN inhiboval proliferáciu ER-pozitívnych, (MCF-7)36, 40) ako aj ER-negatívnych MDA-MB-231 nádorových buniek prsníka38), pričom v posledných menovaných zároveň redukoval hladinu cyklínu B1, CDK1 (cyklín dependentné kinázy) a Cdc25 C38) a inhiboval aktivitu PTK35). Usudzuje sa teda, že liečba GEN môže spôsobiť zastavenie bunkového cyklu redukciou aktivity CDK1/cyklín B kinázového komplexu38) a inhibíciou fosforylácie tyrozínu36, 37, 41). GEN sa viaže na ER-β pri koncentráciách nižších, než je potrebné na aktiváciu ER-α a jeho aktivácia má inhibičný účinok na rast bunky. Selektívna aktivácia ER-β v bunkách môže teda slúžiť na potlačenie rastu estrogén-dependentných nádorových buniek37). Ak je ER-β prítomný spolu s ER-α, pôsobí proti jeho proliferačným účinkom na nádorové bunky prsnej žľazy42). ER-β pozitívne nádory sú lepšie liečiteľné/majú lepšiu prognózu než ER-β negatívne kvôli antiproliferačným účinkom tohto receptora. Avšak množstvo ER-β klesá pri nádoroch prsníka, a tým sa zhoršuje aj ich prognóza. Na druhej strane expresia ER-α podporuje rozvoj rezistencie proti antineoplastikám43).
Inaktivácia Akt a NF-κB signálnych dráh sa podieľa na zvýšení apoptózy nádorových buniek. V MDA-MB-231 bunkách predliečených GEN (50 μM) počas 72 h pred stimuláciou EGF došlo k rušeniu EGF a Akt-indukovanej aktivácii NF-κB. GEN teda nielen inhibuje NF-κB DNA väzbovú aktivitu za nestimulovaných podmienok, ale tiež inhibuje EGF-indukovanú NF-κB aktivitu44).
Synergické účinky GEN boli pozorované v kombinácii s viacerými protinádorovými liečivami45, 46). Napríklad kombinácia GEN (25 µM) a tamoxifénu (TAM) (5 µM) v BT-474 nádorových bunkách prsníka synergicky indukovala apoptózu, potencovala inhibičný účinok na rast nádoru a zastavenie bunkového cyklu v G1 fáze, znižovala expresiu survivínu a down regulovala expresiu EGFR, HER2 a ER-α45). No nie všetky štúdie preukázali pozitívny účinok FE v kombinácii s TAM. Napríklad nízke dávky GEN rušili inhibičný účinok TAM v humánnych MCF-7 a T47D nádorových bunkách prsníka, pričom pri vyšších dávkach tento efekt pozorovaný nebol21, 47). Za rovnakých podmienok však nebol pozorovaný ani účinok na ER-negatívne bunky MDA-MB-43547).
V štúdii realizovanej na bunkovej línii MDA-MB-231 mal GEN silný antiproliferačný účinok závislý od dávky a času podania. Tento účinok bol sprostredkovaný inhibíciou NF-κB signálnej dráhy prostredníctvom Notch-1 expresie48). Hladiny NF-κB cieľových proteínov – cyklínu B1, Bcl-2 (B cell lymphoma 2), Bcl-xL (Bcl-2-associated X protein) boli tiež znížené48). Naopak, v MCF-7 bunkách GEN zvyšoval expresiu antiapototického Bcl-2 a proapoptotických proteínov p53 a Bax40). GEN indukoval apoptózu v MCF-7 bunkách aj prostredníctvom Ca2+ uvoľňovaného z endoplazmatického retikula, čo malo za následok aktiváciu calpain-kaspáza 7 kaskády aj aktiváciu ASK1 (apoptosis signalig kinase1) a p38 MAPK (mitogen-activated protein kinase)49).
TrxR (thioredoxin reductase) up regulácia a GPx (glutathione peroxidase) down regulácia sú spájané s progresiou rakoviny prsníka50). GEN (100 µM) selektívne indukoval bunkovú smrť v MCF-7 bunkách nezávisle od aktivácie ER tým, že redukoval expresiu CuZnSOD, MnSOD a TrxR a zvyšoval GPx s následným nárastom proapoptického pomeru BAX/Bcl-2 a so súčasnou down reguláciou antiapoptického survivínu. Výsledkom bola nerovnováha v antioxidačnom systéme, čo môže podporovať oxidačný stres v MCF-7 bunkách s následnou indukciou apoptózy a autofágie50).
Genisteín a rakovina vaječníkov
Rakovina vaječníkov patrí medzi najzhubnejšie gynekologické nádorové ochorenia s najvyššou incidenciou medzi 55. až 64. rokom života. Asi iba 46 % postihnutých žien sa dožíva 5 rokov od prvotného stanovenia diagnózy, a to predovšetkým kvôli neskorej diagnostike a pokročilému štádiu ochorenia51).
Ukázalo sa, že GEN inhibuje rast nádorových buniek vaječníka OVCAR-3 a expresiu VEGF52). Avšak proliferáciu HO-8910 buniek ovariálneho karcinómu s nízkym metastatickým potenciálom GEN inhiboval len pri vysokých koncentráciách (50 a 100 µM) a naopak pri nízkych koncentráciách (1, 10 a 25 µM) ich proliferáciu zvyšoval53). Zároveň v rozpätí 10–100 µM indukoval poškodenie DNA lineárne s narastajúcou koncentráciou. Pozitívny účinok na indukciu apoptózy a zastavenie bunkového cyklu v G2/M bol v danej štúdii pozorovaný len pri koncentrácii 100 µM53). Iná štúdia porovnávajúca účinok GEN, G8CG (genisteín-8-C-glukozidu) a ich kombinácie preukázala inhibičný efekt oboch FE na bunkovú proliferáciu estrogén dependentných nádorových buniek vaječníkov SK-OV-3, ako aj zvýšenie apoptózy v závislosti od dávky, avšak apoptický účinok GEN bol slabší než účinok G8CG pri použití rovnakých koncentrácií54).
Taktiež sa ukázalo, že GEN potláčal epitelovo-mezenchýmový prechod (EMT) a migračnú schopnosť BG-1 buniek rakoviny vaječníkov zvýšenú účinkom E2 a iných xenoestrogénov antagonizovaním ER signalizácie. Mechanizmus účinku bol spojený s inhibíciou expresie vimentínu a zvýšením expresie E-kaderínu14).
Genisteín a rakovina hrubého čreva
Tretím najčastejšie diagnostikovaným nádorovým ochorením u mužov aj žien je kolorektálny karcinóm. Väčšina prípadov sa začína z nezhubných polypov vznikajúcich na vnútornej strane sliznice čreva a rozvíja sa počas niekoľkých rokov55). Animálne experimenty na potkanoch56) demonštrovali, že expozícia sójovým izoflavónom počas maternicového aj postnatálneho vývoja pôsobí protektívne pred azoxymetánom indukovanou karcinogenézou hrubého čreva (HČ). Táto práca poukazuje na fakt, že sójové izoflavóny obmedzujú rast nádoru zvýšením expresie ER-β, pričom mechanizmus účinku je založený na tvorbe komplexu s ER-β, čo vedie pravdepodobne k indukcii apoptózy a inhibícii proliferácie nádorových buniek56). Zvýšená expresia ER-β a následný pokles živých buniek po terapii sójovými izoflavónmi pozorovali aj u ER-β pozitívnych DLD-1 buniek kolorektálneho karcinómu56).
V ľudských nádorových bunkách HČ je zvýšená expresia a aktivita EGFR, čím dochádza k zoslabeniu tumor supresorovej aktivity FOXO3 cez PI3K/Akt dráhu, čo vedie k zvýšenej proliferácii. Ukázalo sa, že GEN u HT-29 buniek kolorektálneho karcinómu inhibuje EGF-indukovanú FOXO3 disociáciu z p53(mut), čo ďalej podporuje FOXO3 aktivitu a vedie k zvýšenej expresii p27kip1 inhibítora bunkového cyklu s následnou inhibíciou proliferácie nádorových buniek HČ57). Okrem toho došlo k zoslabeniu aktivity PI3K/Akt signálnej dráhy, ktorá je dôležitá v regulácii progresie kolorektálneho karcinómu57).
Pool-Zobel a kol. potvrdili koncentračnú selektivitu GEN voči nádorovým bunkám HČ, pričom zistili, že koncentrácie 12,5–100 µM indukujú zlomy DNA v HT29 (klon 19A) bunkách, avšak koncentrácie do 50 µM neindukovali zlomy alebo oxidáciu báz v normálnych epitelových bunkách HČ58). Poškodenie DNA, blokádu bunkového cyklu v G2/M fáze a iniciáciu apoptózy na HCT-116 a SW-480 bunkách kolorektálneho karcinómu po terapii GEN (25–100 μM) pozorovali aj iní autori26). Tieto procesy boli primárne sprostredkované up reguláciou p53/p21waf1/cip1, GADD45α a down reguláciou cdc2 a cdc25A26).
Genisteín a rakovina prostaty
Rakovina prostaty (PC) je po rakovine kože druhým najčastejšie diagnostikovaným nádorovým ochorením u mužov v USA. Spravidla sa vyskytuje po 50. roku života a má relatívne dobrú prognózu prežitia, ak je diagnostikovaná vo včasnom štádiu ochorenia a bez metastáz59). EGFR a EGF podobné peptidy sú často nadmerne exprimované v ľudských karcinómoch a sú schopné indukovať bunkovú transformáciu60). Dalu a kol. preukázali, že GEN prítomný v strave môže down regulovať expresiu a inhibovať fosforyláciu EGFR aj ErbB2/Neu receptora lokalizovaných na karcinómových bunkách prostaty u potkanov bez vedľajších toxických účinkov na hostiteľa12).
Je známe, že bunky v G2/M fáze bunkového cyklu sú rádiosenzitívnejšie než bunky v iných fázach cyklu. Z toho dôvodu predliečenie PCa buniek GEN spôsobovalo zastavenie rastu v G2/M fáze cyklu. Týmto mechanizmom sa môže zvyšovať ich rádiosenzitivita a následné usmrcovanie buniek. Pokles cyklínu B1 a nárast p21Waf1 po kombinácii GEN/radiácia, má takisto za následok zastavenie rastu v G2/M fáze a môže byť spojený s inhibíciou NF-κB DNA väzbovej aktivity61). Zaujímavé boli výsledky štúdie, v ktorej GEN (100 µM) zvyšoval glutatiónperoxidázovú aktivitu v LNCaP aj PC3 bunkách bez výrazných zmien aktivít iných antioxidačných enzýmov ako napr. CAT a SOD v porovnaní s kontrolou a nižšou testovanou dávkou GEN (5 µM). V LNCaP bunkách bola navyše down regulovaná expresia mnohých ďalších génov vrátane survivínu (inhibítor apoptózy), DNA topoizomerázy II, CDC6 a MAPK 6. Z tohto pohľadu môžeme usudzovať, že aktivácia glutatiónperoxidázy je jeden z dôležitých mechanizmov účinku genisteínu na bunky karcinómu prostaty62).
V in vitro štúdii GEN a β-lapachón (LP) spôsobili zastavenie bunkového rastu, apoptózu a nekrózu v PC3 a LNCaP bunkách v závislosti od dávky v monoterapii aj v kombinovanej terapii GEN a LP. Pri nižších koncentráciách GEN a LP v oboch bunkových líniách spôsobovali smrť apoptózou, pri vyšších koncentráciách sa progresívne zvyšovala incidencia nekrózy. Avšak prechod z apoptózy k nekróze môže byť čiastočne spôsobený aj toxicitou testovanej látky pri vyšších koncentráciách. Môžeme však konštatovať, že bunková línia PC3 bola na kombinovanú aj monoliečbu citlivejšia než LNCaP. Ukázalo sa, že LP zastavuje bunkový rast v G1 a S fáze bunkového cyklu, kým GEN indukuje zastavenie v G2/M fáze. Z týchto výsledkov môžeme vyvodzovať efektívnejšiu inhibíciu delenia buniek za použitia liečiv, ktoré regulujú rôzne kontrolné body bunkového cyklu63). V LNCaP bunkách GEN aktivoval kaspázu-3 a -9 a indukoval apoptózu, pričom účinok bol omnoho silnejší v kombinácii s topotekanom (inhibítor topoizomerázy I)64).
Genisteín a rakovina pečene
Hepatocelulárny karcinóm (HCC) patrí medzi najzákernejšie nádorové ochorenia kvôli veľkej chemorezistencii k súčasne dostupným antineoplastikám. Z tohto dôvodu je najúčinnejšie chirurgické odstránenie nádoru. Vysoká incidencia metastáz je však najčastejšou príčinou úmrtia pacientov s HCC, preto je potrebné získať nové, protinádorovo a antimetastaticky účinné liečivá65).
Potencionálne chemopreventívne aj chemoterapeutické účinky GEN proti rakovine pečene naznačili viaceré in vitro štúdie. Ukázalo sa, že GEN indukuje apoptózu v rôznych bunkových líniách HCC, napr. Bel 740266), HuH-767), Hep3B68) a HepG269). Ďalej môže ovplyvniť progres HCC reguláciou bunkového cyklu, pričom účinkuje ako sľubný inhibítor metastatických procesov65, 66). Napr. v štúdii realizovanej na bunkovej línii HepG2 s TPA (12-O-Tetradekanoylforbol-13-acetát) indukovanou karcinogenézou, GEN efektívne potláčal expresiu MMP-9 supresiou MAPK/AP-1 a PI3K/AKT/NF-κB kaskád, čo následne viedlo k potlačeniu metastatického potenciálu a invazivity buniek70). Terapeuticky zaujímavá je aj schopnosť GEN inhibovať EMT indukovaný TGF-β (transformujúci rastový faktor beta), ktorý je spájaný s procesom metastázovania. Antimetastatický účinok GEN v liečbe HCC spočíva aj v inhibícii NFAT1 (nukleárny transkripčný faktor aktivovaných T-buniek, dôležitý v malignite a progresii tumoru) zapojeného do aktivácie EMT71).
FAK (focal adhesion kinase) je cytoplazmatická tyrozínkináza asociovaná s bunkovým rastom, bunkovou adhéziou a motilitou. Up regulácia FAK je spojená s onkogenézou, na druhej strane nízka expresia je spojená s poklesom bunkovej migrácie, stratou bunkového uchytenia a indukciou apoptózy. Ukázalo sa, že GEN down reguloval p125FAK, čo naznačuje, že môže slúžiť ako protinádorové agens v progresii HCC blokovaním FAK signálnych dráh66). U MHCC97-H65) a Bel 740266) buniek HCC došlo po podaní GEN k zastaveniu bunkového cyklu v G0/G1 a G2/M fáze a indukcii apoptózy. GEN navyše redukoval aj adhezívne vlastnosti MHCC97-H buniek65).
Genisteín a rakovina žalúdka
Je dobre známe, že nádorové kmeňové bunky sú zodpovedné za relaps ochorenia. Výnimkou nie sú ani kmeňové bunky nádoru žalúdka (GCSC – gastric cancer stem cells). Zistilo sa, že GEN je schopný inhibovať niektoré kľúčové vlastnosti GCSC ako schopnosť sebaobnovy či rezistencie voči liečivám. Navyše GEN inhibuje aj invazivitu a migračnú schopnosť nádorových buniek žalúdka72, 73). Tieto zmeny boli spojené s inibíciou expresie ABCG2 (ATP-binding cassette subfamily G member 2) transportného proteínu, inhibíciou aktivity ERK½ 72) a down reguláciou expresie Gli173).
V preklinických štúdiách bol GEN (20 mM) schopný indukovať apoptózu u nádorových buniek izolovaných zo žalúdka znížením expresie Bcl-2 a up reguláciou Bax74). V humánnej bunkovej línii BGC-823 nádoru žalúdka GEN inhiboval bunkovú proliferáciu a indukoval apoptózu v závislosti od času a dávky75). V tomto modeli molekula FE vykazovala značný inhibičný efekt na aktiváciu transkripčného faktora NF-κB, spôsobujúcu redukciu koncentrácie COX-2 proteínu75). V inej in vivo štúdii bola u potkanov indukovaná karcinogenéza pomocou N-metyl-N’-nitro-N-nitrózo guanidínu. Následne boli potkany liečené GEN (30 mg/kg), čo viedlo k zníženiu mitotickej aktivity a počtu ciev antrálnej mukózy, signifikantnej redukcii incidencie nádorov žalúdka, indukcii apoptózy a zníženiu angiogenézy už existujúcich nádorov76).
Genisteín a rakovina pankreasu
Rakovina pankreasu, predovšetkým jeho exokrinnej zložky, patrí medzi najzhubnejšie nádory vôbec a dosahuje v závislosti od štádia ochorenia extrémne vysokú mortalitu77). Štúdia vykonaná za hypoxických podmienok na bunkových líniách ľudského adenokarcinómu pankreasu Capan-1, Capan-2, AsPc-1, PANC-1 a Mia PaCa-2 preukázala inhibičný efekt GEN na sekréciu VEGF a aktiváciu HIF-1, čím došlo k inhibícii angiogenézy78).
Na druhej strane79) samotný GEN neindukoval apoptózu a autofágiu nádorových buniek, ale signifikantne zvyšoval oba tieto procesy indukované 5-fluorouracilom (cytostatikum) spojenú s poklesom expresie bcl-2. Podobne sa ukázalo, že GEN potencuje účinky aj iných protinádorových liečiv. Napr. kombinácia erlotinibu (inhibítor receptorových tyrozín kináz) a GEN viedla k zníženiu prahu pre indukciu apoptózy u BxPC-3, CAPAN-2, a AsPAC-1 bunkových línií80). Rovnaký vplyv mala aj trojkombinácia GEN, erlotinib a gemcitabin (cytostatikum) na nádorové bunky COLO-357. Predliečenie GEN blokovalo aj aktiváciu NF-κB netoxickými dávkami antineoplastík dexecatelom alebo cisplatinou v nádorových bunkách pankreasu (BxPC-3) a podieľalo sa na inhibícii bunkového cyklu a indukcii apoptózy81).
No nie na všetky bunkové línie mal GEN rovnaký synergický účinok. V BxPC-3 bunkách GEN potencoval down reguláciu survivínu indukovanú erlotinibom, ale nie v líniách HPAC alebo MIAPaCa. V bunkovej línii COLO-357 bola inhibícia NF-κB aktivácie po pridaní GEN spojená so zvýšeným apoptickým účinkom erlotinibu a gemcitabínu, ako aj s down reguláciou EGFR, survivínu a Bcl-xL80).
Je známe, že karcinómy v ktorých je vysoký podiel buniek, ktoré prešli EMT, majú výrazne horšiu prognózu. Z tohto dôvodu je cieľom modernej terapie zvrátiť tento nepriaznivý stav procesom zvaným MET (mesenchymal-epithelial transition). Ukázalo sa, že kombinácia GEN a miR-223 (MicroRNA-223) viedla k výraznejšiemu zvráteniu EMT k MET v pankreatických nádorových bunkách AsPC-1 GR a BxPC-3 GR v porovnaní so samotným GEN alebo samotným miR-223. Liečba ďalej inhibovala bunkovú motilitu a invazívny potenciál buniek a zvyšovala ich citlivosť voči gemcitabínu omnoho výraznejšie než monoterapia danými zložkami82).
Genisteín a rakovina pľúc
Aj v dnešnej dobe patrí malobunkový karcinóm pľúc medzi najhoršie formy rakoviny s fatálnym koncom. Ukázalo sa, že GEN vykazuje protinádorové účinky na bunkovú líniu H446 malobunkového karcinómu pľúc, kde indukoval zastavenie bunkového cyklu v G2/M fáze a apoptózu, dereguláciu FoxM1 (Forkhead box proteínu M1) a jeho cieľových génov (Cdc25B, cyklín B1 a survivín a i.)83). Na druhej strane v nemalobunkovej línii A549 došlo účinkom GEN k inhibícii proliferácie, indukcii apoptózy a aktivácii kaspázy 3 a 9 prostredníctvom regulácie miR-27 (MicroRNA-27) a MET84).
Niektoré štúdie poukazujú aj na synergické účinky GEN, napr. v A549 bunkách GEN (5–10 mM) zosilňoval apoptózu a antiproliferačný efekt indukovaný trichostatínom A (TSA – inhibítor histónových deacetyláz)85). V kombinácii s ATRA (all-trans retinoic acid) zase výrazne inhiboval invazivitu A549 buniek in vitro, čo bolo spojené so znížením expresie MUC1 a ICAM-1 a so zmenou expresie proteínov regulujúcich bunkový cyklus (CDK4, Rb a p-ERK1/2) a apoptózu (Bax a Bcl-2)86). Synergické účinky vykazoval aj v kombinácii s gefitinibom (inhibítorom EGFR) na bunkovej línii H1975 s EGFR s mutáciami L858R a T790M indukciou apoptózy a inhibíciou regulátorov rastových signálnych dráh Akt, EGFR a mTOR87).
Genisteín a nádor mozgu
Glioblastóm je najagresívnejší a najčastejšie sa vyskytujúci zhubný nádor mozgu. Väčšina pacientov umiera do 2 rokov od diagnostikovania napriek kombinácii agresívnej chemoterapie, operácie a rádioterapie88). Ukázalo sa, že GEN (50 μM) značne zvyšoval expresiu p21 v rádiosenzitívnych bunkách ľudského glioblastómu A172 a ľudského meduloblastómu ONS76. Zvýšená expresia p21 spolu so zníženou expresiou cyklínu B1 a CDK1 indukovala zastavenie bunkového cyklu89). Avšak v rádiorezistentných bunkových líniách KNS60 a U251MG tento inhibičný účinok nebol pozorovaný89).
Inhibícia telomerázových enzýmov je špeciálne cielená na terapiu nádorov, pretože telomerázové enzýmy sú prítomné v nádorových bunkách a absentujú v normálnych somatických bunkách. GEN (50 μM) spôsobuje pokles expresie TERT (telometázové reverzné transkriptázy, katalytická podjednotka telomerázy) v nádorových bunkových líniách A172, ONS76, KNS60 a U251MG, čo vedie k poklesu aktivity telomerázy. I keď GEN ovplyvňuje telomerázovú aktivitu, nevedie to ku skráteniu telomér, čo naznačuje, že GEN má skôr cytostatické než cytotoxické účinky na nádorové bunky mozgu89). Zaujímavé bolo pozorovanie, že GEN znižuje kaspázovú aktivitu v bunkách ľudského meduloblastómu (D283Med) s následnou inhibíciou cytotoxických (a teda terapeutických) účinkov cisplatiny90). Okrem toho nie je ani vhodné senzitivizujúce agens na C6 gliómové bunky potkanov v kombinácii s As2O3 (oxid arzenitý), lebo počas kombinovanej terapie došlo iba k aditívnej inhibícii rastu indukovanej As2O3. Senzitivita C6 buniek k apoptóze alebo zvýšená produkcia ROS nebola po kombinovanej terapii pozorovaná91).
GEN monoterapia GH3/B6/F10 buniek nádoru hypofýzy s vysokou expresiou ER-α a bez ER-β síce zvyšovala bunkovú proliferáciu, avšak keď bol GEN (v dietetických dávkach) podávaný spolu s E2, pôsobil chemopreventívne a inhiboval proliferačný účinok E292).
Genisteín a hojenie rán
Už v roku 1986 opísal Harold Dvorak vo svojom článku „Nádory: rany, ktoré sa nehoja“ veľkú podobnosť biologických vlastností spojivového tkaniva v ranách a nádoroch93). Ďalšie štúdie, ktoré porovnávali tkanivovú regeneráciu/reparáciu s malignitami preukázali, že tieto dva procesy majú veľa spoločného94–96). Rozdiel je však v tom, že hojenie rán charakterizuje skôr nedostatok kmeňových buniek a ich predčasná diferenciácia, čo môže proces predlžovať a v niektorých prípadoch viesť k tvorbe rozsiahlych jaziev. Vzhľadom na protikladné účinky SERM-ov v rôznych tkanivách bolo správne predpokladať, že GEN by mohol mať pozitívny vplyv na hojenie rán. Ukázalo sa, že97) GEN urýchľuje hojenie viacerými mechanizmami. Zrýchlenie migrácie keratinocytov, fibroblastov aj makrofágov patria medzi tie základné. Zaujímavé bolo predovšetkým pozorovanie, že reepitelizácia bola urýchlená po liečbe s GEN ešte výraznejšie ako po liečbe s E297). GEN navyše inhiboval fosforyláciu EGFR a aktiváciu MAPK. Okrem toho GEN tlmil aj expresiu prozápalových cytokínov IL-6 (interleukin 6), MIF (migráciu makrofágov inhibujúci faktor) a TNF-α (tumor nekrotizujúci faktor alfa) v ranách ovarektomizovaných myší, a to dokonca v podobnom rozsahu ako E297).
Vekom podmienené spomalenie hojenia rán je spájané s nízkymi hladinami TGF-β198). V pokusoch uskutočnených na ovarektomizovaných potkanoch sa ukázalo, že GEN podávaný s.c. (1 a 10 mg/kg) výrazne zvyšoval expresiu TGF-β1, TG2 (tkanivová transglutamináza 2) a VEGF v rane v porovnaní s kontrolou, pričom nižšia dávka GEN bola účinnejšia99). Autori ďalej pozorovali, že GEN (opäť s lepšími výsledkami pri nižšej koncentrácii) výrazne zvyšoval pevnosť rany v porovnaní s kontrolou a potkanmi dostávajúcimi raloxifén alebo E2. Na druhej strane ovarektomizované potkany liečené s E2 mali oproti GEN takmer trojnásobne nižšiu pevnosť rán. Histologický obraz rán bol charakteristický kompletnou reepitelizáciou, dobre formovaným granulačným tkanivom a adekvátnou prítomnosťou kolagénu v rane. V inej štúdii lokálna aplikácia mastí s extraktom izoflavónov z Trifolium canescens L. a Trifolium pratense L. takisto zvyšovala pevnosť incíznych rán a kontrakciu excíznych rán u potkanov. Hojivý potenciál T. canescens bol však vyšší než u T. pratense, čo mohlo byť spôsobené vyšším obsahom izoflavónov v testovanom extrakte100).
Proliferácia fibroblastov, ich rezistencia k apoptóze a nerovnováha medzi syntézou a degradáciou ECM (najmä kolagénu) sú charakteristické znaky vzniku keloidných jaziev101, 102). CTGF (connective tissue growth factor) je proteín indukovaný TGF-β1 v bunkách spojivového tkaniva. Zvýšená a najmä pretrvávajúca expresia CTGF podporuje predĺženú syntézu kolagénu a jeho ukladanie a následnú fibrózu101). GEN potláčal génovú expresiu TGF-β1, β2, β3, následkom čoho došlo pravdepodobne k poklesu expresie CTGF mRNA a CTGF proteínu v keloidných fibroblastoch in vitro. Génová expresia p53 a p21 ostala nezmenená, preto autori dedukujú, že GEN nespôsobuje apoptózu v monokultúre keloidných fibroblastov101).
Rastové faktory ako napr. EGF, PDGF, TGF-β, FGF a IGF podporujú proliferáciu a diferenciáciu fibroblastov v hypertrofických jazvách, preto zohrávajú dôležitú úlohu v regulácii tvorby jaziev a fibrózy102). Väčšina týchto rastových faktorov pôsobí na bunky prostredníctvom TPK signálnej transdukcie. Stimulácia hypertrofických fibrobalstov s GEN (50 μmol/l alebo 100 μmol/l) potláčala PDGF-stimulovanú TPK aktiváciu a signifikantne inhibovala RTK-Ras-MAPK (ERK/p38) signálnu dráhu, účinne inhibovala rast a syntézu kolagénu I a III, pričom tieto procesy neboli výrazne inhibované v normálnych kožných fibroblastoch102).
Okrem toho sa ukázalo, že GEN redukoval veľkosť rany, hladinu TNF-α a NF-κB v závislosti od dávky a zároveň znižoval expresiu Cu/Zn-SOD a Mn-SOD v skorých fázach hojenia kože103, 104). Teda relatívne nízka koncentrácia endogénnych enzýmov s GEN bola dostačujúca na vyrovnanie sa s oxidačným stresom103). Naopak, GEN zvyšoval hladiny NLRP3 (gén kódujúci kryopyrín) aj IL-1β, čím pravdepodobne urýchľoval hojenie rán diabetických myší104).
Záver
Monoterapia nádorových ochorení v mnohých prípadoch nedosahuje dostatočnú klinickú účinnosť liečby. Naproti tomu kombinovanou terapiou je možné dosiahnuť inhibíciu viacerých/všetkých dôležitých regulačných dráh, a tým efektívnejšie potlačiť rast nádoru a znížiť jeho metastatický potenciál. Kombinovaná terapia navyše znižuje riziko rezistencie nádorových buniek voči liečivám, teda zvyšuje pravdepodobnosť remisie ochorenia/úplného vyliečenia pacienta. Preto individuálne navrhnutá terapia komplexom antineoplastík, ktoré ovplyvňujú všetky fázy rastu nádoru, je rozhodujúca pre celkový výsledok liečby. Okrem toho je nutné vykonať ďalšie štúdie zamerané na optimálne rozvrhnutie kombinácie liečiv, čomu sa stále nevenuje dostatočná pozornosť105).
Na druhej strane lepšie pochopenie interakcií medzi nádorovými bunkami a nádorovou strómou môže pomôcť zlepšiť hojenie rán podporou tvorby granulačného tkaniva a procesu reepitelizácie rozsiahlych a chronických rán. Podobne ako u nádorov, monoterapia nemusí byť dostatočná na optimálnu liečbu rán, pretože expresia rôznych faktorov sa mení v závislosti od fázy hojenia rany a času. Preto je dôležité do klinickej praxe zaviesť priestorovo a časovo riadené systémy dodávania liečiv so správnym načasovaním liečby, aby sa aktivovali rozhodujúce regeneračné procesy106).
Poďakovanie
Táto práca vznikla s podporou Vedeckej grantovej agentúry Ministerstva školstva, vedy, výskumu a športu Slovenskej republiky (VEGA-1/0404/15, VEGA-1/0048/15 a VEGA-1/0561/18), Agentúry na podporu výskumu a vývoja (APVV-14-0731, APVV-16-0446 a APVV-16-0207) a grantu Univerzity Komenského UK/109/2017.
Stret záujmov: žiadny.
P. Mitrengová, P. Mučaji
Katedra farmakognózie a botaniky, Farmaceutická fakulta, Univerzita Komenského, Bratislava, SR
V. Peržeľová
Referát biomedicínskeho výskumu, Východoslovenský ústav srdcových a cievnych chorôb, a.s., Košice, SR
E. Dosedla
Gynekologicko-pôrodnícka klinika, Univerzita Pavla Jozefa Šafárika a Nemocnica Košice-Šaca a.s., 1. súkromná nemocnica, Košice-Šaca, SR
RNDr. Peter Gál, Ph.D., MBA (∗)
Východoslovenský ústav srdcových a cievnych chorôb, a.s.
Ondavská 8, 040 66 Košice, SR
e-mail: pgal@vusch.sk
Ústav farmakológie, Lekárska fakulta, Univerzita Pavla Jozefa Šafárika, Košice, SR
Sources
1. Ososki A. L., Kennelly E. J. Phytoestrogens: a review of the Present State of Research. Phytother. Res. 2003; 17, 845–869.
2. Brzezinski A., Debi A. Phytoestrogens: the “natural” selective estrogen receptor modulators? Eur J. Obstet. Gynecol. Reprod. Biol. 1999; 85, 47–51.
3. Kelly P. M., Keely N. O., Bright S. A., Yassin B., Ana G., Fayne D., Zisterer D. M., Meegan M. J. Novel selective estrogen receptor ligand conjugates incorporating endoxifen-combretastatin and cyclofenil-combretastatin hybrid scaffolds: Synthesis and biochemical evaluation. Molecules 2017; 22, 1440.
4. Lee I. R., Dawson S. A., Watherall J. D., Hahnel R. Sex hormone-binding globulin secretion by human hepatocarcinoma cells is increased by estrogens and androgens. J. Clin. Endocrinol. Metab. 1987; 64, 825–831.
5. Cassidy A. Potential risks and benefits of phytoestrogen-rich diets. Int. J. Vitam. Nutr. Res. 2003; 73, 120–126.
6. Mezei O., Banz W. J., Steger R. W., Peluso M. R., Winters T. A., Shay N. Soy isoflavones exert antidiabetic and hypolipidemic effects through the PPAR pathways in obese Zucker rats and murine RAW 264.7 cells. J. Nutr. 2003; 133, 1238–1243.
7. Chemical Book. © 2016 citované 2017-01-27). Dostupné na: http://www.chemicalbook.com/ChemicalProductProperty_EN_CB6163787.htm
8. Roland W. S., Vincken J. P., Gouka R. J., van Buren L., Gruppen H., Smit G. Soy Isoflavones and Other Isoflavonoids Activate the Human Bitter Taste Receptors hTAS2R14 and hTAS2R39. J. Agric. Food Chem. 2011; 59, 11764–11771.
9. Yang Z., Kulkarni K., Zhu W., Hu M. Bioavailability and Pharmacokinetics of Genistein: Mechanistic Studies on its ADME. Anticancer Agents Med. Chem. 2012; 12, 1264–1280.
10. Wu J. G., Ge J., Zhang Y. P., Yu Y., Zhang X. Y. Solubility of Genistein in Water, Methanol, Ethanol, Propan-2-ol, 1-Butanol, and Ethyl Acetate from (280 to 333) K. J. Chem. Eng. Data 2010; 55, 5286–5288.
11. Fukutake M., Takahashi M., Ishida K., Kawamura H., Sugimura T., Wakabayashi K. Quantification of Genistein and Genistin in Soybean and Soybean products. Food Chem. Toxicol. 1996; 34, 457–461.
12. Dalu A., Haskell J. F., Coward L., Lamartiniere C. A. Genistein, a Component of Soy, Inhibits the Expression of the EGF and ErbB2/Neu Receptors in the Rat Dorsolateral Prostate. Prostate. 1998; 37, 36–43.
13. Banerjee S., Li Y., Wang Z., Sarkar F. H. Multi-targeted therapy of cancer by genistein. Cancer Lett. 2008; 269, 226–242.
14. Kim Y. S., Choi K. C., Hwang K. A. Genistein suppressed epithelial-mesenchymal transition and migration efficacies of BG-1 ovarian cancer cells activated by estrogenic chemicals via estrogen receptor pathway and down-regulation of TGF-β signaling pathway. Phytomedicine 2015; 22, 993–999.
15. Kuiper G. G., Lemmen J. G., Carlsson B., Corton J. C., Safe S. H., van der Saag P. T., van der Burg B., Gustafsson J. A. Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor β. Endocrinology 1998; 139, 4252–4263.
16. Polkowski K., Popiołkiewicz J., Krzeczyński P., Ramza J., Pucko W., Zegrocka-Stendel O., Boryski J., Skierski J. S., Mazurek A. P., Grynkiewicz G. Cytostatic and cytotoxic activity of synthetic genistein glycosides against human cancer cell lines. Cancer Lett. 2004; 203, 59–69.
17. Popiołkiewicz J., Polkowski K., Skierski J.S., Mazurek A. P. In vitro toxicity evaluation in the development of new anticancer drugs – genistein glycosides. Cancer Lett. 2005; 229, 67–75.
18. Kwon S. H., Kang M. J., Huh J. S., Ha K. W., Lee J. R., Lee S. K., Lee B. S., Han I. H., Lee M. S., Lee M. W., Lee J., Choi Y. W. Comparison of oral bioavailability of genistein and genistin in rats. Int. J. Pharm. 2007; 337, 148–154.
19. Steensma A., Faassen-Peters M. A., Noteborn H. P., Rietjens I. M. Bioavailability of Genistein and Its Glycoside Genistin As Measured in the Portal Vein of Freely Moving Unanesthetized Rats. J. Agric. Food Chem. 2006; 54, 8006–8012.
20. Pasqualini J. R. Breast Cancer: Prognosis, Treatment, and Prevention. New York, Basel: CRC Press 2002.
21. Liu B., Edgerton S., Yang X., Kim A., Ordonez-Ercan D., Mason T., Alvarez K., McKimmey C., Liu N., Thor A. Low-dose dietary phytoestrogen abrogates tamoxifen-associated mammary tumor prevention. Cancer Res. 2005; 65, 879–886.
22. Kapiotis S., Hermann M., Held I., Seelos C., Ehringer H., Gmeiner B. M. Genistein, the dietary-derived angiogenesis inhibitor, prevents LDL oxidation and protects endothelial cells from damage by atherogenic LDL. Arterioscler. Thromb. Vasc. Biol. 1997; 17, 2868–2874.
23. Akiyama T., Ishida J., Nakagawa S., Ogawara H., Watanabe S., Itoh N., Shibuya M., Fukami Y. Genistein, a specific inhibitor of tyrosine-specific protein kinases. J. Biol. Chem. 1987; 262, 5592–5595.
24. Stahl S., Chun T. Y., Gray W. G. Phytoestrogens act as estrogen agonists in an estrogen-responsive pituitary cell line. Toxicol. Appl. Pharmacol. 1998; 152, 41–48.
25. Jurzak M., Ramos P., Pilawa B. The influence of genistein on free radicals in normal dermal fibroblasts and keloid fibroblasts examined by EPR spectroscopy. Med. Chem. Res. 2017; 26, 1297–1305.
26. Zhang Z., Wang C. Z., Du G. J., Qi L. W., Calway T., He T. C., Du W., Yuan C. S. Genistein induces G2/M cell cycle arrest and apoptosis via ATM/p53 - dependent pathway in human colon cancer cells. Int. J. Oncol. 2013; 43, 289–296.
27. Varinská L., Gál P., Mojžišová G., Mirossay L., Mojžiš J. Soy and breast cancer: focus on angiogenesis. Int. J. Mol. Sci. 2015; 16, 11728–11749.
28. Su S. J., Yeh T. M., Chuang W. J., Ho C. L., Chang K. L., Cheng H. L., Liu H. S., Cheng H. L., Hsu P. Y., Chow N. H. The novel targets for anti-angiogenesis of genistein on human cancer cells. Biochem. Pharmacol. 2005; 69, 307–318.
29. Guo Y., Wang S., Hoot D. R., Clinton S. K. Suppression of VEGF-mediated autocrine and paracrine interactions between prostate cancer cells and vascular endothelial cells by soy isoflavones. J. Nutr. Biochem. 2007; 18, 408–417.
30. Zhou J. R., Gugger E. T., Tanaka T., Guo Y., Blackburn G. L., Clinton S. K. Soybean phytochemicals inhibit the growth of transplantable human prostate carcinoma and tumor angiogenesis in mice. J. Nutr. 1999; 129, 1628–1635.
31. Bakkiyanathan A., Joseph A. M., Tharani L., Malathi R. Genistein, the phytoestrogen induces heart-and-soul (has) phenotypes in zebrafish embryo. J. Dev. Biol. Tissue Eng. 2010; 2, 18–22.
32. Mukhopadhyay S., Ballard B. R., Mukherjee S., Kabir S. M., Das S. K. Beneficial effects of soy protein in the initiation and progression against dimethylbenz(a) anthracene-induced breast tumors in female rats. Mol. Cell Biochem. 2006; 290 : 169–176.
33. Farina H. G., Pomies M., Alonso D. F., Gomez D. E. Antitumor and antiangiogenic activity of soy isoflavone genistein in mouse models of melanoma and breast cancer. Oncol. Rep. 2006; 16, 885–891.
34. Lamartiniere, C. A. Protection against breast cancer with genistein: a component of soy. Am. J. Clin. Nutr. 2000; 71, 1705–1707.
35. Allred C. D., Allred K. F., Ju Y. H., Virant S. M., Helferich W. G. Soy diets containing varying amounts of genistein stimulate growth of estrogen-dependent (MCF-7) tumors in a dose-dependent manner. Cancer Res. 2001; 61, 5045–5050.
36. Hsieh C. Y., Santell R. C., Haslam S. Z., Helferich W. G. Estrogenic effects of genistein on the growth of estrogen receptor-positive human breast cancer (MCF-7) cells in vitro and in vivo. Cancer Res. 1998; 58, 3833–3838.
37. Chang E. C., Charn T. H., Park S. H., Helferich W. G., Komm B., Katzenellenbogen J. A., Katzenellenbogen B. S. Estrogen receptors α and β as determinants of gene expression: influence of ligand, dose, and chromatin binding. Mol. Endocrinol. 2008; 22, 1032–1043.
38. Li Z., Li J., Mo B., Hu C., Liu H., Qi H., Wang X., Xu J. Genistein induces G2/M cell cycle arrest via stable activation of ERK1/2 pathway in MDA-MB-231 breast cancer cells. Cell Biol. Toxicol. 2008; 24, 401–409.
39. Wang T. T. Y., Sathyamoorthy N., Phang J. M. Molecular effects of genistein on estrogen receptor mediated pathways. Carcinogenesis 1996; 17, 271–275.
40. Leung L. K., Wang T. T. Bcl-2 is not reduced in the death of MCF-7 cells at low genistein concentration. J. Nutr. 2000; 130, 2922–2926.
41. Pagliacci M. C., Smacchia M., Migliorati G., Grignani F., Riccardi C., Nicoletti I. Growth-inhibitory effects of the natural phytoestrogen genistein in MCF-7 human breast cancer cells. Eur. J. Cancer. 1994; 30, 1675–1682.
42. Paruthiyil S., Parmar H., Kerekatte V., Cunha G. R., Firestone G. L., Leitman D. C. Estrogen receptor β inhibits human breast cancer cell proliferation and tumor formation by causing a G2 cell cycle arrest. Cancer Res. 2004; 64, 423–428.
43. Jiang Y., Gong P., Madak-Erdogan Z., Martin T., Jeyakumar M., Carlson K., Khan I., Smillie T. J., Chittiboyina A. G., Rotte S. C. K., Helferich W. G., Katzenellenbogen J. A., Katzenellenbogen B. S. Mechanisms enforcing the estrogen receptor β selectivity of botanical estrogens. FASEB J. 2013; 27, 4406–4418.
44. Gong L., Li Y., Nedeljkovic-Kurepa A., Sarkar F. H. Inactivation of NF-κB by genistein is mediated via Akt signaling pathway in breast cancer cells. Oncogene 2003; 22, 4702–4709.
45. Mai Z., Blackburn G. L., Zhou J. R. Genistein sensitizes inhibitory effect of tamoxifen on the growth of estrogen receptor-positive and HER2-overexpressing human breast cancer cells. Mol. Carcinog. 2007; 46, 534–542.
46. Li Y., Ahmed F., Ali S., Philip P. A., Kucuk O., Sarkar F. H. Inactivation of nuclear factor KB by soy isoflavone genistein contributes to increased apoptosis induced by chemotherapeutic agents in human cancer cells. Cancer Res. 2005; 65, 6934–6942.
47. Seo H. S., DeNardo D. G., Jacquot Y., Laïos I., Vidal D. S., Zambrana C. R., Leclercq G., Brown P. H. Stimulatory effect of genistein and apigenin on the growth of breast cancer cells correlates with their ability to activate ER alpha. Breast Cancer Res. Treat. 2006; 99, 121–134.
48. Pan H., Zhou W., He W., Liu X., Ding Q., Ling L., Zha X., Wang S. Genistein inhibits MDA-MB-231 triple-negative breast cancer cell growth by inhibiting NF-κB activity via the Notch-1 pathway. Int. J. Mol. Med. 2012; 30, 337–343.
49. Shim H. Y., Park J. H., Paik H. D., Nah S. Y., Kim D. S., Han Y. S. Genistein-induced apoptosis of human breast cancer MCF-7 cells involves calpain-caspase and apoptosis signaling kinase 1–p38 mitogen-activated protein kinase activation Cascades. Anticancer Drugs 2007; 18, 649–657.
50. Prietsch R. F., Monte L. G., da Silva F. A., Beira F. T., Del Pino F. A., Campos V. F., Collares T., Pinto L. S., Spanevello R. M., Gamaro G. D., Braganhol E. Genistein induces apoptosis and autophagy in human breast MCF-7 cells by modulating the expression of proapoptotic factors and oxidative stress enzymes. Mol. Cell. Biochem. 2014; 390, 235–242.
51. Ovarian Cancer Research Fund Alliance © 2016 citované 2017-11-22). Dostupné na: https://ocrfa.org/patients/about-ovarian-cancer/statistics/
52. Luo H., Jiang B. H., King S. M., Chen Y. C. Inhibition of Cell Growth and VEGF Expression in Ovarian Cancer Cells by Flavonoids. Nutr. Cancer 2008; 60, 800–809.
53. Ouyang G., Yao L., Ruan K., Song G., Mao Y., Bao S. Genistein induces G2/M cell cycle arrest and apoptosis of human ovarian cancer cells via activation of DNA damage checkpoint pathways. Cell. Biol. Int. 2009; 33, 1237–1244.
54. Antosiak A., Milowska K., Maczynska K., Rozalska S., Gabryelak T. Cytotoxic activity of genistein-8-C-glucoside form Lupinus luteus L. and genistein against human SK-OV-3 ovarian carcinoma cell line. Med. Chem. Res. 2016; 26, 64–73.
55. American Cancer Society. Colorectal Cancer Facts & Figures 2014–2016. Atlanta: American Cancer Society © 2014 citované 2017-11-23). Dostupné na: https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/colorectal-cancer-facts-and-figures/colorectal-cancer-facts-and-figures-2014-2016.pdf
56. Raju J., Bielecki A., Caldwell D., Lok E., Taylor M., Kapal K., Curran I., Cooke G. M., Bird R. P., Mehta R. Soy isoflavones modulate azoxymethane-induced rat colon carcinogenesis exposed pre - and postnatally and inhibit growth of DLD-1 human colon adenocarcinoma cells by increasing the expression of estrogen receptor-b 1–3. J. Nutr. 2009; 139, 474–481.
57. Qi W., Weber C. R., Wasland K., Savkovic S. D. Genistein inhibits proliferation of colon cancer cells by attenuating a negative effect of epidermal growth factor on tumor suppressor FOXO3 activity. BMC Cancer 2011; 11, 219.
58. Pool-Zobel B. L., Adlercreutz H., Glei M., Liegibel U. M., Sittlingon J., Rowland I., Wähälä K., Rechkemmer G. Isoflavonoids and lignans have different potentials to modulate oxidative genetic damage in human colon cells. Carcinogenesis 2000; 21, 1247–1252.
59. American Cancer Society © 2016 citované 2017-11-27). Dostupné na: https://www.cancer.org/cancer/prostate-cancer.html
60. Normanno N., De Luca A., Bianco C., Strizzi L., Mancino M., Maiello M. R., Carotenuto A., De Feo G., Caponigro F., Salomon D. S. Epidermal growth factor receptor (EGFR) signaling in cancer. Gene 2006; 366, 2–16.
61. Raffoul J. J., Wang Y., Kucuk O., Forman J. D., Sarkar F. H., Hillman G. G. Genistein inhibits radiation-induced activation of NF-κB in prostate cancer cells promoting apoptosis and G2/M cell cycle arrest. BMC Cancer 2006; 6, 107.
62. Suzuki K., Koike H., Matsui H., Ono Y., Hasumi M., Nakazato H., Okugi H., Sekine Y., Oki K., Ito K., Yamamoto T., Fukabori Y., Kurokawa K., Yamanaka H. Genistein, a soy isoflavone, induces glutathione peroxidase in the human prostate cancer cell lines LNCaP a PC-3. Int. J. Cancer 2002; 99, 846–852.
63. Kumi-Diaka J. Chemosensitivity of human prostate cancer cells PC3 and LNCaP to genistein isoflavone and β-lapachone. Biol. Cell. 2002; 94, 37–44.
64. Hörmann V., Kumi-Diaka J., Durity M., Rathinavelu A. Anticancer activities of genistein-topotecan combination in prostate cancer cells. J. Cell. Mol. Med. 2012; 16, 2631–2636.
65. Gu Y., Zhu C. F., Dai Y. L., Zhong Q., Sun B. Inhibitory effects of genistein on metastasis of human hepatocellular carcinoma. World J. Gastroenterol. 2009; 15, 4952–4957.
66. Gu Y., Zhu C. F., Iwamoto H., Chen J. S. Genistein inhibits invasive potential of human hepatocellular carcinoma by altering cell cycle, apoptosis, and angiogenesis. World J. Gastroenterol. 2005; 11, 6512–6517.
67. Mansoor T. A., Ramalho R. M., Luo X., Ramalhete C., Rodrigues C. M., Ferreira M. J. Isoflavones as apoptosis inducers in human hepatoma HuH‐7 cells. Phytother. Res. 2011; 25, 1819–1824.
68. Yeh T. C., Chiang P. C., Li T. K., Hsu J. L., Lin C. J., Wang S. W., Peng C. Y., Guh J. H. Genistein induces apoptosis in human hepatocellular carcinomas via interaction of endoplasmic reticulum stress and mitochondrial insult. Biochem. Pharmacol. 2007; 73, 782–792.
69. Chodon D., Ramamurty N., Sakthisekaran D. Preliminary studies on induction of apoptosis by genistein on HepG2 cell line. Toxicol. In Vitro 2007; 21, 887–891.
70. Wang S. D., Chen B. C., Kao S. T., Liu C. J., Yeh C. C. Genistein inhibits tumor invasion by suppressing multiple signal transduction pathways in human hepatocellular carcinoma cells. BMC Complement. Altern. Med. 2014; 14, 26.
71. Dai W., Wang F., He L., Lin C., Wu S., Chen P., Zhang Y., Shen M., Wu D., Wang C., Lu J., Zhou Y., Xu X., Xu L., Guo C. Genistein inhibits hepatocellular carcinoma cell migration by reversing the epithelial-mesenchymal transition: partial mediation by the transcription factor NFAT1. Mol. Carcinog. 2015; 54, 301–311.
72. Huang W., Wan C., Luo Q., Huang Z., Luo Q. Genistein-inhibited cancer stem cell-like properties and reduced chemoresistance of gastric cancer. Int. J. Mol. Sci. 2014; 15, 3432–3443.
73. Yu D., Shin H. S., Lee Y. S., Lee D., Kim S., Lee Y. C. Genistein attenuates cancer stem cell characteristics in gastric cancer through the down-regulation of Gli1. Oncol. Rep. 2014; 31, 673–678.
74. Zhou H. B., Chen J. J., Wang W. X., Cai J. T., Du Q. Apoptosis of human primary gastric carcinoma cells induced by genistein. World J. Gastroenterol. 2004; 10, 1822–1825.
75. Li Y. S., Wu L. P., Li K. H., Liu Y. P., Xiang R., Zhang S. B., Zhu L. Y., Zhang L. Y. Involvement of nuclear factor kappa B (NF-κB) in the down-regulation of cyclooxygenase-2 (COX-2) by genistein in gastric cancer cells. J. Int. Med. Res. 2011; 39, 2141–2150.
76. Tatsuta M., Iishi H., Baba M., Yano H., Uehara H., Nakaizumi A. Attenuation by genistein of sodium-chloride-enhanced gastric carcinogenesis induced by N-methyl-N’-nitro-N-nitrosoguanidine in Wistar rats. Int. J. Cancer 1999; 80, 396–399.
77. American Cancer Society © 2016 citované 2017-11-25). Dostupné na: https://www.cancer.org/cancer/pancreatic-cancer/detection-diagnosis-staging/survival-rates.html
78. Büchler P., Reber H. A., Büchler M. W., Friess H., Lavey R. S., Hines O. J. Antiangiogenic activity of genistein in pancreatic carcinoma cells is mediated by the inhibition of hypoxia-inducible factor-1 and the down-regulation of VEGF gene expression. Cancer 2004; 100, 201–210.
79. Suzuki R., Kang Y., Li X., Roife D., Zhang R., Fleming J. B. Genistein potentiates the antitumor effect of 5-fluorouracil by inducing apoptosis and autophagy in human pancreatic cancer cells. Anticancer Res. 2014; 34, 4685–4692.
80. El-Rayes B. F, Ali S., Ali I.F., Philip P. A, Abbruzzese J., Sarkar F. H. Potentiation of the effect of erlotinib by genistein in pancreatic cancer: the role of akt and nuclear factor-KB. Cancer Res. 2006; 66, 10553–10559.
81. Li Y., Ellis K. L., Ali S., El-Rayes B. F., Nedeljkovic-Kurepa A., Kucuk O., Philip P. A., Sarkar F. H. Apoptosis-inducing effect of chemotherapeutic agents is potentiated by soy isoflavone genistein, a natural inhibitor of NF-kB in BxPC-3 pancreatic cancer cell line. Pancreas 2004; 28, 90–95.
82. Ma J., Zeng F., Ma C., Pang H., Fang B., Lian C., Yin B., Zhang X., Wang Z., Xia J. Synergistic reversal effect of epithelial-to-mesenchymal transition by miR-223 inhibitor and genistein in gemcitabine-resistant pancreatic cancer cells. Am. J. Cancer Res. 2016; 6, 1384–1395.
83. Tian T., Li J., Li B., Wang Y., Li M., Ma D., Wang X. Genistein exhibits anti-cancer effects via down-regulating FoxM1 in H446 small - cell lung cancer cells. Tumour Biol. 2014; 35, 4137–4145.
84. Yang Y., Zang A., Jia Y., Shang Y., Zhang Z., Ge K., Zhang J., Fan W., Wang B. Genistein inhibits A549 human lung cancer cell proliferation via miR-27a and MET signaling. Oncol. Lett. 2016; 12 : 2189–2193.
85. Shiau, R. J., Chen K. Y., Wen Y. D., Chuang C. H., Yeh S. L. Genistein and β-carotene enhance the growth-inhibitory effect of trichostatin A in A549 cells. Eur. J. Nutr. 2010; 49, 19–25.
86. Cheng J., Qi J., Li X. T., Zhou K., Xu J. H., Zhou Y., Zhang G. Q., Xu J. P., Zhou R. J. ATRA and Genistein synergistically inhibit the metastatic potential of human lung adenocarcinoma cells. Int. J. Clin. Exp. Med. 2015; 8, 4220–4227.
87. Zhu H., Cheng H., Ren Y., Liu Z. G., Zhang Y. F., De Luo B. Synergistic inhibitory effects by the combination of gefitinib and genistein on NSCLC with acquired drug-resistance in vitro and in vivo. Mol. Biol. Rep. 2012; 39, 4971–4979.
88. Stupp R., Mason W. P., van den Bent M. J., Weller M., Fisher B., Taphoorn M. J., Belanger K., Brandes A. A., Marosi C., Bogdahn U., Curschmann J., Janzer R. C., Ludwin S. K., Gorlia T., Allgeier A., Lacombe D., Cairncross J. G., Eisenhauer E., Mirimanoff R. O., European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups; National Cancer Institute of Canada Clinical Trials Group. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N. Engl. J. Med. 2005; 352, 987–996.
89. Khaw A. K., Yong J. W., Kalthur G., Hande M. P. Genistein Induces Growth Arrest and Suppresses Telomerase Activity in Brain Tumor Cells. Genes Chromosomes Cancer 2012; 51, 961–974.
90. Belcher S. M., Burton C. C., Cookman C. J., Kirby M., Miranda G. L., Saeed F. O., Wray K. E. Estrogen and soy isoflavonoids decrease sensitivity of medulloblastoma and central nervous system primitive neuroectodermal tumor cells to chemotherapeutic cytotoxicity. BMC Pharmacol. Toxicol. 2017; 18, 63.
91. Klauser E., Gülden M., Maser E., Seibert S., Seibert H. Additivity, antagonism, and synergy in arsenic trioxide - induced growth inhibition of C6 glioma cells: Effects of genistein, quercetin and buthionine-sulfoximine. Food Chem. Toxicol. 2014; 67, 212–221.
92. Jeng Y. J., Watson C. S. Proliferative and anti-proliferative effects of dietary levels of phytoestrogens in rat pituitary GH3/B6/F10 cells – the involvement of rapidly activated kinases and caspases. BMC Cancer 2009; 9, 334.
93. Dvorak H. F. Tumors: Wounds that do not heal. Similarities between tumor stroma generation and wound healing. N. Engl. J. Med. 1986; 315, 1650–1659.
94. Dvořánková B., Szabo P., Lacina L., Gál P., Uhrová J., Zima T., Kaltner H., André S., Gabius H. J., Syková E., Smetana Jr. K. Human galectins induce conversion of dermal fibroblasts into myofibroblasts and production of extracellular matrix: Potential application in tissue engineering and wound repair. Cells Tissues Organs 2011; 194, 469–480.
95. Kolář M., Szabo P., Dvořánková B., Lacina L., Gabius H. J., Strnad H., Sáchová J., Vlček C., Plzák J., Chovanec M., Cada Z., Betka J., Fík Z., Pačes J., Kovářová H., Motlík J., Jarkovská K., Smetana Jr. K. Up-regulation of il-6, il-8 and cxcl-1 production in dermal fibroblasts by normal/malignant epithelial cells in vitro: Immunohistochemical and transcriptomic analyses. Biol. Cell 2012; 104, 738–751.
96. Lacina L., Plzák J., Kodet O., Szabo P., Chovanec M., Dvořánková B., Smetana Jr. K. Cancer microenvironment: What can we learn from the stem cell niche. Int. J. Mol. Sci. 2015; 16, 24094–24110.
97. Emmerson E., Campbell L., Ashcroft G. S., Hardman M. J. The phytoestrogen genistein promotes wound healing by multiple independent mechanisms. Mol. Cell Endocrinol. 2010; 321, 184–193.
98. Ashcroft G. S., Dodsworth J., van Boxtel E., Tarnuzzer R. W., Horan M. A., Schultz G. S., Ferguson M. W. Estrogen accelerates cutaneous wound healing associated with an increase in TGF-beta1 levels. Nat. Med. 1997; 3, 1209–1215.
99. Marini H., Polito F., Altavilla D., Irrera N., Minutoli L., Calò M., Adamo E. B., Vaccaro M., Squadrito F., Bitto A. Genistein aglycone improves skin repair in an incisional model of wound healing: a comparison with raloxifene and oestradiol in ovariectomized rats. Br. J. Pharmacol. 2010; 160, 1185–1194.
100. Renda G., Yalçın F. N., Nemutlu E., Akkol E. K., Süntar I., Keleş H., Ina H., Çalış I., Ersöz T. Comparative assessment of dermal wound healing potentials of various Trifolium L. extracts and determination of their isoflavone contents as potential active ingredients. J. Ethnopharmacol. 2013; 148, 423–432.
101. Jurzak M., Adamczyk K., Antończak P., Garncarczyk A., Kuśmierz D., Latocha M. Evaluation of genistein ability to modulate CTGF mRNA/protein expression, genes expression of TGFβ isoforms and expression of selected genes regulating cell cycle in keloid fibroblasts in vitro. Acta Pol. Pharm. 2014; 71, 972–986.
102. Cao C., Li S., Dai X., Chen Y., Feng Z., Zhao Y., Wu J. Genistein inhibits proliferation and functions of hypertrophic scar fibroblasts. Burns 2009; 35, 89–97.
103. Park E., Lee S. M., Jung I. K., Lim Y., Kim J. H. Effects of genistein on early-stage cutaneous wound healing. Biochem. Biophys. Res. Commun. 2011; 410, 514–519.
104. Eo H., Lee H. J., Lim Y. Ameliorative effect of dietary genistein on diabetes induced hyper - inflammation and oxidative stress during early stage of wound healing in alloxan induced diabetic mice. Biochem. Biophys. Res. Commun. 2016; 478, 1021–1027.
105. van der Veldt A. A., Lammertsma A. A., Smit E. F. Scheduling of anticancer drugs: Timing may be everything. Cell Cycle 2012; 11, 4339–4343.
106. Park J. W., Hwang S. R., Yoon I. S. Advanced growth factor delivery systems in wound management and skin regeneration. Molecules 2017; 22, 1259.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2018 Issue 1-
All articles in this issue
- Genisteín: sľubná molekula modulujúca rast nádorov a hojenie rán?
- Liberalizace a integrace distribuce léčiv v EU 28 a Norsku
- Imunomodulační aktivita extraktů a komplexů biologicky aktivních látek Galium verum L. herba
- Teorie a praxe lékopisné kontroly jakosti léčiv a pomocných látek VII. Porovnávací barevné roztoky Evropského lékopisu (Ph. Eur.)*
- Farmacie a Johann Wolfgang von Goethe: lékárníci jako Goethovi učitelé chemie
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Liberalizace a integrace distribuce léčiv v EU 28 a Norsku
- Genisteín: sľubná molekula modulujúca rast nádorov a hojenie rán?
- Imunomodulační aktivita extraktů a komplexů biologicky aktivních látek Galium verum L. herba
- Farmacie a Johann Wolfgang von Goethe: lékárníci jako Goethovi učitelé chemie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

