-
Medical journals
- Career
Kompatibilita fosforečnanů se solemi vápníku v parenterální výživě
: Michal Janů; Marek Vecka 1; Ruta Masteiková 2; Jurga Bernatoniene 3
: Nemocniční lékárna VFN ; IV. interní klinika 1. LF UK a VFN, Praha 1; Ústav technologie léků, Farmaceutická fakulta, Veterinární a farmaceutická univerzita Brno 2; Katedra technologie léků a sociální farmacie, Farmaceutická fakulta, Litevská univerzita zdravotnických věd, Akademie medicíny, Litva 3
: Čes. slov. Farm., 2012; 61, 34-39
: Original Articles
Při sestavování receptur pro totální parenterální výživu (TPN) je nezbytné zvažovat i substituci vápníkem a fosforem. V některých klinických stavech nebo u určitých skupin nemocných bývá zapotřebí podávat tyto prvky ve vysokých koncentracích při redukovaném objemu, což kvůli vzájemným interakcím může být problematické. Proto bylo cílem práce experimentální sledování kompatibility komerčně dostupných nebo magistraliter získaných přípravků obsahujících sloučeniny vápníku a fosforu. Tyto přípravky byly zkoumány ve směsi s klinicky užívanými roztoky aminokyselin nebo s roztoky glukosy. Hodnocení se provádělo titračně do vzniku viditelné sraženiny a též pomocí lékopisné metody hodnocení částic pod hranicí viditelnosti. Bylo prokázáno, že hydrogenfosforečnan má nižší kompatibilitu a stabilitu ve směsích obsahujících soli vápníku ve srovnání s dihydrogenfosforečnanem nebo organickým fosforečnanem. Mezi dihydrogenfosforečnanem a organickým fosforečnanem však významné rozdíly zjištěny nebyly. Experiment potvrdil lepší stabilitu organické soli vápníku oproti anorganické pouze u vzorků obsahujících roztoky aminokyselin. Ze sledovaných roztoků aminokyselin nejlepší stabilizující vlastnosti měly roztoky určené pro použití v neonatologii a pediatrii.
Klíčová slova:
parenterální výživa • vápník • fosforečnany • kompatibilitaÚvod
Totální parenterální výživa (TPN) představuje úplné umělé nitrožilní pokrytí potřeb organismu živinami, vitamíny, makroprvky, mikroprvky a energií. U řady pacientů, kterým je TPN indikována, se vyskytuje ve zvýšené míře hypokalcémie a hypofosfatémie. Substituční dodání vápníku a fosforu je zásadní zejména v pooperační péči a v neonatologii, především u předčasně narozených dětí. U těchto pacientů se tyto dva prvky podávají ve vysokých koncentracích při redukovaném objemu TPN1). Souhrnná molární koncentrace se v těchto případech pohybuje okolo 50 mmol/l, přičemž celkový objem jednorázově podané parenterální výživy dosahuje cca 120–150 ml2). Takto vysoká koncentrace při malém objemu infuze, jakožto i působení světla a zvýšené teploty v inkubátoru během aplikace, vystavuje roztoky parenterální výživy extrémnímu riziku precipitace1). Již v roce 1994 byly americkou FDA zdokumentovány klinické komplikace a dokonce úmrtí v důsledku vzájemné interakce vápenatých a fosforečnanových iontů3). Rovněž byla publikována celá řada studií, jejichž výsledky ovšem nelze aplikovat univerzálně, zejména kvůli rozdílným podmínkám a variabilitě použitých přípravků4, 5).
Mezi faktory ovlivňující riziko vniku sraženiny patří6–10):
- pH směsi,
- koncentrace vápenatých a fosforečnanových iontů,
- druh vápenatých a fosforečnanových solí,
- koncentrace hořečnatých iontů,
- koncentrace glukosy,
- koncentrace a složení aminokyselinových roztoků,
- osmolarita roztoků11),
- přítomnost tukové emulze,
- pořadí při mísení jednotlivých složek směsi,
- doba uchovávání před aplikací,
- teplota,
- rychlost podávání infuze,
- současné podávání dalších léčiv.
Publikačně se tematika klinicky používaných parenterálií obsahujících vápenaté a fosforečnanové ionty omezuje zejména na problematiku uplatnění různých sloučenin a možnost jejich vzájemné interakce (precipitace). Fosforečnany ve vodných roztocích mohou existovat ve třech iontových formách: jako trojmocný fosforečnan (PO43-), dvojmocný hydrogenfosforečnan (HPO42-) a jednomocný dihydrogenfosforečnan (H2PO4-)10). Jelikož trojmocný fosforečnan (PO43-) se vyskytuje pouze při vysokých hodnotách pH, nebývá prakticky přítomný v parenterálních přípravcích, a proto jsou z hlediska TPN důležité jen zbývající dvě formy12). Je dobře zdokumentováno, že dihydrogenfosforečnan vápenatý Ca(H2PO4)2 je dobře rozpustný ve vodě (71 mmol/l), kdežto hydrogenfosforečnan vápenatý CaHPO4 vykazuje rozpustnost nízkou (1,8 mmol/l)7, 10, 13). Rovnovážný stav mezi oběma formami závisí na koncentraci vápenatých a fosforečnanových iontů, pH a teplotě7, 10). K posunu k téměř nerozpustnému CaHPO4 dochází při vyšší koncentraci obou iontů, nebo zvýšením pH a částečně též při zvýšené teplotě. Optimální hodnota pH je 6,2 nebo nižší 12, 14).
Wong et al. ve své souhrnné práci popisují vliv dvou anorganických fosforečnanů (dihydrogenfosforečnanu draselného a hydrogenfosforečnanu draselného) na rozpustnost výsledné soli s ionty vápníku15). Jelikož je známo, že dihydrogenfosforečnan vápenatý je dobře rozpustný ve vodě, lze použít dihydrogenfosforečnany v parenterálních směsích v podstatně vyšších koncentracích a docílit souhrnné koncentrace vápenatých a fosforečnanových solí 45 mmol/l bez vzniku makroskopicky i mikroskopicky pozorovatelných sraženin. V případě hydrogenfosforečnanů může docházet ke vzniku sraženiny již při souhrnné koncentraci obou solí 10 mmol/l15). V literatuře se uvádí, že nejvýhodnější, z hlediska kompatibility, jsou organické formy fosforečnanů, např. glukoso-1-fosfát, fruktoso-1,6-difosfát, glycerolfosfát16) (v České republice je registrován glukoso-1-fosfát). Organické formy fosfátů umožňují dosáhnout souhrnné koncentrace 50 mmol/l17).
Maximální bezpečná koncentrace vápenatých a fosforečnanových iontů, kterou lze použít při sestavování receptur parenterální výživy, ve velké míře závisí též na použitých nutričních substrátech. Velmi důležité jsou z tohoto hlediska aminokyseliny, které významně ovlivňují rozpustnost vznikajících sloučenin7, 18). V současné době se v parenterální výživě uplatňují výhradně standardní roztoky aminokyselin. Běžně používané roztoky aminokyselin však neumožňují dosáhnout tak vysokých koncentrací vápenatých a fosforečných iontů, jaké jsou zapotřebí např. v neonatologii18). K těmto účelům se vyvíjejí speciální roztoky aminokyselin. Avšak prací věnovaných otázkám inkorporace různých prvků do jednotlivých roztoků aminokyselin, obzvlášť těch pediatrických, je minimálně. Proto cílem práce bylo sledování kompatibility a stability různých fosforečnanů se solemi vápníku v roztocích aminokyselin a glukosy.
Pokusná část
Materiál
Pro experiment byly použity následující sterilní a bezrogenní parenterální přípravky: roztoky glukosy 10% (Ardeanutrisol G 10 – Ardeapharma, a.s., Česká republika) a 40% (Ardeanutrisol G 40 – Ardeapharma, a.s., Česká republika); roztoky aminokyselin: Neonutrin 5% (Fresenius Kabi, Česká republika), Neonutrin 15% (Fresenius Kabi, Česká republika), Aminoplasmal Hepa 10% (B. Braun, Melsungen AG, Německo), Aminovenoes N Paed 10% (Fresenius Kabi AB, Uppsala, Švédsko), Primene 10% (Baxter Czech, Česká republika); roztok chloridu vápenatého 10% (Calcii chloridum inf. conc. 10% – Nemocniční lékárna VFN, Česká republika), roztok glukonanu vápenatého (Calcium inj. Sol. 10 × 10 ml/1 g Biotika – Hoechst-Biotika, spol. s r. o., Slovensko), roztok glukoso-1-fosfátu (Glucose-1-phosphat „Fresenius“ 1 molar – Fresenius Kabi AB, Švédsko), roztok hydrogenfosforečnanu sodného 8,7% (Ardeaelytosol conc. Natriumhydrogenfosfát 8,7% – Ardeapharma, a.s., Česká republika), roztok dihydrogenfosforečnanu draselného 13,6% (Kalii dihydrogenphosphatis inf. conc. 13,6% – Nemocniční lékárna VFN, Česká republika). K filtraci roztoků se použil membránový filtr SterivexTM – GP 0,22 μm FILTER UNIT (Millipore Corp., USA).
Použité přístroje
Mikroskop Leica DM LB 2 (Leica microsystems Launches Branding Campaign, Německo), komůrka Fast read s definovaným objemem 1 μl (Biosigma, S.r.I., Itálie), pH metr InoLab® Level 2 pH/mV Meter (Wissenchaftlich Technische Werkstatten, Wilheim, Německo). Hodnocení kontaminace neviditelnými částicemi se provádělo v Ardeapharma, a.s. s použitím Particle Sizing Systems LE400-1 SUM, Inc. (USA).
Příprava vzorků
Vzorky se připravovaly za aseptických podmínek v čistých prostorech Nemocniční lékárny VFN. Připravené vzorky se uchovávaly v lednici při 2–8 °C (lednice jsou kalibrovány a monitorovány SW firmy Regukon) chráněny před světlem.
Vzorky pro titraci
K 50 g roztoku glukosy o koncentraci 10 % nebo 40 % nebo roztoku aminokyselin (Neonutrin 5%, Neonutrin 15%, Aminoplasmal Hepa 10%, Aminovenoes N Paed 10%, Primene 10%) bylo přidáno vždy po 10 g jednotlivých fosforečnanových roztoků.
Vzorky pro hodnocení kontaminace částicemi pod hranici viditelnosti
K 50 g roztoku glukosy o koncentraci 10 % nebo 40 % nebo roztoku aminokyselin (Neonutrin 5%, Neonutrin 15%, Aminoplasmal Hepa 10%, Aminovenoes N Paed 10%, Primene 10%) bylo přidáno 2 g roztoku glukonanu vápenatého a dále buď 4 g roztoku glukoso-1-fosfátu, nebo 4 g roztoku dihydrogenfosforečnanu draselného 13,6%. Bezprostředně před smícháním byly všechny roztoky přefiltrovány membránovým filtrem o velikosti pórů 0,22 μm, aby se vyloučily případné pevné částice z přidávaných roztoků. Všechny roztoky byly naplněny do sterilních lahví DIN 100 ml, v nichž se pak v ochranném termoobalu odesílaly do kontrolní laboratoře. Odběr vzorků k hodnocení se prováděl v den přípravy a pak po 4 a 8 dnech. Vzorky také sloužily k mikroskopickému hodnocení.
Hodnocení vzorků titrací
Přibližně 10 g (analytická navážka s přesností na 1 mg hmotnosti) jednotlivých vzorků bylo titrováno 10% roztokem chloridu vápenatého nebo 10% roztokem glukonanu vápenatého do vzniku viditelné sraženiny. Každý vzorek byl titrován třikrát a pro další hodnocení byl použit aritmetický průměr výsledků. Bylo také hodnoceno pH před přidáním roztoku vápenatých solí do směsi a v momentě vzniku sraženiny fosforečnanu vápenatého.
Hodnocení kontaminace částicemi pod hranici viditelnosti
Hodnotily se vzorky, u nichž nedošlo k viditelné precipitaci při titraci. Kritériem hodnocení byla velikost a počet částic v přípravku v souladu s metodikou článku Hodnocení kontaminace částicemi pod hranicí viditelnosti (2.9.19), zkouška 1.B Českého lékopisu 200919). Toto hodnocení prováděla kontrolní laboratoř Ardeapharma, a.s. Tvar a vzhled krystalů byl hodnocen mikroskopicky při 400násobném zvětšení.
Zpracování výsledků
Výpočty byly provedeny v prostředí SW STATISTIKA® pro Windows (Statsoft s.r.o., Praha, Česká republika), většinou s pomocí neparametrických postupů. Za statisticky významné byly považovány hodnoty P menší než 0,05.
Výsledky a diskuse
Provedený experiment potvrdil, že nejnáchylnější k precipitaci s vápenatými ionty je hydrogenfosforečnan – organická forma fosforečnanu nebo dihydrogenfosforečnan jsou totiž oproti němu asi 30krát rozpustnější13). Při titraci roztoků obsahujících různé fosforečnany docházelo ke vzniku viditelné sraženiny právě pouze u vzorků s hydrogenfosforečnanem sodným při spotřebě roztoku glukonanu vápenatého 10% od 0,34 ml do 1,19 ml (0,0765 do 0,26775 mmol) nebo roztoku chloridu vápenatého 10% od 0,15 ml do 0,41 ml (0,0684 do 0,18696 mmol) (obr. 1). Ke vzniku nerozpustného fosforečnanu vápenatého nejsnáze docházelo ve vzorcích obsahujících roztok glukosy 10% nebo roztok aminokyselin Neonutrin 5%, což koresponduje s výsledky literatury, která uvádí, že vyšší riziko vzniku sraženiny představují nižší koncentrace glukosy a aminokyselin9, 17). Naopak nejodolnější vůči precipitaci byly vzorky obsahující roztoky aminokyselin o vyšší koncentraci (nejvíce Primene 10%). Pozitivní vliv v tomto případě mohlo mít nižší pH Primene 10%, stejně jako druh a koncentrace jednotlivých aminokyselin (tab. 1). Uvádí se, že stabilizující účinek aminokyselin vyplývá zejména:
- ze snížení pH směsi za současného zvýšení rozpustnosti vznikajících solí (především díky cysteinu7, 9, 18, 20, 21)),
- vytvoření potřebné tlumivé kapacity (podílí se hlavně arginin, histidin, lysin)7),
- ze vzniku rozpustných komplexů s vápenatými nebo fosforečnanovými ionty, které snižují množství volně přístupných disociovaných iontů (komplex s vápenatými ionty vytváří kyseliny s negativním nábojem, jako např. kyseliny aspartová a glutamová, fosforečnanové ionty vážou pozitivně nabité bazické aminokyseliny, jako jsou lysin, arginin nebo histidin)7, 9).
1. Složení zkoumaných roztoků aminokyselin 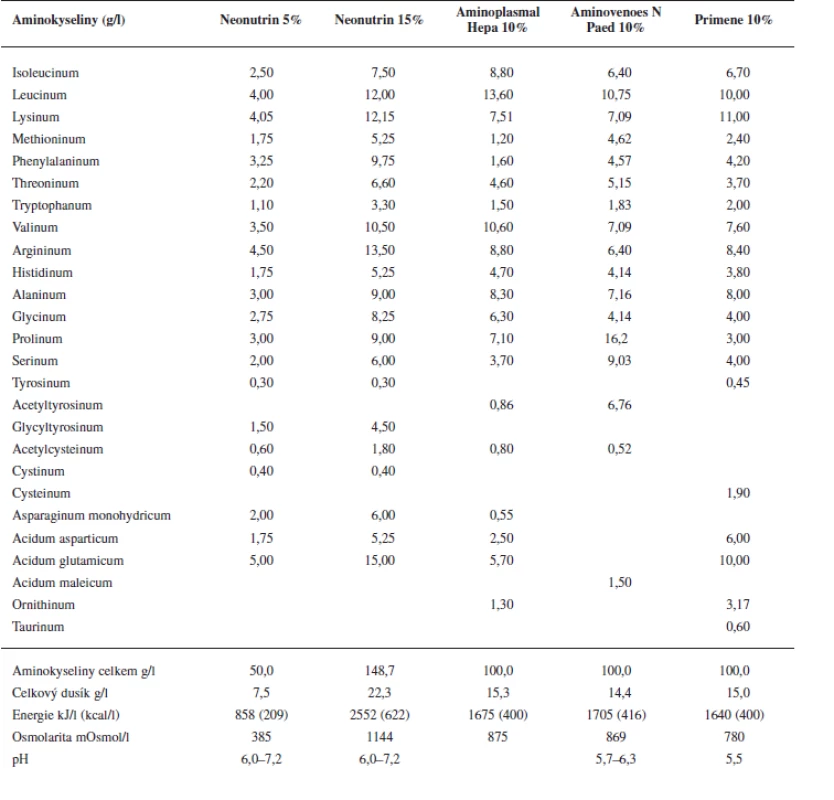
Z tabulky 1 je patrné, že Primene 10% obsahuje, v porovnání s ostatními roztoky, vyšší koncentrace zmíněných aminokyselin a cystein obsahuje jako jediný.
V roztocích glukosy k rychlejší tvorbě sraženiny docházelo při titraci roztokem glukonanu vápenatého, kdežto u roztoků aminokyselin, s výjimkou Aminoplasmalu Hepa 10%, použitím anorganické soli (obr. 1). Tento rozdíl však byl statisticky významný pouze v případě Primene 10%. Naše výsledky se shodují se zjištěním Bouchoud et al., a sice že povaha vápenatých solí nemá příliš výrazný vliv na vznik sraženiny fosforečnanu vápenatého, přesněji, významnější z hlediska stability směsí obsahujících vápenaté a fosforečnanové ionty je druh použitého fosforečnanu17).
1. Spotřeba roztoků vápenatých solí ke vzniku pozorovatelné sraženiny při titraci 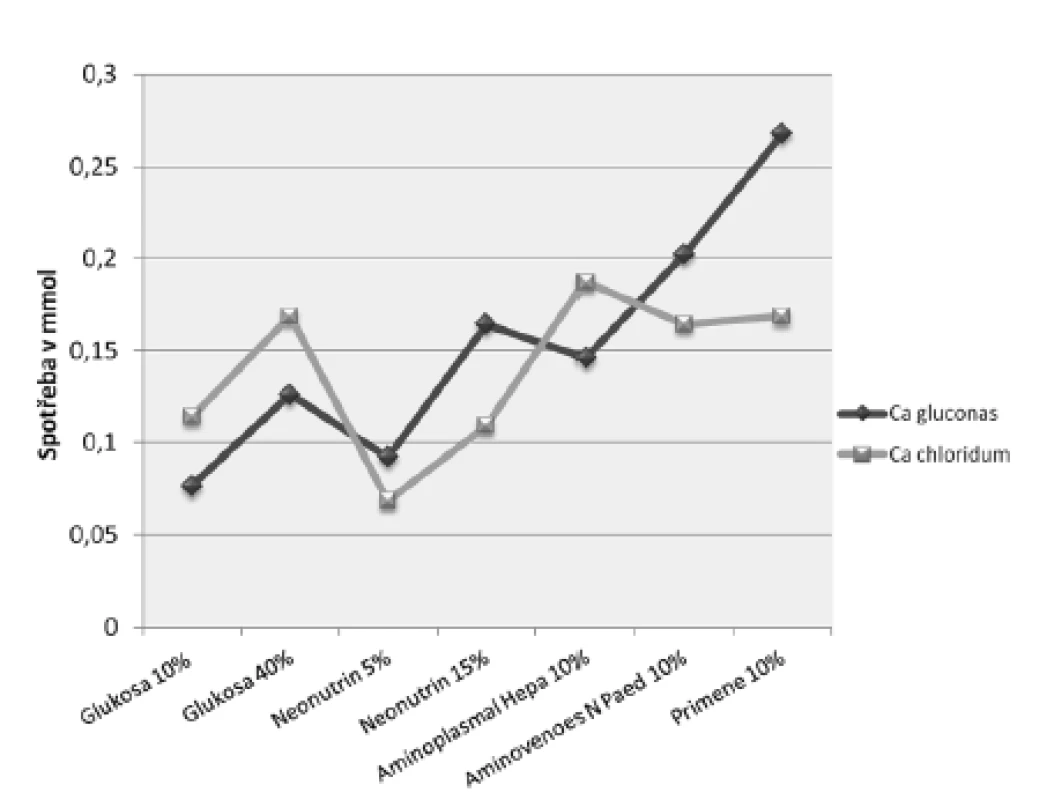
Při titraci kleslo pH roztoků přidáním solí vápníku u všech vzorků, a to v rozmezí hodnot 0,06–0,19, což je výsledkem změny disociace sloučenin a vzniku sraženiny. Hodnoty pH po přidání vápenatých sloučenin měly vztah k původním hodnotám.
U přípravků obsahujících organický fosforečnan nebo dihydrogenfosforečnan se viditelná sraženina neobjevila ani během uchovávání po dobu 8 dnů. Proto se u těchto fosforečnanů ve směsi s glukonanem vápenatým provedla lékopisná zkouška19) Hodnocení kontaminace částicemi pod hranicí viditelnosti. Souhrnná koncentrace solí v tomto případě tvořila 87 mmol/l, což je koncentrace asi 4krát až 6krát vyšší, než se obvykle vyskytuje v parenterální výživě pro dospělé pacienty22). Při hodnocení bylo u vzorků s dihydrogenfosforečnanem draselným (anorganický fosforečnan) v 5 ml nalezeno od 1 do 410 částic o velikosti 10 μm a větších, respektive od 1 do 242 částic o velikosti 25 μm a větších. U vzorků obsahujících glukoso-1-fosfát (organický fosforečnan) se počet částic o velikosti 10 μm a větších pohyboval od 10 do 506 a částic a o velikosti 25 μm a větších od 2 do 177. U obou typů fosforečnanů nejhorší výsledky vykazovaly vzorky obsahující glukosu (obr. 2 a 3). Prokazatelně menší počet kontaminantů byl nalezen u vzorků s roztoky aminokyselin, zvláště pak primárně určených pro pediatrické pacienty. Počet částic narůstal během uchovávání. Nejvíce patrné to bylo ve skupině o velikosti částic 10 μm a větších – tento nárůst byl statisticky významný u obou typů fosforečnanů, a to jak 4., tak i 8. den po přípravě (p < 0,05). V případě velikostní třídy částic 25 μm a větších byl pozorován statisticky významný nárůst u obou fosforečnanů jen 4. den po přípravě (p < 0,05). U vzorků s roztoky aminokyselin vyhovovaly lékopisnému limitu (u roztoků v obalech se jmenovitým objemem 100 ml nebo menším – ne více než 6000 částic v obalu pro částice o velikosti 10 μm a větší a ne více než 600 částic v obalu pro částice o velikosti 25 μm a větší19)) všechny jednotky po celou dobu měření u obou sledovaných typů fosforečnanů. Vzorky s oběma koncentracemi glukosy u anorganického fosforečnanu vyhovovaly limitu jen první den, kdežto u organické formy kromě prvního dne ještě i 4. den vyhovoval roztok glukosy 40%. Ze statistické analýzy dat vyplývá, že ve všech zkoumaných roztocích délka uchovávání nejvíce ovlivňovala nárůst částic o velikosti nad 10 μm. χ2-test s Yatesovou korekcí (pro p < 0,05) potvrdil předpoklad, že by k větším změnám mohlo docházet v roztocích glukosy, což se uskutečnilo v obou velikostních třídách. Toto zjištění ukazuje na nižší stabilitu vápenatých a fosforečnanových sloučenin v prostředí glukosy. V roztocích aminokyselin byl nárůst částic o velikosti 25 μm a větších minimální (obr. 2 a 3). Přestože z grafického porovnání roztoků obsahujících dva druhy fosforečnanů (obr. 2 a 3) jsou patrné určité rozdíly ve prospěch organického fosforečnanu, Wilcoxonův párový test nepotvrdil statisticky významný rozdíl ani v případě počtu částic v celé skupině, ani z hlediska velikosti částic či doby uchovávání.
2. Vliv doby uchovávání na vznik nerozpustných solí (kontaminace neviditelnými částicemi) v roztocích obsahujících dihydrogenfosforečnan draselný 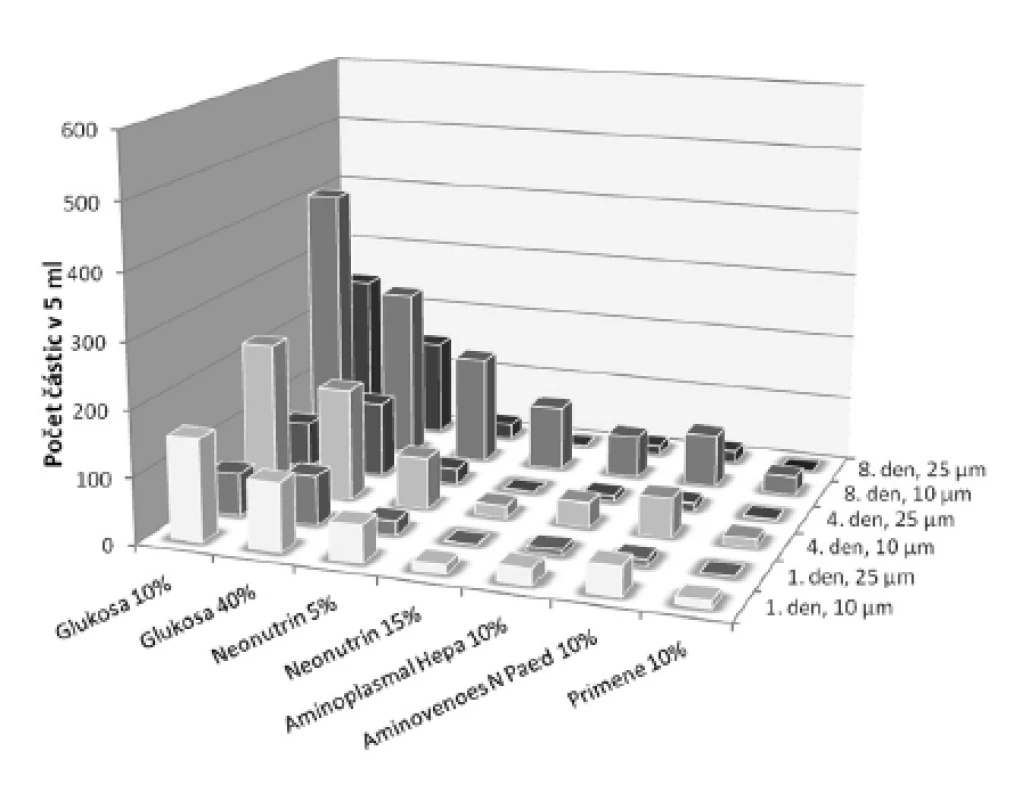
3. Vliv doby uchováváni na vznik nerozpustných soli (kontaminace neviditelnými částicemi) v roztocích obsahujících glukoso-1-fosfát 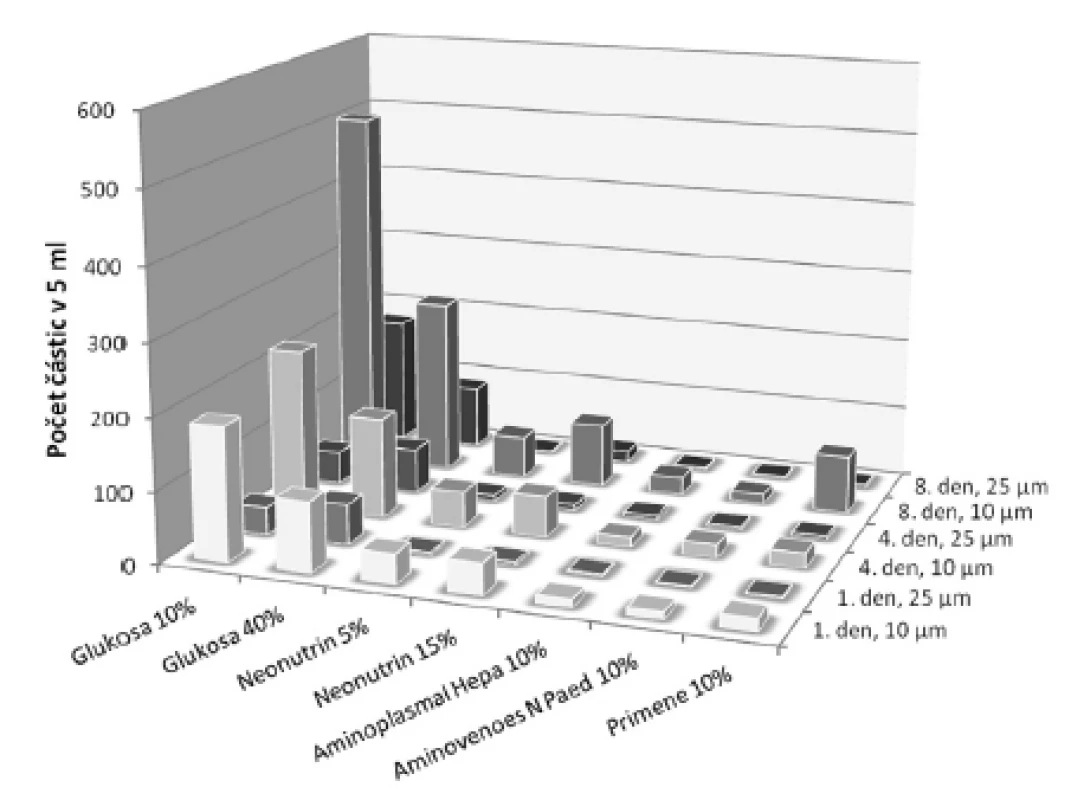
Pro ověření nálezů částic bylo provedeno mikroskopické hodnocení morfologie částic. Ve vzorcích byla potvrzena přítomnost krystalů fosforečnanů vápenatých s morfologicky odlišným tvarem – anorganických jehlicovitých a organických nepravidelného tvaru (obr. 4–5). Podobný vzhled organických krystalů pozorovali při hodnocení parenterálních směsí Chaieb et al.1).
4. Mikroskopicky hodnocená morfologie krystalů fosforečnanů vápenatých – anorganická forma 
5. Mikroskopicky hodnocená morfologie krystalů fosforečnanů vápenatých – organická forma 
Závěr
Provedené hodnocení parenterálních směsí potvrdilo nižší kompatibilitu hydrogenfosforečnanu se solemi vápníku v roztocích glukosy nebo aminokyselin ve srovnání s dihydrogenfosforečnanem nebo organickým fosforečnanem. Stabilita roztoků obsahujících dihydrogenfosforečnan nebo organický fosforečnan se významně nelišila. Experiment rovněž potvrdil lepší stabilitu organické soli vápníku, avšak pouze u vzorků obsahujících roztoky aminokyselin. V roztocích glukosy byl vliv druhu soli spíše opačný. Ze sledovaných roztoků aminokyselin největší stabilizující vlastnosti měly roztoky určené pro použití v neonatologii a pediatrii.
Střet zájmů: žádný.
Došlo 16. srpna 2011 / Přijato 18. září 2011
PharmDr. Michal Janů
Nemocniční lékárna VFN
U Nemocnice 2, 128 08 Praha 2
e-mail: janu.michal@vfn.cz
Sources
1. Chaieb D. R., Chaumeil J-C., Jebnoun S., Khrouf N., Bednili A., Sfar S. Calcium and phosphate compatibility and stability studies in different neonatal parenteral nutrition mixtures. EJHPScience 2006; 12, 35–40.
2. Iacobelli S., Bonsante F., Vintéjoux A., Gouyon J.-B. Standardized parenteral nutrition in preterm infants: Early impact on fluid and electrolyte balance. Neonatology, 2010; 98, 84–90.
3. Food and Drug Administration. Safety alert: hazards of precipitation associated with parenteral nutrition. Am J Hosp Pharm 1994; 51, 1427–1428.
4. Niemiec P. W., Vanderveen T. W. Compatibility considerations in parenteral nutrient solutions. Am J Hosp Pharm 1984; 41, 893–911.
5. Newton D. W., Driscoll D. F. Calcium and phosphate compatibility: revisited again. Am J Health Syst Pharm 2008; 65, 73–80.
6. Zadák Z. Výživa v intenzivní péči. 2. vydání. Praha: Grada Publishing 2008; 212 s.
7. Allwood M. C., Kearney M. C. J. Compatibility and stability of additives in parenteral nutrition admixtures. Nutrition 1998; 14, 697–706.
8. Pertkiewicz M., Cosslett Mühlebach S., Dudrick S. J. Basics in clinical nutrition: Stability of parenteral nutrition admixtures. e-SPEN, Eur. e-J. Clin Nutr Metabol 2009; 4, e117–e119.
9. Parikh M. J., Dumas G., Silvestri A., Bistrian B. R., Driscoll D. F. Physical compatibility of neonatal total parenteral nutrient admixtures containing organic calcium and inorganic phosphate salts. Am J Health-Syst Pharm 2005; 62, 1177–1183.
10. SchrŅder A. M. Total parenteral nutrition – problems in compatibility and stability. EJHPPractice 2008; 14, 65–67.
11. Joy J., Silvestri A. P., Franke R., Bistrian B. R., Nehne J., Newton D. W., Driscoll D. F. Calcium and phosphate compatibility in low-osmolarity parenteral nutrition admixtures intended for peripheral vein administration. J Parenter Enteral Nutr 2010; 34, 46–54.
12. Newton D. W., Driscoll D. F. Chemistry and safety of phosphates injections. Am J Health-Syst Pharm 2008; 65, 1761–1766.
13. Allwood M. C. Compatibility and stability of TPN mixtures in big bag. J Clin Hosp Pharm 1984; 9, 181–198.
14. Braun B. All in one směsi pro totální parenterální výživu. Hradec Králové: Progrestisk 2000; 9–19.
15. Wong J. C., McDougal A. R., Tofan M., Aulakh J., Pineault M., Chessex P. Doubling calcium and phosphate concentration in neonatal parenteral nutrition solutions using monobasic potassium phosphate. J Am Coll Nutr 2006; 25, 70–77.
16. Ronchera-Oms C. L., Jimenez N. V., Peidro J. Stability of parenteral nutrition admixtures containing, organic phosphates. Clin Nutr 1995; 14, 373–380.
17. Bouchoud L., Fonzo-Christe C., Sadeghipour F., Bonnabry P. Maximizing calcium and phosphate content in neonatal parenteral nutrition solutions using organic calcium and phosphate salts. J Parenter EnteralNutr 2010; 34, 542–545.
18. Ybarra J. V. Calcium and phosphate solubility in neonatal parenteral nutrient solutions containing TrophAmine. Nutr Clin Pract 2010; 25, 353–356.
19. Český lékopis 2009. Praha: Grada Publishing 2009.
20. Trissel, L. A., Xu Q. A., Zhang Y., Walter W. V. Use of cysteine hydrochloride injection to increase the solubility of calcium and phosphates in FreAmine III-containing parenteral nutrition solutions. Int J Pharm Compound 2003; 7, 71–77.
21. Shulman R. J., Phillips S. Parenteral nutrition in infants and children. J Pediatr Gastroent Nutr 2003; 36, 587–607.
22. Sobotka L., Allison S. P., Furst P., Meier R., Pertkiewicz M., Soeters P. B. Basics in clinical nutrition. 3rd ed. Prague: Galén 2004; 500 s.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2012 Issue 1-2-
All articles in this issue
- Intended pharmacotherapeutical approaches of Alzheimer’s disease therapy
- The possibilities of innovation of extemporaneous preparation in pharmacies in the Czech Republic
- Derivatives of phenylcarbamic acid as potential antituberculotics
- Metabolomics in research of phytotherapeutics
- Compatibility of phosphates with calcium salts in parenteral nutrition
- Analytical profile of mono[{3-[4-(2-ethoxyethoxy)-benzoyloxy]-2-hydroxypropyl}-tert-butylammonium] fumarate
- Identification of lipoxygenase expressing ω-6 dioxygenase activity by means of liquid chromatography
- Stability testing of alginate-chitosan films
- Monitoring of effectiveness of some preventive measures against influenza
- Study of local anaesthetics – Part 196*Formulation of the local anaesthetic heptacaine into hydrogel on the basis of chitosan
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The possibilities of innovation of extemporaneous preparation in pharmacies in the Czech Republic
- Compatibility of phosphates with calcium salts in parenteral nutrition
- Metabolomics in research of phytotherapeutics
- Intended pharmacotherapeutical approaches of Alzheimer’s disease therapy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

