-
Medical journals
- Career
Deriváty pyrazinkarboxylové kyseliny jako účinné abiotické elicitory produkce isoflavonoidů
Authors: L. Tůmová 1; J. Tůma 2; M. Doležal 3; B. Danielová 1
Authors‘ workplace: Univerzita Karlova v Praze, Farmaceutická fakulta v Hradci Králové, Katedra farmakognosie 1; Univerzita Hradec Králové, Pedagogická fakulta, Katedra biologie 2; Univerzita Karlova v Praze, Farmaceutická fakulta v Hradci Králové, Katedra farmaceutické chemie a analýzy léčiv 3
Published in: Čes. slov. Farm., 2010; 59, 117-122
Category: Original Articles
Overview
Genista tinctoria (Kručinka barvířská) je rostlinou obsahující isoflavonoidy, které se řadí k významným estrogenům. Kultura in vitro této rostliny produkuje více isoflavonoidů než matečná rostlina. Cílem této práce byla snaha ještě zvýšit produkci těchto látek v kalusové kultuře působením abiotických elicitorů a to derivátů pyrazinkarboxylové kyseliny. Vhodnějším elicitorem pro produkci isoflavonoidů se ukázala látka A (N-(3-jod-4-methylfenyl)pyrazin-2-karboxamid), i když naprostého maxima produkce genistinu bylo dosaženo 12hodinovým působením látky B 5‑terc-butyl-6-chlor-N-(3-jod-4-methylfenyl)pyrazin-2-karboxamid v koncentraci 2,33 . 10-3 mol/l (57 × oproti kontrole). Elicitací látkou B bylo dosaženo vyrovnanějších výsledků ve zvýšené produkci isoflavonoidů v průřezu jednotlivých odběrových časů i koncentrací.
Klíčová slova:
Genista tinctoria – isoflavonoidy – kalusová kultura – deriváty pyrazinkarboxylové kyselinyÚvod
Rostlinné tkáňové kultury představují nadějný zdroj látek přírodního původu. Hlavním problémem jejich využití je nízká produkce většiny sekundárních metabolitů. Jednou z metod pro zvýšení tvorby těchto látek je elicitace, protože biosyntéza mnoha sekundárních metabolitů v rostlinných buňkách je součástí obranné reakce vůči biologickým nebo abiotickým stresovým vlivům1–3). Základním předpokladem úspěšné elicitace, která se využívá ke zvýšení produkce sekundárních metabolitů, je mimo jiné nalezení vhodného elicitoru, jeho koncentrace a optimální doby působení elicitoru na rostlinnou kulturu in vitro 4).
Role látek odvozených od pyrazinu se intenzivně studuje od sedmdesátých let 20. století. V přírodě se často vyskytují jako feromony, atraktanty či signální látky. V potravinách je najdeme jako flavoranty a fragranty – přírodní i přírodně identické. V poslední době jsou často využívány i jako součásti parfémů a v tabákovém průmyslu. Pyrazinové sloučeniny vytvářené některými druhy plísní a kvasinek mohou mít i antibiotický nebo antifungální účinek.
Významné farmakologické účinky byly zjištěny i u syntetických derivátů pyrazinu. Pyrazinový kruh je farmakoforem především u menších molekul, nicméně je součástí široké palety účinných látek. Molekulu pyrazinu obsahují například sulfonamidová chemoterapeutika, kalium šetřící diuretikum amilorid, perorální antidiabetikum glipizid a pyrazin najdeme i v hypnotiku eszopiklon. Od pyrazinu je odvozeno i antituberkulotikum pyrazinamid, konkrétně amid pyrazin-2-karboxylové kyseliny. K perspektivním látkám s antimykobakteriálním účinkem patří jednoduché chlorované pyrazinové deriváty, které se chovají jako proléčivo, tedy estery a amidy pyrazin-2-karboxylové kyseliny 5). Látky typu substituovaných pyrazin-2-karboxamidů byly zkoumány nejen pro svůj potenciální antimykobakteriální účinek, ale většina z nich vykazovala i účinek herbicidní a ukázaly se i vhodnými abiotickými elicitory 6). Většina látek popsaných Doležalem a kol. inhibovala elektronový transport při fotosyntéze v chloroplastech špenátu. Míra inhibice produkce kyslíku byla ovlivněna lipofilitou a elektronakceptorovými vlastnostmi substituentů dané sloučeniny. Některé z látek redukovaly obsah chlorofylu v Chlorella vulgaris 7).
Substituované pyrazin-2-karboxamidy byly použity jako elicitory u kalusové kultury Ononis arvensis (L.), kde se po 12 hodinové elicitaci jednou z pěti testovaných látek tohoto typu zvýšila produkce flavonoidů o 900 % oproti kontrole. Výrazného navýšení produkce bylo dosaženo i po 48 a 72hodinové elicitaci a navíc k určitému nárůstu produkce flavonoidů došlo po aplikaci všech testovaných látek 6).
Další nově syntetizované látky typu substituovaných pyrazin-2-karboxamidů byly použity k elicitaci kalusové a suspenzní kultury Silybum marianum (L.) Gaertn. I v tomto případě došlo k významnému ovlivnění produkce sekundárních metabolitů – flavolignanů 8).
Genista tinctoria je 10–100 cm vysoký keř nebo polokeř s vystoupavým nebo poléhavým kmínkem. V České republice se vyskytuje roztroušeně až hojně od nížin až po podhůří. Sbírá se kvetoucí nať – Genistae tinctoriae herba, která působí močopudně, zvyšuje chorobně snížený tlak, čistí krev a ovlivňuje metabolismus. V lidovém léčitelství je používána proti dně, revmatismu a při ledvinových kamenech 10).
Droga obsahuje důležité isoflavonoidy – známou skupinu látek s estrogenní aktivitou, tzv. fytoestrogeny a chinolizidinové alkaloidy (cytisin, spartein, methylcytisin, anagyrin) 9, 10). Fytoestrogeny jsou funkčně definovány jako látky, které v savčím organismu vykazují estrogenní aktivitu, navíc jejich molekula je i strukturálně podobná hlavnímu savčímu estrogenu 17ß-estradiolu. Mezi přírodně se vyskytující isoflavonoidy s estrogenní aktivitou řadíme především aglykony daidzein (4’,7-dihydroxyisoflavon) a genistein (4’,5,7-trihydroxyisoflavon) a jejich glykosidy daidzin a genistin. Dále se jedná o aglykony biochanin A a formononetin, což jsou 4’ methylethery genisteinu a daidzeinu. Pro získávání isoflavonoidů je dnes nejvíce využívána čeleď Fabaceae – např. sója (Glycine max) nebo jetel (Trifolium pratense). Dalšími, především potravinovými zdroji, jsou semena a ořechy bohaté na oleje – např. slunečnicová semínka (Helianthus spp., Asteraceae) a vlašské ořechy (Juglans regia L., Juglandaceae). Isoflavonoidy byly prokázány i v čeledích Iridaceae či Euphorbiaceae. Fytoestrogeny svým působením v organismu zasahují do průběhu mnoha typů onemocnění od rakoviny prostaty a prsu po ovlivnění kardiovaskulárních onemocnění. Jsou čím dál častěji používány při kompenzaci menopauzálních symptomů a jako podpůrná léčba při osteoporóze 9, 13, 14). I zde se ovšem objevují pochybnosti o jejich přínosu. Vzhledem k jejich možné podpoře proliferace nádorových buněk u hormon-dependentních nádorových onemocnění je zvážení poměru přínosu a rizik stále předmětem mnoha studií.
Łuckiewicz et al. zkoumali šest druhů rodu Genista z hlediska produkce isoflavonoidů. Zabývali se různými metodami kultivace včetně vlivu morfogeneze na množství a zastoupení jednotlivých isoflavonoidů. Testovány byly kultury suspenzní, kalusové, embryonální, kořenové i prýtové. Bylo zjištěno, že kultury in vitro produkovaly zpravidla více isoflavonoidů než matečné rostliny, a to dokonce 6–9×. Kultury in vitro narozdíl od matečných rostlin neprodukovaly jednoduché flavonoidy – luteolin a apigenin. Jejich syntéza je prokazatelně potlačena při in vitro podmínkách, jelikož v regenerovaných rostlinách byla jejich tvorba znovu obnovena. Potlačena byla i syntéza chinolizidinových alkaloidů. V kořenových kulturách byl naproti tomu prokázán vysoký obsah isoliquiritigeninu – prekurzoru isoflavonoidů – naprosto chybějícího v matečných rostlinách. Ve všech kulturách byly isoflavonoidy akumulovány jako intracelulární metabolity. Obsah isoflavonoidů byl výrazně ovlivněn stupněm tkáňové morfogeneze. Studie ukázaly negativní vztah mezi procesem organogeneze a akumulací isoflavonoidů – aglykonů i glykosidů. Naopak pozitivně morfogeneze ovlivňovala tvorbu esterů genistinu. Nejvyšší obsah genistin malonátu a acetátu byl zaznamenán v prýtové kultuře. Skupina produkovaných isoflavonoidů byla tvořena 14 sloučeninami s jasnou dominancí genistinu. Z testovaných druhů byla nejvyšší produkce isoflavonoidů potvrzena u suspenzní a kalusové kultury Genista tinctoria. Nejvhodnějším médiem se pak ukázalo SH médium (Schenk-Hildebrandt) s přídavkem 22,6 μmol-1 2,4-dichlorfenoxyoctové kyseliny (2,4-D), 23,2 μmol-1 kinetinu a 3 % (w/v) sacharosy 9, 11, 12).
POKUSNÁ ČÁST
Použitý rostlinný materiál
Byla použita kalusová kultura odvozená z kořenové části klíční rostliny Genista tinctoria v 16. až 28. pasáži.
Kultivace kultur in vitro a elicitace
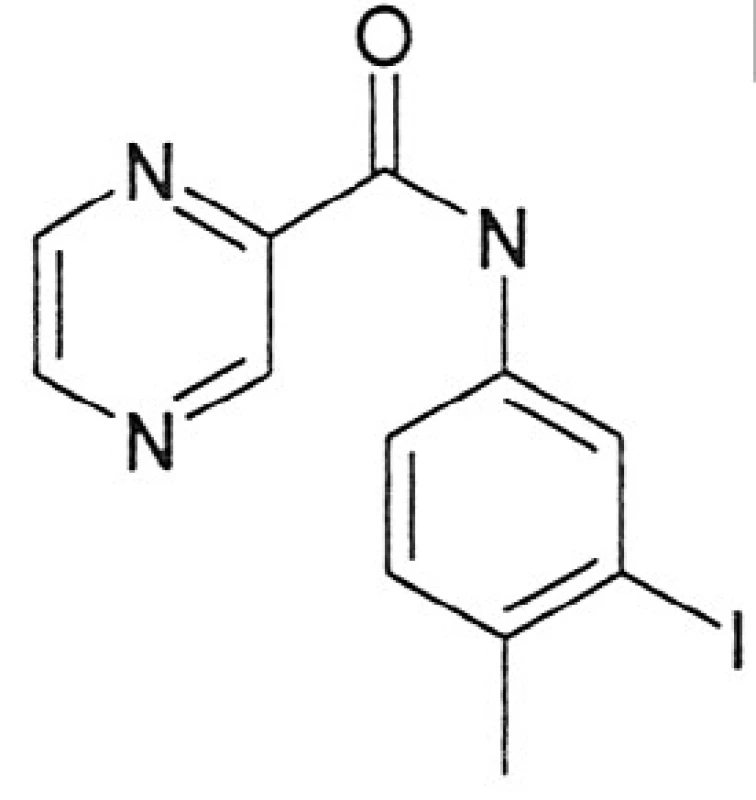
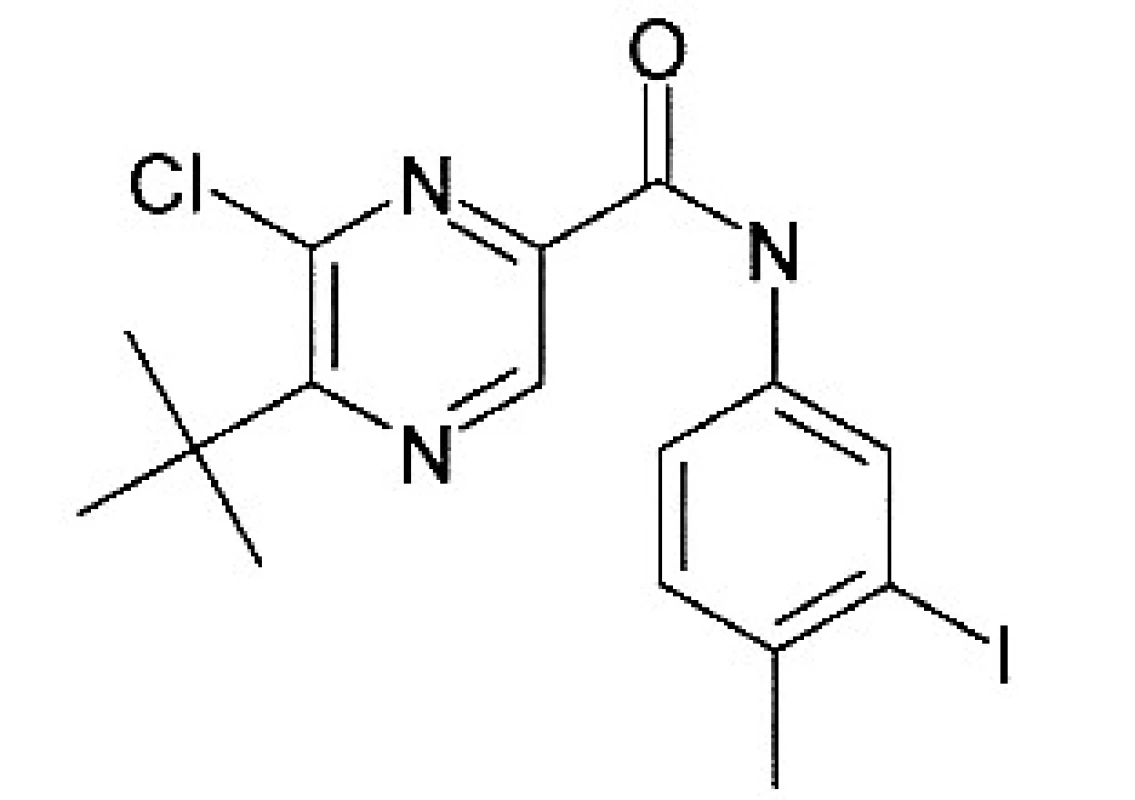
Kalusová kultura Genista tinctoria byla kultivována na médiu sestaveném dle Schenka Hildebrandta 15). Jako růstové regulátory byly přidány: kyselina 2,4-dichlorfenoxyoctová v koncentraci 0,5 mg/l a kinetin v koncentraci 0,1 mg/l. Pasážování bylo prováděno v prostředí laminárního boxu. Kultura rostla po dobu 30 dní při teplotě 25 °C při normálním světelném režimu (16 hodin světlo, 8 hodin tma). Jako elicitory byly použity ethanolické roztoky látky A a B, a to ve třech koncentracích (obr. 1, 2):
látka A:N-(3-jod-4-methylfenyl)pyrazin-2-karboxamid)
cA1 = 100 mg/100 ml (2,95 . 10-3 mol/l);
cA2 = 10 mg/100 ml (2,95 . 10-4 mol/l)
cA3 = 1 mg/100 ml (2,95 . 10-5 mol/l)látka B: (5-terc-butyl-6-chlor-N-(3-jod-4-methylfenyl)pyrazin-2-karboxamid)
cB1 = 100 mg/100 ml (2,33 . 10-3 mol/l);
cB2 = 10 mg/100 ml (2,33 . 10-4 mol/l)
cB3 = 1 mg/100 ml (2,33 . 10-5 mol/l)Pro každou koncentraci látky A i B bylo použito vždy 36 baněk, které byly rozděleny do šesti skupin dle časů elicitace. Byl aplikován vždy 1ml roztoku dané látky v dané koncentraci ke kalusové kultuře. Kultura byla po aplikaci elicitoru udržována za stejných podmínek jako při kultivaci. Vzorky byly odebírány po 6, 12, 24, 48, 72 a 168 hodinách po aplikaci elicitoru. Po dané době elicitace byly kalusy vyjmuty z baněk a usušeny na filtračním papíře při laboratorní teplotě. Usušené vzorky byly následně upráškovány a použity ke stanovení obsahu isoflavonoidů. Jako kontrola sloužila kalusová kultura bez přídavku elicitoru. Bylo sledováno i vylučování metabolitů do živného média. Médium bylo odebíráno vždy společně s kalusem ve zmíněných odběrových časech. Odebrané médium bylo odpařeno a dále byl v odparku stanoven obsah isoflavonoidů.
Stanovení obsahu isoflavonoidů 19)
Přibližně 0,100 g usušeného a upráškovaného kalusu bylo extrahováno s 10 ml 80% methanolu na vodní lázni pod zpětným chladičem 20–30 minut. Po ochlazení se výluh zfiltroval přes chomáček vaty. Extrakce byla opakována ještě jednou za stejných podmínek. Získané výluhy se spojily a doplnily na objem 25 ml. Vytřepáním v 10 ml petroletheru byl extrakt zbaven tuků a chlorofylu. Přibližně 2 ml výluhu byly přefiltrovány přes mikrofiltr do označených vialek a analyzovány pomocí metody HPLC.
Vzorky média byly nejprve odpařeny na vodní lázni do sucha a poté vysušeny v sušárně při 105 °C. Sušina byla rozpuštěna v 5 ml methanolu, vzniklý roztok zfiltrován přes mikrofiltr a množství o objemu přibližně 1,7 ml bylo převedeno do vialek. Poté byly vzorky analyzovány pomocí HPLC.
Parametry HPLC analýzy
Chromatograf: sestava Jasco; čerpadlo: PU-2089; autosampler: AS-2055; kolona: Li Chrospher RP – 18 250 × 4, sorbent Li Chrospher 5 μm; předkolonový filtr, ochranná předklonka; objem nástřiku:20 μl; detekce: DAD MD – 2015, λ = 190–450 nm, vyhodnoceno při λ = 260 nm; mobilní fáze: methanolický roztok 0,15% kyseliny fosforečné; eluční profil: 0–9 min., gradientová eluce, z t = 0 min, 30% methanol na t = 9 min, 80% methanol, 9–15 min, isokratická eluce, 80% methanol.
Standardy: genistin, genistein, daidzein, formononetin, biochanin A; průtoky: 1,1 ml/min.
VÝSLEDKY A DISKUZE
Elicitace je jednou z metod vhodných k ovlivnění produkce sekundárních látek v kulturách in vitro 16). Jedním ze základních předpokladů úspěšné elicitace, která povede k požadovanému zvýšení produkce sekundárních látek, je nalezení vhodného elicitoru, jeho koncentrace a optimální doby působení elicitoru na rostlinnou kulturu in vitro 17).
Cílem naší práce bylo prověřit potenciál nově nasyntetizovaných látek typu substituovaných pyrazin-2-karboxamidů jako elicitorů u kalusové kultury Genista tinctoria.
Po aplikaci látky A v koncentraci cA1 došlo v kalusové kultuře Genista tinctoria k vysokým nárůstům obsahu genistinu. Po 6hodinovém působení byl zaznamenán dvanáctinásobný nárůst oproti kontrole a po 12hodinovém působení dokonce zvýšení obsahu genistinu 28× oproti kontrole. Po 24, 48, 72, 168 hodinách byla produkce genistinu také zvýšena a to minimálně o 120 % (po 168 hodinách). Obsah daidzeinu ve většině vzorků poklesl oproti kontrole, jen po 48 hodinové elicitaci byl jeho obsah na úrovni kontroly. Elicitovaná kultura tvořila od 0,04 % (6 hod.) do 0,47 % (48 hod.) genisteinu. Byl detekován i formononetin (0,01 %) a to v čase 48 a 72 hodin elicitace. V kontrolním vzorku byl pod detekovatelnou hranicí. Biochanin A po elicitaci prokázán nebyl stejně jako v kontrolním vzorku (tab. 1).
Table 1. Obsah jednotlivých isoflavonoidů (%) v kalusové kultuře Genista tinctoria po elicitaci látkou A o různé koncentraci v závislosti na době odběru 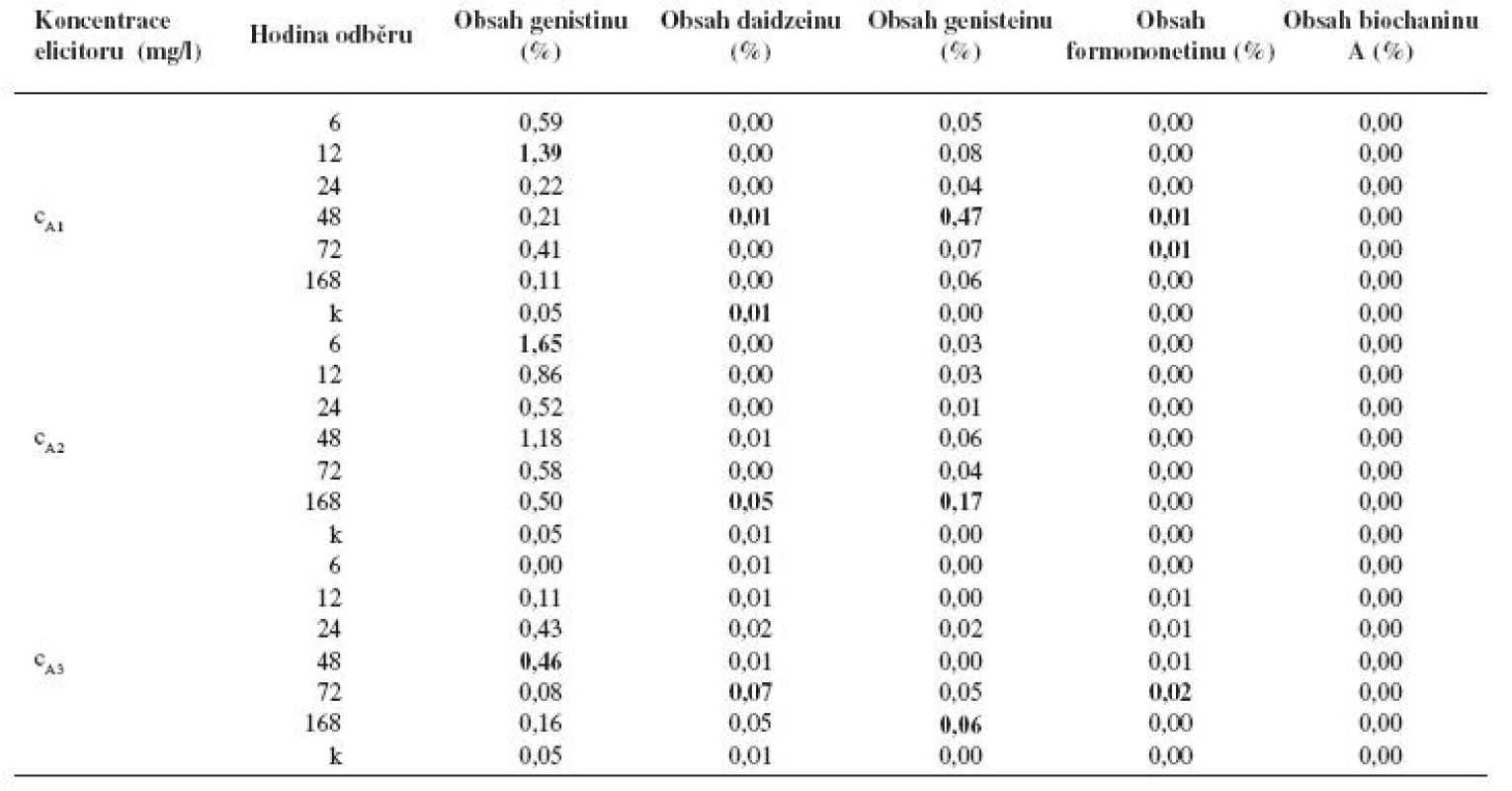
k – kontrola Jak vyplývá z tabulky 1 po aplikaci látky A o koncentraci cA2 došlo k ještě významnějšímu navýšení obsahu genistinu. Maximální zvýšení jeho produkce látkou A bylo dosaženo po 6 hodinách elicitace, a to 33× proti kontrole. V ostatních odběrových časech byla jeho produkce zvýšena také velmi výrazně. Minimální navýšení dosahovalo 900 % proti kontrole a bylo zaznamenáno po 168 hodinách působení elicitoru. Obsah daidzeinu (0,01%), který byl v kontrolním vzorku zaznamenán, byl navýšen po 168 hodinové elicitaci pětinásobně. V ostatních odběrových časech ovšem jeho množství buď bylo stejné jako ve vzorku kontrolním, nebo kleslo pod detekovatelnou mez. I po aplikaci koncentrace cA2 došlo k navýšení tvorby genisteinu, i když ne tak výrazně jako po aplikaci látky A o koncentraci cA1. Zde bylo maximum produkce dosaženo až po 168 hodinách působení elicitoru a obsahem genisteinu 0,17 %. Formononetin ani biochanin A detekovány nebyly.
Navýšení syntézy isoflavonoidů bylo dosaženo i působením látky A o koncentraci cA3, ovšem u genistinu a genisteinu bylo o něco menší než u koncentrací předchozích. Nejvyšší nárůst genistinu byl zaznamenán po 48hodinové elicitaci, a to 9× a u genisteinu byl zaznamenán maximální obsah 0,06 % po 168 hodinách. Naopak tato koncentrace stimulovala lépe syntézu daidzeinu a formononetinu. Po 72 hodinách elicitace byla navýšena produkce daidzeinu 6× oproti kontrole. Jeho obsah byl vyšší i u kalusů elicitovaných 24 a 168 hodin. Ve zbylých odběrových časech byl jeho obsah nedetekovatelný stejně jako v případě kontroly. Obsah formononetinu byl detekovatelný po 12, 24, 48 a 72 hodinách, přičemž v posledním uvedeném čase dosáhl maxima, a to 0,02 %. Biochanin A nebyl detekován ani po aplikaci této koncentrace (tab. 1).
Po aplikaci látky B v koncentraci cB1 došlo po 12hodinovém působení elicitoru k vůbec nejvyššímu navýšení produkce genistinu. Jeho obsah byl zvýšen 57× oproti kontrole. Vysokého obsahu genistinu bylo dosaženo i po 24hodinovém působení elicitoru, kde byl jeho obsah zvýšen 14×, ovšem v ostatních časech byl obsah genistinu buď zvýšen jen nevýrazně, nebo naopak snížen oproti kontrole. Po 12 a 24 hodinách elicitace byl ve vzorku prokázán i obsah daidzeinu (na úrovni kontroly), genisteinu (navýšení oproti kontrole) a formononetinu (navýšení oproti kontrole). Ve zbylých vzorcích nebyly daidzein, genistein ani formononetin detekovatelné. Biochanin A nebyl detekován v žádném ze vzorků (tab. 2).
Table 2. Obsah jednotlivých isoflavonoidů (%) v kalusové kultuře Genista tinctoria po elicitaci látkou B o různé koncentraci v závislosti na době odběru 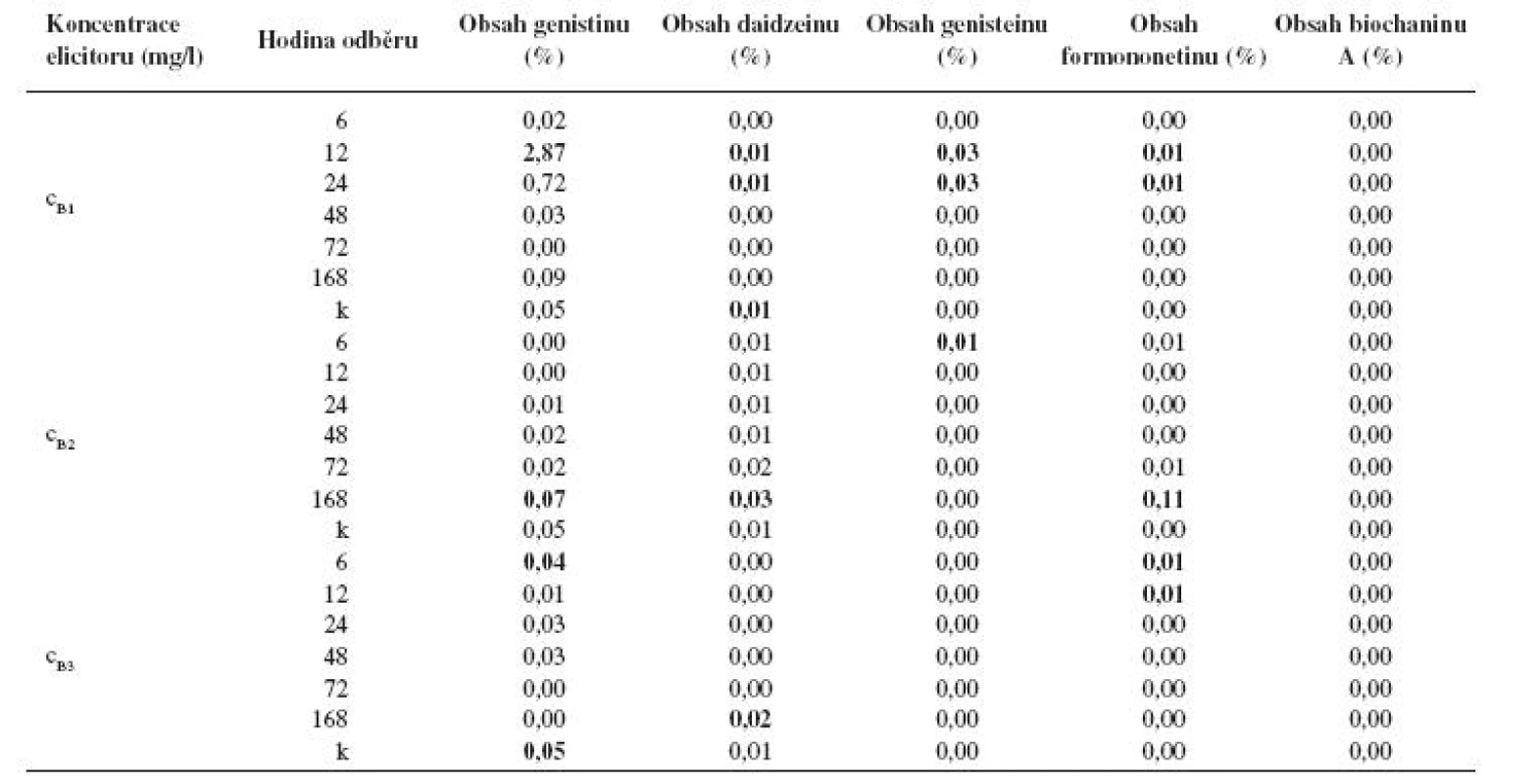
k – kontrola Po aplikaci látky B o koncentraci cB2 došlo k výraznějšímu navýšení produkce pouze u daidzeinu po 168hodinové elicitaci, a to o 200 %. V tomto případě bylo také zjištěno navýšení produkce genisteinu, ale pouze o 40 %, a obsah formononetinu dosáhl 0,11 %, přičemž v kontrole nebyl detekovatelný. V ostatních odběrových časech byla produkce isoflavonoidů buď na úrovni kontroly, nebo snížená (tab. 2).
Působením elicitoru o koncentraci cB3 bylo dosaženo obecné snížení tvorby isoflavonoidů. Jedinými dvěma výjimkami je navýšení obsahu daidzeinu po 168 hodinách působení elicitoru a detekovatelný obsah formononetinu po 6 a 12 hodinách. Jinak ve většině vzorků byl obsah isoflavonoidů pod detekovatelnou mezí (tab. 2).
Výhodnějším elicitorem pro produkci isoflavonoidů se ukázala být látka A, protože bylo dosaženo vyrovnanějších výsledků (zvýšené tvorby isoflavonoidů) v průřezu jednotlivých odběrových časů i koncentrací. Naprostého maxima produkce genistinu (57 násobného) však bylo dosaženo 12hodinovým působením látky B v koncentraci cB1 oproti kontrole.
Bylo sledováno i vylučování isoflavonoidů do živného média. V žádném z testovaných vzorků nebyla prokázána detekovatelná hladina isoflavonoidů.
Látky typu pyrazin-2-karboxamidů byly jako potenciální elicitory popsány i Doležalem a kol. 6) u kalusové kultury Ononis arvensis. Testováno bylo celkem pět látek typu substituovaných pyrazin–2–karboxamidů. Nejvyššího zvýšení produkce flavonoidů bylo dosaženo aplikací 6-chlor-N-(3-jod-4-methylfenyl)pyrazin-2-karboxamidu. Po 12hodinovém působení na tkáňovou kulturu Ononis arvensis bylo dosaženo navýšení produkce flavonoidů v tkáňové kultuře o 900 %. Vysoký obsah flavonoidů byl zjištěn i po 48 a 72hodinovém působení stejné látky. I u ostatních testovaných látek byl obsah navýšen, i když ne tak výrazně.
Zvýšená produkce flavonoidů v kalusové kultuře Ononis arvensis a flavolignanů v kalusové kultuře Silybum marianum po elicitaci látkami typu substituovaných amidů pyrazinkarboxylových kyselin testovala i Tůmová a kol. 18). Jako elicitory byly testovány N-(3-jod-4-methylfenyl)pyrazin-2-karboxamid a 5-terc-butyl-N-(3-jod-4-methylfenyl)pyrazin-2-karboxamid. U kultury Ononis arvensis byla testována pouze první z uvedených látek a produkci flavonoidů zvyšovala jen minimálně nebo vůbec. Nejvyšší produkce flavonoidů bylo dosaženo po 168hodinové elicitaci u této kultury, a to o 88 %. Při elicitaci kalusové kultury Silybum marianum oběma látkami byl zaznamenán jen nižší nárůst produkce flavolignanů. Za použití N-(3-jod-4-methylfenyl)pyrazin-2-karbo - xamidu se nejvyšší tvorby silychristinu podařilo dosáhnout po 6hodinové elicitaci, kdy jeho obsah byl dvojnásobný oproti kontrole. Šestihodinovou elicitací 5 terc--butyl-N-(3-jod-4-methylfenyl)pyrazin-2-karboxamidem bylo dosaženo jedenáctinásobného navýšení obsahu silychristinu oproti kontrole, což bylo celkově nejvyšší navýšení. Zvýšená tvorba flavolignanů byla zjištěna i při elicitaci kalusové a suspenzní kultury Silybum marianum látkami typu terc-butyl-N-(3-methylfenyl)pyrazin-2-karboxamidu a 5-terc-butyl-6-chlor-N--(5-brom-2-hydroxyfenyl)pyrazin-2-karboxamidu 8). Maximální produkce flavolignanů se podařilo dosáhnout 72hodinovou elicitací suspenzní kultury 5-terc-butyl-N--(3-methylfenyl)pyrazin-2-karboxamidem o koncentraci 3,71 . 10-7 mol . l-1, přičemž bylo dosaženo navýšení produkce o 893 % oproti kontrolnímu vzorku. Po 24hodinové elicitaci kalusové kultury 5-terc-butyl-6-chlor-N-(5--brom-2-hydroxyfenyl)pyrazin-2-karboxamidem o koncentraci 2,59. 10-4 mol . l-1 byl dokonce zaznamenán nárůst produkce flavolignanů o 1039 %. Z dostupné literatury vyplývá, že se jako elicitory velmi dobře uplatňují zvláště jodované deriváty pyrazin-2-karboxamidů. Potvrzuje to ve své práci i Doležal a kol. 6). Ačkoliv elicitací tkáňové kultury Ononis arvensis nebylo dosaženo aplikací jodovaných pyrazin-2-karboxamidů výrazného navýšení produkce flavonoidů (pouze o 88 %), u tkáňové kultury Silybum marianum se podařilo aplikací těchto látek dosáhnout značného navýšení produkce sekundárních metabolitů18). Z tohoto hlediska se zdá být potenciál těchto jod-derivátů velmi nadějný.
Práce byla vypracována za finanční podpory Výzkumného záměru MSM 0021620822.
Adresa pro korespondenci:
doc. PharmDr. Lenka Tůmová, CSc.
Katedra farmakognozie FaF
Heyrovského 1203, 500 05 Hradec Králové
e-mail: tumova@faf.cuni.cz
Sources
1. Sikyta, B., Dušek J.: Biotechnologie pro farmaceuty. 2. vyd. Praha: Karolinum, 2001; 75–84.
2. Kašparová, M., Siatka, T., Dušek, J.: Vliv kyseliny jasmonové na produkci anthracenových derivátů v kultuře Rheum palmatum L. in vitro. Čes. slov. Farm., 2003; 52 (3), 148–151.
3. Kašparová, M., Siatka, T.: Vliv chitosanu na produkci anthracenových derivátů v tkáňové kultuře Rheum palmatum L. Čes. slov. Farm., 2001; 50, 249–253.
4. Tůmová, L., Blažková, R.: Vliv tvorby flavonoidů v kuluře Ononis arvensis L. in vitro působením CrCl3. Čes. slov. Farm., 2002; 51, 44-46.
5. Doležal, M.: Biologicky aktivní pyraziny přírodního a syntetického původu. Chem. listy 2006; 100, 959–966.
6. Doležal, M., Tůmová, L., Kešetovičová, D., Tůma, J., Kráľová, K.: Substituted N-Phenylpyrazine-2-carboxamides. Their Synthesis and Evaluation as Herbicides and Abiotic Elicitors. Molecules, 2007; 12, 2589–2598.
7. Doležal, M., Čmedlová, P., Palek, L., Vinšová, J., Kuneš, J., Buchta, V., Jampílek, J., Kráľová, K.: Synthesis and antimycobacterial evaluation of substituted pyrazincarboxamides. Eur. J. Med. Chem., 2008; 45, 1105–1113.
8. Tůmová, L., Gallová, K., Řimáková, J., Doležal, M., Tůma, J.: The effect of substituted amides of pyrazine-2-carboxylic acids on flavonolignan production in Silybum marianum culture in vitro. Acta Physiol. Plant., 2005; 27, 357–362.
9. Łuczkiewicz, M., Piotrowski, A.: Two-Stage system for Microprapagation of Several Genista Plants Producing Large Amounts of Phytoestrogens. Z. Naturforsch. 2005; 60c, 557–566.
10. Hubík, J., Dušek, J., Spilková, J., Šícha, J.: Obecná farmakognosie II. Praha: SNP 1989, 175.
11. Łuczkiewicz, M., Głód, D.: Morphogenesis-dependent accumulation of phytoestrogenes in Genista tinctoria in vitro cultures. Plant Sci., 2005; 168, 967–979.
12. Łuczkiewicz, M., Głód, D.: Callus cultures of Genista plants-in vitro material producing high amounts of isoflavones of phytoestrogenic activity. Plant Sci., 2003; 165, 1101–1108.
13. Ososki, A. L., Kennelly, E. J.: Phytoestrogens: a Review of the Present State of Research. Phytother. Res., 2003; 17, 845–869.
14. Button, B. J., Patel, N.: Phytoestrogens for Osteoporosis. Clinic. Rev. in Bone and Mineral Metabolism, 2004; 2, 341–356.
15. Schenk, R. U., Hildebrandt, A. C.: Medium and techniques for induction of growth of monocotyledonous and dicotyledonous plant cell cultures. Canad. J. Bot., 1972; 50, 199–204.
16. Kašparová, M., Siatka T.: Produkce anthracenových derivátů elicitovanou tkáňovou kulturou Rheum palmatum L. Čes. slov. Farm., 1999; 48, 256–261.
17. Kašparová, M., Dušek, J.: Vliv biotické elicitace na produkci anthraglykosidů tkáňovou kulturou Rheum palmatum L. Čes. slov. Farm., 1999; 48, 132–135.
18. Tůmová, L., Tůma, J., Doležal, M., Megušar, K.: Substituted pyrazinecarboxamides as abiotie elicitors of the flavonolignan production in Silybum marianum culture in vitro. Molecules, 2010; 15, 331–340.
19. deRijke, E., Joshi, H. C., Sanderse, H. R., Ariese, F., Brinkman, U. A. Th., Gooijer, C.: Natively fluorescent isoflavones exhibiting anomalous Stokes’shifts. Anal. Chim. Acta, 2002; 468, 3–11.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2010 Issue 3-
All articles in this issue
- Analytické metody pro stanovení vybraných psychofarmak
- Deriváty pyrazinkarboxylové kyseliny jako účinné abiotické elicitory produkce isoflavonoidů
- Vplyv druhu polyméru na liberáciu chlórhexidínu z hydrogélu
- Porovnanie retardačného účinku prírodných matricovotvorných polymérov so syntetickými polymérmi Kollicoatom SR a Eudragitom NE
- Vliv chloridu hlinitého na buněčný růst a produkci kumarinů v suspenzní kultuře Angelica archangelica L.
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Analytické metody pro stanovení vybraných psychofarmak
- Porovnanie retardačného účinku prírodných matricovotvorných polymérov so syntetickými polymérmi Kollicoatom SR a Eudragitom NE
- Vplyv druhu polyméru na liberáciu chlórhexidínu z hydrogélu
- Deriváty pyrazinkarboxylové kyseliny jako účinné abiotické elicitory produkce isoflavonoidů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career