-
Medical journals
- Career
Perspektivy buněčné terapie v oftalmologii
1. Využití kmenových buněk v regeneraci poškozeného povrchu oka
Authors: E. Javorková; V. Holáň
Authors‘ workplace: Ústav experimentální medicíny AV ČR, v. v. i., Oddělení transplantační imunologie, vedoucí oddělení prof. RNDr. Vladimír Holáň, DrSc.
Published in: Čes. a slov. Oftal., 72, 2016, No. 1, p. 268-271
Category: Original Article
Overview
Přirozenou obnovu rohovkového epitelu zajišťuje populace limbálních kmenových buněk (LSC), které se nacházejí v bazální části limbálního epitelu. Pokud je zdroj LSC poškozen nebo nefunkční, dochází k deficitu LSC a k chronickým zánětům, zjizvení a konjunktivizaci rohovky. Terapie může spočívat v transplantaci limbální tkáně, laboratorně kultivovaných limbálních epitelů či nově i v transplantaci vhodných autologních buněk včetně mezenchymálních kmenových buněk, buněk epitelu orální sliznice nebo kmenových buněk vlasového folikulu. Velkého pokroku bylo dosaženo nejen v oblasti výzkumu vhodných buněčných typů, ale i ve vývoji vyhovujících nosičů pro přenos a růst buněk na poškozenou rohovku.
Klíčová slova:
poškození povrchu oka, kmenové buňky, buněčná terapieÚVOD
Zrak je naším nejdůležitějším smyslovým orgánem, jehož prostřednictvím získáváme přibližně 4/5 všech informací o svém okolí. Povrch oka je chráněn rohovkou, která zprostředkovává přenos světelných paprsků na sítnici. Snížení průhlednosti rohovky v důsledku poškození nebo onemocnění může vést ke zhoršení zraku a v krajních případech až k úplné slepotě. Regenerace rohovky a obnova rohovkového epitelu proto byly a jsou předmětem intenzivního studia, v němž jsou hledány především terapeutické postupy, které by nabízely alternativu k transplantaci rohovky nebo limbálních štěpů. Takovou alternativu může představovat obnova rohovkového epitelu pomocí transplantace různých typů kmenových buněk. Ty mohou být často získány přímo od postiženého pacienta jako autologní buňky, čímž odpadají komplikace spojené s použitím alogenního materiálu, kdy je současně nutno aplikovat imunosupresivní léčbu spojenou s častými nežádoucími vedlejšími účinky.
Kmenové buňky
Kmenové buňky představují populaci nediferencovaných buněk, mezi jejichž vlastnosti patří pomalý buněčný cyklus, vysoká proliferační schopnost následkem aktivace, schopnost neomezeného buněčného dělení a zároveň schopnost dávat vznik alespoň jednomu typu vysoce specializovaných dceřiných buněk. Mezi kmenovými buňkami a terminálně diferencovanými buňkami obvykle existují i mezistupně, přičemž tyto buňky již mohou proliferovat a diferencovat pouze v omezené míře (22).
Kmenové buňky lze rozdělit na embryonální kmenové buňky a kmenové buňky z dospělého organizmu. Samostatné kategorie pak tvoří kmenové buňky z pupečníkové krve novorozence a indukované pluripotentní kmenové buňky, které jsou připravovány experimentálně vnesením sady specifických genů do somatických buněk.
Limbální kmenové buňky a obnova rohovkového epitelu
Rohovka je jako povrchová struktura oka neustále vystavována různým vlivům vnějšího prostředí včetně vysychání, infekcí a rizika poškození mechanického či chemického charakteru.
Neustálou obnovu rohovkového epitelu zajišťuje populace limbálních kmenových buněk (LSC) sídlících v bazální vrstvě limbálního epitelu ve struktuře zvané Vogtovy palisády. Tato struktura poskytuje LSC unikátní mikroprostředí zajišťující jejich ochranu před nežádoucími vlivy prostředí, škodlivým UV zářením a přítomné cévní zásobení zároveň přináší potřebné živiny a podpůrné faktory. LSC se vyznačují pomalým buněčným cyklem a vysokou proliferační schopností, již lze vyvolat jako reakci na poškození rohovky. Jelikož nebyl doposud nalezen jedinečný znak, který by byl exprimován pouze populací LSC, využívá se nejčastěji k jejich charakterizaci kombinace znaků asociovaných s kmenovými buňkami jako je transkripční faktor p63, receptorový protein Lgr5 a membránový transportér ABCG2 (ATP-binding cassette transporter group 2 protein). Současně musí být vyloučeny buňky nesoucí diferenciační znaky asociované s rohovkovým epitelem, mezi něž patří keratiny 3 a 12 (4). Některých znaků charakteristických pro populaci LSC, jako je malá velikost a přítomnost transportéru ABCG2, se využívá při jejich izolaci pomocí centrifugace na hustotním gradientu nebo na základě efluxu fluorescenční barvy Hoechst 33342 (14).
LSC tedy zajišťují přirozenou obnovu rohovkového epitelu a kompenzují tak drobná poškození rohovky v důsledku jejího každodenního vystavení vlivům vnějšího prostředí. Problém však nastává v okamžiku, kdy dojde k rozsáhlejšímu poškození povrchu oka zasahujícímu i limbální oblast, což může v některých případech vést až k deficitu LSC, a tudíž zásadnímu narušení procesu obnovy rohovkového epitelu.
Deficit LSC a jeho léčba
Deficit LSC může mít celou řadu příčin, které lze rozdělit do dvou základních skupin, a to na primární a získané. Do první skupiny patří například aniridie a vícenásobný endokrinní deficit. Získaná onemocnění jsou více častá a zahrnují například oční pemphigoid, Stevens-Johnsonův syndrom nebo opakované oční operace. Dalšími příčinami pak mohou být i mikrobiální infekce, chronické alergie nebo poleptání rohovky v důsledku neopatrné manipulaci s žíravými látkami či rozsáhlejší mechanická poškození.
Důležitými kritérii pro možnosti léčby a případnou prognózu je pak především to, zda je poškození či onemocnění oka jednostranné či oboustranné a dále zda je deficit LSC částečný nebo úplný. Deficit LSC pak vede k narušení sebeobnovy rohovky, chronickým zánětům a nakonec k jejímu zjizvení a konjunktivizaci.
Jednou z možností při léčbě celkového jednostranného deficitu LSC je transplantace části limbální tkáně ze zdravého oka pacienta. Nevýhodou tohoto přístupu je riziko získaného deficitu LSC v původně zdravém dárcovském oku jako následek odběru limbálního transplantátu. První rozsáhlejší studií využívající tento přístup byla roku 1989 práce Kenyon a kol., v níž bylo léčeno 26 pacientů trpících deficitem LSC způsobeným především chemickým nebo tepelným poškozením. Léčba zahrnovala přenos 2 kusů limbální tkáně z nepoškozeného nebo alespoň méně poškozeného oka pacienta. Pacienti byli sledováni déle než rok a půl a u více než poloviny došlo ke zlepšení zraku, rychlejšímu hojení, absenci epiteliálních defektů, k zastavení nebo dokonce ústupu neovaskularizace rohovky a cytologie potvrdila obnovení rohovkového epiteliálního fenotypu (13).
Alternativu k transplantaci celé limbální tkáně představuje transplantace laboratorně kultivovaných limbálních buněk připravených z velmi malé limbální biopsie. První studií využívající tento přístup byla práce Pellegrini a kol. z roku 1997, sledující u dvou pacientů s poleptaným povrchem oka možnost obnovy poškozené rohovky pomocí autologní epiteliální vrstvy získané sériovou kultivací limbálních buněk z malé limbální biopsie o velikosti 1 mm2 ze zdravého oka. Po transplantaci utvořily limbální buňky u obou pacientů kompaktní vrstvu rohovkového epitelu a došlo k stabilní obnově rohovkového epitelu přetrvávající i 2 roky po transplantaci (17).
Celosvětově bylo od roku 1997 provedeno již více než 1000 transplantací kultivovaných limbálních epitelů. Hlavním kritériem při hodnocení úspěšnosti léčby je přítomnost stabilního povrchu bez rohovkové vaskularizace a konjunktivizace. Souhrnná analýza 18 prací, v rámci nichž bylo léčeno bezmála 600 pacientů, ukázala, že transplantace epitelu kultivovaného z limbální biopsie na amniové membráně je účinným způsobem léčby u pacientů s deficitem LSC. V přibližně 60 % případů došlo ke zlepšení vidění, přičemž úspěšnost léčby nezávisela na tom, zda se jednalo o tkáň autologní či alogenní. Při hodnocení bezpečnosti léčby bylo zjištěno, že většina vedlejších účinků této terapie byla pouze přechodná (24).
Kultivace a přenos LSC pro terapii deficitu LSC
Při získávání a kultivaci LSC se využívá dvou hlavních strategií. Prvním přístupem je explantátová technika, při níž je kultivována celá limbální biopsie. Při druhé jsou jednotlivé LSC vyizolovány z limbální tkáně pomocí enzymatické digesce. Kultivace takto získaných buněk však obvykle vyžaduje použití živných vrstev, jako jsou inaktivované fibroblasty. Pro podporu expanze a udržení LSC v kultuře se také často využívá amniová membrána, která následně slouží i jako nosič kmenových buněk při transplantaci na povrch oka.
Amniová membrána je od počátku 20. století používána při léčbě popálenin kůže. V oftalmologii je již dlouhou dobu využívána při léčbě spojivkových defektů a v 90. letech došlo k rozšíření jejího použití i na oblast rohovky. Hlavními důvody jsou její protizánětlivé a antimikrobiální účinky spolu s nízkou imunogenitou. Amniová membrána má schopnost redukovat zánětlivou odpověď a zjizvení povrchu oka po jeho poškození, zároveň podporuje reepitelizaci díky přítomnosti růstových faktorů a svým antimikrobiálním vlastnostem (6).
V posledních letech byla ve snaze usnadnit přenos LSC při léčbě očních defektů vyvinuta řada nových biokompatibilních materiálů včetně fibrinového gelu (16), kolagenových nosičů (3), hydrogelů tvořených směsí chitosanu s kolagenem nebo elastinem (8), průhledné vrstvy vlasového keratinu (5), různých forem kontaktních čoček nesoucích kmenové buňky (1) nebo různých typů nanovlákenných nosičů (23, 9, 2) připravených nejčastěji z přírodních polymerů, jako je chitosan a kolagen, nebo ze syntetických polymerů, jako je polyamid nebo polyvinylalkohol.
Další typy buněk využívané při léčbě deficitu LSC
Alternativu k transplantaci autologních LSC, kterou nelze použít například u oboustranného deficitu LSC, představují terapeutické přístupy využívající jiné typy kmenových buněk. Ty mohou být získány přímo z organismu pacienta, namnoženy v tkáňových kulturách a použity jako autologní buňky pro regeneraci poškozené rohovky. Povzbudivých výsledků bylo dosaženo zejména při použití mezenchymálních kmenových buněk (MSC), buněk epitelu orální sliznice nebo kmenových buněk vlasového folikulu. V souvislosti s regenerací a reparací rohovkového epitelu jsou v současnosti nejintenzivněji studovány právě MSC. Některé terapeutické přístupy pro léčbu deficitu LSC jsou ukázány na obr. 1.
Image 1. Možné terapeutické přístupy při léčbě deficitu LSC. Při léčbě deficitu LSC mohou být transplantovány části limbální tkáně nebo laboratorně kultivované LSC, MSC či orální slizniční vrstva 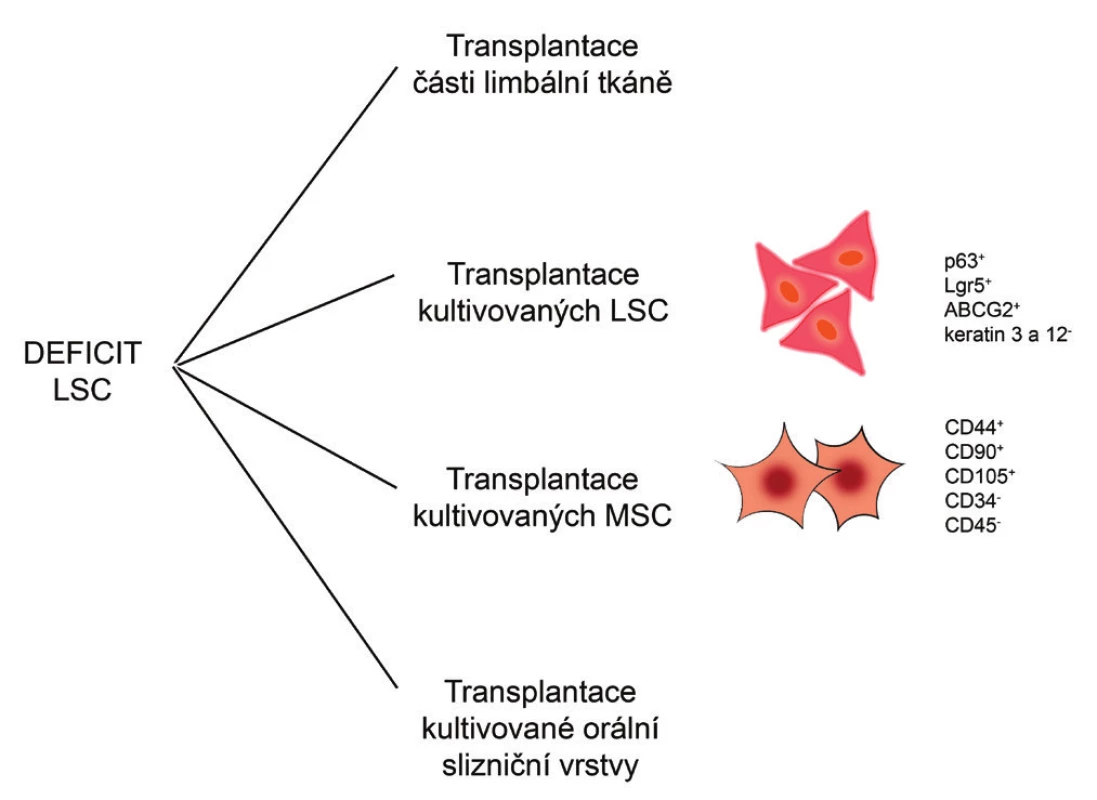
Mezenchymální kmenové buňky
MSC jsou používány především pro svou poměrně snadnou dostupnost, možnost jejich namnožení v tkáňových kulturách, schopnost diferenciace v epiteliální buňky a pro jejich imunomodulační vlastnosti umožňující potlačení nežádoucí zánětlivé imunitní odpovědi v poškozené rohovce (9, 2).
MSC byly poprvé popsány roku 1966 v práci Friedenstein a kol., ukazující přítomnost buněk s osteogenním potenciálem v suspenzi získané z kostní dřeně. Od té doby byla přítomnost MSC prokázána v celé řadě orgánů a tkání, ale mezi nejčastěji používané zdroje těchto buněk stále patří kostní dřeň a v posledních letech i tuková tkáň a pupečníková krev. Během kultivace in vitro se MSC vyznačují vřetenovitým tvarem a adherencí k podkladu. Stejně jako u LSC, ani pro MSC nebyl doposud nalezen znak, který by byl unikátní pouze pro tuto populaci. Mohou však být charakterizovány kombinací exprese pozitivních znaků mezi než patří molekuly CD44, CD90 a CD105, a naopak nepřítomností leukocytárních znaků CD34 nebo CD45. Zároveň by buňky nesoucí tyto znaky měly být schopné diferencovat v adipocyty, osteocyty a chondrocyty. Diferenciační potenciál MSC je však ve skutečnosti mnohem rozsáhlejší a zahrnuje schopnost diferencovat v buňky tvořící mezodermální tkáně a rovněž transdiferencovat v buňky tvořící entodermální a ektodermální tkaně. MSC navíc disponují rozsáhlými imunomodulačními vlastnostmi ovlivňujícími přirozenou i adaptivní složku imunitního sytému (21, 20).
Ma a kol. jako první ukázali, že lidské MSC transplantované pomocí amniové membrány na poškozenou rohovku laboratorního potkana mohou podporovat hojení a obnovu rohovkového epitelu. Terapeutický účinek byl spojen především s potlačením zánětu a angiogeneze (15). V jiné práci byly u potkanů použity MSC, které po inkubaci s rohovkovými stromálními buňkami exprimovaly keratin 12, což je znak buněk rohovkového epitelu. Tyto buňky byly pomocí amniové membrány přeneseny na poškozenou rohovku, kde již 4 týdny po aplikaci snižovaly její neprůhlednost a neovaskularizaci (12).
Podle výsledků naší skupiny jsou intravenózně podané MSC schopny specificky migrovat do poškozené rohovky a přispívat zde po jejím poleptání hydroxidem sodným k potlačení časné fáze rohovkového zánětu. V poškozené rohovce bylo v porovnání se zdravým okem nalezeno 30krát vyšší množství fluorescenčně značených MSC a zároveň zde došlo ke snížení infiltrace rohovky leukocyty a k potlačení produkce prozánětlivých cytokinů včetně IL-1 a IL-6 (11). V další práci jsme prokázali, že MSC mají srovnatelný terapeutický potenciál jako LSC a po přenosu na poškozený oční povrch podporují regeneraci rohovkového epitelu a potlačují lokální zánětlivou reakci v místě poškození (10).
V současné době jsou na webových stránkách www.clinicaltrials.gov evidovány dvě klinické studie využívající MSC k léčbě poškozené rohovky. Jedna z nich probíhá ve Španělsku a je v rámci ní léčeno 27 pacientů trpících deficitem LSC. Jedná se o klinickou studii fáze 1 a 2, jejímž hlavním cílem je určit, zda je transplantace alogenních MSC bezpečná a účinná při léčbě deficitu LSC v porovnání s léčbou pomocí alogenních LSC.
Druhá studie bude probíhat v Číně a odhadovaný počet léčených pacientů s chemicky poškozenou rohovkou by se měl pohybovat okolo 100. Bude se jednat o klinickou studii fáze 2 zaměřenou na bezpečnost a účinnost léčby prostřednictvím opakovaných dávek MSC injekčně podaných pod spojivku.
Orální slizniční epiteliální buňky
Dalším buněčným typem testovaným pro rekonstrukci poškozeného rohovkového epitelu jsou epiteliální buňky orální sliznice, které by mohly být vhodné, protože vykazují strukturní podobnosti k jiným vrstevnatým epitelům.
První studií používající tyto buňky byla práce Gipson a kol. z roku 1986, ve které byla na králičím modelu poškozeného povrchu oka testována léčba pomocí orální epiteliální vrstvy. Bylo zjištěno, že ještě 4 měsíce po transplantaci bylo oko bez známek zánětlivé odpovědi (7).
Velmi zajímavé jsou výsledky dvou studií, v nichž bylo pomocí transplantace kultivované orální slizniční vrstvy na amniové membráně léčeno celkem 49 pacientů trpících deficitem LSC v důsledku Stevens-Johnsonova syndromu, očního pemphigoidu nebo poleptání oka. Zlepšení ostrosti vidění nastalo po půl roce po léčbě především u pacientů trpících Stevens-Johnsonovým syndromem, v případě pemphigoidu bylo zlepšení pouze měsíc po operaci. U všech pacientů došlo ke snížení výskytu abnormalit na povrchu oka a celkově došlo k dlouhodobému zlepšení ostrosti vidění u poloviny pacientů (18, 19).
Závěr
V posledních dvou desetiletích došlo ke značnému vývoji v terapeutickém přístupu při léčbě deficitu LSC. V některých případech se již uskutečnily klinické studie přinášející povzbudivé výsledky. Tyto studie jsou v současnosti zaměřeny především na využití kultivovaných LSC a nověji i různých typů MSC, které mohou nahradit při jejich deficienci LSC.
Práce byla podpořena projektem NPU LO1309 z Ministerstva školství, mládeže a tělovýchovy České republiky.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
Mgr. Eliška Javorková, Ph.D.
Ústav experimentální medicíny AV ČR, v.v.i.
– Oddělení transplantační imunologie
Vídeňská 1083
142 20 Praha 4
e-mail: javorkova@biomed.cas.cz
Do redakce došlo dne 19. 10. 2015
Do tisku přijato dne 22. 1. 2016
Sources
1. Brown, K.D., Low, S., Mariappan, I. et al.: Plasma polymer-coated contact lenses for the culture and transfer of corneal epithelial cells in the treatment of limbal stem cell deficiency. Tissue Eng, 20; 2014 : 646–655.
2. Cejkova, J., Trosan, P., Cejka, C. et al.: Suppression of alkali-induced oxidative injury in the cornea by mesenchymal stem cells growing on nanofiber scaffolds and transferred onto the damaged corneal surface. Exp Eye Res, 116; 2013 : 312–323.
3. Dravida, S., Gaddipati, S., Griffith, M. et al.: A biomimetic scaffold for culturing limbal stem cells: a promising alternative for clinical transplantation. J Tissue Eng Regen Med, 2; 2008 : 263–271.
4. Echevarria, T.J., Di Girolamo, N.: Tissue-regenerating, vision-restoring corneal epithelial stem cells. Stem Cell Rev, 7; 2011 : 256–268.
5. Feng, Y., Borrelli, M., Meyer-Ter-Vehn, T. et al.: Epithelial wound healing on keratin film, amniotic membrane and polystyrene in vitro. Curr Eye Res, 39; 2014 : 561–570.
6. Fernandes, M., Sridhar, M.S., Sangwan, V.S. et al.: Amniotic membrane transplantation for ocular surface reconstruction. Cornea, 24; 2005 : 643–653.
7. Gipson, I.K., Geggel, H.S., Spurr-Michaud, S.J.: Transplant of oral mucosal epithelium to rabbit ocular surface wounds in vivo. Arch Ophthalmol, 104; 1986 : 1529–1533.
8. Grolik, M., Szczubiałka, K., Wowra, B. et al.: Hydrogel membranes based on genipin-cross-linked chitosan blends for corneal epithelium tissue engineering. J Mater Sci Mater Med, 23; 2012 : 1991–2000.
9. Holan, V., Javorkova, E.: Mesenchymal stem cells, nanofiber scaffolds and ocular surface reconstruction. Stem Cell Rev, 9; 2013 : 609–619.
10. Holan, V., Trosan, P., Cejka, C. et al.: A comparative study of the therapeutic potential of mesenchymal stem cells and limbal epithelial stem cells for ocular surface reconstruction. Stem Cells Transl Med, 4; 2015 : 1052–1063.
11. Javorkova, E., Trosan, P., Zajicova, A. et al.: Modulation of the early inflammatory microenvironment in the alkali-burned eye by systemically administered interferon-γ-treated mesenchymal stromal cells. Stem Cells Dev, 23; 2014 : 2490–2500.
12. Jiang, T.S., Cai, L., Ji, W.Y. et al.: Reconstruction of the corneal epithelium with induced marrow mesenchymal stem cells in rats. Mol Vis, 16; 2010 : 1304–1316.
13. Kenyon, K.R., Tseng, S.C.: Limbal autograft transplantation for ocular surface disorders. Ophthalmology, 96; 1989 : 709–722.
14. Krulova, M., Pokorna, K., Lencova, A. et al.: A rapid separation of two distinct populations of mouse corneal epithelial cells with limbal stem cell characteristics by centrifugation on percoll gradient. Invest Ophthalmol Vis Sci, 49; 2008 : 3903–3908.
15. Ma, Y., Xu, Y., Xiao, Z. et al.: Reconstruction of chemically burned rat corneal surface by bone marrow-derived human mesenchymal stem cells. Stem Cells, 24; 2006 : 315–321.
16. Marchini, G., Pedrotti, E., Pedrotti, M. et al.: Long-term effectiveness of autologous cultured limbal stem cell grafts in patients with limbal stem cell deficiency due to chemical burns. Clin Experiment Ophthalmol, 40; 2012 : 255–267.
17. Pellegrini, G., Traverso, C.E., Franzi, A.T. et al.: Long-term restoration of damaged corneal surfaces with autologous cultivated corneal epithelium. Lancet, 349; 1997 : 990–993.
18. Sotozono, C., Inatomi, T., Nakamura, T. et al.: Visual improvement after cultivated oral mucosal epithelial transplantation. Ophthalmology, 120; 2013 : 193–200.
19. Sotozono, C., Inatomi, T., Nakamura, T. et al.: Cultivated oral mucosal epithelial transplantation for persistent epithelial defect in severe ocular surface diseases with acute inflammatory activity. Acta Ophthalmol, 92; 2014 : 447–453.
20. Svobodova, E., Krulova, M., Zajicova, A. et al.: The role of mouse mesenchymal stem cells in differentiation of naive T-cells into anti-inflammatory regulatory T-cell or proinflammatory helper T-cell 17 population. Stem Cells Dev, 21; 2012 : 901–910.
21. Uccelli, A., Moretta, L., Pistoia, V.: Mesenchymal stem cells in health and disease. Nat Rev Immunol, 8; 2008 : 726–736.
22. Watt, F.M., Hogan, B.L.: Out of Eden: stem cells and their niches. Science, 287; 2000 : 1427–1430.
23. Zajicova, A., Pokorna, K., Lencova, A. et al.: Treatment of ocular surface injuries by limbal and mesenchymal stem cells growing on nanofiber scaffolds. Cell Transplant, 19; 2010 : 1281–1290.
24. Zhao, Y., Ma, L.: Systematic review and meta-analysis on transplantation of ex vivo cultivated limbal epithelial stem cell on amniotic membrane in limbal stem cell deficiency. Cornea, 34; 2015 : 592–600.
Labels
Maxillofacial surgery Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2016 Issue 1-
All articles in this issue
-
Perspektivy buněčné terapie v oftalmologii
1. Využití kmenových buněk v regeneraci poškozeného povrchu oka -
Perspektivy buněčné terapie v oftalmologii
2. Potenciál kmenových buněk pro léčbu onemocnění sítnice - Klinické projevy experimentální autoimunitní uveitidy
- Oční jizevnatý pemfigoid – retrospektivní studie
- Klinické zkoušky testující nové terapie pro Stargardtovu chorobu
- Drúzy papily zrakového nervu a jejich komplikace
- Bilaterální makulární edém na podkladě drúzových papil
-
Perspektivy buněčné terapie v oftalmologii
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Drúzy papily zrakového nervu a jejich komplikace
- Klinické zkoušky testující nové terapie pro Stargardtovu chorobu
- Bilaterální makulární edém na podkladě drúzových papil
- Oční jizevnatý pemfigoid – retrospektivní studie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


