-
Medical journals
- Career
Medikamentózní léčba glaukomu a biomechanické vlastnosti rohovky
: I. Liehneová; S. Karlovská
: Oční oddělení KZ a. s., Masarykova nemocnice v Ústí nad Labem primářka MUDr. Ivana Liehneová
: Čes. a slov. Oftal., 70, 2014, No. 5, p. 167-176
: Original Article
Cíl:
Zhodnotit vliv dlouhodobé farmakoterapie glaukomu na biomechanické vlastnosti rohovky.Metodika a materiál:
Do prospektivní kohortní studie bylo zahrnuto 305 očí 154 pacientů. Jednalo se o pacienty s nově diagnostikovaným primárním glaukomem otevřeného úhlu (PGOÚ, n = 68) nebo oční hypertenzí (OH, n = 6). Kontrolní skupina zahrnovala 80 očí 40 pacientů s ční hypertenzí bez léčby a 80 zdravých očí 40 jedinců.
Sledovanými parametry byly: hodnota nitroočního tlaku (IOPg, IOPcc), hystereze (CH), faktor rohovkové rezistence (CRF) a centrální tloušťka rohovky (CCT), a to před nasazením léčby a v intervalech 3, 6, 9 a 12 měsíců po nasazení léčby. Stejné periody měření byly použity i u kontrolní skupiny. Pacienti s PGOÚ a OH byli léčeni analogy prostaglandinů a inhibitory karboanhydrázy samostatně nebo fixní kombinací s betablokátory. Kontrolní skupina zahrnovala 80 očí 40 pacientů s oční hypertenzí bez léčby a 80 zdravých očí 40 jedinců.Výsledky:
U hystereze nebyly před zahájením léčby prokázány významné rozdíly mezi skupinou pacientů s nově diagnostikovaným glaukomem a skupinou kontrolních očí (p = 0,238).
U kontrolní neléčené skupiny pacientů s oční hypertenzí byla prokázána statisticky významně vyšší hodnota CRF (p = 0,032) a CCT (p = 0,013) oproti ostatním skupinám. Tento výsledek potvrzuje větší zastoupení pacientů, kteří měli pevné rohovky s nadprůměrnou tloušťkou. Ve sledovacím období byl zjištěn statisticky významný rozdíl CH a CRF (p < 0,0001) ve skupině očí léčených analogy prostaglandinů, kde došlo i k poklesu CCT (p < 0,001). V ostatních měřených parametrech nebyl nalezen statisticky signifikantní rozdíl.Závěr:
Vzestup hodnot CH a CRF může svědčit pro změnu biomechanických vlastností rohovky po dlouhodobé léčbě analogy prostaglandinů. Inhibitory karboanhydrázy biomechanické vlastnosti rohovky neovlivnily. Budou nutné další studie k potvrzení vlivu dlouhodobého podávání analog prostaglandinů na přesnost měření nitroočního tlaku.Klíčová slova:
glaukom, nitrooční tlak, rohovka, biomechanické vlastnosti, hysterese, centrální tloušťka rohovkyÚvod
Biomechanické vlastnosti rohovky – elasticita a viskozita ovlivňují fyziologickou i patofyziologickou funkci rohovky. Určují, jak bude rohovková tkáň reagovat na zátěž či změnu tvaru.
Možnost měření biomechanických vlastností rohovky in vivo je stále důležitým cílem pro některé diagnostické i léčebné postupy v oftalmologii. V současné době je v klinické praxi biomechanika rohovky dostupně měřitelná přístrojem Ocular Response Analyzer (ORA). ORA je bezkontaktní tonometr, který měří nitrooční tlak (NOT) bez závislosti na centrální tloušťce rohovky. Dále poskytuje parametry, které reprezentují biomechaniku rohovky: Corneal Hysteresis (CH) a Corneal Resistance Factor (CRF).
V refrakční chirurgii lze pomocí této metody rozpoznat potencionální kandidáty, u kterých je riziko vzniku ektázie rohovky po LASIKu (1), dále pak zpřesnit diagnostiku některých onemocnění rohovky (keratokonus, Fuchsova endotelová dystrofie) (2–4).
U primárního glaukomu s otevřeným úhlem se pomýšlí i na určitou patogenetickou souvislost viskoelasticity s glaukomem. U pacientů s glaukomem je průkazné, že rohovka (5) i skléra (6,7) mají změněné biomechanické vlastnosti. Pokud se zvýší nitrooční tlak, dochází i k většímu zatížení těchto struktur. Uvažujeme-li, že naměříme tenčí a flexibilní rohovku, mohlo by to napovídat i o tenčí a flexibilní lamině cribroze. V oblasti lamina cribrosa přecházejí axony gangliových buněk z prostředí nitra oka s relativně vyšším tlakem do prostředí retrobulbárního mozkomíšního prostoru, kde je tlak nižší. Pevnost a elastičnost laminy cribrozy je důležitá pro vyrovnání tlakového gradientu a funkční podporu axonů gangliových buněk, aby nedošlo k přerušení axoplazmatického průtoku (8).
Variabilita viskoelasticity může také ovlivnit výsledky měření nitroočního tlaku.
Z hlediska hodnocení účinnosti léčby a kompenzace nitroočního tlaku u komplikovaných případů pacientů s glaukomem je získání co nejpřesnějších hodnot rovněž důležité.
Dosud ne zcela vyjasněná otázka možné spojitosti mezi změnami biomechanických vlastností rohovky v průběhu léčby různými typy antiglaukomatik nás vedla k vypracování této práce. Farmakoterapii glaukomu reprezentuje šest hlavních skupin léků, ale jen inhibitory karboanhydrázy a analoga prostaglandinů mohou potencionálně ovlivnit strukturu rohovky. Analoga prostaglandinů aktivují skupinu enzymů matrix metalloproteinázy (MMP), které jsou přítomné i v rohovkovém stromatu a mohou mít vliv na strukturu kolagenu (9, 10). Obecně jsou zodpovědné za degradaci extracelulární matrix (ECM). Inhibitory karboanhydrázy (ICA) mohou negativně ovlivnit endotelovou pumpu rohovky (11) inhibicí enzymu karboanhydrázy II, který je přítomen v rohovce a podílí se na optimální hydrataci rohovky.
Metodika
Do prospektivní kohortní studie byla zahrnuta skupina 305 očí 154 pacientů.
Pacienti s nově diagnostikovaným primárním glaukomem otevřeného úhlu (PGOÚ) a oční hypertenzí (OH) byli srovnáváni s kontrolní skupinou. Kontrolní skupina zahrnovala 80 očí 40 pacientů s oční hypertenzí bez léčby a 80 zdravých očí 40 jedinců.
Pacienti s nově diagnostikovaným glaukomem nebo oční hypertenzí byli zařazeni do studie, pokud klinický nález vyžadoval nasazení léčby ke snížení nitroočního tlaku a léčeni dosud nebyli.
Vyřazovacím kritériem pro všechny skupiny byla předchozí nitrooční operace, laserová nebo chirurgická léčba rohovky, degenerativní, dystrofická nebo zánětlivá onemocnění rohovky. Dále pak nebyli zařazeni nositelé kontaktních čoček, pacienti s torickou refrakční vadou vyšší než 2 dioptrie, pacienti, kteří si dlouhodobě aplikují oční kapky snižující nitrooční tlak, umělé slzy nebo jiné protizánětlivé léky.
Soubor tvoří tři skupiny.
První skupina A (n = 74) jsou pacienti s nově diagnostikovaným PGOÚ (n = 68) a OH (n = 6), u nichž byla nově nasazena léčba. Ve skupině A bylo 44 žen (59,5 %) a 30 mužů (40,5 %). Průměrný věk v době stanovení diagnózy byl u žen 62,2 (±10,36) let, u mužů 58,5 (±11,61) let. V této skupině byli pacienti přiřazováni do dvou podskupin A1, A2. Podskupina A1 byla léčena analogy prostaglandinů (n = 45), A2 inhibitory karboanhydrázy samostatně (n = 12) nebo fixní kombinací s betablokátory (n = 17).
Druhá skupina B (n = 40) jsou pacienti s oční hypertenzí, u nichž léčba nebyla nutná. Ve skupině B bylo 21 žen (52,5 %) a 19 mužů (47,5 %). Průměrný věk byl 54,5 (±12,5) let u žen, 53,6 (±12,4) u mužů. Třetí skupina C (n = 40) jsou zdraví jedinci bez očního onemocnění. Ve skupině C bylo 26 žen (65,8 %) a 14 mužů (34,2 %). Průměrný věk byl 57,96 (±12,15) let u žen a 52,14 (±12,61) let u mužů.Pacienti byli kontrolováni po zařazení do studie v harmonogramu návštěv 3., 6., 9. a 12. měsíc. Při vstupním vyšetření byla odebrána osobní a oční anamnéza a bylo provedeno komplexní oftalmologické vyšetření. Jednalo se o automatickou keratometrii a refraktometrii (Nidek ARK-700A), stanovení nejlépe korigované zrakové ostrosti (NKZO) do dálky (optotypová tabule ETDRS typu), stanovení subjektivní manifestní refrakce (sférické složky i astigmatismu), biomikroskopické vyšetření předního segmentu oka na štěrbinové lampě, změření nitroočního tlaku bezkontaktním tonometrem ORA, změření tloušťky rohovky ultrazvukovou pachymetrií (ORA), vyšetření úhlu přední komory (gonioskopickou čočkou Zeiss), vyšetření očního pozadí nepřímou oftalmoskopií se zhodnocením poměru C/D na terči zrakového nervu a vyšetření zorného pole (perimetr Humphrey – Zeiss).
Výsledné křivky měření nitroočního tlaku, hystereze a rohovkové rezistence přístrojem ORA byly vybírány podle skóre kvality. Vždy byly zprůměrovány hodnoty čtyř měření nejvyšší kvality. Stejně tak ultrazvuková pachymetrie byla výsledkem průměru hodnot čtyř měření. Vyšetření zorného pole se provádělo po 6 měsících u pacientů s glaukomem a oční hypertenzí, v kontrolní skupině zdravých jedinců při vstupním a výstupním vyšetření. Výsledky měření biomechanických vlastností rohovky a nitroočního tlaku byly zhodnoceny statistickou analýzou v časovém vývoji jednotlivých měřených veličin IOPg, IOPcc, CH, CRF, CCT, metodou korelační analýzy a ANOVA testem.
Výsledky
Nitrooční tlak IOPg a IOPcc před zahájením léčby a po 12 měsících sledování ve skupině A nově diagnostikovaných a léčených PGOÚ a OH, v kontrolní skupině B a C bez léčby shrnují tabulky 1 a 2.
1. Vývoj nitroočního tlaku IOPg ve skupině A1, A2, B a C. 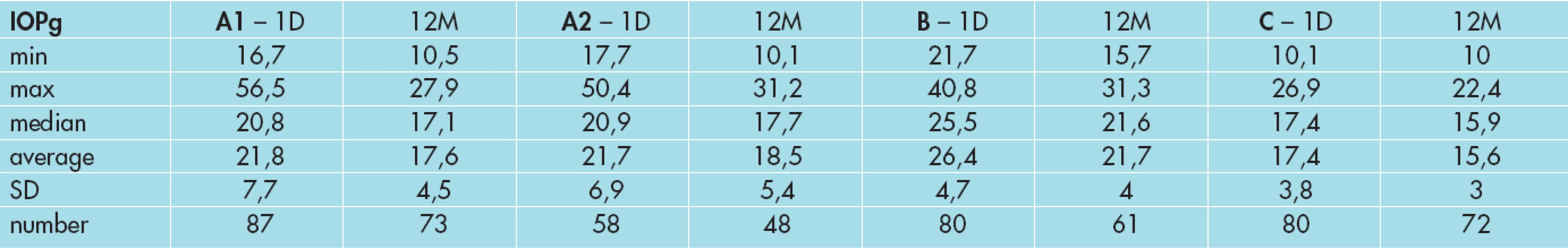
IOPg= nitrooční tlak ekvivalentní podle Goldmanna , A1= skupina PGOÚ nebo OH léčená analogy prostaglandinů, A2= skupina PGOÚ nebo OH léčená ICA nebo ICA a betablokátory, B= skupina oční hypertenze bez léčby, C= kontrolní skupina min=minimum, max=maximum, smodch=směrodatná odchylka, 1.D=1.den, 12.M=12.měsíc 2. Vývoj nitroočního tlaku IOPcc ve skupině A1, A2, B a C. 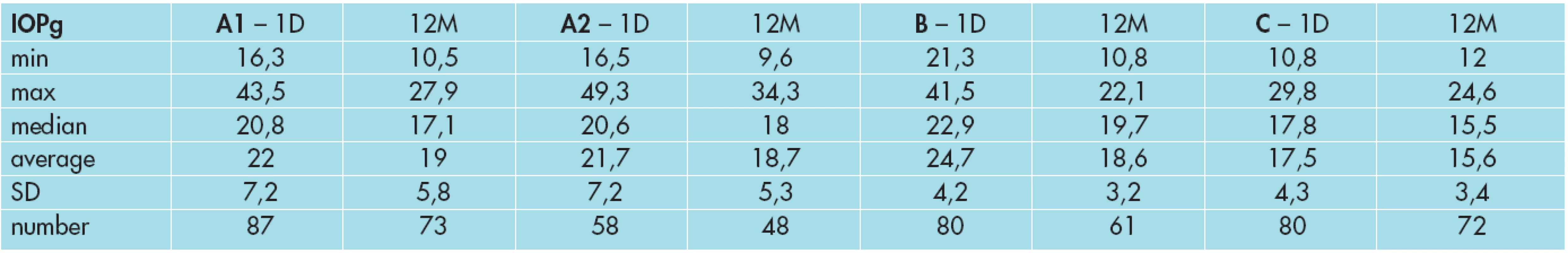
IOPcc=nitrooční tlak kompenzovaný vlastnostmi rohovky, A1= skupina PGOÚ nebo OH léčená analogy prostaglandinů, A2= skupina PGOÚ nebo OH léčená ICA nebo ICA a betablokátory, B= skupina oční hypertenze bez léčby, C= kontrolní skupina min=minimum, max=maximum, smodch=směrodatná odchylka, 1.D=1.den, 12.M=12.měsíc V podskupině A1 bylo 87 očí léčených analogy prostaglandinů, v prvním roce počet sledovaných očí poklesl na 73 (84 %). Průměrná hodnota nitroočního tlaku IOPg byla na začátku před nasazením léčby 21,8 mmHg (±7,7 mmHg) s maximální hodnotou NOT 56,5 mmHg a minimální hodnotou 16,7 mmHg. Korigovaná hodnota nitroočního tlaku IOPcc se výrazně nelišila. Průměrná hodnota IOPcc byla 22,0 mmHg (±7,2 mmHg) s maximální hodnotou NOT 43,5 mmHg a minimální hodnotou 16,3 mmHg. Průměrná hodnota nitroočního tlaku IOPg na konci sledovaného období byla 17,6 mmHg (±4,5 mm Hg) a IOPcc 19,0 mmHg (±5,8 mmHg). Nitrooční tlak IOPg poklesl o 4,2 mmHg a NOT IOPcc o 3,0 mmHg ve sledovaném období. Obě hodnoty IOPg a IOPcc vykazují klesající trend.
V podskupině A2 bylo 58 očí léčených samostatně inhibitory karboanhydrázy nebo fixní kombinací s betablokátory, v prvním roce počet sledovaných očí poklesl na 48 (83 %). Průměrná hodnota nitroočního tlaku IOPg byla na začátku před nasazením léčby 21,7 mmHg (± 6,9 mmHg) s maximální hodnotou NOT 50,4 mmHg a minimální hodnotou 17,7 mmHg. Průměrná korigovaná hodnota nitroočního tlaku IOPcc byla rovněž 21,7 mmHg (±7,2 mmHg) s maximální hodnotou NOT 49,3 mmHg a minimální hodnotou 16,5 mmHg. Průměrná hodnota nitroočního tlaku IOPg na konci sledovaného období byla 18,5 mmHg (±5,4 mmHg) a IOPcc 18,7 mmHg (±5,3 mmHg). Nitrooční tlak IOPg poklesl o 3,2 mmHg a NOT IOPcc o 3,0 mmHg ve sledovaném období. Obě hodnoty IOPg a IOPcc vykazují klesající trend.
Ve skupině B bylo 80 očí s oční hypertenzí bez léčby, počet sledovaných očí poklesl v prvním roce na 61 (76 %). Průměrná hodnota nitroočního tlaku IOPg byla na začátku sledování 26,4 mmHg (±4,7 mmHg) s maximální hodnotou NOT 40,8 mmHg a minimální hodnotou 21,7 mmHg. Průměrná korigovaná hodnota nitroočního tlaku IOPcc byla 24,7 mmHg (±4,2 mmHg) s maximální hodnotou NOT 41,5 mmHg a minimální hodnotou 21,3 mmHg. Průměrná hodnota nitroočního tlaku IOPg na konci sledovaného období byla 21,7 mmHg (±4,0 mmHg) a IOPcc 18,6 mmHg (±3,2 mmHg). Obě hodnoty IOPg a IOPcc zůstaly ve sledovaném čase nadprůměrné.
Ve skupině C bylo 80 očí bez očního onemocnění, v prvním roce poklesl počet na 72 (90 %). Průměrná hodnota nitroočního tlaku IOPg byla na začátku sledování 17,4 mmHg (±3,8 mmHg) s maximální hodnotou NOT 21,9 mmHg a minimální hodnotou 10,1 mmHg. Průměrná korigovaná hodnota nitroočního tlaku IOPcc byla 17,5 mmHg (±4,3 mmHg) s maximální hodnotou NOT 22,1 mmHg a minimální hodnotou 10,8 mmHg. Průměrná hodnota nitroočního tlaku IOPg na konci sledovaného období byla 15,6 mmHg (±3,0 mmHg) a IOPcc 15,6 mmHg (±3,4 mmHg). Rozdíl hodnot nitroočního tlaku IOPg a IOPcc ve sledovaném období byl minimální.
Výsledné časové křivky IOPg a IOPcc dokumentují grafy 1 a 2.
1. Časová křivka IOPg ve skupině A1, A2, B a C. 
2. Časová křivka IOPcc ve skupině A1, A2, B a C. 
Rohovkovou hysterezu (CH) a faktor rohovkové rezistence (CRF) před zahájením léčby a po 12 měsících sledování ve skupině A nově diagnostikovaných a léčených PGOÚ a OH, v kontrolní skupině B a C bez léčby shrnují tabulky 3 a 4.
3. Vývoj CH ve skupině A1, A2, B a C. 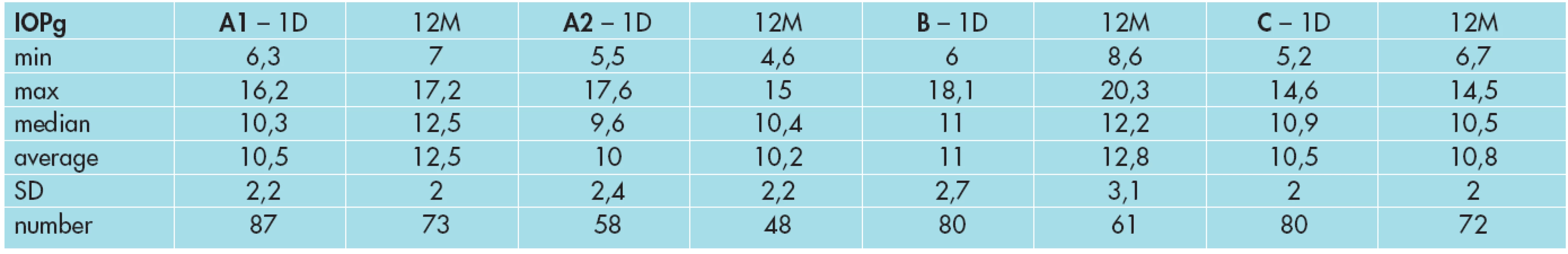
CH=hystereze, A1= skupina PGOÚ nebo OH léčená analogy prostaglandinů, A2= skupina PGOÚ nebo OH léčená ICA nebo ICA a betablokátory, B= skupina oční hypertenze bez léčby, C= kontrolní skupina min=minimum, max=maximum, smodch=směrodatná odchylka, 1.D=1.den, 12.M=12.měsíc 4. Vývoj CRF ve skupině A1, A2, B a C. 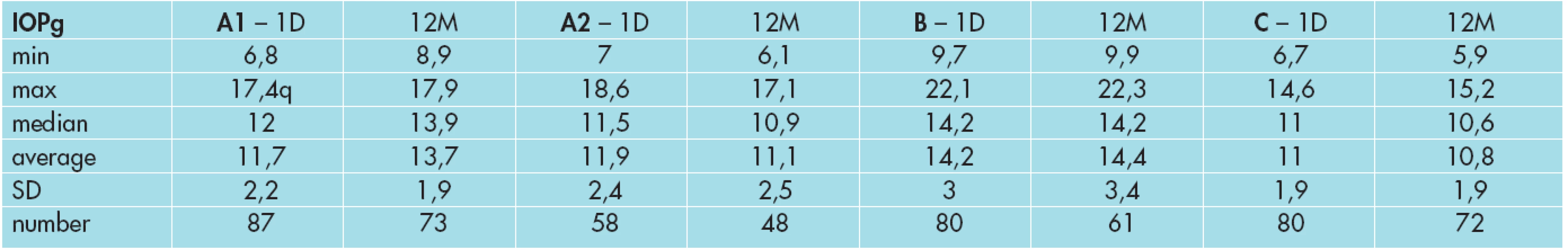
CRF= faktor rezistence rohovky, A1= skupina PGOÚ nebo OH léčená analogy prostaglandinů, A2= skupina PGOÚ nebo OH léčená ICA nebo ICA a betablokátory, B= skupina oční hypertenze bez léčby, C= kontrolní skupina min=minimum, max=maximum, smodch=směrodatná odchylka, 1.D=1.den, 12.M=12.měsíc Ve skupině A1 průměrná hodnota CH byla na začátku léčby 10,5 mmHg (±2,2 mmHg) a na konci sledovaného období 12,8 mmHg (±2,0 mmHg). Vzestup průměrné hodnoty CH byl o 2,3 mmHg. Průměrná hodnota CRF byla na začátku léčby 11,7 mmHg (±2,2 mmHg) a na konci sledovaného období 13,7 mmHg (±1,9 mmHg). Vzestup průměrné hodnoty CH byl o 2,0 mmHg.
Ve skupině A2 byla průměrná hodnota CH na začátku léčby 10,0 mmHg (±2,4 mmHg) a na konci sledovaného období 10,2 mmHg (±2,2 mmHg). Průměrná hodnota CRF byla na začátku léčby 11,9 mmHg (±2,4 mmHg) a na konci sledovaného období 11,1 mmHg (±2,5 mmHg). Rozdíl hodnot CH a CRF byl minimální.
Ve skupině B byla průměrná hodnota CH na začátku sledování 11 mmHg (±2,7 mmHg) a na konci sledovaného období 12,8 mmHg (±3,1 mmHg). Průměrná hodnota CRF byla na začátku léčby 14,2 mmHg (±3,0 mmHg) a na konci sledovaného období 14,4 mmHg (±3,4 mmHg). Vzestup průměrné hodnoty CH byl o 1,8 mmHg, rozdíl CRF byl minimální.
Ve skupině C průměrná hodnota CH byla na začátku sledování 10,5 mmHg (±2,0 mmHg) a na konci sledovaného období 10,8 mmHg (±2,0 mmHg). Průměrná hodnota CRF byla na začátku léčby 11 mmHg (±1,9 mmHg) a na konci sledovaného období 10,8 mmHg (±1,9 mmHg). Rozdíl hodnot CH a CRF byl minimální.
Výsledné časové křivky CH a CRF dokumentují grafy 3 a 4.
3. Časová křivka CH ve skupině A1, A2, B a C. 
4. Časová křivka CRF ve skupině A1, A2, B a C. 
Centrální tloušťku rohovky (CCT) před zahájením léčby a po 12 měsících sledování ve skupině A nově diagnostikovaných a léčených PGOÚ a OH a v kontrolní skupině B a C bez léčby shrnuje tabulka 5 a graf 5.
5. Vývoj CCT ve skupině A1, A2, B a C. 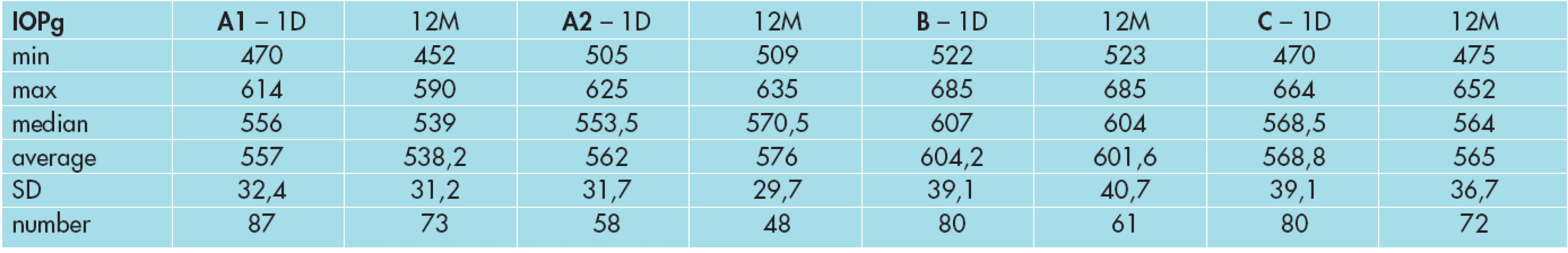
CCT= centrální tloušťka rohovky, A1= skupina PGOÚ nebo OH léčená analogy prostaglandinů, A2= skupina PGOÚ nebo OH léčená ICA nebo ICA a betablokátory, B= skupina oční hypertenze bez léčby, C= kontrolní skupina min=minimum, max=maximum, smodch=směrodatná odchylka, 1.D=1.den, 12.M=12.měsíc 5. Časová křivka CCT ve skupině A1, A2, B a C. 
Ve skupině A1 průměrná hodnota CCT během sledovaného období poklesla o -18,8 μm. Vzestup průměrné hodnoty CCT byl ve skupině A2 o 14 μm. Kontrolní skupiny B a C prokázaly minimální rozdíly.
V žádné skupině při vstupu ani po roce sledování korelační analýza neprokázala korelaci veličin IOPcc, IOPg s CH a CRF.
Metodou Kruskal-Wallisova neparametrická ANOVA (SW STATISTICA) byly testovány rozdíly mezi skupinami pro veličiny IOPg, IOPcc, CH, CRF a CCT při vstupu a po 12 měsících. Test byl proveden pro rozdílovou veličinu po roce oproti hodnotě vstupní.
Pro veličinu IOPg při vstupu byly prokázány významné rozdíly mezi skupinami A1, A2, B a C (p < 0,0001). Rozdíly jsou patrné z grafu 6. Ve skupině A1 je nejvyšší variabilita hodnot IOPg, dále oproti zbylým skupinám je ve skupině C nejnižší medián, což potvrzuje průměrné hodnoty NOT u zdravých jedinců. I pro veličinu IOPcc při vstupu byly prokázány významné rozdíly mezi skupinami A1, A2, B a C na 1% hladině významnosti (p = 0,0001) obdobné rozdílům veličiny IOPg. Podle grafu 7 po roce u veličiny IOPg nebyl mezi skupinami A1, A2, B a C zjištěn významný rozdíl ve změně nitroočního tlaku ve srovnání se vstupním měřením (p = 0,6717). U většiny pacientů byla meziroční změna IOPg malá, ať už u nich došlo k nárůstu či poklesu. Obdobný závěr lze formulovat i pro veličinu IOPcc (p = 0,503), jak zobrazují grafy 8 a 9.
6. Rozdíly mezi skupinami A1, A2, B a C pro veličinu IOPg při vstupu. 
7. Rozdíly mezi skupinami A1, A2, B a C pro veličinu IOPg po 12 měsících. 
8. Rozdíly mezi skupinami A1, A2, B a C pro veličinu IOPcc při vstupu. 
9. Rozdíly mezi skupinami A1, A2, B a C pro veličinu IOPcc po 12 měsících. 
Pro veličinu CH při vstupu nebyly prokázány významné rozdíly mezi skupinami A1, A2, B a C (p = 0,3559). Po roce byl zjištěn významný rozdíl ve změně hystereze mezi skupinami (p < 0,001), skupina A1 se výrazně odlišuje - má nejvyšší hodnotu mediánu. Znamená to, že ve skupině A1 došlo k nárůstu CH, nárůst naznačuje i skupina B, ale u menšího počtu očí. Ve zbylých skupinách A2, C je hodnota CH po roce přibližně stejná jako byla při vstupním měření. Rozdíl změn dokumentují grafy 10 a11.
10. Rozdíly mezi skupinami A1, A2, B a C pro veličinu CH při vstupu. 
11. Rozdíly mezi skupinami A1, A2, B a C pro veličinu CH po 12 měsících. 
Pro veličinu CRF při vstupu byly prokázány významné rozdíly mezi skupinami A1, A2, B a C (p = 0,032). Podle grafu 12 vykazuje odlišné chování především skupina B, nabývající obecně vyšších hodnot než zbylé tři skupiny, které jsou navzájem srovnatelné. I po roce byl u veličiny CRF zjištěn významný rozdíl ve změně mezi skupinami ve srovnání se vstupním měřením na 1% hladině významnosti (p < 0,001), jak dokumentuje graf 13. Výrazně se odlišuje skupina A1, vykazuje nejmenší variabilitu změny CRF, obdobně jako u CH má nejvyšší hodnotu mediánu. Ve skupině A1 došlo k nárůstu CRF, zatímco ve zbylých skupinách A2, B a C je hodnota CRF po roce přibližně stejná jako byla při vstupním měření.
12. Rozdíly mezi skupinami A1, A2, B a C pro veličinu CRF při vstupu. 
13. Rozdíly mezi skupinami A1, A2, B a C pro veličinu CRF po 12 měsících. 
Pro veličinu CCT při vstupu byly prokázány významné rozdíly mezi skupinami A1, A2, B a C (p = 0,0132). Ve skupině C je nejvyšší variabilita hodnot CCT, skupina B má výrazně vyšší medián (nad úrovní 600 μm). Po roce byl u veličiny CCT mezi skupinami A1, A2, B a C zjištěn významný rozdíl ve změně centrální tloušťky rohovky ve srovnání se vstupním měřením na 1% hladině významnosti (p < 0,001). Rozdíly zobrazují grafy 14 a 15.
14. Rozdíly mezi skupinami A1, A2, B a C pro veličinu CCT při vstupu. 
15. Rozdíly mezi skupinami A1, A2, B a C pro veličinu CCT po 12 měsících. 
Ve skupině A1 je medián záporný – v této skupině došlo tedy po roce k poklesu hodnot CCT (o 5 μm, ale také až o 30 μm). Pokles byl zaznamenán u všech pacientů z této skupiny. Medián činí -15 μm, to znamená, že u poloviny pacientů byl pokles větší nebo menší než 15 μm. Oproti tomu ve skupině A2 je medián kladný – v této skupině docházelo tedy po roce k nárůstu hodnoty CCT. Nárůst byl zaznamenán u velké většiny pacientů z této skupiny. Na druhé straně v této skupině byla největší variabilita meziroční změny CCT zjištěné u jednotlivých pacientů. Skupiny B a C jsou srovnatelné: v obou je velmi malá variabilita rozdílové veličiny a medián této rozdílové veličiny je v obou skupinách zhruba nulový. Po roce byla v těchto skupinách CCT víceméně stejná jako při vstupu.
Diskuse
Chronická farmakoterapie glaukomu ovlivní příznivě výši nitroočního tlaku, na druhé straně může být provázena celou řadou vedlejších negativních účinků. Cílovou oblastí léků, které vedou ke snížení NOT, je řasnaté těleso a biochemické procesy jeho enzymů. Vzhledem k tomu, že řada enzymů řasnatého tělesa je přítomna i ve stromatu rohovky, mohou některé z nich ovlivnit i biochemické procesy v rohovce. To vedlo ke sledování možných negativních účinků léků, které snižují nitrooční tlak na morfologické, metabolické a biomechanické vlastnosti rohovky.
Klinické projevy poškození povrchu spojivky i rohovky jsou nejdéle známé ve skupině beta-blokátorů. Mietz a kolektiv (12) prokázali u králíků po18 měsících aplikace timololu signifikantní zvýšení subepiteliální hustoty kolagenu spojivky. Negativní účinek způsobuje samotná účinná látka betablokátoru, zároveň se potvrdil i toxický efekt konzervační látky.
Nejčastěji užívaná konzervační látka je benzalkonium chlorid (BAC). Dlouhodobá zátěž povrchu očí benzalkonium chloridem zhoršuje kvalitu slzného filmu, snižuje jeho stabilitu a vytváří hydrofobní prostředí povrchu oka. BAC má také toxické účinky na epiteliální buňky rohovky a spojivky, porušuje hematookulární bariéru a může být příčinou alergické reakce. Řada studií srovnává účinek betablokátorů na povrch očí s a bez konzervační látky BAC. Výsledek je příznivější ve prospěch léků bez BAC nebo s jeho nízkou koncentrací (13, 14). Betablokátory a BAC mění morfologii epitelu rohovky, nemají vliv na CCT a biomechanické vlastnosti rohovky.
Inhibitory karboanhydrázy jsou další skupinou léků, které mohou ovlivnit strukturu rohovky. Enzym karboanhydráza v očích katalyzuje chemickou reakci přeměny oxidu uhličitého a vody na kyselinu uhličitou a naopak. V rohovce je přítomen izoenzym II, který je důležitý pro dehydrataci stromatu. Činnost izoenzymu II může být blokována ICA, čehož následkem může dojít k edému a ohrožení transparence rohovky. Několik publikovaných studií v oblasti této problematiky potvrzuje vliv ICA na centrální tloušťku rohovky (11, 15–18).
Wirtitsch a kolektiv (16) ve své randomizované, placebem kontrolované, dvojitě maskované studii potvrdil statisticky významný vzestup v centrální tloušťce rohovky po čtyřech týdnech aplikace dorzolamidu u pacientů s Fuchsovou endotelovou dystrofií ve fázi cornea guttata a nezměněnou centrální tloušťku rohovky u zdravých jedinců.
Zhao a spoluautor (17) referovali dva případy pacientů, u nichž došlo k dekompenzaci rohovky po léčbě brinzolamidem, u jednoho pacienta po patnácti měsících léčby, u druhého po 2 letech. Na rohovkách se objevil jemný edém a zašednutí stromatu, zajímavé bylo, že jejich centrální tloušťka se nezměnila. Po vysazení léčby nález během 3 měsíců vymizel.
March a kolektiv (18) publikovali randomizovanou, dvojitě zaslepenou studii, ve které bylo 372 pacientů s primárním glaukomem léčeno ICA nebo betablokátory. Po 18 měsících léčby neprokázali změny v centrální tloušťce rohovky, ani změny v hustotě endotelových buněk. Stejně tak Iester a spoluautoři v multicentrické studii nepotvrdili změnu CCT po léčbě ICA ani po léčbě analogy prostaglandinů (19).
V naší studii u pacientů, kteří byli léčeni ICA, došlo po roce k nárůstu hodnot CCT. Nárůst byl zaznamenán u velké většiny pacientů z této skupiny. I když výsledky rozdílu CCT jsou po dvanácti měsících sledování statisticky signifikantní, je nutné upozornit na úbytek počtu očí o 17 % (48 očí), u části pacientů byla léčba kombinovaná s betablokátory. Rovněž byla prokázána největší variabilita meziroční změny CCT u jednotlivých pacientů. Miglior (20) udává variabilitu měření ultrazvukovou pachymetrií více než 15 μm, přestože vyšetření provádí jeden stejný lékař.
Vzhledem k tomu, že je více faktorů, které mohou CCT ovlivnit (fyziologické kolísání tloušťky rohovky během dne, věk, hladina estrogenů u žen), nelze užívání terapie jednoznačně považovat za jediný podklad změn tloušťky rohovky. Ve studiích, které potvrdily nárůst CCT, se většinou jednalo o rohovky s narušenou kvalitou endotelu (16). V našem souboru nebyl endotel hodnocen.
V literatuře bylo publikováno mnoho prací (11, 16–18) zabývajících se změnou CCT u pacientů léčených ICA, málo je však známo o vlivu ICA na biomechanické vlastnosti rohovky (21).
V naší skupině léčené ICA jsou hodnoty CH a CRF po roce přibližně stejné, jako byly při vstupním měření. Biomechanické vlastnosti rohovky se nezměnily.
V současné době nejčastěji používaná skupina léků analoga prostaglandinů a prostamidy mají rovněž potenciál ovlivnit morfologické a biomechanické vlastnosti rohovky. Přesto, že jejich mechanismus účinku na buněčné úrovni nebyl dosud plně objasněn, teoreticky se primární působení vysvětluje zvýšením aktivity enzymu matrix metalloproteinázy (MMP) typu 1, 2 a 3 (22). MMP je skupina 20 typů enzymů, které jsou přítomné v předním segmentu oka: v slzném filmu, ve spojivce, v epitelu, stromatu a endotelu rohovky, v trámčině, v nitrooční tekutině a čočce. Podílejí se na degradaci částic ECM a bazálních membrán (23). U pacientů léčených analogy prostaglandinů vede vzestup aktivity MMP k poklesu imunoreaktivity a následnému úbytku kolagenu I, III a IV v extracellulární matrix hladké svaloviny řasnatého tělesa a přilehlé skléry. V důsledku tohoto procesu se zvyšuje uveosklerální odtok a dochází ke snížení nitroočního tlaku (10). Pod vlivem analogů prostaglandinů byla potvrzena aktivace enzymu MMP rovněž ve spojivce králíků (12) a došlo k subepiteliálnímu snížení hustoty kolagenu spojivky (12). Méně objasněnou oblastí je vliv MMP na fyziologickou funkci keratocytů (fibroblastů) ve stromatu rohovky.
Wu a spoluautoři (9) studovali změny uměle vykultivovaných rohovkových stromálních buněk po aplikaci latanoprostu. Imunofluorescenční barvení prokázalo změnu v biosyntéze buněk, jejímž projevem byla změna v rozložení kolagenu typu I, pokles migrace buněk a pokles fibronektinu.
Liu a kolektiv (24) v experimentálním modelu odhalili, že uměle vykultivované fibroblasty rohovky se po expozici latanoprostem kontrahují, na rozdíl od timololu, po němž zůstávají nedotčené. Rovněž dochází k redukci gelu kolagenních vláken, za jehož produkci jsou fibroblasty zodpovědné. S ohledem na to, že ECM reprezentuje významnou část objemu stromatu rohovky a určuje její tvar a tloušťku, vznikla teoretická hypotéza, zda analoga prostaglandinů nemění objem ECM a CCT.
Viestenz a kolektiv (25) v randomizované kontrolované studii publikovali snížení CCT ve skupině léčené analogy prostaglandinů, kontrolní skupina a skupina léčená ICA tyto změny neprokázaly. Některé rozdíly dosáhly až 60 μm během několika měsíců léčby.
Schlote a spoluautoři (26) sledovali vliv travoprostu na CCT. Ve sledovací době 12 měsíců došlo k poklesu v prvních 6 měsících, v dalších 6 měsících nebyly rozdíly signifikantní.
Zhong a spoluautoři (27) hodnotili vliv analog prostaglandinů na CCT ve sledovací době 17,19 ± 15,71 měsíců u 69 očí nově léčených pacientů s glaukomem a prokázali snížení CCT u latanoprostu (14,95 ± 5,04 μm), travoprostu (15,73 ± 3,25 μm) a u bimatoprostu (17,00 ± 6,23 μm). Snížení CCT neovlivnilo změny v naměřených hodnotách NOT.
Naopak lehké zvýšení CCT po léčbě analogy prostaglandinů shledali Bafa a spoluautoři (28). Jednalo se o 108 očí u pacientů s nově diagnostikovaným glaukomem léčených analogy prostaglandinů (latanoprost, travoprost a bimatoprost). Ve sledovací době dvou let došlo ke konstantnímu vzestupu CCT o 1,85–8,83 μm v periodě všech návštěv u skupiny léčené bimatoprostem a latanoprostem. U travoprostu se CCT nezměnila.
V naší studii u pacientů, kteří byli léčeni analogy prostaglandinů, došlo po roce k poklesu hodnot CCT, medián hodnot byl -15 μm. Pokles byl zaznamenán u všech pacientů z této skupiny, u poloviny z nich byl pokles větší než 15 μm.
Závěry vyplývající ze studií vlivu analog prostagalandinů na CCT u pacientů s glaukomem nejsou jednoznačné. Většina však ve shodě s našimi výsledky prokazuje názor, že analoga prostaglandinů mohou snižovat CCT. Pokud by vlivem analog prostaglandinů docházelo ke ztenčení rohovky, a hodnotili bychom tento vliv na přesnost měření nitroočního tlaku aplanací samostatně, naměřené hodnoty NOT by byly podhodnocené.
Přesnost měření NOT je však závislá kromě CCT i na zakřivení rohovky a jejích biomechanických vlastnostech. Rezistence, kterou klade rohovka deformaci během aplanace, závisí na viskoelasticitě a její pevnosti více, než na její tloušťce. Z tohoto pohledu jsme se zabývali více otázkou vlivu analog prostaglandinů na biomechanické vlastnosti rohovky před a po nasazení léčby.
V námi léčené skupině analogy prostaglandinů byl po roce zjištěn významný rozdíl biomechanických vlastností rohovky ve srovnání se vstupním měřením u veličiny CH i CRF na 1% hladině významnosti (p < 0,001). K nárůstu došlo přibližně o 2 jednotky. U poloviny pacientů z této skupiny byl nárůst větší než 2 jednotky.
V literatuře bylo publikováno několik prací, které vysvětlují změny CH a CRF po nasazení léčby analogy prostaglandinů v závislosti na NOT.
Ve studii u pacientů s angulárním glaukomem (29, 30), u kterých byly naměřeny vysoké hodnoty NOT, byly shledány nízké hodnoty CH a naopak. Po snížení NOT chirurgickou léčbou došlo k vzestupu hodnoty CH. Agarwal (31) toto potvrdil i sledováním CH před a po nasazení léčby analogy prostaglandinů. Dokonce dospěl k závěru, že znalost výchozí hodnoty CH před zahájením léčby analogy prostaglandinů by mohla napovědět, jak velké snížení NOT lze očekávat. U pacientů, kde je výchozí hodnota CH vyšší, snížení NOT analogy prostaglandinů lze očekávat nižší.
V námi sledovaném souboru tato teorie nebyla potvrzena, i u pacientů s vyšší hodnotou CH došlo k dostatečnému snížení NOT a naopak. Stejně tak korelační analýza neprokázala vzájemnou závislost IOPcc a CH (R = 0,027) při vstupu a (R = 0,072) po roce a mezi IOPcc a CRF (R = 0,204) při vstupu a (R = 0,139) po roce.
Dalším možným faktorem majícím vliv na výsledek CH a CRF může být chyba měření CH u extrémně vysokých hodnot NOT. Maximální síla proudu vzduchu, kterou disponuje ORA přístroj, nestačí na dostatečnou indentaci rohovky a změří falešně nižší hodnotu CH (32).
Podrobnější analýzou naměřených křivek bylo také zjištěno, že přístroj není schopen zachytit určitý pohyb oka a tato dynamika bulbu může rovněž navodit chybu měření.
A konečně analoga prostaglandinů mohou skutečně ovlivňovat strukturu rohovky – strukturu kolagenních vláken, tak jak to prokazují experimentální studie (10, 24). Viskoelastické vlastnosti rohovky se měnit nezávisle na CCT a NOT. Otázkou je, zda ORA přístroj má dostatečnou senzitivitu a specificitu tuto změnu spolehlivě zaznamenat.
Závěr
Biomechanické vlastnosti rohovky – hystereze (CH) se podle řady studií jeví jako parametr, který by mohl předpovídat progresi glaukomového onemocnění. Uvádí se, že CH reprezentuje nepřímo integritu a pevnost laminy cribrozy a nižší hodnota CH je rizikový faktor progrese glaukomu (33). Zatím má ale využití hodnoty CH, měřené přístrojem ORA, jako rizikového faktoru progrese glaukomu své limity. Stejná hodnota CH může vyjadřovat různý podíl elasticity a viskozity (34).
V hodnoceném souboru očí s nově diagnostikovaným glaukomem a oční hypertenzí jsme zjistili po nasazení léčby odlišné biomechanické vlastnosti rohovky u pacientů léčených analogy prostaglandinů.
U obou veličin CH i CRF byl po roce sledování prokázán statisticky významný rozdíl v porovnání se vstupním měřením (p < 0,001). Hodnoty CH a CRF se zvýšily.
Inhibitory karboanhydrázy biomechanické vlastnosti nezměnily. Rovněž kontrolní skupina zdravých očí a oční hypertenze bez léčby změnu neprokázala.
V kontrolní skupině oční hypertenze bez léčby bylo prokázáno větší zastoupení očí s pevnou a nadprůměrně silnou rohovkou. Toto nám potvrdilo důležitost měření CH a CRF kromě CCT u pacientů s OH, abychom předčasně nezahajovali léčbu.
Přestože z výsledků naší studie nelze dělat jednoznačné závěry, chtěli jsme upozornit na možný vliv analog prostaglandinů na biomechanické vlastnosti rohovky při dlouhodobé léčbě a tím i na možný vliv přesnosti měření NOT v průběhu léčby. V současné době je zřejmé, že ORA nerozliší v naměřené hodnotě CH podíl elasticity a podíl viskozity. Bude nutné provést další studie k potvrzení vlivu dlouhodobého podávání analog prostaglandinů na přesnost měření nitroočního tlaku s využitím nové generace přístrojů, které podrobněji zanalyzují elasticitu a viskozitu odděleně.
Do redakce doručeno dne 2. 12. 2013
Do tisku přijato dne 9. 9. 2014
MUDr. I. Liehneová, Ph.D.
Oční oddělení KZ, a.s.,
Masarykova nemocnice v Ústí nad Labem
Sociální péče 12A
400 11 Ústí nad Labem
email: ivana.liehneova@kzcr.eu
Sources
1. Randleman JB.: Post-laser in-situ keratomileusis ectasia: current understanding and future directions. Curr Opin Ophthalmol, 2006 Aug; 17(4): 406–12.
2. Shah S, Laiquzzaman M., Bhojwani R, Mantry S.: Assessment of the Biomechanical properties of the Cornea with the Ocular Response Analyzer in Normal and Keratoconic Eyes. IOVS, 2007 July; Vol. 48, No.7.
3. Liu R, Chu RY, Zhou XT, Qu XM, Dai JH, Wang L.: A compare study on cornea biomechanical properties in normal and keratoconic eyes. Zhonghua Yan Ke Za Zhi, 2009 Jun; 45(6): 509–13.
4. Schweitzer C, Roberts CJ, Mahmoud AM, Colin J, Maurice-Tison S, Kerautret J.: Screening of forme fruste keratoconus with the ocular response analyzer. Invest Ophthalmol Vis Sci, 2010 May; 51(5): 2403-10. doi: 10.1167/iovs.09-3689.
5. Congdon NG, Broman AT, Bandeen-Roche K, Grover D, Quigley HA.: Central corneal thickness and corneal hysteresis associated with glaucoma damage. Am J Ophthalmol, 2006 May; 141(5): 868–75.
6. Downs JC, Suh JK, Thomas KA, Bellezza AJ, Hart RT, Burgoyne CF.: Viscoelastic material properties of the peripapillary sclera in normal and early-glaucoma monkey eyes. Invest Ophthalmol Vis Sci, 2005 Feb; 46(2): 540–6.
7. Burgoyne CF, Downs JC, Bellezza AJ, Suh JK, Hart RT.: Optic nerve head as a biomechanical structure: a new paradigm for understanding the role of IOP-related stress and strain in the pathophysiology of glaucomatous optic nerve head damage. Prog Retin Eye Res, 2005; 24 : 39–73.
8. Jonas JB.: Role of cerebrospinal fluid pressure in the pathogenesis of glaucoma. Acta Ophthalmol, 2011; 89 : 505–14.
9. Wu KY, Wang HZ, Hong SJ.: Effect of latanoprost on cultured porcine corneal stromal cells. Curr Eye Res, 2005 Oct; 30(10): 871–9.
10. Sagara T, Gaton DD, Lindsey JD, Gabelt BT, Kaufman PL, Weinreb RN.: Topical prostaglandin F2alpha treatment reduces collagen types I, III, and IV in the monkey uveoscleral outflow pathway. Arch Ophthalmol, 1999 Jun;117(6): 794–801.
11. Inoue K, Okugawa K, Oshika T, Amano S.: Influence of Dorzolamide on Corneal Endothelium. Jpn J Ophthalmol, 2003; 47 : 129–133.
12. Mietz H., Schrehardt U., Strassfeld C., Krieglstein GK.: Effect of latanoprost and timolol on the histopathology of the rabbit conjunctiva. IOVS, 2001 Mar; 42(3): 679–87.
13. Baudouin Ch., De Lunardo Ch.: Short term comparative study of topical 2% carteolol with and without benzalkonium chloride in healthy volunteers. Br J Ophthalmol, 1998; 82, 39–42.
14. Ishibashi T, Yokoi N, Kinoshita S.: Comparison of the short-term effects on the human corneal surface of topical timolol maleate with and without benzalkonium chloride. J Glaucoma, 2003 Dec; 12(6): 486-90.
15. Liehneová I.: Farmakoterapie glaukomu. Čes a Slov Oftalmol, 2010 Oct; 66(4): 155–8.
16. Wirtitsch MG, Findl O, Heinzl H.: Effect of Dorzolamide Hydrochloride on Central Corneal Thickness in Humans with Cornea Guttata. Arch Ophthalmol, 2007, 125; (10): 1345-1350.
17. Zhao JC, Chen T.: Brinzolamide induced reversible corneal decompensation. Br J Ophthalmol, 2005 Mar; 89(3): 389-90.
18. March WF, Ochsner KI.: The long-term safety and efficacy of brinzolamide 1.0% (azopt) in patients with primary open-angle glaucoma or ocular hypertension. The Brinzolamide Long-Term Therapy Study Group. Am J Ophthalmol. 2000 Feb; 129(2): 136–43.2004.
19. Iester M, Telani S, Brusini P, Rolle T, Fogagnolo P, Martini E, Milano G, Paoli D.: Italian Central corneal thickness and glaucoma treatment: an Italian multicenter cross-sectional study. Glaucoma Register. J Ocul Pharmacol Ther, 2013 Jun; 29(5): 469–73.
20. Miglior S,Albe E, Guareschi M, et al.: Intraobserver and interobserver reproducibility in the evaluation of ultrasonic pachymetry measurements of central corneal thickness, Br J Ophthalmol, 2004; 88 : 174–7.
21. Bagga H, Liu JH, Weinreb RN.: Intraocular pressure measurements throughout the 24 h. Curr Opin Ophthalmol, 2009 Mar; 20(2): 79–83.
22. Gaton DD, Sagara T., Lindsey JD, Gabelt BT, Kaufman PL, Weinreb RN.: Increased matrix metalloproteinases 1,2 and 3 in monkey uveoscleral outflow pathway after topical prostaglandin F(2 alpha) -isopropyl ester treatment. Arch Ophthalmol, 2001 Aug; 119(8): 1165–70.
23. Hatanaka M., Vessani R., Elias I., Morita C., Susanna R.: The effect of Prostaglandin Analogs and Prostamide on Central Corneal Thickness. J. Ocular Pharmacology and Therapeutics, 2009; 25 : 51–53.
24. Liu Y., Yanai R., Lu Y., Hirano S., Sagara T., Nishida T.: Effects of antiglaucoma drugs on collagen gel contraction mediated by human corneal fibroblasts. J Glaucoma, 2006 Jun; 15(3): 255–9.
25. Viestenz A, Martus P, Schlötzer-Schrehardt U, Langenbucher A, Mardin CY.: Impact of prostaglandin-F (2alpha)-analogues and carbonic anhydrase inhibitors on central corneal thickness - a cross-sectional study on 403 eyes. Klin Monbl Augenheilkd, 2004 Sep; 221(9): 753–6.
26. Schlote T, Tzamalis A, Kynigopoulos M.: Central corneal thickness during treatment with travoprost 0.004% in glaucoma patients. J. Ocul Pharmacol Therap, 2009; 25 : 459–4662.
27. Zhong Y, Shen X, Yu J, Tan H, Cheng Y.: The comparison of the effects of latanoprost, travoprost, and bimatoprost on central corneal thickness. Cornea, 2011 Aug; 30(8): 861–4.
28. Bafa M., Georgopoulos G., Mihas C., Stavrakas P., Papaconstatinou, Vergados I.: The effect of prostaglandin analogues on central corneal thickness of patients with chronic open-angle glaucoma: a 2year study on 129 eyes. Acta Ophthalmol, 2011; 89 : 448–451.
29. Sun L, Shen M, Wang J, Fang A, Xu A, Fang H, Lu F.: Recovery of corneal hysteresis after reduction of intraocular pressure in chronic primary angle-closure glaucoma. Am J Ophthalmol, 2009 Jun; 147(6): 1061–6.
30. Shimmyo M.: Recovery of corneal hysteresis after reduction of intraocular pressure in chronic primary angle-closure glaucoma. Am J Ophthalmol, 2009; 148 : 623.
31. Agarwal DR, Ehrlich JR, Shimmyo M, Radcliffe NM.: The relationship between corneal hysteresis and the magnitude of intraocular pressure reduction with topical prostaglandin therapy. Br J Ophthalmol, 2012 Feb; 96(2): 254–7.
32. Rouse EJ, Roberts CJ, Mahmoud AM.: The Measurement of Biomechanical Parameters as a Function of Peak Applied Pressure in the Reichert Ocular Response Analyzer. IOVS, 2007; 48: ARVO E-Abstract 1247.
33. Congdon NG, Broman AT, Bandeen-Roche K, Grover D, Quigley HA.: Central corneal thickness and corneal hysteresis associated with glaucoma damage. Am J Ophthalmol, 2006, May; 141(5): 868–75.
34. Glass DH, Roberts CJ, Litsky AS, Weber PA.: A viscoelastic biomechanical model of the cornea describing the effect of viscosity and elasticity on hysteresis. Invest Ophthalmol Vis Sci, 2008 Sep; 49(9): 3919–26.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2014 Issue 5-
All articles in this issue
- The Glaucoma Pharmacological Treatment and Biomechanical Properties of the Cornea
- Retinal Tamponade with Silicone Oil – Long Term Results
- The Incidence of Endophtalmitis after the Application of Intravitreal Injections in FNKV with Regard to Various Prophylactic Antibiotic Regimens
- Oculars Disturbances as First Sign of Decompensated Arterial Hypertension
- The Use of Anti-VEGF Preparations and PDT in the Treatment of Retinal Juxtapapillary Hemangioma - A Case Report
- Frosted Branch Angiitis Syndrome
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Oculars Disturbances as First Sign of Decompensated Arterial Hypertension
- Retinal Tamponade with Silicone Oil – Long Term Results
- The Glaucoma Pharmacological Treatment and Biomechanical Properties of the Cornea
- The Incidence of Endophtalmitis after the Application of Intravitreal Injections in FNKV with Regard to Various Prophylactic Antibiotic Regimens
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

