-
Medical journals
- Career
Denní dávka benzalkonium chloridu – významné kritérium v léčbě glaukomu
: P. Výborný; S. Sičáková
: Oční klinika 1. LF UK a ÚVN, Praha, přednosta doc. MUDr. Jiří Pašta, CSc.
: Čes. a slov. Oftal., 67, 2011, No. 2, p. 63-66
: Original Article
Konzervační činidla v očních kapkách, zvláště benzalkonium chlorid (BAC), mohou působit cytotoxicky, dále mimo jiné vyvolat nestabilitu slzného filmu, záněty spojivek, subkonjunktivální fibrózu, apoptózu epitelu a zhoršení prognózy případného chirurgického zákroku. Subjektivní potíže pacienta mohou snížit jeho spolupráci v léčebném režimu. Pro lepší orientaci v tomto problému jsme kalkulovali denní dávku BAC v očních kapkách používaných v léčbě glaukomu. Významné rozdíly vyplývají z nestejné velikosti kapky u jednotlivých léků, z různé koncentrace BAC na objemovou jednotku balení a z frekvence aplikace. Denní dávka BAC v mikrogramech: Betablokátory – Timo-COMOD 0, Arutimol 2,6, Vistagan 2,8, Timolol POS 3,0, Arteoptic 3,7, Carteol 4,0, Betoptic S 4,8, Timoptol MSD 6,3, Betoptic 10,0. Alfamimetika – Alphagan a Luxfen 3,5, Aruclonin 7,1. Deriváty prostaglandinu, prostamidy a docosanoidy – Taflotan 0, Lumigan 1,4, Unilat 3,0, Travatan 3,9, Rescula 5,8, Xalatan 6,0, Latanoprost-ratiopharm, Xaloptic, Latanoprost Actavis, Latanoprost Arrow, Solusan, Glaucotens 6,0. Inhibitory karboanhydrázy – Azopt 4,8, Trusopt 5,4. Fixní kombinace – Ganfort 1,4, Combigan 3,2, Duotrav 4,3, Cosopt 5,6, Xalacom 6,0.
Moderním trendem medikamentózní léčby glaukomu jsou oční kapky bez konzervačních činidel.Klíčová slova:
benzalkonium chlorid, glaukom, complianceÚvod
Mnoho klinických a experimentálních studií prokazuje, že dlouhodobé užívání lokálních očních léků může způsobit změny povrchu oka, působit stav nepohodlí (diskomfort), nestabilitu slzného filmu, záněty spojivek, subkonjunktivální fibrózu, epiteliální apoptózu, zhoršení kvality rohovkového povrchu a potenciální risk neúspěchu antiglaukomové chirurgie indikované v budoucnu (4).
Po dlouhodobé aplikaci antiglaukomových očních kapek byly pozorovány známky subklinického zánětu. Laboratorními, experimentálními i klinickými studiemi bylo prokázáno, že nejvíce používané konzervační činidlo, benzalkonium chlorid (BAC), působí toxicky. Jako amoniová sůl působí nestabilitu slzného filmu, ztrátu pohárkových buněk, skvamózní metaplazii spojivky a apoptózu, porušení bariér v epitelu rohovky a poškození hlubších očních struktur. Konzervačním činidlem způsobené změny tedy zdaleka nejsou omezeny pouze na alergickou reakci. Nežádoucí účinky jsou mnohdy obtížně dávány do souvislosti s vyvolávajícím agens pro svůj pozdní nástup a nespecifický charakter. Ani zdánlivě nevýznamné a mírné symptomy by neměly být podceňovány, protože se mohou rozvinout ve vážnější subklinickou reakci a způsobit významné problémy. I když se aplikují oční kapky s konzervačními činidly krátkodobě, působí jejich používání dlouhodobé nežádoucí účinky, dochází k poškození nejen povrchu oka,ale i nitroočních struktur. Tyto nežádoucí účinky snižují compliance pacienta, negativně ovlivňují také úspěšnost glaukomové chirurgie. Konečným výsledkem je neadekvátní kontrola nitroočního tlaku u pacientů s glaukomem. Na podkladě experimentálních a klinických zpráv je při dlouhodobé léčbě doporučováno používání roztoků bez BAC.
Problematikou BAC a stanovením denní dávky BAC při použití různých očních kapek používaných v léčbě glaukomu jsme se zabývali v předcházející publikaci (2006). Situace na trhu antiglaukomatik se od té doby výrazně změnila, proto je třeba údaje aktualizovat a komentovat vývoj.
Metodika
Dostupné údaje o podílu BAC v očních kapkách jsou zpravidla jak v domácí nebo zahraniční literatuře, tak v souhrnných údajích o léku (SPC) uváděny ve formě koncentrace BAC na jednotku objemu (ml). Z této informace zjistíme, kolik BAC je v příslušném balení léku. Pro pacienta i lékaře je ovšem zásadní důležitosti vědět spíše to, jaká je skutečná denní dávka BAC při léčbě konkrétními očními kapkami a získat tak srovnání mezi jednotlivými léky. Tyto údaje se ale nikde nedočteme. Získáme je však pomocí jednoduchého matematického výpočtu, při znalosti sumárních výše uvedených údajů, dále velikosti kapky, terapeutického schématu a samozřejmě trojčlenky. Zásadním zjištěním je to, že velikost oční kapky u antiglaukomatik je většinou 33,3 mikrolitrů, není to však zdaleka pravidlem. Nejmenší objem kapky je u Betopticu S a Azoptu (24 mikrolitrů), největší objem kapky u Betopticu (50 mikrolitrů).(19) Tyto významné rozdíly je zapotřebí brát v úvahu při konečné kalkulaci denní dávky BAC. Frekvenci aplikace jsme kalkulovali podle údajů doporučených výrobcem, u inhibitorů karboanhydrázy jsme zvolili aplikaci dvakrát denně.
Výsledky
Oční kapky používané v léčbě glaukomu jsme rozdělili do 5 skupin: na betablokátory, alfamimetika, deriváty prostaglandinu, prostamidy, docosanoidy, dále inhibitory karboanhydrázy a fixní kombinace. Pořadí antiglaukomatik podle podílu mikrogramů BAC v denní dávce je uvedeno v tabulce 1.
1. Pořadí antiglaukomatik podle skupiny a podílu mikrogramů BAC v denní dávce 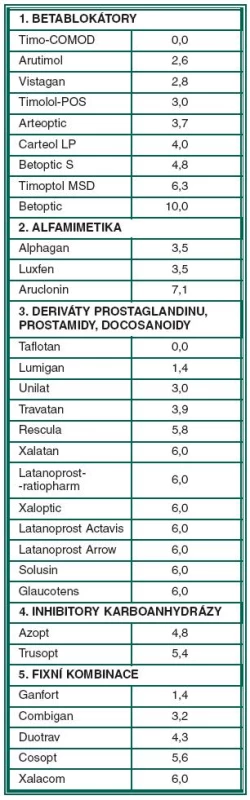
Diskuse
V přehledu a se stručným komentářem uvádíme konzervační látky nebo systémy pro aplikaci účinné látky, které se v oftalmologii používají.
Benzalkonium chlorid – BAC.
Edetan sodný – EDTA.
Chlorhexidin (narušuje lipidovou vrstvu slzného filmu, je cytotoxický).
Thiomersal (organická sloučenina rtuti, neovlivňuje lipidovou vrstvu slzného filmu, ale vyvolává hypersenzitivní reakce).
Cetrimid, chlorobutanol (nenarušují lipidovou vrstvu slzného filmu).
Polyquad – polyqaternium-1 (nízká konzervační schopnost).
Systém continuous monodose – COMOD (originální systém dávkování bránící kontaminaci, a tím minimalizuje požadavky na konzervační činidlo).
Single dose unit – SDU (lék bez konzervačních látek je k dispozici v polyetylénových pipetách na jedno použití).
V úvahu je zapotřebí vzít také to, že balení různých očních kapek mohou obsahovat i další pomocné látky – chlorid sodný, monohydrát dihydrogenfosforečnanu sodného (E339a), bezvodý hydrogenfosforečnan sodný (E339b), kyselinu chlorovodíkovou k úpravě pH, vodu pro injekci apod.
Výběr z nejvýznamnějších prací zabývajících se sledovanou problematikou poskytuje dostatek informací o závažnosti působení konzervačních činidel na oko.
BAC je nejčastěji používané konzervační činidlo v očních kapkách. Z výsledků studií in vivo a in vitro vyplývá, že oční kapky obsahují různé množství BAC s různou mírou působení na povrch oka. V tkáňových kulturách působí BAC zánik buněk epitelu (16,18), indukuje prozánětlivé a proapoptotické mediátory (8,16), oxidativní stres, mitochondriální aktivitu a změny související s působením glutathionu (7,16). Na povrchu oka pacienta s glaukomem indukuje BAC komplex zánětlivých mechanismů způsobujících alergii a toxicitu (3,16).
V současné době se u prostaglandinových očních kapek začínají používat buďto jiná konzervační činidla nebo systém jednorázové aplikace léku bez konzervačních přísad. Jedním z příkladů je Travoprost Z, kde BAC byl nahrazen prezervačním systémem Sofzia (borát, sorbitol, propylenglykol a chlorid zinku). In vitro studie prokázaly, že nejsou přítomny proapoptotické ani oxidativní stresové faktory (3,4). Zavedení tohoto léku se u nás nepřipravuje. Distributor nabízí Travatan BAK Free, kde konzervačním činidlem je polyquad. Tafluprost, nově syntetizovaný PGF-2alfa agonista vysoce selektivní k FP receptorům, neobsahuje BAC, a proto v in vitro studiích bylo prokázáno snížení toxicity v řadách epitelových buněk lidské spojivky (5, 16).
Dlouhodobě se problematikou konzervačních činidel v oftalmologii zabývají francouzští autoři v Institute of Vision v Paříži. (3, 4, 16) Srovnávali reakci spojivek a rohovky u králíků po užití komerčně dostupných roztoků latanoprostu (Xalatan) a preservative-free (PF) tafluprostu. Aplikovali 50 um pufrovaného fosfátového roztoku, 0,015% tafluprostu, 0,005% latanoprostu a 0,02% benzalkonium chloridu (BAC), celkem 15krát na povrch oka králíka v pětiminutových intervalech. Povrch oka byl vyšetřován biomikroskopicky, pomocí flow cytometrie (FCM), spojivkovou impresní cytologií (CIC) na výskyt CD45+ a tumor-necrosis factor receptoru 1 (TNFR1) a in vivo konfokální mikroskopií (IVCM). Imunohistologickým vyšetřením byl sledován výskyt zánětlivých a apoptotických buněk. Klinickým pozorováním a ICVM byla zjištěna výrazná toxicita k povrchu oka u BAC a latanoprostu způsobující různé patologické změny rohovkového epitelu – např. deskvamaci epitelových buněk, nepravidelnosti velikosti buněk, anisocytózu, poškození buněčných spojení, abnormální reflektivitu, zduření buněk a zánětlivou infiltraci. Naopak žádné ovlivnění nebylo pozorováno po PF-tafluprostu a pufrovaném roztoku – téměř normální vzhled rohovkového epitelu s pravidelnou polygonální buněčnou mozaikou,výraznou reflektivitou jader a žádná buněčná zduření. Bazální epitel po pufrovaném roztoku a PF-tafluprostu nejevil žádné známky zánětu. Po aplikaci latanoprostu a BAC vznikla významná buněčná infiltrace, signifikantně výraznější po BAC. Na předním stromatu vznikla mírná zánětlivá infiltrace a dezorganizace, a to pouze po aplikaci BAC. Na limbu a v periferní rohovce byla popsána zřetelná zánětlivá infiltrace po latanoprostu a BAC. Ve stromatu spojivky nevznikly ani po aplikaci pufrovaného roztoku, ani po aplikaci PF-tafluprostu žádné změny, neobjevily se zánětlivé buňky. Po latanoprostu a BAC byl zaznamenán zřetelný výskyt zánětlivých buněk. FCM ukázala vysokou expresi CPS45+ a TNRF1+ u skupiny po aplikaci latanoprostu a BAC ve srovnání s PF-tafluprostem a pufrovaným roztokem. Po latanoprostu byla CIC zjištěná hladina zánětlivých markerů nižší v porovnání s BAC samostatně podaným, byla však vyšší než po PF-tafluprostu nebo pufrovaném roztoku. U očí s aplikací BAC byla zjištěna sekrece obsahující shluky zánětlivých buněk bez příměsi buněk epitelu. Zánětlivé infiltráty byly tvořeny především neutrofily, lymfocyty a zřídka eosinofily, bez přítomnosti pohárkových buněk. Toxické změny zjištěné imunohistologicky měly obdobnou tendenci výskytu.
Molekula prostaglandinů se zdá mít protektivní účinek vůči toxicitě BAC (10,16).
Betablokátory s BAC působí kondenzaci chromatinových jader spojenou s alterací mitochondriální aktivity a ovlivněním hladiny glutathionu – proapoptotický fenomén. BAC zvýšil hladinu glutathionu po 15 minutách, po určité době byl zaznamenán pokles. Při podání BAC byla pozorována tvorba ROS (reactive oxygen species) signifikantně ve vyšší míře, než u očí bez podání konzervačních činidel (7).
Antiglaukomové oční kapky působí toxicky na endotelové buňky lidské rohovky (HCEC) v závislosti na přítomnosti BAC. Protože zředění antiglaukomových kapek (v praxi používaná nižší koncentrace) snižuje výrazně HCEC toxicitu, vzniká poškození buněk endotelu při léčebném používání zřídka. Pro srovnání toxicity různých léků lze použít tzv. cell viabilty score (CVS). Podle viability buněk je možno seřadit některé sledované oční kapky do sestupné řady takto: Travatan Z – prezervative free timolol maleat – prezervative free dorzolamid – 0,5% Timoptol – 1% Trusopt – Travatan – Xalatan – BAC (2).
Byla sledována cytotoxicita 5 analogů prostaglandinu na čtyřech povrchových očních buněčných kulturách – Chang (lidská spojivka), SIRC (králičí rohovka), RC-1 (králičí rohovka) a BCE C/D-1b (hovězí rohovka) v časových intervalech po 10, 30 a 60 minutách po aplikaci níže uvedených látek, a to buď neředěných, nebo ředěných dvakrát nebo desetkrát. Pořadí podle buněčné viability: Travatan Z – tafluprost – Travatan – Xalatan – Rescula (1).
BAC indukuje in vitro cytotoxické postižení buněk trámčiny charakteristické pro apoptózu (11).
Sledované antiglaukomové léky působily inhibičně na migraci rohovkových buněk v králičím systému kultury buněčných tkání. Je však nepravděpodobné, že povrch rohovky by mohl být v klinické praxi vystaven takové koncentraci těchto látek (12).
Poškození oka konzervačními látkami je částečně reverzibilní. Vždy by měly být brány v úvahu pacientovy subjektivní stesky. Kapky bez konzervačních činidel by měly být při preskripci preferovány. V dotazníkové akci 125 oftalmologů se vyjádřilo 919 glaukomatiků (15).
Vzorky ze spojivky získané biopticky u 124 pacientů po filtrační operaci glaukomu byly vyšetřeny světelnou biomikroskopií. Mnohočetná antiglaukomová terapie způsobuje známky subklinického zánětu, více rozvinuté změny jsou po 3 letech léčby (6).
Při monitorování prevalence OSD (ocular surface disease), chorobných změn očního povrchu u glaukomatiků, pomocí Schirmerova testu, rohovkového a spojivkového barvení lisaminovou zelení a slzného break-up času bylo zjištěno, že u pacientů s glaukomem a oční hypertenzí se velmi často vyskytují známky OSD, a to minimálně na 1 oku. Koexistence OSD a léčby očními kapkami s podílem BAC může být příčinou zhoršení kvality života (14).
Koncentrace 0,007 % BAC působí na kulturách epitelových buněk do 2 minut lýzu v 50 % (17).
Závěr
Non-compliance je bezpochyby jedním z hlavních limitujících faktorů v medikamentózní léčbě glaukomu. Podílí se na případech zhoršení zrakových funkcí u glaukomatiků až ve 20 %. Procentuální rozpětí výskytu non-compliance u pacientů s glaukomem v literatuře značně kolísá – 5–80 % (13). Dobrou spolupráci pacienta v léčebném režimu lze dosáhnout například správnou edukací, motivací, optimalizací časového schématu aplikace léčby, zlepšením dostupnosti lékařské péče, stanovením terapie s ohledem na kvalitu pacientova života, dobrým vztahem lékaře a pacienta. Indikace takové léčby, kterou pacient bude dobře tolerovat, je samozřejmým předpokladem úspěchu. Léčba očními kapkami bez konzervačních činidel je významným přínosem v tomto úsilí.
MUDr. Petr Výborný, CSc., FEBO
Oční klinika 1. LF UK a ÚVN
U Vojenské nemocnice 1200
169 00 Praha 6
e-mail: petr.vyborny@uvn.cz
Sources
1. Ayaki M, Iwasawa A: Cytotoxicity of prostaglandin analog eye drops preserved with benzalkonium chloride in multiple corneoconjunctival cell line. Clinical Ophthalmology, 2010, 4 : 919–924.
2. Ayaki M., Iwasawa A., Inoue Y: Toxicity of antiglaucoma drugs with and without BAK to cultured human corneal endothelial cells. Clinical Ophthalmology 2010, 4 : 1217–1222.
3. Baudoin C., Liang H., Hazard P. et al.: The ocular surface of glaucoma patients treated over the long term expresses inflammatory markers related to both T‑helper 1 and T-helper 2 pathways. Ophthalmology, 115, 2008 : 109–115.
4. Baudoin, Ch., Labbe A., Homg L. et al: Preservatives in eye drops: the good, the bad and the ugly. Progress in Retina and Eye Research (17 March 2010) doi:10.1016/j.preteyres.2010.03.001 Key: citeulike: 6879370.
5. Brasnu E., Brignole-Baudoin F., Riancho L. et al.: In vitro effects of preservative-free tafluprost and preserved latanoprost, travoprost, bimatoprost in conjunctival epithelial cell line. Curr Eye Res, 33, 2008 : 303–312.
6. Broadway D.C., Grierson I., O’Brien C., et al: Adverse effects of topical antiglaucoma medication. Arch Ophthalmol, 112,1994,11 : 1437–1445.
7. Debbasch C., Pisella P.J., De Saint Jean J.M., et al.: Mitochondrial activity and glutathione injury in apoptosis induced by unpreserved and preserved beta-blockers on Chang conjunctival cells. Invest Ophthalmol Vis Sci, 42, 2001 : 2525–2533.
8. De Saint Jean M., Brignole F., Briguier A.F. et al.: Effects of benzalkonium chloride on growth and survival of Chang conjunctival cells. Invest Ophthalmol Vis Sci, 40, 1999 : 619–630.
9. Guenoun JM, Baudoin C., Rap P., et al.: In vitro comparison of cytoprotective and antioxidative effect of latanoprost, travoprost, and bimatoprost on conjunctiva-derived epithelial cells. Invest. Ophthalmol Vis Sci, 46, 2005 : 4594–4599.
10. Guenoun JM, Baudoin, C., Rap, P. et al.: In vitro study of inflammatory potential and toxicity profile of latanoprost, travoprost and bimatoprost in conjunctiva-derived epithelial cells. Invest Ophthalmol Vis Sci 46,2005 : 2444–2450.
11. Hamard P., Debbasch C., Brignole F., et al.: Toxicity of preserved and unpreserved antiglaucoma eye drops on human cultured trabecular cells. Invest Ophthalmol Vis Sci, 43, 2002: E-Abstract 1035.
12. Hirano S., Sagara T., Sizuki K., et al.: Inhibitory effects of antiglaucoma drugs on corneal epithelium migration in rabbit organ culture system. J Glaucoma, 13, 2004,3 : 196–199.
13. Krieglstein G.K.: Is compliance a barrier? European Glaucoma Society Meeting, Madrid 2010, Abstracts MS7.1.
14. Leung, E.W., Medeiros F., Weinreb R.N: Prevalence of ocular surface disease in glaucoma patients. J Glaucoma, 17, 2008, 5 : 350–355.
15. Levrat F., Pisella PJ, Baudoin C.: Clinical tolerance of antiglaucomas eyedrops with and without a preservative. Results of an unpublished survey in Europe. J Fr Ophtalmol, 22, 1999, 2 : 186–91.
16. Liang H., Baudoin G., Pauly A. et al.: Conjunctival and corneal reactions in rabbits following short-and repeated exposure to preservative-free tafluprost, commercially available latanoprost and 0,02% benzalkonium chloride. Br J Ophthalmol, 92, 2008 : 1275–1282.
17. Takahashi N.: Quantitative cytotoxicity of preservatives evaluated in cell culture with Changęs human conjunctival cells – effect of temperature on cytotoxicity. Jpn J Ophthalmol, 26, 1982 : 234–238.
18. Van Bijsterveld O.P., Lemp M.A., Spinelli D.R.M., et al.: The effect of different benzalkonium chloride in concentrations on human normal ocular surface: a controlled prospective impression cytology study. In: van Bijsterveld O.P., Lemp M.A., Spinelli D. (Eds) The lacrimal system. Amsterdam, Kugler, 1991, 89–91.
19. Výborný, P., Sejčková L.: Antiglaukomatika – obsah konzervačních látek a spolupráce pacienta v léčebném režimu. Čes Slov Oftal, 62, 2006, 5 : 270–274.
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2011 Issue 2-
All articles in this issue
- Keratoconjunktivitis sicca (KCS) při folikulární konjunktivitidě u dospělých pacientů s etiologií Chlamydia pneumoniae (souhrnná dvanáctiletá studie)
- Visual Functions and Quality of Life in Patients with Keratoconus
- EPI-LASEK – Our Experience
- Comparison of Topic Mydriasis and Mydriasis Achieved by Soaked Cellulose in the Conjunctival Sac
- Benzalkonium Chloride Daily Dose – an Important Criterion in Glaucoma Treatment
- Ocular Signs and Symptoms after Scoliosis Surgery (a Case Report)
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Benzalkonium Chloride Daily Dose – an Important Criterion in Glaucoma Treatment
- Ocular Signs and Symptoms after Scoliosis Surgery (a Case Report)
- Visual Functions and Quality of Life in Patients with Keratoconus
- Keratoconjunktivitis sicca (KCS) při folikulární konjunktivitidě u dospělých pacientů s etiologií Chlamydia pneumoniae (souhrnná dvanáctiletá studie)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

