-
Medical journals
- Career
Využití moderních vyšetřovacích metod k časné diagnostice pigmentového glaukomu a syndromu pigmentové disperze
: J. Lešták; E. Nutterová; Š. Pitrová
: Oční klinika JL, V Hůrkách 1296/10, Praha, primář MUDr. Ján Lešták, CSc., MBA
: Čes. a slov. Oftal., 66, 2010, No. 2, p. 55-60
: Original Article
Cíl:
Pomocí moderních vyšetřovacích postupů zjistit, zda lze stanovit poškození zrakových funkcí typických pro glaukom u syndromu pigmentové disperze (SPD) dříve, než klasickými metodami, a zda se pigmentový glaukom (PG) liší v poškození zrakových funkcí od primárního glaukomu s otevřeným úhlem (POAG).Soubor a metodika:
Sledovaný soubor 21 osob (celkem vyšetřeno 34 očí) byl rozdělen do 4 skupin, z nichž jednu skupinu (označená jako 1. skupina) tvořili zdraví jedinci a 3 ostatní byly rozděleny podle typu onemocnění. První skupinu tvořilo 10 očí 5 zdravých osob (1 žena ve věku 50 let a 4 muži ve věku 23–45 let). Průměrná refrakce byla v této skupině = 0,25 dioptrií. Do druhé skupiny bylo zařazeno 10 očí 7 nemocných s SPD (z nichž byly 2 ženy ve věku 55 a 56 let a 5 mužů ve věku 27–46 let). Průměrná refrakce byla v této skupině = 2,85 dioptrií. Třetí skupinu tvořilo 9 očí 6 nemocných s PG (3 ženy ve věku 50–56 let a 3 muži ve věku 21–49 let). Průměrná refrakce byla v této skupině = 5 dioptrií. Čtvrtou skupinu zahrnovalo 5 očí 3 nemocných (1 žena ve věku 44 let a 2 muži ve věku 35 a 50 let) s POAG. Průměrná refrakce byla v této skupině = 1 dioptrie. Věková struktura ve všech skupinách byla srovnatelná.
U sledovaného souboru 21 osob (34 očí) byla zjištěna refrakce, zraková ostrost (ETDRS optotypy), gonioskopie (byla hodnocena dle Spaethe), nitrooční tlak (bezkontaktním přístrojem Canon TX 10 a aplanačně přístrojem Inami), zorné pole (přístrojem Medmont M700), vrstva nervových vláken (GDx – VCC), objem makuly – MV (OCT Stratus), PR-ERG a PR-VEP (Retiscan podle metodiky ISCEV).Výsledky:
Bylo provedeno statistické vyhodnocení výsledků vzájemného srovnání mezi jednotlivými skupinami s těmito výstupy:Kontrolní skupina versus skupina se SPD:
statisticky významné rozdíly byly zjištěny u GDx a MV. Statisticky nejvýznamnější byly rozdíly v amplitudách PR-ERG i PR-VEP (t = 28, resp.18,254 proti tabelované hodnotě 2,845).Kontrolní skupina versus skupina s PG:
statisticky významné rozdíly byly zjištěny u GDx, MV i amplitud PR-ERG a PR-VEP.Kontrolní skupina versus skupina s POAG:
statisticky významné rozdíly byly zjištěny u GDx a MV. Statisticky nejvýznamnější byl rozdíl v amplitudě PR-VEP (t = 63,973 proti tabulkové hodnotě 3,012).Skupina se SPD versus skupina s PG:
statisticky významné rozdíly byly zjištěny jak u GDx tak MV. Statisticky nejvýznamnější byl rozdíl v amplitudě PR-VEP (t = 36,75 proti tabulkové hodnotě 2,898).Závěr:
Pomocí moderních diagnostických technik lze odlišit SPD od PG. Statisticky významné rozdíly byly jak u GDx, tak i u MV. Největší rozdíl vykázaly PR-ERG a PR-VEP. Diferencované zpomalení vedení vzruchů ve zrakových vyvolaných odpovědích, které se vyskytuje u PG i u PDS, může svědčit pro úzký vztah obou onemocnění. Proto je vhodné nemocné s PDS dispenzarizovat jako glaukomatiky.Klíčová slova:
syndrom pigmentové disperze, pigmentový glaukom, primární glaukom s otevřeným úhlem, časná diagnostika, NFI, MV, PR-ERG, PR-VEPÚvod
Syndrom pigmentové disperze (SDP) je onemocnění, které vzniká v důsledku uvolnění pigmentu z pigmentového epitelu duhovky a jeho ukládání na strukturách předního segmentu. Akumulace pigmentových granulí v trabekulární trámčině vede poté ke vzniku progresivní trabekulární dysfunkce a nitrooční hypertenze, někdy ve spojení s glaukomovou optickou neuropatií [19,20]. Onemocnění začíná nejčastěji ve 3.–4. dekádě života a je důležitou, často nediagnostikovanou příčinou ztráty vidění u mladých osob [19].
Pigmentový glaukom (PG) je relativně vzácný typ sekundárního glaukomu s otevřeným úhlem. V roce 1949 Sugar a Barbour [26] popsali dva mladé muže s myopií, Krukenbergovým vřeténkem, hyperpigmentací trabekulární trámčiny a otevřeným komorovým úhlem, u kterých došlo k elevaci nitroočního tlaku v mydriáze. Jeho snížení nastalo po aplikaci pilokarpinu. Další studie objasnily typické rysy tohoto onemocnění včetně oboustranného postižení, častého spojení s myopií a vyšším výskytem u mladých osob.
SPD a PG jsou následná stadia téhož chorobného procesu, ale literární údaje se liší v tom, u kolika procent pacientů se SPD mění na PG. Rané studie uváděly 6 %, Schie a Cameron asi 25,6 % [24] a Lehto a Vesti 20 % [15]. Pacienti postižení SPD jsou převážně muži, myopové, ve 3. – 4. [19] nebo až 5. dekádě života. Poměr mužů a žen je přibližně 5 : 1. Z mnoha studií vyplývá, že muži s SPD mají prokazatelně vyšší riziko vzniku PG, i když důvod není zcela jasný [24, 27]. U žen je vznik klinických známek, typických pro SPD, pozvolnější a příznaky vznikají přibližně o 10 let později než u mužů. Též průměrný věk pacientek s PG je asi o 14 let vyšší než u mužů [5]. U žen se předpokládá určitý hormonální ochranný efekt.
Typickou triádu klinických diagnostických příznaků SPD tvoří: Krukenbergovo vřeténko, radiální transiluminační defekty ve střední periferii duhovky a pigmentová deposita v trabekulární trámčině. Všechny klinické příznaky vznikají v důsledku uvolnění pigmentu ze zadního pigmentového listu duhovky a jeho kumulací na strukturách předního segmentu. Klíčový význam má přitom duhovka a její postavení. Je známo, že periferní část duhovky má u SPD a PG konkávní konfiguraci a je ukotvena do ciliárního tělíska více posteriorně. Tato anatomická zvláštnost je příčinou toho, že se pigmentový epitel duhovky a zonulární aparát čočky k sobě více přiblíží [19]. V roce 1979 Campbell [6] zjistil, že mechanický kontakt mezi konkávní zadní plochou duhovky a předním zonulárním svazkem je odpovědný za uvolnění pigmentových granulí z pigmentového epitelu duhovky. Další abnormitou duhovky je u SPD hyperplasie dilatátoru zornice a tzv. svalové ostruhy u kořene duhovky, které podle Campbella odpovídají oblastem iridozonulárního tření. Z práce Moroie a spol. [16] vyplývá, že dlouhé přední zonuly, upínající se do centra čočky, mohou také způsobit mechanickou disrupci pigmentového epitelu duhovky v její centrální části a vést k pigmentové disperzi. Pohyb zadní plochy konkávní duhovky podél předních zonulárních svazků způsobí narušení pigmentového epitelu duhovky podél radiálně orientovaných duhovkových vláken, což vede ke vzniku transiluminačních defektů ve střední periferii duhovky patrných při vyšetření štěrbinovou lampou. Tento nález je patognomický pro SPD a odlišuje toto onemocnění od ostatních stavů spojených s akumulací pigmentu v trámčině duhovky. Kumulace pigmentu v oblasti drenážní zóny komorového úhlu snižuje propustnost trabekulární trámčiny [22]. Poškození trabekulárního endotelu a dysfunkce trámčiny později vedou k elevaci nitroočního tlaku. Nitrooční hypertenze nebo glaukom vzniká u 30–50 % pacientů s SPD [19]. Recentní histologické práce ukazují na ztrátu trabekulárních buněk, fúzi trabekulárních lamel s kolabovanými intertrabekulárními prostory, zvýšení extrabuněčného materiálu a obliteraci Schlemova kanálu u SPD a PG [12].
Z hlediska původu se onemocnění často vyskytuje v kavkazské populaci [19]. Není běžným nálezem u osob asijského původu a ve své typické formě ani u osob původu afrického. Volně plovoucí melanin v přední komoře, který je u typické formy SPD možné vidět ve fázi aktivního uvolňování pigmentu z pigmentového listu duhovky, může být u osob afrického původu normálním nálezem a nesouvisí s SPD [3]. Naproti tomu u pacientů afrického původu mohou chybět některé klinické známky typické pro SPD: transiluminační defekty a pigmentace endotelu rohovky. Další studie potvrdila atypickou formu u afričanů, která je charakterizována predominancí žen, hypermetropů a sytou pigmentací endotelu rohovky a přední plochy čočky [21].
PDS je považován za autosomálně dědičné onemocnění s neúplnou penetrací. Gen, který je za jeho vznik odpovědný, se nachází na chromosomu 7q35–q36 [2]. Pouze u 30 % osob s tímto genem ale dochází k vývoji PG. Předpokládá se, že u osob s SPD se na vzniku PG podílí více faktorů, včetně dalších genetických [7]. Myopie je velmi důležitou diagnostickou známkou u SPD a je přítomna asi u 90 % pacientů s SPD [8, 20]. Stupeň myopie je též významným rizikovým faktorem pro vznik PG v mladším věku. Klinický průběh u těchto pacientů bývá často těžší. SPD i PG jsou oboustranná, často asymetrická onemocnění, u nichž bylo zjištěno, že výraznější klinický nález je zpravidla u oka s vyšší refrakční vadou [4, 10]. U pacientů s SPD nebo PG je zvýšené riziko vzniku sítnicových změn (asi u 2–3 % osob). Předpokládá se, že trhliny sítnice a mřížková degenerace i retinoschisa se ve srovnání s věkem a refrakcí odpovídající kontrolní skupinou vyskytují u pacientů s SPD dvakrát častěji. I když je známo, že mřížková degenerace je častým nálezem u myopie, myopové se SPD mají větší prevalenci sítnicových degenerací než myopové bez SPD [28]. Byl také popsán úzký vztah mřížkové degenerace u pacientů s glaukomem primárního i sekundárního typu s otevřeným úhlem, zejména ve spojení s myopií [18].
Cílem práce je zjistit, zda lze pomocí moderních vyšetřovacích postupů stanovit u SPD poškození zrakových funkcí typických pro glaukom dříve, než klasickými metodami, a zda se PG liší v poškození zrakových funkcí od primárního glaukomu otevřeného úhlu (POAG).
Soubor a metodika
Sledovaný soubor 21 osob (celkem vyšetřeno 34 očí) byl rozdělen do 4 skupin, z nichž jednu skupinu (označená jako 1. skupina) tvořili zdraví jedinci a tři ostatní byly rozděleny podle typu onemocnění. Souhrnné údaje o sledovaném souboru jsou uvedeny v tabulce 1.
1. Souhrnné údaje o sledovaném souboru pacientů 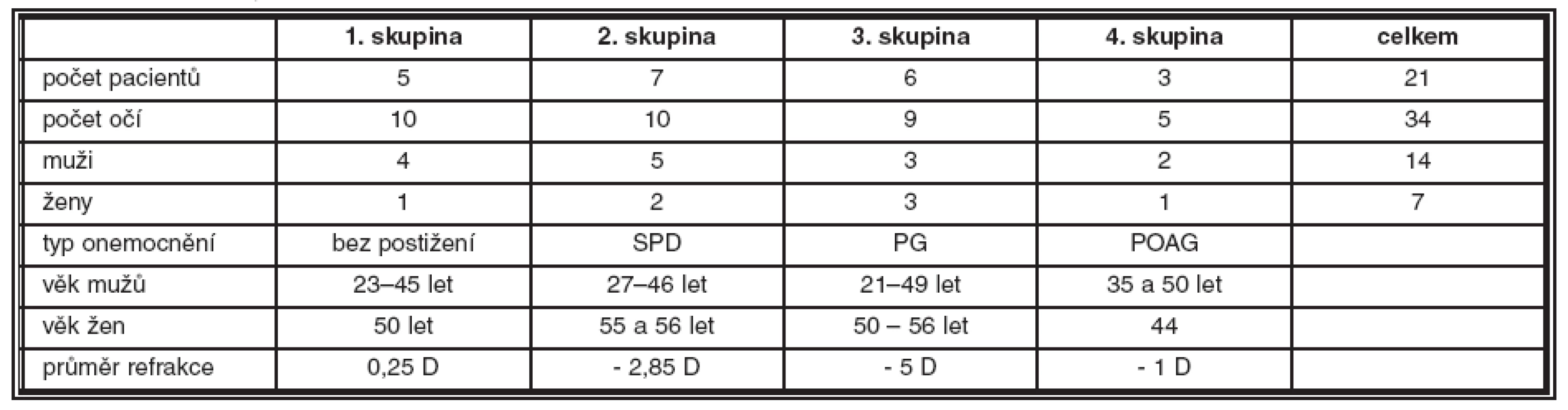
Jak z tabulky 1 vyplývá, první skupinu tvořilo 10 očí 5 zdravých osob (1 žena ve věku 50 let a 4 muži ve věku 23–45 let). Průměrná refrakce byla v této skupině = 0,25 dioptrií. Do druhé skupiny bylo zařazeno 10 očí 7 nemocných s SPD (2 ženy ve věku 55 a 56 let a 5 mužů ve věku 27–46 let). Průměrná refrakce byla v této skupině = 2,85 dioptrií. Třetí skupinu tvořilo 9 očí 6 nemocných s PG (3 ženy ve věku 50–56 let a 3 muži ve věku 21–49 let). Průměrná refrakce byla v této skupině = 5 dioptrií. Čtvrtou skupinu zahrnovalo 5 očí 3 nemocných (1 žena ve věku 44 let a 2 muži ve věku 35 a 50 let) s POAG. Průměrná refrakce byla v této skupině = 1 dioptrie. Věková struktura ve všech skupinách byla srovnatelná.
U sledovaného souboru 21 osob (34 očí) byl zjištěn vizus (měřeno na ETDRS optotypech) a refrakce (součet sférické a cylindrické myopické refrakce). Naše snaha byla zařadit do každé skupiny osoby se stejnou nebo podobnou refrakcí. Z důvodu abnormalit v PR-ERG nebyli do souboru zařazeni nemocní s hypermetropickou refrakcí. Dále byl změřen nitrooční tlak bezkontaktním přístrojem Canon TX 10, ve sporných případech aplanačně přístrojem Inami. Při gonioskopii bylo hodnocení prováděno dle Spaethe (25). Zorné pole bylo vyšetřeno přístrojem Medmont M700, hodnocen pattern defekt (vzorový defekt –PD). Vrstva nervových vláken byla měřena přístrojem GDx – VCC, přičemž hlavní důraz byl kladen na posouzení parametru NFI. Objem makuly (MV) byl zjišťován přístrojem OCT Stratus a vyjádřena v objemových jednotkách (mm3). PR-ERG a PR-VEP byly vyšetřeny přístrojem Retiscan podle metodiky ISCEV [13, 17]. U PR-ERG byly hodnoceny latence P50 a N95 ms a amplituda kmitu P50 – N95, u PR-VEP latence P100, amplituda A1 (N70-P100) i A2 (P100-N140) a rovněž tvar této křivky.
Naměřené výsledky byly podrobeny statistické analýze (Studentův t-test) Vzájemně byly srovnány výsledky NFI, MV a amplitudy PR-ERG i PR-VEP. Párové soubory srovnávaných skupin byly hodnoceny párovým t-testem, nepárové soubory nepárovým t-testem. Výsledky byly porovnány s tabulkovými hodnotami na různých úrovních významnosti. Vzhledem k minimálním změnám v zorném poli nebyly výsledky perimetrického vyšetření podrobeny statistické analýze.
Výsledky
Získané výsledky jsou souhrnně uvedeny v tabulkách 2, 3, 4 a 5. Tabulka 2 obsahuje údaje od zdravých jedinců a představuje kontrolní skupinu. V tabulce 3 jsou souhrnné výsledky od pacientů se syndrom pigmentové disperze (SPD). Tabulka 4 zobrazuje výsledky vyšetření u nemocných s pigmentovým glaukomem (PG). V tabulce 5 jsou představeny výsledky vyšetření od pacientů s primárním glaukomem s otevřeným úhlem (POAG).
2. Kontrolní skupina zdravých osob, souhrnné výsledky jednotlivých typů vyšetření v kontrolní skupině 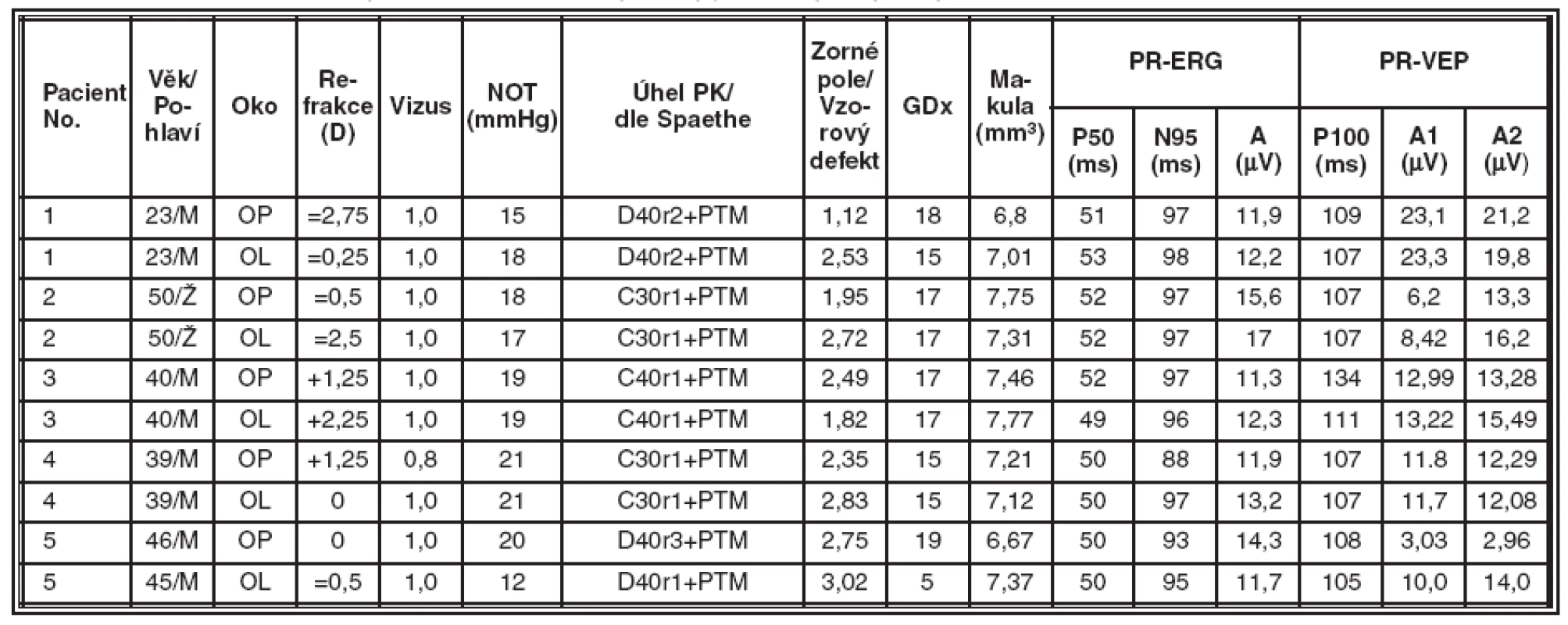
3. Skupina nemocných se Syndromem pigmentové disperze (SPD), souhrnné výsledky jednotlivých typů vyšetření v této skupině 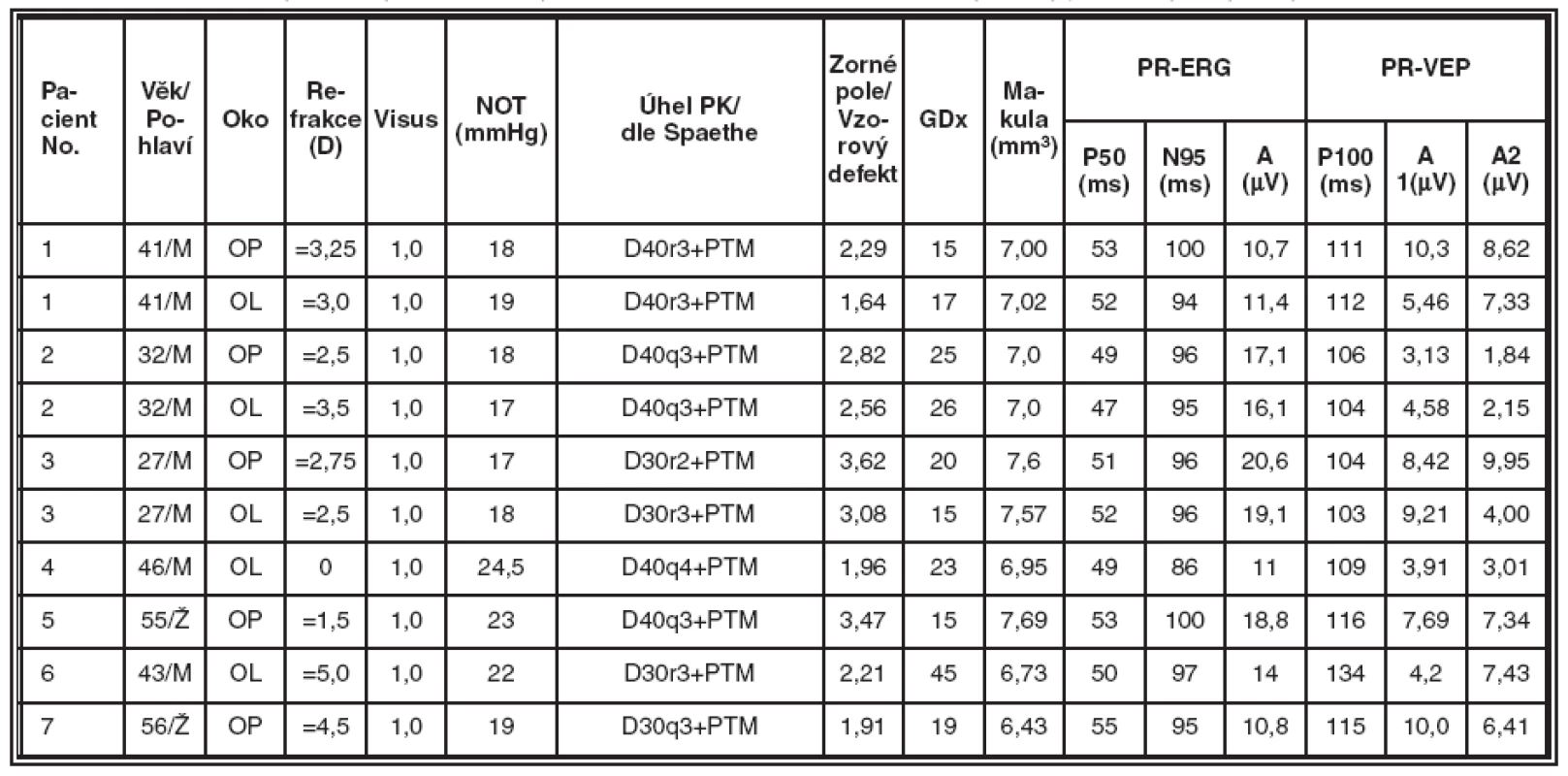
4. Skupina nemocných s pigmentovým glaukomem (PG), souhrnné výsledky jednotlivých typů vyšetření v této skupině 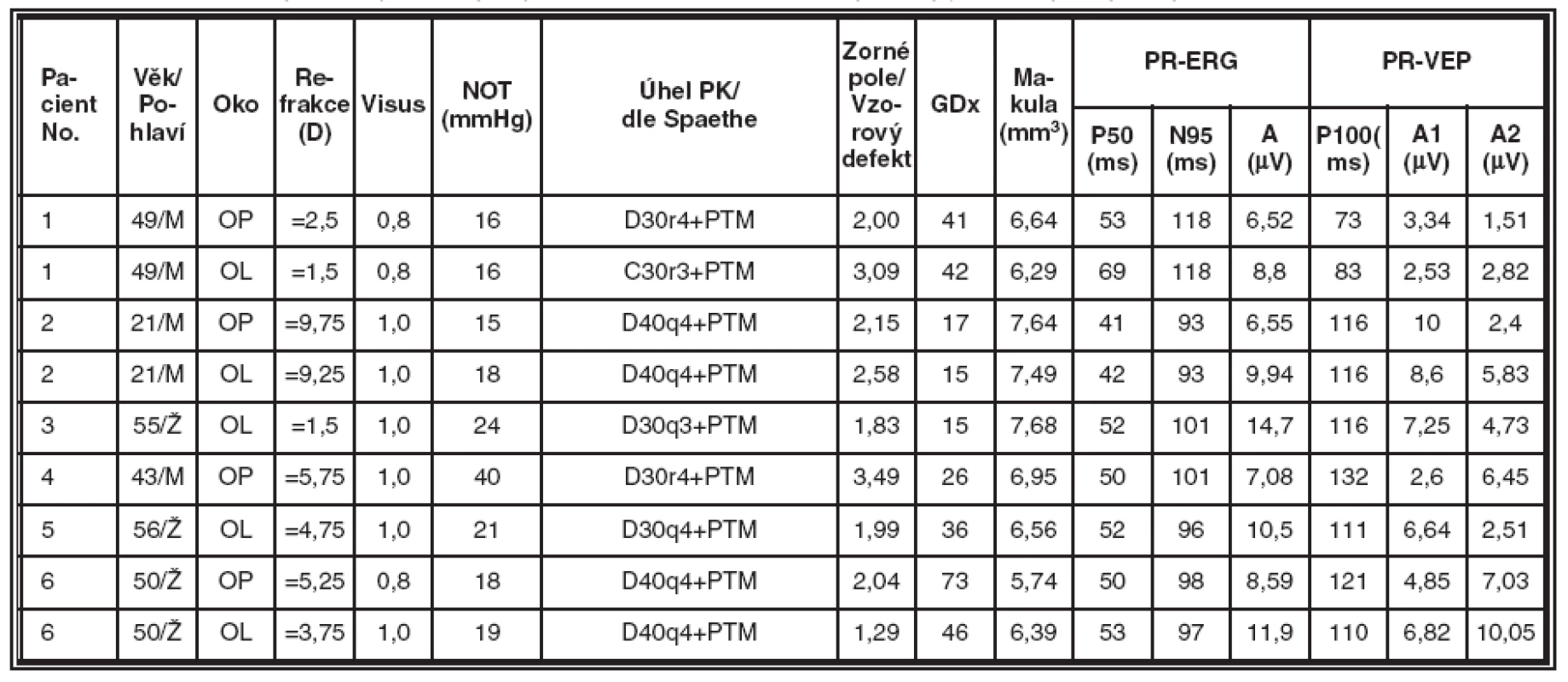
5. Skupina nemocných s primárním glaukomem s otevřeným úhlem (POAG), souhrnné výsledky jednotlivých typů vyšetření v této skupině 
Věk žen s PG a SPD byl o 10 a více let vyšší než u mužů v obou skupinách, zatímco věk obou pohlaví u pacientů s POAG byl vyrovnaný. Při posuzování komorového úhlu bylo použito hodnocení dle Spaethe, které by mělo minimalizovat subjektivitu vyšetření. Komorový úhel byl u pacientů všech sledovaných skupin široký. Kořen duhovky byl u zdravých osob z kontrolní skupiny i skupiny s POAG plochý, u pacientů s PG a SPD konkávní, maximálně plochý. Také pigmentace trabekula byla výrazně sytější u pacientů s SPD a PG, což je jedním z charakteristických znaků obou nemocí. Rovněž asymetrie stupně pigmentace trámčiny obou očí téhož pacienta je pro tato dvě onemocnění typická. Pacienti s SPD i PG byli vesměs myopové.
Protože změny v zorném poli našich pacientů s SPD a PG byly minimální, byl pro jejich hodnocení vybrán vzorový pattern-defekt (PD). Ten udává index poklesu citlivosti v daném bodě a jeho sousedních bodech. Pokud je v daném místě pokles citlivosti pouze v jednom bodě, je závažnost poruchy menší než v místě, kde je pokles citlivosti v několika bodech. Ve srovnání se skupinou nemocných s POAG byl nález v zorném poli pacientů s SPD i PG minimální.
Statistické vyhodnocení výsledků vzájemného srovnání mezi jednotlivými skupinami:
Kontrolní skupina versus skupina se SPD
GDx statisticky významný rozdíl 0,01% na hladině významnosti
MV 0,02 %
Amplituda PR-ERG 0,01 %
A2 amplituda PR-VEP 0,01 %
statisticky nejvýznamnější byly rozdíly v amplitudách PR-ERG i PR-VEP (t=28, resp.18,254 proti tabelované hodnotě 2,845).Kontrolní skupina versus skupina s PG
GDx statisticky významný rozdíl 0,01% na hladině významnosti
MV 0,01 %
Amplituda PR-ERG 0,01 %
Amplituda A2 PR-VEP 0,01 %Kontrolní skupina versus skupina s POAG
GDx statisticky významný rozdíl 0,01% na hladině významnosti
MV 0,01 %
Amplituda PR-ERG 0,01 %
A2 amplituda PR-VEP 0,01 %
statisticky nejvýznamnější byl rozdíl v amplitudě PR-VEP (t = 63,973 proti tabulkové hodnotě 3,012).Skupina se SPD versus skupina s PG
GDx statisticky významný rozdíl na 0,01% hladině významnosti
MV 0,01 %
Amplituda PR-ERG 0,01 %
A2 amplituda PR-VEP 0,01 %
statisticky nejvýznamnější byl rozdíl v amplitudě PR-VEP (t = 36,75 proti tabulkové hodnotě 2,898).Skupina s PG versus skupina s POAG
GDx statisticky významný rozdíl na 0,01% hladině významnosti
MV nebyl zjištěn statisticky významný rozdíl
Amplituda PR-ERG statisticky významný rozdíl na 0,01% hladině významnosti
A2 amplituda PR-VEP 0,01 %
statisticky nejvýznamnější byl rozdíl ve vrstvě nervových vláken – GDx (t = 34,8 proti tabulkové hodnotě 3,055).Diskuse
SPD lze bez použití speciálních technik diagnostikovat biomikroskopicky na štěrbinové lampě. Při zjištění nálezu na předním segmentu je pak nutno rozhodnout, zda se jedná „jen o disperzi pigmentu“, kterou je nutno sledovat, nebo již počínající glaukomové onemocnění. Časné stanovení diagnózy glaukomu je důležité z hlediska pozdějších nevratných morfologických a funkčních změn.
Změny v zorném poli dnes již nepatří mezi diagnostické techniky časného glaukomového poškození. Až ztráta 25 až 35% gangliových buněk sítnice vede ke statisticky významným změnám ve statické automatické perimetrii [16]. Předejít tomuto obrovskému výpadku gangliových buněk sítnice, který se již odrazí změnami v zorném poli, se snažily diagnostické techniky zobrazení vrstvy nervových vláken hlavně v okolí terče zrakového nervu, kde je jejich hustota největší. A to v období, kdy bylo zjištěno, že změny ve vrstvě nervových vláken předcházejí perimetrickým změnám až o 6 let [1].
Vyšetření vrstvy nervových vláken v bezčerveném světle, které bylo zpočátku populární, jsme z důvodů nízké specificity a senzitivity neprováděli. Histologicky bylo prokázáno, že při tomto vyšetření lze diagnostikovat až 50 % degenerovaných, difuzně lokalizovaných nervových vláken, což nebylo prokazatelné v bezčerveném světle. K axonální diagnostice na terči a kolem něj jsme použili laserový polarimetr GDx s rohovkovým kompenzátorem. Senzitivita tohoto vyšetření se pohybuje od 72–82 % a specificita od 56–82 % [28]. Za suspektní hodnoty při tomto vyšetření jsou výrobcem doporučovány hodnoty NFI nad 30. Jak jsme zjistili u našich nemocných, statisticky významný rozdíl mezi kontrolní skupinou zdravých jedinců a skupinou se SPD ještě nepotvrdilo glaukomové onemocnění. Jen v jednom případě jsme zaznamenali NFI nad 30 (tabulka 3). Největší statistický rozdíl jsme zjistili při srovnání skupiny s PG proti skupině s POAG. Tento velký rozdíl přičítáme právě časné diagnostice pigmentového glaukomu.
Degenerací axonů a gangliových buněk po celé sítnici dochází ke snížení celé její tloušťky. Z celkového počtu gangliových buněk sítnice je jich v centrální krajině umístěno až 50 %. Při apoptóze gangliových buněk a atrofii jejich axonů u glaukomu lze zaznamenat největší pokles tloušťky právě v makule. Ke změření MV v přesně stanoveném rozsahu jsme použili vyšetření pomocí OCT Stratus. Naše výsledky jsou podobné literárním [34]. V našem souboru byl mezi kontrolní skupinou a skupinou se SPD rozdíl na úrovni 0,02 %. V ostatních skupinách na úrovni 0,01 %. Při srovnání skupiny s POAG se skupinou s PG jsme statisticky významný rozdíl nezaznamenali.
Význam elektrofyziologických vyšetření u glaukomu je znám již od doby, kdy se zjistilo, že ve vzorovém ERG se objevuje i odpověď gangliových buněk sítnice [9]. U experimentálního glaukomu změny v ERG (pokles amplitud až o 50 %) předcházely změnám ve vrstvě nervových vláken [11]. Tento a jiné poznatky nás vedly k využití elektrofyziologických technik (PR-ERG) k časné diagnostice glaukomového onemocnění. Změny axonální a následně i v oblasti podkorových a korových zrakových ústředí mozku lze verifikovat pomocí vyvolaných zrakových skalpových odpovědí (PR-VEP). Ze srovnání výsledků vyšetření v námi sledovaných skupinách je zajímavé, že největší statistický rozdíl mezi kontrolní skupinou a skupinami s PG a POAG jsme zaznamenali právě vyšetřením PR-ERG a PR-VEP. Velmi důležité je zjištění, že kromě poklesu amplitud, hlavně PR-VEP, měla křivka jak u SPD, tak u PG kvalitativně jiný průběh. V elektrofyziologii se tento typ křivky označuje jako „diferencované zpomalení vedení vzruchů“ a je typický pro některé druhy optické neuritidy nebo demyelinizace. Také se dá pozorovat u ischemických lézí zrakového nervu. Podobný nález jsme u primárních nebo jiných glaukomů prozatím nezaznamenali.
Závěr
1. Pomocí moderních diagnostických technik lze odlišit SPD od PG. Diferencované zpomalení vedení vzruchů ve vyvolaných zrakových odpovědích, které se vyskytuje u PG i u SPD, může svědčit pro úzký vztah obou onemocnění. Proto je vhodné nemocné s PDS dispenzarizovat jako glaukomatiky.
2. Pacienti s SPD i PG jsou převážně myopové, kteří díky své refrakční vadě navštěvují oftalmologa pravidelně, respektive přicházejí na kontrolní vyšetření dříve než emetropové. Tím je dána větší pravděpodobnost odhalení charakteristických diagnostických znaků pro SPD a tím i předcházení vzniku glaukomových změn.
MUDr. Ján Lešták, CSc., FEBO, MBA
Privátní oční klinika JL
V Hůrkách 1296/10, 158 00 Praha 5
E-mail: lestak@seznam.cz
Sources
1. Airaksinen, P.J., Drance, S.M.: Neuroretinal rim area and retina nerve fiber layer in glaucoma. Arch. Ophthalmol. 1985, 103, 2, s. 203–204
2. Andersen, J.S. et al.: A gene responsible for the pigment dispersion syndrome maps to chromosome 7q35-q36. Arch. Ophthalmol. 1997, 115, 3, s. 384–388
3. Balaboa, O.E., Mudroch, I.E.: Free floating melanin particles in anterior chamber: a normal finding in African eyes. Eye. 2003, 17, 3, s. 410–4.
4. Berger, A., Ritech, R., McDermott: Pigmentary dispersion, refraction and glaucoma. Invest. Ophthal. Vis. Sci. 1987, 28 (suppl.), s. 134
5. Bick, M.W.: Sex differences in pigmetary glaucoma. Am. J. Ophthalmol. 1962, 54, 11, s. 831–837
6. Campbell, D.G.: Pigmentary dispersion and glaucoma: a new theory. Arch. Ophthalmol. 1997, 97, 9, s. 1667–1672
7. Craig, J.E., Baier, P.N., Haeley, D.L., et al.: Evidence for genetic heterogenity within eight glaucoma families, with GLCA 1 G.ln 368 STOP mutations being an important phenotypic modifier. Ophthalmology 2001, 108, 9, s. 1607–1620
8. Davidson, J.A., Brubaker, R.F., Ilstrup, D.M.: Dimensions of the anterior chamber in pigment dispersion syndrome., Arch. Ophthalmol. 1983, 101, 1, s.81–83
9. Dawson, W., Maida, R., Rubin, M.: Human pattern retina evoked response are altered by optic Atrophy. Invest. Ophthal. Vis. Sci. 1982, 22, 6, s. 796–803
10. Farrar, S.M., et al.: Risk factors for the development and severity of glaucoma in the pigment dispersion syndrome. Am. J. Ophthalmol. 1989, 108, 3, s. 223–229
11. Fortune, B., Bui, B.V., Johnson, E.C., et al.: Selective ganglion cell functional loss in rats with experimental glaucoma. Invest. Ophthal. Vis. Sci. 2004, 45, 6, s. 1854–1862
12. Gottanka, J., Johnson, D.H., Grehn, F., Lütjen-Drecoll, E.: Histologic findings in pigment dispersion syndrome and pigmentary glaucoma. J. Glaucoma, 2006, 15, 2, s. 142–-151
13. Holder, G.E., Brigell, M.G., Hawlina, M., et al: ISCEV standard for clinical pattern electroretinography—2007 update. Doc Ophthalmol. 2007, 114, 3, s.111–116
14. Kerrigan-Baumrid, L.A., Quigley, H.A., Pease, M.E., et al.: Numer of ganglion cells in glaucoma eyes compared with threshold field tests in the same person. Invest. Ophthal. Vis. Sci. 2000, 41, 3, s. 741–748
15. Lehto, I., Vesti, E.: Diagnosis and management of pigmenary glaucoma. Curr. Opin. in Ophthal. 1998, 9, 2, s. 61–64
16. Moroi, S.E., Lark, K.K., Sieving, P.A., et al.: Long anterior zonules and pigment dispersion. Am. J. Ophthalmol. 2003, 136, 6, s. 1176–8
17. Odom, J.V., Bach, M., Brigell, M., et al.: ISCEV standard for clinical visual evoked potential (2009 update Doc Ophthalmol. 2010, 120, 1, s.111–119
18. Rahimi, M.: Relationship between retinal lattice and open angle glaucoma. Med. Hypotheses. 2005, 64, 1, s. 86–7
19. Ritch, R.: A unification hypothesis of pigment dispersion syndrome. Trans. Am. Ophthalmol. Soc. 1996, 94, s. 381–409
20. Ritch, R., Steinberger, D., Liebmann, J.M.: Prevalence of pigment dispersion in a population undergoing glaucoma screening. Am. J. Ophthalmol. 1993, 115, 6, s. 707–710
21. Robert, D.K., Winter, J.E., Castells, D.D., et al.: Pigment strie of anterior lens capsule and age-associated pigment dispersion of variable degree in a group of older African-Americans: an age, race, and gender matched study. Int. Ophthalmol. 2001, 24, s. 313–22
22. Růžičková, E., Pitrová, Š., Šíp, L.: Možnosti léčby pigmentového glaukomu. Čs. Oftal. 1992, 48, 2, s. 81–85
23. Sanchez-Galeana, C., Bowd, C., Blumenthal, E.Z., et al.: Using optical imaging summary data to detect glaucoma. Ophthalmology 2001, 108, 10, s. 1812–1818
24. Schie, H.D., Cameron, J.D.: Pigment dispersion syndrome: a clinical study. Br. J. Ophthalmol. 1981, 65, 4, s. 264–269
25. Spaeth, G.L.: The normal development of the human chamber angle a new systém of descriptive fading. Trans Ophthalmol. Soc. UK, 1971, 91, s. 709–739.
26. Sugar, H.S., Barbour, F.A.: Pigmentary glaucoma: A rare clinical entity. Am. J. Ophthalmol. 1949, 32, 1, s. 90–92
27. Sugar, H.S.: Pigmentary glaucoma: a 25-year review. Am. J. Ophthalmol. 1966, 62, 3, s. 499–507
28. Weseley, P., Liebmann, J., Walsh, J.B., Ritch, R.: Lattice degeneration of the retina and the pigment dispersion syndrome. Am. J. Ophthalmol. 1992, 114, 4, s. 539–543
29. Wollstein, G., Ishikawa, H., Wang, J., et al.: Comparison of tree optical coherence tomography scanning areas for detection of glaucomatous damage. Am. J. Ophthalmol. 2005, 139, 1, s. 39–43
Labels
Ophthalmology
Article was published inCzech and Slovak Ophthalmology

2010 Issue 2-
All articles in this issue
- The Use of Modern Examination Methods in Early Diagnosis of Pigmentary Glaucoma and Pigmentary Dispersion Syndrome
- The ERG Contribution in Early Diagnosis of Chloroquine and Hydroxychloroquine Maculopathy
- Implantation of the Stenopeic Aniridiae Posterior Chamber Intraocular Lens after the Trauma – Yes or No?
- Treatment of Angioid Streaks with Bevcizumab
- Efficiency of Vitrectomy in Diabetic Macular Edema and Morphometry of Surgically Removed of the Internal Limiting Membrane
- The Influence of the Idiopathic Macular Hole (IMH) Surgery with the ILM Peeling and Gas Tamponade on the Electrical Function of the Retina
- The Use of Intravitreal Ranibizumab Application in the Treatment of Post-inflammatory Neovascular Membranes – a Case Report
- Czech and Slovak Ophthalmology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The Use of Modern Examination Methods in Early Diagnosis of Pigmentary Glaucoma and Pigmentary Dispersion Syndrome
- The ERG Contribution in Early Diagnosis of Chloroquine and Hydroxychloroquine Maculopathy
- The Influence of the Idiopathic Macular Hole (IMH) Surgery with the ILM Peeling and Gas Tamponade on the Electrical Function of the Retina
- Implantation of the Stenopeic Aniridiae Posterior Chamber Intraocular Lens after the Trauma – Yes or No?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

