-
Medical journals
- Career
Kognitivní poruchy u dětí s epilepsií
Authors: S. Kolář 1; J. Pejčochová 2; ; O. Horák 2; H. Ošlejšková 2
Authors‘ workplace: LF MU, Brno 1; Akademické centrum pro, epileptologii a epileptochirurgii, Klinika dětské neurologie LF MU, a FN Brno 2
Published in: Cesk Slov Neurol N 2020; 83/116(3): 243-250
Category: Review Article
doi: https://doi.org/10.14735/amcsnn2020243Overview
Epilepsie u dětí je často spojena s poruchami kognitivních funkcí, které mohou být globální povahy či zasahovat pouze některé domény. Etiologie těchto poruch může být shodná s etiologií epilepsie, avšak kognitivní deficit může způsobit i samotná terapie antiepileptiky, což je třeba vzít v potaz při výběru léčby. Pro správný management kognitivních poruch je nezbytné sledovat aktuální stav kognitivních funkcí pomocí neuropsychologického vyšetření. K dispozici je celá řada testů určená pro různé věkové skupiny hodnotící různé oblasti kognitivních funkcí, přičemž je možné použít i rychlý skríningový test monitorující vliv antiepileptik na kognitivní funkce a dynamiku kognitivních poruch. Při nalezení jakéhokoliv kognitivního deficitu je nutné pátrat po faktorech, které negativně ovlivňují kognitivní funkce a které lze správným managementem ovlivnit, např. vyšší četnost záchvatů, interiktální epileptická aktivita, nežádoucí účinky antiepileptik a některé etiologické faktory. Zvážit je potřeba i to, zda je dítě vhodným kandidátem k epileptochirurgické terapii.
Klíčová slova:
epilepsie – kognitivní poruchy – neuropsychologická vyšetření – dítě
Úvod
Děti s epilepsií často trpí poruchami kognitivních funkcí. Včasné rozpoznání kognitivní poruchy, a je-li to možné, řešení její příčiny, je v dětském věku kritické, neboť hrozí zhoršení intelektu a až mentální regres, což se v neposlední řadě projeví na zhoršení školního výkonu [1]. Z těchto důvodů je nezbytné u dětských pacientů s epilepsií provádět pravidelné neuropsychologické vyšetření umožňující kvantitativně a kvalitativně zhodnotit aktuální kognitivní výkon a jeho dlouhodobou dynamiku.
Příčina kognitivního deficitu není vždy jasná. Na kognici má negativní vliv mnoho faktorů, přičemž některé z nich jsou současně i příčinou epilepsie jako takové. Mohou to být např. nejrůznější strukturální léze mozku, vývojové vady mozku nebo genetické vlivy [2]. Na druhé straně ale nesmíme podcenit, že zhoršení kognitivního výkonu může být způsobeno rovněž např. terapií antiepileptiky, což lze do určité míry považovat za iatrogenní poškození [3]. Z tohoto důvodu je sledování kognitivního profilu součástí správného managementu epilepsie v dětství. Odborná veřejnost se v současné době na základě výsledků studií většinově přiklání k poznání, že poruchy kognitivních funkcí jsou častěji přítomny již při prvním záchvatu nebo mu předcházejí [4,5]. U většiny pacientů je tedy na místě považovat zhoršený kognitivní výkon spíše za komorbiditu epilepsie a nikoliv její důsledek [5].
Cílem této přehledové práce je shrnutí nejnovějších poznatků o kognitivních poruchách u dětí s epilepsií a představení nástrojů, které umožňují iniciální zmapování a dynamické sledování kognitivních funkcí. Jedním z cílů práce je též upozornit na možné faktory, které mohou negativně ovlivnit kognitivní výkon dětí s epilepsií.
Strukturalizace kognitivních funkcí (domény)
Etiologie epilepsií je velmi heterogenní, proto i projevy kognitivních dysfunkcí jsou variabilní [6]. Projevy kognitivního deficitu lze rozdělit na globální a doménově specifické [7].
Globální kognitivní schopnosti můžeme u dětí hodnotit pomocí Wechslerovy inteligenční škály pro děti (Wechsler Intelligence Scale for Children; WISC), která nyní existuje již v páté verzi (WISC-V, viz část zabývající se nástroji k hodnocení kognitivního výkonu). Kognitivní schopnosti lze však i specificky hodnotit v rámci jednotlivých domén definovaných diagnostickým a statistickým manuálem duševních poruch DSM-5 [8]. Ten rozděluje kognitivní domény do šesti skupin – exekutivní funkce, perceptuálně motorické funkce, jazyk, učení a paměť, sociální kognice a komplexní pozornost. Podrobná strukturalizace kognitivních domén je uvedena na obr. 1 [8].
Image 1. Kognitivní domény. Převzato, přeloženo a graficky modifikováno z [8].
Fig. 1. Cognitive domains. Originally from [8]; translated and graphically modified.![Kognitivní domény. Převzato, přeloženo a graficky modifikováno z [8].<br>
Fig. 1. Cognitive domains. Originally from [8]; translated and graphically modified.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/722bf059268e20bad77e3f38668ca567.png)
Aby bylo možné zhodnotit zasažené domény, a stanovit tak neurokognitivní profily dětí s epilepsií, je třeba u populace těchto pacientů provést specifické psychologické testy zkoumající co největší spektrum kognitivních funkcí, pokud možno s porovnáním se zdravou kontrolní skupinou. Mnoho dřívějších studií se zaměřovalo pouze na děti se zjištěným kognitivním deficitem, ale nebralo v potaz celou populaci dětí s epilepsií [7]. Jako příklad uvádím dvě studie:
Studie z roku 2012 porovnávala děti s parciálními komplexními záchvaty (complex parcial seizures; CPS) a děti s absencemi (childhood absence epilepsy; CAE) z hlediska odlišností v kognitivních profilech [9]. U dětí se testovaly globální kognitivní výkon za použití WISC-III, dále exekutivní funkce, verbální paměť a vizuální paměť. Stejné testování podstoupily děti z kontrolní skupiny. Mezi skupinou CPS a CAE byl nalezen významný rozdíl v celkovém (globálním) intelektu ve prospěch skupiny s CAE, avšak stran specifických kognitivních domén nebyl žádný významný rozdíl nalezen. Ve srovnání s kontrolní skupinou si děti s CPS vedly hůře v testu celkového intelektu (průměrné IQ = 94), zatímco děti s CAE měly obdobné skóre jako kontrolní skupina (IQ = 102).
Populační studie CHESS (Children with Epilepsy in Sussex Schools) zkoumala neurokognitivní profily dětí s aktivní epilepsií (děti léčené antiepileptiky nebo děti, které měly záchvat v posledním roce) [7]. Zahrnovala hodnocení globálního kognitivního výkonu pomocí zkrácené Wechslerovy inteligenční škály (Wechsler Abbreviated Scale of Intelligence; WASI), popř. pátou verzí Stanford-Binetova testu inteligence u dětí, které vývojově nezvládly WASI; a hodnocení pracovní paměti a rychlosti zpracování. Ze zkoumané populace dětí s aktivní epilepsií mělo 40 % poruchu celkového intelektu, přičemž 59 % z této subpopulace mělo IQ pod 50. U 58 % dětí byl zjištěn snížený výkon v pracovní paměti a u 62 % dětí byla zaznamenána snížená rychlost zpracování. Polyterapie antiepileptiky a přítomnost ADHD (attention deficit hyperactivity disorder) byly spojeny s horším celkovým kognitivním výkonem. Časný výskyt záchvatů byl spojen se sníženým celkovým intelektem a rychlostí zpracování.
Souhrn výsledků vč. popisu skupin pacientů v citovaných studiích poskytuje tab. 1.
Table 1. Souhrn výsledků, popis skupin pacientů a počtu pacientů ve studiích zkoumajících kognitivní funkce u dětí s epilepsií. 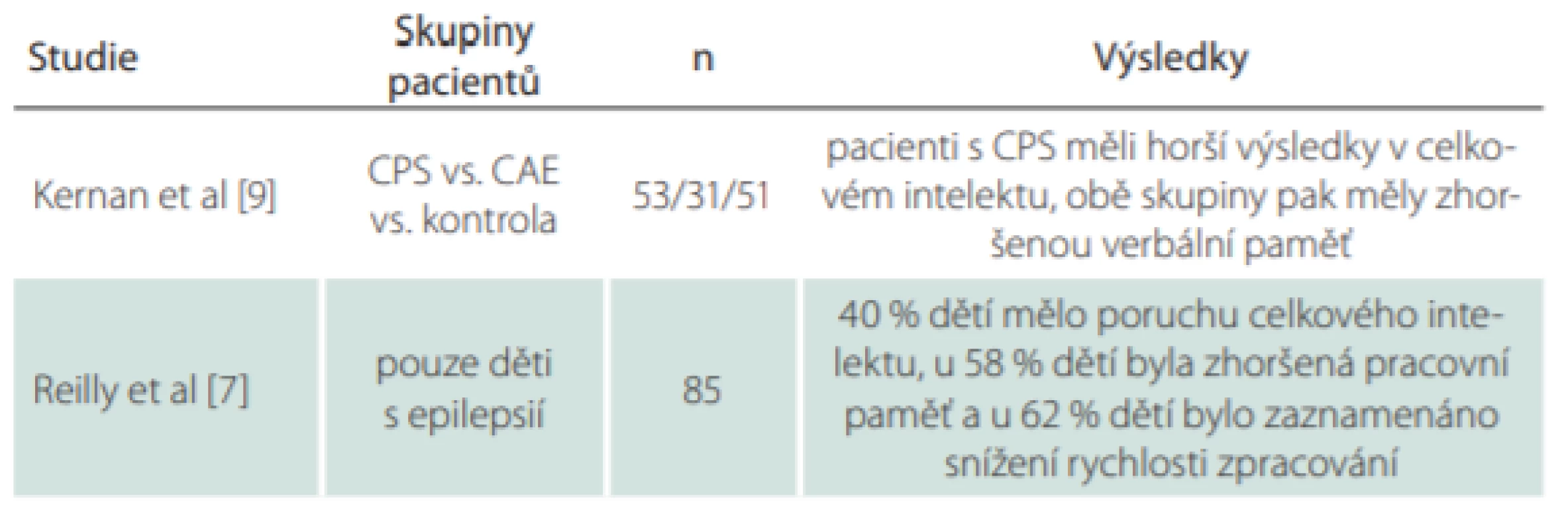
CAE – děti s absencemi; CPS – parciální komplexní záchvaty; n – počet Hodnocení kognitivních funkcí a používané nástroje
V této části uvádíme odpovědi na následující čtyři otázky týkající se neuropsychologického vyšetření dětí s epilepsií:
- Proč provádět vyšetření?
- Komu testy administrovat?
- Kdy vyšetření provádět?
- Jaké testy zvolit?
Role neuropsychologického vyšetření dětí s epilepsií je především v časném odhalení kognitivního deficitu a sledování jeho dynamiky. Jakékoliv zhoršení, ať již z normy či z existujícího postižení kognice, je alarmující a musí vést k revizi postupu, úpravě léčby, urychlení posouzení vhodnosti epileptochirurgického přístupu atd. Role neuropsychologického vyšetření však může být i: 1. diagnostická, kdy projevy poruchy kognitivních funkcí mohou napovědět, o jaký syndrom se jedná, jaká je lokalizace či lateralizace epileptogenních sítí apod.; 2. prognostická, díky které je možné předvídat vývoj kognitivních funkcí v závislosti na efektu přítomných záchvatů nebo terapie; 3. edukativní, neboť umožňuje pacientům porozumět svým limitacím a možnostem, jak je zmírnit [10]. Vhodné je provedení vyšetření dítěte i za účelem stanovení výchozího stavu kognitivních funkcí, abychom měli o tomto stavu záznam v případě pochybností, zda dítě mělo kognitivní deficit již před nasazením terapie.
Neuropsychologické vyšetření by mělo být administrováno všem dětem, u kterých byla nově diagnostikována epilepsie, a to z důvodu přítomnosti poruchy kognitivních funkcí až u 50 % nově diagnostikovaných pacientů [10]. Vyšetřeny by měly být též děti s epilepsií, u kterých jsou zřejmé neurovývojové opoždění, poruchy učení nebo kognitivní regres, kdy je nezbytné sledovat vývoj kognitivních funkcí v čase [10]. Nakonec by rutinně měly neuropsychologické vyšetření podstupovat všechny děti ke zhodnocení vývoje onemocnění a vlivu léčby na kognitivní výkon. Testy naopak není vhodné administrovat dětem, které momentálně trpí akutním onemocněním či úrazem s předpokladem uzdravení v krátké době [10].
Vyšetření je důležité provést co nejdříve poté, kdy bylo vysloveno podezření na epilepsii. Důvodem je možnost časné intervence ještě ve stavu, kdy je možné zvrátit nástup obtíží [10]. Následně je dobré testy opakovat v pravidelných intervalech dle individuálních potřeb dítěte i managementu k již výše zmíněnému zhodnocení vývoje onemocnění a vlivu léčby.
V neuropsychologickém vyšetření kognitivních funkcí se obecně používají dva druhy nástrojů; první představuje testy hodnotící globální kognitivní výkon, druhý specifické kognitivní domény [2]. Při výběru vhodného testu samozřejmě záleží na věku pacienta (v různém věku se používají různé škály), jeho schopnostech a zkušenostech vyšetřujícího. Jednoduché skríningové testy může administrovat lékař či patřičně proškolený zdravotník, složitější neuropsychologické baterie zadává neuropsycholog. Tab. 2 uvádí souhrn nejčastěji používaných testů k hodnocení kognitivních funkcí u dětských pacientů [2]. Pro rychlé a dynamické sledování účinků antiepileptik na kognitivní funkce je vhodný test EpiTrack Junior, který hodnotí pozornost, exekutivní funkce a pracovní paměť [11].
Table 2. Souhrn nejčastěji používaných neuropsychologických testů u dětí s epilepsií. V ČR je situace lehce odlišná, všechny z uvedených metod nedisponují českými normami, tedy je jejich užití limitováno. 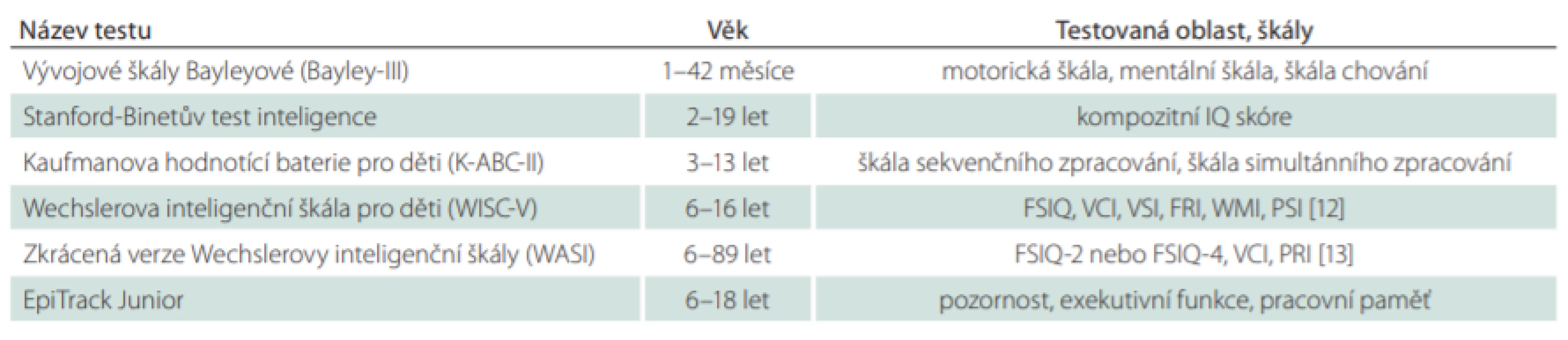
FRI – index fluidního uvažování; FSIQ – full scale IQ; PRI – index percepčního uvažování; PSI – index rychlosti zpracování; VCI – index verbálního porozumění; VSI – vizuálně prostorový index; WMI – index pracovní paměti Faktory ovlivňující kognitivní výkon
Kognitivní výkon dětí s epilepsií je závislý na mnoha faktorech, které jsou znázorněny na obr. 2 [3]. Z něj je patrné, že etiologické faktory, které mohou být strukturální, genetické, metabolické a zánětlivé, spolu s výskytem status epilepticus (SE), epileptické encefalopatie, častých záchvatů a interiktálních výbojů, mají vliv na strukturální a funkční konektivitu, které následně ovlivňují vývoj kognitivních funkcí. Farmakoterapie antiepileptiky může kognitivní funkce zhoršovat a zlepšovat, časně provedená chirurgická terapie epilepsie může kognitivní funkce výrazně zlepšit.
Image 2. Znázornění vlivu etiologických faktorů záchvatů (epileptogenní patologie), status epilepticus, epileptické encefalopatie, častých záchvatů a interiktálních výbojů na strukturální a funkční konektivitu, které následně ovlivňují vývoj kognitivních funkcí. Převzato, přeloženo a modifikováno z [3].
Fig. 2. Illustration of the impact of seizure etiological factors (epileptogenic pathology), status epilepticus, epileptic encephalopathy, frequent seizures and interictal discharges on structural and functional connectivity which then aff ect cognitive function development. Originally from [3]; translated and modifi ed.![Znázornění vlivu etiologických faktorů záchvatů (epileptogenní patologie), status epilepticus, epileptické encefalopatie, častých záchvatů a interiktálních výbojů na strukturální a funkční konektivitu, které následně ovlivňují vývoj kognitivních funkcí. Převzato, přeloženo a modifikováno z [3]. <br>
Fig. 2. Illustration of the impact of seizure etiological factors (epileptogenic pathology), status epilepticus, epileptic encephalopathy,
frequent seizures and interictal discharges on structural and functional connectivity which then aff ect cognitive function development. Originally from [3]; translated and modifi ed.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/62e5837bb4c07ca3e20c8be19d679bcf.png)
Kognitivní funkce u dětských pacientů s epilepsií mohou být zhoršeny již při prvních projevech onemocnění a jejich ovlivnění pozitivním směrem nemusí být možné (např. epileptické encefalopatie). V jiných případech se však dá sledovat zhoršování kognitivního výkonu, které je závislé na mnoha prokazatelně ovlivnitelných faktorech, jako jsou nežádoucí účinky antiepileptik, časté nekompenzované záchvaty, frekventní epileptická interiktální aktivita a špatný management.
Význam znalosti faktorů ovlivňujících kognitivní fungování dítěte tedy není jen v predikci kognitivního výsledku, ale samozřejmě i v možnosti jejich zacílení při terapii za účelem snížení jejich negativního vlivu. Mezi faktory patří: 1. etiologické faktory; 2. epileptické encefalopatie; 3. status epilepticus; 4. frekvence záchvatů; 5. interiktální EEG obraz; 6. terapie antiepileptiky; 7. epileptochirurgie.
Etiologické faktory
Etiologické faktory zahrnují strukturální léze, geneticky podmíněné patologie, infekční příčiny, metabolické patologie, autoimunitní patologie či etiologie není známa [14].
Strukturální léze mohou kognitivní funkce ovlivňovat dvojím způsobem. Jednak je mohou zhoršovat v důsledku přítomnosti záchvatů, jednak mohou samotné léze způsobovat kognitivní deficit. To můžeme pozorovat u tuberózní sklerózy (tuberous sclerosis complex; TSC) [15]. Asi 50 % pacientů s TSC má normální intelekt, druhá polovina trpí poruchou intelektu různé tíže [16]. Nejméně u 30 % školních dětí s TSC existuje riziko školního neprospěchu z důvodu poruch čtení, psaní, pravopisu a matematických dovedností, a to i při zachovaném intelektu [16]. Specifické poruchy pak zahrnují deficit pozornosti, poruchy paměti a poruchy exekutivních funkcí [16]. Včasné zahájení terapie ještě před výskytem prvních záchvatů zlepšuje celkový intelekt a snižuje výskyt mentální retardace [17].
Do kategorie geneticky podmíněných patologií způsobujících epilepsii můžeme zařadit mutace v genech pro iontové kanály, jmenovitě např. mutace v genu SCN2A, který kóduje napěťově řízený sodíkový kanál. Tento defekt je spojen s výskytem vážných fenotypů s encefalopatií vč. Ohtaharova syndromu, infantilních spazmů a Westova syndromu, jejichž kognitivní výsledek je závažný (viz část zabývající se encefalopatiemi) [18]. Dalším příkladem je výskyt syndromu Dravetové, jehož podkladem je v 70–80 % případů mutace v genu SCN1A, který kóduje alfa1 podjednotku sodíkového kanálu. Na úrovni kognitivních funkcí u tohoto syndromu dochází k rozvoji až těžké mentální retardace [19]. Lehčí formy mentální retardace vykazují poruchu vizuokonstrukčních schopností, zatímco verbální schopnosti mohou zůstat relativně zachovány. U těžších forem mentální retardace může být přítomna těžká porucha všech schopností. Při podezření na syndrom Dravetové je výhodné provést genetické testování, které umožní výběr vhodné antiepileptické terapie, stanovení prognózy, zajištění správné dispenzarizace v podobě logopedie, kardiologie apod. [20].
Celosvětově nejčastější příčinou epileptických záchvatů je infekce [14]. Rozlišujeme časné záchvaty, které se objevují v prvních 2 týdnech po infekci, a pozdní neprovokované záchvaty, které se mohou objevit několik měsíců až let po infekci [21]. Časné, symptomatické záchvaty se objevují až u 30 % všech infekcí CNS a nejsou považovány za spontánní; jsou však rizikovým faktorem pro pozdější rozvoj epilepsie. Infekce mohou vyprovokovat i SE. Závažným stavem manifestujícím se v souvislosti s infekcí je tzv. epileptický syndrom asociovaný s febrilním onemocněním (febrile infection–related epilepsy syndrome; FIRES) [22]. Obvykle jej vyvolá hořečnatý virový infekt horních cest dýchacích, příp. gastroenteritida, a manifestuje se do 24 h až 2 týdnů od začátku horečky jako refrakterní SE [23], během kterého může a nemusí být horečka přítomna. Prognóza tohoto syndromu je závažná a je dána vysokou mortalitou a regresem kognitivních funkcí. U pacientů je možné pozorovat poruchy učení, lehkou až častěji těžkou mentální retardaci či vegetativní stav [24]. Stav je bohužel poměrně často pozdě diagnostikován, což prognózu zhoršuje [23]. Zlepšení kognitivního výsledku při terapii ketogenní dietou a/nebo intravenózním podáváním imunoglobulinu nebylo až na pár izolovaných případů prokázáno [24].
V případě epilepsie metabolické etiologie je epilepsie přímým důsledkem známého nebo předpokládaného metabolického onemocnění, u kterých jsou záchvaty jedním z hlavních příznaků [25]. Mohou být vrozené a získané. Získaná epilepsie metabolické etiologie může vzniknout z důvodu nedostatečného přísunu vitaminu B12, dysfunkce orgánu zapojeného do metabolizmu určitého substrátu, z důvodu malabsorpce atd. [26]. Vrozené (dědičné) poruchy metabolizmu (inborn errors of metabolism; IEM) jsou způsobeny defektem genů kódujících enzymy, čímž dochází k nahromadění jejich substrátů a vzniku neurologických poruch, v tomto případě záchvatů [27]. IEM jsou poměrně vzácné příčiny epilepsie, avšak záchvaty jsou u pacientů s IEM docela časté [28]. Manifestují se časně, provází je vývojový regres a běžně užívaná antiepileptika nejsou obvykle při léčbě účinná. Mezi IEM řadíme pyridoxin-dependentní epilepsii (PDE), která se projevuje refrakterními záchvaty u dětí do 3 let a je snadno léčitelná vysokými dávkami pyridoxinu [29]. PDE je naneštěstí doprovázena poruchou intelektu, které nelze předcházet samotnou terapií pyridoxinem a je přítomna až u 75 % pacientů i přes dobrou kontrolu záchvatů [30]. Nové terapie cílící na defekt v degradaci lyzinu se zdají být z hlediska kognitivního výsledku slibné.
Autoimunitní epileptická encefalitida se manifestuje záchvaty, poruchami kognitivních funkcí a abnormálními pohyby [31]. U dětí se může projevit autoimunitní etiologie epilepsie ve formě Rasmussenova syndromu (encefalopatie). Jde o poměrně vzácné chronické onemocnění, které je charakterizováno unilaterálním zánětem a atrofií mozkového kortexu, refrakterními fokálními záchvaty, progresivní hemiplegií a deteriorací kognitivního výkonu [32]. V případě postižení dominantní hemisféry může dojít až k poruše řeči [32]. Záchvaty je možné řešit chirurgicky funkční hemisferotomií, která navíc zlepšuje kognitivní funkce [33].
Epileptické encefalopatie
Termín epileptická encefalopatie vyjadřuje poruchu, při které narušují četné záchvaty a/nebo četná epileptiformní aktivita v EEG psychomotorický vývoj dítěte, což má za následek zpomalení vývoje a často i regres [25]. Je-li zpomalení přítomno ještě před výskytem epileptiformní aktivity, lze použít termín vývojová epileptická encefalopatie. Vývojové a epileptické encefalopatie jsou často asociovány s etiologiemi, u kterých byla prokázána těžká premorbidní porucha intelektu, a to i při absenci epileptických záchvatů [34]. Může jít o příčiny genetické (dysfunkce iontových kanálů), strukturální (kongenitální a získané léze) a metabolické. Klíčové u epileptické encefalopatie je, že kognitivní výsledek u těchto dětí se při dobré kontrole epilepsie může zlepšit [25]. Bohužel jsou však záchvaty, které jsou důsledkem epileptické encefalopatie, často farmakorezistentní a dětem je s nutností nasazována polyterapie antiepileptiky i ve vysokých dávkách, která taktéž mohou mít negativní vliv na kognitivní funkce [34]. Mezi epileptické encefalopatie lze řadit časnou myoklonickou encefalopatii, Ohtaharův syndrom, Westův syndrom, Lennoxův-Gastautův syndrom a syndrom Dravetové, který byl popsán výše.
Časná myoklonická encefalopatie (early myoclonic encephalopathy; EME) a Ohtaharův syndrom se poprvé objevují nejčastěji v novorozeneckém období. EME se projevuje fokálními myoklony, nejfrekventovaněji v oblasti obličeje a končetin, ale i fokálními záchvaty, které vidíme až v 80 % případů [35]. Ohtaharův syndrom se projevuje tonickými generalizovanými nebo fokálními spazmy, které se objevují až několiksetkrát za den. V EEG obrazu u obou syndromů pozorujeme grafoelementy typu supression-burst (oploštění-výboj), v případě Ohtaharova syndromu kontinuálně v období bdění i spánku, v případě EME obraz není kontinuální a je výrazněji viditelný ve spánku [35]. Prognóza u obou syndromů je bohužel špatná, přítomna je těžká porucha intelektu a mortalita v prvních 2 letech života je 50 %. Děti, které přežijí, obvykle trpí farmakorezistentní epilepsií s těžkou poruchou intelektu a vyvíjí se Westův syndrom, případně Lennoxův-Gastautův syndrom [34]. V případě Ohtaharova syndromu je vhodné pátrat po epileptogenní lézi, jejíž resekce by mohla výrazně zlepšit prognózu z hlediska záchvatů a kognitivního výsledku.
Westův syndrom je nejčastější epileptickou encefalopatií a poprvé se manifestuje v prvním roce života, s maximem mezi 4. a 7. měsícem [34,36]. Klinický obraz zahrnuje kombinaci spazmů v clusterech (infantilní spazmy), obraz hypsarytmie v EEG a psychomotorický regres, který se může objevit ještě před manifestací spazmů a je striktním diagnostickým kritériem Westova syndromu [36]. Děti s Westovým syndromem mají vyšší míru předčasné úmrtnosti. Vývoj intelektu je vysoce závislý na etiologii, která je známa až u dvou třetin pacientů; u těchto dětí je výkon intelektu zhoršený [34]. Nejčastější příčinou jsou strukturální abnormality, přičemž kortikální malformace nebo perinatální poranění mozku zhoršují prognózu v oblasti intelektu a managementu záchvatů. Tuberózní sklerózu jako další etiologii Westova syndromu lze naopak dobře zvládat vigabatrinem s dobrým kognitivním výsledkem. Taktéž chirurgická řešení v případě fokálních lézí zlepšují intelekt s lepšími výsledky v časnějších stadiích.
Lennox-Gastautův syndrom (LGS) postihuje děti ve věku 1–8 let s nejčastějším věkem diagnózy 2–5 let [37]. Diagnostická kritéria zahrnují kognitivní deficit, EEG s obrazem pomalých hrotů a vln, multifokálních hrotů nebo obou, dále záchvaty více typů s nejčastějšími tonickými záchvaty (ale i myoklonické, atypické, absence, atonické a tonicko-klonické), které jsou však bohužel farmakorezistentní a většina dětí trpí denními záchvaty [34]. Psychomotorický vývoj je povětšinou abnormální již před prvními záchvaty a až dvě třetiny pacientů mají v anamnéze Westův syndrom [34]. Zhruba polovina dětí má poruchu intelektu v době stanovení diagnózy a až 95 % jich má při vstupu do dospělosti kognitivní poruchu, a to i v případě dobrého managementu záchvatů. Ten je však nepravděpodobný a je potřeba se vyhýbat nadměrné farmakoterapii z důvodu nežádoucích účinků.
Status epilepticus
Status epilepticus je život ohrožující stav, který často vyžaduje intenzivní péči [38]. Status můžeme klasifikovat na SE s převážně motorickými symptomy a na SE bez převažujících motorických symptomů, tzv. non-konvulzivní SE (NCSE). Obecně jsou výsledky SE nejvíce závislé na jeho etiologii a mohou zahrnovat neurologické, kognitivní a behaviorální poruchy. Negativní vliv na kognitivní funkce sledujeme hlavně u refrakterního SE (RSE) a super-refrakterního SE (super-RSE), přičemž dlouhodobé následky vidíme u 28–34 % dětí [38]. Výskyt NCSE je taktéž spojen se zhoršeným kognitivním výsledkem [39]. Přímý vliv SE na kognitivní funkce je však složité prokázat, což ilustrují dvě studie. První studie z roku 2018 zjistila, že děti se SE v anamnéze mají horší kognitivní výsledky ve srovnání se zdravou kontrolní skupinou, přičemž děti s non-febrilním SE mají větší kognitivní deficit než děti s febrilním SE [40]. V druhé studii publikované roku 2012 naopak autoři nezjistili žádný rozdíl mezi dětmi, které měly SE, a mezi kontrolní skupinou dětí, které měly epilepsii, ale neměly SE [41].
Frekvence záchvatů
Častější výskyt záchvatů je asociován s horším kognitivním a školním výsledkem [42]. Ve studii 341 dětí, adolescentů a mladých dospělých s epilepsií byla popsána spojitost mezi vyšší frekvencí záchvatů a zhoršenou pracovní pamětí, rychlostí zpracování, FSIQ (Full Scale Intelligence Quotient) a potřebou pedagogické asistence. Na zhoršování kognitivního výsledku s vyšší frekvencí záchvatů lze pohlížet i jako na součást epileptické encefalopatie, která tento koncept podporuje [34].
Interiktální EEG obraz
Interiktální epileptiformní výboje (interictal epileptiform discharges; IEDs) jsou krátké vysokoamplitudové výboje v období mezi dvěma záchvaty, které je možné vidět na EEG obrazu až u 80 % dětí s epilepsií [43]. Jejich existence může zhoršovat kognitivní funkce dvěma způsoby – IEDs mohou narušovat probíhající kognitivní procesy (tzv. tranzientní porucha kognitivních funkcí, angl. transient cognitive impairment; TCI) a mohou způsobit dlouhodobé strukturální změny [44]. Bylo demonstrováno, že vyskytnou-li se IEDs během úkolu vyžadujícího pracovní paměť, sníží se přesnost a prodlouží se reakční doba. Častější výskyt IEDs koreluje s nižším IQ a horšími výsledky v testech paměti a exekutivních funkcí [43]. Konkrétní projevy TCI jsou závislé na lokalizaci IEDs, kdy např. porucha jazykových funkcí se manifestuje při lokalizaci IEDs převážně v oblasti temporální [45]. Zda IEDs způsobují i chronické postižení kognitivních funkcí, musí být ještě prokázáno. Negativní vliv IEDs na kognici vyvolá otázku, zda by u pacienta bez záchvatů s přítomnými IEDS v EEG obrazu měla být nasazena terapie antiepileptiky. Odpověď bohužel v tuto chvíli není jasná, neboť samotná antiepileptika mohou mít negativní vliv na kognitivní funkce [45].
Terapie antiepileptiky
Výběr antiepileptické terapie by měl být proveden s ohledem na účinky jednotlivých antiepileptik na kognitivní funkce. Cílem by tedy nemělo být pouze snížení frekvence záchvatů, ale i vyhnout se zhoršování kognitivních funkcí a, pokud je to možné, jejich zlepšení [46]. Obecně lze konstatovat, že riziko vedlejších kognitivních účinků zvyšují polyterapie, vyšší dávkování a vyšší plazmatické hladiny antikonvulziv [2]. Následuje výčet nejčastěji používaných antiepileptik a jejich účinek na kognitivní funkce.
Valproová kyselina
Terapie valproovou kyselinou je spojena s mírnými behaviorálními vedlejšími účinky (iritabilita, agrese, hyperaktivita a změny spánku) a zhoršením pozornosti. Vyšší dávky valproátu byly spojeny s horšími výsledky v přesnosti a v reakčním času a s vyšší mírou impulzivity [47].
Fenytoin a karbamazepin
U fenytoinu a karbamazepinu byl pozorován negativní vliv na psychomotorické tempo, obzvláště ve vyšším dávkování a v polyterapii [2].
Etosuximid
Dle dřívější studie bylo užívání etosuximidu spojeno s mírnou dočasnou poruchou pozornosti, avšak novější studie ukazují, že etosuximid má méně negativních účinků na pozornost než valproát nebo lamotrigin [2].
Vigabatrin
Jelikož je použití vigabatrinu indikováno u malých pacientů s vážnými formami epilepsie, existuje jen velmi málo údajů ohledně jeho kognitivního účinku. Bylo však zjištěno, že čím časněji je vigabatrin nasazen od počátku infantilních spazmů asociovaných s tuberózní sklerózou, tím lepší je dlouhodobý kognitivní výsledek [46].
Lamotrigin
Lamotrigin má příznivý účinek na výskyt agresivity a impulzivity, užívá se též jako stabilizátor nálady u adolescentů s bipolární poruchou. U pacientů s epilepsií však může poruchy chování indukovat. Lamotrigin nevykázal významnější efekt na kognitivní výkon [46].
Topiramát
Asi u 20 % pacientů užívajících topiramát se projeví široké spektrum nežádoucích účinků na kognitivní funkce, které je přítomno i u pacientů, kteří před začátkem terapie neměli zhoršený kognitivní výkon. Zasažené domény zahrnují pozornost, paměť, rychlost zpracování a verbální fluenci. Funkční neurozobrazovací studie prokázaly sníženou aktivaci celého mozku, zejména pak v oblasti jazykových funkcí. Monoterapie topiramátem má lepší účinek na kognitivní funkce než polyterapie [46].
Levetiracetam
Mezi nejčastější nežádoucí účinky levetiracetamu patří spavost a behaviorální poruchy, ponejvíce iritabilita, hyperaktivita a agrese. Pozitivně však působí na pozornost a komunikační schopnosti, hlášeno bylo i zlepšení poruch chování [46].
Oxkarbazepin
Studie prokázaly zlepšení výkonu při úkolu vyžadujícím soustředění a pozitivní efekt na rychlost psaní rukou [46].
Zonisamid
Obecně je zonisamid dobře tolerován, avšak při jeho užívání se mohou vyskytnout vážné psychiatrické nežádoucí účinky, vč. mánie, suicidálních sklonů, psychózy, ale i kognitivního zpomalení, poruchy paměti a poruchy řeči. Po roce užívání bylo prokázáno výrazné zhoršení verbální fluence a pozornosti [46].
Epileptochirurgie
Chirurgické řešení epilepsie je nejefektivnější metodou kontroly záchvatů u pacientů s farmakorezistentní fokální epilepsií a vede ke zlepšení kognitivních funkcí, chování a celkové kvality života [48]. Z dlouhodobého hlediska je chirurgická terapie epilepsie též méně nákladná [49]. Pěti - a víceletého období bez záchvatu je dosaženo až u 60 % pacientů [49]. Z tohoto důvodu je vhodné děti s fokální epilepsií nereagující na antiepileptickou terapii časně referovat ke zvážení chirurgické terapie. Časně proto, že s pokračujícími fokálními záchvaty dochází ke strukturálním a funkčním změnám mozku, které mohou vést ke zhoršení kognitivního výkonu. Též při časném chirurgickém řešení epilepsie je v případě úspěšného dosažení bezzáchvatového období možné vysadit antiepileptickou terapii, což dále může zlepšit kognitivní deficit [49].
Kognitivní výsledek chirurgické terapie epilepsie závisí na mnoha faktorech. Patří mezi ně např. věk dítěte při začátku epilepsie, věk dítěte při operaci, délka trvání epilepsie, vysazení antiepileptické terapie po operaci, kognitivní výkon před operací apod. [50] Kognitivní výsledek po chirurgické terapii lze hodnotit na základě typu chirurgického zákroku – častá je hemisferektomie, případně hemisferotomie a temporální lobektomie [50,51].
Hemisferotomie se v ČR provádí zhruba u 11 % pediatrických pacientů referovaných k chirurgické terapii [52]. Indikací je buď vrozené (např. fokální kortikální dysplázie hemisféry), získané (např. perinatální cévní mozková příhoda) nebo progresivní (např. Rasmussenova encefalopatie) postižení a s ním asociovaná farmakorezistence. Většina dětí je po zákroku bez záchvatů. Hlavními prediktory kognitivního výkonu po zákroku jsou předoperační kognitivní výkon, délka trvání epilepsie a bezzáchvatovost po operaci. Nejlepších výsledků dosahují pacienti starší v době operace, se získaným postižením a bez záchvatů. [50]
Temporální lobektomie je indikována u dětí s epilepsií temporálního laloku (TLE). Kognitivní výsledek operace závisí na lateralizaci [51]. Dominantní temporální lalok je důležitý pro verbální paměť a řečová centra, zatímco nedominantní temporální lalok hraje důležitou roli v neverbální a vizuální paměti. U dětí s TLE se po temporální lobektomii v rámci dlouhodobého sledování ukázalo, že nedošlo ke zhoršení paměti, ať už šlo o temporální lobektomii levou nebo pravou; vizuální paměť se zlepšila po levostranné temporální lobektomii; verbální paměť se zlepšila po pravostranné temporální lobektomii; epizodická paměť byla lepší u pacientů s vyšším ponechaným objemem hipokampu; sémantická paměť byla lepší u pacientů s ponechanými temporálními póly [51]; došlo k významnému nárůstu IQ [50]. U pacientů byl pooperačně pozorován dočasný pokles výkonu v paměti, který se následně zlepšil. Prediktory pozitivně ovlivňujícími kognitivní výkon po operaci jsou unilobární epileptogenní ložisko, meziotemporální skleróza, dosažení bezzáchvatového období po operaci [51].
Závěr
Kognitivní poruchy u dětí s epilepsií jsou obávanou komplikací a mělo by se na ně myslet u každého pacienta vyšetřovaného či léčeného pro epilepsii. Intelekt je u těchto dětí zasažen často a málokdy to lze ovlivnit. Mnoho příčin, které způsobují zhoršení kognitivního výkonu, je však ovlivnitelných, a měla by jim být věnována patřičná pozornost. Nesprávný výběr antiepileptika, nedostatečná kompenzace záchvatů a např. špatný management etiologie mohou být právě těmito faktory. Vidíme-li zhoršení kognitivních funkcí, je třeba po nich vždy cíleně pátrat a zvážit revizi případu. Vždy je nutné si položit otázku, zda mohu pro zástavu horšení něco udělat. Kvalitní monitoring kognitivních funkcí je proto nezbytný a umožňuje nejen zjistit již přítomný deficit, ale právě dynamicky sledovat jakékoliv zhoršení.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů. The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
doc. MUDr. Hana Ošlejšková, Ph.D.
Akademické centrum pro epileptologii a epileptochirurgii,
Klinika dětské neurologie LF MU a FN Brno Jihlavská 340/20
625 00 Brno
e-mail: oslejskova.hana@fnbrno.cz
Přijato k recenzi: 18. 12. 2019
Přijato do tisku: 28. 4. 2020
Sources
1. Aldenkamp AP, Bodde N. Behaviour, cognition and epilepsy. Acta Neurol Scand Suppl 2005; 182 : 19–25. doi: 10.1111/j.1600-0404.2005.00523.x.
2. Kim EH, Ko TS. Cognitive impairment in childhood onset epilepsy: Up-to-date information about its causes. Korean J Pediatr 2016; 59 (4): 155–164. doi: 10.3345/kjp.2016.59.4.155.
3. Braun KP. Preventing cognitive impairment in children with epilepsy. Curr Opin Neurol 2017; 30 (2): 140–147. doi: 10.1097/WCO.0000000000000424.
4. Camfield P, Camfield C. Regression in children with epilepsy. Neurosci Biobehav Rev 2019; 96 : 210–218. doi: 10.1016/j.neubiorev.2018.12.008.
5. Helmstaedter C, Witt JA. Epilepsy and cognition – a bidirectional relationship? Seizure 2017; 49 : 83–89. doi: 10.1016/j.seizure.2017.02.017.
6. Karrasch M, Tiitta P, Hermann B et al. Cognitive outcome in childhood-onset epilepsy – a five-decade prospective cohort study. J Int Neuropsychol Soc 2017; 23 (4): 332–340. doi: 10.1017/S1355617716001077.
7. Reilly C, Atkinson P, Das KB et al. Cognition in school--aged children with “active” epilepsy – a population-based study. J Clin Exp Neuropsychol 2015; 37 (4): 429–438. doi: 10.1080/13803395.2015.1024103.
8. Sachdev PS, Blacker D, Blazer DG et al. Classifying neurocognitive disorders: the DSM-5 approach. Nat Rev Neurol 2014; 10 (11): 634–642. doi: 10.1038/nrneurol.2014.181.
9. Kernan CL, Siddarth P, Lanphier EK et al. Neurocognitive profiles in children with epilepsy. Epilepsia 2012; 53 (12): 2156–2163. doi: 10.1111/j.1528-1167.2012.03706.x.
10. Wilson SJ, Baxendale S, Barr W et al. Indications and expectations for neuropsychological assessment in routine epilepsy care: Report of the ILAE Neuropsychology Task Force, Diagnostic Methods Commission, 2013–2017. Epilepsia 2015; 56 (5): 674–681. doi: 10.1111/epi.12962.
11. Helmstaedter C, Schoof K, Rossmann T et al. Introduction and first validation of EpiTrack Junior, a screening tool for the assessment of cognitive side effects of antiepileptic medication on attention and executive functions in children and adolescents with epilepsy. Epilepsy Behav 2010; 19 (1): 55–64. doi: 10.1016/j.yebeh.2010.06.042.
12. MacAllister WS, Maiman M, Vasserman M et al. The WISC-V in children and adolescents with epilepsy. Child Neuropsychol 2019; 25 (7): 992–1002. doi: 10.1080/09297049.2019.1571181.
13. McCrimmon AW, Smith AD. Review of the Wechsler Abbreviated Scale of Intelligence, Second Edition (WASI-II). J Psychoeduc Assess 2013; 31 : 337–341. doi: 10.1177/0734282912467756.
14. Scheffer IE, Berkovic S, Capovilla G et al. ILAE classification of the epilepsies: position paper of the ILAE Commission for Classification and Terminology. Epilepsia 2017; 58 (4): 512–521. doi: 10.1111/epi.13709.
15. Cusmai R, Moavero R, Bombardieri R et al. Long-term neurological outcome in children with early-onset epilepsy associated with tuberous sclerosis. Epilepsy Behav 2011; 22 (4): 735–739. doi: 10.1016/j.yebeh.2011.08.037.
16. Curatolo P, Moavero R, de Vries PJ. Neurological and neuropsychiatric aspects of tuberous sclerosis complex. Lancet Neurol 2015; 14 (7): 733–745. doi: 10.1016/S1474-4422 (15) 00069-1.
17. Jóźwiak S, Kotulska K, Domańska-Pakieła D et al. Antiepileptic treatment before the onset of seizures reduces epilepsy severity and risk of mental retardation in infants with tuberous sclerosis complex. Eur J Paediatr Neurol 2011; 15 (5): 424–431. doi: 10.1016/j.ejpn.2011.03.010.
18. Wolff M, Johannesen KM, Hedrich UBS et al. Genetic and phenotypic heterogeneity suggest therapeutic implications in SCN2A-related disorders. Brain 2017; 140 (5): 1316–1336. doi: 10.1093/brain/awx054.
19. Olivieri G, Battaglia D, Chieffo D et al. Cognitive-behavioral profiles in teenagers with Dravet syndrome. Brain Dev 2016; 38 (6): 554–562. doi: 10.1016/j.braindev.2015.12.014.
20. Česká K, Aulická Š, Dahofer P et al. SCN1A mutation positive Dravet syndrome, genetic aspects and clinical experiences. Cesk Slov Neurol N 2018; 81/114 (1): 55–59. doi: 10.14735/amcsnn201855.
21. Vezzani A, Fujinami RS, White HS et al. Infections, inflammation and epilepsy. Acta Neuropathol 2016; 131 (2): 211–234. doi: 10.1007/s00401-015-1481-5.
22. Česká K, Horák O, Ošlejšková H et al. New-onset refractory status epilepticus and considered spectrum disorders (NORSE/FIRES). Cesk Slov Neurol N 2018; 81/114 (6): 658–662. doi: 10.14735/amcsnn2018658.
23. Gaspard N, Hirsch LJ, Sculier C et al. New-onset refractory status epilepticus (NORSE) and febrile infection–related epilepsy syndrome (FIRES): state of the art and perspectives. Epilepsia 2018; 59 (4): 745–752. doi: 10.1111/epi.14022.
24. Lee HF, Chi CS. Febrile infection-related epilepsy syndrome (FIRES): therapeutic complications, long-term neurological and neuroimaging follow-up. Seizure 2018; 56 : 53–59. doi: 10.1016/j.seizure.2018.02.003.
25. Marusič P, Ošlejšková H, Brázdil M et al. Nové klasifikace epileptických záchvatů a epilepsií ILAE 2017. Neurol praxi 2018; 19 : 32–36.
26. Lee VL, Choo BK, Chung YS et al. Treatment, therapy and management of metabolic epilepsy: a systematic review. Int J Mol Sci 2018; 19 (3): pii: E871. doi: 10.3390/ijms19030871.
27. Papetti L, Parisi P, Leuzzi V et al. Metabolic epilepsy: an update. Brain Dev 2013; 35 (9): 827–841. doi: 10.1016/j.braindev.2012.11.010.
28. Sharma S, Prasad A. Inborn Errors of metabolism and epilepsy: current understanding, diagnosis, and treatment approaches. Int J Mol Sci 2017; 18 (7): pii: E1384. doi: 10.3390/ijms18071384.
29. Aulická Š, Fajkusová L, Šilerová P et al. Pyridoxine-dependent epilepsy – case reports. Cesk Slov Neurol N 2017; 80/113 (3): 346–9. doi: 10.14735/amcsnn2017346.
30. Van Karnebeek CD, Tiebout SA, Niermeijer J et al. Pyridoxine-dependent epilepsy: an expanding clinical spectrum. Pediatr Neurol 2016; 59 : 6–12. doi: 10.1016/j.pediatrneurol.2015.12.013.
31. Wright S, Vincent A. Progress in autoimmune epileptic encephalitis. Curr Opin Neurol 2016; 29 (2): 151–157. doi: 10.1097/WCO.0000000000000304.
32. Varadkar S, Cross JH. Rasmussen syndrome and other inflammatory epilepsies. Semin Neurol 2015; 35 (3): 259–268. doi: 10.1055/s-0035-1552921.
33. Kim J, Park EK, Shim KW et al. Hemispherotomy and functional hemispherectomy: indications and outcomes. J Epilepsy Res 2018; 8 (1): 1–5. doi: 10.14581/jer.18001.
34. Nickels KC, Wirrell EC. Cognitive and social outcomes of epileptic encephalopathies. Semin Pediatr Neurol 2017; 24 (4): 264–275. doi: 10.1016/j.spen.2017.10.001.
35. Beal JC, Cherian K, Moshe SL. Early-onset epileptic encephalopathies: Ohtahara syndrome and early myoclonic encephalopathy. Pediatr Neurol 2012; 47 (5): 317–323. doi: 10.1016/j.pediatrneurol.2012.06.002.
36. D’Alonzo R, Rigante D, Mencaroni E et al.West syndrome: a review and guide for paediatricians. Clin Drug Investig 2018; 38 (2): 113–124. doi: 10.1007/s40261-017-0595-z.
37. Berg AT, Levy SR, Testa FM. Evolution and course of early life developmental encephalopathic epilepsies: focus on Lennox-Gastaut syndrome. Epilepsia 2018; 59 (11): 2096–2105. doi: 10.1111/epi.14569.
38. Sculier C, Gaínza-Lein M, Sánchez Fernández I et al.Long-term outcomes of status epilepticus: a critical assessment. Epilepsia 2018; 59 (Suppl 2): 155–169. doi: 10.1111/epi.14515.
39. Jafarpour S, Loddenkemper T. Outcomes in pediatric patients with nonconvulsive status epilepticus. Epilepsy Behav 2015; 49 : 98–103. doi: 10.1016/j.yebeh.2015.06.015.
40. Martinos MM, Pujar S, Gillberg C et al. Long--term behavioural outcomes after paediatric convulsive status epilepticus: a population-based cohort study. Dev Med Child Neurol 2018; 60 (4): 409–416. doi: 10.1111/dmcn.13636.
41. Camfield P, Camfield C. Unprovoked status epilepticus: the prognosis for otherwise normal children with focal epilepsy. Pediatrics 2012; 130 (3): e501–e506. doi: 10.1542/peds.2012-0838.
42. Kavanaugh BC, Scarborough VR, Salorio CF. Use of a cumulative risk scale to predict poor intellectual and academic outcomes in childhood epilepsy. J Child Neurol 2016; 31 (7): 831–836. doi: 10.1177/0883073815623633.
43. Meekes J, Jennekens-Schinkel A. Effects of interictal epileptiform discharges on cognition. J Ped-iatr Epilepsy 2018; 7 : 82–88. doi: 10.1055/s-0038-1676847.
44. Lenck-Santini PP, Scott RC. Mechanisms responsible for cognitive impairment in epilepsy. Cold Spring Harb Perspect Med 2015; 5 (10): 1–15. doi: 10.1101/cshperspect.a022772.
45. Landi S, Petrucco L, Sicca F et al. Transient cognitive impairment in epilepsy. Front Mol Neurosci 2019; 11 : 252–267. doi: 10.3389/fnmol.2018.00458.
46. Moavero R, Santarone ME, Galasso C et al. Cognitive and behavioral effects of new antiepileptic drugs in pediatric epilepsy. Brain Dev 2017; 39 (6): 464–469. doi: 10.1016/j.braindev.2017.01.006.
47. Ulate-Campos A, Fernández IS. Cognitive and Behavioral comorbidities: an unwanted effect of antiepileptic drugs in children. Semin Pediatr Neurol 2017; 24 (4): 320–330. doi: 10.1016/j.spen.2017.10.011.
48. Ryvlin P, Cross JH, Rheims S. Epilepsy surgery in children and adults. Lancet Neurol 2014; 13 (11): 1114–1126. doi: 10.1016/S1474-4422 (14) 70156-5.
49. Braun KP, Cross JH. Pediatric epilepsy surgery: the earlier the better. Expert Rev Neurother 2018; 18 (4): 261–263. doi: 10.1080/14737175.2018.1455503.
50. Ramantani G, Zentner J. Epilepsy surgery in children and adolescents. Neurol Int Open 2017; 1 (2): E86–E97. doi: 10.1055/s-0043-102834.
51. Moosa AN, Wyllie E. Cognitive outcome after epilepsy surgery in children. Semin Pediatr Neurol 2017; 24 (4): 331–339. doi: 10.1016/j.spen.2017.10.010.
52. Belohlavkova A, Jezdik P, Jahodova A et al. Original article evolution of pediatric epilepsy surgery program over 2000–2017: improvement of care? Eur J Paediatr Neurol 2019; 23 (3): 456–465. doi: 10.1016/j.ejpn.2019.04.002.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2020 Issue 3-
All articles in this issue
- Primary progressive aphasia
- Are we close to targeted treatments for Huntington’s disease? YES
- Are we close to targeted treatments for Huntington’s disease? NO
- Are we close to targeted treatments for Huntington’s disease? COMMENT
- Cognitive disorders in children with epilepsy
- Autoimmune encephalitis with negative anti-neuronal antibodies – clinical characteristics and available methods of antibody detection
- APOE and BDNF as genetic risk markers for predicting the onset and development of cognitive deficits due to Alzheimer’s disease
- Role of novel laboratory techniques in Niemann-Pick type C disease diagnostics
- Headaches in pregnancy
- Occurrence and risk factors of unprovoked epileptic seizures in ischaemic stroke patients
- Validation of DYsphagia in MUltiple Sclerosis questionnaire – Czech version of DYMUS
- Effect of a neuropalliative care intervention on quality of life in patients with progressive neurological disease – interventional study
- Characteristics of a cohort of boys with Duchenne and Becker muscular dystrophies – a study from a single neuromuscular centre
- Epidural application of steroids Part 2 – The quality of life of patiens before application
- Glioblastoma grade IV – long-term survival
- Stanovisko redakční rady k diskuzi o úrovni a směřování Cesk Slov Neurol N
- Erratum
- Informace vedoucího redaktora
- Recenze
- Impact of dementia on the trajectories of quality of life in older adults
- Magnetic resonance spectroscopy metabolomics of cerebrospinal fluid in patients with multiple sclerosis, clinically isolated syndrome, other inflammatory brain diseases and controls
- Focal epileptic seizure in a young female from South Korea
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Glioblastoma grade IV – long-term survival
- Primary progressive aphasia
- Headaches in pregnancy
- Cognitive disorders in children with epilepsy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

