-
Medical journals
- Career
Intravenózní trombolýza po zrušení účinku dabigatranu specifickým antidotem Idarucizumabem
: D. Šaňák 1; P. Dušek 2; B. Matušková 3; F. Čtvrtlík 4
: Komplexní cerebrovaskulární centrum, Neurologická klinika LF UP a FN Olomouc 1; Oddělení urgentního příjmu, FN Olomouc 2; Neurologické oddělení, Nemocnice Kroměříž, a. s. 3; Radiologická klinika LF UP a FN Olomouc 4
: Cesk Slov Neurol N 2017; 80/113(Online only): 0
: No. 4
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amcsnn2017474Úvod
Pacienti, které postihla akutní ischemická cévní mozková příhoda (iCMP), často užívají perorální antikoagulancia, zejména jako preventivní terapii emboligenních příhod při nevalvulární fibrilaci síní. Provedení intravenózní trombolýzy (IVT) není však u těchto pacientů doporučeno, pokud nejsou splněny určité podmínky [1–3]. V případě pacientů užívajících warfarin nesmí být hodnota parametru INR > 1,7. U pacientů užívajících tzv. přímá (direktní) antikoagulancia (DOAK) je pak doporučováno provedení IVT pouze v případě, že nebyly DOAK prokazatelně užívány v posledních 48 hod anebo pokud jsou specifické laboratorní detekční testy pro příslušnou molekulu v normě [1–3].
Provedení IVT je nyní možné u pacientů, kteří užívají dabigatran, po okamžitém zrušení jeho antikoagulačního účinku intravenózně podaným specifickým antidotem. Od konce roku 2015 je k dispozici specifická humánní monoklonální protilátka idarucizumab (Praxbind®), která se váže na dabigatran přibližně 350× více než dabigatran na trombin [4]. Standardní dávka 5 g idarucizumabu kompletně zruší biologický účinek dabigatranu do několika min [5,6]. Dosud bylo publikováno šest případů provedení IVT pro akutní iCMP po předchozím zrušení antikoagulačního účinku dabigatranu.
V následující části prezentujeme první dokumentované podání idarucizumabu a následně provedenou IVT pro akutní iCMP v České republice.
Kazuistika
Žena (70 let) byla přijata začátkem prosince 2016 na Emergency urgentního příjmu naší nemocnice pro 2 hodiny trvající těžkou levostrannou centrální hemiparézu s centrální lézí n. VII vlevo s dysartrií a taktilní hypestézií levostranných končetin vč. obličeje; skóre ve škále National Institutes of Health Stroke Scale (NIHSS) bylo 8 bodů. Pacientka užívala dabigatran v dávce 2 × 150 mg denně jako preventivní terapii pro fibrilaci síní (FiS) a naposled jej užila přibližně 5 hod před přijetím. Dále se léčila pro arteriální hypertenzi, diabetes mellitus (na perorálních antidiabeticích), hypotyreózu a bronchiální astma.
Při vyšetření počítačovou tomografií (CT) mozku se zobrazily pouze diskrétní drobné hypodenzní areály v bílé hmotě v sousedství postranních komor odpovídající starým postischemickým změnám (obr. 1). CT angiografie neprokázala uzávěr či významnou stenózu jak v intrakraniálním, tak v extrakraniálním tepenném řečišti (obr. 1). Trombinový čas (TT) byl prodloužen nad 180 sekund (s) a aktivovaný tromboplastinový čas (aPTT) na 61,7 s. Krevní obraz byl v normě, sérový kreatinin byl zvýšen na 125 mmol/l.
1. CT mozku při přijetí. 1A: nativ. 1B: CT angiografie (Volume Rendering Technique). 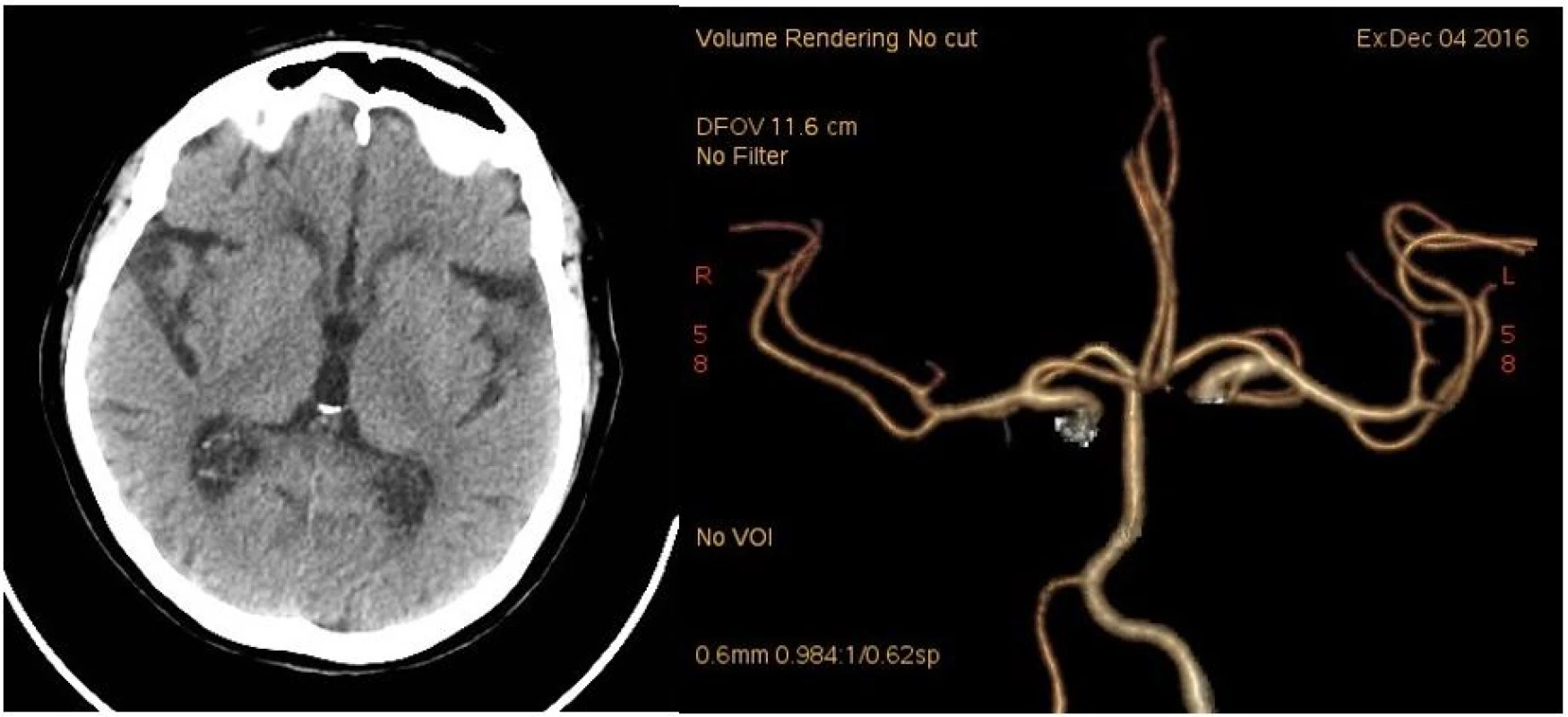
Pacientce bylo následně podáno 5 g idarucizumabu (2 × 2,5 g/50 ml) dle doporučeného schématu a to přibližně 5,5 hod od posledního užití dabigatranu [7]. Po ukončení podání protilátky byl proveden kontrolní odběr koagulace a bezprostředně po odběru krve bylo zahájeno podání 85 mg rt-PA (Actilyse®) v obvyklém schématu při pacientkou udané váze 95 kg. Výsledky kontrolního odběru koagulace provedeného před podáním IVT byly v normě: TT byl 15,1 s a aPTT 31,9 s.
U pacientky došlo ke klinickému zlepšení již cca za 2 hod po ukončení IVT a po 24 hod byla přítomna pouze diskrétní levostranná hemiparéza (NIHSS 2). Kontrolní CT mozku bylo se stacionárním nálezem, tedy bez detekce akutní ischemie či hemoragie. Neurosonologické vyšetření prokázalo nevýznamné aterosklerotické změny v oblasti bifurkace a vnitřní krkavice oboustranně. Nebyly zaznamenány žádné komplikace v souvislosti s podáním antidota a rt-PA. V rámci sekundární prevence byla pacientka zajištěna nízkomolekulárním heparinem (Fraxiparine®) v dávce 0,9 ml s.c. 2× denně. Čtvrtý den byla přeložena k další rehabilitaci do nemocnice v místě bydliště, kde jí byl následně vrácen dabigatran v dávce 2 × 150 mg denně. Byla propuštěna domů (NIHSS 2) s 1 bodem v modifikované Rankinově škále.
2. Kontrolní CT mozku (nativ) po 24 hod. 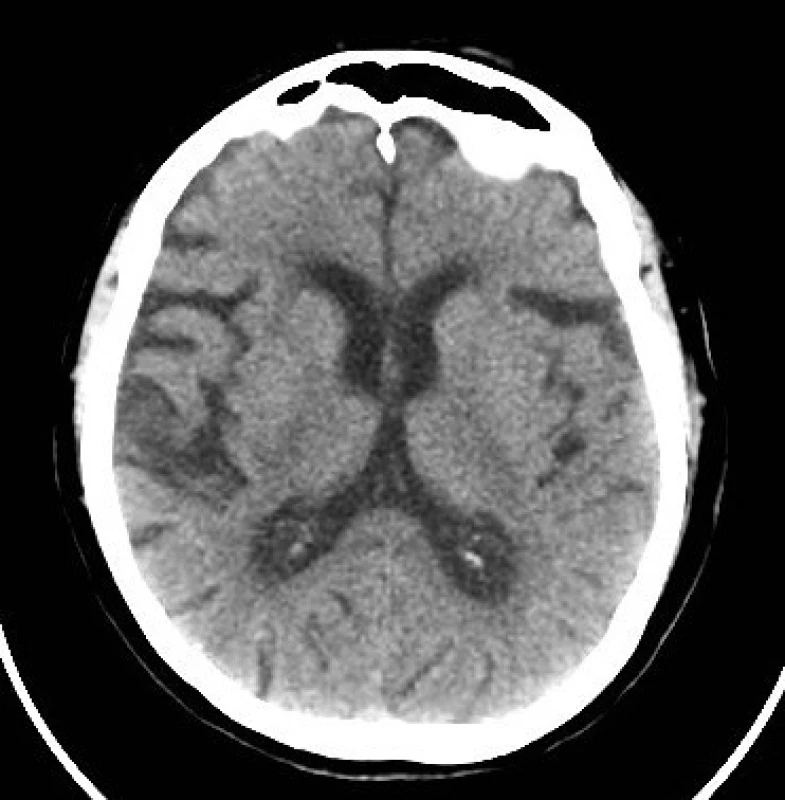
Diskuze
V tomto sdělení prezentujeme první dokumentovaný případ provedení IVT pro akutní iCMP po předchozím zrušení účinku dabigatranu specifickou protilátkou idarucizumab v České republice. Dosud bylo celosvětově publikováno celkem šest podání [8–13], přičemž pouze v jednom případě pacient užíval dávku dabigatranu 2 × 150 mg denně [9]; v ostatních případech to byla dávka 2 × 110 mg. Recentně publikovaný expertní názor vychází z údajů 14 provedení IVT po předchozím zrušení antikoagulačního účinku dabigatranu idarucizumabem v Německu [14].
Idarucizumab je specifická humánní monoklonální protilátka, která se přímo váže na molekulu dabigatran (přímý inhibitor trombinu), a to s velmi vysokou afinitou [4]. Protilátka byla schválena na podzim 2015 (US Food and Drug Administration, European Medicines Agency) k použití pro okamžik zrušení antikoagulačního účinku v případě urgentních situací nebo závažného či život ohrožujícího krvácení u pacientů užívajících dabigatran [15]. Účinek protilátky byl potvrzen výsledky prospektivní multicentrické studie RE-VERSE-AD (Reversal Effects of Idarucizumab on Active Dabigatran), do které byli zařazeni buď pacienti vyžadující urgentní operační zákrok anebo pacienti, kteří utrpěli závažné či život ohrožující krvácení [6].
V prezentovaném případě došlo ke zrušení antikoagulačního efektu dabigatranu s normalizaci koagulačních parametrů bezprostředně po ukončení aplikace antidota, což dokumentují hodnoty TT a aPTT z kontrolního odběru před podáním IVT (viz kazuistika).
Výhodou idarucizumabu je mimo okamžité zrušení účinku dabigatranu také fakt, že nemá žádný prokoagulační efekt (na rozdíl od koncentrátů koagulačních faktorů) a také nebyly zaznamenány žádné interakce mezi protilátkou a lidskou plazmou po rt-PA indukované trombolýze v in vitro testech [4,5,16].
Recentně publikovaný názor mezinárodní expertní skupiny doporučuje u pacientů užívajících dabigatran, kteří jsou indikováni k IVT podat 5 g idarucizumabu s následným odběrem TT a aPTT a poté zahájení IVT v obvyklém schématu. V případě, že hodnoty obou koagulačních parametrů budou prodlouženy nad normu, by měla být IVT ihned ukončena. V případě provedení mechanické trombektomie bez předchozího provedení IVT je doporučeno podat idarucizumab v případě intrakraniálních krvácivých komplikací nebo v případě velkého krvácení v místě zavedení katétru (tříslo) [14].
Závěrem konstatujeme, že prezentovaný případ představuje nové terapeutické paradigma, kdy může být léčen IVT pro akutní iCMP i pacient, který užívá dabigatran, a to po zrušení jeho antikoagulačního účinku idarucizumabem. Tento nový terapeutický koncept podporují dosud publikované případy a také názor mezinárodní expertní skupiny. Tento nový terapeutický postup má zásadní význam pro klinickou praxi v souvislosti s narůstajícím počtem pacientů – uživatelů dabigatranu v indikaci primární či sekundární prevence trombembolických příhod.
Sources
1. Škoda O, Herzig R, Mikulík R, et al. Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016. Cesk Slov Neurol N 2016;79/112(3):351–63.
2. Neumann J, Tomek A, Školoudík D, et al. Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014. Cesk Slov Neurol N 2014;77/110(3):381–5.
3. Demaerschalk BM, Kleindorfer DO, Adeoye OM, et al.; American Heart Association Stroke Council and Council on Epidemiology and Prevention. Scientific rationale for the inclusion and exclusion criteria for intravenous alteplase in acute ischemic stroke: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2016;47(2):581–641. doi: 10.1161/STR.0000000000000086.
4. Schiele F, van Ryn J, Canada K, et al. A specific antidote for dabigatran: functional and structural characterization. Blood 2013;121(18):3554–62. doi: 10.1182/blood-2012-11-468207.
5. Glund S, Stangier J, Schmohl M, et al. Safety, tolerability, and efficacy of idarucizumab for the reversal of the anticoagulant effect of dabigatran in healthy male volunteers: a randomised, placebo-controlled, double-blind phase 1 trial. Lancet 2015;386(9994):680–90. doi: 10.1016/S0140-6736(15)60732-2.
6. Pollack CV jr, Reilly PA, Eikelboom J, et al. Idarucizumab for dabigatran reversal. N Engl J Med 2015;373(6):511–520. doi: 10.1056/NEJMoa1502000.
7. Státní ústav pro kontrolu léčiv. SPC přípravku Praxbind®. [cit. 2017 20 Čer]. Dostupné z URL: http://www.sukl.cz/modules/medication/detail.php?code=0209048&tab=texts.
8. Berrouschot J, Stoll A, Hogh T, et al. Intravenous Thrombolysis with Recombinant Tissue-Type Plasminogen Activator in a Stroke Patient Receiving Dabigatran Anticoagulant after Antagonization with Idarucizumab. Stroke 2016;47(7):1936–8. doi: 10.1161/STROKEAHA.116.013550.
9. Schäfer N, Müller A, Wüllner U. Systemic Thrombolysis for Ischemic Stroke after Antagonizing Dabigatran with Idarucizumab – a Case Report. J Stroke Cerebrovasc Dis 2016;25(8):e126–7. doi: 10.1016/j.jstrokecerebrovasdis.2016.05.006.
10. Kafke W, Kraft P. Intravenous thrombolysis after reversal of dabigatran by idarucizumab: a case report. Case Rep Neurol 2016;8(2):140–4. doi: 10.1159/000447531.
11. Gawehn A, Ayari Y, Heuschkel C, et al. Successful thrombolysis with recombinant tissue plasminogen activator after antagonizing dabigatran by idarucizumab: a case report. J Med Case Rep 2016;10(1):269.
12. Schulz JG, Kreps B. Idarucizumab elimination of dabigatran minutes before systemic thrombolysis in acute ischemic stroke. J Neurol Sci 2016;370 : 44. doi: 10.1016/j.jns.2016.09.010.
13. Mutzenbach JS, Pikija S, Otto F, et al. Intravenous thrombolysis in acute ischemic stroke after dabigatran reversal with idarucizumab –a case report. Ann Clin Transl Neurol 2016;3(11):889–92. doi: 10.1002/acn3.346.
14. Diener HC, Bernstein R, Butcher K, et al. Thrombolysis and thrombectomy in patients treated with dabigatran with acute ischemic stroke: Expert opinion. Int J Stroke 2017;12(1):9–12. doi: 10.1177/1747493016669849.
15. FDA approved drugs database Praxbind prescribing information. Boehringer Ingelheim International GmbH; 2015. [accessed 2017 20 Jun]. Available from URL:
http://www.Accessdata.Fda.Gov/drugsatfda_docs/label/2015/761025lbl.Pdf.
16. van Ryn J, Schurer J, Fischer D. Abstract wp73: No influence of Dabigatran or its specific reversal agent, Idarucizumab, on rtpa-induced thrombolysis of clots in human plasma: an in vitro study Stroke 2016;47:AWP73.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery
2017 Issue Online only
Most read in this issue- Two cases of an atypical teratoid rhabdoid tumour of the CNS and literature review
- Intravenous Thrombolysis after Dabigatran Reversal with a Specific Antidote Idarucizumab
- Case of Adult Escherichia Coli Meningitis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

