-
Medical journals
- Career
Cievne nehemoragické komplikácie hlbokej mozgovej stimulácie
Authors: M. Kľoc 1; Z. Košutzká 2; J. Šteňo 1; P. Valkovič 2,3
Authors‘ workplace: Neurochirurgická klinika LF UK SZU a UNB, Nemocnica akad. L. Dérera, Bratislava 1; II. neurologická klinika LF UK a UNB Nemocnica akad. L. Dérera, Bratislava 2; Inštitút normálnej a patologickej fyziológie, Slovenská akadémia vied Bratislava 3
Published in: Cesk Slov Neurol N 2017; 80(6): 690-694
Category: Original Paper
doi: https://doi.org/10.14735/amcsnn2017690Overview
Úvod:
Je popísaných viacero komplikácií hlbokej mozgovej stimulácie. Súvisia so zavedením elektród do cieľovej štruktúry, stimuláciou alebo poruchou implantovaného materiálu. Medzi menej často popísané komplikácie patria cievne nehemoragické komplikácie, akými sú vznik vazospazmu a ischemického infarktu v okolí elektródy.Cieľ:
Analýza skupiny pacientov s klinicky významnými nehemoragickými cerebrovaskulárnymi komplikáciami počas operácie, resp. v časovej súvislosti so zavedením elektród hlbokej mozgovej stimulácie.Materiál a metódy:
Retrospektívna analýza 58 po sebe nasledujúcich operácií hlbokej mozgovej stimulácie subthalamického jadra a globus pallidus internus v rokoch 2009 – 2016 s identifikáciou skupiny pacientov s nehemoragickou cievnou komplikáciou. Analyzované boli rizikové faktory vzniku týchto komplikácií. Výsledky: Pozorovali sme prípad pacienta so vznikom ischémie subkortikálne v okolí elektród hlbokej mozgovej stimulácie a ďalších štyroch pacientov s akútnym rozvojom neurologických príznakov, akými sú centrálna lézia n. facialis, hemiparéza, prechodná somnolencia a pooperačná psychomotorická pasivita. Spolu bol výskyt nehemoragických cievnych komplikácií pozorovaný v sledovanom súbore u 8,6 % pacientov.Záver:
Nehemoragické cievne komplikácie okrem ich prejavu v podobe ischemického infarktu s korelátom na pooperačných zobrazovacích vyšetreniach sú pravdepodobne častejšie v podobe transientných príhod peroperačne bez korelátu na pooperačných zobrazovacích vyšetreniach. Predpokladaným mechanizmom vzniku je navodenie vazospazmu.Kľúčové slová:
hlboká mozgová stimulácia – operačná komplikácia – vazospazmus – ischemický infarktÚvod
Hlboká mozgová stimulácia (deep brain stimulation; DBS) je efektívná a bezpečná metóda pri liečbe extrapyramídových ochorení pohybu, epilepsie, niektorých psychiatrických ochorení a chronickej bolesti. Táto metóda umožňuje ovplyvnenie funkcie mozgu pomocou implantovanej elektródy. Na zavedenie elektródy do cieľovej štruktúry mozgu využíva princípy stereotaktickej neurochirurgie a na ovplyvnenie jej funkcie využíva fyzikálne pôsobenie elektrického prúdu na tkanivo. V mieste pôsobenia elektrický prúd ovplyvňuje funkciu nervových buniek, ich axónov, ale aj aktiváciu axónov fibers en passage, ktoré oblasťou prechádzajú. Cestou synaptických spojení ovplyvňuje aj siete nervových buniek vrátane vzdialených oblastí mozgu.
Komplikácie hlbokej mozgovej stimulácie možno rozdeliť do troch skupín:
- súvisiace s operačným zákrokom – prechodná zmätenosť (15,6 %), krvácanie (3,9 %), infekcia (1,7 %), kŕčový stav (1,5 %), úmrtie (0,3 %), iné komplikácie (3,3 %), kam radíme aj nehemoragické cievne komplikácie
- súvisiace s poruchou alebo poškodením implantovaného materiálu – poškodenie elektródy/ extenzie (4,4 %), migrácia elektródy (1,5 %), nefunkčnosť IPG (internal pulse generator)
- súvisiace so stimuláciou – dyzartria (9,3 %), zvýšenie telesnej váhy (8,4 %), depresia (6,8 %), apraxia otvorenia viečka, dyskinéza, manické epizódy, ďalšie motorické a psychiatrické komplikácie [1].
Medzi menej často popísané komplikácie patria cievne nehemoragické komplikácie, ako je vznik vazospazmu a ischemického infarktu v okolí elektródy. Cieľom tejto práce je analýza výskytu, klinických prejavov a možných príčin nehemoragických cievnych komplikácií DBS.
Materiál a metódy
Retrospektívne sme analyzovali 58 po sebe nasledujúcich pacientov (47 pacientov s Parkinsonovou chorobou (Parkinson‘s disease; PD) a 11 pacientov s dystonickým syndrómom) so zavedením elektród hlbokej mozgovej stimulácie do subthalamického jadra (STN) a globus pallidus internus (Gpi) bilaterálne (116 elektród) v rokoch 2009 – 2016. Pacientov s dystonickým syndrómom bolo v súbore 11 (fokálna dystónia – 2 pacienti, segmentálna dystónia – 5 pacientov, generalizovaná dystónia – 4 pacienti). Pacienti boli indikovaní k implantácii elektród DBS po vyčerpaní dostupných metód konzervatívnej liečby vrátane opakovanej cielenej chemickej denervácie botulotoxínom.
Elektródy boli zavedené stereotaktickou metódou s použitím stereotaktického systému Leksell. Na plánovanie bola použitá stereotaktická počítačová tomografia (CT) fúzovaná s magnetickou rezonanciou (MR). Cieľom stimulácie u PD bolo STN v 42 prípadoch a Gpi v 5 prípadoch, pri dystóniách Gpi u všetkých 11 pacientov. Pacienti s PD boli operovaní štandardne v lokálnej anestéze, pacienti s dystóniou boli operovaní v celkovej anestéze (CA) u 3 detí, u ostatných pacientov bol v spolupráci s anesteziológom zvolený rôzny stupeň sedácie a analgézie so snahou o čo najmenšie ovplyvnenie „microelectrode recordingu“ (MER). Pooperačne bola realizovaná stereotaktická CT s kontrolou polohy definítivnej elektródy a u vybraných pacientov bolo realizované MR vyšetrenie. U pacientov so vznikom peroperačnej cievnej nehemoragickej komplikácie boli analyzované možné rizikové faktory jej vzniku.
Výsledky
V súbore 58 pacientov sa ischémia po operácii DBS vyskytla u jedného pacienta, čo predstavuje 1,7 %. Transientné prejavy peroperačne sme v sledovanom súbore pacientov pozorovali u ďalších štyroch pacientov (6,9 %). Spolu bol výskyt nehemoragických cievnych komplikácií pozorovaný u piatich pacientov (8,6 %). Z ďalších komplikácií v sledovanom súbore sa vyskytli: prechodná zmätenosť, dezorientácia, psychomotorická pasivita u šiestich pacientov (10,3 %), krvácanie symptomatické u jedného pacienta (1,7 %), krvácanie asymptomatické u jedného pacienta (1,7 %). Infekciu sme po operácii nepozorovali. U jedného pacienta sme zistili drobné ischemické zmeny na okraji rany, čo si vyžiadalo chirurgickú revíziu. Migrácia elektródy bola zistená u jedného pacienta (1,7 %) a poškodenie elektródy tiež u jedného pacienta (1,7 %). Migrovaná aj poškodená elektróda boli operačne vymenené. U niektorých pacientov sme pozorovali aj komplikácie súvisiace so stimuláciou, a to najčastejšie dyzartriu a psychiatrické komplikácie.
U pacienta s rozvojom ischemického infarktu okolo elektródy DBS sme pozorovali prechodnú psychomotorickú pasivitu s úpravou do 1 dňa po skončení operácie, v dlhodobejšom časovom horizonte 4 rokov sa u pacienta postupne rozvinul dementný syndróm. Klinický obraz s možnou cerebrovaskulárnou etiológiou sme v sledovanom súbore zaznamenali u ďalších štyroch pacientov. Počas operácie sa u nich prechodne objavili príznaky, ako je centrálna lézia VII. hlavového nervu, hemiparéza, pasivita a somnolencia. Tieto príznaky trvali rádovo niekoľko minút. K odozneniu týchto príznakov došlo v priebehu pár sekúnd. Pooperačné zobrazovacíe vyšetrenia u týchto pacientov boli bez krvácania alebo ischemického infarktu.
Charakteristika pacientov aj s výskytom rizikových faktorov vzniku ischémie je uvedená v tab. 1 (pacient s ischemickými ložiskami po DBS-1) [2]:
Table 1. Charakteristika pacientov so vznikom cievnej nehemoragickej komplikácie DBS s výskytom rizikových faktorov vzniku ischémie. 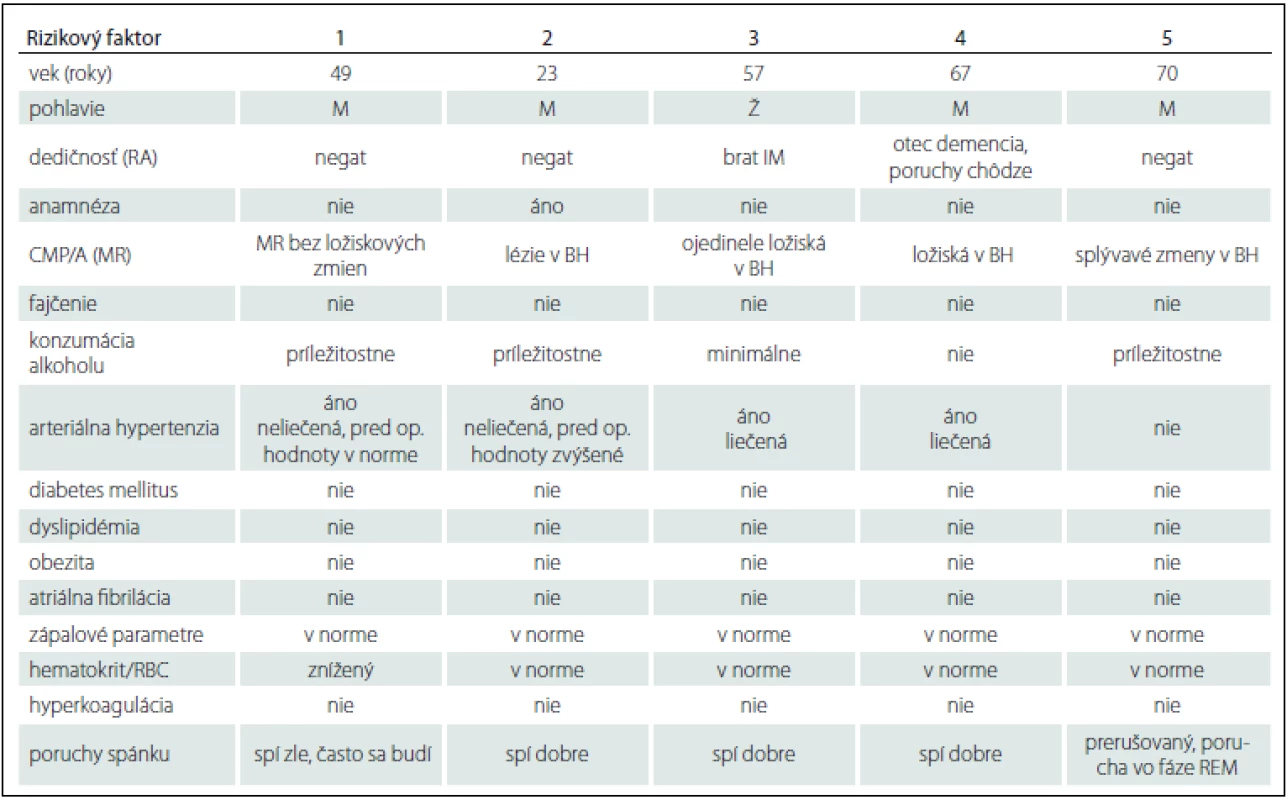
DBS – hlboká mozgová stimulácia; RA – rodinná anamnéza; IM – infarkt myokardu; BH – biela hmota; RBC – počet erytrocytov; CMP/TIA – cievná mozgová príhoda/tranzitorná ischemická ataka; MR – magnetická rezonancia; REM – rapid eye movement; M – muž; Ž – žena Kazuistika
U pacienta s PD so vznikom ischemického infarktu v súvislosti s implantáciou systému DBS bola diagnóza PD stanovená 9 rokov pred operáciou, v priebehu ochorenia bola opakovane upravovaná antiparkinsonská medikamentózna liečba. Napriek tomu sa začali vyskytovať motorické fluktuácie s ,,off“ symptómami vrátane freezingu chôdze a dyskinéz na vrchole dávky. Neuropsychologické vyšetrenie verifikovalo ľahký kognitívny deficit nedosahujúci stupeň demencie, pacient bol bez signifikantnej depresívnej symptomatológie. Levodopový test objektivizoval 60% zlepšenie stavu hybnosti na škále MDS-UPDRS (Movement Disorder Society-Unified Parkinson‘s Disease Rating Scale – jednotná škála k hodnocení Parkinsonovy nemoci).
Indikácia DBS bola realizovaná podľa štandardných kritérií. Elektródy sme implantovali bilaterálne do STN. Pacient 49-ročný muž, kontrolovaný hypertonik. Počas hospitalizácií v súvislosti s predoperačnými vyšetreniami ani v súvislosti s implantáciou sme výraznejšie zvýšené hodnoty tlaku krvi nezaznamenali.
Implantáciu elektród sme začali vľavo podľa dominancie príznakov parkinsonizmu, použili sme päť MER elektród, pričom typický MER záznam sme zaznamenali vo všetkých piatich elektródach, v priebehu trajektórie najdlhší v centrálnej a zadnej elektróde. Peroperačná stimulácia bola s dobrým efektom bez nežiaducich účinkov. Definitívna elektróda bola implantovaná v centrálnej trajektórii. Vpravo sme taktiež primárne implantovali päť MER elektród. Tieto v zapojení vykazovali primerané impedancie, napriek tomu pri MER nebol hodnotiteľný záznam ani v jednej elektróde. Preto sme jednu MER elektródu vymenili. Ani to nedokázalo zlepšiť kvalitu signálu. Takže sme následne pokračovali v tzv. peroperačnej stimulácii. Zvolená bola centrálna trajektória s prítomným pozitívnym efektom na ústup parkinsonizmu (najmä bradykinézy a rigidity). Pacient počas zákroku dovtedy spolupracoval primerane, na konci operácie však ostával pasívnejší. Redukcia psychomotorickej spontánnej aktivity ako aj reaktivity na výzvy pokračovala aj po operácii s úpravou do 1 dňa od operácie, po operácii pacient popisoval kŕče na stehne v ľavej dolnej končatine.
Pooperačne sa zaznamenali subfebrility a vzostup zápalových parametrov charakterizovala hodnota C reaktívneho proteínu 2 dni po operácii 167 mg/ l; bola ponechaná antibiotická liečba ceftriaxonom do 7. dňa po operácii. Na 3. deň po operácii bolo vzhľadom na to zrealizované CT vyšetrenie s nálezom hypodenzného ložiska v bielej hmote okolo elektródy vpravo veľkosti 37 × 32 mm v transverzálnej rovine (obr. 1).
Image 1. CT vyšetrenie 3. deň po operácii s hypodenzným ložiskom okolo elektródy vpravo. Fig. 1. CT scan 3 days after operation with hypodense lesion around electrode on the right side. 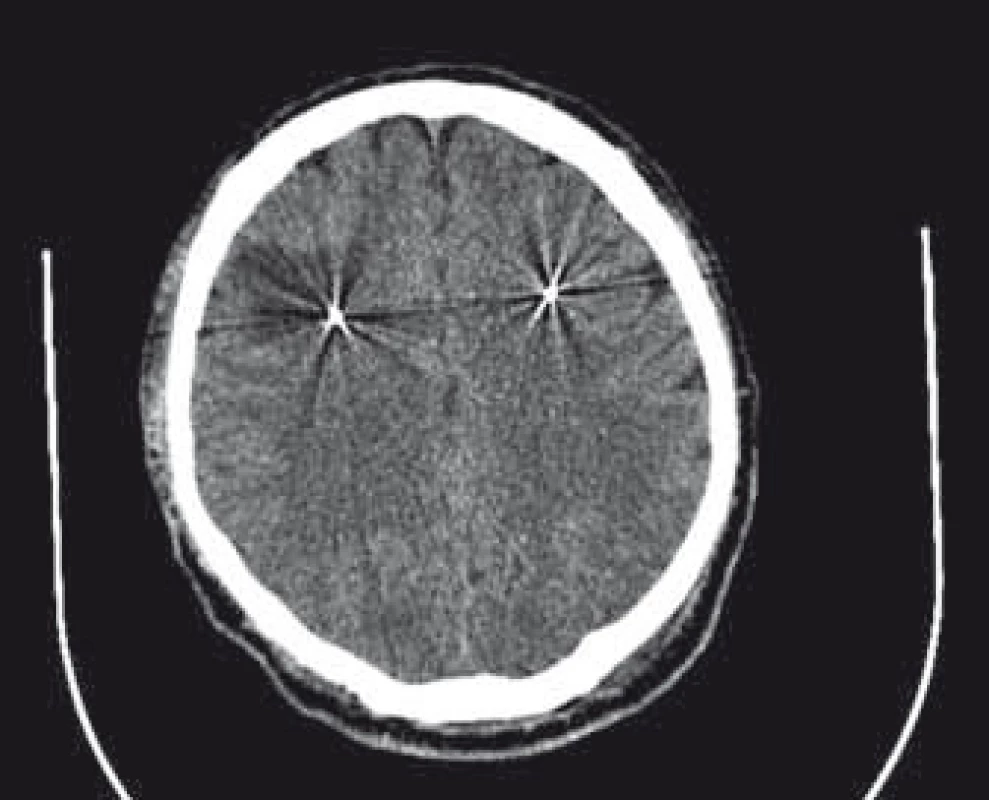
Vzhľadom na podozrenie na neuroinfekciu sme zrealizovali lumbálnu punkciu, ktorej výsledok bol negatívny. Kontrolné CT na 5. deň po operácii bolo s nálezom stacionárneho obrazu hypodenzity vpravo. Na kontrolnom CT vyšetrení na 10. deň po operácii bol obraz mierne zväčšeného ložiska vpravo na 48 × 46 mm v transverzálnej rovine, objavilo sa však nové podobné ložisko ischemického charakteru veľkosti do 28 mm v bielej hmote aj okolo ľavej elektródy (obr. 2). Dvanásť dní po implantácii elektród sme internalizovali neurostimulátor. Na 22. deň po implantácii elektród sme zrealizovali MR vyšetrenie, na ktorom ložisko vľavo vykazuje hyperintenzitu v DWI (difúzne vážené sekvencie) subakútneho ischemického charakteru a ložisko vpravo v chronickej fáze sa zobrazuje ako glióza v okolí elektródy v chronickej fáze ischémie (obr. 3). U pacienta sa v priebehu 4 rokov postupne vyvinul dementný syndróm. Kontrolné MR realizované 4 roky po operácii zobrazuje naďalej oblasť širokej gliózy v okolí elektród.
Image 2. CT vyšetrenie 10. deň po operácii s ložiskom vpravo; objavilo sa podobné ložisko ischemického charakteru okolo elektródy vľavo. Fig. 2. CT scan 10 days after operation with lesion on the right side; similar ischemic lesion developed around electrode on the left side. 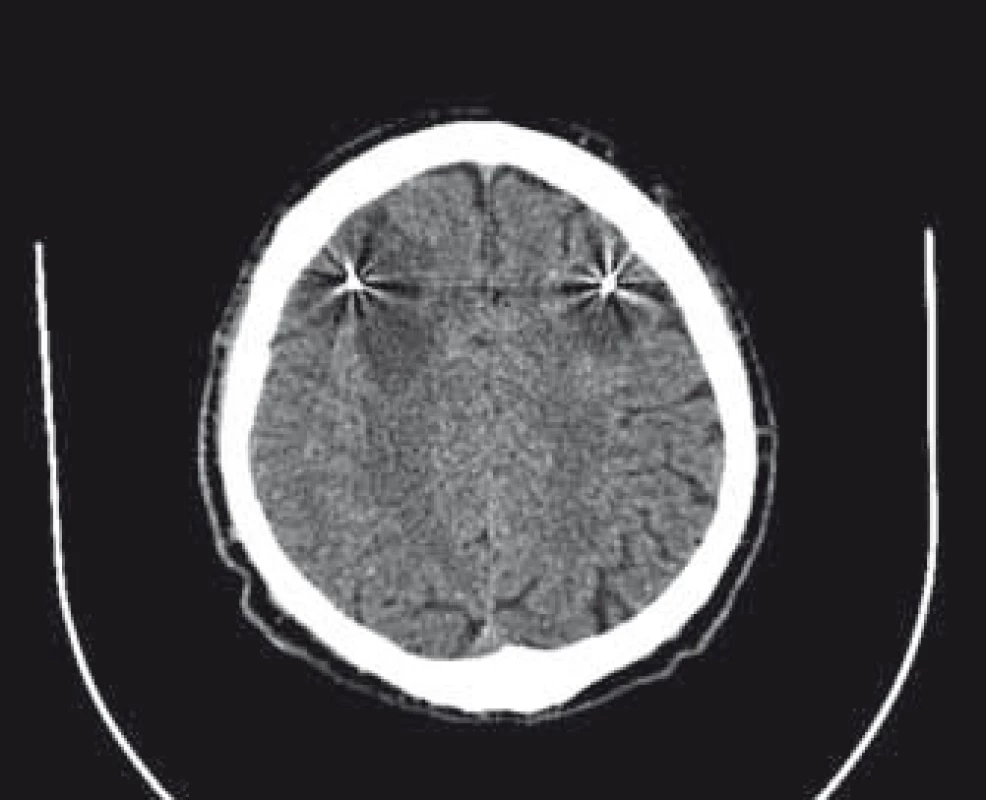
Image 3. Subakútny ischemický infarkt hyperintenzívny na DWI MR okolo ľavej elektródy; glióza okolo pravej elektródy. Fig. 3. Subacute ischemic infarction around left electrode on diffusion weight ed imaging MRI; gliosis around right electrode. 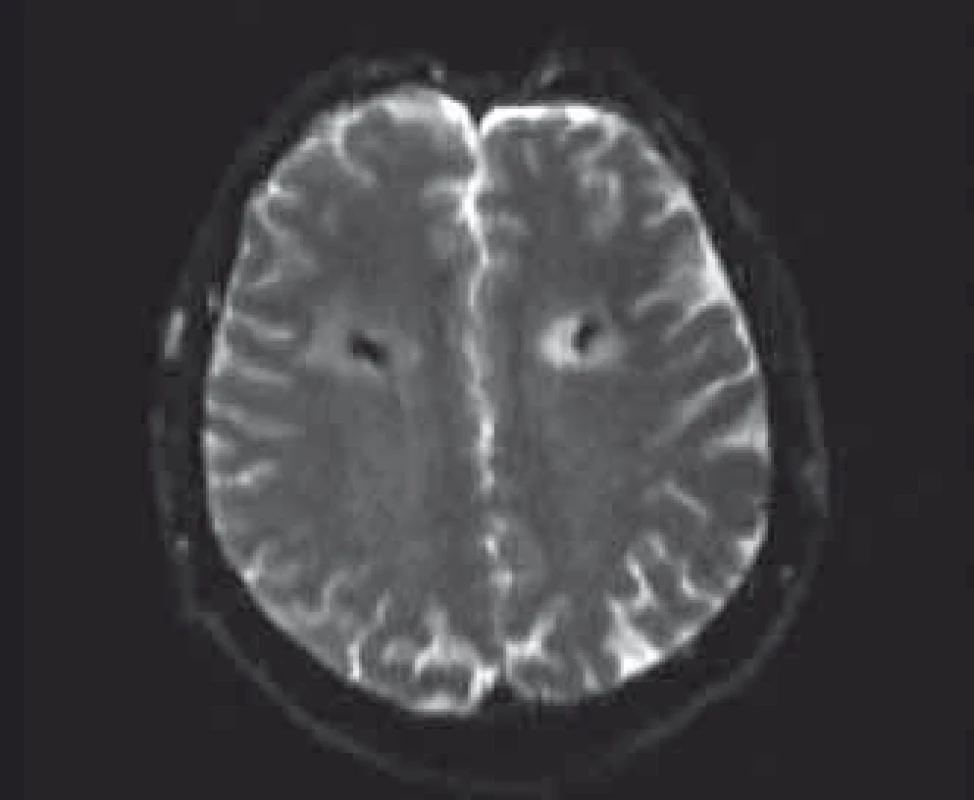
Diskusia
V sledovanom súbore 58 pacientov sme v časovej súvislosti s DBS identifikovali 1 pacienta so vznikom ischemického infarktu okolo elektródy pri jej implantácii do STN vpravo. K vzniku ďalšej nehemoragickej lézie vľavo došlo s odstupom času pravdepodobne až 10 dní po operácii. U ďalších štyroch pacientov sme pozorovali akútny rozvoj neurologických príznakov s pravdepodobnou cerebrovaskulárnou etiológiou. Celkovo bol výskyt cievnych nehemoragických komplikácií v sledovanom súbore 8,6 %. V literatúre nachádzame niekoľko prípadov ischemického infarktu po DBS (tab. 2).
Table 2. Prípady vzniku ischemického infarktu po DBS v literatúre. 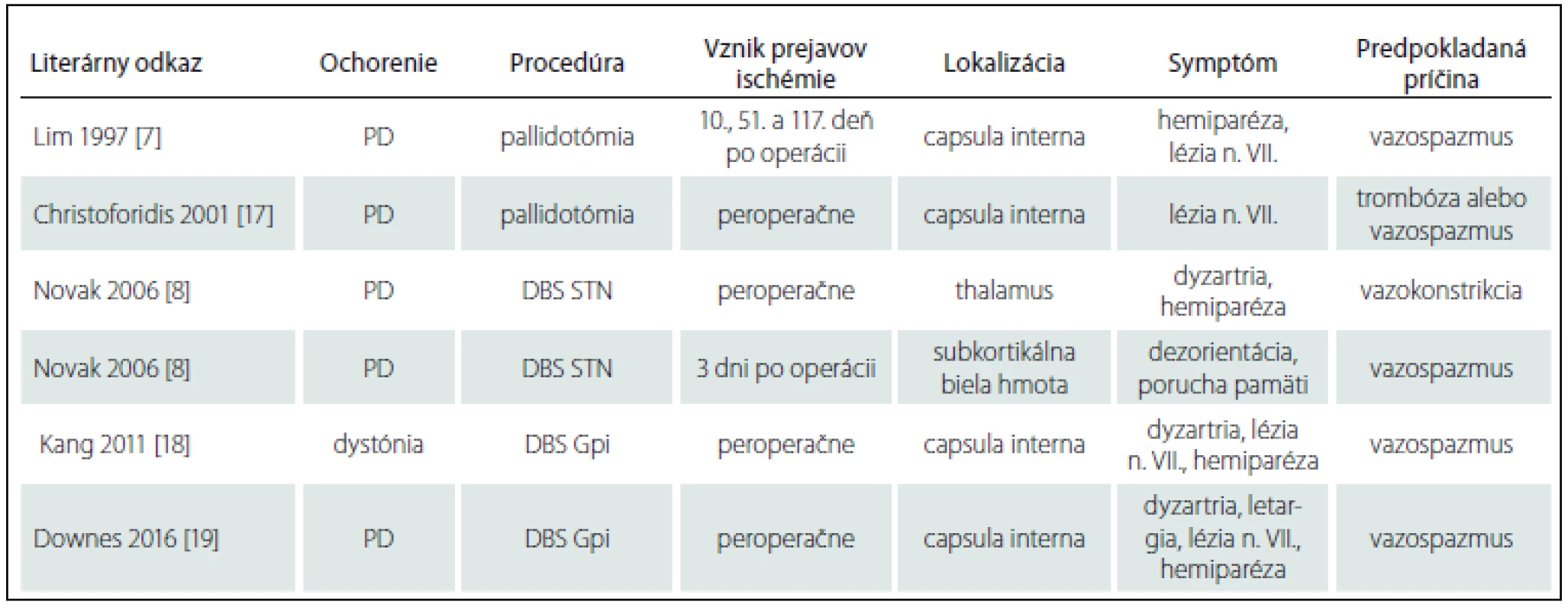
DBS – hluboká mozgová stimulácia, STN – subthalamické jadro, PD – Parkinsonova choroba, Gpi – globus pallidus internus Veľa pozornosti sa venuje hemoragickým komplikáciám pri DBS ako potenciálne devastujúcim stavom s možnými trvalými neurologickými následkami po operácii, avšak systematicky sa zabúda na nehemoragické cievne komplikácie v súvislosti s DBS.
Medzi nehemoragické lézie v okolí elektród DBS patria reaktívne zmeny v okolí elektródy – fibrózne puzdro hrúbky 5 – 25 µm, na ktoré nadväzuje vrstva reaktívnej gliózy do hrúbky 500 µm, ďalej je to edém, ktorý po určitej dobe po implantácii vymizne [4], cystické zmeny v okolí elektródy [3 – 6].
Medzi cievne nehemoragické komplikácie po DBS sa radí aj vznik ischemického infarktu. Nevieme veľa o rizikových faktoroch, ktoré môžu k tejto komplikácii viesť. Lim et al a Novak et al poukázali pri týchto prípadoch na ich vyššiu incidenciu u pacientov s preexistujúcim ochorením malých ciev a preexistujúcimi oblasťami ischémie v mozgu [7,8].
V niektorých prípadoch boli počas operácie pozorované zmeny na MER v zmysle až úplného vymiznutia celulárnej aktivity [8]. Vymiznutie MER aktivity sme tiež pozorovali u pacienta so vznikom ischemického infarktu. U väčšiny pacientov však tento nález nie je pozorovaný a je nespoľahlivým indikátorom vzniku ischémie. Pravdepodobne podmienkou vzniku tohto javu je určitý rozsah funkčnej poruchy a vzniku ischémie už počas MER. Je možné, že patologické zmeny sa môžu vyvíjať v závislosti od sprievodných faktorov, ako je tlak krvi, hemodynamické parametre krvi a k rozvoju funkčných zmien dochádza až v neskoršom období.
U nami popisovaného prípadu dochádza k rozvoju ischemického infarktu bilaterálne. Prvé vzniká ložisko vpravo peroperačne. Druhé ložisko sa na zobrazovacích vyšetreniach objavuje až 10 dní po operácii.
Vo všetkých popisovaných prípadoch sa ako príčina označuje vazospazmus.
Artériospazmy sú najčastejšie definované ako prolongovaná vazokonstrikcia jednej alebo viacerých intrakraniálnych artérií spôsobujúca hypoperfúziu mozgového tkaniva v povodí spastickej cievy, ktorá môže viesť k rozvoju ischémie mozgu.
Vazospazmus najčastejšie vzniká ako dôsledok subarachnoidálnej hemorágie (SAH), ale popisované sú aj ďalšie príčiny vazospazmu, ako traumatické poranenie mozgu bez SAH, mechanické podráždenie v okolí cievy najmä tlak a strihové napätie (shear stress) [9,10].
Štúdie potvrdili, že nie každý vazospazmus má za následok manifestné prejavy ischemického poškodenia mozgu. Toto vysvetľuje vyššiu incidenciu spazmov v porovnaní s incidenciou neurologického deficitu [11,12].
Môže sa vyskytovať aj dočasná funkčná porucha mozgového tkaniva bez zobrazenia na zobrazovacích vyšetreniach pri znížení lokálnej cerebrálnej perfúzie v zmysle vzniku ischemickej penumbry. V tomto stave dochádza k poruche elektrickej komunikácie medzi neurónmi, oxiadačný metabolizmus je redukovaný, ale nervové bunky v tejto oblasti sú živé, a môžu znova nadobudnúť svoje funkcie [13].
Pri vazospazmoch dochádza k štrukturálnym zmenám v stene cievy s následným zúžením jej priesvitu [14]. Znížený prietok krvi mozgom (cerebral blood flow; CBF) pri vazospazme pretrváva približne 3 týždne, najnižšie hodnoty prietoku sú v druhom týždni po hemorágii, kedy môže vzniknúť DCI (delayed cerebral ischemia) [10,15].
V prípadoch popisovaných v literatúre sa najčastejšie objavujú príznaky s cerebrovaskulárnou etiológiou peroperačne. Sú však popisované aj prípady ischémií vzniknutých až v pooperačnom období [7,8].
Vzhľadom na priebeh vazospazmov, štrukturálne zmeny steny cievy a závislosti rozvoja vazospazmu od faktorov ako arteriálny tlak krvi, hemodynamické krvné parametre je možný aj vznik transientných prejavov vo včasnom pooperačnom období.
Medzi najčastejšie komplikácie po DBS patria transientné príznaky ako dezorientácia, zmätenosť, psychomotorická pasivita. Aj keď sa jedná väčšinou o transientné poruchy, u niektorých pacientov môžu ovplyvňovať potrebnú compliance pacienta, pooperačnú starostlivosť aj očakávania pacienta a jeho príbuzných. Presný mechanizmus ich vzniku nie je objasnený. Môže sa na nich podieľať mikrolezionálny efekt v kombinácii s pooperačnými úpravami antiparkinsonickej liečby a ovplyvnenie limbických a asociačných oblastí cieľových štruktúr [16].
Výskyt vazospazmov a ich klinických následkov môže byť podhodnotený a zároveň sa im nevenuje pozornosť v zmysle dôslednejšieho pomenovania rizikových faktorov a prípadnej liečby či už všetkých pacientov alebo pacientov z rizikových skupín.
Pacient so vznikom ischémie po DBS mal predoperačne znížené hodnoty hematokritu a ľahkú anémiu, čo sa v literatúre popisuje ako jeden z možných faktorov podieľajúcich sa na vzniku ischemického infarktu. V tejto kpine pacientov je častejšie zastúpené mužské pohlavie, často sú predoperačne na MR vyšetrení prítomné nešpecifické zmeny v bielej hmote (BH) ischemického pôvodu, u jedného z pacientov s dystóniou bola v anamnéze prítomná predchádzajúca TIA so zmenami v BH. Ďalším rizikovým faktorom môže byť arteriálna hypertenzia. Je možné, že sa efekt rizikových faktorov pri vzniku vazospazmu kumuluje.
V kontexte s uvedenenými mechanizmami vzniku vazospazmu a následne rozvojom ischemického infarktu alebo transientnej funkčnej poruchy mozgového tkaniva predpokladáme, že u pacientov v našom súbore sa jednalo o prejavy cerebrovaskulárnej etiológie, pričom v jednom prípade došlo k ischemickému infarktu peroperačne s jeho kontralaterálnou recidívou na 10. deň po operácii.
Záver
Cievne nehemoragické komplikácie patria medzi menej často popisované komplikácie DBS. Predpokladaná príčina ich vzniku je najčastejšie vazospazmus. Výskyt vazospazmov a ich klinických následkov môže byť podhodnotený. Vazospazmus môže viesť k rozvoju ischemického infarktu alebo transientnej funkčnej poruchy mozgového tkaniva, a to nielen počas operácie, ale aj v pooperačnom období. Medzi najčastejšie komplikácie DBS patria transientné príznaky v súvislosti s operáciou ako dezorientácia, zmätenosť, psychomotorická pasivita. Presný mechanizmus ich vzniku nie je objasnený. V tejto súvislosti môže byť navodenie vazospazmu jednou z možných príčin týchto stavov.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Michal Kľoc
Neurochirurgická klinika LF UK, SZU a
UNB, nemocnica akad. L. Dérera
Limbová 5
833 05 Bratislava
Slovenská republika
e-mail: klocmichal@gmail.com
Přijato k recenzi: 20. 7. 2017
Přijato do tisku: 28. 8. 2017
Sources
1. Kleiner-Fisman G, Herzog J, Fisman DN et al. Subthalamic nucleus deep brain stimulation: summary and meta-analysis of outcomes. Mov Disord 2006;21(14):290 – 304. doi: 10.1002/ mds.20962.
2. Soler EP, Ruiz VC. Epidemiology and risk factors of cerebral ischemia and ischemic heart diseases: similarities and differences. Curr Cardiol Rev 2010;6(3):138 – 49. doi: 10.2174/ 157340310791658785.
3. Griffith RW, Humphrey DR. Long-term gliosis around chronically implanted platinum electrodes in the Rhesus macaque motor cortex. Neurosci Lett 2006; 406(1-2): 81 – 6. doi: 10.1016/ j.neulet.2006.07.018.
4. Haberler C, Alesch F, Mazal PR, et al. No tissue dama-ge by chronic deep brain stimulation in Parkinson‘s disease. Ann Neurol 2000; 48 : 372 – 6. doi: 10.1002/ 1531-8249(200009)48 : 33.3.0.CO;2-0.
5. Lefaucheur R, Derrey S, Borden A, et al. Post-operative edema surrounding the electrode: an unusual complication of deep brain stimulation. Brain Stimul 2013;6(3):459 – 60. doi: 10.1016/ j.brs.2012.05.012.
6. Sharma VD, Bona AR, Mantovani A. Cystic Lesions as a Rare Complication of Deep Brain Stimulation. Movement Disorders Clinical Practice 2015;3(1):87 – 90. doi: 10.1002/ mdc3.12230.
7. Lim JY, De Salles AA, Bronstein J, et al. Delayed internal capsule infarctions following radiofrequency pallidotomy. Report of three cases. J Neurosurg 1997;87(6): 955 – 60. doi: 10.3171/ JNS.1997.87.6.0955.
8. Novak KE, Nenonene EK, Bernstein LP, et al. Two cases of ischemia associated with subthalamic nucleus stimulator implantation for advanced Parkinson‘s disease. Mov Disord 2006;21(9):1477 – 83. doi: 10.1002/ mds.20947.
9. Alford PW, Dabiri BE, Goss JA, et al. Blast-induced pheno-typic switching in cerebral vasospasm. Proc Natl Acad Sci USA 2011;108(31):12705 – 10. doi: 10.1073/ pnas.1105860108.
10. Pluta RM. Delayed cerebral vasospasm and nitricoxide: review, new hypothesis, and proposed treatment. Pharmacol Ther 2005;105(1):23 – 56. doi: 10.1016/ j.pharmthera.2004.10.002.
11. Claassen J, Bernardini GL, Kreiter K, et al. Effect of cisternal and ventricular blood on risk of delayed cerebral ischemia after subarachnoid hemorrhage: The Fisher Scale Revisited. Stroke 2001;32(9):2012 – 20. doi: 10.1161/ hs0901.095677.
12. Goldsher D, Shreiber R, Shik V, et al. Role of multisection CT angiography in the evaluation of vertebrobasilar vasospasm in patients with subarachnoid hemorrhage. Am J Neuroradiol 2004; 25(9): 1493 – 8. doi: 10.3174/ ajnr2004.25.9.1493 – 8.
13. Hakim J. The penumbra: The therapeutic window. Neurology 1998;51(3):44 – 6. doi: 10.1212/ wnl.51.3_Suppl_3.S44.
14. Weaver JP, Fisher M. Subarachnoid hemorrhage: an update of pathogenesis, diagnosis and management. J Neurol Sci 1994;125(2):119 – 31. doi: 10.1016/ 0022-510X(94)90024-8.
15. Diehl RR. Cerebral autoregulation studies in clini-cal practice. Eur J Ulrasound 2002;16(1–2):31 – 6. doi: 10.1016/ s0929.826600048.4.
16. Abulseoud OA, Kasasbeh A, Min HK, et al. Stimulation-induced transient nonmotor psychiatric symptoms following subthalamic deep brain stimulation in patients with Parkinson‘s disease: association with clinical outcomes and neuroanatomical correlates. Stereotact Funct Neurosurg 2016;94(2):65 – 72. doi: 10.1159/ 000445076.
17. Christoforidis GA, Spickler EM, Papaioannou G, et al. Lacunar infarct during pallidotomy: case report. Neuroradiology 2001;43(4):321 – 4. doi: 10.1007/ s002340000505.
18. Kang DW, Kim HY, Chang JW. Cerebral ischemia related to globus pallidus internus stimulation for cervical dystonia. Stereotact Funct Neurosurg 2011;89(4):201 – 4. doi: 10.1159/ 000325655.
19. Downes AE, Pezeshkian P, Behnke E et al. Acute ischemic stroke during deep brain stimulation surgery of globus pallidus internus: report of 5 cases. Operative Neurosurgery 2016;12(4):383 – 90. doi: 10.1227/ neu.0000000000001359.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2017 Issue 6-
All articles in this issue
- Využití ultrazvuku pro navigaci v neurochirurgii
- H-reflex – jeho role v neurofyziologii a klinice
- Moderní techniky MR zobrazení u roztroušené sklerózy
- Případ časné neurosyfilis s neurokognitivní poruchou
- Periferní paréza lícního nervu vázaná na cestování letadlem
- AMETYST – výsledky observační studie fáze IV sledující účinky intramuskulárně podávaného interferonu beta-1a u pacientů s klinicky izolovaným syndromem/ klinicky definitivní roztroušenou sklerózou
- Hodnocení životní spokojenosti u pacientů s klinicky izolovaným syndromem
- Krátký test slovní paměti pomocí věty u Alzheimerovy nemoci
- Kdy operovat zlomeniny spánkové kosti?
- Cievne nehemoragické komplikácie hlbokej mozgovej stimulácie
- Účinky robotické rehabilitace chůze na psychosomatické indikátory u osob s různou etiologií lehké mentální retardace
- Prediktory pozitivního léčebného výsledku u pacientů s akutní cévní mozkovou příhodou podstupujících endovaskulární léčbu - výsledky z registru CERBERUS
- Kvantitativní analýza MRI textury pro rozlišení enhancujících a neenhancujících T1 hypointenzních lézí bez podání kontrastní látky u roztroušené sklerózy
- Syndrom reverzibilní mozkové vazokonstrikce
- Závažný serotoninový syndrom
- Předávkování baklofenem a klonazepamem u pacienta s chronickou bolestí krční páteře a ramen
- Nová mutace v genu GIGYF2 u pacienta s Parkinsonovou chorobou
- Stereotaktická biopsie mozku pomocí bezrámové navigace – výhody, omezení a technické tipy
- Dermatomyositis – úvodní projev pokročilého stadia primárního karcinomu ovaria z prstenčitých buněk
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Krátký test slovní paměti pomocí věty u Alzheimerovy nemoci
- Moderní techniky MR zobrazení u roztroušené sklerózy
- H-reflex – jeho role v neurofyziologii a klinice
- Kdy operovat zlomeniny spánkové kosti?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

