-
Medical journals
- Career
Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
Authors: F. Kurinec 1; B. Rudinský 2; L. Marinčák 3
Authors‘ workplace: Otorinolaryngologická klinika FNsP Nové Zámky 1; Neurochirurgická klinika FNsP Nové Zámky 2; CEIT Biomedical Engineering, s. r. o., Košice 3
Published in: Cesk Slov Neurol N 2016; 79/112(6): 723-727
Category: Case Report
Overview
Fibrózna dysplázia je zriedkavé nemalígne ochorenie kostí. Kosť postihnutá touto poruchou je nahradená abnormálnym fibróznym spojivovým tkanivom. Toto fibrózne tkanivo oslabuje kosť, ktorá sa stáva fragilnou a je náchylná k fraktúre. Fibrózna dysplázia môže postihovať len jednu kosť (monoostotická forma) alebo viaceré kosti skeletu (polyostotická forma). Fibrózna dysplázia sa obvykle vyskytuje u detí a mladistvých, ale niektoré ľahšie prípady nemusia byť diagnostikované hneď a zistia sa až v dospelosti. V tejto kazuistike popisujeme manažment a chirurgické riešenie rozsiahlej fibróznej dysplázie u 29-ročného muža.
Kľúčové slová:
fibrózna dysplázia – kraniofaciálna oblasť – chirurgická liečbaÚvod
Fibrózna dysplázia je vzácna benígna choroba neznámej etiologie spôsobená postzygotickou mutáciou GNAS génu, ktorá vedie k inhibícii diferenciácie a proliferácie buniek strómy kostného tkaniva a nahrádza normálnu kosť a kostnú dreň vláknitým tkanivom a vláknitou kosťou. Táto choroba môže byť lokalizovaná na jednej kosti (monoostotická forma) alebo na viacerých miestach skeletu (polyostotická forma). Niekedy je fibrózna dysplázia spojená s extraskletelálnymi prejavmi na koži alebo na endokrinných orgánoch, čo označujeme ako McCune-Albrightov syndróm. U tejto choroby sa môže meniť tak klinické správanie ako aj rýchlosť rastu kostných lézií, čo potom sťažuje rozhodovanie o správnom spôsobe liečby [1].
Prvý presný opis tohto patologického stavu pochádza od von Recklinghausena, Wirchowovho študenta. Avšak tieto charakteristické kostné lézie boli identifikované už v 7. storočí. McCune, Bruch a Albright so spolupracovníkmi publikovali v prácach nezávisle od seba v roku 1937 stav, ktorý označovali ako „osteodystrophia fibrosa disseminata“ charakterizovaný endokrinopatiami, kožnou hyperpigmentáciou a predčasnou pubertou u žien. Táto ťažká forma fibróznej dysplázie sa stala neskôr známa jako Albrightova triáda alebo McCune-Albrightov syndróm. Termín fibrózna dysplázia a polyostotická fibrózna dysplázia prvý krát navrhol Lichtenstein v roku 1938 [2].
Monoostotická forma je najčastejší typ, ktorý sa vyskytuje v 70 % prípadov, a to hlavne na dlhých kostiach. Polyostotická forma býva približne v 30 % prípadov, z ktorých je však viac ako polovica na kostiach hlavy a krku. McCune-Albrightov syndróm je približne v 3 % prípadov.
Príznaky fibróznej dysplázie závisia od typu a umiestnenia lézie. Sú to predovšetkým asymetria a deformity tváre, poruchy vízu, poškodenie sluchu, obštrukcia nosovej dutiny, bolesti a parestézie. Mnohí pacienti sú bez príznakov a deformitu tváre alebo asymetriu si všimnú rodinní príslušníci alebo priatelia, ktorí pacienta dlhší čas nevideli. Niekedy sa zistí lézia ako náhodný nález na RTG snímke alebo na CT [3].
Odhaduje sa, že pacienti s fibróznou dyspláziou majú až 400krát vyššiu pravdepodobnosť vzniku malígneho nádora kosti ako ostatná populácia. Z tohto dôvodu sa neodporúča rádioterapia. Liečba sa riadi hlavne sledovaním lézií v pravidelných intervaloch u malých lézií, rôznymi kozmetickými úpravami u väčších lézií alebo kompletnou kostnou resekciou. Chirurgický zákrok je všeobecne určený na riešenie kozmetických tvárových deformít a na dekompresiu hlavových nervov. Abnormálna kosť musí byť kompletne odstránená. Chirurgická liečba sa zvyčajne odkladá až do adolescentného veku, ak však hrozí porucha nervovej funkcie, výkon sa robí skôr. Niektorí autori pri rekonštrukcii používajú opracované a stenčené bloky pôvodnej fibróznej kosti ako voľné štiepy [2,4], väčšina autorov však používa polymetylmetakrylátové (PMMA) alebo kovové, zväčša titánové implantáty. V našej literatúre Mihál et al popísali náhradu defektu kalvy s Palacosom [5].
Kazuistika
Muž, 29 rokov, bol vyšetrený v ambulancii všeobecného lekára pre bolesti hlavy na pravej strane. Už predtým si jeho priateľka všimla, že mu rastie hrčka nad pravým okom v blízkosti koreňa nosa. Bol odoslaný na neurologickú ambulanciu, kde mu odporučili CT vyšetrenie, na ktorom sa zobrazila rozsiahla tumorózna lézia etmoidovej kosti, prednej jamy lebkovej bázy, čelových kostí až takmer po koronárne sutúry a laterálne po fronto-zygomatické spojenie, stropu a mediálnej časti pravej orbity (os lacrimalis) s rastom do orbity ako aj koreňa nosa (obr. 1 – 3). K úvahe o operačnom riešení nás viedol rast kostného tumoru do orbity vpravo, zvýraznenie protrúzie bulbu vpravo v ostatných mesiacoch, zmeny v perimetri a zhoršenie pohyblivosti pravého bulbu, progredujúca deformita v oblasti čelových kostí a nosa, ako aj hrúbka frontálnych kostí zmenených nádorom s kompresiou čelových lalokov, resp. hrúbka stropu pravej orbity. Nakoniec sme sa rozhodli pre radikálnu resekciu nádorom zmenených kostných štruktúr a súčasnú rekonštrukciu vzniknutých kostných defektov v oblasti bázy a klenby lebečnej.
Image 1. Predoperačné CT vyšetrenie (axiálny rez) s nálezom kostného tumoru v oblasti prednej jamy lebkovej a prínosových dutín. Fig. 1. Preoperative CT scan (axial view) showing bone tumor within anterior cranial fossa and paranasal sinuses. 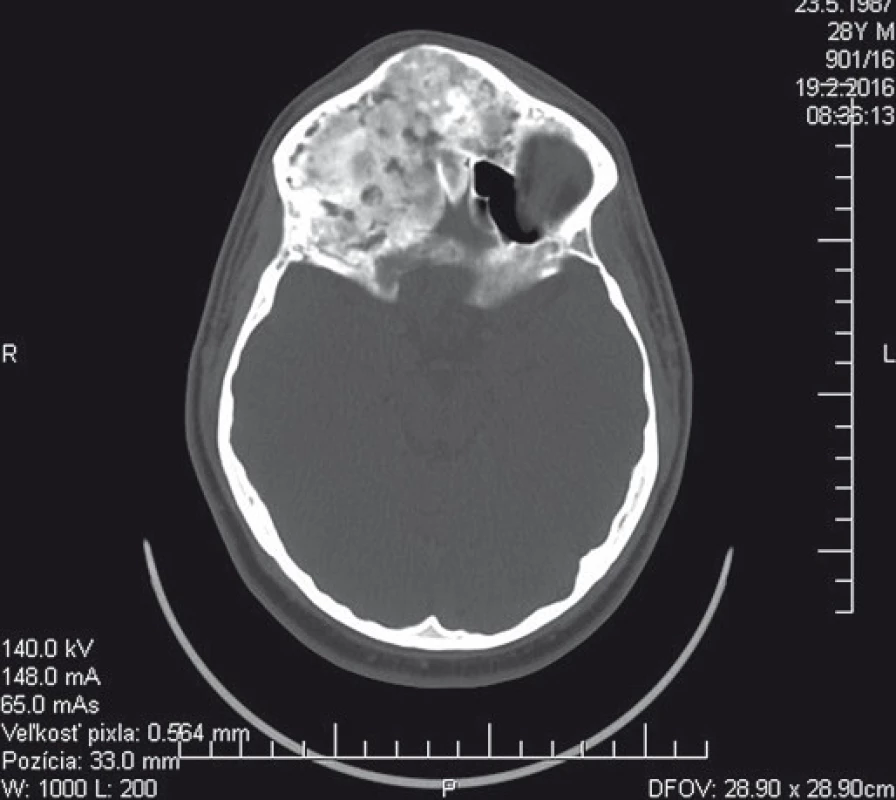
Image 2. Pooperačné CT vyšetrenie (axiálny rez), rekonštrukcia v oblasti lebkovej bázy a etmoidov. Fig. 2. Postoperative CT scan (axial view), reconstruction of radix nasi area and the orbital margining modelled using titanium mesh. 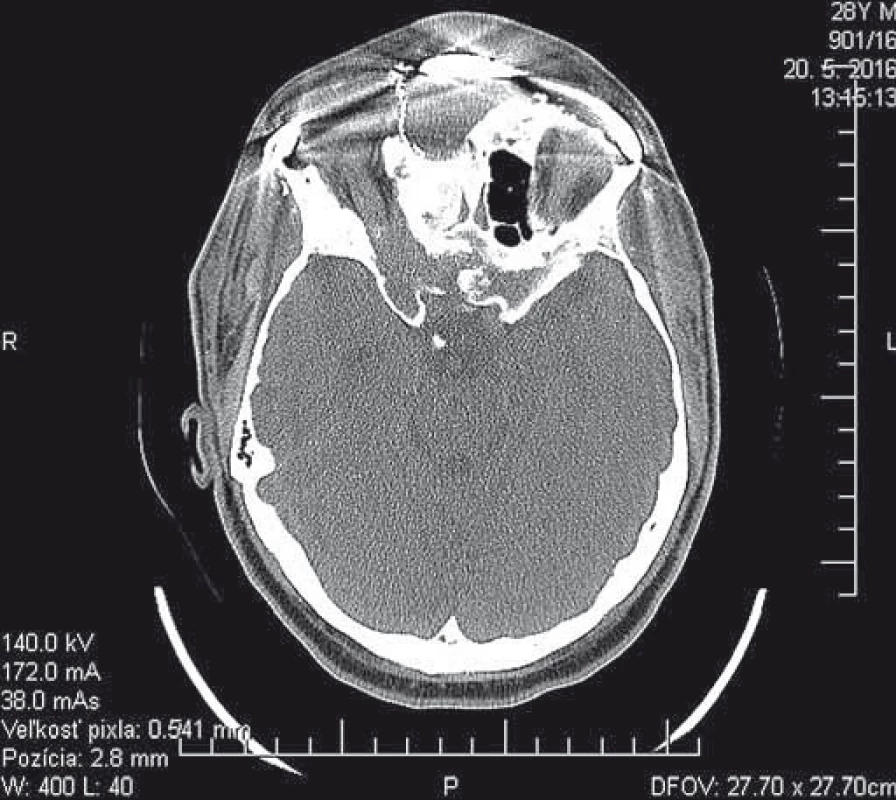
Image 3. Predoperačné CT vyšetrenie (sagitálny rez) – zrejmé je postihnutie bázy lebečnej, prínosových dutín ako aj hrúbka nádorom zmenených kostných štruktúr. Fig. 3. Preoperative CT scan (sagittal view) – apparent infiltration of cranial basis and paranasal sinuses as well as evident changes of thickness within tumour-aff ected bone tissue. 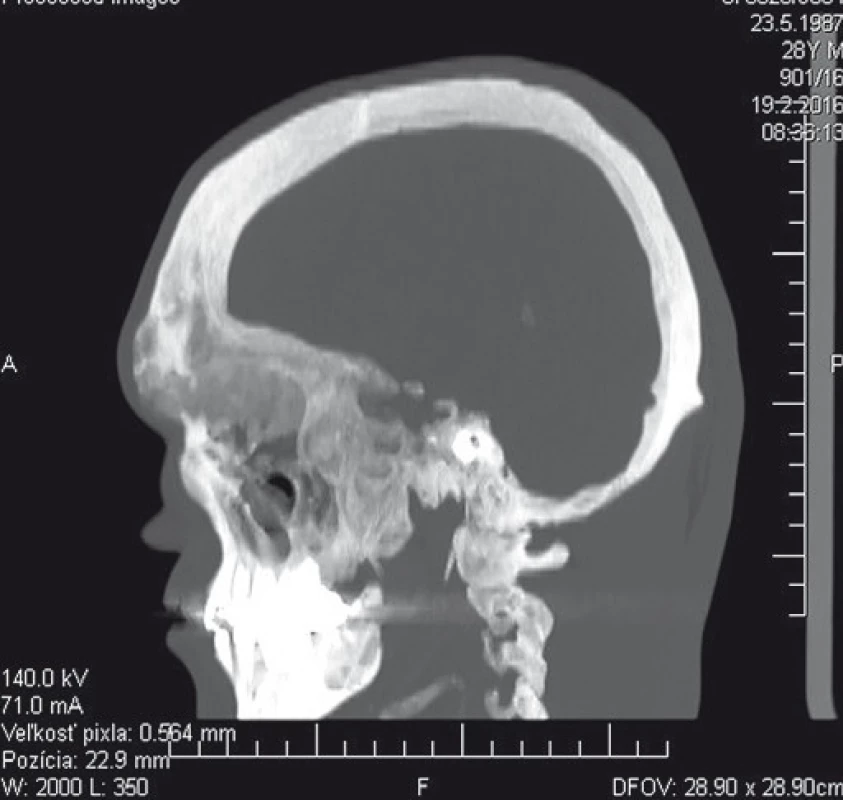
Pri realizácii tohto zámeru sme spolupracovali s odborníkmi v oblasti výpočtovej techniky, resp. výroby individuálnych implantátov z pórovitého titánu. Bol vyrobený pracovný plastový model, na ktorom boli stanovené hranice resekcie kostných štruktúr a na základe toho bol naprogramovaný titánový implantát a následne vyrobený na 3D tlačiarni. Tento proces bol veľmi náročný, najmä z hľadiska presnosti a naplánovania uchytenia implantátu (obr. 4).
Image 4. 3D CT rekonštrukcia s použitím filtra na zvýraznenie nádorom postihnutých kostných štruktúr s postihnutím oboch frontálnych kostí až po okraj orbity, dorzálne takmer až po koronárny šev a laterálne až po fronto-zygomatické spojenie, mediálnej plochy pravej orbity a koreňa nosa. Fig. 4. A 3D CT reconstruction image with a filter to enhance tumour-aff ected bone tissue showing involvement of both frontal bones up to orbital margins, almost reaching the coronal suture dorsally and zygomaticofrontal junction, medial area of the right orbit and radix nasi laterally. 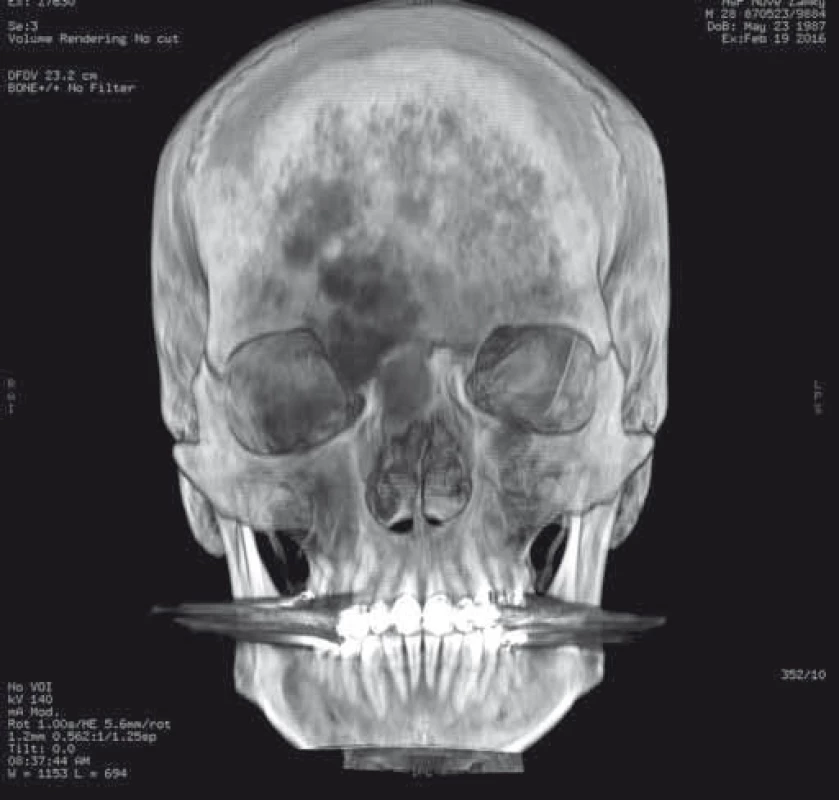
Pri samotnej operácii bol z bikoronárneho kožného rezu vytvorený priestor pre postupnú resekciu čelových kostí, až po okraj orbít a laterálne po fronto-zygomatické spojenie. Hrúbka kosti dosahovala dorzo-frontálne cca 20 mm, smerom do oblasti koreňa nosa až 35 mm. Tu sme použili postupnú, blokovú, tzv. salámovú resekciu kosti, za použitia špeciálnych fréz, vrtákov a v oblasti orbity aj s použitím ultrazvukovej odsávačky so špeciálnym násadcom. Po odtlačení čelových lalokov sme extradurálne realizovali resekciu stropu pravej orbity aj s dekompresiou optického nervu pri vstupe do orbity. Následne sme resekovali tumorom postihnutú prednú časť čuchovej jamy, kde nádor plynule prechádzal do etmoidových dutín, resp. rástol v oblasti mediálnej plochy pravej orbity (os lacrimalis). Resekovali sme podstatnú časť fibrózne zmenenej kosti laterálnej časti (lamina cribriformis) v okolí canalis opticus, kde sme uvoľnili n. opticus od tumorovej masy. Nakoniec sme resekovali podstatnú časť nádoru v oblasti etmoidového labyrintu, ponechali sme len tenkú časť kosti etmoidového labyrintu, aby sme neporušili sliznicu v nosovej dutine, pričom sme sa v kostnej mase orientovali pomocou neuronavigácie. Pred samotným zahájením rekonštrukčnej fázy sme upravili okraje kostnej resekcie po jej obvode s použitím špeciálne vyrobených titánových šablón, aby sme celý implantát mohli bezproblémovo uchytiť.
Rekonštrukciu vzniknutých kostných defektov sme zahájili rekonštrukciou stropu orbity titánovou 3D sieťkou, ktorú sme fixovali titánovými samoreznými skrutkami. Následne sme realizovali rekonštrukciu mediálnej plochy pravej orbity ako aj koreňa nosa s použitím titánovej 3D sieťky. Rekonštruovanú spodinu prednej jamy sme prekryli fasciami z tkanivovej banky, ktoré sme fixovali do okolia. Na okraje fascie sme ešte aplikovali tkanivové lepidlo. Nakoniec sme položili na kostný defekt kalvy titánový implantát, ktorý sme fixovali titánovými skrutkami na vopred určené miesta okraja kostného defektu. Následne sme prekryli implantát kožným lalokom.
Pooperačný priebeh bol bez výraznejších komplikácií, okrem podkožného hematómu resp. opuchu rozsiahleho kožného laloka a očných viečok. Pri rekonštrukcii sme na krytie titánových sieťok použili fasciu a tkanivové lepidlo. Do nosovej dutiny sme vložili vazelínovú tamponádu, ktorú sme odstránili po siedmich dňoch. V pooperačnom priebehu sme nepozorovali likvoreu, nález sme kontrolovali endoskopicky. Nedošlo k zhoršeniu klinického neurologického nálezu ani k zhoršeniu oftalmologického nálezu. Kontrolné 3D CT vyšetrenie preukázalo správne postavenie implantátov, v súlade s plánom rekonštrukcie pred operáciou (obr. 5 – 7). Histopatologické vyšetrenie potvrdilo nález fibróznej dysplázie v súlade s predoperačnou probatórnou excízionálnou biopsiou z etmoidového labyrintu (obr. 8).
Image 5. Plánovanie na počítači (volumetrická štúdia), stanovenie rozsahu resekcie a uchytenia titánového implantátu. Fig. 5. The PC planning (volumetric study), determining the extent of tissue resection and anchoring points for titanium implants. 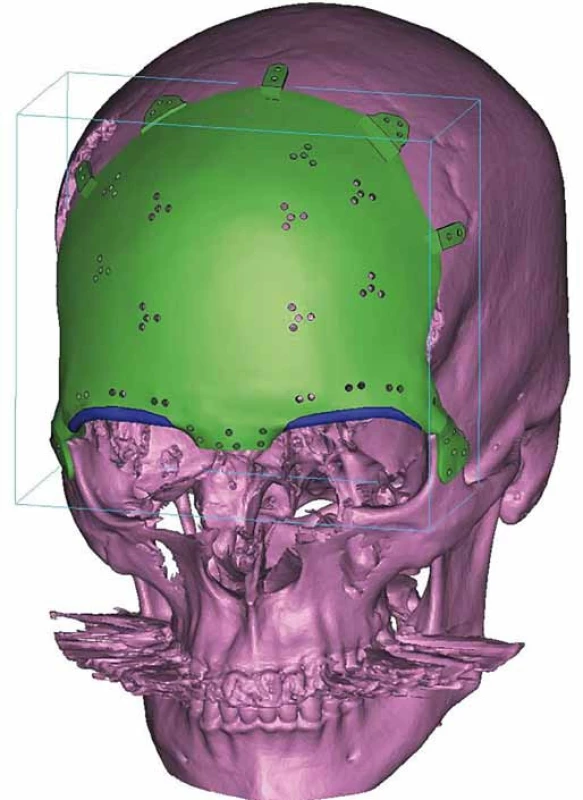
Image 6. Detailný pohľad 3D CT rekonštrukcie na oblasť koreňa nosa, okraja orbity, ktoré boli domodelované použitím 3D titánovej sieťky. Fig. 6. Detailed 3D CT reconstruction depicting radix nasi area and the orbital margins shaped using 3D titanium mesh. 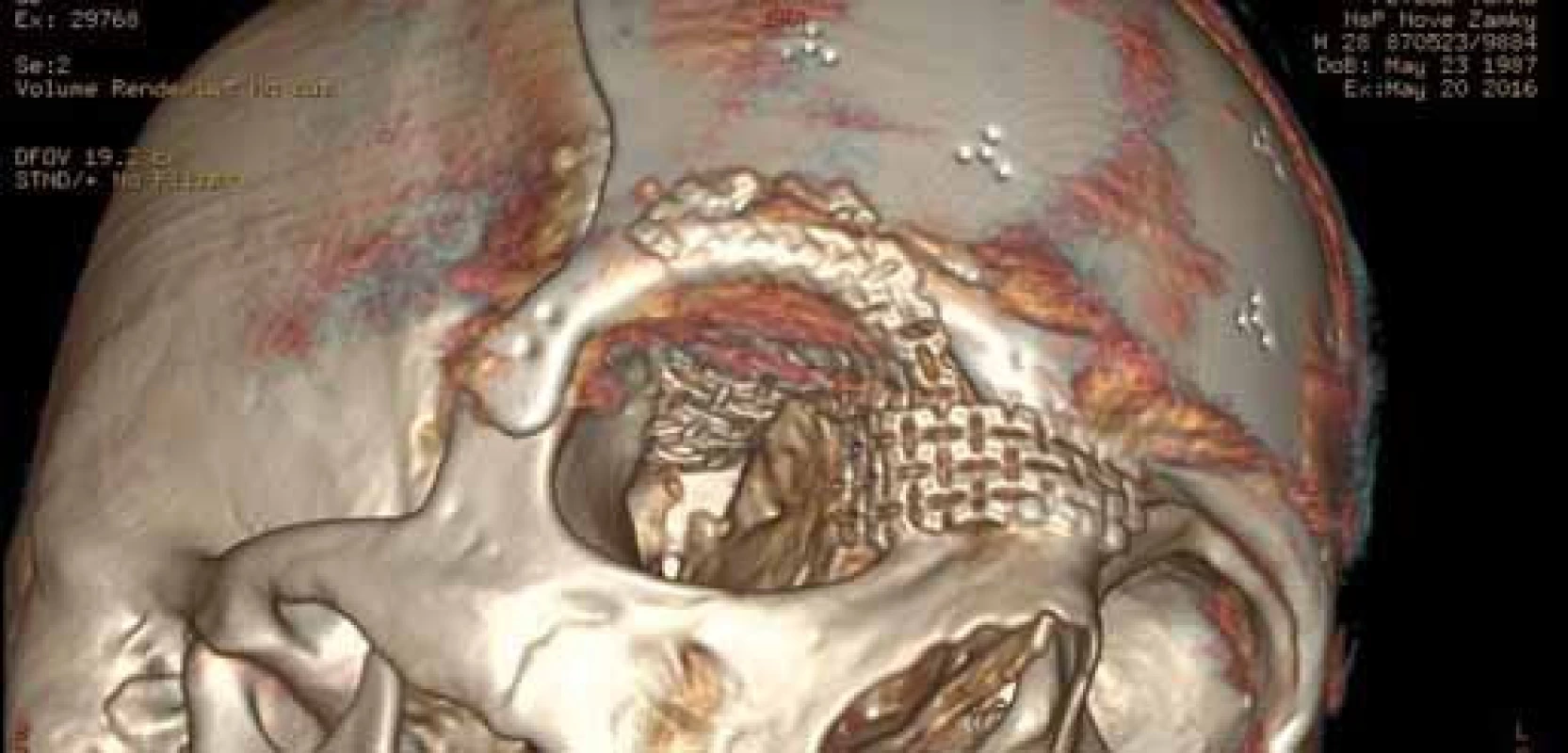
Image 7. 3D CT rekonštrukcia s titánovým implantátom a jeho uchytením frontodorzálne resp. v oblasti fronto-zygomatického spojenia. Fig. 7. A 3D CT of a reconstruction with titanium implants and its anchoring within dorsofrontal and frontozygomatic area. 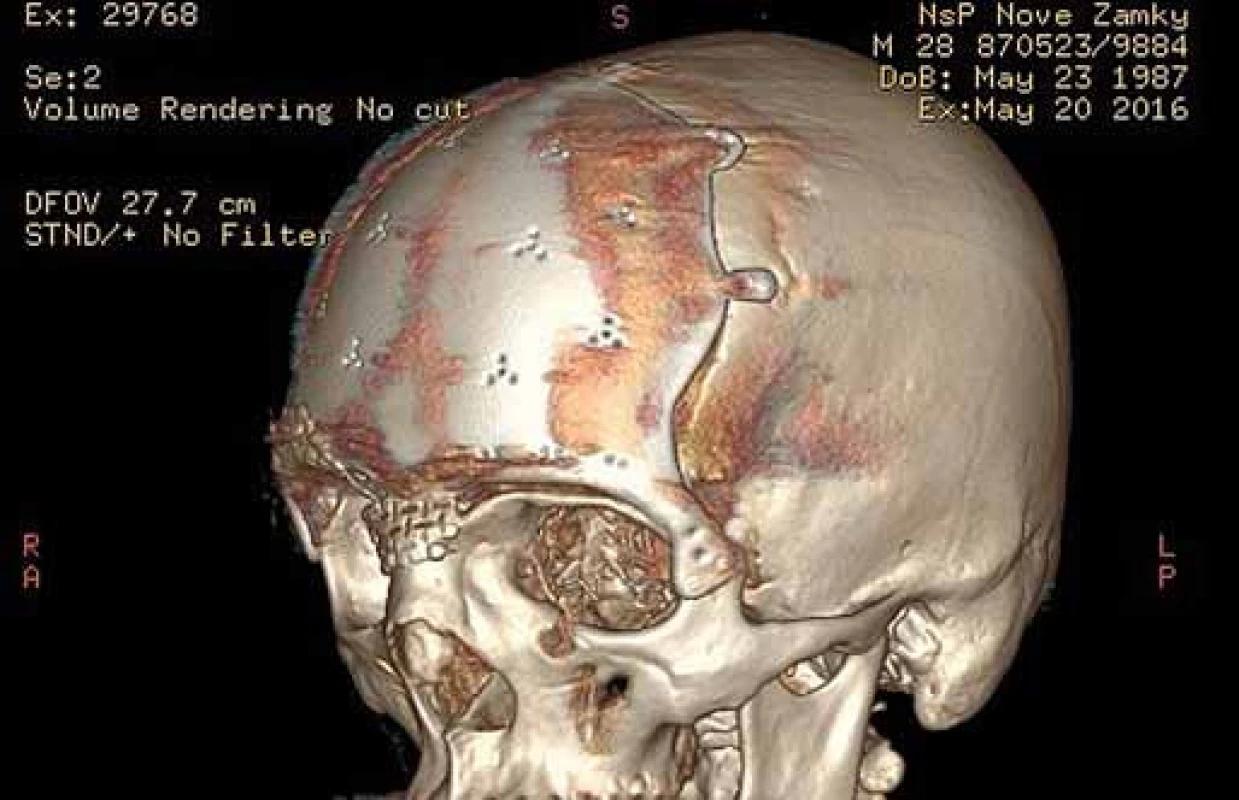
Image 8. Histologický obraz fibróznej dysplázie. Fig. 8. Histological picture of fibrous dysplasia. 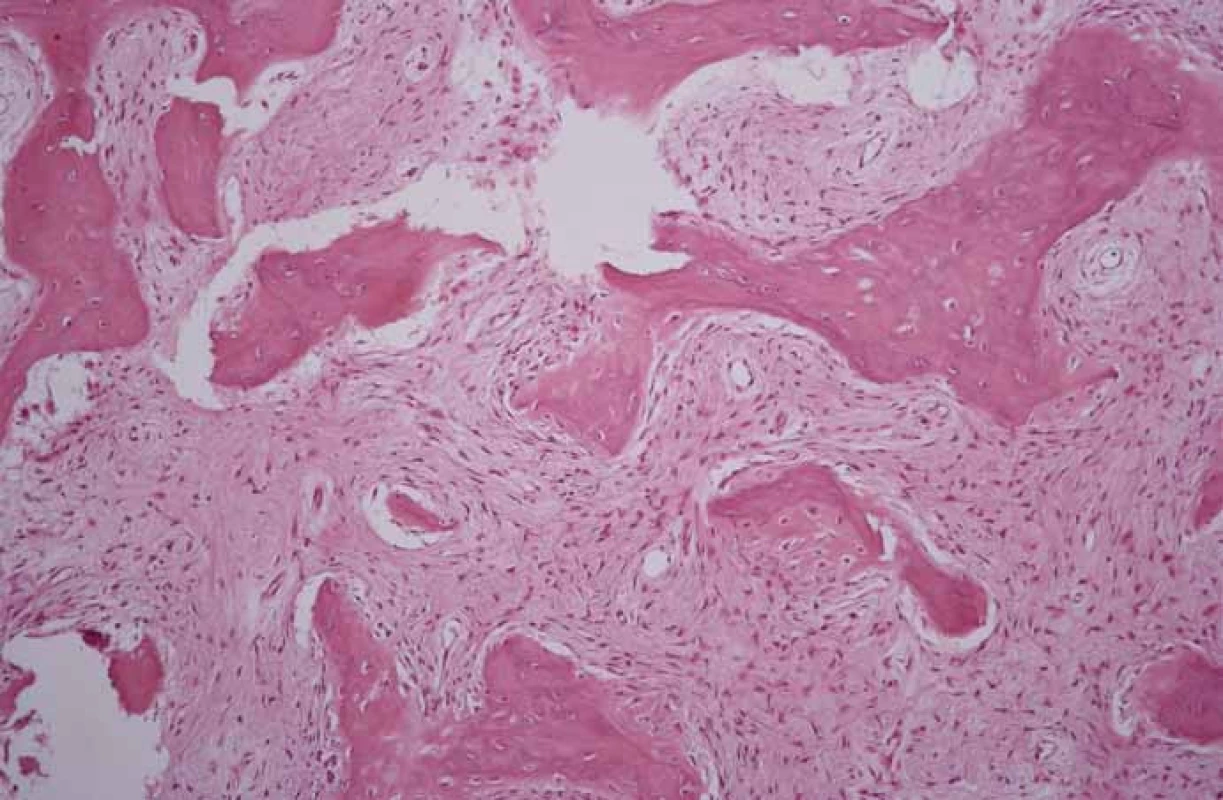
Spongióza je tu nahradená bunkovým väzivovým tkanivom, niekde usporiadaným do uzlovitého tvaru, v ktorom sú nepravidelné trámce pletivovej kosti bez osteoklastového lemu (farbenie H-E, 200x). Bone spongiosa is replaced with cellular connecting tissue randomly arranged in knot-like formations containing irregular bone spicules without the osteoclast layer (staining of H-E, 200x). Diskusia
Fibrózna dysplázia sa najčastejšie chová ako pomaly rastúca lézia. Deformita tváre a zmena anatomických pomerov v priľahlých štruktúrach, napr. zrakového nervu, očného bulbu, nosovej dutiny, kostičiek stredného ucha a zubov, sú postupné a zákerné. Menej často, hlavne u mladých ľudí pred pubertou, môžu lézie progredovať veľmi rýchlo. Takýto rast môže byť spojený s ďalšími patologickými léziami, ako sú napr. aneuryzmálne kostné cysty alebo mukokély, alebo môže dôjsť raritne k malígnej transformácii. Malígne zmeny typu osteosarkómu sú zriedkavé a tvoria menej jako 1 % prípadov [6,7]. Ak dôjde k rýchlemu rastu, lézie môžu poškodiť zrakový nerv, môže byť vytlačený bulbus, môže dôjsť k upchatiu nosovej dutiny a pod. Niektorí autori preto obhajujú agresívnu chirurgickú liečbu, aby sa zabránilo možnému oslepnutiu alebo strate sluchu. Posledné výskumy však ukazujú, že agresívne správanie lézií s rýchlym rastom je skôr výnimočné, a dnes je pohľad na túto chorobu opatrnejší a konzervatívnější [8,9]. Údaje z literatúry ukazujú, že závažné deformity a príznaky sa objavujú u pacientov s nadbytkom produkcie rastového hormónu. V retrospektívnej štúdii 266 sériových kostných skenov od 66 pacientov s rozsiahlou polyostotickou formou fibróznej dysplázie Hart et al ukázali, že 90 % lézií sa za 15 rokov nezmenilo [1,10]. Pokiaľ dochádza k rýchlemu rozvoju lézií a k poruche zraku, sluchu, k obštrukcii dýchacích ciest alebo k parestéziám a neuralgiám, chirurgické riešenie by malo byť urobené čo najskôr. V operačnom tíme by mali byť neurochirurgovia, kraniofaciálni chirurgovia, čeľustní ortopédi, otorinolaryngológovia a oční chirurgovia v závislosti od príznakov a lokalizácie dysplastických lézií. Bežné nálezy u polyostotickej formy fibróznej dysplázie v okolí očného bulbu sú proptóza a dystopia. Tie sú spôsobené ložiskami v čelovej kosti, sfenoidovej kosti a v čuchovej kosti. K menej častým príznakom patrí neuropatia n. opticus, strabizmus, problémy s pohyblivosťou mihalníc, nazolabiálna obštrukcia a neuralgia n. trigeminus [11]. Kontroverzná oblasť je dysplázia klinovej kosti, v ktorej je kanál n. opticus, najmä u pacientov, ktorí nemajú poruchu zraku. Klinici predpokladajú, že ak je takáto kosť postihnutá fibróznou dyspláziou, môže dôjsť k rýchlej strate zraku. Niektoré štúdie udávajú, že najčastejšou neurologickou komplikáciou je strata zraku, preto mnohí chirurgovia v minulosti doporučovali profylaktickú dekompresiu zrakového nervu [1,12]. Bohužiaľ dekompresia často nevedie k žiadnemu zlepšeniu, ale môže viesť niekedy až k oslepnutiu. Okrem toho je tendencia kosti dorásť na pôvodnú úroveň. Len čo je určené, že existuje fibrózna dysplázia v okolí zrakového nervu a orbity, malo by byť urobené komplexné neurooftalmologické vyšetrenie. Toto by malo byť robené jedenkrát ročne. Vyšetrenie by sa malo sústrediť na posúdenie neuropatie. Mala by sa vyšetriť zraková ostrosť, perimeter, senzitivita kontrastu, farbocit, pupilárny reflex, pohyblivosť bulbu, exoftalmometria a priechodnosť slzného kanálika. Novou diagnostickou metódou je tzv. optická koherentná tomografia, ktorá používa prierezy zrakového nervu s vysokým rozlíšením na určenie hrúbky nervových vláken (Retinal Nerve Fiber Layer; RFNL). Tenká RNFL koreluje s vizuálnymi zmenami polí a je dôkazom optickej neuropatie. Ak je RNFL tenká už pred operáciou, je nepravdepodobné, že operácia zlepší vízus, zatiaľ čo pacient s normálnou RNFL môže mať určité zlepšenie po dekompresii [13]. Etiológia zmien vízu a straty vízu u pacientov s kraniofaciálnou fibróznou dyspláziou stále zostáva nejasná. Je však pravdepodobné, že k tomu prispieva najčastejšie vysoká hladina rastového hormónu, čo vedie postupne k strate zraku. V prípadoch iných lézií, ako napr. aneuryzmovej kostnej cysty alebo mukokély, k strate zraku dochádza rýchlejšie. Štúdia Cutlera ukázala, že u 12 % pacientov s ťažkou kraniofaciálnou fibróznou dyspláziou bola preukázaná optická neuropatia. Pacienti s vysokou hladinou rastového hormónu mali štyrikrát vyššie relatívne riziko neuropatie zrakového nervu v porovnaní s pacientami s normálnou hladinou tohoto hormónu. Pacienti s vysokou hladinou rastového hormónu by teda mali byť riešení operačne čo najagresívnejšie. Takisto pacienti s akútnym zhoršením vízu alebo straty zraku by mali okamžite podstúpiť neurochirurgický zákrok [1,14].
Zatiaľ čo bolesť je bežná u pacientov s fibróznou dyspláziou, existuje málo štúdií na posúdenie prípadov, vplyvu analgetík na priebeh ochorenia a účinnosť rôznych modalít liečby. Kelly et al skúmali 78 pacientov [15] – 67 % z nich sa sťažovali na bolesť. Niektorí pacienti dostávali nesteroidné antiflogistiká, iní boli liečení s bifosfonátmi. Dospelí mali väčšie bolesti ako deti. Napriek vysokej prevalencii kraniofaciálnej fibróznej dysplázie, menej ako 50 % pacientov sa sťažovalo na bolesť. Použitie bifosfonátov (alendronát, pamidronát alebo kyselina zoledrónová) je považované za prospešné na zníženie bolesti a na zníženie rastu lézií [15].
Záver
Fibrózna dysplázia v kraniofaciálnej oblasti sa môže prejaviť rôznym spôsobom. Moderné zobrazovacie metódy a histopatologické vyšetrenie nám určia diagnózu veľmi jednoducho a presne. Chirurgická resekcia v tejto zložitej anatomickej oblasti je náročná s cieľom zachovania nervových funkcií. Ešte náročnejšia je rekonštrukcia tak rozsiahleho defektu, ako to bolo v prezentovanom prípade.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. František Kurinec
Otorinolaryngologická klinika
FNsP Nové Zámky
Slovenská 11 A
940 34 Nové Zámky
e-mail: frantisek.kurinec@nspnz.sk
Prijato k recenzii: 7. 6. 2016
Prijato do tlače: 27. 7. 2016
Sources
1. Lee JS, Fitzgibbon EJ, Chen YR, et al. Clinical guidelines for the management of craniofacial fibrous dysplasia. Orphanet J Rare Dis 2012;7(Suppl 1):S2. doi: 10.1186/ 1750-1172-7-S1-S2.
2. Lustig LR, Holliday MJ, McCarthy EF, et al. Fibrous dysplasia involving the skull base and temporal bone. Arch Otolaryngol Head Neck Surg 2001;127(10):1239 – 47.
3. Edgerton MT, Persing JA, Jane JA. The surgical treatment of fibrous dysplasia. Ann Surg 1985;202(4):459 – 79.
4. Cai M, Ma LT, Xu GZ, et al. Clinical and radiological observation in a surgical series of 36 cases of fibrous dysplasia of the skull. Clin Neurology Neurosurgery 2012;114(3):254 – 9. doi: 10.1016/ j.clineuro.2011.10.026.
5. Mihál V, Michálková K, Ehrmann J, et al. Fibrózní dysplazie lebky. Pediatr Praxi 2013;14(1):58 – 9
6. Martinez-Lage JL. Bony reconstruction in the orbit region. Ann Plast Surg 1981;7 : 464 – 79.
7. Lee JS, Fitzgibbon E, Butman JA, et al. Normal vision despote narrowing of the optic canal in fibrous dysplasia. N Engl J Med 2002;347(21):1670 – 6.
8. Diah E, Morris DE, Lo I, et al. Cyst degeneration in craniofacial fibrous dysplasia: clinical presentation and management. J Neurosurg 2007;107(3):504 – 8.
9. Michael CB, Lee AG, Patrinely JR, et al. Visual loss associated with fibrous dysplasia of the anterior skull base. Case report and review of the literature. J Neurosurgery 2000;92(2):350 – 4.
10. Chen YR, Chang CN, Tan YC, et al. Craniofacial fibrous dysplasia an update. Chang Gung Med J 2006;29(6):543 – 9.
11. Hart ES, Kelly MH, Brillante B, et al. Onset, progression, and plateau of skeletal lesions in fibrous dysplasia and the relationship to functional outcome. J Bone Miner Res 2007;22(9):1468 – 74.
12. Sassin JF, Rosenberg RN. Neurological complications of fibrous dysplasia of the skull. Arch Neurol 1968;18(4):363 – 9.
13. Pham TQ, Chua B, Gorbatov M, et al. Optical coherence tomography findings of acute traumatic maculopathy following motor vehicle accident. Am J Ophtalmol 2007;143(2):348 – 50.
14. Cutler CM, Lee JS, Butman JA, et al. Long-term outcome of optic nerve encasement and optic nerve decompression in patiens with fibrous dysplasia: risk factors for blindness and safety of observation. Neurosurgery 2006;59(5):1011–7.
15. Kelly MH, Brillante B, Collins MT. Pain in fibrous dysplasia of bone:age-related changes and the anatomical distribution of skeletal lesions. Osteoporos Int 2008;19(1):57 – 63.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 6-
All articles in this issue
- Deprese u vybraných neurologických onemocnění
- Návrh bezpečnostní MR monitorace u pacientů s roztroušenou sklerózou léčených natalizumabem
- Netestuj, ale POBAV – písemné záměrné Pojmenování OBrázků A jejich Vybavení jako krátká kognitivní zkouška
- Neuropsychologické abnormity v exekutivních funkcích u pacientů s blefarospazmem
- Význam testování termických prahů v detekci neuropatie tenkých vláken u diabetiků 1. typu
- Případ závažného průběhu HIV-1 meningoencefalitidy a lues secundaria
- Autoimunitní encefalitidy – kazuistiky
- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Strach související s bolestí u pacientů s chronickou bolestí dolní části zad
- Možnosti transkraniální sonografie na neuropsychiatrickém pomezí
- Úvod do neuromuskulární ultrasonografie
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
- Předoperační výkony v oblasti vizuální paměti jako prediktivní faktor kognitivních změn po hluboké mozkové stimulaci subthalamického jádra u Parkinsonovy nemoci
- Orbitocelulitida jako komplikace akutní rhinosinusitidy – naše zkušenosti s léčbou u dospělých pacientů
- Spinálny gossypibóm 20 rokov po lumbálnej diskektómii – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Deprese u vybraných neurologických onemocnění
- Autoimunitní encefalitidy – kazuistiky
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

