-
Medical journals
- Career
Bezpečnost karotického stentingu – srovnání protekčních systémů
Authors: O. Pavlík 1; D. Václavík 1; D. Kučera 2; J. Návratová 3; G. Solná 1; M. Rabasová 4
Authors‘ workplace: Vzdělávací a výzkumný institut Agel, Neurologické oddělení, Vítkovická nemocnice a. s., Ostrava 1; Vaskulární centrum, Vítkovická nemocnice a. s., Ostrava 2; Radiologické oddělení, Vítkovická nemocnice a. s., Ostrava 3; Katedra matematiky a deskriptivní geometrie, VŠB – Technická univerzita Ostrava 4
Published in: Cesk Slov Neurol N 2016; 79/112(5): 560-564
Category: Original Paper
Overview
Cíl:
Porovnat účinnost a bezpečnost distálního protekčního zařízení (Filtr) s proximální protekcí (Mo.Ma systém) během karotického stentingu (KAS) a potvrdit či vyvrátit nižší výskyt mikroembolizací při použití Mo.Ma systému. Určit efekt mikroembolizací na kognitivní funkce.Metodika:
Padesát šest pacientů bylo randomizováno do dvou skupin dle použité protekce (skupina Filtr vs. Mo.Ma). Všichni pacienti podstoupili magnetickou rezonanci (MR) mozku před výkonem a po něm. Třicet dva pacientů podstoupilo revidovaný Adenbrookský kognitivní test (ACE-R) před a měsíc po výkonu. Dále byl sledován výskyt 30denní mortality a morbidity.Výsledky:
Nové ischemické léze po KAS byly nalezeny celkem u 32,14 % pacientů (n = 18). Ve skupině Filtr (n = 37) u 32,43 % pacientů (n = 12), ve skupině Mo.Ma (n = 19) u 31,58 % (n = 6; p = 0,4741). Pouze 38,89 % lézí bylo lokalizováno čistě v povodí intervenované tepny, ve skupině Filtr 16,67 % (p = 0,006), ve skupině Mo.Ma 83,33 % (p = 0,037). Signifikantní pokles v ACE-R testu byl zaznamenán jednou.Závěr:
Nové ischemické léze po KAS jsme našli v obou sledovaných skupinách, předpokládaný nižší výskyt ve skupině Mo.Ma se nepotvrdil. Ve skupině Filtr bylo signifikantně více lézí lokalizováno mimo povodí intervenované tepny nebo ve více povodích současně. Ve skupině Mo.Ma bylo signifikantně více nových lézí v povodí intervenované tepny. Negativní vliv mikroembolizací na výsledek v ACE-R testech se nám nepodařilo prokázat.Klíčová slova:
stenóza karotidy – protekční zařízení – magnetická rezonance – kognitivní funkceÚvod
Karotický stenting (KAS) je uznávaná alternativní metoda v léčbě stenózy vnitřní karotické tepny (ACI) [1]. Počátky této metody se datují do roku 1980, kdy Kerber provedl první perkutánní transluminální angioplastiku k odstranění stenózy ACI [2].
Spolu s rozvojem této intervenční metody dochází současně i k rozvoji protekčních zařízení mozku (CPD), která chrání mozek před embolizací v průběhu stentingu. Již v roce 1983 popisují Vitek et al použití od stentu distálně umístěného balónu k ochraně mozku při výkonu [3].
První skupinou srovnávaných CPD jsou tzv. distální protekční systémy. Nejčastěji se jedná o košíček z porézního materiálu/síťky s otvory o velikosti řádově stovek mikrometrů. Košíček se rozvine v tepně nad místem výkonu a zachytává materiál, který se uvolnil během výkonu a putuje krevním řečištěm směrem do mozku. Po ukončení výkonu je košíček stažen z tepenného řečiště a vytažen i se zachyceným materiálem. Nevýhodou tohoto typu CPD je nutný průchod zařízení skrze stenózu tepny ještě před ošetřením stenózy a nedostatečné přiléhání košíčku ke stěně tepny, zejména v oblastech vinutí tepny.
Druhou skupinou jsou proximální CPD. Od distálních protekcí se zásadně liší v tom, že při jejich použití nedochází k průchodu CPD skrze stenózu tepny. Jejich konstrukce i použití je složitější. Před vlastním stentingem se provede balónková okluze vnější a společné karotické tepny. Tím dojde k zastavení krevního toku v ACI a zavede se vlastní stent. Po výkonu je z ACI aspirována krev, dochází tedy přechodně k obrácení toku v ACI a odstranění embolického materiálu z intervenované tepny. Po vypuštění obturačních balónků je tok krve v tepnách obnoven. Podmínkou použití proximální protekce je dobrá neurologická tolerance okluze společné karotické tepny v průběhu výkonu.
Použití CPD během KAS významně snižuje riziko kombinované 30denní mortality a morbidity ve srovnání s nechráněným stentingem [4]. Nicméně je známo, že i při nekomplikovaném průběhu KAS lze po výkonu zachytit na magnetické rezonanci (MR) mozku nové asymptomatické ložiskové změny odpovídající nově vzniklým ischemiím [5,6]. Jejich výskyt po KAS se dle jednotlivých studií různí – od 17,3 % [7] po 73 % [8] a vyskytují se po stentingu s protekcí i bez ní [8]. CPD významně snižují výskyt těchto nových ischemických lézí [9].
Příčinou nových ischemických lézí po KAS se nejčastěji uvádí mikroembolizace [5,6,10]. Při monitorování mikroembolických signálů (MES) transkraniálním dopplerovským vyšetřením během KAS lze dle Schmidta et al zjistit záchyt MES v průběhu celého výkonu, od umístění CPD, dosažení stenózy, zavedení stentu, roztažení stentu až po stažení protekčního zařízení [11]. Zdá se, že zásadní roli pro počet nových ischemií na MR po KAS má vedle použití CPD i pokles krevního tlaku v průběhu výkonu či po výkonu, kdy dochází ke snížení schopnosti cirkulace vymýt mikroemboly z mozkové cirkulace a vzniká více nových ischemických lézí než po výkonech bez poklesu tlaku [10]. Ačkoliv je výskyt těchto nových ischemických lézí po KAS vysoký, zůstávají v naprosté většině asymptomatické [5,6].
Efekt KAS na kognitivní funkce je stále nejasný [12,13]. V různých studiích a jejich metaanalýzách lze najít údaje o zlepšení i zhoršení kognitivních funkcí po KAS [12,13] a není možné z nich stanovit jednoznačný závěr. Za příčinu zhoršení kognitivního výkonu se považují mikroembolizace a hypoperfuze mozku během výkonu. Předpokladem pro zlepšení kognitivního výkonu je odstranění chronické hypoperfuze při stenóze ACI [14]. Bohužel většina studií zabývajících se bezpečností KAS sleduje pouze výskyt klasické kombinované mortality a morbidity. Kognitivní deficit nemusí být – zejména tam, kde není pacient sledován neurologem – považován za neurologický deficit a nemusí být po výkonu vůbec odhalen. Kognitivní testy by měly patřit mezi běžně sledované parametry po revaskularizačních výkonech obecně [12].
Metodika
Studie byla koncipována jako srovnávací, prospektivní, randomizovaná, monocentrická. V letech 2012–2015 jsme randomizovali a sledovali ve Vítkovické nemocnici v Ostravě pacienty, kteří byli indikační komisí složené z angiologa, cévního chirurga a neurologa indikováni ke karotickému stentingu. Indikační kritéria KAS se řídila aktuálními doporučeními American Stroke Association [15].
Vyloučeni byli pacienti s kontraindikací k provedení MR, kontraindikací k použití systému Mo.Ma (nevhodné anatomické podmínky k umístění systému, těžké aterosklerotické postižení společné či zevní karotické tepny, nemožnost femorálního přístupu, těžký neurologický deficit znemožňující kontakt s pacientem). Pacienti vhodní pro použití obou protekčních metod byli konsekventně randomizováni do dvou skupin 1 : 1. Skupina první byla stentována s protekcí distální (skupina Filtr), skupina druhá s protekcí proximální (skupina Mo.Ma).
Pacienti udělovali informovaný souhlas se zařazením do studie. Studie byla provedena v souladu s Helsinskou deklarací z roku 1975, revidovanou v letech 2004 a 2008 a byla schválena lokální etickou komisí Vítkovické nemocnice, a. s.
Pacienti byli před výkonem vyšetřeni neurologem, zhodnoceni pomocí NIHSS škály (National Institutes of Healt Stroke Scale), modifikované Rankinovy škály (mRS). Zhodnocení NIHSS a mRS bylo provedeno ještě v den propuštění pacienta ze zařízení a měsíc po výkonu. U pacientů jsme zaznamenávali výskyt sledovaných onemocnění (tab. 1).
Table 1. Základní charakteristiky souborů. 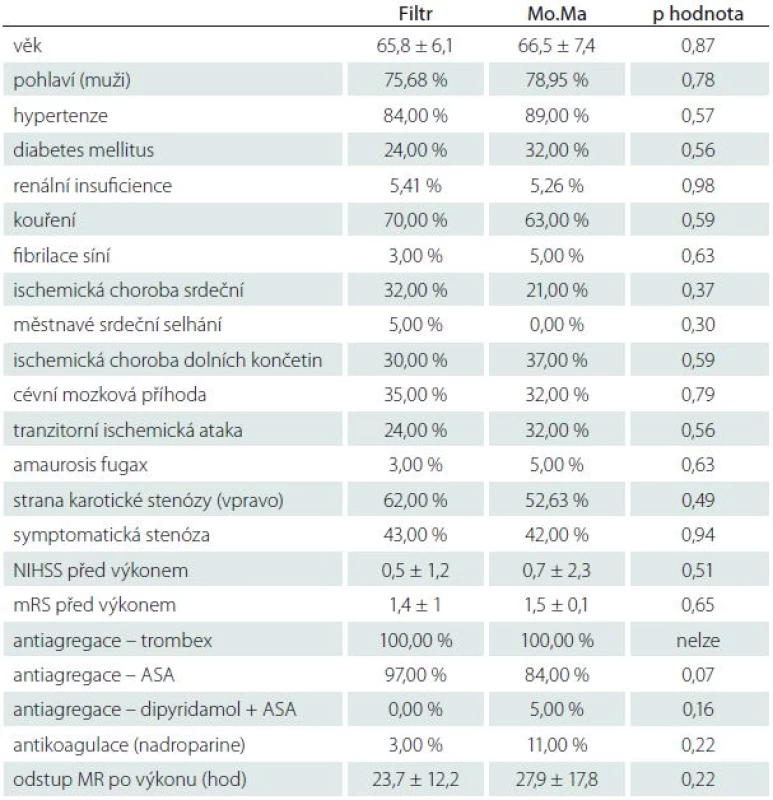
renální insuficience – sérová hladina kreatininu > 120 μmol/l, NIHSS – National Institute of Health Stroke Scale, mRS – modifikovaná Rankinova škála, MR – magnetická rezonance. Cíl studie
Vzhledem k principu obou protekčních zařízení jsme předpokládali, že výskyt nových ischemických lézí bude nižší ve skupině Mo.Ma. Dalším předpokladem bylo, že vícečetné mikroembolizace vznikající po výkonu mohou způsobovat v časovém odstupu zhoršení kognitivních funkcí.
Jako primární cíle byly zvoleny výskyt nových ischemických lézí na MR mozku po výkonu a pokles výkonu v Adenbrookském kognitivním testu. Mezi další sledované cíle patřily počet a distribuce dle povodí u nových ischemických lézí na MR mozku, výskyt cévní mozkové příhody, tranzitorní ischemické ataky, infarktu myokardu a úmrtí do 30 dní od výkonu.
Karotický stenting
Před výkonem užívalo 100 % pacientů 75 mg clopidogrelu denně, v kombinaci s kyselinou acetylsalicylovou (93 %), dipyridamolem (2 %) a nadroparinem (5 %). Na výkonech se podílelo celkem pět angiologů a intervenčních radiologů. Použity byly stenty Precise (Cordis, Fremont, CA, USA), Cristallo ideale (Invatec, Brescia, Itálie), Wallstent (Boston Scientific, Boston, MA, USA) a Xact (Abbott Vascular, Santa Clara, CA, USA).
Z distálních protekcí byly použity filtry FilterWire EZ (97 %, Boston Scientific, Boston, MA, USA) a Emboshield (3 %, Abbott Vascular, Santa Clara, CA, USA). Jako proximální protekce byl použit systém Mo.Ma (Invatec, Brescia, Itálie).
Po výkonu byli pacienti sledováni 24 hod na neurologické jednotce intenzivní péče, kde byl monitorován neurologický status a vitální funkce. Sledován byl i výskyt poklesu krevního tlaku (TK) po výkonu. Jako významný pokles bylo hodnoceno snížení TK do 60 min po výkonu o 30 mm Hg systolického tlaku proti TK měřenému před výkonem.
Zobrazovací metody
Ke zjištění počtu, charakteru a distribuce nových lézí na mozku po KAS jsme použili MR vyšetření mozku. Všichni pacienti podstoupili MR mozku den před výkonem a 1–3 dny po výkonu. Vyšetření bylo provedeno na přístroji Philips Achieva 1,5 T (Eindhoven, Nizozemí). K identifikaci nově vzniklých ložisek byly použity difuzně vážené obrazy (DWI), vč. Apparent Diffusion Coefficient (ADC) map, T1 a T2 vážené sekvence, Fluid Atenuated Inversion Recovery (FLAIR) sekvence v axiálních řezech o tloušťce 5 mm. Nová ischemická léze byla definována jako nově vzniklá hyperintenzita v DWI obrazech (hypointenzita v ADC mapě), která nebyla zachycena na MR vyšetření před výkonem. Sledovaná distribuce nových ischemických změn byla hodnocena do čtyř kategorií (povodí intervenované tepny, kontralaterální povodí, vertebrobazilární (VB) povodí, více povodí současně). Snímky byly hodnoceny radiologem a neurologem, kteří byli zaslepeni vůči použitým metodám protekce.
Kognitivní testy
K průkazu vlivu mikroembolizací na kognitivní funkce pacientů jsme zvolili Adenbrookský kognitivní test (Adenbrook Cognitive Examination Revised; ACE-R). Pacienti absolvovali ACE-R test těsně před výkonem. Test byl prováděn klinickou logopedkou s dlouhodobou zkušeností v testování kognitivních funkcí, která byla zaslepena vůči randomizovaným skupinám. ACE-R test se opakoval po měsíci od KAS.
Jako předlohu k hodnocení výkonu v ACE-R testu jsme použili původní tabulky dle Mioshiho et al [16]. Za normální kognitivní výkon byl považován výsledek 89–100 bodů. Přísnější hranice demence v ACE-R testu je 88 bodů (senzitivita 94 %, specifita 89 %), mírnější kritérium demence je hranice 82 bodů (senzitivita 84 %, specifita 100 %) [17]. Primárním cílem byl zvolen pokles v kontrolním ACE-R pod hodnotu 88 bodů při normálním kognitivním výkonu.
Statistická zpracování
Srovnání rozdílů ve skupinách bylo provedeno pomocí Mannova-Whitneyova testu u spojitých proměnných a pomocí χ2 testu u dichotomických proměnných. K ověření hlavní hypotézy jsme použili test homogenity dvou binomických rozdělení, u ostatních hypotéz Waldův test. Statistické výpočty byly provedeny s využitím programů SPSS (Chicago, IL, USA) a Microsoft Excel (Redmont, WA, USA). Za hladinu významnosti bylo považováno p = 0,05.
Výsledky
Celkem bylo randomizováno 77 pacientů do dvou skupin. Z toho bylo 21 pacientů z různých důvodů dodatečně po randomizaci vyřazeno (nedodržení protokolu MR, kontraindikace KAS či MR zjištěné po randomizaci, technické problémy s MR atd.), což způsobilo asymetrii skupin. Výkon podstoupilo celkem 56 pacientů, z toho 37 ve skupině Filtr a 19 ve skupině Mo.Ma. Průměrný věk pacientů ve studii byl 66,1 ± 6,6 let (nejmladšímu bylo 54 let, nejstaršímu 82 let), převažovali muži nad ženami (43 vs. 13) a asymptomatické stenózy nad symptomatickými (32 vs. 24). Základní charakteristiky souborů jsou srovnány v tab. 1.
U všech pacientů jsme provedli MR mozku před výkonem a průměrně 25,2 ± 14,5 hod po výkonu. Nové ischemické léze na MR mozku po výkonu jsme našli celkem u 32,14 % případů (n = 18), ve skupině Filtr v 32,43 % případů (n = 12), ve skupině Mo.Ma v 31,58 % případů (n = 6) (tab. 2). Ze všech nových ischemických ložisek (n = 18) se pouze 38,89 % (n = 7) nacházelo čistě v povodí intervenované tepny, zbylé léze byly distribuovány v 16,67 % (n = 3) kontralaterálně, v 5,56 % (n = 1) ve VB povodí a v 38,89 % (n = 7) ve více povodích současně (tab. 3). Ve skupině Filtr bylo signifikantně více nových ischemií nalezeno mimo řečiště intervenované tepny či současně ve více povodích (n = 10; 83,33 %) než čistě v povodí intervenované tepny (n = 2; 16,67 %; p = 0,006). Ve skupině Mo.Ma byla signifikantní většina nových ischemií nalezena v povodí intervenované tepny (n = 5; 83,33 %; p = 0,037) (tab. 4).
Table 2. Výskyt nových ischemických lézí po výkonu. 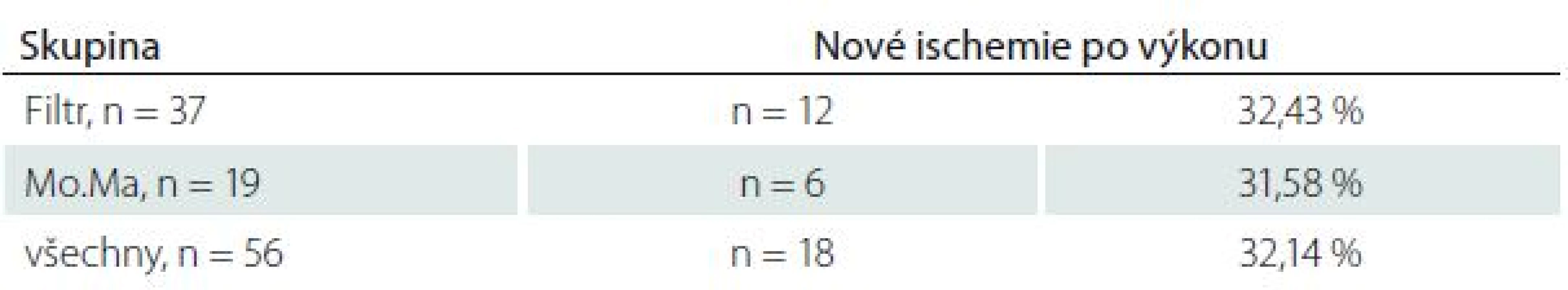
Table 3. Vaskulární teritoria nových ischemických lézí. 
Table 4. Vaskulární teritoria nových ischemických lézí ve skupinách. 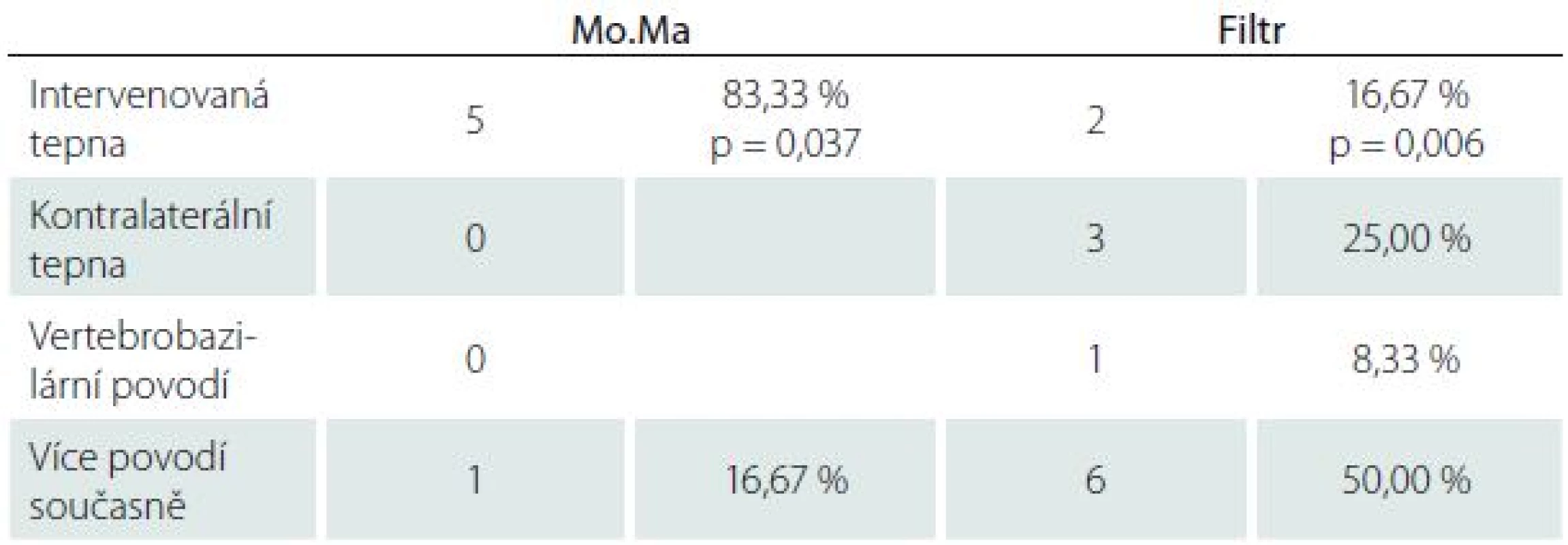
Počet nových ischemických lézí u jednotlivých pacientů se mezi skupinami významně nelišil. Ve skupině Filtr bylo na MR mozku po výkonu nalezeno průměrně 3,42 ± 2,5 nových ischemických lézí, ve skupině Mo.Ma 2,5 ± 2,1 (p = 0,82). Nenalezli jsme ani významný rozdíl mezi počtem nových ischemií po výkonu mezi skupinami asymptomatických a symptomatických stenóz, ve skupině asymptomatických stenóz byl průměrný počet nových ischemií 2,89 ± 2,6, ve skupině symptomatických stenóz 3,33 ± 2,2 (p = 0,5158).
U 53 našich pacientů jsme zaznamenali TK před výkonem, ihned po výkonu, 1 a 6 hod po výkonu. Jeden z našich sekundárních cílů byl pokles TK v systole v čase 60 min po výkonu minimálně o 30 mm Hg nezávisle na počátečním TK před výkonem. Takto definovaný pokles TK jsme zaznamenali celkem u 68 % (n = 36) pacientů. Nicméně výskyt nových ischemických lézí ve skupině s poklesem TK o 30 mm Hg a bez poklesu se signifikantně nelišil (p = 0,596).
V našem souboru byla 24hod mortalita a morbidita nulová, jednou jsme zaznamenali tranzitorní ischemickou ataku, která do ukončení výkonu na intervenčním sále odezněla. Ve 30 dnech od výkonu jsme zaznamenali výskyt dvou cévních mozkových příhod, první ve skupině Filtr, druhá ve skupině Mo.Ma, oba pacienti byli indikováni pro symptomatickou stenózu.
U 32 pacientů byl proveden ACE-R test před výkonem a v odstupu průměrně 33,63 ± 9,39 dne od výkonu. V ACE-R testech jsme zaznamenali zhoršení u tří pacientů (o 1, 2 a 4 body), stejný výsledek také u tří pacientů, kdežto zlepšení u 26 pacientů (průměrně o 4,88 ± 3,27 bodu; p = 0,0001). Ve skupině pacientů, kde se vyskytly nové ischemické léze na MR po výkonu, došlo ke zhoršení v ACE-R testu pouze u jedné pacientky, nicméně výsledek zůstal nadále v mezích normálních hodnot a nebyl pro nás signifikantní.
Diskuze
Na rozdíl od podstudie International Carotid Stenting Study (ICSS), kde byl záchyt nových lézí po stentingu symptomatických stenóz ACI na MR mozku u 68 % pacientů [8], jsme zaznamenali podstatně lepší výsledky v účinnosti protekčních systémů. Záchyt nových lézí po výkonu na MR byl v našem souboru u 32,14 % pacientů celkem, ve skupině symptomatických stenóz u 38 % pacientů. Tento rozdíl může souviset s v dnešní době rutinním používáním protekčních systémů u všech pacientů, což nebylo pro ICSS pravidlem.
Ačkoliv je náš soubor pacientů malý, ve studii PROFI [18], jejíž výsledky byly publikovány v průběhu naší studie, bylo na souboru 62 pacientů prokázáno, že protekční zařízení Mo.Ma významně snižuje vznik nových ischemií na MR po KAS. V našem souboru byly výsledky v obou skupinách téměř shodné.
Významné rozdíly jsme zaznamenali v distribuci nových ischemických ložisek. Ve skupině Filtr bylo významně více nových ischemií nalezeno mimo povodí intervenované tepny, nebo ve více povodích současně (83,3 %; p = 0,006). Toto pozorování svědčí pro vznik embolizací z aortálního oblouku při zavádění nebo stahování protekčního zařízení. Dle Schmidta et al vznikají MES v průběhu celého výkonu při použití filtrů (zavádění a umístění protekce, průchod stenózou, stenting, dilatace, stažení protekce) [11]. Ve skupině Mo.Ma se navzdory tomu nové ischemie distribuovaly převážně jen v povodí intervenované tepny (83 %; p = 0,037). Za kritické situace lze považovat zejména zavádění a stahování Mo.Ma systému ze společné a zevní karotické tepny. Mo.Ma systém je objemnější a méně flexibilní CPD. Tento názor potvrzují i výsledky Schmidta et al, kteří prokázali významnou redukci MES při použití systému Mo.Ma při průchodu stenózou, zavedení stentu a dilataci stentu [11]. Ve fázích zavedení a stažení Mo.Ma systému byl počet MES srovnatelný s protekcí filtrem.
Častým průvodním jevem KAS je hemodynamická deprese [19], kdy dochází k hemodynamicky významným bradykardiím a poklesům krevního tlaku, které mohou vyžadovat i nutnost korekce. Dle podstudie ICSS se na vzniku nových ischemických lézí podílí právě hypotenze, která snižuje schopnost krevní cirkulace vymýt emboly z mozkových cév a potencuje tak vznik nových ischemií po výkonu [10].
V našem souboru splnilo výše uvedená kritéria pro pokles TK po výkonu celkem 68 % pacientů, nicméně výskyt nových ischemických lézí v této skupině nebyl významně vyšší než ve skupině bez poklesu TK.
Pokud jsme stanovili arbitrární hranici hypotenze na hodnoty TK 100/60 mm Hg a nižší s výskytem do 60 min po výkonu a porovnali je se skupinou pacientů, kde byly hodnoty ve stejný čas vyšší než 100/60 mm Hg, došli jsme k závěru, že výskyt nových ischemií je signifikantně vyšší ve skupině s takto definovanou hypotenzí (p = 0,041). Tento závěr podporuje teorii, že se pokles tlaku po KAS může významně podílet na vývoji nových ischemických změn.
Ve skupině Filtr jsme zaznamenali signifikantně více poklesů TK po výkonu jak o 30 mm Hg proti tlaku před výkonem (p = 0,001), tak pod arbitrární hranici 100/60 mm Hg (p = 0,021). Pravděpodobně se jedná o chybu malých čísel, jelikož výběr protekčního systému by nijak kardiovaskulární systém ovlivňovat neměl.
Při hodnocení kognitivních funkcí u pa - cientů po KAS jsme na rozdíl od našeho předpokladu zaznamenali zlepšení v ACE-R testu, a to u statisticky významné většiny. Ve vlastní skupině pacientů, kteří měli po výkonu na MR mozku nové ischemické léze, jsme nezaznamenali jediné signifikantní zhoršení. Interpretace výsledků ACE-R testů mohou být různé. Zlepšení kognitivního výkonu u většiny pacientů je možno přisuzovat zlepšení mozkové perfuze po odstranění karotické stenózy [14], nicméně je také možno považovat tyto testy za nespecifické pro nově vzniklé ischemické léze [20].
Závěr
Na souboru našich pacientů se nepodařilo prokázat redukci nových ischemických ložisek na MR mozku po KAS při použití proximálního protekčního zařízení Mo.Ma vůči distální protekci filtrem. Stejně jako se nepodařilo prokázat negativní vliv mikroembolizací na kognitivní funkce pacientů.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Ondřej Pavlík
Vzdělávací a výzkumný institut Agel
Neurologické oddělení
Vítkovická nemocnice a.s.
Zalužanského 1192/15
703 84 Ostrava
e-mail: ondrej.pavlik@vtn.agel.cz
Přijato k recenzi: 2. 5. 2016
Přijato do tisku: 13. 6. 2016
Sources
1. Kernan WN, Ovbiagele B, Black HR, et al. Guidelines for the Prevention of Stroke in Patients With Stroke and Transient Ischemic Attack: a Guideline for Healthcare Professionals From the American Heart Association. Stroke 2015; 46 (4): e87–9. doi: 10.1161/STROKEAHA.115.008661.
2. Stankovic G, Liistro F, Moshiri S, et al. Carotid artery stenting in the first 100 consecutive patients: results and follow-up. Heart 2002,88 (4): 381–6.
3. Vitek JJ, Al-Mubarak N, Iyer SS, et al. Carotid artery stent placement with distal balloon protection: technical considerations. Am J Neuroradiol 2005; 26 (4): 854–61.
4. Kastrup A, Groschel K, Krapf H, et al. Early outcome of crotid angioplasty and stenting with and without cerebral protection devices: a systematic review of the literature. Stroke 2003; 34 (3): 813–9.
5. Jaeger HJ, Mathias KD, Hauth E, et al. Cerebral ischemia detected with diffusion-weighted MR imaging after stent implantation in the carotid artery. Am J Neuroradiol 2002; 23 (2): 200–7.
6. Bijuklic K, Wandler A, Tubler T, et al. Impact of asymptomatic cerebral lesions in diffusion-weighted magnetic resonance imaging after carotid artery stenting. JACC Cardiovasc Interv 2013; 6 (4): 394–8. doi: 10.1016/j.jcin.2012.10.019.
7. Pinero P, González A, Mayol A, et al. Silent ischemia after neuroprotected percutaneous carotid stenting: a diffusion-weighted MRI study. Am J Neuroradiol 2006; 27 (6): 1338–45.
8. Bonati LH, Jongen ML, Haller S, et al. New ischaemic brain lesions on MRI after stenting or endarterectomy for symptomatic carotid stenosis: a substudy of the International Carotid Stenting Study (ICSS). Lancet Neurol 2010; 9 (4): 353–62. doi: 10.1016/S1474-4422 (10) 70057-0.
9. Schnaudigel S, Groschel K, Pilgram MS, et al. New Brain Lesions After Carotid Stenting Versus Carotid Endarterectomy: a Systematic Review of the Literature. Stroke 2008; 39 (6): 1911–9. doi: 10.1161/STROKEAHA.107.500603.
10. Altinbas A, Algra A, Bonati LH, J et al. Periprocedural Hemodynamic Depression Is Associated With a Higher Number of New Ischemic Brain Lesions After Stenting in the International Carotid Stenting Study – MRI Substudy. Stroke 2013; 45 (1): 146–51. doi: 10.1161/STROKEAHA.113.003397.
11. Schmidt A, Diederich KW, Scheiert S, et al. Effect of two different neuroprotection systems on microembolization during carotid artery stenting. J Am Coll Cardiol 2004; 44 (10): 1966–9.
12. Paraskevas KI, Lazaridis C, Andrews CM, et al. Comparison of Cognitive Function after Carotid Artery Stenting versus Carotid Endarterectomy. Eur J Vasc Endovasc Surg 2014; 47 (3): 221–31. doi: 10.1016/j.ejvs.2013.11.006.
13. Rando DE, Caso PV, Leys D, et al. The role of carotid artery stenting and carotid endarterectomy in cognitive performance: a systematic review. Stroke 2008; 39 (11): 3116–27. doi: 10.1161/STROKEAHA.108.518357.
14. Lal BK. Cognitive function after carotid artery revascularization. Vascular Endovasc Surg 2007; 41 (1): 5–13.
15. Brott TG, Halperin JL, Abbara S, et al. 2011 ASA/ACCF/AHA/AANN/AANS/ACR/ASNR/CNS/SAIP/SCAI/SIR/SNIS/SVM/SVS Guideline on the Management of Patients With Extracranial Carotid and Vertebral Artery Disease: a Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, and the American Stroke Association, American Association of Neuroscience Nurses, American Association of Neurological Surgeons, American College of Radiology, American Society of Neuroradiology, Congress of Neurological Surgeons, Society of Atherosclerosis Imaging and Prevention, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of NeuroInterventional Surgery, Society for Vascular Medicine, and Society for Vascular Surgery. Circulation 2011; 124 (4): e54–130. doi: 10.1161/CIR.0b013e31820d8c98.
16. Mioshi, E, Dawson K, Mitchel J, et al. The Addenbrooke‘s Cognitive Examination Revised (ACE-R): a brief cognitive test battery for dementi screening. Int J Geriatr Psychiatry 2006; 21 (11): 1078–85.
17. Raisová M, Kopeček M, Řípová D, et al. Addenbrookský kognitivní test a jeho možnosti použití v lékařské praxi. Psychiatrie 2011; 15 (3): 145–50.
18. Bijuklic K, Wandler A, Hazizi F, et al. The PROFI study (Prevention of Cerebral Embolization by Proximal Balloon Occlusion Compared to Filter Protection During Carotid Artery Stenting): a prospective study. J Am Coll Cardiol 2012; 59 (15): 1383–9. doi: 10.1016/j.jacc.2011.11.035.
19. Qureshi AI, Luft AR, Sharma M, et al. Frequency and determinants of postprocedural hemodynamic instability after carotid angioplasty and stenting. Stroke 1999; 30 (10): 2086–93.
20. Sylivris S, Levi C, Matalanis G, et al. Pattern and significance of cerebral microemboli during coronary artery bypass grafting. Ann Thor Surg 1998; 66 (5): 1674–8.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 5-
All articles in this issue
- Rasmussenova encefalitída
- Léky navozená spánková endoskopie – cesta k lepším chirurgickým výsledkům při léčbě syndromu obstrukční spánkové apnoe
- Současná kortikoterapie u nádorů mozku
- Individualizovaný přístup k léčbě roztroušené sklerózy
- Aktuální pohled na management nízkostupňových gliových nádorů centrálního nervového systému
- Detekce pravolevých zkratů u mladých pacientů po ischemické cévní mozkové příhodě – pilotní studie
- Idiopatická hypertrofická kraniální pachymeningitida – dvě kazuistiky
- Myxovirus resistance protein A v terapii interferony-β u pacientů s roztroušenou sklerózou a algoritmus sledování účinnosti léčby
- Myasténia gravis asociovaná s tymómom – súbor pacientov v Slovenskej republike (1978–2015)
- Bezpečnost karotického stentingu – srovnání protekčních systémů
- Průkaz boreliové DNA u pacientů s neuroboreliózou
- Vztah likvorových hladin IL-6 ke změnám parciálního tlaku kyslíku v mozku a k rozvoji vazospazmů u pacientů po subarachnoidálním krvácení z ruptury aneuryzmatu mozkové tepny
- Stereotaktické biopsie mozkových patologií systémem Varioguide – zkušenosti ze 101 výkonů
- Myasthenia Gravis Composite – validace české verze
- Pilotní studie využití tenzometrické plošiny v domácí terapii poruch rovnováhy
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
- Paroxyzmálna kinezigénna dystónia ako primomanifestácia roztrúsenej sklerózy – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současná kortikoterapie u nádorů mozku
- Rasmussenova encefalitída
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
- Průkaz boreliové DNA u pacientů s neuroboreliózou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

