-
Medical journals
- Career
Gliomy limbického a paralimbického systému, technika a výsledky resekcí
Authors: R. Bartoš 1,2; V. Němcová 2; T. Radovnický 1; A. Sejkorová 1,3; A. Malucelli 1; M. Orlický 1; F. Třebický 4; M. Sameš 1
Authors‘ workplace: Neurochirurgická klinika UJEP a Krajská zdravotní, a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 1; Anatomický ústav, 1. LF UK v Praze 2; Department of Neurologic Surgery, Mayo Clinic, Rochester, USA 3; Ústav radiační onkologie, Nemocnice Na Bulovce, Praha 4
Published in: Cesk Slov Neurol N 2016; 79/112(2): 131-147
Category: Minimonography
doi: https://doi.org/10.14735/amcsnn2016131Overview
Gliomy limbického a paralimbického systému představují anatomicky a tím pádem i operačními přístupy unikátní skupinu mozkových nádorů. Mikrochirurgie v kombinaci s moderními perioperačními postupy zvyšuje šance na radikální odstranění těchto gliomů. Z hlediska lokalizace je dělíme do tří základních skupin: 1. gliomy inzuly, 2. amygdalohippokampálního komplexu a 3. cingula. V minimonografii se věnujeme anatomii i funkci limbického a paralimbického systému a v návaznosti na ni představujeme ucelený pohled na jednotlivé neurochirurgické přístupy k těmto oblastem. Maximální resekce za zachování funkční integrity mozku je předpokladem následné smysluplné onkologické léčby. Taktéž prezentujeme výsledky operací našeho pracoviště ve smyslu morbidity a radikality za posledních sedm let.
Klíčová slova:
limbický systém – inzula – hippokampus – cingulum – gliom – resekceÚvod
Limbický a paralimbický systém je komplexní anatomicky i funkčně komplikovaná struktura (obr. 1a, b). Začíná pod rostrum corpus callosum jako drobný gyrus subcallosus a paraterminalis, pokračuje na mediální straně hemisféry jako gyrus cinguli, dále přecházející isthmem na spodní ploše temporálního laloku do gyrus parahippocampalis, jenž anteriorně končí jako piriformní kortex obsahující entorhinální oblast, gyrus ambiens a semilunaris, poté se stáčí mediálním směrem a tvoří unkus. Na vnitřní straně gyrus parahippocampalis je sulcus hippocampi, uvnitř něj nacházíme jemný gyrus dentatus s drobnými Retziovými gyry a dále mediálně od tela choroidea vlastní hippokampus vyklenující se do temporálního rohu postranní komory jako cornu Ammonis (CA). Mezi hippokampem a parahippokampálním gyrem se na jeho horní ploše nachází subiculum. Gyrus dentatus směřuje posteriorně a na jeho povrchu začíná fimbria fornicis oddělující se od corpus callosum jako crus fornicis, na stropu 3. komory se sdružuje s druhostranným fornixem do commissura fornicis pokračující kaudálně za přední comisurou jako collumnae fornicis směrem do corpora mamillaria. Na povrchu corporis callosi se nachází tenké indusium grisseum směřující z hippokampální formace do paraterminálního gyru. Mezi struktury limbického systému náleží amygdala, patřící mezi bazální ganglia, ležící těsně před koncem temporálního rohu postranní komory a nad ním. Pouze vstupní drahou amygdaly je laterální olfaktorní strie vycházející z olfaktorického bulbu. Amygdala sestává z celé řady podjader (centralis, medialis, lateralis, basalis a corticalis). V poslední době byla anatomická definice amygdaly rozšířena o výběžek směrem k hypothalamu („extended amygdala“). Hlavní spoje amygdaly probíhají ve stria terminalis, posteriorním systému obkružujícím thalamus a směřujícím do subkalózní oblasti, do septa a hypothalamu a v bidirekcionálním ventrálním amygdalofugálním systému směrem k diencefalu a mozkovému kmeni. Fasciculus arcuatus spojuje amygdalu s neokortexem frontálního laloku a amygdaloinzulární fascikl (Klingler a Gloor 1960) s inzulou.
Obr. 1a) Schéma limbického systému s jeho hlavními spoji. Fig. 1a) A scheme of the limbic system and the main clutch. 
Kresba MUDr. Alena Sejkorová. Obr. 1b) Schéma Papezova okruhu, popis v textu. Fig. 1b) A scheme of the Papez circuit, description in the text. 
Kresba MUDr. Alena Sejkorová. Mezi paralimbické oblasti řadíme frontoorbitální kortex, temporální pól, inzulu a parahippokampální gyrus.
Tento anatomický systém integruje emoce, účastní se na vytváření stopy krátkodobé i dlouhodobé paměti a podílí se na řízení somatovegetativních funkcí. Jedná se o komplexní systém s rozsáhlými asociačními spoji k neokortikálním strukturám a představuje zřejmě podklad vnímání naší integrity a existence lidské osobnosti.
Oblastmi, které obvykle postihují moz-kové gliomy, jsou inzula, temporální pól, frontoorbitální oblast, dále temporální mediobazální formace s hippokampem, parahippokampem, unkem a cingulární gyrus. Vzhledem k faktu, že temporální pól a frontorbitální oblast bývají gliomy postiženy nejčastěji ve sdružení s inzulární a temporální mediobazální oblastí, budeme se v našem sdělení věnovat následujícím třem oblastem.
Inzula, poprvé popsaná Johannem Christianem Reilem v roce 1809 [1], je skrytá pod frontálním, parietálním, temporálním operkulem a větvením arteria cerebri media (MCA). Pro svoji obtížnou dostupnost je co do funkčního významu nejméně prozkoumaným mozkovým lalokem u člověka. Má tvar pyramidy s trojúhelníkovitou bazí a od operkul ji oddělují tři periinzulární sulky. V hloubce pod zadní částí sulcus periinsularis superior běží vlákna mířící z motorické kůry do zadního raménka capsula interna. Fasciculus uncinatus je pod přední částí sulcus periinsularis superior a inferior a pod limen insulae. Inzulární kůra je pomocí capsula extrema oddělena od claustra, které má ale jiný vývojový základ i funkci, hlouběji pak následují capsula externa a nucleus lentiformis. Limen insulae je předním dolním okrajem inzuly, která v tomto místě přechází dopředu do area perforata anterior a dolů na mediální plochu temporálního laloku. Centrální inzulární sulkus rozděluje inzulu na dvě základní části – přední, tvořenou třemi krátkými gyry (přední, střední a zadní) a varietními akce-zorním a transverzálním gyrem zcela ventrálně; zadní část tvoří přední a zadní dlouhý gyrus. Inzula je arteriálně zásobena velkým množstvím krátkých inzulárních perforátorů z úseků M2 a někdy M1 a M3. Pro operaci je velice nebezpečný průběh dlouhých inzulárních perforátorů v zadní části inzuly, které mohou zásobovat až vnitřní kapsulu v oblasti corona radiata. Žilní krev je odváděna systémem hlubokých inzulárních žil probíhajících v periinzulárních sulcích [2,3].
Inzula je obousměrně propojena s orbitofrontální kůrou, přední cingulární kůrou, doplňkovou motorickou oblastí (SMA), primární i sekundární senzitivní kůrou, kůrou temporálního laloku, senzitivními jádry thalamu, amygdalou a globus pallidus. Přední agranulární inzula zpracovává chemosenzorické informace (čich a chuť), zatímco zadní granulární inzula je multimodální konvergentní zónou pro senzorické informace a zpracovává exteroceptivní informace (hmat, teplotu a bolest), interoceptivní informace (somatoviscerální senzitivita), sluchové a vestibulární informace. Inzula obsahuje v V. vrstvě velké vřetenovité von Economovy neurony (neurony typické pro člověka a lidoopy) podobně jako přední cingulární kůra.
Chang et al analyzovali velké množství studií o inzule a podle výsledků fMR během různých úkolů inzulu rozdělili do tří částí: 1. přední horní zapojenou do okruhů pro cílevědomé poznávání (spolu s přední cingulární kůrou), myšlení a kontrolu vykonávání; 2. přední dolní spojenou s emocemi, chemosenzitivitou a autonomními funkcemi a 3. zadní spojenou s projevy vnímání bolesti, zpracováním senzorimotorických signálů a vnímáním řeči [4].
Konvergence multimodálních senzorických informací a schopnost hodnocení subjektivního stavu pravděpodobně vysvětluje zapojení inzuly do zpracovávání emocí. Je spojována se zkušeností a pozorováním, znechucením (jak chutí, tak zápachem), předjímáním obav, pocity zloby, pocity hněvu, viny a vnímáním morálních přestupků. Zpracovávání emocí je funkčně důležité pro detekci nejdůležitějších signálů a pro zaměření pozornosti na získání dalších informací, které se jich týkají. Nezbytná je i kognitivní kontrola přicházejících senzitivních a emočních signálů. Inzula se tedy velice dobře hodí jako rozhraní mezi fyziologickými pocity a systémy vyšší kognitivní činnosti. V tomto smyslu ji lze zařadit jako oblast zapojenou do celé řady kognitivních procesů. Přední inzula tvoří společně s přední cingulární kůrou, amygdalou a zadním thalamem nervový okruh vyhodnocující významnost stimulů (detekci priorit). Podle výběru z těch nejvýznamnějších vnitřních i zevních signálů se potom řídí naše chování (vykonání nebo zavržení) [5].
Během peroperačního monitorování hlubokými elektrodami u lidí s epilepsií bylo prokázáno, že stimulace kůry v zadní části inzuly vyvolává somatosenzitivní vjemy, v dorzální části zadní inzuly se projevuje jako bolestivý nebo tepelně zabarvený vjem a stimulace centra inzuly je vnímána jako viscerosenzitivní, případně chuťový vjem. Stimulace přední části inzuly nevyvolala žádnou reakci [5].
Při lézi inzulární kůry, nejčastěji způsobené cévní mozkovou příhodou, byly pozorovány poruchy autonomních funkcí, poruchy chuti a čichu, poruchy časového zpracování akustických signálů, poruchy somatosenzitivního a nociceptivního vnímání, multimodální neglect syndrom, změny v emočním prožívání a rozpoznávání znechucení, zvláštní nálady a poruchy volní aktivity (únava, hypoaktivita), bažení po rekreačních drogách [6]. Některé funkce vykazují asymetrickou lokalizaci. Léze pravé inzuly postihuje hlavně sympatikus a vyjadřování emocí a způsobuje neglect syndrom, útlum energie a volních aktivit. Naopak léze levé inzuly způsobuje spíše poruchy parasympatiku, časového zpracování řeči a jiné řečové vady. Poškození přední inzuly bývá spojeno se sníženým vnímáním sama sebe s poruchami afektivní složky vnímání bolesti a s tím sdruženými poruchami nálady a úzkostí. Léze zadní inzuly se projeví spíše poruchou koordinace senzitivních složek bolesti, tedy skládání somatomotorických, vestibulárních a motorických signálů během vnitřní signalizace organizmu.
Technika operace
Mikrochirurgická operační technika používá široký transsylvijský přístup s preparací větví ACM, devaskularizací nádoru koagulací a následným přestřižením krátkých inzulárních perforátorů, což také umožní další mobilizaci větví ACM a tím vytvoření „okének“, kterými nádor v inzule resekujeme (obr. 2). Přilehlé oblasti event. postižené nádorem (temporální, frontální a parietální operkulum, temporální pól, orbitofronální kortex) lze resekovat před resekcí vlastní inzuly, nicméně je výhodné operaci vždy započít preparací Sylvijské rýhy. Pro určení hloubky resekce v oblasti vlastní inzuly je vhodné ozřejmení odstupu laterálních lentikulostriatálních perforátorů (LLsP), stejně tak je důležité určení kraniokaudálního rozsahu resekce preparací periinzulárních sulků. Nutná je opatrnost při resekci v oblasti horního periinzulárního sulku, což je jediná oblast, kde může dojít k přímému poškození pyramidové dráhy, kterou jinde kryje putamen [7 – 9]. Dle osobní komunikace s prof. Langem (Lang, Praha, 2011) je velice důvtipnou taktikou iniciální koagulace a přestřižení jednoho krátkého inzulárního perforátoru v největším předpokládaném průměru expanze s následným sledováním jeho průběhu do hloubi nádoru, což nám umožní určit hloubku bezpečné resekce. Hlavní „neznámou“ je možné zásobení vnitřní kapsuly dlouhými penetrujícími inzulárními perforátory z distálních úseků M2, ty jsou však velice obtížně odlišitelné od krátkých inzulárních perforátorů [3]. Profesor Tűre doporučuje v případě nejistoty použití dočasného klipu a monitorace MEP. Ostatně monitorace MEP během postupné opatrné resekce přizpůsobené event. kolísání jejich amplitudy je používána během celé operace [10 – 12]. Pro vyvarování se cévním komplikacím musí být operatér taktéž technicky připraven na možné vytržení drobné větévky z M2 a následné ošetření cévy 10/ 0 stehem (Tűre, osobní komunikace, Istanbul, 2010). Výhodou je laboratorní příprava jak na poli cévních mikrosutur, tak i preparace drah Klinglerovou technikou upevňující orientaci operatéra v operačním poli [13 – 15].
Image 1. Inzulární gliomy. Fig. 2. Insular gliomas. 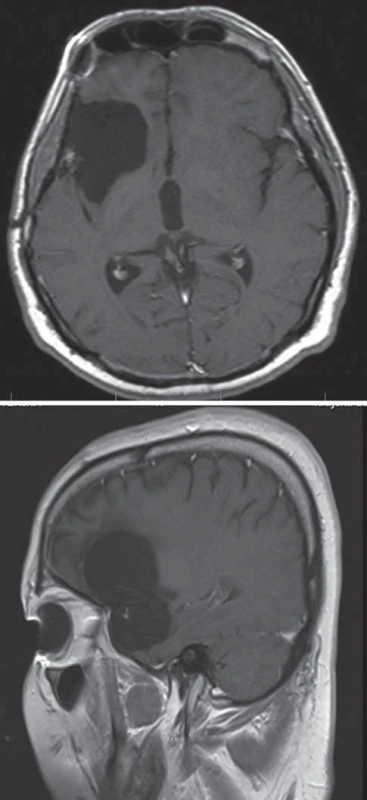
Obr. 2a) Široká disekce Sylvijské rýhy s preparací větvení M2. Obr. 2b) Ozřejmení bifurkace aretria cerebri media a laterálních lentikulostriatických perforátorů – zde varietní odstup perforátoru z M2. Obr. 2c) Koagulace a přestřižení krátkých inzulárních perforátorů. Obr. 2d) Axiální T1W sken 36letého pacienta s původně opakovanými epileptickými záchvaty (operován 2009 a 2012), resekce 94 % původního objemu LGG, je bez záchvatů, během sledování po druhé operaci bez recidivy, proběhla onkologická léčba, pracuje jako stavbyvedoucí. Obr. 2e) Sagitální T1W sken 35leté pacientky původně s refrakterní epilepsií a doporučením radioterapie jiným pracovištěm (operována 2009), resekce 92 % původního objemu nádoru, během sledování asymptomatická progrese LGG v bazálních gangliích, onkologická léčba v roce 2012, regrese nádoru, nyní bez recidivy, pracuje jako zapisovatelka u soudu. M2 – inzulární segment arteria cerebri media, M2S – superiorní trunkus, M2I – inferiorní trunkus, M1 – sphenoidální segment arteria cerebri media, LLsP – šipkou označeny laterální lentikulostriatické perforátory, IP – šipkou označen krátký inzulární perforátor. Temporální mediobazální oblast (temporální pól, amygdala, hippokampus, parahippokampus, unkus)
Mediobazální temporální oblast sestává z části paralimbické (temporální pól a parahippokampální gyrus) a části limbické (amygdala, piriformní kortex a hippokampální formace). Mediální hranici tvoří mezencefalon a systém cisteren (karotická, crurální a ambientní), laterální hranici tvoří rhinální a kolaterální sulkus. Horní hranici tvoří spodina temporálního rohu postranní komory a choroidální plexus. Zadní hranicí je isthmus cingula, přední část cuneu a okcipito-temporální gyry. Mediobazální temporální oblast se dělí na přední, střední a zadní část. Přední část zahrnuje temporální pól, unkus a hlavu hippokampu a parahippokampální gyrus do úrovně inferiorního choroidálního bodu. Střední část pokračuje do úrovně kolikulů mezencefala a posteriorní část se dělí na superiorní parahippokampocingulární část, směřující k isthmu, a inferiorní parahippokampolinguální, směřující k linguálnímu a fusiformnímu gyru (mediální a laterální okcipito-temporální gyrus).
Mediobazální oblast je zásobena unkální arterií, přední choroidální arterií, hippokampálními perforátory z ambientního úseku arteria cerebri posteriori (PCA), laterální posteriorní choroidální arterií, paralimbická oblast je zásobena dominantně inferiorním trunkem arteria cerebri posterior větvícím se na anteriorní, mediální a posteriorní temporální větve pro zadní a střední části a pro přední část polární a anteriorní temporální arterií z arteria cerebri media. Žilní krev z limbických struktur je odváděna venou basalis Rosenthali, z parahippokampálního gyru vena temporalis inferior. Dalšími velice důležitými strukturami této oblasti jsou mezencefalon s pyramidovou dráhou a kolikuly tekta, nervus trochlearis, oculomotorius a corpus geniculatum laterale [16].
Důležitými drahami probíhajícími na horním aspektu mediobazální oblasti jsou v posteroanteriorním pořadí optická radiace, okcipito-frontální traktus, dolní raménko fasciculus longitudinalis superior, optický traktus, commisura anterior a fasciculus uncinatus.
Funkci hippokampu můžeme rozdělit do čtyř kategorií:
- učení a paměť,
- regulace emočního chování,
- podílí se na určitých aspektech kontroly motoriky,
- podílí se na regulaci hypothalamických funkcí.
Co se týká paměti a učení, informace z rozsáhlých izokortikálních oblastí zejména z posteriorního parietálního asociačního kortexu (area 7) a sousední temporální a okcipitální kůry (area 40, 39 a 22) konvergují cestou parahippokampálního gyru do entorhinální oblasti, jsou v hippokampu filtrovány a následně fixovány v neokortikálních asociačních oblastech, prefrontálně a retrospleniálně. Samotný mechanizmus této fixace je zatím neznámý. Lze spekulovat o trvalých změnách v biochemické struktuře a neosynapsích neuronů. Každopádně navzdory své malé velikosti je entorhinální oblast hlavním vstupem hippokampu. Ve II. vrstvě periallokortexu lokalizované velké pyramidové buňky tvoří uzly mající dokonce morfologický korelát na povrchu – verrucae gyri hippocampi. Hippokampus je zapojen do všech aspektů deklarativní paměti: sémantické paměti, tzn. paměti zahrnující fakta a pojmy, epizodické paměti, tzn. paměti, která umožňuje vědomé vybavení si událostí a vztahů mezi nimi, a prostorové paměti přikládající k předchozím rozměr prostoru. Hippokampální alokortex, byť složený ze tří vrstev, má významnou plasticitu, neurony mají schopnost dlouhodobé potenciace a dokonce zde byla prokázána možnost vzniku nových neuronů.
Během tvorby paměťové stopy můžeme rozlišit dvě základní intrahippokampální trasy – polysynaptickou a přímou cestu. Začátkem polysynaptické cesty je II. vrstva entorhinální oblasti, odtud axony tzv. perforující cestou prorážejí subiculum a vestiginální hippokampální sulkus a končí ve stratum moleculare gyrus dentatus. Jedná se o glutaminergní vlákna, která gyrus dentatus excitují. Axony granulárních buněk gyrus dentatus, tzv. mechová vlákna, jsou taktéž glutaminergní, mají velký obsah Zn a stimulují hippokampální oblast CA4 a CA3. Axony neuronů těchto oblastí nejprve vysílají tzv. Schafferovy kolaterály do CA1 a dále přecházejí tamtéž přes CA2 pole, jehož funkce navzdory poměrně bohaté vaskularizaci a zřetelné buněčnosti je u člověka zatím nejasná. Dle klasického popisu Ramona y Cajala byla právě oblast CA1 hlavním hippokampálním výstupem cestou fimbrie. Nyní se zdá, že hlavním výstupem hippokampální formace je subiculum. Má se za to, že dalším funkčně prostorovým uspořádáním je tzv. koronární lamelární uspořádání hippokampální formace, každá lamela složená z entorhinální kůry, gyrus dentatus, CA3 a CA1 je samostatnou funkční jednotkou. Jak jsme již uvedli, hlavním výstupem polysynaptické cesty hippokampální formace je fimbrie fornixu pokračující do postkomisurálního fornixu a dále, buď cestou přímou do předního thalamického jádra, či odbočkou mamillothalamického traktu tamtéž, s možným zapojením též interlaminárních thalamických jader a hypothalamu. Z thalamu se spoje projikují do již uvedených cingulárních (oblast 23, 24) a retrospleniálních oblastí (oblast 29, 30). Polysynaptická cesta slouží prostorové a epizodické paměti, je často nazývána Papezovým mediálním limbických systémem (Papez 1937) či Delayovým-Brionovým systémem (Delay-Brion 1969) (obr. 1b).
Naopak fylogeneticky pozdější a vyvinutá u člověka přímá cesta je zapojena do sémantické paměti. Aferentní oblastí přímé cesty je dolní temporální asociační kůra (areae 20, 37) vstupující do entorhinální oblasti perirhinálním kortexem (areae 35, 36), perirhinální kortex navíc rozpoznává již dříve obdržené stimuly. Tato cesta tedy směřuje z III. vrstvy entorhinální oblasti k neuronům v CA1 bez zapojení interneuronů. Výstupem přímé cesty jsou inferiorní temporální asociační kortex, temporální pól a prefrontální kortex.
Můžeme uvést, že pravý hippokampus je zapojen více do prostorové paměti, zatímco levý více do epizodické paměti. Obecně je pravý hippokampus větší než levý a taktéž je kupodivu větší u žen než u mužů. Role hippokampu na emočním chování je, oproti původnímu Papezovu předpokladu, minoritní, polysynaptická cesta se snad zapojuje prostřednictvím předního cingula do emoční reakce na bolest. Cestou ventrální striatální kličky je hippokampus zapojen do motorické odpovědi na emoce a je možné, že má svou úlohu i v mechanizmu drogové addikce. Dále může hippokampus projekcí do paraventrikulárního hypothalamického jádra inhibovat sekreci ACTH hypofýzou.
Role amygdaly ve tvorbě paměťové stopy je, byť ventrální amygdalofugální trakt dosahuje dorzomediálního thalamu, na rozdíl od známé emoční funkce „receptoru strachu“, kontroverzní. V úvodu popsané spoje amygdaly vedou ke generování endokrinních, autonomních a somatomotorických aspektů emočních stavů. Amygdala je taktéž důležitá v motivaci a sebekontrole. Oboustranná léze amygdaly vede k disrupci sociálního a emočního chování (Klüverův-Bucyho syndrom 1937) [17,18].
Technika operací
V našem sdělení uvádíme pouze selektivní přístupy k meziotemporální oblastii. Snažíme se vyhnout neokortex destruujícím transkortikálním přístupům, o kterých se zde nezmiňujeme.
Standardním předním přístupem k mediobazální temporální oblasti je přední transsylvijský přístup s anteromediální temporální lobektomií (obr. 3, 4) [19,20]. Technicky náročnější je Yaşargilův přímý transsylvijský přístup přes sulcus periinsularis inferior (obr. 5) [21]. Technicky nejjednodušší je transkortikální přístup [22,23], nicméně cenou za jednoduchost je destrukce neokortikálních struktur a drah temporálního kmene, což zejména v dominantní hemisféře může činit problém (obr. 6). Nejselektivnější, avšak obtížnou technikou preparace horního aspektu hippokampu do ambientní cisterny je transchoroidální přístup (obr. 7). Jednodušší je subpiální resekce hippokampu či resekce odspodu od tentoriální incizury.
Image 2. Přední transsylvijský přístup s anteromediální temporální lobektomií. Fig. 3. Frontal trans-sylvian access to the anteromedial temporal lobectomy procedure. 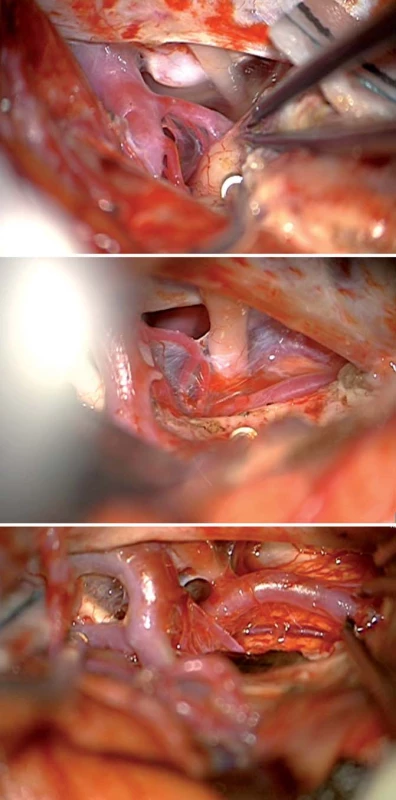
Obr. 3a) Disekce Sylvijské rýhy a mobilizace uncu, arachnoidální disekce nervus oculomotorius. Obr. 3b) Resekce uncu a amygdalohippokampálního komplexu. Obr. 3c) Resekce komplexu k choroidální fi suře. ACI – arteria carotis interna, III. – n. oculomotorius, PCom – arteria communicans posterior, ACho – arteria choroidea anterior, F, T – lobus frontalis, temporalis, BA – arteria basilaris, SCA – arteria cerebelli superior, P2 – ambientní segment arteria cerebri posterior , II. – n. opticus, A1 – horizontální segment arteria cerebri anterior, MK – mozkový kmen, VBR – vena basalis Rosenthali. Image 3. Resekce LGG v oblasti uncu a přední části amygdalohippokampálního komplexu u 36letého pacienta, resekováno 78 % nádoru, reziduum v BG s regresí po onkologické léčbě. Fig. 4. LGG resection involving the uncus and the anterior section of the amygdalohippocampal complex in a 36-year-old patient, 78% of the tumour resected, BG residue with regression after cancer treatment. 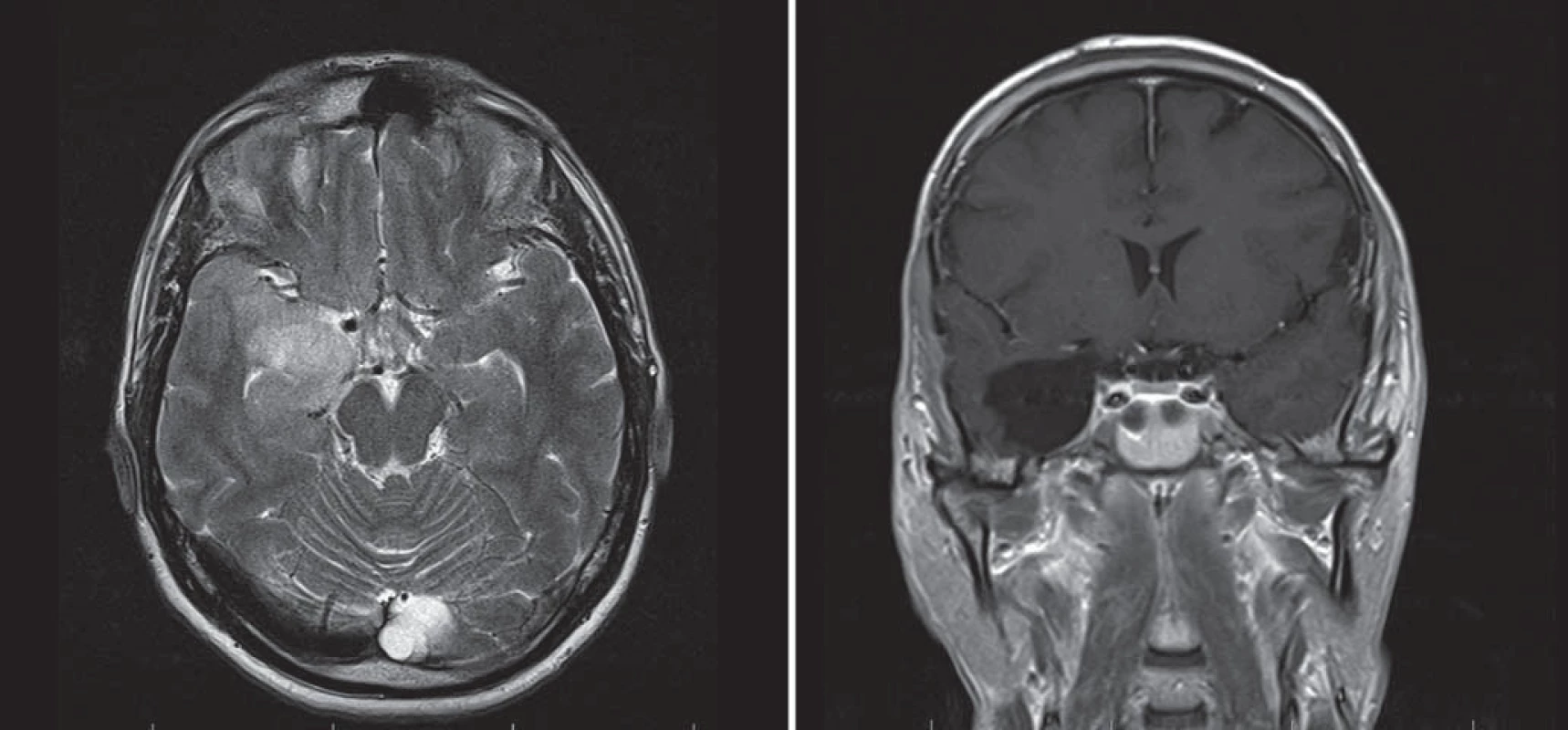
Obr. 4a) Axiální T2W sken. Obr. 4b) Koronární T1W sken. Image 4. Přímý transsylvijský přístup přes sulcus periinsularis inferior. Fig. 5. Direct trans-sylvian access via sulcus periinsularis inferior. 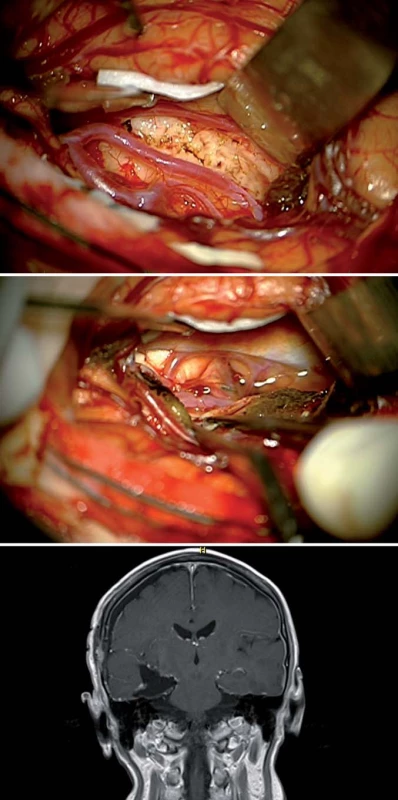
Obr. 5a) Disekce Sylvijské rýhy. Obr. 5b) Průnik přes dolní periinzulární sulkus k meziotemporální oblasti. Obr. 5c) Koronární T1W sken pacientky po radikální resekci recidivy GBM původně operované ze zadního přístupu. F, T – temporální a frontální operkulum, M2 – inzulární větve MCA, dPiS – dolní periinzulární sulkus, Tent – tentorium, P2 – ambientní segment PCA, MK – mesencefalon, šipka – trajektorie transsylvijského přístupu. Image 5. Transkortikální transtemporální přístup (vč. temporální resekce nádoru). Fig. 6. Transcortical transtemporal access (including temporal resection of the tumour). 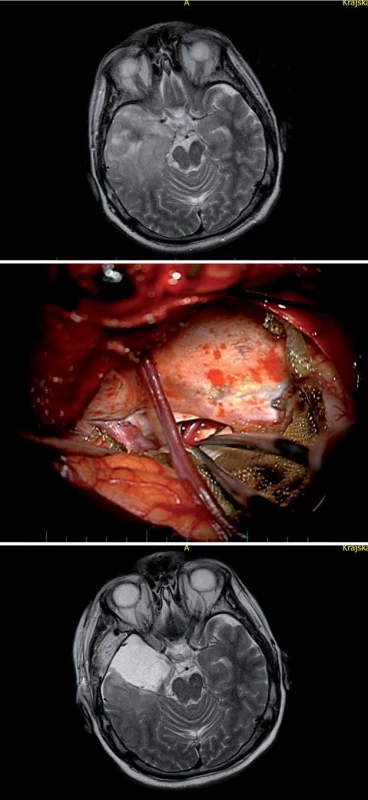
Obr. 6a) Anaplastický astrocytom infiltrující temporální neokortex a mediotemporální struktury vpravo u 44letého pacienta, stav po předchozí radioterapii pro LGG. Obr. 6b) Temporální resekce se zachováním povrchové Sylvijské žíly s drenáží do sinus sphenoparietalis. Obr. 6c) Axiální T2W sken s resekcí 87 % tumoru, následovala chemoterapie při překročení radiačního limitu pro opakování radioterapie, pacient je bez záchvatů, operace 2013. F, T – lobus frontalis, temporalis, SSV– povrchová Sylvisjká žíla, ACI – arteria carotis interna. Image 6. Transchoroidální preparace hippokampu. Fig. 7. Transchoroidal preparation of the hippocampus. 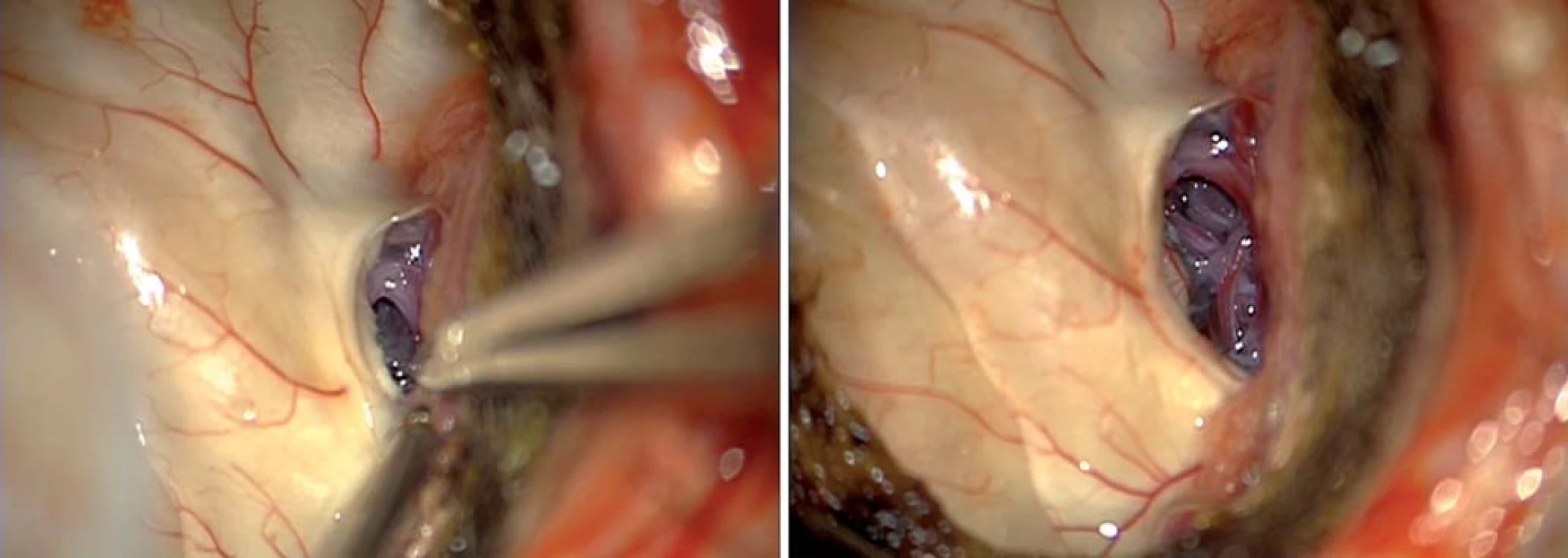
Obr. 7a) Ostrá preparace choroidální fisury. Obr. 7b) Detail. CA – Cornu Ammonis, ChF – choroidální fisura s hippokampálními perforátory a AchoA, ChP – plexus. Z předních přístupů je někdy obtížné dosáhnout na zadní část středního hippokampu a zcela nemožné je dosažení zadní části mediobazální oblasti, zejména jejího superiorního aspektu směrem k isthmu či do atria postranní komory. To je dáno značnou délkou mediobazálního temporálního komplexu a jeho zakřivením okolo mozkového kmene.
Zadní přístupy zahrnují subokcipitální přístup (obr. 8) [24] – ten ovšem za cenu značné trakce okcipitálního laloku s možností léze inferiorní cerebrální či Labbého žíly s tragickými následky hemoragické infarzace. Další možností je i zadní interhemisférický přístup (obr. 9), ovšem s nutností retrakce mediálního aspektu okcipitálního laloku, tedy s rizikem léze zrakového kortexu (Brodmannovy arey 17 – 19) [25,26]. Zde je tedy nejprve nutná šetrná mobilizace okcipitálního laloku a derivace likvoru z perikalózní, kvadrigeminální a zadní části ambientní cisterny, mobilizace P2 – 3 úseku PCA a až následné naložení retraktoru, do zadní části mediobazálního komplexu vstupujeme isthmem a přední částí linguálního gyru.
Image 7. Subokcipitální přístup. Fig. 8. Suboccipital approach. Obr. 8a) Mobilizace okcipitálního laloku a identifikace tentoriální incizury. 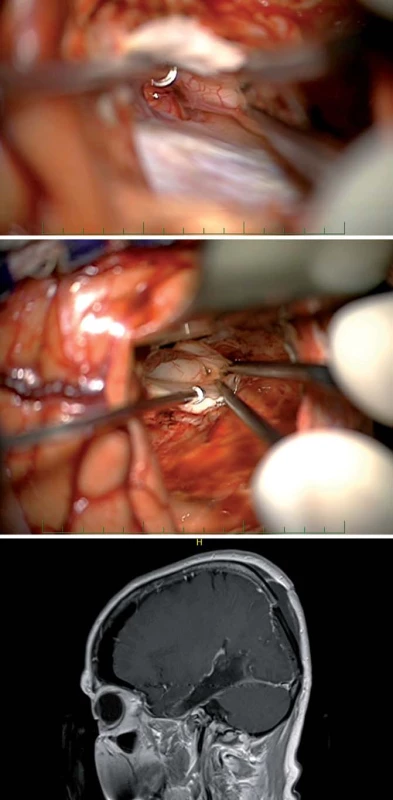
Obr. 8b) Identifi kace hippokampu. Obr. 8c) Sagitální T1W sken pacientky s GBM infiltrujícím v celé délce temporální a mediotemporální oblast – po jeho radikální resekci. Tent – tentorium, hip – hippokampus. Image 8. Zadní interhemisferický přístup. Fig. 9. Posterior interhemispheric approach. 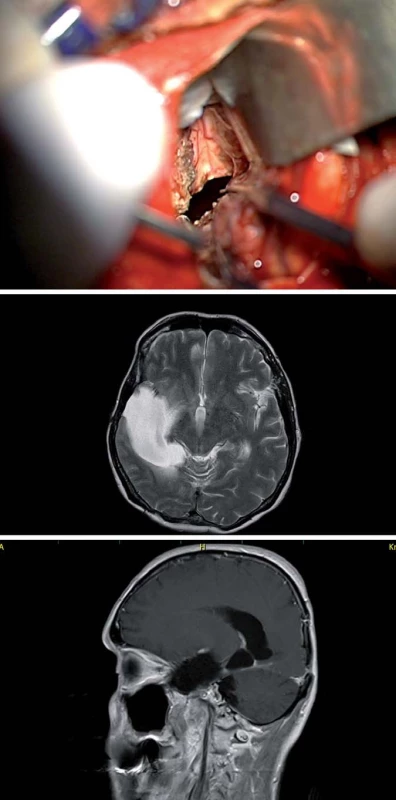
Obr. 9a) Interhemisferický přístup do paraspleniální oblasti, patrný temporální roh postranní komory (TH) resp. dutiny po předním přístupu. Obr. 9b) U pacientky s GBM došlo k progresi tumoru v paraspleniální oblasti, T2W sken ukazující propojení obou dutin po operaci recidivy. Obr. 9c) Sagitální T1W sken, šipka označuje paraspleniální oblast. V poslední době je předními neurochirurgy (U. Tűre, H. Bertalanffy, E. de Oliviera) [16,27] propagován inferiorní supracerebellární transtentoriální přístup (obr. 10, 11), který v sobě nese vtip proniknutí do dané oblasti bez nutnosti atakování či trakce neokortikálních struktur, k mediobazální oblasti se dostáváme mobilizací horní plochy mozečkové hemisféry, vč. přemosťujících žil do tentoria a následně transcidujeme tentorium až do tentoriální incizury, nutná je ovšem i zde primárně subarachnoidální disekce cisteren (kvadrigeminální, ambientní) s ozřejmením nervus trochlearis a arteria cerebri posterior. Výhodou tohoto přístupu je, že po dosažení temporálního rohu postranní komory operatér dosahuje v kraniokaudálním směru radikální resekce a taktéž je možná časná subpiální koagulace hippokampálních perforátorů. Z tohoto přístupu dosáhnout až Sylvijské rýhy [28] a resekovat i temporální pól [16] (obr. 11).
Image 9. Paramediální supracerebellární trans tentoriální přístup. Fig. 10. Paramedian supracerebellar transtentorial access. 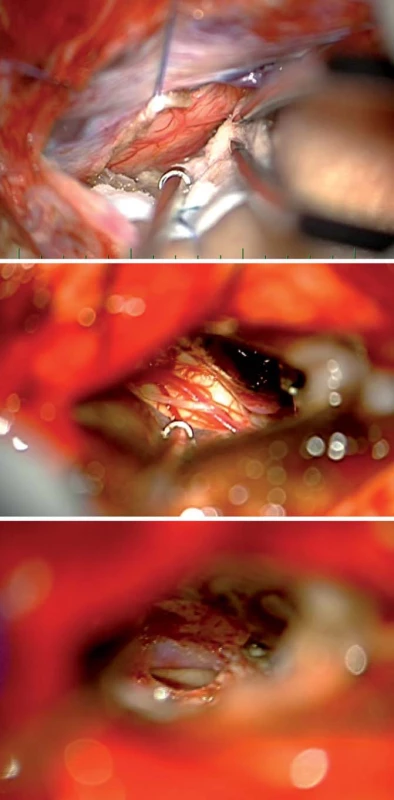
Obr. 10a) Transcize tentoria. Obr. 10b) Resekce zadní části parahippokampálního gyru po preparaci cisteren tentoriální inzury. Obr. 10c) Průnik anteriorně až k arteria cerebri media. Tent – tentorium, MTA – mediotemporální oblast – gyrus lingualis a parahippokampalis, mes – mesencefalon, IV – n. trochlearis, MCA – arteria cerebri media. Image 10. Výsledek resekce anaplastického astrocytomu celé délky mediobazálního temporálního komplexu transtentoriálním s doplněným minimálně invazivním subokcipitálním přístupem v jedné době u 64letého pacienta. Fig. 11. Result of a resection of an anaplastic astrocytoma aff ecting the entire length of the mediobasal temporal complex using transtentorial approach together with a minimally invasive suboccipital approach in a 64-year-old patient. 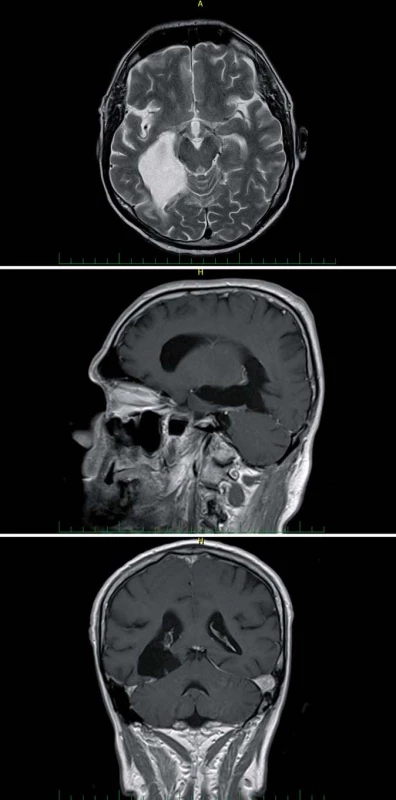
Obr. 11a) Axiální T2W sken. Obr. 11b) Sagitální T1W sken, šipka označuje trajektorii průniku přes tentorium. Obr. 11c) Koronární T1W sken ukazuje šíři resekce v úrovni linguálního gyru Cingulum (cingulární kůra) rozsahem odpovídá gyrus cinguli mezi sulcus corporis callosi a sulcus cinguli. Dorzálně od gyrus cinguli, paralelně s ním běží sulcus paracingularis ohraničující areu 32. Cingulární kůra se dělí na čtyři základní části:
- Přední agranulární kortex (ACC) s výraznou vrstvou V. – část area 24 před a nad genu corporis callosi, area 25 (area subgenualis pod genu corpus callosum) a area 33 (úzký pruh kůry těsně obkružující rostrum a genu corpus callosum). Area 24 se rozděluje ventrodorzálně na area 24a (při area 33), 24b – povrch gyrus cinguli a 24c (dolní svah sulcus cinguli). Area 24 u člověka a lidoopů obsahuje v páté vrstvě kromě pyramidových neuronů i unikátní vřetenovité bipolární neurony. Tyto neurony mají dlouhý, bohatě se větvící axon a jsou součástí nervových okruhů zapojených při činnostech spojených se zaměřenou pozorností a s vyjadřováním emocí. Area 32 obkružuje zepředu areu 24, tvoří přechod mezi cingulární a frontální kůrou a vyznačuje se velkými pyramidovými neurony ve vrstvě III.
- Střední dysgranulární přechodný kortex (MCC) (těsně nad corpus callosum zadní část area 24 a 32, area 23 a dorzálněji area 31). Dělí na přední střední cingulární kůru (aMCC) a zadní střední cingulární kůru (pMCC).
- Zadní granulární kortex (PCC) (area 23 a dorzálně od ní area 31) nad spleniem corpus callosum (ventrální PCC) a a za ním (dorzální PCC).
- Retrospleniální granulární kůru (RSC) (area 29).
Hlavním zdrojem topograficky uspořádaných aferentní spojů do gyrus cinguli jsou přední jádra thalamu, která jsou součástí Papezova okruhu. Další spoje přicházejí z oblasti septa. Významné jsou bilaterální spoje s prefrontální, parietální a temporální kůrou. Většina spojů z amygdaly míří do ACC, zatímco bohaté aferenty z dolních částí parietálního laloku směřují do MCC, PCC a RSC [30]. Eferenty z gyrus cinguli míří prostřednictvím cingula do gyrus parahippocampalis, dále do premotorické kůry, striata, mozečku, thalamu, amygdaly, hippokampální formace, kmene, ale i přímo do míchy (z MCC).
Na cingulum je nutné pohlížet jako funkčně nehomogenní systém [18,29].
Aktivita přední cingulární kůry je spojena s rozhodováním, empatickými reakcemi a se sociálními interakcemi. ACC reguluje autonomní funkce přímou projekcí do kmene (ncl. tr. solitarii a ncl. dorsalis n. vagi) a přijímá vlákna z amygdaly. Její aktivace je spojena s projevy emocí – spokojeností, agitovaností a podmíněnými reakcemi. Reguluje autonomní a endokrinní funkce a je zapojena v emočním učení, vokalizaci vnitřních stavů, v motivaci a přisuzování emoční hodnoty vnitřním i vnějším stimulům. Dorzální část area 24c umístěná na dolním svahu sulcus cinguli projikuje do motorického jádra nervus facialis a nazývá se rostrální cingulární motorická (premotorická) kůra. V gyrus cinguli jsou popsány tři somatotopicky uspořádané motorické oblasti: rostrální přední a rostrální zadní v přední MCC (area M3) a kaudální na hranici MCC a PCC (area M4). Jsou propojeny s motorickou kůrou i míchou a představují jednu z nejdůležitějších částí limbického systému pro řízení motoriky.
Subgenuální kůra zpracovává negativní emoce a je velmi náchylná k vzniku deprese (při depresi dochází k úbytku glie a změnám aktivity). Má mnohem více receptorů pro GABA, benzodiazepiny, noradrenalin (alfa 1) a serotonin (1A) než pregenuální část ACC [31].
Naopak MCC přijímá vlákna z parietální kůry a projikuje přímo do míchy. Jak ze studií drah u opic, tak z funkčních zobrazovacích metod u člověka bylo zjištěno, že přední MCC slouží jak ke zpracování bolestivých signálů, tak k motorickým funkcím. Zobrazovací studie ukázaly, že MCC je jednou z nejčastěji aktivovaných oblastí při akutní bolesti a stresu. Reorganizuje motorickou odpověď a chování tak, aby v budoucnu nedocházelo k bolestivé stimulaci. Aktivuje se však i při bezbolestném plnění myšlenkových a motorických úkolů. Má se za to, že je důležitá pro předvídání škodlivých následků a vyhýbání se jim, což je součástí rozhodování na základě odměny či trestu. Chronicky přicházející bolestivé impulzy mohou MCC dezorganizovat.
PCC je jednou z nejaktivnějších částí sítě „Default Mode Network; DMN“, jejíž aktivita je největší v klidu a při aktivní činnosti klesá. Je to paralimbická kůra, kde typický šestivrstevný izokortex přechází do třívrstevného allokortexu. Dělí se na dorzální PCC (area d23, přední area 31) nad spleniem corpus callosum a ventrální PCC za spleniem (area v23, zadní area 31). Je zapojena do kognitivní činnosti. Ventrální PCC je aktivní hlavně v síti DMN, ve vybavování vzpomínek a v plánování. Dorzální PCC je bohatě propojena se subgenuální kůrou, kontroluje šířku zaměření pozornosti a integruje emoce a vzpomínky [32].
Retrospleniální granulární kůra RCS je u člověka tenký proužek kůry za splenium corporis callosi, tzv. isthmus cinguli. Area 23 ji odděluje od precuneu. Má oboustranné spoje s hippokampální formací, předními jádry thalamu, dorzolaterální prefrontální kůrou a kůrou parietálního a okcipitálního laloku. Je důležitá pro pracovní paměť, vybavování si smyšlených i reálných zážitků a pro prostorovou orientaci.
Cingulum je zásobeno poměrně variabilním větvením přední mozkové tepny (ACA) a zadní perikalózní arterie ze zadní mozkové tepny (PCA-P3).
Technika operace
K resekci cingula přistupujeme nejčastěji interhemisferickým přístupem, v případě infiltrace horního frontálního gyru i transkortikálně, nicméně disekce interhemisferální rýhy s šetrnou mobilizací přemosťujících žil a preparací perikalózní a cingulárních arterií je nutností, pokud je infiltrováno i corpus callosum, pokračujeme s resekcí až do postranních mozkových komor (obr. 12).
Materiál a metodika
V letech 2009 – 9/ 2015 jsme provedli 52 resekcí gliálních nádorů v oblasti limbického systému u 47 pacientů (pětkrát recidiva). Jednalo se o 24 inzulárních (resp. inzulooperkulárních nádorů), 22 meziotemporálních nádorů s event. infiltrací temporálního laloku a šest gliomů postihujících cingulum. Zastoupení mužů a žen bylo obdobné (23 mužů, 24 žen). Průměrný věk pacientů byl 50 let (v rozmezí 20 – 73), pacienti s inzulárními nádory byli mírně mladší (průměrně 47 let, oproti průměrnému věku meziotemporálních a cingulárních nádorů 53 let). Operace byly vedeny snahou o maximální radikalitu, integrita motorické dráhy byla během 20 operací (83 %) inzulárních tumorů monitorována pomocí MEP, MEP jsme prováděli během osmi operací meziotemporálních nádorů (36 %), u tří operací cingulárních nádorů bylo prováděno mapování primární motorické kůry pomocí ECS, u jednoho pacienta byla kortikální stimulace prováděna během „awake fáze“ operace. Všechny operace inzulárních nádorů byly prováděny primárně transsylvijsky, v případě meziotemporálních nádorů jsme čtyřikrát zvolili transtentoriální přístup, jedenkrát subokcipitální, dvakrát zadní interhemisférický přístup, 10krát transsylvijský (jedenkrát přímý transsylvijský přístup) a čtyřikrát transkortikální přístup. Všechny operace cingulárních nádorů jsme provedli interhemisférickým přístupem, u tří pacientů s resekcí infiltrované části horního frontálního gyru.
Výsledky
Histologické zastoupení nádorů
U inzulárních nádorů prokázalo následné histopatologické vyšetření v 11 případech LGG, u tří pacientů anaplastický astrocytom a u devíti GBM, v jednom případě byla diagnóza nejednoznačná – lymfoidní angiektazie/ kavernom. U mladé pacientky reoperované po jednom roce pro recidivu gliomu došlo k malignizaci nádoru z LGG na anaplastický astrocytom.
V meziotemporální oblasti převažovaly malignější nádory: dvakrát anaplastický oligodendrogliom, šestkrát anaplastický astrocytom, osmkrát GBM a pouze v šesti případech LGG. U reoperované pacientky došlo taktéž k upgrade nádoru z anaplastického astrocytomu na GBM.
V cingulární oblasti jsme čtyřikrát resekovali GBM a dvakrát LGG. Zde je zajímavostí dvoudobá resekce oboustranného cingulárního LGG u 48leté pacientky v roce 2009, po operaci dále pracovala jako účetní, nyní je v důchodu, lyžuje a věnuje se vnoučatům (obr. 8).
Klinické výsledky operací
Velice závažnou komplikaci jsme pozorovali ve dvou případech (3,85 %).
V prvním případě meziotemporální a temporální resekce u 59leté pacientky s progredujícím infiltrativním nízkostupňovým gliomem operkulární, inzulární a temporální oblasti, vč. postižení bazálních ganglií a vnitřní capsuly, kdy po nekomplikované resekci (dokumentované integritou MEP) došlo v časném pooperačním období k obliteraci laterálních lentikulostriatálních perforátorů (LLSP) a k následnému prokrvácení rezidua nádoru v pro hybnost vitálně důležitých strukturách.
V druhém případě 70leté pacientky s glioblastomem v inzulární oblasti došlo po nekomplikované parciální resekci k prokrvácení rezidua s následnou těžkou poruchou hybnosti levostranných končetin. Již na předoperační MR bylo patrno prorůstání nádoru do pyramidové dráhy.
Tyto dvě pacientky nezahrnujeme do následujícího volumetrického hodnocení, MR nebyla po operaci prováděna.
Mezi další komplikace patří ischemie v povodí PCA u 54leté pacientky po radikální resekci LGG posteriorní části meziotemporální a paraspleniální oblasti zadním interhemisférickým přístupem, klinickým deficitem je levostranná temporální hemianopsie. U jednoho pacienta po operaci GBM v inzulární oblasti došlo po 10 dnech po nekomplikované monitorované resekci tumoru k rozvoji těžké fatické poruchy a středně těžké, ale upravivší se hemiparézy, které byly dány zřejmě iktem z uzávěru parietální větve M2, jejíž stěna byla peroperačně výrazně adherentní a patrně i infiltrována tumorem, reziduum středně těžké fatické poruchy a lehká hemiparéza perzistovaly. Míra všech nereverzibilních neurologických komplikací našich operací byla tedy 4/ 0,52 = 7,7 %.
U dalšího pacienta s GBM meziotemporální oblasti vznikl hyporesorbční hydrocefalus, byl mu následně zaveden VP shunt.
Radikalita operací hodnocená manuální počítačovou volumetrií
U gliomů lokalizovaných převážně v inzulární oblasti jsme dosáhli průměrné 82% redukce objemu nádoru (43 – 100 %). U osmi pacientů s GBM byla průměrná radikalita resekcí 93 % (86 – 100 %). Objem nádorů před resekcí byl v rozmezí 1,12 – 142,1 cm3 (průměr 44,25 cm3), po resekci v rozmezí 0,00 – 62,19 cm3 (průměr 8,45 cm3).
U gliomů lokalizovaných v meziotemporální oblasti jsme dosáhli průměrné 93% redukce objemu nádoru (67 – 100 %). U osmi pacientů s GBM byla průměrná radikalita resekcí 96 % (83 – 100 %). V této skupině jsme do tohoto průměrného hodnocení nezařadili 22letou pacientku s radikálně inoperabilní recidivou LGG infiltrující bazální ganglia a frontální operkulum, celá meziotemporální oblast byla nekomplikovaně resekována (24 % celého objemu nádoru) za účelem získání histologie, dekomprese kmene a zmírnění epileptických projevů onemocnění. Objem všech nádorů před resekcí byl v rozmezí 3,16 – 123,38 cm3 (průměr 39,19 cm3), po resekci v rozmezí 0,00 – 51,83 cm3 (průměr 4,94 cm3).
U gliomů lokalizovaných v cingulární oblasti jsme dosáhli průměrné 80% redukce objemu nádoru (54 – 100 %). U čtyř pacientů s GBM byla průměrná radikalita resekcí 78 % (54 – 100 %). Objem nádorů před resekcí byl v rozmezí 12,98 – 88,95 cm3 (průměr 35,82 cm3), po resekci v rozmezí 0,00 – 19,41 cm3 (průměr 6,99 cm3).
Závěr
Dle našeho názoru je snaha o radikalitu resekcí gliomů v této technicky náročné oblasti indikována.
Nutností je však dokonalá znalost anatomie limbického systému spojená s laboratorní přípravou umocňující prostorovou představivost operatéra. Neurochirurg musí mít schopnost preparace arachnoidálních cisteren a manipulace s cévními kmeny i perforátory. Monitorace motorických evokovaných potenciálů má z naší zkušenosti přednost před awake monitorací pacienta.
Operatér by měl mít k dispozici armamentarium uvedených operačních přístupů a u každého daného pacienta výhodnost jednotlivých přístupů zvažovat, event. jednotlivé přístupy i kombinovat. Nutné je současné zodpovědné zvážení případného rizika snahy o radikální resekci během výkonu a maximální snaha o zachování výborného funkčního stavu pacienta pro následnou onkologickou léčbu.
Radikalita resekce gliomu dominantně v temporální mediobazální oblasti je dána zejména případnou infiltrací okolních struktur (centrální struktury, řečové oblasti dominantní hemisféry), jinak se však jedná o anatomicky jasně definovanou oblast [20,21]. Resekci elokventních struktur se lze vyhnout selektivním přístupem bez poškození neokortexu transtentoriální cestou [16,27]. Nezodpovězenou otázkou je indikace re-sekce meziotemporálních struktur u pa-cienta s chirurgicky jinak neřešitelným gliomem, dle naší zkušenosti je tato operace zatížena vysokým rizikem (50 %) prokrvácení rezidua tumoru.
V případě inzulárních nádorů je problémem dosažení smysluplné radikality ve smyslu odhadu mediální hranice nádoru směrem k LLsP, a tedy k bazálním gangliím. Podstatné je předoperační rozpoznání (na T2 MR, MRA), zda se tyto perforátory nacházejí na mediální hranici nádoru či jím procházejí – což je ovšem méně časté [33,34]. Určení mediální hranice může napomoci peroperační použití navigace, ultrazvukového zobrazení, event. MR. Awake monitorace řečových funkcí během resekce postižených operkul v našem souboru prováděna nebyla, komplikaci ve smyslu fatické poruchy jsme nezaznamenali. Pokud bychom měli k awake monitoraci přistoupit, bylo by zřejmě nutné – pro velkou technickou a časovou náročnost – operaci rozdělit do dvou fází.
V některých publikacích je zpochybňována, vzhledem k vysoké morbiditě a mortalitě, smysluplnost resekce glioblastomu v inzulární oblasti [11]. Z naší zkušenosti můžeme však tvrdit, že pokud se nejedná o tumor do elokventních struktur vysloveně infiltrativní, lze operaci s přijatelným rizikem provést.
Naopak shoda panuje o indikaci operace inzulární neenhancující léze, v mnoha sériích [35] je mezi těmito nádory vysoké zastoupení anaplastického astrocytomu či LGG s vyšší proliferační aktivitou, u které je následně indikována radio-chemoterapie. Zde by „wait and see“ taktika mohla pacienta poškodit oddálením onkologické léčby. V naší sérii 12 pacientů jsme zastihli dva anaplastické astrocytomy a čtyři LGG s vyšší proliferační aktivitou, kteří byli po operaci indikováni k časné onkologické léčbě. Dva pacienti po opakované resekci a jeden v průběhu sledování dospěli k onkologické léčbě následně a pouze u tří pacientů nebyla zatím radio-chemoterapie v průběhu nemoci aplikována.
Riziko resekce tumoru v cingulární oblasti spočívá zejména v potenciální lézi SMA. Naopak poškození primární motorické kůry a proximální části pyramidové dráhy se lze vyhnout kortikální a subkortikální stimulací. Nutností je opět pečlivá disekce komplexu ACA.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Robert Bartoš, Ph.D.
Neurochirurgická klinika
UJEP a Krajská zdravotní a.s.
Masarykova nemocnice v Ústí nad Labem, o.z.
Sociální péče 12A
401 00 Ústí nad Labem
e-mail: mnbartos@mnul.cz
Přijato k recenzi: 17. 12. 2015
Přijato do tisku: 16. 2. 2016
MUDr. Robert Bartoš, Ph.D.
Robert Bartoš (narozen 26. 5. 1974) prožil své dětství v Písku, 2. LF UK dokončil v roce 1998 a od té doby pracuje na neurochirurgickém pracovišti v Ústí nad Labem pod vedením prof. Martina Sameše. Dlouhodobě se věnuje léčbě pacientů s intrinsickými mozkovými nádory, je koordinátorem NOC Ústí nad Labem. Společně s prof. Samešem a anesteziologem Martinem Červenkou navštívili v roce 2002 Atkinson Morley´s Hospital v Londýně, kde shlédli „awake“ operaci prováděnou prof. Henrym Marshem, což je značně ovlivnilo. Také se věnoval postgraduálnímu studiu „Korelace fMRI a kortikální stimulace“ (školitelé: prof. Pavel Petrovický a doc. Robert Jech; obhajoba 2009). Laskavostí dr. Veroniky Němcové a prof. Karla Smetany se zapojil do výuky neuroanatomie na Anatomickém ústavu 1. LF UK v Praze. Taktéž dospěl do veteránské sportovní kategorie a opět se s kamarády věnuje rychlostní kanoistice (K1), učaroval mu i windsurfing (homespot Máchovo jezero).
Sources
1. Reil J. Die sylvische Grube. Arch Physiol (Halle) 1809;9 : 195 – 208.
2. Türe U, Yaşargil MG, Al-Mefty O, et al. Topographic anatomy of the insular region. J Neurosurg 1999;90(4):720 – 33.
3. Tűre U, Yaşargil MG, Al-Mefty O, et al. Arteries of the insula. J Neurosurg 2000;92(4):676 – 87.
4. Chang LJ, Yarkoni T, Khaw MW, et al. Decoding the role of the insula in human cognition: functional parcellation and large-scale reverse inference. Cereb Cortex 2013;23(3):739 – 49. doi: 10.1093/ cercor/ bhs065.
5. Stephani C, Fernandez-Baca Vaca G, Maciunas R,et al. Functional neuroanatomy of the insular lobe. Brain Struct Funct 2011;216(2):137 – 49. doi: 10.1007/ s00429-010-0296-3.
6. Ibañez A, Gleichgerrcht E, Manes F. Clinical effects of insular damage in humans. Brain Struct Funct 2010;214(5 – 6):397 – 410. doi: 10.1007/ s00429-010-0256-y.
7. Yaşargil MG. Microneurosurgery. Vol. 4. New York, Thieme Medical 1996.
8. Lang FF, Olansen NE, DeMonte F, et al. Surgical resection of intrinsic insular tumors: complication avoidance. J Neurosurg 2001;95(4):638 – 50.
9. Hentschel SJ, Lang FF. Surgical resection of intrinsic insular tumors. Neurosurgery 2005;57(Suppl 1):176 – 83.
10. Neuloh G, Pechstein U, Schramm J. Motor tract monitoring during insular glioma surgery. J Neurosurg 2007;106(4):582 – 92.
11. Simon M, Neuloh G, von Lehe M, et al. Insular gliomas: the case for surgical management. J Neurosurg 2009;110(4):685 – 95. doi: 10.3171/ 2008.7.JNS17639.
12. Bartoš R, Sameš M, Zolal A, et al. Resekce insulárních gliomů – volumetrické hodnocení radikality. Cesk Slov Neurol N 2009;72/ 105(6):534 – 41.
13. Fernandez-Miranda JC, Rhoton AL, Álvarez-Linera J, et al. Three-dimensional microsurgical and tractographic anatomy of the white matter of the human brain. Neurosurgery 2008;62(Suppl 6):989 – 1028. doi: 10.1227/ 01.neu.0000333767.05328.49.
14. Türe U, Yaşargil MG, Friedman AH, et al. Fiber dissection technique: lateral aspect of the brain. Neurosurgery 2000;47(2):417 – 26.
15. Bartoš R, Hejčl A, Zolal A, et al. Laboratorní disekce drah laterálního aspektu mozkové hemisféry. Cesk Slov Neurol N 2012;75/ 108(1):30 – 7.
16. Tűre U, Harupt MV, Kaya AH, et al. The paramedian supracerebellar-transtentorial approach to the entire lenght of the mediobasal temporal region: an anatomical and clinical study. J Neurosurg 2012;116(4):773 – 91. doi: 10.3171/ 2011.12.JNS11791.
17. Duvernoy H, Cattin F, Risold PY. The human hippocampus. functional anatomy, vascularization and serial sections with MRI. 4th ed. Springer-Verlag Berlin Heidelberg 2013.
18. Smahmann J, Pandya D. Fiber pathways of the brain. Oxford University Press. New York 2006.
19. Figueiredo EG, Deshmukh P, Nakaji P, et al. Anterior selective amygdalohippocampectomy: technical description and microsurgical anatomy. Neurosurgery 2010;66(Suppl 3):45 – 53. doi: 10.1227/ 01.NEU.0000350981.36623.8B.
20. Wen HT, Rhoton AL jr, de Oliveira E, et al. Microsurgical anatomy of the temporal lobe: part 1: mesial temporal lobe anatomy and its vascular relationships as applied to amygdalohippocampectomy. Neurosurgery 1999;45(3):549 – 91.
21. Yaşargil MG, von Ammon K, Cavazos E, et al. Tumours of the limbic and paralimbic systems. Acta Neurochir 1992;118(1 – 2):40 – 52.
22. Wheatley BM. Selective amygdalohippocampectomy: the trans-middle temporal gyrus approach. Neurosurg Focus 2008;25(3):E4. doi: 10.3171/ FOC/ 2008/ 25/ 9/ E4.
23. Mengesha T, Abu-Ata M, Haas KF, et at. Visual field defects after selective amygdalohippocampectomy and standard temporal lobectomy. J Neuroophthalmol 2009; 9(3):208 – 13. doi: 10.1097/ WNO.0b013e3181b41262.
24. Jittapiromask P, Deshomukh P, Nakaji P, et al. Comparative analysis of the posterior approaches to the medial temporal region: supracerebellar transtentorial versus occipital transtentorial. Neurosurgery 2009;64(Suppl 1):ons35 – 43. doi: 10.1227/ 01.NEU.0000334048.96772.A7.
25. Ozek MM, Tűre U. Surgical approach to thalamic tumors. Childs Nerv Syst 2002;18(8):450 – 6.
26. Bartoš R, Malucelli A, Provazníková E, et al. Zadní interhemisferický prekuneální/ transspleniální přístup k intrinsickým mozkovým lézím. Cesk Slov Neurol N 2012;75/ 108(3):354 – 8.
27. de Oliveira JG, Párraga RG, Chaddad-Neto F, et al. Supracerebellar transtentorial approach-resection of the tentorium instead of an opening-to provide broad exposure of the mediobasal temporal lobe: anatomical aspects and surgical applications. J Neurosurg 2012;116(4):764 – 72. doi: 10.3171/ 2011.12.JNS111256.
28. Bartoš R, Radovnický T, Orlický M, et al. Kombinovaný paramediánní supracerebellární-transtentoriální a miniinvazivní suboccipitální přístup při resekci gliomu celé délky mediobazální temporální oblasti: anatomická studie, technické poznámky a kazuistika. Cesk Slov Neurol N 2014;77/ 110(3):353 – 8.
29. Vogt BA. Cingulate neurobiology and disease. 1. ed. Oxford University Press. New York 2009.
30. Vogt BA, Hof PR, Vogt L. Cingulate gyrus. In: Paxinos G, Mai JK (eds). The human nervous system. 1. ed.New York: Academic Press 2003 : 915 – 49.
31. Palomero-Gallagher N, Mohlberg H, Zilles K, et al. Cytology and receptor architecture of anterior human cingulate cortex. J Comp Neurol 2008;508(6):906 – 26.
32. Leech R, Sharp DJ. The role of the posterior cingulate cortex in cognition and disease. Brain 2013;137(1):12 – 32. doi: 10.1093/ brain/ awt162.
33. Moshel YA, Marcus JD, Parker EC, et al. Resection of insular gliomas: the importance of lenticulostriate artery position. J Neurosurg 2008;109(5):825 – 34. doi: 10.3171/ JNS/ 2008/ 109/ 11/ 0825.
34. Saito R, Kumabe T, Inoue T, et al. Magnetic resonance imaging for preoperative identification of the lenticulostriate arteries in insular glioma surgery. Technical note. J Neurosurg 2009;111(2):278 – 81. doi: 10.3171/ 2008.11.NS08858.
35. Skrap M, Mondani M, Tomasino B, et al. Surgery of insular nonenhancing gliomas: volumetric analysis of tumoral resection, clinical outcome, and survival in a consecutive series of 66 cases. Neurosurgery 2012;70(5):1081 – 93. doi: 10.1227/ NEU.0b013e31823f5be5.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 2-
All articles in this issue
- Gliomy limbického a paralimbického systému, technika a výsledky resekcí
- Nová éra endovaskulární terapie v léčbě akutních iktů
- Nanočástice jako nosiče léků přes hematoencefalickou bariéru – naděje pro léčbu neurodegenerativních onemocnění v budoucnosti?
- Robotická rehabilitace chůze
- Výsledky studií srovnávajících efekt angioplastik a endarterektomií v léčbě karotických stenóz
- Management tranzitorní ischemické ataky a minor stroke
- Autonomní dysfunkce a její diagnostika u roztroušené sklerózy
- Kognice a hemodynamika po karotické endarterektomii pro asymptomatickou stenózu
- Klinická rekognícia spinálneho lipómu a chirurgické riešenie vlastného súboru
- Využití CT perfuze a multifázické CT angiografie v predikci rozvoje maligního mozkového edému u pacientů s akutním mozkovým infarktem
- Ramsay-Huntov syndróm – vzácna manifestácia pomerne častého ochorenia
- Neurosarkoidóza u muže středního věku – kazuistika
- Doporučení pro rekanalizační léčbu akutního mozkového infarktu – verze 2016
- Neobvyklé endovaskulární řešení trombózy mozkových splavů použitím aspiračního systému – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ramsay-Huntov syndróm – vzácna manifestácia pomerne častého ochorenia
- Management tranzitorní ischemické ataky a minor stroke
- Neurosarkoidóza u muže středního věku – kazuistika
- Autonomní dysfunkce a její diagnostika u roztroušené sklerózy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



