-
Medical journals
- Career
Výsledky studií srovnávajících efekt angioplastik a endarterektomií v léčbě karotických stenóz
Authors: D. Krajíčková 1,2; A. Krajina 1,3
Authors‘ workplace: LF UK a FN Hradec Králové Komplexní cerebrovaskulární centrum 1; LF UK a FN Hradec Králové Neurologická klinika 2; LF UK a FN Hradec Králové Radiologická klinika 3
Published in: Cesk Slov Neurol N 2016; 79/112(2): 173-177
Category: Review Article
Overview
Autoři uvádějí systematický přehled velkých randomizovaných studií z posledních let, které srovnávají krátkodobý i dlouhodobý efekt endovaskulární a chirurgické metody při léčbě stenózy odstupu vnitřní karotické tepny. Studie prokázaly podobný pozitivní dlouhotrvající efekt pro obě metody. Vyšší četnost komplikací v periprocedurálním období po angioplastice je způsobena častějšími drobnými neinvalidizujícími mozkovými ischemiemi, endarterektomie má větší riziko srdečního infarktu. Pro úspěch léčby je zásadní zkušenost operatéra a správná indikace nemocného k léčbě. Nemocní by měli být léčeni v centrech, která mají k dispozici obě metody a provádějí je s nízkým počtem komplikací.
Klíčová slova:
karotický stenting – karotická endarterektomie – randomizované studie – periprocedurální komplikace – dlouhodobý výsledekÚvod
Pro ošetření stenózy odstupu a. carotis interna existují dvě léčebné alternativy: starší chirurgická – karotická endarterektomie (CEA), poprvé úspěšně provedená v roce 1951, a asi o 30 let mladší endovaskulární metoda – perkutánní transluminální angioplastika (PTA – první v roce 1979), v dnešní době standardně doplňovaná zavedením stentu (PTAS), častěji označovaná jako karotický stenting (CAS). Přestože bylo v uplynulém desetiletí věnováno mnoho úsilí zjistit, která metoda je pro nemocného prospěšnější, zůstává toto téma nadále živé [1]. Za tímto účelem bylo do dnešní doby realizováno 12 studií srovnávajících efekt chirurgické a endovaskulární léčby, z nichž šest studií je tzv. velkých s > 300 nemocnými. Studie CAVATAS (the Carotid And Vertebral Artery Transluminal Angioplasty Study), která zařadila 504 nemocných, není součástí následujícího přehledu, protože použitá technika a metodika endovaskulární léčby neodpovídá současným standardům CAS (stenty u 22 % výkonů, bez použití protektivního zařízení, bez protidestičkové léčby) [2].
Přehled studií
SAPPHIRE 2004 (the Stentingand Angioplasty with Protection in Patients at High-Risk for Endarterectomy)
Americká multicentrická studie, 334 nemocných, 96 symptomatických s ≥ 50% stenózou/ 238 asymptomatických s ≥ 80% stenózou, k endovaskulární léčbě 167 pacientů, všichni CAS, všichni protekce, protidestičková léčba povinná, k CEA 167 pacientů (tab. 1, 2). Ve studii pouze nemocní s vysokým rizikem chirurgické léčby pro komorbiditu (městnavá forma ICHS – třída III/ IV, ejekční frakce < 30 %, infarkt myokardu v posledních čtyřech týdnech, nestabilní angina pectoris, nutnost operace v mimotělním oběhu v příštích šesti týdnech, závažná chronická nebo obstrukční plicní choroba) nebo nevhodné anatomické poměry (stav po CEA, postiradiační stenóza). „Non-inferiority“ design s cílem testovat hypotézu, že stenting není u nemocných s vysokým rizikem pro chirurgickou léčbu horší než CEA. Studie předčasně zastavena pro pomalý náběr pacientů (po zveřejnění výsledků registrů malá ochota ze strany spolupracujících praktických lékařů podporovat nemocné v účasti ve studii).
Table 1. Základní charakteristika studií srovnávajících efekt CEA a CAS – I. 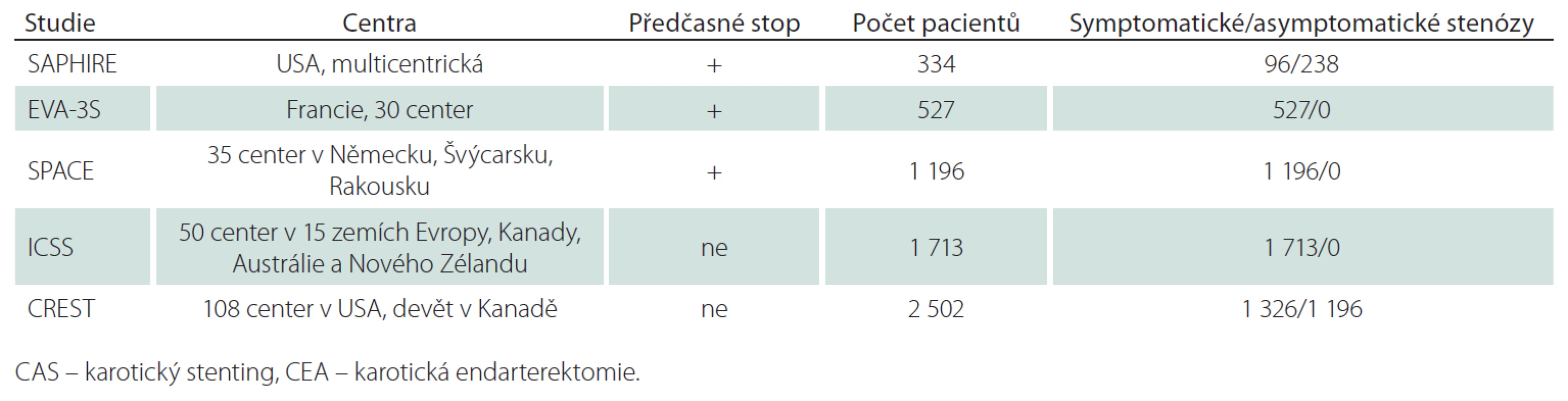
Table 2. Základní charakteristika studií srovnávajících efekt CEA a CAS – II. 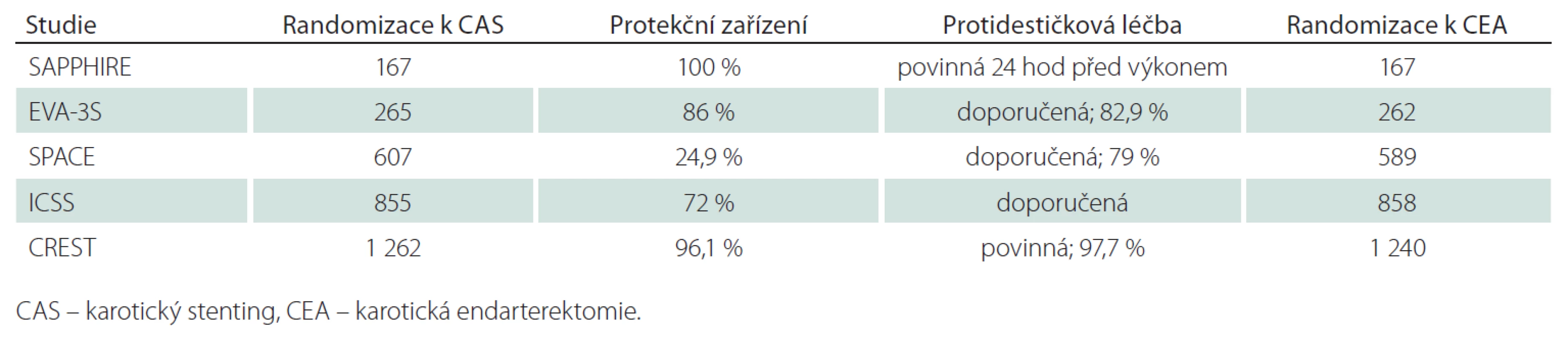
Kvalifikace: Operatéři byli relativně zkušení v obou technikách (tab. 3).
Table 3. Kvalifikace operatérů pro CEA a CAS. 
Primární „end point“: Kumulativní úmrtí v důsledku CMP/ jakákoliv CMP/ infarkt myokardu do 30 dnů nebo stejnostranná CMP mezi 31. dnem a 1 rokem.
Výsledky: Sledovaný parametr pro CAS 12,2 % (20 nemocných), pro CEA 20,1 % (32 nemocných), p = 0,05; ve 30 dnech úmrtí/ jakákoliv CMP/ infarkt myokardu pro CAS 4,4 %, pro CEA 9,9 %; úmrtí/ jakákoliv CMP pro CAS 4,8 %, pro CEA 5,4 %; invalidizující CMP pro CAS 2,4 %, pro CEA 1,2 %; infarkt myokardu pro CAS 2,4 %, pro CEA 5,9 %.
Komentář: Soubor zařazených pacientů značně heterogenní, většina asymptomatických.
Závěr: Nebylo prokázáno, že by CAS s použitím protekce byla horší než CEA u vysoce rizikových nemocných. Výsledky nemají být generalizovány na pacienty s nízkým rizikem chirurgické léčby [3 – 6].
EVA-3S 2006 (the Endarterectomy Versus Angioplasty in patients with Severe carotid Stenosis Study)
Francouzská multicentrická studie, 527 pacientů, 527 symptomatických v posledních 120 dnech/ 0 asymptomatických, k endovaskulární léčbě 265 pacientů, všichni CAS, protekce u 227 pacientů, protidestičková léčba u 82,9 % nemocných, k CEA 262 pacientů (tab. 1, 2). Původně pouze pacienti se stenózou > 70 %, později i ≥ 60 %. „Non-inferiority“ design. Studie byla předčasně zastavena v roce 2005 pro lepší výsledky CEA.
Kvalifikace: Operatéři měli dobrou zkušenost s CEA, ale byli nezkušení pro CAS (tab. 3).
Primární „end point“: Jakákoliv CMP/ úmrtí ve 30 dnech.
Výsledky: Sledovaný parametr pro CAS 9,4 % (25/ 265), pro CEA 3,8 % (10/ 262); invalidizující CMP/ úmrtí pro CAS 3,4 % (devět nemocných), pro CEA 1,5 % (čtyři nemocní), p = 0,26; infarkt myokardu pro CAS 0,4 %, pro CEA 0,8 %. V šesti měsících úmrtí/ CMP pro CAS 11,7 %, pro CEA 6,1 %.
Komentář: Studie byla kritizována pro neadekvátní a nevyrovnanou zkušenost operatérů s negativním vlivem na CAS (13krát konverze z CAS k urgentní CEA, 15 % z těchto nemocných v této souvislosti předoperačně utrpělo mozkový infarkt). U 16 nemocných (6,5 %) byla CAS provedena v celkové narkóze a u 56 nemocných (22,7 %) v analgosedaci s použitím neuroleptik, což je praxe nepoužívaná ve specializovaných centrech.
Závěr: CEA měla nižší 30denní riziko jakékoliv CMP/ smrti. Byla to však první studie, která prokázala, že rozdíl ve výsledku mezi CEA a CAS je ve vyšším počtu drobných CMP ve skupině CAS [6 – 9].
SPACE 2006, 2007 (the Stent-Protected Angioplasty versus Carotid Endarterectomy in symptomatic patients)
Multicentrická evropská studie, 1 196 nemocných, 1 196 v posledních 180 dnech symptomatických nemocných se stenózou ≥ 70 % dle ECST nebo ≥ 50 % dle NASCET/ 0 asymptomatických, k endovaskulární léčbě 607 nemocných, všichni CAS, protekce použita u 151 (25 %) nemocných, duální protidestičková léčba doporučena nejméně tři dny před výkonem (79 %), k CEA 589 nemocných (tab. 1, 2). „Non-inferiority“ design. Studie byla předčasně zastavena po průběžné analýze 1 183 nemocných, která ukázala, že k průkazu ekvivalence by byl třeba mnohem větší soubor nemocných a k tomu chyběly finanční prostředky.
Kvalifikace: Pro CAS ve srovnání s předcházejícími studiemi lepší (tab. 3).
Primární „end point“: Ve 30 dnech kombinovaný ukazatel úmrtí/ stejnostranné CMP.
Výsledky: Sledovaný parametr pro CAS 6,8 % (41/ 607), pro CEA 6,3 % (37/ 589); invalidizující CMP pro CAS 4,1 %, pro CEA 2,9 %; infarkt myokardu pro CAS ani CEA neuveden.
Komentář: Studie byla kritizována pro neadekvátní a neuniformní zkušenost operatérů s negativním vlivem na CAS.
Závěr: Přestože nebyl signifikantní rozdíl v primárním sledovaném parametru, studie nedoporučila CAS pro široké použití, protože neprokázala ekvivalenci CEA a CAS. Rozdíl pouhých čtyř periprocedurálních komplikací na 600 nemocných může být však vnímán jako zanedbatelný [6,10 – 12].
ICSS 2010 (the International Carotid Stenting Study)
Multicentrická studie, 1 713 nemocných v 50 centrech, 1 713 symptomatických v posledních 12 měsících s ≥ 50% (NASCET kritéria) stenózou/ 0 asymptomatických, k endovaskulární léčbě 855 nemocných, všichni CAS, protekce u 72 % (nejaktivnější centrum v Utrechtu nepoužívalo protekci), duální protidestičková léčba doporučená, k CEA 858 nemocných (tab. 1, 2). Design „ekvivalence“. První velká srovnávací studie, která dokončila plánovaný náběr pacientů, aniž byla předčasně zastavena.
Kvalifikace: Intervenční radiologové měli s CAS malou zkušenost (tab. 3).
Primární „end point“: Jakákoliv fatální nebo invalidizující CMP ve třech letech.
Výsledky: Ve 120 dnech kombinovaný ukazatel úmrtí/ jakékoliv CMP/ infarktu myokardu pro CAS 8,4 % (72/ 857), pro CEA 5,1 % (44/ 857); invalidizující CMP/ úmrtí pro CAS 4,0 % (34), pro CEA 3,2 % (27). Největší rozdíl byl ve větším počtu drobných CMP ve skupině endovaskulární, infarkty myokardu vzácné. Dlouhodobý funkční výsledek (rozložení jednotlivých skóre modifikované Rankinovy škály [18] v jednom roce, pěti letech a na konci sledování) a riziko fatální nebo invalidizující CMP byly podobné pro CAS i CEA (6,4 vs. 6,5 %).
Komentář: Výsledek ve 120 dnech favorizující CEA byl, stejně jako v EVA-3S, způsoben především větším počtem drobných neinvalidizujících CMP ve skupině CAS.
Závěr: Výsledky dlouhodobého sledování (medián 4,2 roky) byly publikovány teprve koncem roku 2014 a potvrzují, že mezi oběma metodami není rozdíl v dlouhodobém pozitivním efektu [6,13 – 17].
CREST (the Carotid Revascularization Endarterectomy versus Stenting Trial)
Studie se účastnilo 108 center v USA a devět v Kanadě, zařazeno bylo 2 502 nemocných, 1 326 v posledních 180 dnech symptomatických nemocných s ≥ 50% (NASCET kritéria) stenózou dle DSA nebo ≥ 70% dle UZ nebo CTA, MRA v případě, že stenóza podle UZ byla 50 – 69%/ 1 196 asymptomatických nemocných s ≥ 60% stenózou dle DSA, ≥ 70% dle UZ a ≥ 80% dle CTA, MRA, když stenóza dle UZ byla 50 – 69%. Randomizováno pro CAS 1 262 nemocných, pro CEA 1 240 nemocných (tab. 1, 2). Průměrný věk v CAS skupině činil 68,9 roků, v CEA skupině 69,2 roky; muži byli ve skupině CAS zastoupeni 63,9 %, ve skupině CEA 66,4 %; podíl asymptomatických tepen ve skupině CAS byl 47,1 %, ve skupině CEA 47,3 %; stenóz < 70 % bylo ve skupině CAS 13,1 %, ve skupině CEA 14,9 %, > 70 % ve skupině CAS 86,9 %, ve skupině CEA 85,1 %. Okluze druhostranné karotické tepny byla přítomna ve skupině CAS u 2,7 % nemocných, ve skupině CEA u 3,2 % nemocných. Průměrná doba sledování byla 2,5 roku. Předběžná analýza na základě „non-inferiority“ designu, další analýza vycházela z designu „superiority“. Studie byla dokončena dle plánu.
Kvalifikace: Přísná vstupní kritéria, při randomizaci vyrovnaná zkušenost pro obě metody (tab. 3).
Primární „end point“: Kombinovaný ukazatel úmrtí/ jakékoliv CMP/ infarktu myokardu periprocedurálně, nebo stejnostranná CMP ve čtyřech letech.
Výsledky: Periprocedurální sledovaný parametr byl pro obě léčebné skupiny podobný – ve skupině CAS 5,2 %, ve skupině CEA 4,5 %. Lišily se však jeho jednotlivé komponenty. CAS vs. CEA: úmrtí 0,7 vs. 0,3 %, jakákoliv CMP 4,1 vs. 2,3 %, infarkt myokardu 1,1 vs. 2,3 %. V periprocedurálním období bylo ve skupině CAS více i stejnostranných CMP, s převažujícím podílem drobných CMP: četnost „major stroke“ ve skupině CAS 0,9 vs. 0,3 % ve skupině CEA, „minor stroke“ ve skupině CAS 2,9 vs. 1,4 % ve skupině CEA. Ženy po CAS neměly větší pravděpodobnost periprocedurální komplikace – ve 30 dnech CMP/ úmrtí u žen 4,5 %, u mužů 4,2 % [20]. Ve čtyřech letech nebyl signifikantní rozdíl mezi CAS a CEA v sledovaném ukazateli (periprocedurálně úmrtí/ jakákoliv CMP/ infarkt myokardu + stejnostranná CMP v dalším období) 7,2 vs. 6,8 %.
Komentář: CREST je příkladem správně uspořádané studie. Rozdíl v četnosti infarktu myokardu mezi CREST a ICSS je důsledkem rozdílných diagnostických kritérií.
Závěr: CREST je první studie, která vykázala podobné výsledky endovaskulární a chirurgické léčby karotické stenózy [21]. Hlavní zjištěný rozdíl mezi oběma metodami spočívá v tom, že CAS měl periprocedurálně vyšší riziko drobných neinvalidizujících CMP a CEA vyšší riziko infarktu myokardu. CAS vykázal větší efekt u mladších [22], CEA u starších nemocných, hranicí bylo 70 let. Sekundární analýza dat [23] ukázala, že pravděpodobnost komplikací po CAS a CEA nebyla ovlivněna pohlavím ani skutečností, zda byla stenóza symptomatická nebo asymptomatická. CREST vykázal ze všech randomizovaných studií nejlepší výsledky, nejméně komplikací po CAS – u symptomatických nemocných periprocedurálně jakákoliv CMP, úmrtí nebo postprocedurálně stejnostranná CMP v 6 % (SPACE 6,8 %, a to bez neipsilaterální CMP, EVA-3S 9,4 %, ICSS 8,4 %), ale také po CEA – periprocedurálně stejný ukazatel 3,2 %, podobně jako v EVA-3S 3,8 % a ICSS 3,2 % (SPACE vyšší 6,3 %). U asymptomatických nemocných v CREST po CAS byl ukazatel úmrtí/ jakékoliv CMP 2,5 %, podobně jako v ACAS 2,3 % – ta však neobsahovala nemocné starší 79 let [24] – a byl nižší než v ACST 3,1 % [25], po CEA v CREST 1,4 % – také nižší než v ACAS a ACST. Ve čtyřech letech byla incidence stejnostranné CMP podobně nízká pro CAS 2,0 % jako pro CEA 2,4 % [6,19].
Diskuze
Výsledky studií jsou navzájem obtížně srovnatelné, protože studie jsou v mnoha ohledech heterogenní. Liší se podílem symptomatických a asymptomatických stenóz (evropské studie EVA-3S, SPACE, ICSS pouze symptomatické stenózy, americké SAPPHIRE a CREST i asymptomatické stenózy), stupněm stenózy, typy stentů, použitím protekčních zařízení (americké studie použily protekci téměř u všech výkonů, evropské studie méně) vč. materiálové rozdílnosti. Rozdílný byl i rizikový profil nemocných a lišily se sledované parametry, i jejich diagnostická kritéria (např. pro infarkt myokardu). Hlavním problémem studií je však absence standardizovaného protokolu antikoagulační a protidestičkové léčby, která je zásadní pro snížení emboligenního rizika během CAS, a nevyrovnaná kvalifikace chirurgů a intervenčních radiologů v neprospěch endovaskulární skupiny (tab. 2, 3).
Systematická analýza studií potvrdila, že zvýšení periprocedurálního rizika CAS je způsobeno vyšším počtem drobných neinvalidizujících CMP, zatímco podíl těžkých invalidizujících CMP nebo smrti je u obou metod podobný [17,19].
Studie jasně ukázaly, že pro snížení periprocedurálních komplikací má zásadní význam zkušenost, tj. dlouhodobý trénink operatéra [26]. Bylo patrné snížení počtu komplikací se zvyšujícím se počtem zařazených nemocných v CAS skupině. Čím nižší byl limit pro zkušenost s CAS, tím vyšší bylo procento komplikací – EVA-3S > ICSS > SPACE. Medián délky výkonu v EVA-3S byl 70 min (rozmezí 50 – 90 min), ačkoliv samotná CAS i s použitím protektivního filtru trvá na našem pracovišti v průměru 30 min. Existuje přitom jasná souvislost mezi trváním výkonu a pravděpodobností komplikací [27]. U 4 % nemocných ve studii byly použity 2 – 4 stenty [6], zřejmě proto, že léze nebyla dostatečně překryta jedním stentem, což je situace, která se zkušenému operatérovi nestává. Analýza studie ICSS ukázala, že v centrech, která provedla < 50 CAS, byl ukazatel CMP/ úmrtí/ infarkt myokardu 10 %, ale 5,9 % v centrech s > 50 výkony (p = 0,035) [13]. Poté, co byl původní požadavek na kvalifikaci nejméně 25 CAS před vstupem do studie SPACE zmírněn na ≥ 10 CAS („preliminary“ certifikát), se počet komplikací zvýšil [8]. Současně byla zjevná nepřímá úměrnost mezi počtem provedených CAS v jednotlivých centrech a počtem komplikací, což neplatilo pro CEA [28]. Tendence ke zlepšujícím se výsledkům CAS, a to navzdory již k přísným vstupním požadavkům na kvalifikaci, byla zřejmá i ve studii CREST. Zatímco během první poloviny studie od roku 2000 do počátku roku 2006 byl ukazatel „major stroke“/ úmrtí 2,5 %, v druhé polovině studie klesl na 0,4 % – a byl stejný pro CAS i CEA [6]. Lepší výsledky CAS v CREST zřejmě odrážejí větší zkušenost operatérů vč. lepšího osvojení endovaskulární techniky.
Na vyšším počtu komplikací v endovaskulární skupině se podílela i skutečnost, že k této léčbě byli randomizováni i nemocní primárně k endovaskulární léčbě nevhodní. Zatímco vlající trombus byl většinou uveden ve vyřazovacích kritériích, nebyly tam pokročilé kalcifikace a excentrické dlouhé stenózy. Ve studii EVA-3S měli větší pravděpodobnost špatného výsledku nemocní s větší tortuozitou karotické tepny (angulace ACC-ACI ≥ 60 %) – RR 4,96 a menší ti, u kterých bylo použito protekční zařízení – RR 0,38 [9].
Metaanalýza studií EVA-3S, SPACE a ICSS ukázala [29], že věk signifikantně ovlivňoval výsledek. U nemocných < 70 let bylo riziko CMP/ úmrtí ve 120 dnech podobné ve skupině CAS i CEA (5,8 a 5,7 %), u nemocných > 70 let bylo riziko CAS dvojnásobné, z větší části na vrub vyššího počtu drobných CMP (12,0 vs. 5,9 % u CEA). Zvýšené periprocedurální riziko CAS > 70 let prokázala i studie CREST. U nemocných ≥ 80 let byl u CAS ukazatel CMP/ úmrtí ve 30 dnech 12,12 %, a 3,23 % u mladších nemocných [30]. Větší rizikovost CAS u starších nemocných je důsledkem pokročilejšího aterosklerotického procesu s výraznějšími kalcifikacemi a tortuozitami tepen, které znesnadňují katetrizaci a zvyšují riziko distální embolizace během výkonu [20,31].
Na rozdíl od periprocedurálního období v dlouhodobém horizontu není rozdíl ve výsledku mezi oběma metodami. Ve studii CREST byla incidence stejnostranné CMP čtyři roky po léčbě podobně nízká pro CAS 2,0 % jako pro CEA 2,4 % a k podobnému výsledku dospěly i studie EVA-3S (4 roky), SPACE (2 roky) a recentně ICSS (4,2 roky) [7,11,17]. Znamená to tedy, že po úspěšné CAS bez periprocedurální komplikace mají nemocní v dalších letech stejně nízké riziko recidivy CMP jako po úspěšné CEA [32].
Závěr
Studie prokázaly podobný pozitivní dlouhotrvající efekt obou metod. Vyšší četnost neinvalidizujících drobných ischemických inzultů v periproceduálním období po CAS by měla být snížena striktním zajištěním nemocného duální protidestičkovou léčbou, jejíž účinnost musí být laboratorně ověřena, standardním použitím protekčního zařízení, dalším vývojem instrumentária, delším tréninkem operatéra a správnou indikací. V tom by měly pomoci poznatky plynoucí ze studií. Endovaskulární a chirurgická metoda spolu nesoupeří o stejného pacienta, ale vzájemně se doplňují, protože pro každou metodu je vhodný jiný nemocný. Správně vybraní nemocní musí být léčeni v centrech, která mají k dispozici obě léčebné metody a provádějí je s nízkým počtem komplikací [33].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Dagmar Krajíčková, CSc.
Neurologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: dagmar.krajickova@fnhk.cz
Přijato k recenzi: 29. 1. 2015
Přijato do tisku: 14. 12. 2015
Sources
1. Kinlay S. Fire in the hole: carotid stenting versus endarterectomy. Circulation 2011;123(22):2522 – 5. doi: 10.1161/ CIRCULATIONAHA.111.034314.
2. Ederle J, Featherstone RL, Brown MM. Randomized controlled trials comparing endarterectomy and endovascular treatment for carotid artery stenosis. A Cochrane systematic review. Stroke 2009;40(4):1373 – 80. doi: 10.1161/ STROKEAHA.108.531228.
3. Yadav JS, Wholey MH, Kuntz RE, et al. Protected carotid-artery stenting versus endarterectomy in high-risk patients. N Engl J Med 2004;351(15):1493 – 501.
4. Massop D, Dave R, Metzger C, et al. Stenting and angioplasty with protection in patients at high-risk for endarterectomy. SAPPHIRE Worldwide Registry first 2,011 patients. Catheter Cardiovasc Interv 2009;73(2):129 – 36. doi: 10.1002/ ccd.21844.
5. Wimmer NJ, Yeh RW, Cutlip DE, et al. Risk prediction for adverse events after carotid stenting in higher surgical risk patients. Stroke 2012;43(12):3218 – 24. doi: 10.1161/ STROKEAHA.112.673194.
6. Macdonald S. Carotid artery stenting trials: conduct, results, critique, and current recommendations. Cardiovasc Intervent Radiol 2012;35(1):15 – 29. doi: 10.1007/ s00270-011-0223-x.
7. Mas JL, Trinquart L, Leys D, et al. Endarterectomy versus angioplasty in patients with symptomatic severe carotid stenosis (EVA-3S) trial: results up to 4 years from a randomized, multicentre trial. Lancet Neurol 2008;7(10):885 – 92. doi: 10.1016/ S1474-4422(08)70195-9.
8. Fiehler J, Bakke SJ, Clifton A, et al. Plea of the defence – critical comments on the interpretation of EVA-3S, SPACE and ICSS. Neuroradiology 2010;52(7):601 – 10. doi: 10.1007/ s00234-010-0707-4.
9. Naggara O, Touzé E, Beyssen B, et al. Anatomical and technical factors associated with stroke or death during carotid angioplasty and stenting. Results from the Endarterectomy Versus Angioplasty in Patients With Symptomatic Severe Carotid Stenosis (EVA-3S) trial and systemic review. Stroke 2011;42(2):380 – 8. doi: 10.1161/ STROKEAHA.110.588772.
10. Ringleb PA, Allenberg JR, Bruckmann H, et al. 30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomized non-inferiority trial. Lancet 2006;368(9543):1239 – 47.
11. Eckstein HH, Ringleb P, Allenberg JR, et al. Results of the stent-protected angioplasty versus carotid endarterectomy (SPACE) study to treat symptomatic stenosis at 2 years: a multinational, prospective, randomized trial. Lancet Neurol 2008;7(10):893 – 902. doi: 10.1016/ S1474-4422(08)70196-0.
12. Jansen O, Fiehler J, Hartmann M, et al. Protection or nonprotection in carotid stent angioplasty. The influence of interventional techniques on outcome data from the SPACE trial. Stroke 2009;40(3):841 – 6. doi: 10.1161/ STROKEAHA.108.534289.
13. Ederle J, Dobson J, Featherstone RL, et al. Carotid artery stenting compared with endarterectomy in patients with symptomatic carotid stenosis (International Carotid Stenting Study): an interim analysis of a randomized controlled trial. Lancet 2010;375(9719):985 – 97. doi: 10.1016/ S0140-6736(10)60239-5.
14. Berkefeld J, Chaturvedi S. The International Carotid Stenting Study and the North American Carotid Revascularization Endarterectomy versus Stenting Trial. Fueling the debate about carotid artery stenting. Stroke 2010;41(11):2714 – 5. doi: 10.1161/ STROKEAHA.110.596833.
15. Mas JL, Arquizan C, Calvet D, et al. Long-term follow-up study of endarterectomy versus angioplasty in patients with symptomatic severe carotid stenosis trial. Stroke 2014,45(9):2750–6. doi:10.1161/STROKEAHA.114.005671.
16. Gensicke H, Zumbrunn T, Jongen LM, et al. Characteristics of ischemic brain lesions after stenting or endarterectomy for symptomatic carotid artery stenosis. Results from the international carotid stenting study – magnetic resonance imaging substudy. Stroke 2013;44(1):80 – 6. doi: 10.1161/ STROKEAHA.112.673152.
17. Bonati LH, Dobson J, Featherstone RL, et al. Long-term outcomes after stenting versus endarterectomy of symptomatic carotid stenosis: the International Carotid Stenting Study (ICSS) randomized trial. Lancet 2015;385(9967):529 – 38. doi: 10.1016/ S0140-6736(14)61184-3.
18. Sulter G, Steen C, De Keyser J. Use of the Barthel index and modified Rankin scale in acute stroke trials. Stroke 1999;30(8):1538 – 41.
19. Brott TG, Hobson RW, Howard G, et al. Stenting versus endarterectomy for treatment of carotid artery stenosis. N Engl J Med 2010;363(1):11 – 23. doi: 10.1056/ NEJMoa0912321.
20. Howard JV, Voeks JH, Lutsep HL, et al. Does sex matter? Thirty-day stroke and death rates after carotid artery stenting in women versus men. Results from the Carotid Revascularization Endarterectomy versus Stenting Trial (CREST) lead-in phase. Stroke 2009;40(4):1140 – 7. doi: 10.1161/ STROKEAHA.108.541847.
21. Pierot L, van der Bom IMJ, Wakhloo AK. Advances in stroke. Advances in interventional neuroradiology. Stroke 2012;43(2):310 – 3. doi: 10.1161/ STROKEAHA.111.642652.
22. Voeks JH, Howard G, Roubin GS, et al. Age and outcomes after carotid stenting and endarterectomy: the carotid revascularization endarterectomy versus stenting trial. Stroke 2011;42(12):3484 – 90. doi: 10.1161/ STROKEAHA.111.624155.
23. Silver FL, Mackey A, Clark WM, et al. Safety and stenting and endarterectomy by symptomatic status in the Carotid Revascularization Endarterectomy versus Stenting Trial (CREST). Stroke 2011;42(3):675 – 80. doi: 10.1161/ STROKEAHA.110.610212.
24. Executive Committee for the Asymptomatic Carotid Atherosclerosis Study. Endarterectomy for asymptomatic carotid artery stenosis. JAMA 1995;273(18):1421 – 8.
25. Halliday A, Mansfield A, Marro J, et al. Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: randomized controlled trial. Lancet 2004;363(9420):1491 – 502.
26. Calvet D, Mas J-L, Algra A, et al. Carotid stenting. Is there an operator effect? A pooled analysis from the Carotid Stenting Trialists’ Collaboration. Stroke 2014;45(2):527 – 32. doi: 10.1161/ STROKEAHA.113.003526.
27. Setacci C, Chisci E, Setacci F, et al. Siena carotid artery stenting score. A risk modelling study for individual patients. Stroke 2010;41(6):1259 – 65. doi: 10.1161/ STROKEAHA.110.578583.
28. Fiehler J, Jansen O, Berger J, et al. Differences in complication rates among the centers in the SPACE study. Neuroradiology 2008;50(12):1049 – 53. doi: 10.1007/ s00234-008-0459-6.
29. Bonati LH, Dobson J, Algra A, et al. Short-term outcomes after stenting versus endarterectomy for symptomatic carotid stenosis. A preplanned meta-analysis of individual patient data. Lancet 2010;376(9746):1062 – 73. doi: 10.1016/ S0140-6736(10)61009-4.
30. Hobson RW, Howard VJ, Roubin GS, et al. Carotid artery stenting is associated with increased complications in octogenarians: 30-day stroke and death rates in the CREST lead-in phase. J Vasc Surg 2004;40(6):1106 – 11.
31. Chiam PT, Roubin GS, Iyer SS, et al. Carotid artery stenting in elderly patients: importance of case selection. Catheter Cardiovasc Interv 2008;72(3):318 – 24. doi: 10.1002/ ccd.21620.
32. Naylor AR. A surgeon view on endarterectomy and stenting in 2011: lest we forget, it’s all about preventing stroke. Cardiovasc Intervent Radiol 2012;35(2):225 – 33. doi: 10.1007/ s00270-011-0282-z.
33. Beneš V, Netuka D, Charvát F, et al. Stenóza vnitřní krkavice – endarterektomie nebo stent? Cesk Slov Neurol N 2008;71/ 104(4):388 – 99.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2016 Issue 2-
All articles in this issue
- Gliomy limbického a paralimbického systému, technika a výsledky resekcí
- Nová éra endovaskulární terapie v léčbě akutních iktů
- Nanočástice jako nosiče léků přes hematoencefalickou bariéru – naděje pro léčbu neurodegenerativních onemocnění v budoucnosti?
- Robotická rehabilitace chůze
- Výsledky studií srovnávajících efekt angioplastik a endarterektomií v léčbě karotických stenóz
- Management tranzitorní ischemické ataky a minor stroke
- Autonomní dysfunkce a její diagnostika u roztroušené sklerózy
- Kognice a hemodynamika po karotické endarterektomii pro asymptomatickou stenózu
- Klinická rekognícia spinálneho lipómu a chirurgické riešenie vlastného súboru
- Využití CT perfuze a multifázické CT angiografie v predikci rozvoje maligního mozkového edému u pacientů s akutním mozkovým infarktem
- Ramsay-Huntov syndróm – vzácna manifestácia pomerne častého ochorenia
- Neurosarkoidóza u muže středního věku – kazuistika
- Doporučení pro rekanalizační léčbu akutního mozkového infarktu – verze 2016
- Neobvyklé endovaskulární řešení trombózy mozkových splavů použitím aspiračního systému – kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ramsay-Huntov syndróm – vzácna manifestácia pomerne častého ochorenia
- Management tranzitorní ischemické ataky a minor stroke
- Neurosarkoidóza u muže středního věku – kazuistika
- Autonomní dysfunkce a její diagnostika u roztroušené sklerózy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

