-
Medical journals
- Career
Chirurgie baze lební (uvnitř minimonografie video)
: M. Sameš 1–3; P. Vachata 1–3; A. Zolal 1–3; T. Radovnický 1–3; J. Ceé 1; F. Cihlář 4
: Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. Neurochirurgická klinika Univerzity J. E. Purkyně 1; Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. Anatomická laboratoř baze lební Univerzity J. E. Purkyně 2; Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. Komplexní cerebrovaskulární centrum 3; Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. Radiologické oddělení 4
: Cesk Slov Neurol N 2013; 76/109(4): 402-424
: Minimonography
Chirurgie baze lební se zabývá chirurgickým řešením vývojových, traumatických, zánětlivých, cévních a nádorových patologií v anatomicky nejkomplikovanějších oblastech lidského organizmu. K extenzivnímu rozvoji této subspecializace došlo v 80. letech 20. století a její vznik byl podmíněn zavedením operačního mikroskopu, zdokonalením znalostí mikroanatomie (zejména topografických vztahů hlavových nervů, mozkových cév a intrapyramidových struktur temporální kosti), vývojem zobrazovacích metod (CT, MR) a pokrokem v neuroanestezii. Nejdůležitější podmínkou však byla intenzivní a systematická mezioborová spolupráce neurochirurgie, otorinolaryngologie a stomatochirurgie. Rozsáhlá oblast baze lební je v článku rozdělena topograficko‑anatomicky na přední jámu lební, zadní jámu, střední jámu lební a centrální oblasti baze. Hlavní pozornost je věnována nádorovým onemocněním lební baze, důraz je kladen na první klinické příznaky a časnou diagnózu, neboť ta je pro chirurgické řešení nejdůležitější. Pojednání o cévních patologiích, rekonstrukcích faciálního nervu a selárních lézích jdou již nad rámec rozsahu této práce. Definování této disciplíny a jejích cílů vedlo k vytvoření speciálních anatomických laboratoří, k mezinárodní spolupráci a systematické výuce těchto technicky a časově náročných operačních výkonů. Tím přestaly být tyto operace výsadou několika nejvyspělejších chirurgů na světě a bylo možné úspěšně řešit tato onemocnění v jednotlivých zemích. V textu je shrnut vývoj světové a evropské odborné společnosti chirurgie baze lební, samostatná podkapitola je věnována vývoji této subspecializace v naší zemi.
Klíčová slova:
chirurgie baze lební – mikrochirurgie – operační přístupyÚvod
Patologie na bazi lební představovaly vždy specifický problém jak pro diagnostiku, tak i pro léčbu, neboť onemocnění v této oblasti byla velmi zřídka limitována do oblasti působení jednoho oboru medicíny. Úsilí překonat bariéry mezi jednotlivými specializacemi vedlo k úzké mezioborové spolupráci, jež formovala základ pro vývoj společné systematické diagnostické a chirurgické strategie pro tyto pacienty [1].
Baze lební byla po dlouhou dobu oblastí, kterou žádný obor nepovažoval za vlastní. Připočteme‑li komplexní a složitou anatomii, bylo řešení těchto onemocnění konvenčními technikami zatíženo nepřijatelně vysokou morbiditou a mortalitou. Chirurgie baze lební se rychle rozvíjela především od 80. let 20. století a je jako subspecializace či operační metoda specifická tím, že atakuje nejsložitější oblasti lidského organizmu, a tím, že vyžaduje kooperaci několika chirurgických disciplín – neurochirurgie, ORL, stomatochirurgie, plastické chirurgie, přičemž každý obor musí přesáhnout své konvenční hranice. Patologické léze v těchto oblastech byly dlouho považovány za inoperabilní. Vývoj delikátní chirurgické techniky byl podmíněn a šel paralelně s rozvojem anestezie a s revolučním vývojem diagnostické radiologie. Zdokonalení počítačové tomografie (HR ‑ CT), angiografie (CTA, DSA) a magnetické rezonance umožnilo dokonale zobrazit patologické procesy a následně se spolupodílelo na vývoji nových mikrochirurgických přístupů. Pro vývoj operační techniky v oblasti baze lební byla nezbytná syntéza technických dovedností z cévní neurochirurgie, onkochirurgie, otochirurgie, stomatochirurgie a spinální chirurgie kraniocervikálního přechodu. Velký vliv měl později i rozvoj intervenční neuroradiologie. Anatomické detaily nových přístupů bylo a stále je nutno studovat v disekčních anatomických laboratořích. Ani v současné době nemůže existovat centrum zabývající se problematikou baze lební bez experimentálního anatomického laboratorního zázemí.
Chirurgie baze lební se zabývá onemocněními, která postihují lebeční spodinu a mají vztah k tvrdé pleně mozkové na bázi mozku. Onemocnění může mít původ v intrakraniálních strukturách, v subkraniální extradurální oblasti nebo může být primárně postižena kost lebeční spodiny. Onemocnění v této oblasti jsou původu traumatického, cévního, neoplastického, zánětlivého nebo může jít o vrozené vývojové vady [2].
Léta chirurgických zkušeností opakovaně ukázala, že i techniky, jež se jeví dokonalé, potřebují neustálou interdisciplinární sebereflexi především z pohledu indikace. Neustálá mezioborová diskuze a dialog na konkrétní témata jsou zásadně důležité, pokud má pokrok a vývoj léčby pokračovat. Pokud nebudeme tomuto dialogu věnovat čas a pozornost, můžeme zaspat a selhat ve znalostech o výhodách jiných specializací, a minout tak možnosti pro dynamický růst medicíny a zdokonalení léčby našich nemocných [1].
Podobně jako všechny jiné subspecializace neurochirurgie, tak i chirurgie baze lební se v posledních letech významně vyvíjela. I přes mnoho alternativních modalit léčby (endovaskulární techniky, radiochirurgie apod.) jsou specifické techniky baze lební stále aktuální a užívané, především u komplexních lézí zasahujících k lebeční spodině. Hlavním úkolem pionýrů a zakladatelů této subspecializace je předávat a vyučovat tyto techniky mladé generaci neurochirurgů. Proto centra chirurgie baze lební na všech kontinentech pořádají excelentní praktické „hands ‑ on“ kurzy zaměřené na anatomii a chirurgii baze lební. Tyto komplexní a složité techniky vyžadují nejen hluboké a podrobné teoretické znalosti, ale též praktický trénink na anatomických preparátech, dříve než jsou rutinně aplikovány na operační sál. Pevné a široké znalosti anatomie umožňují neurochirurgovi nejen provádět náročné přístupy na bazi lební, ale i modifikovat standardní přístupy k dosažení optimální trajektorie a expozice daného individuálního případu [3].
Management léčby u pacientů s tumory baze lební se významně vyvinul během posledních dvou dekád. Velkého pokroku bylo dosaženo v chirurgické technice, zvláště pak v bezpečnější a radikálnější resekci nádorů a lepší funkční a estetické rekonstrukci po komplexních výkonech. Zatímco 80. léta byla spojena s extenzivním rozvojem oboru a publikací nových a nových agresivních přístupů, v posledních dvou desetiletích pozorujeme přísně selektivní indikaci těchto metod s maximálním důrazem na účelnost výkonu a kvalitu života nemocného. Pokrok je z velké části dán interdisciplinární spoluprací a vzájemným přesahem oborů.
Podobně podstatný a rychlý vývoj v radioterapii, například stereotaktická radiochirurgie, proton ‑ beam terapie, frakcionovaná stereotaktická radioterapie [4], stejně jako pokroky v chemoterapii a cílené biologické léčbě, významně obohatily nabídku léčebných možností těchto nádorů. Ačkoli jsou dnes k dispozici excelentní mikrochirurgické a endoskopické techniky a postupy, současný specialista chirurgie baze lební by měl mít dokonalý přehled o všech těchto alternativních metodách a měl by být schopen pacienta navigovat a doporučit mu individuální cestu v současném systému multidisciplinární medicíny.
Ve velmi blízké budoucnosti bude nezbytné hlubší porozumění unikátnímu biologickému chování nádorů, které vychází z molekulárních a genetických aberací různých typů nádorů. Ty pak již jsou nebo brzy budou zásadní jak pro zobrazení a diagnostiku, tak pro selektivní léčbu těchto nádorů [5].
Širokou oblast baze lební jsme systematicky rozdělili podle topograficko‑anatomických kritérií na přední, zadní, střední jámu a centrální oblasti baze. Práce navazuje ve stejném formátu kapitol na dříve publikovanou historii chirurgie baze lební [6]. V následujícím textu jsou shrnuty nejčastější patologie na bazi lební s důrazem na klinické příznaky a časnou diagnózu, neboť ta je pro efektivní neurochirurgickou léčbu nejdůležitější.
Přední baze lební (anterior skull base)
Vrozené malformace přední baze lební
Při pojednání o chirurgickém řešení vrozených malformací přední jámy lební rozlišujeme dvě hlavní skupiny:
- a) frontobazální dysrafické anomálie
- b) kraniofaciální synostózy a dysostózy
Defekty frontobazálních dysrafických anomálií jsou klasifikovány podle strany herniace (tab. 1) nebo podle obsahu vaku (tab. 2). Nejjednodušší rozštěpovou vadou je nazální fistula s dermální cystou, nejčastěji lokalizovaná na dorzu nosu. První případ dermální cysty popsal v již roce 1890 Bramann [7]. Fistuly mohou zasahovat z kůže do kraniálního kostního krytu, do tvrdé pleny skrze rozštěp krania nebo do intrakraniálního subarachnodálního prostoru. Sinus bývá nenápadný a maskovaný pigmentovou skvrnou, klinicky se většinou projeví až při fistulitidě nebo intrakraniálními komplikacemi, nejčastěji meningitidou nebo abscesem. Při nevysvětlitelné meningitidě bychom měli vždy na tyto anomálie myslet. V likvoru mohou být epiteliální buňky a v kultivaci bývá prokázán staphylococcus. V léčbě je třeba vždy preferovat časnou kompletní resekci anomálie s rekonstrukcí i u asymptomatických případů, abychom předešli intrakraniálním komplikacím.
1. Klasifikace frontobazálních dysrafických anomálií podle strany herniace. 
2. Klasifikace frontobazálních dysrafických anomálií podle obsahu vaku [117]. ![Klasifikace frontobazálních dysrafických anomálií podle obsahu vaku [117].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0a4adfebade1fee33ab1a621e4205062.png)
Encefalokély vznikají kongenitálně ve střední čáře často v místě junkce chondro ‑ a desmokrania s herniací plen nebo mozku z intrakraniální dutiny. Prevalence se udává od 1 případu na 2 500 až na 1 případ na 25 000 normálních porodů. Nejvážnějším stupněm herniace je encefalocystomeningokéla, v které jsou části mozku a mozkových komor doprovázeny velkou kolekcí mozkomíšního moku v prostoru meningeálních obalů. Nazo ‑ orbitální encefalokély způsobují vyklenutí vnitřního koutku a v diferenciální diagnóze je třeba odlišit traumatickou encefalokélu, mukokélu etmoidálního sinu a prostý aterom. Velká nazoorbitální encefalokéla může způsobit až slepotu tlakem na optický nerv. Sfeno‑orbitální enfefalokély jsou pro diagnózu ještě obtížnější. Projevují se pouze exoftalmem se sníženou pohyblivostí bulbu a je třeba diferenciálně diagnosticky uvažovat o neurinomu, hemangiomu a gliomu. Společným rysem encefalokél zasahujících do nazálního a nazofaryngeálního prostoru je zhoršené dýchání nosem; tyto kély jsou v klinické praxi snadno zaměněny za nosní polypy a nebo tonzilární hyperplazii. Nezřídka je diagnóza stanovena až po meningitidě, jež se vyvine po adenotomii. V nejistých případech odhalí až endoskopie hladké pulzující vyklenutí. Operační léčbě musí předcházet selektivní diagnostické vyšetření pomocí endoskopie, CT a MR (obr. 1).
1. Nazofaryngeální encefalokéla, typ transetmoidální v obraze. Obr. 1a) CT, obr. 1b) MR. 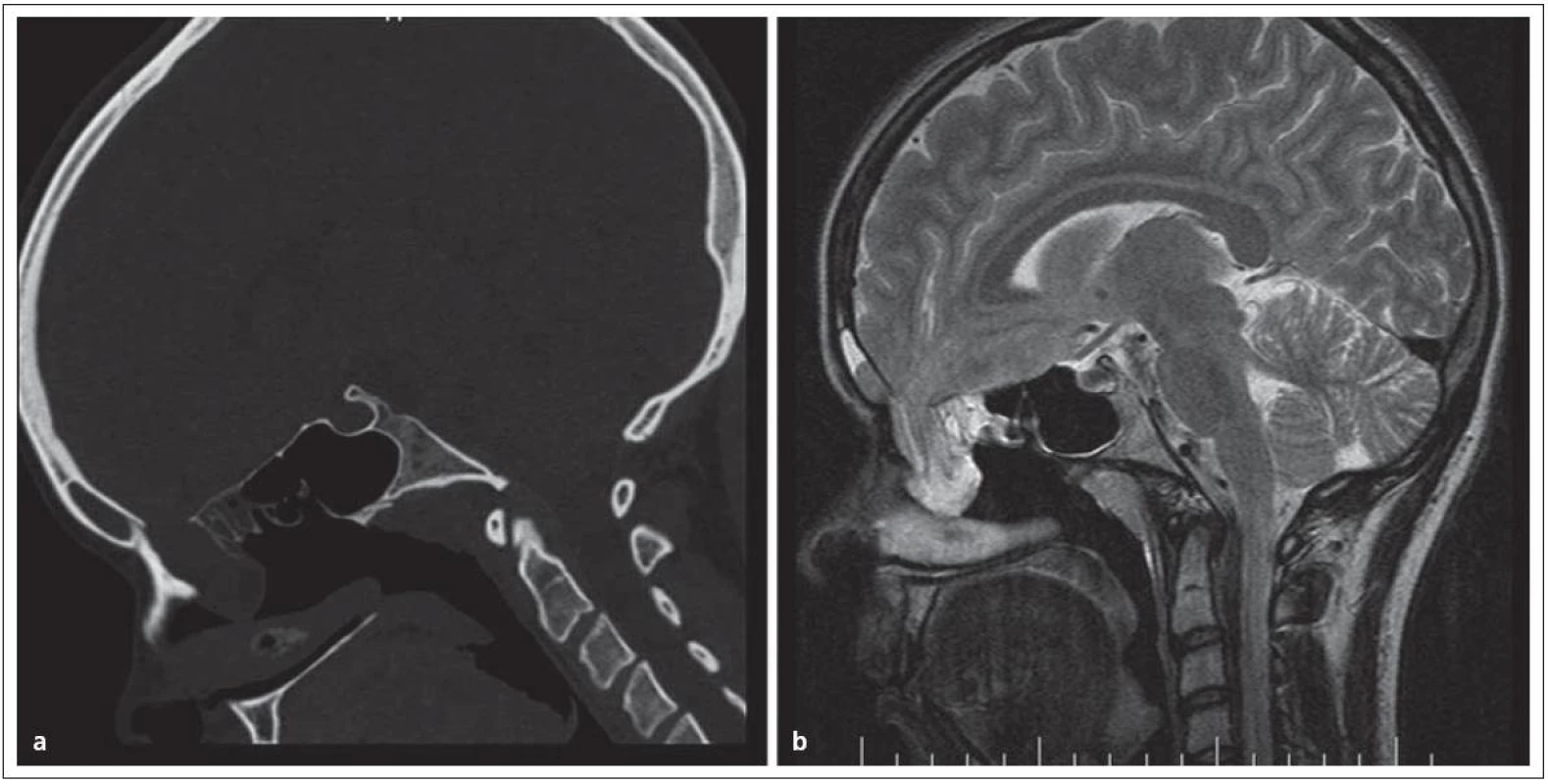
Principem chirurgické léčby nazálních fistulí je úplná resekce epitelem vystlané výchlipky. U fistule s cystou je třeba správně zrekonstruovat kořen nosu autologní chrupavkou z nosního septa, autograft by se poté měl překrýt štěpem fascie, aby dorzum nosu a kořen měly hladký povrch. Spolupráce s plastickým chirurgem je v těchto případech výhodou. U fistul zasahujících do subarachnoidálního prostoru je podstatou výkonu vodotěsná plastika tvrdé pleny a uzavření komunikace intrakraniálního prostoru.
U meningokél na dorzu nosu je kožní lalok elevován vzhůru, herniovaný vak izolujeme, resekujeme a plastiku dury provedeme skrze kostní defekt. U velkých encefalokél s extenzí do nazofaryngu je doporučován subfrontální intradurální přístup a plastika dury je jištěna perikraniálním lalokem.
U pacientů s kraniofaciálními synostózami a dysostózami jsou efektivní extenzivní osteotomie a skeletální korekce k obnově kraniofaciální morfologie a funkce. Přímo epochální pionýrskou práci na tomto poli odvedli Tessier a jeho spolupracovníci [8]. Tyto složité procedury vyžadují spolupráci zkušených a specializovaných plastických chirurgů, oftalmologů, neurochirurgů, maxilofaciálních chirurgů a ORL specialistů [9 – 14]. V našich podmínkách tyto komplexní výkony rozvinul v mezioborovém týmu Kozák [15 – 17]. Pro správnou indikaci a timing výkonu je nezbytná přesná antropometrie lebky a úzká spolupráce s pediatry.
Traumatické léze přední baze
Diagnostika a indikace k chirurgickému řešení frontobazálních poranění je příkladnou ukázkou interdisciplinární spolupráce. Je třeba hodnotit poranění obličejového skeletu, orbity, paranazálních dutin a intrakraniálních struktur.
Z pohledu neurochirurgického je nejvýznamnějším problémem nosní nebo nazofaryngeální likvorea. Pokud je likvorea klinicky prokázána, je nutné přesně lokalizovat místo kranionazální komunikace a operačně ji uzavřít. A to i v případě, že prokázaná likvorea spontánně ustane. Jizevnaté zhojení tvrdé pleny v oblasti baze, která je v kontaktu s nosní dutinou a paranazálními siny, nespolehlivě chrání intrakraniální prostor. Bakteriální flóra paranazálních dutin může způsobit vážné intrakraniální komplikace, jako meningitidu, absces, i po dlouhých letech, pokud nebyla komunikace správně ošetřena duroplastikou [18].
Aktivní pátrání po příznacích likvorey je u frontobazálních úrazů zásadní. Je třeba věnovat pozornost vlhkým vzlínajícím skvrnám kolem krve na polštáři nebo obvazu, tzv. halo sign. Pro laboratorní detekci likvoru v sekretech z nosu nebo z úst je dnes nejspolehlivější vyšetření hladiny beta‑trace proteinu nebo beta‑2 transferinu [19].
Přesná lokalizace likvorey určí cílený operační výkon k uzavření defektu. Nejčastějším místem likvorey je v místě pevné adherence dury ke kosti přední báze v oblasti etmoidů, druhou nejčastější příčinou je fraktura zadní stěny frontálního sinu, relativně vzácná je likvorea ze zlomeniny sfenoidálního sinu. U extenzivních kominutivních fraktur přední jámy bývá místem komunikace současně frontální sinus, etmoidy a sfenoidální sinus. Mozkomíšní mok může též pronikat skrze otvory v duře po avulzi olfaktoriálních nervových vláken, zvláště „contre coup“ mechanizmem u poranění v okcipitální krajině. Musíme zvažovat též paradoxní likvoreu přes Eustachovu trubici u zlomenin petrózní kosti. Pro grafickou diagnostiku likvorey je nejspolehlivější CT vyšetření. Již pneumocefalus je patognomonický pro durální defekt i při absenci manifestní rinorey. Pro přesnou lokalizaci defektu provádíme tenké řezy CT v koronární a sagitální rovině, v případě pochybností CT cisternografii s intratékálním kontrastem v Trendelenburgově poloze nebo MR cisternografii [20].
Timing operační léčby závisí na celkovém stavu pacienta a na typu poranění. Pouze život ohrožující krvácení je indikací pro emergentní výkon bez speciálního vyšetření. V ostatních případech je rychlé a důkladné vyšetření základem pro adekvátní plán chirurgického výkonu v interdisciplinárním týmu. Pokud je to možné, preferujeme akutní ošetření, abychom předešli otoku měkkých tkání, negativnímu psychologickému vlivu u disfigurací obličeje a fixaci fragmentů především u dětí.
Pro systematickou diskuzi o chirurgickém přístupu a technice je vhodné rozdělit přední jámu lební na mediální oblast, tzv. rinobáze související s nosní dutinou a paranazálními siny, a laterální oblast, jež zahrnuje strop orbity a malé křídlo kosti klínové. Volba přístupu pro uzavření frontobazálního durálního defektu (endoskopického či mikrochirurgického) musí splňovat následující kritéria:
- poskytnout širokou expozici durálního defektu,
- být minimálně chirurgicky invazivní,
- zachovat olfaktorický nerv.
Ohraničené kostní a durální defekty v oblasti sousedící s etmoidálními siny lze ošetřit endoskopicky rinochirurgickým přístupem. Tato technika je zvláště výhodná pro ošetření likvorey skrze sfenoidální sinus. Naopak mikroneurochirurgický subfrontální intradurální přístup je preferován ve dvou případech:
- U kominutivních poranění celé přední baze s lacerací tvrdé pleny a s prolapsem mozkové tkáně do dutin a postižením zadních oblastí přední jámy (křídlo kosti klínové, planum sphenoidale, optický kanál). Výhodná je kooperace se stomatochirurgem při rekonstrukci obličejového skeletu u kraniofaciálních poranění v jedné době „early single stage repair“. Otok mozku na rozdíl od měkkých tkání nastupuje řádově v hodinách a při časné diagnóze lze realizovat akutní mikrochirurgický přístup k poraněné bazi.
- U frontobazálních poranění s likvoreou se současnou intrakraniální expanzí a hrozící tentoriální herniací. Zde je nezbytná urgentní dekomprese intrakraniálního prostoru a poté navazuje uzavření defektu tvrdé pleny. Naopak menší inracerebrální hematomy, kontuze a rozvinutý edém frontálních laloků je zřídkakdy indikací k akutní neurochirurgické intervenci. Kontrola regrese ložisek na CT mozku umožní neurochirurgovi odloženou plastiku tvrdé pleny s daleko nižším rizikem a s menší trakcí za frontální laloky.
Traumatická optická neuropatie – mechanizmus poškození optického nervu zahrnuje avulzi, hematom nervové pochvy, kompresi nervu zlomeninou v apexu orbity, penetrující cizí těleso. Nejčastěji však jde o kontuzi nervu v optickém kanálu přenosem působících sil skrze kosti a meningy. Následně jsou axony a mikrovaskulární struktury postiženy ischemií a edémem.
Méně často se může optická neuropatie vyvinout sekundárně několik dní až měsíců po úrazu s postupnou deteriorací zraku. Patofyziologicky je nutno uvažovat o kompresi nervu traumatickým aneuryzmatem karotidy, arachnoiditidou, jizvou nebo hypertrofickým kalem při hojení fraktury v blízkosti optického kanálu. Interval mezi okamžikem úrazu a zhoršováním vizu dokazuje kontinuitu nervu a dává největší šanci na zlepšení zraku po chirurgické dekompresi [21].
Základem diagnózy je podrobná anamnéza a důkladné vyšetření vizu a perimetru, pokud je možné. Velmi komplikovaná je situace u pacientů v bezvědomí. V grafickém vyšetření dominuje HR-CT. Lubben provádí časnou dekompresi při CT nálezu v oblasti optického kanálu a apexu orbity a dosáhl zlepšení u 57,7 % pacientů v komatu a u 61,5 % nemocných při vědomí [22]. U primární neuropatie existují v současné době tři možnosti terapie: observace, aplikace kortikoidů a chirurgická dekomprese optického nervu. Podle jiných studií nebyl nalezen signifikantní rozdíl mezi těmito modalitami a je doporučen individuální postup [23,24].
Zánětlivé komplikace oblasti přední baze
Zánětlivé komplikace přední jámy lební vznikají z infekce paranazálních dutin nebo se mohou vyvinout sekundárně po úrazu. Mezi možné intrakraniální komplikace sinusitidy patří epidurální absces, meningoencefalitis, empyém, mozkový absces a trombóza splavu. Tyto komplikace vznikají přímým šířením z dutin, hematogenním rozsevem nebo osteomyelitidou frontální kosti.
Mukokéla a pyokéla – může vzniknout ve všech paranazálních dutinách, nejčastější je však ve frontálním sinu. Podmínkou vzniku je zánětlivý proces, jizvení nebo trauma a obstrukce přirozeného ostia a drenáže dutiny. Dochází k retenci mukózního sekretu a k erozi okolních struktur kosti tlakovou atrofií. Mukokéla může růst ve směru k orbitě, utlačovat bulbus a způsobovat okohybnou poruchu, může atakovat tvrdou plenu a přilehlý mozek. Vak mukokély působí v nosní dutině obstrukci dýchacích cest. Ve sfenoidálním sinu hrozí náhlá slepota při kompresi zrakového nervu [25]. Extrémně rozsáhlá mukokéla sfenoidálního sinu může imitovat selární expanzi.
Léčba mukokély je chirurgická. U menších kél je otevřen paranazální sinus a vak odstraněn in toto, důležité je zajištění adekvátní drenáže dutiny. U rozsáhlých mukokél, nejčastěji ve sfenoidálním sinu, není možná invazivní radikální resekce. Preferuje se proto transnazální přístup a resekce části vaku s širokou drenáži do nosní dutiny.
Nádory přední baze
Nádory vyrůstající z anatomických struktur této oblasti, ať benigní či maligní, mohou erodovat skrze spodinu přední jámy, a tím vytvářejí specifickou entitu. Uvádíme přehled nejčastějších patologií tohoto regionu.
Meningeomy přední jámy lební
Představují kolem 40 % všech intrakraniálních meningeomů [26]. Vyrůstají z tvrdé pleny sulcus olfactorius, planum shenoidale, processus clinoideus anterior, diaphragma sellae, stropu orbity a z tuberculum sellae. Nejčastější jsou olfaktoriální a tuberculum sellae meningeomy. Maligní meningeomy tvoří 1 – 7 % ze všech meningeomů, dalších 5 % je atypických [27]. Existuje devět subtypů meningeomů s nízkým rizikem recidivy (WHO grade I), atypické a chordoidní jsou klasifikovány jako WHO grade II,rhabdoidní, papilární a anaplasický jako maligní grade III se signifikantně vyšší pravděpodobností agresivního chování a recidivy. Benigní meningeomy jsou častější u žen, avšak maligní formy jsou frekventnější u mužů.
Nejčastějšími přístupy k meningeomům přední baze jsou varianty subfrontálního přístupu nebo standardního pterionálního přístupu. Na základě literární a vlastní zkušenosti preferujeme unilaterální pterionální ‑ transsylvijský přístup podle Yasargila [28]. I pro gigantické nádory je unilaterální přístup více než dostačující. Velké tumory produkují „large birth canals“ [28]. Pterionální kraniotomie poskytuje přístup bez retrakce frontálních laloků, přehled o Willisově okruhu, chiazmatu, karotidách a stopce hypofýzy. Dále umožňuje časné vypuštění likvoru z cisteren a tím příznivou relaxaci mozku, chrání čichové nervy a venózní drenáž frontálních laloků. Vyhýbá se pracnému ošetření frontálních sinů. Poloha chiazmatu a karotidy jsou základní orientační anatomické struktury pro resekci. Následuje důležitá taktika koagulace a kontrola hlavních vyživujících arterií z bazální tvrdé pleny z povodí a. ethmoidales. Za dočasného krvácení je nutno rychle proniknout skrze nádor k jeho bázi a monopolární koagulací zatavit a odpojit arteriální zásobení nádoru. Následně se tumor zmenší a konzistencí a bezkrevností se podobá lipomu [28]. Tato taktika pak učiní enukleaci a disekci nádoru od okolních struktur daleko snadnější. Yasargilův žák Fukushima tuto taktiku shrnuje pojmem „4D – Devascularization, Deattachment, Debulking, Dissection“ [29]. Samii srovnal oba základní přístupy u olfaktoriálních meningeomů. Mortalita 4,9 % se vyskytla pouze u bilaterálního subfrontálního přístupu, a proto preferuje pterionální (frontolaterální) kraniotomii [30].
Různými autory byly navrženy modifikace subfrontálních přístupů s orbitofrontoetmoidální osteotomií s cílem zlepšit přehled a minimalizovat retrakci čelních laloků [31]. Jho jako první popsal endoskopický endonazální a endoskopický glabelární přístup k nádorům přední baze [32,33]. Endoskopické výkony mají evidentní výhody v jiných oblastech baze, v přední jámě lební jsou však zatíženy zbytečně vysokým rizikem rinorey. Pro rekonstrukci přední jámy je nutno použít rozsáhlý nazoseptální lalok a hojení nosní dutiny je poté spojeno až s 3 – 6měsíčními potížemi charakteru páchnoucího výtoku z nosu, tvorbou krust, ztráty čichu apod. [34]. V případech extenze nádoru do zadních částí přední jámy a do tureckého sedla je daleko miniinvazivnějším postupem pohled endoskopem ke konci resekce kraniotomickým otvorem (nikoli endonazálně) a případné dobrání nádoru pomocí kyret (endoscopy assisted microsurgical approach) [35].
Esthesioneuroblastom
Vzácný olfaktoriální neuroblastom vyrůstá z čichového neuroepitelu a tvoří pouze 3 % intranazálních nádorů. Přesto je na tento nádor třeba myslet, neboť je velmi agresivní a prognóza přežití je dána především časností diagnózy. Projevuje se nazální obstrukcí, krvácením a poruchou čichu. Může invadovat do baze, do paranazálních dutin, do orbit a intrakraniálně. V 17 – 48 % případů metastazuje do krčních uzlin, vzdálené metastázy do plic a kostí jsou méně časté. Vyskytuje se hlavně ve 2. a 5. dekádě života. Staging podle Kadishe se v praxi užívá nejčastěji (tab. 3). Léčba je multimodální, resekce nádoru je kombinována s radioterapií a chemoterapií [36]. U histologického grade III je pětileté přežití 50 %. Recidivy se objevují v rozsahu 1 – 19 let, důležité je pečlivé MR sledování a reoperace recidiv jsou plně indikované.
3. Esthesioneuroblastom, Kadish Staging [118]. ![Esthesioneuroblastom, Kadish Staging [118].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c49b041037c2c2370b7b1e9c6015278a.png)
Juvenilní angiofibrom
Jedná se o benigní a vysoce vaskularizovaný nádor. Vyskytuje se u mladých mužů ve věku 14 – 25 let. Klasickým klinickým příznakem je nazální obstrukce a epistaxe. Nádor postihuje nazální dutinu, etmoidy, maxilární sinus a může invadovat do fossa pterygopalatina [37]. Pro diagnózu je důležité zobrazení CT, MR (často patrný tokový artefakt, flow voids fenomén) a DSA se selektivním nástřikem ACI a ACE. V léčbě se využívá selektivní předoperační embolizace, chirurgická resekce a radioterapie [38].
Nádory paranazálních dutin
Adenoidní cystický karcinom a nazofaryngeální karcinom (nádor ze skvamózních buněk) představují 2 – 3 % karcinomů hlavy a krku. Ve většině zemí je poměrně vzácný a s vysokým věkem vázaná incidence je méně než 1 nemocný na 100 000 obyvatel za rok [39]. V endemických oblastech, jako například v jižní Číně, je incidence až 15 – 50/ 100 000 za rok. Virus Epstein‑Barrové je zvažován v patogenezi nazofaryngeálního karcinomu, též vliv životního prostřední je vypozorován v epidemiologii těchto nádorů. V evropských studiích je 39 % sinonazálních karcinomů spojeno s povoláním: rafinace niklu zvýšila incidenci stokrát, angličtí výrobci nábytku měli výskyt tisíckrát vyšší, vliv měl izopropylový olej v obuvnictví a radium při barvení ciferníků hodin. V Japonsku je incidence čtyřikrát vyšší než v USA vinou častější chronické sinusitidy a kouření, vysoký výskyt byl na územích Bantustanu při častém užívání domácího šňupacího tabáku. Pro diagnózu má krom CT, MR a endoskopie zásadní význam biopsie. V léčbě se využívá kombinovaná resekce s následnou radioterapií. U rozsáhlých expanzí lze nádor redukovat indukční chemoterapií a radioterapií [40]. Pětileté přežití je udáváno u 47 – 70 % nemocných, desetileté u 41 – 48 % pacientů. Vysoké dávky proton ‑ beam terapie a gamma knife radiochirurgie byly testovány u adenoidně cystického karcinomu [41,42].
Standardem chirurgické léčby pro maligní nádory přední baze jsou již od publikace Ketchama kraniofaciální přístupy [43]. Podle mezinárodní kooperativní studie kraniofaciální chirurgie pro maligní nádory z roku 2003 jde o bezpečnou a efektivní metodu. Mortalita byla 4 % a pooperační komplikace byly uvedeny ve 33 % [44]. Pro menší nádory a pro ty, které nezahrnují karotidu, někteří autoři preferují endoskopický přístup nebo přístup kombinovaný [45].
Rozsáhlé resekce maligních nádorů přední baze vytváří přímou komunikaci mezi intrakraniálním prostorem a paranazálními dutinami. Adekvátní rekonstrukce je naprosto zásadní pro vytvoření bariéry mezi těmito kompartmenty a nezbytná pro prevenci vzniku likvorové píštěle a infekčních komplikací. Laloky pro rekonstrukci přední baze lební lze klasifikovat na tři stupně:
- lokální laloky, nejčastěji užívaný perikraniální ‑ galeální lalok nebo mediální transpozice temporálního svalu k rekonstrukci anterolaterálních defektů či rekonstrukci orbity po exenteraci [46];
- stopkaté regionální myokutánní laloky, m. pectoralis major je vhodný pro extenzivní defekty přední jámy, lalok m. trapezius je vhodný spíše pro laterální defekty zadní baze [47];
- volné laloky jsou mnohými považované za nejspolehlivější pro rozsáhlé defekty. Lalok m. rectus abdominis je nejvíce užíván, má příznivý tvar pro vyplnění mrtvých prostor po resekci [46]. Z dalších variant lze využít lalok radiálního předloktí nebo m. latissimus dorzi podle individuálního charakteru defektu a donora s ohledem na cévní anastomózy [48].
Zadní baze lební (posterior skull base)
Vrozené anomálie, zánětlivé afekce a traumatické léze jsou na bazi lební v zadní jámě poměrně vzácné.
Nádory zadní baze
Nádory mostomozečkového koutu (MMK)
Mohou vyrůstat z hlavových nervů, tvrdé pleny, mozkové tkáně a ze struktur temporální kosti. Diferenciální diagnózu expanzí a jejich četnost výskytu uvádí tab. 4. Vestibulární schwannom (neurinom akustiku) je daleko nejčastějším nádorem MMK a představuje 75 % všech patologických lézí v této lokalizaci a 6 % všech intrakraniálních nádorů. Meningeomy jsou druhé nejčastější expanze mostomozečkového koutu. Místo durálního origa, odkud nádor vyrůstá, je v okolí meatus acusticus internus ve všech směrech (nejčastěji před meatem), dále na tentoriu, klivu a ve foramen jugulare. Místo origa určuje směr růstu meningeomu a současně směr odtlačení faciálního a vestibulokochleárního nervu. Epidermoid a schwannomy ostatních hlavových nervů (VII, XII) jsou třetí a čtvrté nejčastější nádory koutu. Metastázy představují pouze 1 % expanzí v této oblasti. Do mostomozečkového úhlu se též propagují nádory IV. komory jako ependymomy a papilomy choriodálního plexu. V malém procentu se vyskytují chordomy, lipomy a paragangliomy. Netumorózní expanze, jako arachnoidální cysty a vertebrobazilární dolichoektázie, představují 2 – 4 %.
4. Specifické nádory a expanze mostomozečkového koutu a jejich četnost v této lokalizaci. 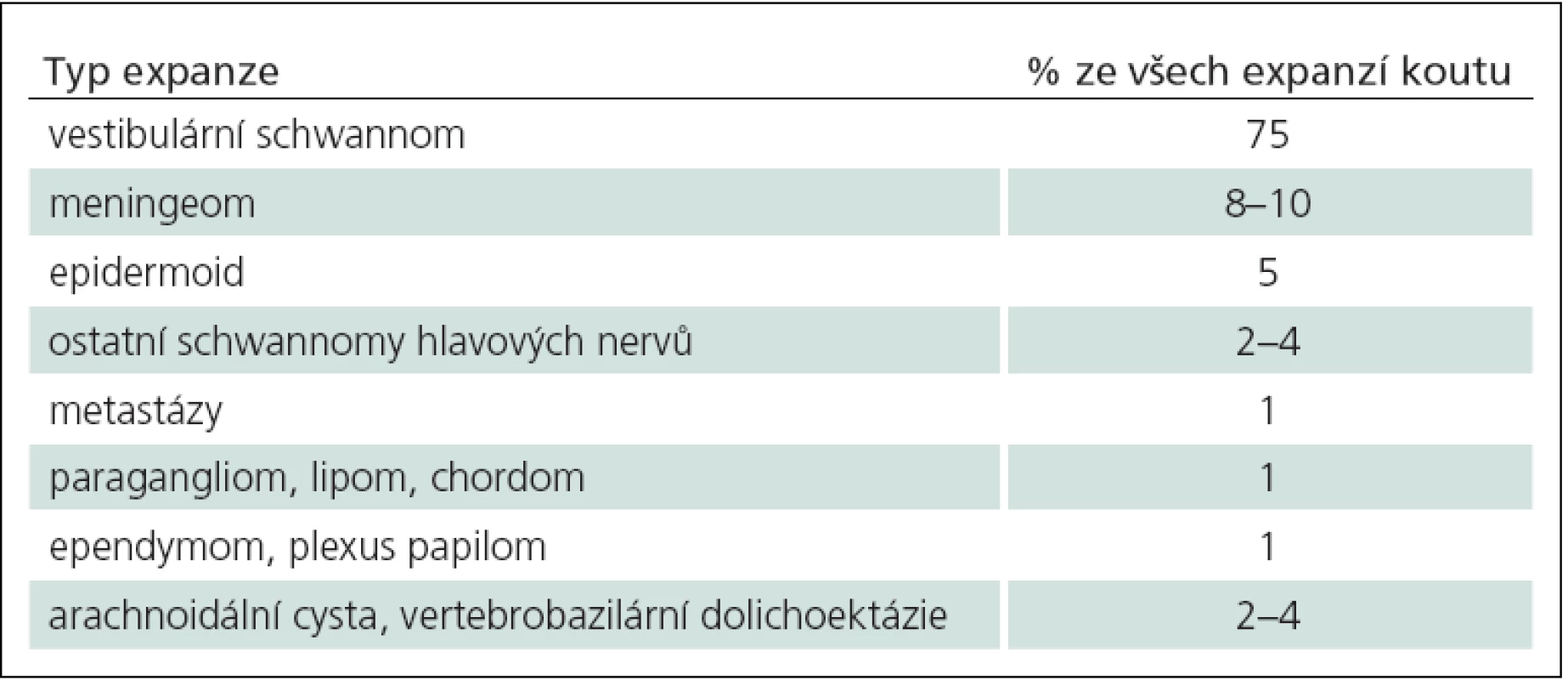
Klinické symptomy jsou úzce spojeny s velikostí nádoru. U malých schwannomů v meatu a v cisterně jsou nejčastějšími příznaky tinnitus, poruchy sluchu a závratě, u velkých nádorů mozečkové příznaky, kmenová symptomatologie a hydrocefalus. Pacienti s epidermoidem trpí často neuralgií trigeminu nebo hemifaciálním spazmem. Funkce faciálního nervu by měla být posuzována podle stupnice House ‑ Brackmanna (tab. 5).
5. Klasifikace funkce faciálního nervu [119]. ![Klasifikace funkce faciálního nervu [119].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5ba45a774d08fbcb03e34d0e0a8b0699.png)
Evokované sluchové potenciály a PTA (Pure Tone Audiogram) jsou prvními skríningovými testy při podezření na vestibulární schwannom. Ztráta suchu ve vysokých frekvencích je typickou abnormitou PTA, současně však tento typ křivky je častý u stařecké hluchoty a po expozici hlukem. Diference PTA více než 10 – 15 dB při porovnání jednoho ucha k druhému je důvodem k podrobnějšímu vyšetření. Třetí důležitou metodou pro klinické vyšetření sluchu je SDS (Speech Discrimination Score). Pokud je SDS více než 50 % slov a PTA ≤ 50 dB, pak je reálné indikovat resekci nádoru se snahou a zaměřením na zachování sluchu.
V diagnostickém zobrazení má CT význam v detekci kalcifikací u meningeomů, erozi temporální kosti u cholesteatomu (epidermoid) a rozšíření meatu u vestibulárního schwannomu. HRCT (High Resolution CT) je nezastupitelné pro navigaci a přesné zobrazení anatomie temporální kosti, především velikost a lokalizace sklípků kolem meatu, individuální anatomie a vztah meatu, hlemýždě a vestibula se semicirkulárními kanálky. HRCT je nezbytné pro odhalení vysoké polohy jugulárního bulbu [49,50]. Magnetická rezonance je v současné době metodou volby. U vestibulárních schwannomů zaujme typický nálevkovitý tvar meatu, sycení nádoru po intravenózním podání gadolinia, MR umožnuje analyzovat vztah nádoru k vaskulárním strukturám ve třech rovinách. V moderním zobrazení DTI (Diffusion Tensor Imaging) je možno u velkých schwannomů predikovat polohu faciálního nervu (obr. 2) [51 – 53]. Nejčastější lokalizací intrakraniálních epidermoidů je právě mostomozečkovýkout. Epidermoid je izointenzní k mozkomíšnímu moku v T1WI i T2WI, avšak vykazuje významnou restrikci difuze a hyperintenzní signál ve srovnání k moku v difuzně váženém obrazu DWI (obr. 3) [54].
2. Vestibulární schwannom vlevo s dorzální polohou faciálního nervu v DTI zobrazení. 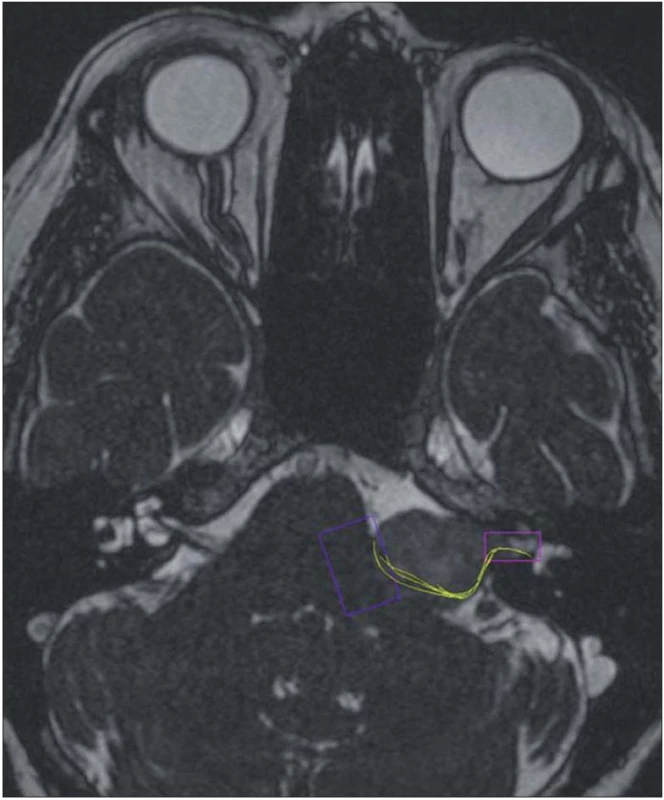
Obr. 3a) Epidermoid v mostomozečkovém koutu vlevo v T1WI. Obr. 3b) Typická restrikce difuze a hyperintenzní signál ve srovnání k moku v DWI. 
Předoperační příprava má obecně, a tím spíše u nádorů v mostomozečkovém koutu, zásadní postavení. Zahrnuje zhodnocení celkového stavu pacienta, jež má určující vliv na indikaci příslušné procedury. Dále obsahuje klinická vyšetření, SDS a PTA k zhodnocení sluchu a podrobnou analýzu zobrazovacích metod s užitím všech dostupných modalit (HRCT, MR, MRA, DTI, CISS – Constructive Interference Into Steady State). V obecné rovině je nezbytná úvaha o přínosnosti intervenční neuroradiologie (embolizace zásobujících cév, okluzní testy). Následuje plánování vlastního přístupu a trajektorie k nádoru. V této fázi nabíráme data pro navigaci, většinou fúzujeme obraz CT a MR. Podle extenze nádoru a podle stavu sluchu rozhodujeme o tom, které hlavové nervy budeme monitorovat a mapovat [55] a zda je třeba monitoringu MEP při očekávané manipulaci v okolí mozkového kmene. V této fázi přípravy by měl být vyčleněn čas na koncentraci a trénink v anatomické laboratoři.
Vlastní operační taktika vyžaduje přesnou a promyšlenou polohu pacienta a polohu hlavy, uvažujeme o tom, jak využít gravitace k samovolnému odpadávání mozku a k minimalizaci retrakce za mozkovou tkáň. Rozsah kraniotomie musí splňovat principy chirurgie baze lební, kdy každý milimetr kosti rozhoduje při optimalizaci trajektorie [56]. Síla a doba působení mozkového retraktoru zásadně ovlivňuje pooperační edém. Jsme dlouhodobými zastánci filozofie omezení retrakce mozku, avšak citlivé přidržování mozku lopatkou ve vypreparované pozici – „brain holding“, je daleko méně invazivní než opakovaná traumatizce mozku mikroodsávačkou křečovitých a fundamentálních zastánců bezretrakční techniky.
Léčebná paradigmata pro pacienty s vestibulárním schwannomem byla opakovaně publikována jak z pohledu observace, mikrochirurgie i gama nože [57,58].
U pacientů s malým neurinomem (≤ 2,5 cm) se zachovalým sluchem (PTA ≤ 50 dB, SDS > 50 %) lze nabídnout observaci, mikrochirurgii (obr. 4, 5) nebo gama nůž. Observace je modalitou léčby, avšak není bez rizika ztráty sluchu. V práci Godefroye v 3,5letém sledování 36 % nádorů vykázalo růst a 43 % pacientů ztratilo sluch (!!) [59]. Observace vyžaduje každoroční vyšetření klinické, MR a audiometrickou kontrolu, a tudíž i zodpovědnou spolupráci pacienta. Stejně tak by observace neměla být substitucí „obávané chirurgie“ a příliš dlouhé sledování nezlepšuje chirurgické výsledky (nejlepší výsledky u sluch zachovávající chirurgie jsou pouze u nádorů do velikosti 20 – 25 mm). Srovnání výsledků mikrochirurgie a gama nože z hlediska zachování sluchu uvádějí tab. 6a, 6b a 7. Po ozážení gama nožem dochází u 17 – 74 % případů k tzv. pseudoprogresi velikosti nádoru. To vrcholí mezi 6. a 9. měsícem a stabilizuje se do 24 měsíců. Pro klinickou praxi má tento relativně nově popsaný fenomém dva dopady: větší opatrnost v indikaci gama nože u pacientů se zhoršeným sluchem (dočasné zvětšení nádoru může způsobit definitivní hluchotu), na druhou stranu selhání léčby gama nožem lze hodnotit až po 24 měsících [60].
Obr. 4. Vestibulární schwannom vlevo st. II. Obr. 4a) Předoperační MR a nádor v obraze operačního mikroskopu. Obr. 4b) MR obraz radikální resekce a pohled mikroskopem do volného meatu ze zachovalými nervy VII a VIII a funkcí obou nervů. 
Obr. 5. Vestibulární schwannom vpravo. Obr. 5a) MR před operací a audiogram před výkonem. Obr. 5b) MR po operaci bez rezidua nádoru a zachování užitečného sluchu, audiogram po operaci nezměněn. 
Tab. 6a) Zachování sluchu po mikrochirurgické operaci (retrosigmoideální přístup). 
Tab. 6b) Klasifikace velikosti vestibulárních schwannomů dle Koose [115]. ![Tab. 6b) Klasifikace velikosti vestibulárních schwannomů dle Koose [115].](https://pl-master.mdcdn.cz/media/image/0cfb45c16ab19d122be16481ca93382d.png?version=1537791891)
6. Zachování sluchu po ozáření gama nožem. 
U pacientů s malým nádorem (≤ 2,5 cm) s neužitečným sluchem nebo s nepříznivými parametry pro zachování sluchu (PTA > 50 dB, SDS ≤ 50 %) jsou k dispozici opět všechny tři modality léčby, zde však observace již nenese riziko ztráty sluchu a růst nádoru lze kontrolovat. Benjamin zaznamenal v metaanalýze studií (5 568 pacientů) růst u 29 – 54 % nemocných s průměrnou hodnotou 1 – 3 mm za rok [61]. U pacientů s velkým nádorem (> 2,5 cm) zůstavají pro léčbu pouze observace nebo mikrochirurgie (obr. 6). Volba závisí na neurologických příznacích nemocného a stabilitě nádoru při MR sledování.
3. Cystický vestibulární schwannom st. IV. Obr. 6a) MR před operací. Obr. 6b) Úplné odstranění nádoru se zachováním lícního nervu. 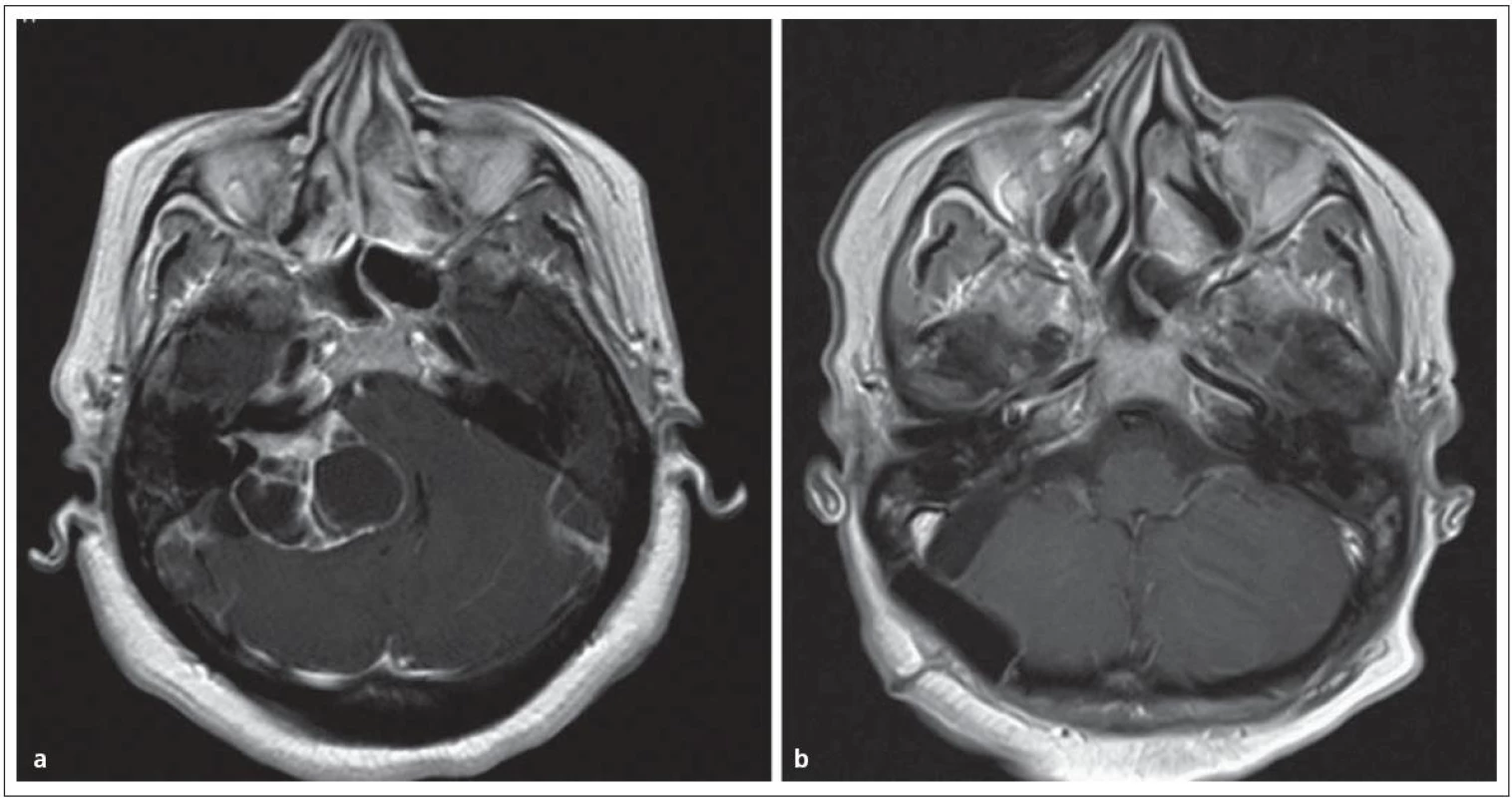
K tumorům v mostomozečkovém úhlu lze přistoupit subokcipitálním retrosigmoideálním přístupem [62], translabyrintálně [63] nebo skrze střední jámu. První přístup je nejužívanější, translabyrintální přístup má nevýhodu obětování sluchu při pracném odvrtávání labyrintu [64]. Přístup skrze střední jámu využívá poměrně málo autorů a pouze u malých intrakanalikulárních nádorů.
Cílem mikrochirurgické resekce a strategií výkonu by měla být radikální resekce (100 %) nebo near total resekce (99 – 95 % nádoru odstraněno) s ponecháním drobného filmu na nervu v případě vzestupu EMG stimulačního prahu faciálního nervu při resekci posledních adherujících částí pouzdra neurinomu. Pro tyto výkony je četnost recidiv 3,8 % pro radikální a 9,4 % pro near total resekci při pětiletém sledování. Při pouze subtotální resekci (méně než 95 % nádoru odstraněno) byla zaznamenána recidiva v 27,6 % za 5 let [65]. Strategie subtotální či pouze subkapsulární resekce s dozářením rezidua gama nožem je považována za inadekvátní léčbu a recidivy po ozáření gama nožem je velmi obtížné léčit (obr. 7).
Obr. 7a) Subtotální resekce vestibulárního schwannomu. Obr. 7b) Dva roky po operaci progrese rezidua a indikace LGK. Obr. 7c) Progrese nádoru dva roky po LGK, nutnost reoperace. 
Zachování funkce faciálního nervu u malých nádorů by mělo být standardem, u velkých schwannomů se v současných sestavách pohybuje kolem 80 % [66]. Přesto vlivem manipulace s nervem zpravidla pacienti trpí 2 – 3 měsíce dočasnou periferní parézou lícního nervu. V tomto období reparace funkce je třeba věnovat pozornost ošetřování rohovky ve dne i v noci a předejít korneálním ulceracím. Pokud nedojde ve vzácných případech k regeneraci funkce lícního nervu, lze nemocnému nabídnout hypogloso ‑ faciální anastomózu, závěs koutku temporálním svalem a okuloplastickou korekci s implantací závaží do horního víčka (obr. 8).
Obr. 8a) Lagoftalmus při paréze lícního nervu. Obr. 8b) Kosmetický řez a připravené titanové závaží. Obr. 8c) Elegantní řešení po implantaci titanového závaží do víčka. 
Nádory foramen jugulare
Nejčastějšími nádory foramen jugulare jsou tumory glomus jugulare, schwannomy a meningeomy. Správná předoperační diagnóza a dokonalá znalost rozdílů v zobrazení MR a CT jsou zásadní pro další specifickou terapii (tab. 8). Neurochirurg a neuroradiolog musí být schopen rozpoznat i anatomické variety, především vysokou polohu jugulárního bulbu a turbulentní proud, a nezaměnit je s nádorem ve foramen jugulare.
7. Charakteristiky v zobrazení nádorů foramen jugulare. 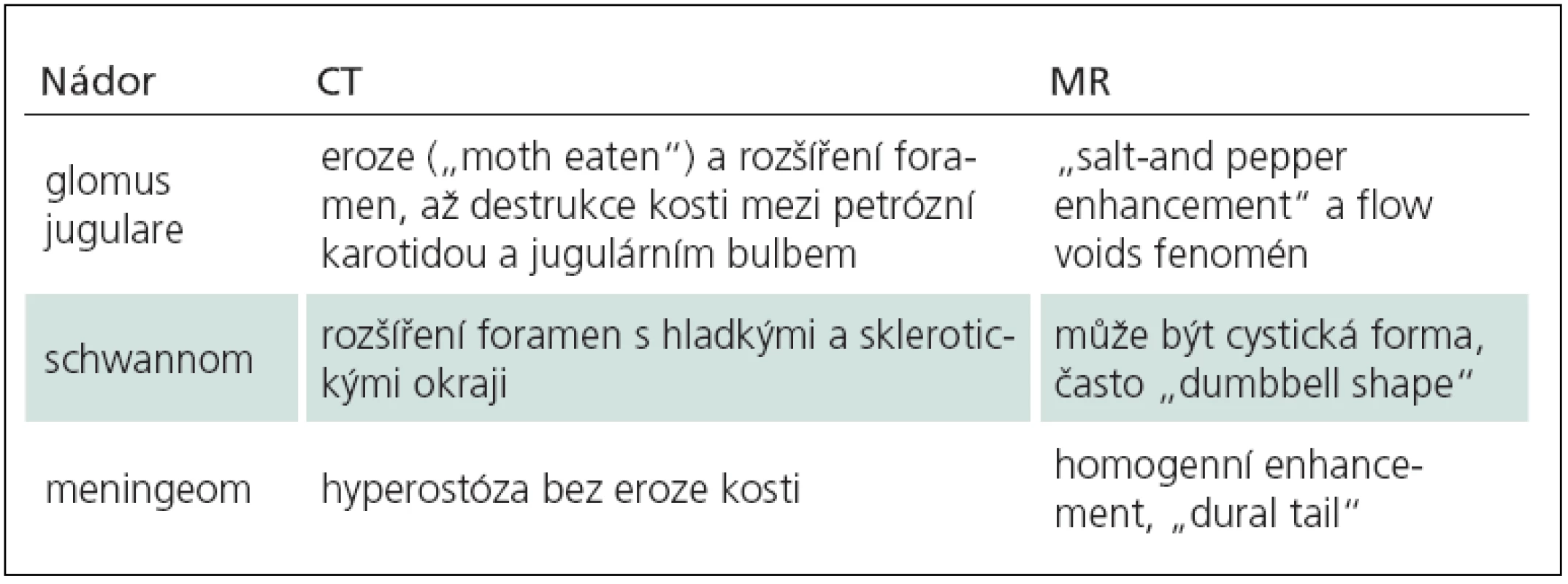
Tumor glomus jugulare vyrůstá z glomových tělísek v jugulárním bulbu a představuje pouze 0,6 % všech nádorů hlavy a krku. Je to však druhý nejčastější tumor temporální kosti. Vrchol incidence je v 5. dekádě života a nádor se vyskytuje 3 – 6krát častěji u ženského pohlaví. Familiární formy jsou zaznamenány u 20 % tumorů a u těchto pacientů je vícečetný výskyt glomových nádorů až v 78 % případů (většinou nádory karotického glomu), zatímco u sporadických forem pouze u 10 % [67]. Tumory glomus jugulare jsou až na výjimky benigní pomalu rostoucí paragangliomy. V praxi se používají klasifikace podle Fische [68] a dle Jacksona [69]. Podstatou gradingu je velikost expanze a přítomnost extenze do intrakranálního prostoru. Glomus jugulare tumory jsou vzácné, ale představují významnou kapitolu chirurgie baze lební, neboť operace těchto nádorů patří mezi nejnáročnější výkony v oboru.
Příznaky zahrnují pulzatilní tinnitus, poruchu sluchu a parézy postranního smíšeného systému (nejčastěji chrapot, asymetrii patrových oblouků) a deviaci jazyka. Nádory produkující katecholaminy se projevují palpitacemi, excesivním pocením a bolestí hlavy.
V zobrazení CT je typická eroze a zvětšení foramen jugulare s nepravidelnými okraji (jako „prožrané od molů“, „moth eating“), na MR po podání gadolinia připomíná sycení „sůl a pepř“ (salt and pepper enhancement). Nádor glomu je extrémně vaskularizovaný, na DSA se zobrazuje typický hypervaskulární „blush“ s časnou až zkratovou drenáži do žilního systému. Tento nádor je zásoben z povodí a. carotis externa, převážně z a. pharyngica ascendes. Angiografická studie je zásadní pro předoperační embolizaci, bez této procedury nelze tyto hypervaskularizované nádory bezpečně resekovat.
V předoperační přípravě je důležité audiologické vyšetření a skríningové stanovení hladiny katecholaminů. U nádorů produkujících vazoaktivní neuropeptidy je důležitá příprava alfa ‑ a betablokátory [70]. U pacientů s hormonálně aktivním glomus tumorem se mohou vyskytovat i jiné neuroendokrinní nádory (pheochromocytom), proto je i grafické vyšetření nadledvin součástí předoperačních studií. Pro vlastní operační přístup analyzujeme, zda je nádor extrakraniální nebo též s intrakraniální extenzí, pořizujeme data pro navigaci, na DSA věnujeme zvláštní pozornost dominanci splavů, velikosti a poloze jugulárního bulbu, všímáme si přítoků sinus petrosus inferior a superior. Embolizace je plně indikována a má zásadní význam (obr. 9) [71]. Elekrofyziologicky monitorujeme hlavové nervy VII, IX, XI, XII. Nervus vagus lze mapovat pomocí endotracheální roury se stripovou elektrodou.
4. Tumor glomus jugulare vlevo v zobrazení DSA. Obr. 9a) Obliterace sinus sigmoideus vlevo. Obr. 9b) Extrémní hypervaskularizace tumoru glomus jugulare. Obr. 9c) Příznivý stav po embolizaci nádoru. 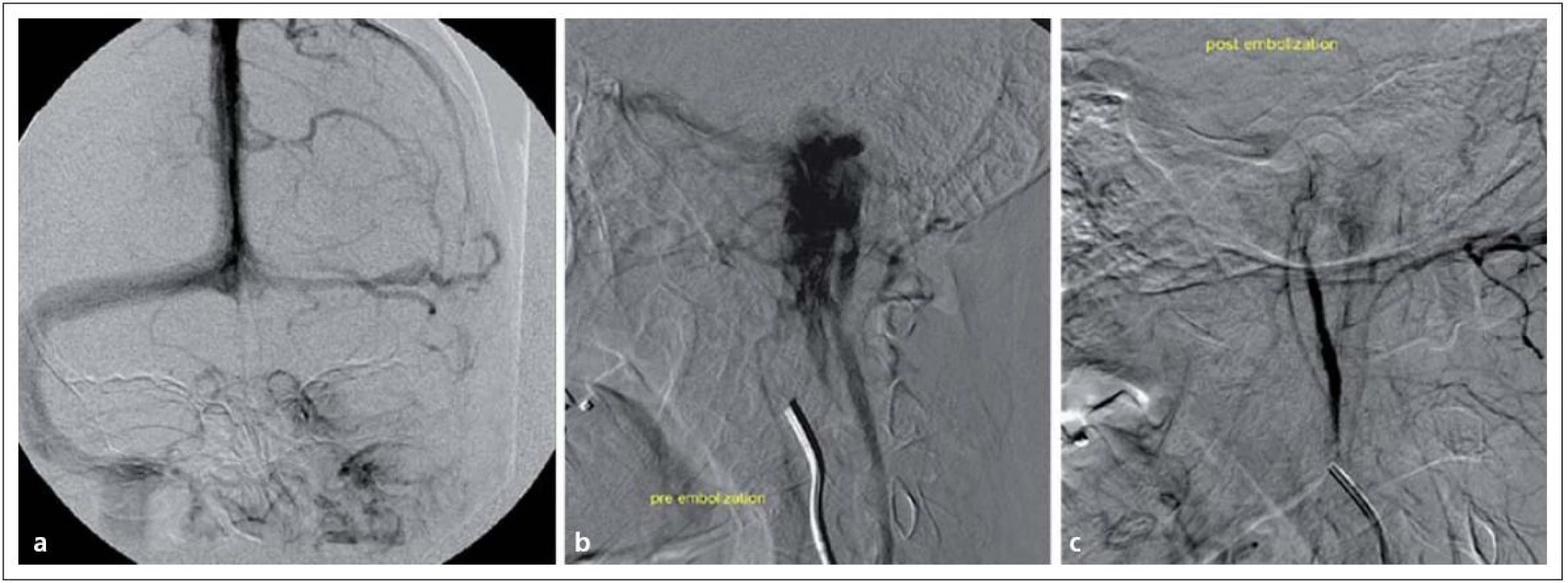
Operační přístup volíme podle rozsahu tumoru. Při nádoru sutkovitého tvaru s intrakraniální extenzí operační postup komplexně propojuje současné dovednosti chirurgie baze lební: přístup do zadní jámy, preparaci kraniocervikální junkce, techniky transtemporálních přístupů včetně odvrtání a odhalení jugulárního bulbu a Fallopiova kanálu, kaudálně preparaci vena jugularis interna a n. accesorius na krku. Přístup lze stručně shrnout v anglické terminologii takto: transmastoid retrolabyrinthine + retrosigmoid + transjugular, transcondylar + high cervical approach. Podstatou operace je přístup do jugulárního istmu, který je ohraničen laterálním výbežkem C1 a mastoidálním výběžkem. Mastoid je nutno retrolabyrintárně odvrtat, identifikovat n. facialis v mastoidálním segmentu a šetrně jej retrahovat anteriorně a dále odhalit celý jugulární bulbus. Poté je nutno podvázat sinus sigmoideus a venu jugularis na krku. Celý podvázaný segment žíly i s nádorem postupně resekujeme. Zásadním problémem je krvácení ze sinus petrosus inferior, pokud nebyl předoperačně embolizován [72]. Hlavním trikem k předejití parézy postranního smíšeného systému je ponechání části žilní stěny přiléhající k hlavovým nervům IX, X, XI in situ [73]. Tím v původním foramen jugulare minimalizujeme trauma a devaskularizaci těchto životně důležitých hlavových nervů (obr. 10, 11).
5. Glomus jugulare tumor sutkovitého tvaru s propagací extrakraniálně i intrakraniálně v MR zobrazení v a) transverzální, b) sagitální, c) koronární rovině. 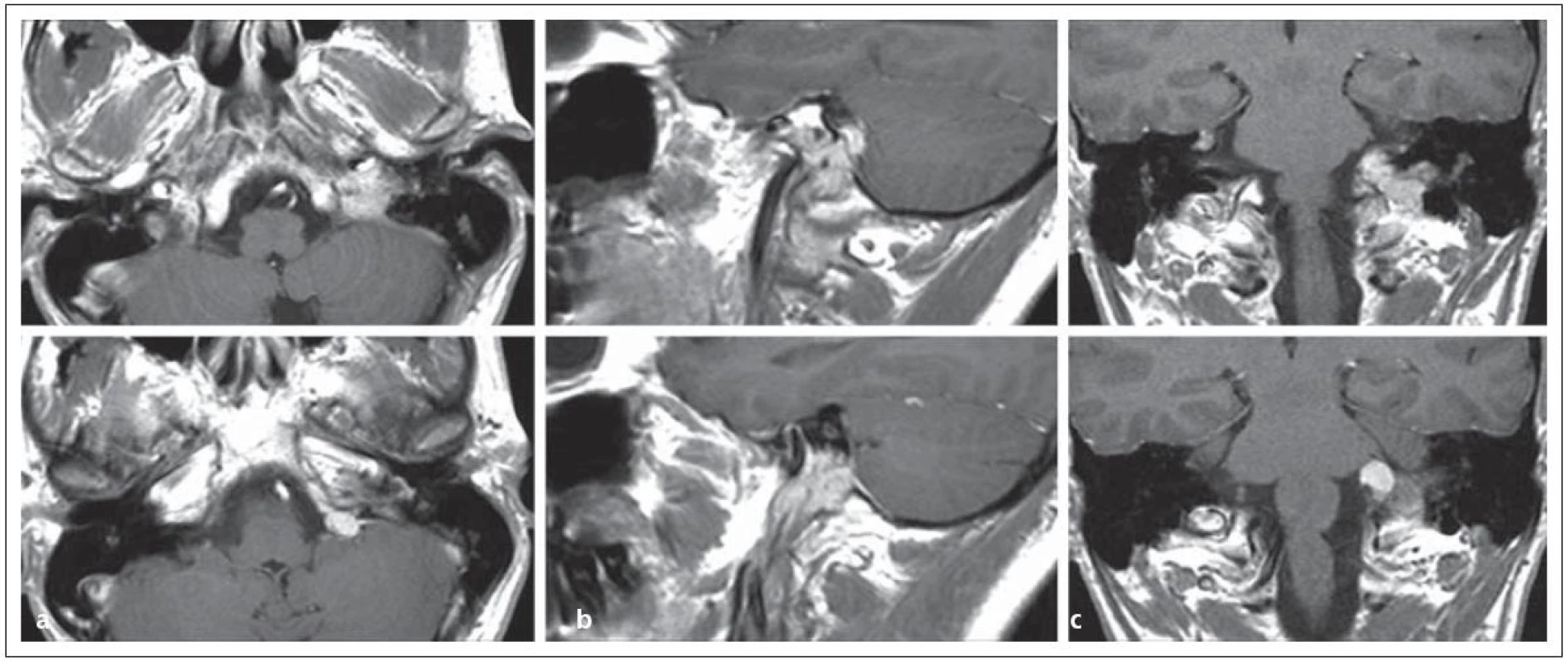
6. Glomus jugulare tumor po radikální resekci. Obr. 11a) Rozsah operační rány. Obr. 11b, c) Pooperační CT a MR bez rezidua nádoru. 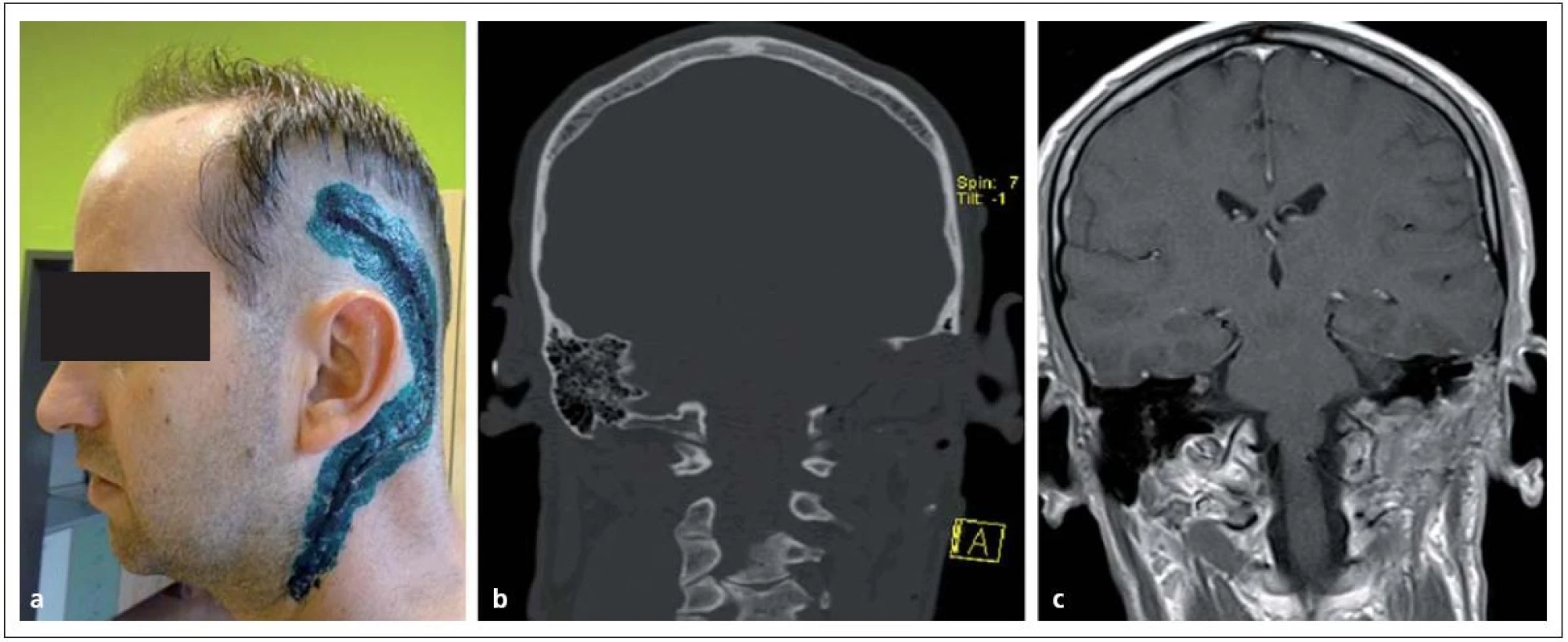
V pooperačním období je třeba před extubací otestovat polykací reflex, neboť největším nebezpečím u těchto pacientů je aspirační pneumonie. Pokud se polykací akt obnovuje delší dobu, vyživujeme nemocného transpylorickou sondou. Při dlouhodobé dysfonii lze pacientovi nabídnout medializaci hlasivek [74]. Perzistuje‑li periferní paréza lícního nervu, dáváme dnes přednost elegantním a esteticky výhodným závažím do víčka (obr. 5) před tarzorafií. Výsledky chirurgické léčby glomus jugulare tumorů se významně zlepšily právě díky pokrokům spojeným s vývojem chirurgie baze lební. I gigantické nádory lze resekovat s minimální morbiditou a mortalitou [70]. Metaanalýzy výsledků ukázaly radikální resekci v 88,2 % u primárních operací, kontrolu onemocnění až 92 % a rekurenci v 3,1 %, mortalita byla zaznamenána v 1,3 % [74].
V době před rozvojem chirurgie baze lební byla radioterapie po dlouhou dobu léčebnou metodou, i když glomus tumory jsou považovány za radiorezistentní. Ozařování bylo též spojeno s dlouhodobými nežádoucími účinky, osteonekrózou temporální kosti, demyelinizací a indukcí malignit [75]. Stereotaktická radiochirurgie pomocí Leksellova gama nože (Leksell Gamma Knife, LGK) poskytuje daleko povzbudivější výsledky především u nádorů, které svou velikostí splňují optimální cílový objem pro tuto metodu. LGK se jeví také jako účinný komplement pro terapii oboustranných glomus jugulare nádorů a pro rezidua po resekci gigantických nádorů [76]. U pacientů, kde byl LGK poskytnut jako primární léčba, došlo ve 36,5 % ke zmenšení nádoru, u 61,3 % byl nádor stabilní. Příznaky se zlepšily u 39 % nemocných a 2,1 % pacientů mělo recidivu tumoru. Morbidita v přímé relaci k léčbě byla 8,5 % [74].
Schwannomy foramen jugulare jsou vzácné patologie zahrnující pouze 2 – 4 % intrakraniálních schwannomů. Mohou vyrůstat z nervus glossopharyngeus, vagus nebo accesorius. Anatomická blízkost a podobná klinická manifestace schwannomů vyrůstajících z nervus hypoglossus jsou důvodem, proč někteří autoři referují tyto nádory společně se schwannomy foramen jugulare.
K typickým příznakům patří parézy dolních hlavových nervů, tzn. poruchy polykání, chrapot, paréza elevace ramene, paréza jazyka a audiovestibulární příznaky tinnitus, poruchy sluchu, závratě [77]. Téměř všichni pacienti s dumbbell ‑ shaped schwannomy mají deficit hlavových nervů IX a X.
V zobrazení CT s tenkými řezy v kostním okně je rozšířené foramen jugulare s ostře ohraničenými sklerotickými okraji. Na MR expanduje foramen jugulare bez eroze, po podání gadolinia se sytí středně až silně a u některých lze pozorovat cystickou degeneraci. Na angiografii jsou schwannomy avaskulární (tab. 8) [78].
Předoperační příprava a peroperační elektrofyziologcký monitoring je obdobný jako u glomus jugulare tumorů, hormonální studie ani embolizace nejsou indikovány. Výzvou pro neurochirurgickou léčbu je zachovat funkci dolních hlavových nervů a současně dosáhnout radikální resekce, a snížit tak riziko rekurence nádoru. Reoperace drasticky zvyšují riziko poranění nervů postranního smíšeného systému, a proto by tyto operace mělo primárně provádět pracoviště se zkušenostmi, vybavením a nasazením pro chirurgii baze lební. Tato výzva platí především u nádoru se sutkovitým tvarem expanze. Schwannomy se liší od glomus tumorů tím, že komprimují spíše než invadují jugulární bulbus a nervy jsou uloženy anteriorně od nádoru. Labyrint je též zachován a sluch se může zlepšit po odstranění nádoru. Tím, že schwannomy ve foramen jugulare vytlačují bulbus posteriorně, dovoluje výhodný suprajugulární přístup odstranit nádor bez otevření stěny bulbu. Transjugulární přístup se nepoužívá, neboť po dekompresi foramen může dojít k obnově průtoku skrze předoperačně obliterovaný bulbus. Suprajugulární přístup je v podstatě presigmoidální infralabyrintární přístup. Při adekvátní expozici anatomických struktur na krku, mastoidektomii se skeletonizací sigmoidálního sinu, jugulárního bulbu a jugulární vény, lze odstranit tento nádor bez neurologického deficitu [79]. V pooperačním období je opět největším nebezpečím život ohrožující aspirace při poruše polykacího reflexu. V těchto případech je indikována dočasná parenterální výživa a postupný nácvik polykacího aktu.
LGK lze nabídnout pacientům s malým nádorem, s intaktní funkcí postranního smíšeného systému a těm, kteří odmítnou chirurgickou léčbu. Je též zvažována pro pacienty s reziduálním či rekurentním nádorem a u pacientů s jediným patentním sigmoideálním sinem a jugulárním bulbem na straně nádoru [80].
Meningeomy foramen jugulare jsou jedny z nejvzácnějších meningeomů a konstituují pouze 9 % z nádorů ve foramen jugulare [81,82]. Tyto meningeomy podle všeho nejspíše vyrůstají z arachnoidálních buněk lemujících jugulární bulbus [81]. Ženy jsou postiženy častěji než muži. Komplexní anatomie foramen jugulare a tendence k sutkovitému šíření připomíná oba předchozí nádory. Klinické příznaky dolních kraniálních nervů jsou též obdobné. Na CT studii jsou patrné sklerotické za hyperostotické změny v kostním okně, v MR zobrazení je typické intenzivní a homogenní sycení gadoliniem a „dural tail“. Tento příznak je pozorován u meningeomů na MR s kontrastní látkou jako zesílení kontrastní tvrdé pleny u nádoru, které se postupně zeslabuje směrem od tumoru a připomíná ocásek (tab. 8). Angiografie ukazuje hypervaskularizaci a retenci venózní fáze, na MRV (Magnetic Resonance Venography) věnujeme pozornost patenci jugulárního bulbu.
Strategie chirurgického výkonu musí směřovat k odstranění tvrdé pleny a kosti ohraničující foramen jugulare, abychom eliminovali riziko recidívy. Podle analýzy grafických zobrazení volíme tyto přístupy:
- suprajugulární (presigmoidální a infralabyrintární) je indikován, pokud je jugulární bulbus patentní a nádor se šíří anteriorně,
- retrojugulární (transkondylární, transtuberkulární, retrosigmoideální) je vhodný při průchodnosti jugulárního bulbu a při propagaci nádoru posteriorně,
- transjugulární je indikován, pokud je jugulární bulbus obliterován.
Radikální resekce lze dosáhnout v 83 až 100 % případů [81,82]. Nejčastější komplikací je tranzientní deficit dolních kraniálních nervů, který by se měl upravit nebo kompenzovat během měsíce. Radiochirurgie by měla být rezervována pro pacienty, kde je riziková venózní anatomie s jediným patentním bulbem na straně nádoru, pro recidivy nádoru a pro pacienty odmítající výkon nebo interně rizikové pro operační řešení [83].
Nádory petrózního apexu a petroklivální nádory
Chirurgická léčba této oblasti je obdobně náročná, neboť nádory jsou ve vztahu ke karotidě, k bazilární arterii, mozkovému kmeni, k nervus trigeminus a ganglion geniculi. V posteriorní části apexu pak k Dorellově kanálu a petrózním splavům. Nejčastější zastoupení mají v této krajině chordomy, chondrosarkomy, petroklivální meningeomy, trigeminální schwannomy, cholesteatomy. Volba chirurgického přístupu závisí na anatomické lokalizaci a extenzi nádoru, na jeho histopatologické povaze, na stavu sluchu a v neposlední řadě na preferencích a zkušenosti operačního týmu. Lze volit z variet invazivnějších transtemporálních přístupů (retrolabyrintární, translabyritární, transkochleární) nebo kombinovaných petrózních přístupů (po prostřižení tentoria umožňují přístup ze střední i zadní jámy lební v jedné době). Daleko méně invazivní je klasický přístup retrosigmoidální a přední transpetrózní přístup podle Kawaseho.
Střední baze lební (middle skull base)
Traumatické léze střední baze
Z pohledu indikace chirurgické léčby likvorey jsou zcela odlišné od poranění frontobazálního. Pneumatizované prostory ucha nejsou za fyziologických poměrů bakteriálně kolonizovány, a proto je riziko ascendentní infekce daleko nižší. Ve většině případů se likvorea řeší konzervativně zvýšenou polohou poraněného ucha, léky snižujícími tvorbu likvoru a případně likvorovou lumbální drenáží [18].
Rekonstrukční operace lícního nervu při poranění v pyramidě jsou indikovány při lomné linii přes kanál lícního nervu a dislokaci kanálu, při plegii nervu od počátku poranění a při nepřítomnosti spontánní regenerace na EMG během tří měsíců.
Zánětlivé léze střední baze
Komplikace zánětlivých chorob zevního a především středního ucha mohou invadovat do střední jámy přímo skrze bazi nebo skrze struktury pyramidy. Epidurální absces, empyém, absces mozku, otogenní meningitis jsou vzácné komplikace akutní i chronické otitis media i v éře atibiotik. Léčba zahrnuje sanaci primárního ložiska, standardní neurochirurgické řešení těchto komplikací s plastikou tvrdé pleny.
Nádory střední baze
Selární nádory
Nejčastějšími nádory v oblasti tureckého sedla jsou adenomy hypofýzy. Další vzácné nádory selární, paraselární a supraselární oblasti představují velmi diverzní a různorodou skupinu: cysta Rathkeho výchlipky, kraniofaryngeomy, gliomy optického nervu, germinomy, dermoidní a epidermoidní cysty, meningeomy, lipomy, teratomy, metastázy a hamartomy. Do oblasti sedla lze zvolit přístup transkraniální nebo transsfenoidální. Současné pokroky v mikrochirurgii, endoskopii, zobrazování a molekulární biologii významně změnily diagnostiku a léčbu pituitárních nádorů. Tato problematika byla podrobně zpracována v minimonografii CSNN 3/ 2011.
Meningeomy
Jedná se o extra ‑ axiální pomalu rostoucí benigní nádory mening. Ve střední jámě jsou nejčastěji zastoupeny meningeomy křídla kosti klínové. Jsou klasifikovány tradičně podle Cushinga a House na mediální, střední a laterální. Yasargil rozlišuje mediální variantu (skupina paramediálních bazálních meningeomů) a laterální variantu (skupina laterálních bazálních meningeomů). Mediální sfenoidální meningeomy vyrůstají z mediální části sfenoidální kosti a z kavernózního splavu. Lze je dále dělit na klinoidální, sfenoorbitální, sfenopetrózní a sfenopetroklivální. Tyto meningeomy jsou nejčastěji unilaterální, mohou se šířit do střední jámy, do petrózní kosti, stejně tak kaudálně na klivus a do zadní jámy lební. Kavernózní meningeomy mohou vyrůstat primárně ze sinu nebo sinus může být invadován sekundárně ze sousední oblasti. Systematický přístup do sinu popsal Parkinson v roce 1965, Dolenc v roce 1979, Sekhar klasifikoval intrakavernózní nádory podle vztahu ke karotidě [84]. V současné době se u meningeomů zasahujících do kavernózního splavu preferuje resekovat pouze extrakavernózní porci (Simpson IV)(tab. 9) a intrakavernózní část sledovat či dozářit gama nožem, neboť preparace ve splavu přináší nepřijatelné riziko poškození hlavových nervů. Laterální varianta sfenoidálních meningeomů se může šířit laterálně nebo kaudálně do fossa pterygopalatina.
8. Simpson grading system pro resekci meningeomů [116]. ![Simpson grading system pro resekci meningeomů [116].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f6075d329b8c30ae23685774cef54c39.png)
Trigeminální schwannomy jsou vzácné a reprezentují pouze 0,4 % všech intrakraniálních nádorů. Rozdělují se do pěti skupin: na schwannomy zadní jámy, nádory Gasserského ganglia, sutkovité nádory zasahující střední a i zádní jámu, schwannomy periferních větví a nádory gigantické.
Další nádory, které je třeba zvažovat v diferenciální diagnóze, jsou metastázy, lymfomy, osteosarkom, cholesteatom, chordom a chondrosarkom.
Příznaky a symptomy nádorů střední jámy jsou nejčastěji charakteru bolestí hlavy, diplopie, parézy okohybných nervů VI a III. Příznaky trigeminálních schwannomů zahrnují hypestezii tváře, bolesti podobné trigeminální neuralgii jsou častější u nádorů ganglia. Častá je absence korneálního reflexu a slabost žvýkacího svalu.
V zobrazení CT pozorujeme změny kostní architektury. Lytické destrukce v oblasti petroklivální junkce jsou charakteristické pro chordomy a chondrosarkomy. Naopak meningeomy jsou spojeny s hyperostózou a kalcifikacemi. Velmi důležité je CT s tenkými řezy cílené na spodinu střední jámy a na temporální kost k přesnému zhodnocení anatomie labyrintu a jeho vztahu k nádoru a případné destrukci kosti. Na MR jsou meningeomy ostře ohraničeny, homogenně se sytí gadoliniem a typický je „dural tail“.
Základním přístupem do střední jámy je temporální kraniotomie. Léze na bázi lební vyžadují často další komponenty přístupu, aby byla minimalizována trakce za mozkovou tkáň. Zygomatická osteotomie rozšiřuje přístup inferiorně a umožňuje dosáhnout úroveň spodiny střední baze a je extrémně důležitá při plánované trajektorii na vysoko zasahující nádory nad úroveň dorza tureckého sedla. Pokud tumor zasahuje anteriorní část střední jámy, zahrnuje fissuru orbitalis superior a malé křídlo kosti klínové, je nutná pterionální kraniotomie. Pokud je nádor uložen v oblasti apexu pyramidy nebo se šíří ze střední do zadní jámy, pak přední petrosektomie (Kawaseho přístup) otevírá přístup mezi oběma bazemi až na úroveň meatus acusticus internus [85]. Expozice poskytovaná Kawaseho přístupem je konstantní a limitovaná meatem a n. abducens [86]. Avšak gigantické nádory často svým růstem erodují petrózní apex, a otevírají tak samy širokou trajektorii skrze střední bazi až k foramen magnum.
Delikátnost a vulnerabilita temporálního laloku spolu s úzkým operačním koridorem a jistou trakcí může vyústit v otok nebo kontuzi spánkového laloku. Ještě nebezpečnější situace nastává při poranění Labbého vény a při postižení dominantní hemisféry. Tyto komplikace jsou dány nedostatkem anatomických znalostí, špatným plánováním a nesprávným provedením [87]. Komplikacím mikrochirurgie střední jámy je nutno čelit peroperační likvorovou lumbální drenáží, ideální polohou hlavy, co nejbazálnějším přístupem, popř. se zygomatickou osteotomií k minimalizaci trakce mozkovou lopatkou. Velmi důležité je přesné zobrazení, identifikace a šetření Labbého žíly.
Pravidelné kontroly MR a jejich interval by měly být založeny na predikci času rekurence, který vychází z histologie, stupně radikality resekce a zvolené adjuvantní terapie. Protokol léčby u těchto často vzácných nádorů střední baze by měl být veden a evidován v mezioborové spolupráci s onkologickými centry.
Centrální oblast baze lební a kraniocervikální junkce
Centrální oblast a kraniocervikální junkce (CCJ) zahrnuje foramen occipitale magnum, klivus a obratle atlas a axis (C1 – 2). Koncentrace životně důležitých anatomických struktur, mozkového kmene, kraniálních a spinálních nervů, vertebrální arterie a jejich větví představují nejsložitější místa pro chirurgickou dostupnost. Stejně tak klinické příznaky jsou velmi rozmanité.
Nádory centrální oblasti baze
Nejčastějšími extramedulárními nádory CCJ jsou meningeomy, jež jsou třikrát častější než schwannomy. Meningeomy jsou častější u žen a hlavní predilekční lokalizací je foramen magnum. V diferenciální diagnóze figurují vzácné dermoidy, teratomy, neurenterické cysty, arachnoidální cysty, lipomy a tuberkulomy. Neurofibromy jsou také vzácné, vyjma neurofibromatózy (NF1), která je spojena s mnohočetnými nádory.
Pomalý růst těchto nádorů určuje, že se symptomy obvykle projevují až při značné velikosti tumoru. Příznaky zahrnují bolesti hlavy, bolesti krční páteře, parézy hlavových nervů (polykací problémy, chrapot), vertigo, dýchací potíže a hyperreflexii.
Zvažován musí být v této oblasti výskyt maligních nádorů. Chondrosarkomy vyrůstají primárně ze sfenopetroklivální junkce nebo vznikají maligní transformací enchondromů [88]. Většina chondrosarkomů jsou low ‑ grade léze, ale agresivnější subtypy jako dediferencovaný a mesenchymální varianta jsou předzvěstí špatné prognózy. Míra recidiv je velmi vysoká i v případech benigní histologie a opakované resekce jsou nutné pro reziduální nebo recidivující expanzi. Období bez recidivy nádoru (recurrence‑free survival) podle současných prací je 32 % v 10 letech [88].
Lokální kontrola po následné protonové radioterapii je 70 % za 5 let [89]. Radioterapie může prodloužit interval mezi resekcí a recidivou [90]. Radiochirurgie kombinovaná s frakcinovanou radioterapií je spojena s vysokým počtem komplikací [91]. Chemoterapie nemá efekt v léčbě chondrosarkomů.
Chordomy mají zřejmě původ ve vývojových zbytcích notochordu. Klivální chordomy popsali již v roce 1856 Virchov a Luschka. Tyto nádory se mohou vyskytovat kdekoli podél neuraxis. Kolem 50 % je jich lokalizováno v sakrokokcygeální oblasti, 37 % na klivu a 13 % v tělech obratlů, z toho polovina v krční páteři. Chordomy představují 3 – 4 % primárních maligních nádorů kostí. Jsou to čtvrté nejčastější primární malignity v kostech po osteosarkomech, chondrosarkomech a Ewingově sarkomu. Chordomy mají vrchol incidence v první a druhé dekádě a druhý vrchol mezi pátou a sedmou dekádou. Průměrný věk v době diagnózy u kraniálních chordomů je 38 let. Kraniální formy jsou stejně časté u mužů i u žen.
Popisují se tři subtypy chordomů: konvenční chordom, chondroidní chordom se vyskytuje téměř exkluzivně v kraniální oblasti, dediferencovaný chordom obsahuje high‑grade sarkomatózní komponentu. Tvoří 1 – 8 % všech chordomů a vznikají spontánně nebo po ozáření konvenčního chordomu. Jeho prognóza je nesmírně špatná, většina pacientů umírá během jednoho roku [92].
CT je nejlepší modalitou k vyšetření kostní eroze, chordomy typicky lyzují přilehlé kostní struktury [93,94]. Zatímco T1 vážené MR s kontrastem ukazuje nízkou až střední intezitu signálu, pak T2 vážené MR vykazuje heterogenní hyperintenzitu [95].
Symptomy závisí na velikosti a lokalizaci nádoru, bolesti hlavy byly nejčastějším příznakem, paréza n. abducens se objevila nejčastěji v neurologickém nálezu [96].
V léčbě by po agresivní chirurgické resekci měla následovat proton ‑ beam radioterapie. Byla popsána až 80% lokální kontrola nebo zmenšení nádoru [97]. Chordomy reagují minimálně nebo vůbec na chemoterapii.
Prognóza u malých dětí pod 5 let věku je velmi špatná vzhledem k častým maligním formám nádoru [98,99]. Prognóza přežití u mladších nemocných je však příznivější než u starších. Pokud určíme hranici 40 let věku, pak 5 - a 10leté přežití u mladší skupiny je 75 % a 63 %, u starší skupiny pouze 30 % a 11 % [100]. Lokální rekurence je pravidlem, 20 % pacientů má klinicky evidentní vzdálené metastázy a 40 % nemocných má prokázané metastázy při pitvě. Recidivy se objevují průměrně 2 – 3 roky po léčbě, ale mohou se projevit až 10 let po terapii. Komplikace a úmrtí jsou v přímém vztahu k lokálnímu expanzivnímu chování a k rekurenci [101].
Kostní nádory v oblasti CCJ mohou být maligní i benigní. Metastatické nádory jsou častější než primární kostní nádory [102]. Mezi primární osteogenní nádory patří osteoblastomy a osteoidní osteom. Ten je pětkrát častější u mužů než u žen a manifestuje se lokalizovanou bolestí, která dobře reaguje na aspirin, operativní excize je kurativní [103].
Plazmocytomy se též mohou vyskytovat v oblasti CCJ a projevují se bolestmi a deficitem kraniálních nervů. Plazmocytom je solitární B lymfocytický nádor a je prekurzorem systémové choroby mnohočetného myelomu. Vyvine se u 55 – 60 % pacientů za 5 let. Plazmocytom je velmi radiosenzitivní a primární léčbou je radioterapie. Vertebroplastika nebo kyfoplastika má vysokou účinnost u bolestivých patologických fraktur [104,105]. Prognóza je závislá na pozdějším výskytu mnohočetného myelomu, který má špatnou prognózu, 10leté přežití je 50 % [106].
Intramedulární nádory v oblasti foramen occipitale magnum jsou nejčastěji astrocytomy u pediatrické populace a ependymální predominance u dospělých. Další, méně časté tumory této oblasti jsou kavernózní angiom, hemangioblastom, melanocytom. Před chirurgickou indikací by měla být vždy vyloučena myelitis.
Klinické příznaky jsou velmi variabilní, zahrnují nejčastěji bolest, parestezie, parézy hlavových nervů, polykací potíže, dále hyperreflexii, poruchy chůze, atrofie svalů a sfinkterové poruchy. Progresivní bolest v noci a při pohybu může signalizovat kostní lézi. Lokální bolest může být ve vztahu s kompresí nervového kořene nebo patologickým kolapsem obratle. Extramedulární nádory vedou často k neuropatiím kraniálních nervů, k myelopatii a k atrofiím svalstva. U intrinsických tumorů pacienti líčí napětí a ztuhlost postižené oblasti, bolest a poruchy čití jsou také časté. U lézí medulla oblongata bývá prvním příznakem singultus, později se objevuje bulbární řeč, nauzea, poruchy dýchání.
Zobrazení CCJ musí definovat a hodnotit změny měkkých tkání, kosti, nervové tkáně, cév a vliv dynamické zátěže. Dynamické rentgenové snímky v předklonu a záklonu jsou v praxi stále používány ke zjištění instability. Anatomie kostních struktur je identifikována pomocí CT v sagitální a koronární rekonstrukci. MR se zobrazením patologie ve třech rovinách je určující pro stanovení cíle a plánování trajektorie operačního výkonu. CTA poskytuje excelentní 3D rekonstrukci anatomie cév a kostních struktur a jejich vzájemných vztahů. DSA je rezervována pro okluzní testy a embolizační výkony.
Léčebné paradigma je komplexní, od biopsie a adjuvantní terapie až po agresivní chirurgickou resekci. Léze CCJ vyžadují širokou paletu přístupů baze lební. Výběr přístupu závisí na velikosti, předpokládané histopatologii a lokalizaci vzhledem k tvrdé pleně.
Extradurální nádory uložené anteriorně lze resekovat transorálním přístupem. Crockard standardizoval optimální středočárový transorální přístup k dolní třetině klivu a horním dvěma krčním obratlům C1 – 2 [107]. Předoperační tracheostomie většinou není nezbytná při použití nové generace speciálních retraktorů (obr. 12). Po finální sutuře zadní stěny faryngu je pod vizuální kontrolou aplikována pacientovi nazogastrická sonda na dobu jednoho týdne, poté se sutura postupně zatěžuje tekutou a kašovitou stravou. Endotracheální extubace se provádí co nejdříve po výkonu, jakmile ustoupí otok jazyka a hltanu. Vždy je třeba hodnotit stabilitu CCJ.
7. Transorální přístup za pomoci speciálních retraktorů. 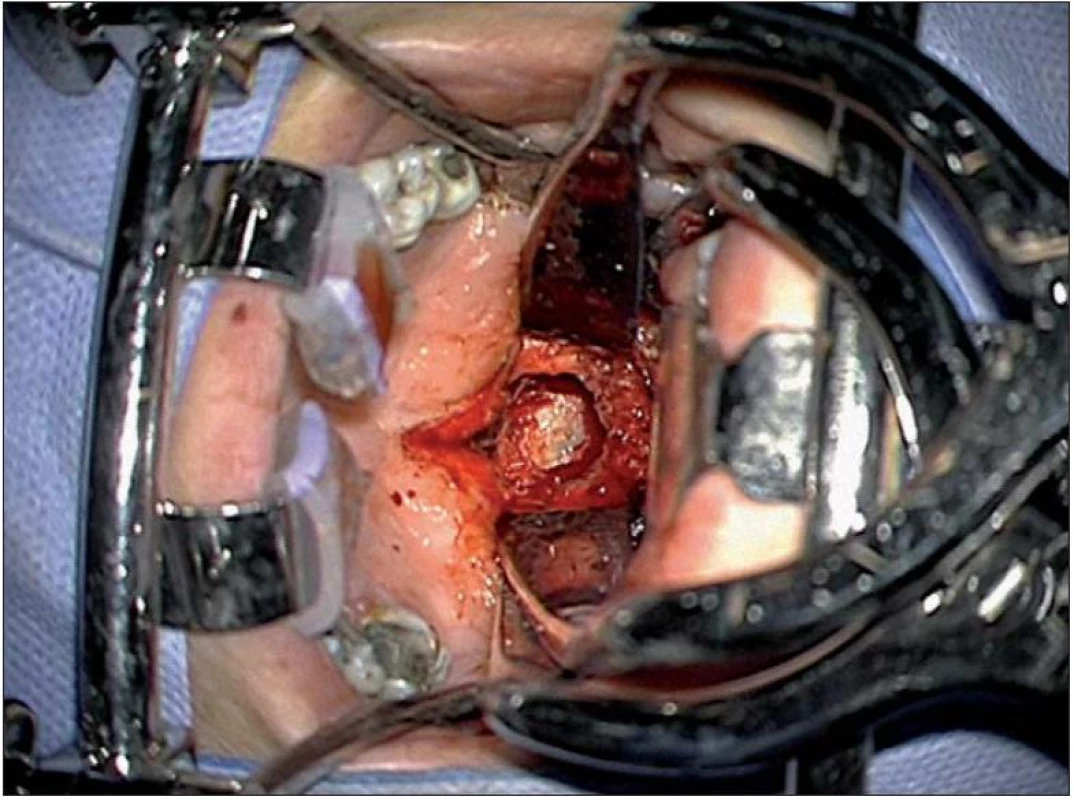
Pro rozšíření expozice centrální báze rostrálně až k tureckému sedlu lze využít variety transorálních ‑ transpalatálních přístupů. Široké spektrum všech invazivních transfaciálních přístupů klasifikoval do šesti etáží Beals [6,108].
Daleko elegantnější a méně invazivní jsou endoskopické endonazální přístupy pro klivální chordomy a chondrosarkomy. Stippler et al z Pittsburghu udávají 67 % radikálních resekcí u primárních výkonů a pouze 5 % nových neurologických deficitů po operaci. Problémem zůstává 25% riziko likvorových píštělí, stejně jako u extenzivních neurochirurgických přístupů [109]. Podobně příznivé povzbuzující výsledky publikují Fraser et al [110]. Komotar ze Sloan ‑ Kettering Cancer Center provedl metaanalýzu 37 studií pro srovnání endoskopických a mikrochirurgických přístupů ke kliválním chordomům publikovaných v letech 1950 až 2010. Zhodnotil 766 pacientů, a ve srovnání se skupinou otevřené chirurgie, měla endoskopická kohorta signifikantně vyšší procento radikálních resekcí (61 % vs 48,1 %), méně deficitů kraniálních nervů (1,3 % vs 24,2 %), nižší mortalitu (4,7 % vs 21,6 %) a méně lokálních recidiv (16,9 % vs 40 %). Rozdíl nebyl pouze v incidenci pooperačních likvorových píštělí. Tyto systematické analýzy podporují přímou endoskopickou ventrální cestu jako bezpečnou a efektní alternativu pro léčbu kliválních chordomů [111].
Pro intradurální laterální a anteriorní léze CCJ jsou preferovány posterolaterální přístupy. Základním a standardním přístupem je „far lateral approach“ popsaný Herosem (obr. 13). Podstatou je retrosigmoideální kraniotomie s otevřením foramen magnum a identifikací vstupu a. vertebralis do tvrdé pleny, kondyl není u tohoto přístupu atakován [112]. U komplexních nádorů lze tento přístup rozšířit transkondylárním přístupem nebo kombinací s transtemporálními přístupy (retrolabyrintární, translabyrintární, transkochleární).
8. Meningeom v přední části foramen occipitale magnum. Obr. 13a) V obraze MR před operací. Obr. 13b) Po radikálním odstranění „far lateral přístupem“. 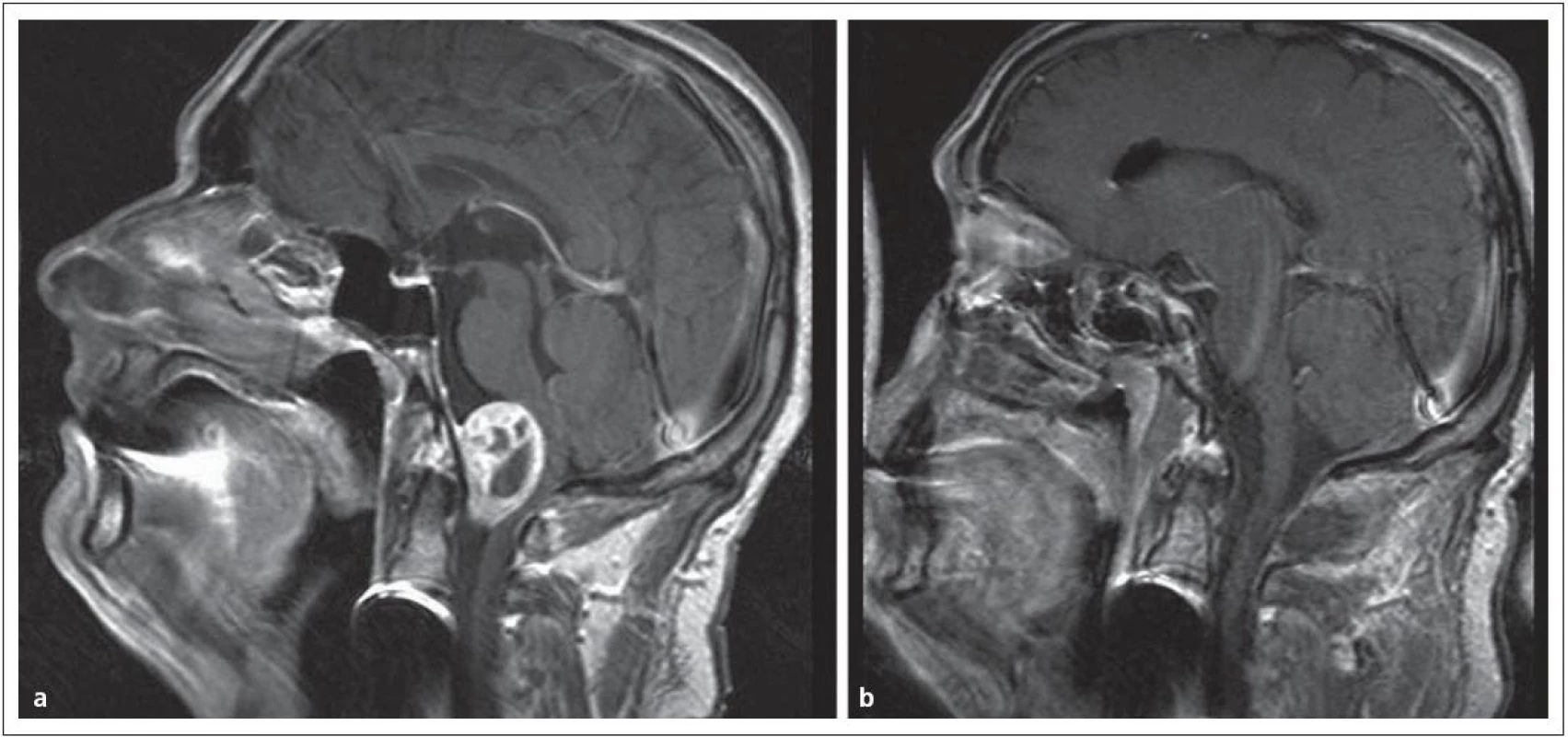
Mezinárodní a národní odborné společnosti, kongresy a výukové kurzy chirurgie baze lební
Prvním impulzem pro systematickou mezioborovou spolupráci a vědecký výzkum patologií na bazi lební byly mezinárodní anatomické kurzy v Hannoveru. Od roku 1979 je organizoval neurochirurg M. Samii a otorinolaryngolog W. Draf a tyto dvě osobnosti založily v témže roce pracovní skupinu „International Skull Base Study Group“. Společnost nadšenců a přátel, kteří byli fascinováni výzvou této anatomicky složité oblasti. Pod křídly pracovní skupiny bylo záhy organizováno množství mezinárodních workshopů a sympozií.
Až o 10 let později byla v roce 1989 založena ve Spojených státech amerických North American Skull Base Society (NASBS). Hlavními protagonisty byli L. Sekhar, I. Janecka a kongresy NASBS se v USA konají každým rokem.
Důležitým mezníkem pro vznik mnoha národních společností chirurgie baze lební na všech kontinentech byl dnes již legendární první světový kongres „1st International Skull Base Congress“ v Hannoveru v roce 1992. Prezidentem kongresu byl hlavní protagonista této medicínské disciplíny M. Samii. Úspěchem československé chirurgie bylo uvedení naší pracovní skupiny „Skull Base Study Group of CSFR“ na seznamu spolupořadatelů a účast neurochirurgů I. Fuska, J. Štěňa a E. Zveřiny a maxilofaciálního chirurga J. Kozáka [6].
Světové kongresy báze lební jsou pořádány jednou za čtyři roky a druhý kongres se konal v roce 1996 v San Diegu. Na třetím světovém kongresu v Brazílii ve Foz do Iguacu byla dne 9. listopadu 2000 založena světová federace společností „World Federation of Skull Base Societies“ a čtvrtý kongres v australské Sydney v roce 2004 již nesl oficiální název „4th International Congress of the World Federation of Skull Base Societies“. Pátý kongres byl pořádán v roce 2008 společně s NASBS ve Vancouveru a šestý kongres se uskutečnil v roce 2012 v britském Brightonu.
Evropská společnost baze lební (ESBS) byla založena v Itálii v Riva del Garda v roce 1993 a prezidentem prvního kongresu byl A. Mazzoni. Evropské kongresy jsou organizovány každé dva roky a druhý evropský kongres byl pořádán v roce 1995 v Paříži, třetí v roce 1997 v Londýně, čtvrtý v roce 1999 v Norimberku, pátý v roce 2001 v Kodani, šestý v roce 2003 ve španělské Terrasse, sedmý v roce 2005 v německé Fuldě s prezidentem W. Drafem. V roce 2007 se konal úspěšný „8th European Skull Base Society Congress“ v Praze a prezidentem kongresu byl V. Beneš. Devátý kongres pořádala evropská společnost baze v roce 2009 v Rotterdamu a desátý kongres byl pořádán společně se světovou federací v Brightonu v roce 2012.
V Československu byl protagonistou nové subspecializace stomatochirurg J. Kozák a neurochirurg E. Zvěřina [113]. Již v roce 1991 založili Pracovní skupinu chirurgie baze lební a na základě dohody tří zainteresovaných oborů neurochirurgie, ORL a stomatochirurgie vznikla v roce 1996 Sekce chirurgie baze lební a ta byla akceptována Evropskou společností baze lební. Oba protagonisté se pak stali členy European Council Members ESBS. V roce 2001 v Kodani byl neurochirurg V. Beneš zvolen členem Executive Committee Evropské společnosti baze lební a tato volba měla význam pro pořádání evropského kongresu 2007 v Praze. V roce 2008 se ve Vancouveru stali E. Zvěřina a M. Sameš členy výboru chirurgie baze lební Světové federace WFNS.
První národní mezioborový kongres chirurgie baze lební v České republice se konal v roce 1996 v Brně a v roce 1997 v Přešticích u Plzně v rámci Odborného shromáždění vojenských otolaryngologů s celostátní a mezioborovou účastí. Hlavními organizátory byli otorinolaryngologové K. Čada z Brna a Z. Voldřich z ÚVN Praha. V letech 1998 – 2001 organizoval otorinolaryngolog J. Mrázek Ostravské pracovní dny lební baze v Rožnově pod Radhoštěm a další navazující mezioborová setkání Pracovní skupiny baze lební ČR (www.skullbase.cz) byla pořádána v cirkulaci oborů neurochirurgie, ORL a stomatochirurgie (tab. 10). V roce 2010 se v Praze konal kongres věnovaný chirurgii baze za účasti předních světových odborníků, prezidentem kongresu byl T. Fukushima a kongres organizovala ústecká neurochirurgie [114].
9. Přehled mezioborových kongresů chirurgie baze lební v České republice od roku 2001. 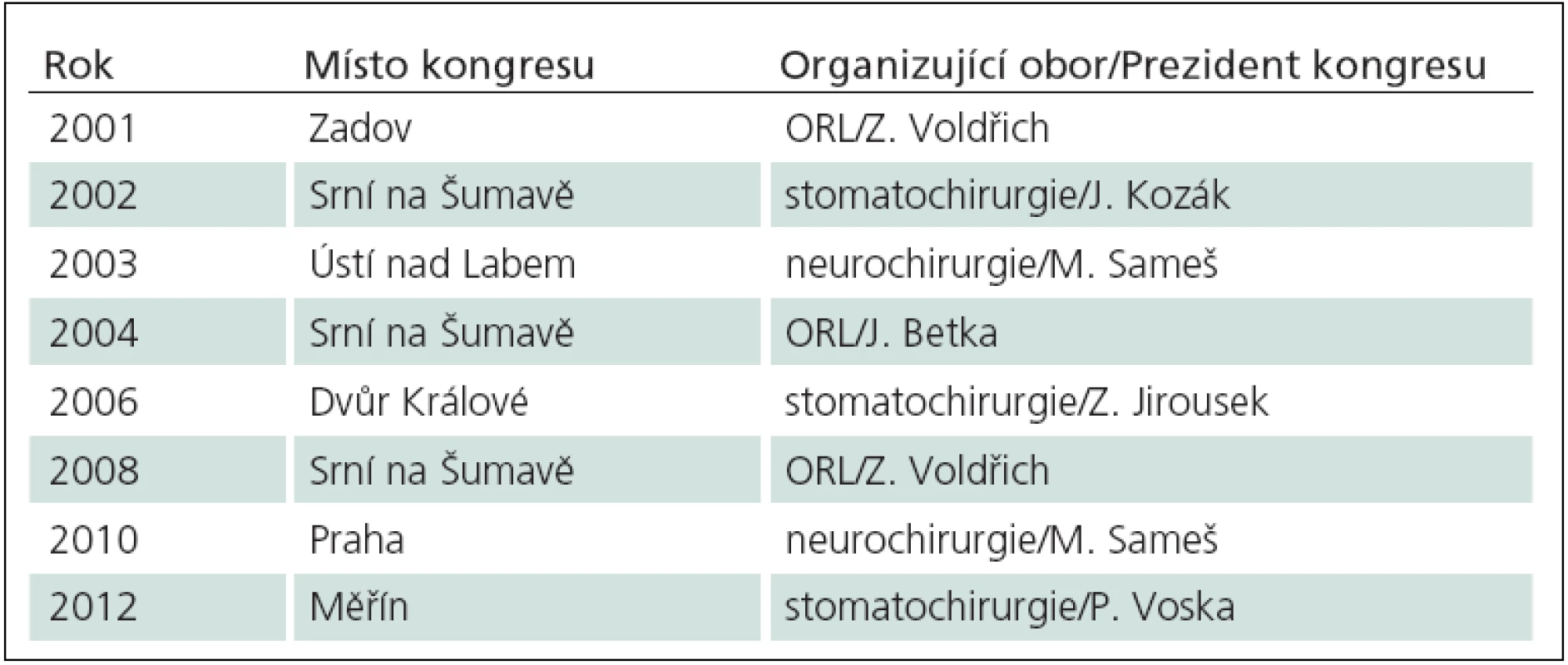
Kromě světových, kontinentálních a národních kongresů, které mají zásadní vliv na inspiraci a vzdělávání odborníků, jsou s velkým ohlasem od roku 2004 vyhlašovány ESBS granty na fellowshipy a odborné stáže na etablovaných klinikách chirurgie baze lební.
Naprosto nezbytnou součástí vzdělávání a konkrétní přípravy na mikrochirurgické operace jsou výukové kurzy na anatomických kadaverózních preparátech. Zde je nutné na prvním místě jmenovat neuro‑mikroanatomickou laboratoř prominentního a fenomenálního anatoma A. L. Rhotona v Gainesville v USA, široký program „hands ‑ on“ kadaverózních kurzů v Saint Louis, disekční kurzy T. Fukushimy v Severní Karolíně a řada satelitních kurzů pořádaných paralelně s kongresy.
V naší zemi vznikla první anatomická laboratoř baze lební v roce 2001 díky spolupráci Anatomického ústavu 1. LF UK v Praze a Neurochirurgické kliniky v Ústí nad Labem. Zázemí této laboratoře bylo a je základem pro organizování mezinárodních výukových anatomických kurzů na území naší republiky. V roce 2008 ve Vancouveru získala tato laboratoř a klinika mezinárodní certifikát edukačního centra Světové federace WFNS kategorie „A“(obr. 14). Od roku 2010 uspořádalo Edukační centrum praktické anatomie (ECPA) v Brně dva národní kadaverózní praktické kurzy na neurochirurgické přístupy a velmi přínosné jsou českobudějovické cerebrovaskulární workshopy pro nácvik cévních bypassů na zvířecím modelu.
Obr. 14a) Mezinárodní anatomické kurzy s certifikací edukačního centra Světové federace WFNS kategorie „A“ pořádané v České republice. Obr. 14b) Nová generace anatomických preparátů zhotovena laserovou technikou podle 3D CT modelů je vyvíjena ve spolupráci s kurzy v ČR. 
Díky těmto systematickým edukačním aktivitám začal ve světě i u nás zvládat tyto operace dostatečný počet specialistů a náročné výkony na bazi lební přestaly být výsadou několika odborníků na světě. Velmi žádoucí se v každé zemi stala centralizace pacientů do specializovaných center, která o chirurgii lební baze mají zájem a která disponují anatomickým laboratorním zázemím.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Martin Sameš, CSc.
Neurochirurgická klinika
UJEP a Krajská zdravotní a.s., Masarykova nemocnice v Ústí nad Labem, o.z.
401 13 Ústí nad Labem
e-mail: martin.sames@mnul.cz
Přijato k recenzi: 5. 4. 2013
Přijato do tisku: 2. 7. 2013
Recenzenti
MUDr. Jan Klener, Ph.D.
MUDr. Vladimír Přibáň, Ph.D.
doc. MUDr. Miroslav Vaverka, CSc.
Operace vestibulárního schwannomu stupně IV vpravo (obr. 6) a meningeomu v přední části foramen occipitale magnum (obr. 13) lze zhlédnout na videu:
#vid:csnn_meningiom_foramen_magnum.flv#
prof. MUDr. Martin Sameš, CSc. (1963)
Profesor Sameš se narodil 1. 11. 1963 v Jablonci nad Nisou. V letech 1982 až 1988 studoval 2. LF UK v Praze. V roce 1988 nastoupil jako sekundární lékař na neurochirurgické oddělení Masarykovy nemocnice v Ústí nad Labem. V roce 1991 absolvoval atestaci I. stupně v oboru chirurgie a v roce 1996 atestaci II. stupně v oboru neurochirurgie. V témže roce dokončil vzdělávací kurzy evropské asociace EANS. Stážoval na šesti evropských klinikách a pěti pracovištích v USA (Phoenix, USC Los Angeles, UCSF San Francisco, GWU Washington, Mount Sinai New York), podnikl dvě studijní neurochirurgické cesty po Japonsku. V roce 1997 byl jmenován primářem neurochirurgického oddělení. V roce 2000 obhájil experimentální dizertační práci, o šest let později habilitoval na 2. LF UK v Praze, v roce 2012 byl jmenován profesorem UK v Praze. Je autorem nebo spoluautorem 90 odborných článků, z toho 54 v impaktovaných časopisech. Autorsky se podílel na třech monografiích, je autorem učebnice pro lékařské fakulty a tří kapitol v monografiích. Byl zvaným řečníkem na 50 národních a mezinárodních kongresech. Za vědecké práce byl oceněn redakcí časopisu ČSNN a cenou odborné společnosti ČNchS ČLS JEP. Podílel se na řešení 10 grantů, z toho v osmi jako hlavní řešitel. Je členem redakční rady časopisu ČSNN a členem výkonné redakční rady časopisu Rozhledy v chirurgii. Byl organizátorem sedmi národních a 10 mezinárodních kongresů a sympozií, je hlavním organizátorem a členem týmu lektorů mezinárodních anatomických disekčních kurzů s certifikací Skull Base Surgery Committee WFNS. Od roku 2000 vyučuje neurochirurgii na 2. LF UK v Praze, je školitelem pěti postgraduálních doktorandů DSPB Neurověd, z nichž tři úspěšně obhájili dizertační práce. Je členem výboru České neurochirurgické společnosti ČLS JEP, členem výboru a sekretářem Pracovní skupiny chirurgie baze lební ČR, členem Etické komise EANS, členem výboru Skull Base Surgery WFNS, mezinárodním členem CNS (Congress of Neurological Surgeons), členem vědecké rady Fakulty zdravotnických studií Univerzity J. E. Purkyně a předsedou vědecké rady Masarykovy nemocnice.
Sources
1. Samii M, Draf W. Surgery of the skull base. An interdisciplinary approach. Berlin: Springer Verlag 1989 : 1 – 2.
2. Donald PJ. History of skull base surgery. In: Donald PJ (ed). Surgery of the skull base. Philadelphia: Lippincott ‑ Raven Publishers 1998 : 3 – 12.
3. Wanibuchi M, Friedman AH, Fukushima T. Photo atlas of skull base dissection. Techniques and operative approaches. New York: Thieme 2009.
4. Welling DB, Packer MD. Stereotactic radiation treatment of benign tumors of the cranial basae. In: Flint PW, Haughey BH, Lund VJ et al (eds). Cummings Otolaryngology: Head & Neck Surgery. 5th ed. Philadelphia, PA: Mosby Elsevier 2010.
5. Hanna EY, DeMonte F. Comprehensive management of skull base tumors. New York: Informa Healthcare 2009.
6. Sameš M, Vachata P. Historie a současnost chirurgie baze lební. Cesk Slov Neurol N 2003; 66/ 99(5): 315 – 322.
7. Bramann F. Uber die Dermoide der Nase. Langenbecks Arch Klin Chir 1890; 40 : 101.
8. Tessier P. The definitive plastic surgical treatment of the severe facial deformities of craniofacial dysostosis. Cruzon’s and Apert’s disease. Plast Reconstr Surg 1971; 48(5): 419 – 442.
9. Converse JM, McCarthy JG, Wood ‑ Smith D, Coccaro PJ. Principles of craniofacial surgery. In: Converse J (ed). Reconstructive plastic surgery. Philadelphia: Saunders 1977.
10. Munro JR, Das SK. Improving results in orbital hypertelorism correction. Ann Plast Surg 1979; 2(6): 499 – 507.
11. David DJ, Paswillo D, Simpson D. The craniosynostoses. Berlin: Springer 1982.
12. van der Meulen JC, Mazda R, Vermey ‑ Keers C, Stricker M, Raphael B. A morphogenetic classification of craniofacial malformations. Plast Reconstr Surg 1983; 71(4): 560 – 572.
13. Haberl H, Hell B, Zöckler MJ, Zachow S, Lamecker H, Sarrafzadeh A et al. Technical aspects and results of surgery for craniosynostosis. Zentralbl Neurochir 2004; 65(2): 65 – 74.
14. Schaller BJ, Filis A, Merten HA, Buchfelder M. Premature craniosynostosis – the role of skull base surgery in its correction. A surgical and radiological experience of 172 operated infants/ children. J Craniomaxillofac Surg 2012; 40(3): 195 – 200.
15. Kozák J, Škodová I, Beneš V, Neméth T. Nové možnosti operačního řešení kraniofaciálních malformací. Čs Pediatrie 1984; 39(8): 468 – 473.
16. Kozak J, Skodova I, Nemeth T, Benes V. Modern surgical possibilities in craniofacial malformations. Rozhl Chir 1985; 64(7): 511 – 518.
17. Skodova I, Kozak J. Surgical treatment of craniosynostosis in children. Acta Chir Plast 1986; 28(1): 7 – 13.
18. Mraček Z. Kraniocerebrální poranění. Praha: Avicenum 1988.
19. Meco C, Oberascher G, Arrer E, Moser G, Albegger K. Beta‑trace protein test: new guidelines for the reliable diagnosis of cerebrospinal fluid fistula. Otolaryngol Head Neck Surg 2003; 129(5): 508 – 517.
20. Wang X, Xu M, Liang H, Xu L. Comparison of CT and MRI in diagnosis of cerebrospinal leak induced by multiple fractures of skull base. Radiol Oncol 2011; 45(2): 91 – 96.
21. Brihaye J. Transcranial decopression of optic nerve after trauma. In: Samii M, Jannetta PJ (eds). The Cranial nerves. Berlin: Springer 1981 : 116 – 124.
22. Lübben B, Stoll W, Grenzebach U. Optic nerve decompression in the comatose and conscious patients after trauma. Laryngoscope 2001; 111(2): 320 – 328.
23. Levin LA, Beck RW, Joseph MP, Seiff S, Kraker R. The treatment of traumatic optic neuropathy: the International Optic Nerve Trauma Study. Ophthalmology 1999; 106(7): 1268 – 1277.
24. Levin LA, Baker RS. Management of traumatic optic neuropathy. J Neuroophthalmol 2003; 23(1): 72 – 75.
25. Blum EM, Larson A. Mucocele of the sphenoid sinus with sudden blindness. Laryngoscope 1973; 83(12): 2042 – 2049.
26. DeMonte F. Surgical treatment of anterior basal meningiomas. J Neurooncol 1996; 29(3): 239 – 248.
27. Drummond KJ, Zhu JJ, Black PM. Meningiomas: updating basic science, management, and outcome. Neurologist 2004; 10(3): 113 – 130.
28. Yasargil MG. Microneurosurgery of CNS tumors. Volume IVB. New York: Thieme Medical Publishers 1996.
29. Fukushima T, Sameshima T. Manual of skull base dissection. 2nd ed. Raleigh: AF ‑ Neuro Video, Inc 2004.
30. Nakamura M, Struck M, Roser F, Vorkapic P, Samii M.Olfactory groove meningiomas: clinical outcome and recurrence rates after tumor removal through the frontolateral and bifrontal approach. Neurosurgery 2007; 60(5): 844 – 852.
31. Sekhar LN, Nanda A, Sen CN, Snyderman CN, Janecka IP. The extended frontal approach to tumors of the anterior, middle, and posterior skull base. J Neurosurg 1992; 76(2): 198 – 206.
32. Jho HD, Ha HG. Endoscopic endonasal skull base surgery: part 1 – the midline anterior fossa skull base. Minim Invasive Neurosurg 2004; 47(1): 1 – 8.
33. Jho HD, Alfieri A. Endoscopic glabellar approach to the anterior skull base: a technical note. Minim Invasive Neurosurg 2002; 45(3): 185 – 188.
34. de Almeida JR, Snyderman CH, Gardner PA, Carrau RL, Vescan AD. Nasal morbidity following endoscopic skull base surgery: prospective cohort study. Head Neck 2011; 33(4): 547 – 551.
35. Frazier JL, Chaichana K, Jallo GI, Quiñones ‑ Hinojosa A. Combined endoscopic and microscopic management of pediatric region tumors through one nostril: technical note with case illustrations. Childs Nerv Syst 2008; 24(12): 1469 – 1478.
36. McLean JN, Nunley SR, Klass C, Moore C, Müller S,Johnstone PA. Combined modality therapy of esthesioneuroblastoma. Otolaryngol Head Neck Surg 2007; 136(6): 998 – 1002.
37. Bales C, Kotapka M, Loevner LA, Al ‑ Rawi M, Weinstein G, Hurst R et al. Craniofacial resection of advanced juvenile nasopharyngeal angiofibroma. Arch Otolaryngol Head Neck Surg 2002; 128(9): 1071 – 1078.
38. Cummings BJ, Blend R, Keane T, Fitzpatrick P, Beale F, Clark R et al. Primary radiation therapy for juvenile nasopharyngeal angiofibroma. Laryngoscope 1984; 94 (12 Pt 1): 1599 – 1605.
39. Wei WI, Sham JS. Nasopharyngeal carcinoma. Lancet 2005; 365(9476): 2041 – 2054.
40. Chan AT, Hui EP, Leung SF. ESMO Guidelines working group. Nasopharyngeal cancer: ESMO clinical recommendation for diagnosis, treatment and follow‑up. Ann Oncol 2007; 18 (Suppl 2): ii67 – ii68.
41. Pommier P, Liebsch NJ, Deschler DG, Lin DT, McIntyre JF, Barker FG 2nd et al. Proton beam radiation therapy for skull base adenoid cystic carcinoma. Arch Otolaryngol Head Neck Surg 2006; 132(11): 1242 – 1249.
42. Mori Y, Kobayashi T, Kida Y, Oda K, Shibamoto Y,Yoshida J. Stereotactic radiosurgery as a salvage treatment for recurrent skull base adenoid cystic carcinoma. Stereotact Funct Neurosurg 2005; 83(5 – 6): 202 – 207.
43. Ketcham AS, Hoye RC, Van Buren JM, Johnson RH, Smith RR. Complications of intracranial facial resection for tumors of the paranasal sinuses. Am J Surg 1966; 112(4): 591 – 596.
44. Patel SG, Singh B, Polluri A, Bridger PG, Cantu G,Cheesman AD et al. Craniofacial surgery for malignant skull base tumors: report of an international collaborative study. Cancer 2003; 98(6): 1179 – 1187.
45. Casler JD, Doolittle AM, Mair EA. Endoscopic surgery of the anterior skull base. Laryngoscope 2005; 115(1): 16 – 24.
46. Liu JK, Niazi Z, Couldwell WT. Reconstruction of the skull base after tumor resection: an overview of methods. Neurosurg Focus 2002; 12(5): e9.
47. Sasaki CT, Ariyan S, Spencer D, Buckwalter J. Pectoralis major myocutaneous reconstruction of the anterior skull base. Laryngoscope 1985; 95(2): 162 – 166.
48. Pusic AL, Chen CM, Patel S, Cordeiro PG, Shah JP. Microvascular reconstruction of the skull base: a clinical approach to surgical defect classification and flap selection. Skull Base 2007; 17(1): 5 – 15.
49. Vachata P, Sameš M. Anatomické a klinické poznámky k poloze jugulárního bulbu. Otorinolaryng a Foniat (Prague) 2003; 52(1): 10 – 13.
50. Vachata P, Petrovicky P, Sames M. An anatomical and radiological study of the high jugular bulb on high‑resolution CT scans and alcohol ‑ fixed skull of adults. J Clin Neurosci 2010; 17(4): 473 – 478.
51. Roundy N, Delashaw JB, Cetas JS. Preoperative identification of the facial nerve in patients with large cerebellopontine angle tumors using high‑density diffusion tensor imaging. J Neurosurg 2012; 116(4): 697 – 702.
52. Gerganov VM, Giordano M, Samii M, Samii A. Diffusion tensor imaging‑based fiber tracking for prediction of the position of the facial nerve in relation to large vestibular schwannomas. J Neurosurg 2011; 115(6): 1087 – 1093.
53. Nakai T, Koyama J, Fujita A, Taniguchi M, Kohmura E. Preoperative detection of the facial nerve location using balanced fast field echo and diffusion tensor imaging in patients with large cerebellopontine angle tumors. J Neurol Surg B 2012; 73: A267.
54. Liu P, Saida Y, Yoshioka H, Itai Y. MR imaging of epidermoids at the cerebellopontine angle. Magn Reson Med Sci 2003; 2(3): 109 – 115.
55. Vachata P, Sameš M, Cee J, Bartoš R. Peroperační elektromyografická monitorace v chirurgii baze lební. Otorinolaryng a Foniat (Prague) 2005; 54(1): 3 – 9.
56. Spetzler RF, Sanai N. The quiet revolution: retractorless surgery for complex vascular and skull base lesions. J Neurosurg 2012; 116(2): 291 – 300.
57. Rutherford SA, King AT. Vestibular schwannoma management: What is the best option? Br J Neurosurg 2005; 19(4): 309 – 316.
58. Kondziolka D, Lunsford LD, Flickinger JC. Acoustic tumors: operation versus radiation – making sense of opposing viewpoints. Part II. Acoustic neuromas: sorting our management options. Clin Neurosurg 2003; 50 : 313 – 328.
59. Godefroy WP, Kaptein AA, Vogel JJ, van der Mey AG. Conservative treatment of vestibular schwannoma: a follow‑up study on clinical and QOL outcome. Otol Neurotol 2009; 30(7): 968 – 974.
60. Hayhurst C, Zadeh G. Tumor pseudoprogression following radiosurgery for vestibular schwannoma. Neuro Oncol 2012; 14(1): 87 – 92.
61. Arthurs BJ, Fairbanks RK, Demakas JJ, Lamoreaux WT, Giddings NA, Mackay AR et al. A review of treatment modalities for vestibular schwannoma. Neurosurg Rev 2011; 34(3): 265 – 277.
62. Rand RW, Kurze TL. Facial nerve preservation by posterior fossa transmeatal microdissection in total removal of acoustic tumor. J Neurol Neurosurg Prychiatry 1965; 28 : 311 – 316.
63. House WF. Transtemporal bone microsurgical removal of acoustic neuromas. Arch Otolaryngol 1964; 80 : 597 – 756.
64. Sameš M, Vachata P. Manual of the transtemporal approaches. Praha: Galén 2003 : 17 – 25.
65. Seol HJ, Kim CH, Park CK, Kim CH, Kim DG, Chung YS. Optimal extent of resection in vestibular schwannoma surgery: relationship to recurrence and facial nerve preservation. Neurol Med Chir (Tokyo) 2006; 46(4): 176 – 181.
66. Samii M, Gerganov V, Samii A. Improved preservation of hearing and facial nerve function in vestibular schwannoma surgery via the retrosigmoid approach in a series of 200 patients. J Neurosurg 2006; 105(4): 527 – 535.
67. Spector GJ, Gado M, Ciralsky R, Ogura JH, Maisel RH. Neurologic implications of glomus tumors in the head and neck. Laryngoscope 1975; 85(8): 1387 – 1395.
68. Fisch U, Fagan P, Valavanis A. The infratemporal fossa approach for the lateral skull base. Otolaryngol Clin North Am 1984; 17(3): 513 – 552.
69. Jackson CG. Basic surgical principles of neurotologic skull base surgey. Laryngoscope 1993; 103 (11 Pt 2 Suppl 60): 29 – 44.
70. Al ‑ Mefty O, Teixeira A. Complex tumors of the glomus jugulare: criteria, treatment, and outcome. J Neurosurg 2002; 97(6): 1356 – 1366.
71. Ramina R, Maniglia JJ, Fernandes YB, Paschoal JR, Pfeilsticker LN, Neto MC et al. Jugular foramen tumors: diagnosis and treatment. Neurosurg Focus 2004; 17(2): E5.
72. Carrier DA, Arriaga MA, Gorum MJ, Dahlen RT, Johnson SP. Preoperative embolization of anastomoses of the jugular bulb: an adjuvant in jugular foramen surgery. AJNR Am J Neuroradiol 1997; 18(7): 1252 – 1256.
73. Sen C, Hague K, Kacchara R, Jenkins A, Das S,Catalano P. Jugular foramen: microscopic anatomic features and implications for neural preservation with reference to glomus tumors involving the temporal bone. Neurosurgery 2001; 48(4): 838 – 847.
74. Gottfried ON, Liu JK, Couldwell WT. Comparison of radiosurgery and conventional surgery for the treatment of glomus jugulare tumors. Neurosurg Focus 2004; 17(2): E4.
75. Michael LM 2nd, Robertson JH. Glomus jugulare tumors: historical overview of the management of this disease. Neurosurg Focus 2004; 17(2): E1.
76. Teixeira A, Al ‑ Mefty O, Husain MM. Paragangliomas of the skull base. In: Berger MS, Prados MD (eds). Textbook of Neuro‑Oncology. Philadelphia, PA: Elsevier 2004 : 366 – 370.
77. Wilson MA, Hillman TA, Wiggins RH, Shelton C. Jugular foramen schwannoma: diagnosis, management, and outcomes. Laryngoscope 2005; 115(8): 1486 – 1492.
78. Eldevik OP, Gabrielsen TO, Jacobsen EA. Imaging findings in schwannomas of the jugular foramen. AJNR Am J Neuroradiol 2000; 21(6): 1139 – 1144.
79. Kadri PA, Al ‑ Mefty O. Surgical treatment of dumbbell ‑ shaped jugular foramen schwannomas. Neurosurg Focus 2004; 17(2): E9.
80. Muthukumar N, Kondziolka D, Lunsford LD, Flickinger JC. Stereotactic radiosurgery for jugular foramen schwannomas. Surg Neurol 1999; 52(2): 172 – 179.
81. Amautovic KI, Al ‑ Mefty O. Primary meningiomas of the jugular fossa. J Neurosurg 2002; 97(1): 12 – 20.
82. Ramina R, Neto MC, Fernandes YB, Aquiar PH, de Meneses MS, Torres LF. Meningiomas of the jugular foramen. Neurosurg Rev 2006; 29(1): 55 – 60.
83. Couldwell WT, Cole CD, Al ‑ Mefty O. Patterns of skull base meningioma progression after failed radiosurgery. J Neurosurg 2007; 106(1): 30 – 35.
84. Sekhar LN, Altschuler EM. Meningiomas of the cavernous sinus. In: Al ‑ Mefty O (ed). Meningiomas. New York: Raven Press 1991 : 445 – 460.
85. Kawase T, Shiobara R, Toya S. Anterior transpetrosal ‑ transtentorial approach for sphenopetroclival meningiomas: surgical method and results in 10 patients. Neurosurgery 1991; 28(6): 869 – 876.
86. Sameš M, Vachata P. Přední transpetrózní přístup k nádorům petroklivální oblasti: chirurgická technika a srovnání s retrosigmoideálním (RISA) přístupem. Cesk Slov Neurol N 2006; 69/ 102(4): 296 – 301.
87. Baaj AA, Agazzi S, van Loveren R. Tumors of the middle cranial fossa. In: Hanna EY, DeMonte F (eds). Comprehensive management of skull base tumors. New York: Informa Healthcare 2009 : 367 – 374.
88. Tzortzidis F, Elahi F, Wright DC, Temkin N, Natarajan SK, Sekhar LN. Patient outcome at long‑term follow‑up after aggressive microsurgical resection of cranial base chondrosarcomas. Neurosurgery 2006; 58(6): 1090 – 1098.
89. Hug EB, Slater JD. Proton radiation therapy for chordomas and chondrosarcomas of the skull base. Neurosurg Clin N Am 2000; 11(4): 627 – 638.
90. Noel G, Feuvert L, Ferrand R, Boisserie G, Mazeron JJ, Habrand JL. Radiotherapeutic factors in the management of cervical ‑ basal chordomas and chondrosarsomas. Neurosurgery 2004; 55(6): 1252 – 1260.
91. Krishnan S, Foote RL, Brown PD, Pollock BE, Link MJ, Garces YI. Radiosurgery for cranial base chordomas and chondrosarcomas. Neurosurgery 2005; 56(4): 777 – 784.
92. Barnes EL, Kapadia SB, Nemzek WR. Biology of selected skull base tumors. In: Janecka IP, Tiedmann K(eds). Skull Base Surgery: Anatomy, Biology, and Technology. Philadelphia, PA: Lippincott ‑ Raven 1997 : 263 – 292.
93. Larson TC 3rd, Houser OW, Laws ER jr. Imaging of cranial chordomas. Mayo Clin Proc 1987; 62(10): 886 – 893.
94. Šercl M, Klzo L. Báze lební – úskalí zobrazení. Ces Radiol 2007; 61(3): 304 – 307.
95. Meyers SP, Hirsch WL Jr, Curtin HD, Barnes L,Sekhar LN, Sen C. Chordomas of the skull base: MR features. AJNR Am J Neuroradiol 1992; 13(6): 1627 – 1636.
96. Colli BO, Al ‑ Mefty O. Chordomas of the skull base: follow‑up review and prognostic factors. Neurosurg Focus 201; 10(3): E1.
97. Chang SD, Martin DP, Lee E, Adler JR Jr. Stereotactic radiosurgery and hypofractionated stereotactic radiotherapy for residual or recurrent cranial base and cervical chordomas. Neurosurg Focus 2001; 10(3): E5.
98. Coffin CM, Swanson PE, Wick MR, Dehner LP. Chordoma in childhood and adolescence. A clinicopathologic analysis of 12 cases. Arch Pathol Lab Med 1993; 117(9): 927 – 933.
99. Borba LA, Al ‑ Mefty O, Mrak RE, Suen J. Cranial chordomas inchildren and adolescents. J Neurosurg 1996; 84(4): 584 – 591.
100. Forsyth PA, Cascino TL, Shaw EG, Scheithauer BW, O’Fallon JR, Dozier JC et al. Intracranial chordomas: a clinicopathological and prognostic study of 51 cases. J Neurosurg 1993; 78(5): 741 – 747.
101. Amendola BE, Amendola MA, Oliver E, McClatchey KD. Chordoma: role of radiation therapy. Radiology 1986; 158(3): 839 – 843.
102. Black P. Spinal metastasis: current status and recommended guidelines for management. Neurosurgery 1979; 5(6): 726 – 746.
103. Raskas DS, Graziano GP, Herzenberg JE, Heidelberger KP, Hensinger RN. Osteoid osteoma and osteonlastoma of the spine. J Spinal Discord 1992; 5(2): 204 – 211.
104. Fourney DR, Schomer DF, Nader R, Chlan ‑ Fourney J, Suki D, Ahrar K et al. Percutaneous vertebroplasty and kyphoplasty for painful vertebral body fractures in cancer patients. J Neurosurg 2003; 98 (Suppl 1): 21 – 30.
105. Hentschel SJ, Burton AW, Fourney DR, Rhines LD, Mendel E. Pecutaneous vertebroplasty and kyphoplasty performed at a cancer center: refuting proposed contraindications. J Neurosurg Spine 2005; 2(4): 436 – 440.
106. Schwartz TH, Rhiew R, Isaacson SR, Orazi A, Bruce JN. Association between intracranial plasmocytoma and multiple myeloma: clinicopathological outcome study. Neurosurgery 2001; 49(5): 1039 – 1044.
107. Crockard HA. Transoral approach to intra/ extradural tumors. In: Sekhar LN, Janecka IP (eds). Surgery of cranial base tumors. New York: Raven Press 1993 : 225 – 234.
108. Beals SP, Joganic EF, Spetzler RF. Classification of transfacial approaches in treatment of tumors of the anterior skull base and clivus. Plast Surg Forum 1993; 16 : 211 – 213.
109. Stippler M, Gardner PA, Snyderman CH, Carrau RL, Prevedello DM, Kassam AB. Endoscopic endonasal approach for clival chordomas. Neurosurgery 2009; 64(2): 268 – 277.
110. Fraser JF, Nyquist GG, Moore N, Anand VK, Schwartz TH. Endoscopic endonasal transclival resection of chordomas: operative technique, clinical outcome, and review of the literature. J Neurosurg 2010; 112(5): 1061 – 1069.
111. Komotar RJ, Starke RM, Raper DM, Anand VK, Schwartz TH. The endoscope ‑ assisted ventral approach compared with open microscope ‑ assisted surgery for clival chordomas. World Neurosurg 2011; 76(3 – 4): 318 – 327.
112. Vachata P, Sameš M. Posterolaterální transkondylární přístup do oblasti foramen magnum. Cesk Slov Neurol N 2002; 65/ 98(4): 250 – 255.
113. Zvěřina E, Kozák J. Současné možnosti chirurgie lební báze. Pracovní dny České neurochirurgické společnosti. Praha: Homolka 1991.
114. Vaverka M. Týden světové neurochirurgie v Praze – zpráva z kongresu. Cesk Slov Neurol N 2010; 73/ 106(5): 596 – 597.
115. Koos WT, Matula C, Lang J. Color Atlas of Microneurosurgery of Acoustic Neurinomas. New York: Thieme 2002 : 88 – 94.
116. Simpson D. The recurrence of intracranial meningiomas after surgical treatment. J Neurol Neurosurg Psychiatry 1957; 20(1): 22 – 39.
117. Meyer E. Mi3bildungen und angeborene Störungen. In: Busche KA, Glees P (eds). Chirurgie des Gehirns and Rückenmarks in Kindes - und Jugendalter. Stuttgart: Hippokrates 1968 : 948–991.
118. Kadish S, Goodman M, Wang C. Olfactory neuroblastoma: a clinical analysis of 17 cases. Cancer 1976; 37(3): 1571–1576.
119. House JW, Brackmann DE. Facial nerve grading system. Otolaryngol Head Neck Surg 1985; 93(2): 146–147.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2013 Issue 4-
All articles in this issue
- Skull Base Surgery
- Conus Medullaris Arteriovenous Malformation – a Case Report
- Acute Encephalitis Caused by Influenza B Virus – a Case Report
- Trigemino‑ Cardiac Reflex and its Variations
- Genetic and Environmental Factors Involved in the Pathogenesis of Multiple Sclerosis
- Neuropsychiatric View of Huntington‘s Disease
- Endoscopic Endonasal Resection of Skull Base Meningiomas
- A Set of High Name Agreement Pictures for Evaluation and Therapy of Language and Cognitive Deficits
- Validation of the Slovak version of the Movement Disorder Society – Unified Parkinson’s Disease Rating Scale (MDS‑ UPDRS)
- The Importance of Vestibular and Posturographic Evaluation in Patients with Vestibular Schwannoma
- The Role of MR Diffusion Weighted Imaging in the Differential Diagnosis of Spinal Cord Lesions
- Endovascular Treatment of Indirect Carotid‑ Cavernous Fistula Using Surgical Approach via Superior Ophthalmic Vein
- Augmented Cervical Stabilisation for Failed Fixation in Patients with Severe Osteoporosis – Two Case Reports
- Dysembryoplastic Neuroepithelial Tumor and its Atypical Variant in Children – Case Reports
- Thalamic Germinoma in a Child with Symptoms of Precocious Pseudopuberty – a Case Report
- Difficulties Diagnosing Progressive Multifocal Leukoencephalopathy in Patients Infected with the Human Immunodeficiency Virus – Case Reports
- Guillain‑Barré Syndrome Associated with Breast Cancer Treated with Trastuzumab – a Case Report
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Difficulties Diagnosing Progressive Multifocal Leukoencephalopathy in Patients Infected with the Human Immunodeficiency Virus – Case Reports
- Skull Base Surgery
- Neuropsychiatric View of Huntington‘s Disease
- Acute Encephalitis Caused by Influenza B Virus – a Case Report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


