-
Medical journals
- Career
Hyperkinetická porucha/„Attention Deficit Hyperactivity Disorder“ u dětských pacientů s epilepsií
Authors: P. Cahová; J. Pejčochová; H. Ošlejšková
Authors‘ workplace: Klinika dětské neurologie LF MU a FN Brno
Published in: Cesk Slov Neurol N 2011; 74/107(2): 157-162
Category: Review Article
Overview
Hyperkinetická porucha/„Attention deficit hyperactivity disorder“ (HKP/ADHD) se řadí mezi neurovývojové poruchy. Je charakterizována věku nepřiměřenou mírou nepozornosti, impulzivity a hyperaktivity. HKP/ADHD je jednou z relativně častých komorbidit u dětí s epilepsií. Symptomy této poruchy se u dětí s epilepsií vyskytují až ve 30–40 % případů. Výsledky studií ukazují, že u dětí s HKP/ADHD lze nalézt epileptiformní grafoelementy v EEG v 6–51 % případů. Co se týká komorbidního výskytu HKP/ADHD, nelze se spokojit s hypotézou pouhé náhodné koincidence. Kognitivní a behaviorální změny u pacientů s epilepsií byly dříve vysvětlovány následky opakovaných záchvatů a vlivy antiepileptické medikace. Naopak u řady pacientů symptomatika HKP/ADHD předchází časově rozvoji záchvatů. Nástup záchvatů je výsledkem komplexního procesu epileptogeneze, který zahrnuje řetězec transkripčních změn zasahujících na úrovni plasticity, apoptózy a neurogeneze. Všechny tyto změny mohou ovlivňovat behaviorální a kognitivní profil ještě před rozvojem klinických záchvatů. Patofyziologie HKP/ADHD je vysvětlována poruchou na úrovni prefronto-thalamo-striato-kortikálních neuronálních okruhů. A právě frontální lalok je důležitý pro pochopení společného neurobiologického substrátu HKP/ADHD a epilepsie.
Klíčová slova:
hyperkinetická porucha – ADHD – epilepsie – epilepsie frontálního laloku – dětské absence – BERSÚvod
Hyperkinetická porucha/Attention Deficit Hyperactivity Disorder (HKP/ADHD) se řadí mezi neurovývojové poruchy. Je charakterizována věku nepřiměřenou mírou nepozornosti, impulzivity a hyperaktivity. Postihuje děti již od raného věku a ve 40–50 % [1] přechází do dospělého věku. HKP/ADHD je jedna z častých komorbidit u dětí s epilepsií. Komorbidní výskyt obou těchto diagnóz není jasně vysvětlen. Vzhledem k jejich četnosti se nelze spokojit s hypotézou náhodné koincidence. Patofyziologicky lze předpokládat genetickou poruchu na úrovni vyzrávání CNS vedoucí jak k epileptiformní aktivitě v EEG, tak ke kognitivním a behaviorálním změnám [2]. Výskyt HKP/ADHD u pacientů s epilepsií nesmí být opomíjen. HKP/ADHD významně snižuje kvalitu života těchto pacientů a negativně ovlivňuje úroveň jejich dosažených školních výsledků a dovedností.
Autoři textu se snaží blíže vysvětlit patofyziologické souvislosti koincidenčního výskytu HKP/ADHD a epilepsie, dále se zaměřují na epileptické syndromy, které bývají nejčastěji spojeny s HKP/ADHD.
Diagnostická kritéria HKP/ADHD
Diagnostická kritéria hyperkinetické poruchy vychází z MKN-10 [3], kde jsou rozlišovány dva subtypy: porucha pozornosti a hyperaktivita (F90.0) a hyperkinetická porucha chování (F90.1) (tab.1, 2). Pro diagnózu je nutné, aby byly přítomny všechny jádrové příznaky, a to porucha pozornosti, hyperaktivita a impulzivita. Porucha se musí manifestovat před sedmým rokem věku a musí trvat alespoň šest měsíců. Pokud se k jádrovým příznakům hyperkinetické poruchy přidají i poruchy chování (agresivita, kriminální činy, sociální nepřizpůsobivost atd.), mluvíme o hyperkinetické poruše chování (F90.1), která vyžaduje odlišný terapeutický algoritmus a z pohledu sociální adaptace je závažnější.
Table 1. Diagnostická kritéria HKP (MKN-10) vs ADHD (DSM-IV). 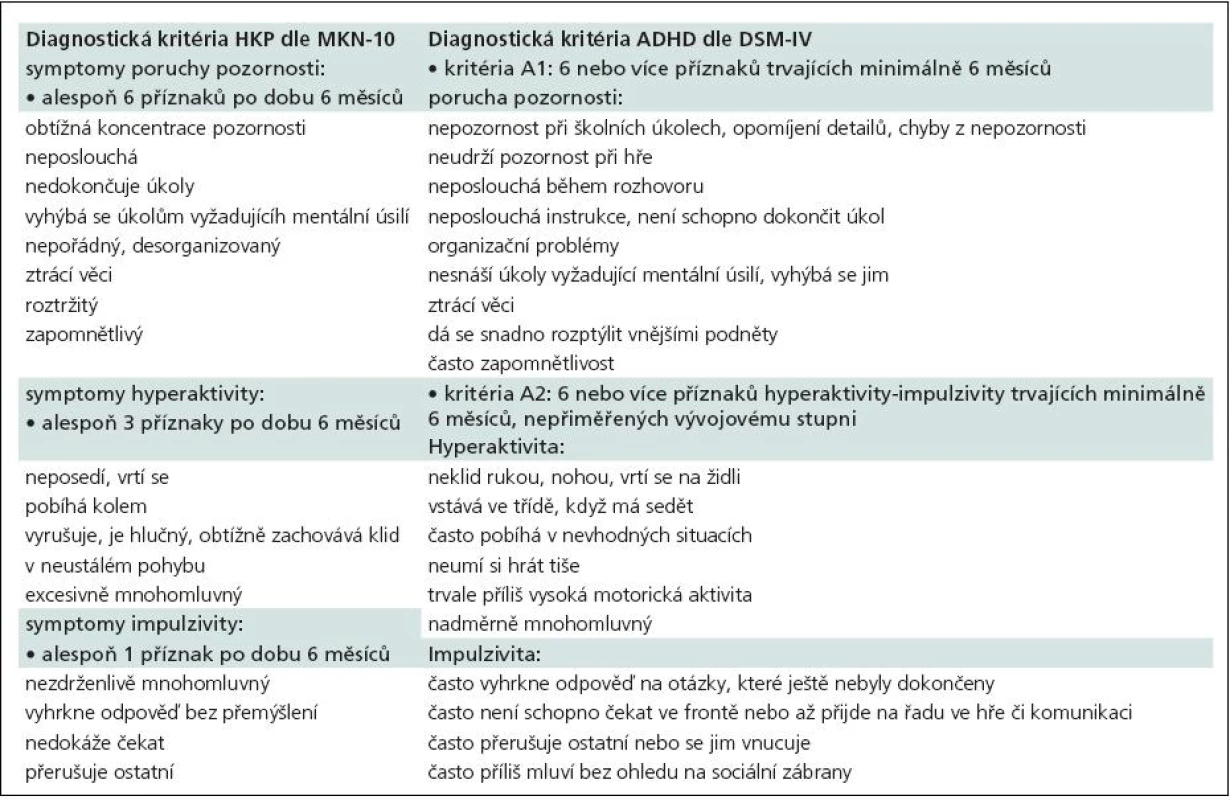
Table 2. Klasifikace HKP (MKN-10) vs ADHD (DSM-IV). 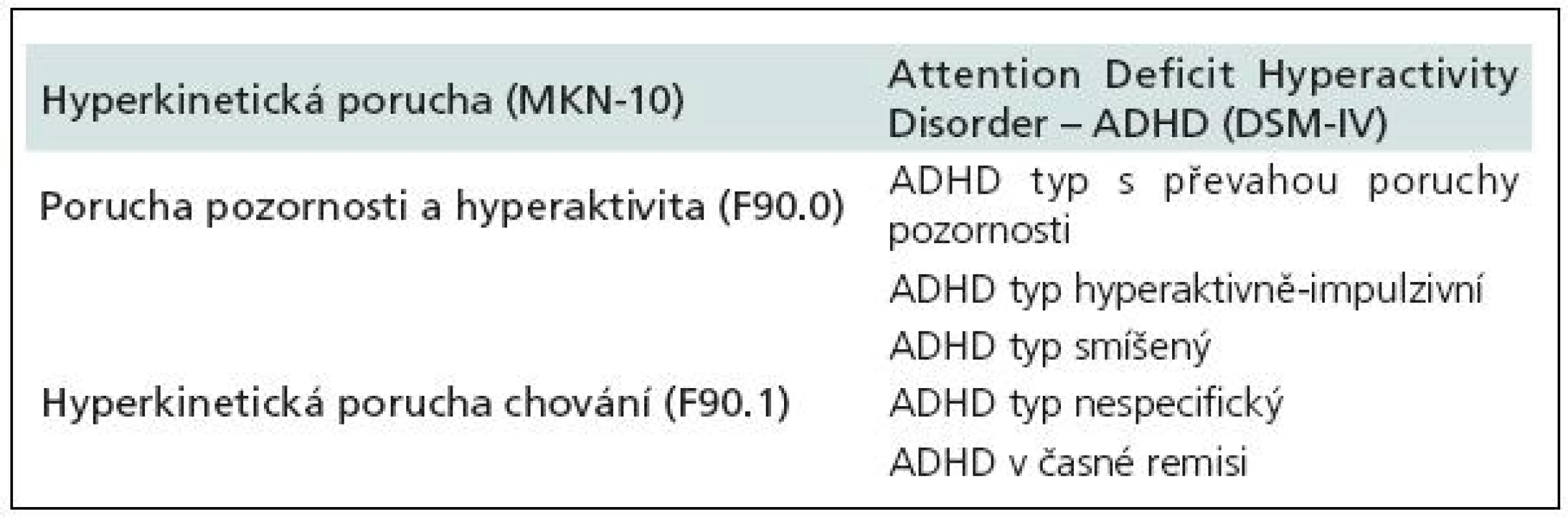
V současnosti hojně používaný termín ADHD (Attention Deficit Hyperactivity Disorder) vychází z amerických diagnostických manuálů. Ve svých diagnostických kritériích využívá jiné členění subtypů a v tomto směru je diagnostika ADHD o něco méně „přísná“ ve srovnání s HKP. DSM-IV [4] definuje ADHD odlišně a rozlišuje tři subtypy: ADHD s převládající poruchou pozornosti (ADHD Inattentive type), ADHD s převládající hyperaktivitou a impulzivitou (ADHD Hyperactivity/Impulsivity type) a ADHD smíšený typ (ADHD Combined type) (tab. 1–3). Zásadní rozdíl oproti klasifikaci dle MKN-10 je, že pro diagnostiku není nutná přítomnost všech jádrových příznaků. Podmínkou diagnózy je nutnost výskytu některých jádrových příznaků již před sedmým rokem věku, některé příznaky se objevují na dvou či více místech (např. doma či ve škole) a musí být zohledňován i aspekt sociální. DSM-IV klasifikace ADHD se oproti MKN-10 klasifikaci HKP liší i tím, že nezahrnuje poruchy chování jako součást ADHD, neexistuje tedy analogie diagnózy F90.1 jako v MKN-10 klasifikaci a pacienti s ADHD a poruchami chování jsou vedeni pod dvojí diagnózou. Právě odlišnosti v tomto členění jsou příčinou vyšší incidence ADHD ve Spojených státech amerických a způsobují jisté rozpaky a nepřesnosti při srovnávání výsledků našich studií s výsledky studií designovaných dle kritérií DSM-IV.
Table 3. Klasifikace ADHD (DSM-IV) dle diagnostických kritérií. 
Autoři se dále soustředí na výskyt a klinické rysy epilepsie bez ohledu na využití klasifikačního schématu HKP, resp. ADHD. Proto je termín HKP/ADHD používán současně. V citacích je terminologie zachována dle záměru autora původní práce.
Epidemiologie současného výskytu HKP/ADHD a epilepsie
Již v roce 1955 publikoval Ounsted [5] práci, kde dává do souvislosti výskyt poruchy pozornosti jako součásti hyperkinetické poruchy a epilepsie. S dalším rozvojem pohledu a klasifikačních schémat ADHD se objevily další práce [6,7], jež využívají u pacientů s ADHD klasifikačního schématu DSM-IV a zjišťují signifikantně vyšší výskyt ADHD v této skupině pacientů s nejpočetnějším zastoupením subtypu s poruchou pozornosti.
Dle výsledků různých studií jsou symptomy HKP/ADHD přítomny u 30–40 % pacientů s epilepsií [7–9]. Dle Salpekara et al [10] se dokonce ADHD řadí mezi nejčastější psychiatrickou komorbiditu u pacientů s epilepsií. U pacientů s HKP/ADHD lze nalézt epileptiformní aktivitu v EEG v 6–53 % [11–13]. Prediktivní hodnota epileptiformní EEG abnormality ve vztahu k následnému rozvoji klinických záchvatů u pacientů s ADHD je 14 % [11].
Neurobiologické aspekty v patogenezi HKP/ADHD a epilepsie
V současné době je pro pochopení patofyziologie HKP/ADHD přijímána hypotéza prefronto-striato-thalamo-kortikálního okruhu. Z pohledu exekutivních funkcí rozlišujeme v neuroanatamicko-fyziologickém pojetí v zapojení frontálního laloku s oblastí bazálních ganglií tři okruhy [14]:
- dorzolaterální okruh (dorzolaterální prefrontální kortex – nucleus caudatus dorsolateralis – globus pallidum lat. dorsomedialis – thalamus ventralis anterior a mediodorsalis), jehož poškození vede k rozvoji dorzolaterálního syndromu (postižení exekutivních kognitivních funkcí s projevy mentální a motorické perseverace, poruchy provádění komplexních cílených činností, motorického programování, snížená plynulost řeči, poruchy řešení problému, poruchy paměti a učení).
- orbitofrontální okruh (laterální orbitální kortex – nucleus caudatus ventromedialis – globus pallidum med. dorsomedialis – thalamus ventralis anterior a mediodorsalis), jehož poškození vede k rozvoji prefrontálního syndromu s emoční labilitou a desinhibicí v chování.
- přední cingulátový (mediofrontální) okruh (přední cingulum – nucleus accumbens – globus pallidum rostrolateralis – thalamus mediodorsalis), jehož poškození vede k rozvoji apatie až akinetického mutizmu.
Právě poruchy neurotransmise vyskytující se v zapojení prefronto-stirato-thalamo-kortikálního okruhu hrají významnou roli v etiopatogenezi HKP/ADHD. V roce 1970 byla vyslovena Kortenskym katecholaminová hypotéza hyperaktivity. Noradrenalin a dopamin se ukázaly hlavními neurotransmitery uplatňujícími se v patogenezi HKP/ADHD. Tato hypotéza byla upevňována výsledky celé řady studií využívajících funkční zobrazení CNS a podpořena také efektem dopaminergních a noradrenergních psychofarmak v terapii HKP/ADHD. Výsledky zobrazovacích a funkčních studií poukazují na hypofunkční katecholaminovou projekci z oblasti bazálních ganglií do prefrontálního kortexu. V neurotransmiterové oblasti se tato dysfunkce projevuje jako relativní hypoaktivita kortikálního dopaminového systému s relativní hyperaktivitou striatálního dopaminu. Jedinci s HKP/ADHD mají hypoaktivitu kortikálního dopaminového systému (nižší tonický dopamin) a hyperaktivitu striatálního dopaminu (zvýšený fyzický dopamin).
Prefrontální oblasti a funkce s těmito oblastmi asociované, jako je kontrola pozornosti či impulzivity, nedozrávají dříve než v období rané dospělosti [15]. Tento fakt je zásadní pro pochopení neurovývojového aspektu HKP/ADHD. HKP/ADHD jako porucha nastupuje před sedmým rokem věku, první známky lze pozorovat již v kojeneckém období. Průběh HKP//ADHD mění svůj klinický obraz i tíži vyjádření současně se zráním mozku jedince. U poloviny případů HKP/ADHD dochází ke spontánnímu ústupu kolem 12. roku věku. Ve 40–60 % případů však porucha přetrvává do dospělosti [16].
Tato „čistá forma“ HKP/ADHD se nezabývá aspekty EEG či výskytu klinicky manifestních epileptických záchvatů. Prevalence HKP/ADHD v dětské populaci je 3–7 % [17], a jak bylo uvedeno výše, u 30–40 % pacientů s epilepsií je pozorována symptomatika HKP/ADHD. Vzhledem k této četnosti komorbidního výskytu HKP/ADHD a epilepsie by bylo odvážné považovat jejich současný výskyt za pouhou náhodnou koincidenci. Jaký je ale vztah mezi symptomy HKP/ADHD a epilepsií, zůstává otázkou.
Epileptická aktivita, která se vyskytuje v kortikálních oblastech funkčně asociovaných s exekutivními funkcemi, může zapříčiňovat rozvoj symptomů HKP/ADHD. Pokud nastupuje v kritickém vývojovém stadiu CNS, může interferovat se zráním mozku a poškozovat vyvíjející se kortikální sítě [18]. Tuto hypotézu podporují i výsledky studií, které hodnotí lokalizaci EEG patologie u pacientů s HKP//ADHD. Silvestri et al [13] prokazují u pacientů s ADHD výskyt epileptiformní aktivity v EEG nejčetněji v centrotemporální oblasti (28,2 %), dále frontálně (12,5 %), zastoupena je i lokalizace fokusu v oblasti okcipitální (9,3 %) a generalizoavné výboje byly zastoupeny 2,3 %. Na Klinice dětské neurologie FN Brno bylo retrospektivně hodnoceno 135 pacientů ve věku 6–18 let s HKP a s výskytem či bez výskytu komorbidní epilepsie. U 60 z nich byla zachycena specifická epileptická aktivita v EEG. V této skupině byl nejčetnější výskyt generalizovaných výbojů u 18 pacientů (30 %), dále u 17 pacientů (28 %) frontálně, u osmi pacientů (13 %) centrotemporálně, u 16 pacientů (27 %) temporálně a u jednoho pacienta (2 %) okcipitálně [19]. Vysvětlení, proč lze u pacientů s HKP/ADHD nalézt fokální epileptiformní grafoelementy i v jiných oblastech než temporálních či okcipitálních, může být složitější. Lze předpokládat, že šíření epileptické aktivity ovlivňuje komplexnější neuronální okruhy a ty jsou schopny zahrnout i oblast frontálního laloku, event. lze přijmout i hypotézu, že určitá část komorbidních epilepsií s HKP/ADHD může být opravdu koincidencí.
Druhou otázkou zůstává, jaký je vztah manifestní epilepsie a HKP/ADHD symptomatiky. Dlouhou dobu byly kognitivní a behaviorální změny typické pro klinický obraz HKP/ADHD u pacientů s epilepsií připisovány především následkům opakovaných epileptických záchvatů, vlivu antiepileptické medikace či podstatě epilepsie jako onemocnění samotného [20,21]. Proti těmto tvrzením byl podán důkaz, že antiepileptika nejsou hlavní příčinou kognitivních a behaviorálních změn u pacientů s epilepsií [22] a že délka klinicky vyjádřené epilepsie či doba vzniku prvního záchvatu neovlivňuje obraz ADHD [23]. Symptomy ADHD předcházejí klinickou manifestaci epilepsie až u 82 % dětí [8]. Existují neurovývojové abnormality, jež předcházejí rozvoj záchvatů a mají vztah k vývoji ADHD a asociovaných komorbidit [8]. Cortez et al předložili důkaz, že nástup spontánních epileptických záchvatů je výsledkem komplexního procesu epileptogeneze, jež zahrnuje kaskádu transkripčních změn odstartovanou interakcí genetických faktorů a faktorů prostředí. Tyto transkripční změny zasahují do procesů plasticity, apoptózy a neurogeneze. Tyto všechny mohou ovlivnit kognitivní a behaviorální změny již před vlastním rozvojem klinických záchvatů [24].
Z výše uvedeného vyplývá, že klinická manifestace symptomů HKP/ADHD je častěji vázána s epileptickými syndromy asociovanými s frontálním lalokem. Jedná se především o epilepsii frontálního laloku (FLE) a benigní epilepsii s centrotemporálními hroty (BERS, BECTS). Další významnou skupinou jsou idiopatické generalizované epilepsie (IGE). Zde se předpokládá patofyziologický podíl abnormálních thalamo-kortikálních okruhů, které aktivují patologické oscilační rytmy a generují generalizované epileptiformní EEG výboje. Předpokládá se propojení thalamu s kortikálními oblastmi (thalamokortikální okruhy) právě v oblasti frontálního laloku [25].
V poslední době se objevuje celá řada studií, jež předpokládají patofyziologický podíl mozečku v rozvoji HKP/ADHD. U dětí s ADHD byl zjištěn signifikantně menší objem mozečkových hemisfér [26] a snížený objem vermis cerebella [27,28]. Podíl mozečku na patofyziologii ADHD je nesporný a ukazuje se, že mozeček je silně zapojen do kognitivních a afektivních procesů [29–31]. Jak ve skupině pacientů s ADHD, tak ve skupině pacientů s ADHD a epilepsií byla zjištěna nižší frakční anizotropie (FA) (pomocí difuzní MR) v oblasti pravého středního mozečkového pedunklu, tedy oblasti která je funkčně zapojena do kortiko-ponto-cerebelárního okruhu [32]. Tento deficit může vést k defektní transmisi signálu z prefrontálních oblastí do mozečku, vedoucí k symptomatice ADHD. Protože ve skupině ADHD i ADHD/epilepsie byla zjištěna nižší FA v identických oblastech mozečku, lze předpokládat, že podíl mozečku na patofyziologii ADHD je u obou skupin pacientů stejný. Výsledky této studie ukazují, že podíl mozečku na procesu epileptogeneze u pacientů s ADHD prokázán nebyl.
Epileptické syndromy asociované s HKP/ADHD
Epilepsie frontálního laloku (FLE)
Prefrontální oblasti hrají klíčovou úlohu v neuronálních okruzích zodpovědných za exekutivní funkce a chování. Epileptiformní výboje lokalizované v oblasti frontálního laloku mohou interferovat s vývojem těchto funkčních okruhů [33]. Ve studii 16 pacientů s epilepsií frontálního laloku ve věku 8–16 let byl prokázán kognitivní a behaviorální deficit kvalitativně srovnatelný s FLE u dospělých. Děti s FLE vykazovaly obtíže v otázkách motorické koordinace, plánování komplexních motorických úkolů, ve vizuo-prostorové organizaci, tenacitě pozornosti, inhibici odpovědi, plánování a schopnosti řešit úkoly [34]. Prevost et al [35] prokazují symptomy ADHD u 14 dětských pacientů s FLE v souboru 21 dětí. Významným faktem je, že celá řada pacientů s nonlezionální FLE může vykazovat poruchy v těchto oblastech a u těchto pacientů kontrola záchvatů nezaručí i zlepšení v oblasti symptomů ADHD [35].
Idiopatické generalizované epilepsie – dětské absence (CAE)
Dětské absence se řadí mezi benigní dětské epileptické syndromy, míra spontánní remise je vysoká. Z hlediska neurokognitivního a behaviorálního je CAE prognosticky závažnější. U dětí s absencemi jsou pozorovány potíže v pozornosti verbální i vizuální, zejména ve složce vytrvalosti [36–38]. Caplan et al [39] prokázali v souboru 69 dětí s CAE výskyt lehkého kognitivního deficitu v 25 %, poruch řeči v 43 % a 61 % pacientů splnilo diagnostická kritéria dle DSM-IV pro ADHD či úzkostnou poruchu. Symptomy těchto poruch byly v korelaci s délkou trvání a frekvencí absencí. Jen malá část pacientů s ADHD či úzkostnou poruchou měla adekvátní psychiatrickou terapii. Nejčastější subtyp ADHD u dětí s CAE je ADHD – subtyp s poruchou pozornosti [7,39]. Kognitivní a behaviorální změny jsou závažnější u pacientů s nástupem CAE před čtvrtým rokem věku [38].
Epilepsie s centrotemporálními hroty („rolandické epilepsie“)
Skupina epilepsií s centrotemporálními hroty je zvolena čistě topograficky, nevychází z aktuálně platné ILAE klasifikace epileptických syndromů. Zahrnuje pacienty s epileptickými syndromy či pacienty s EEG patologií, pro něž je společná lokalizace EEG patologie v oblasti centrotemporální (rolandické). U těchto pacientů bývá často vyjádřen kognitivní deficit a behaviorální změny [40–45]. Výskyt centrotemporálních hrotů v EEG u pacientů s HKP/ADHD je popisován v 3,7–5,6 % případů [40]. Jejich epileptogenicita je nízká, 2–10 % nositelů této patologie vyvine klinické záchvaty [43]. Kromě pacientů s „náhodným nálezem“ EEG patologie v centrotemporální oblasti, která se nemanifestuje klinicky epileptickými záchvaty, je nutno uvést i pacienty s epileptickými syndromy, pro které je lokalizace v rolandické oblasti typická až patognomická. Hroty v centrotemporální oblasti nacházíme u pacientů s benigní dětskou epilepsií s rolandickými hroty (BERS//BECTS), která je v ILAE klasifikaci řazena do skupiny fokálních, idiopatických věkově vázaných epilepsií. Další významnou skupinou jsou pacienti s atypickou benigní parciální epilepsií (Pseudo-Lennox syndromem), která dosud v ILAE klasifikaci své místo nemá. A v neposlední řadě je třeba uvést pacienty s Landau-Kleffner syndromem (dle ILAE klasifikace epileptických syndromů je řazen do skupiny epilepsií nezařazených – fokálních či generalizovaných), se syndromem fragilního chromozomu X a Rettovým syndromem, kde lze v EEG patologii lokalizovat do centrotemporální oblasti [43].
Benigní dětská epilepsie s rolandickými hroty (BERS//BECTS)
Benigní epilepsie s rolandickými hroty se řadí mezi nejčastější epileptické syndromy v dětském věku. Podle International Classification of Epilepsies and Epileptic Syndromes (Commission on Classification and terminology of the ILAE 1989) [46] je BERS řazena mezi věkově vázané epileptické syndromy manifestující se mezi 3–13 lety věku dítěte s normálním psychomotorickým vývojem. Považuje se díky dobré prognóze za benigní epilepsii, je dobře kontrolovatelná antiepileptickou medikací a spontánně remituje v adolescenci.
U pacientů s BERS je ADHD diagnostikováno signifikantně dříve než u pacientů bez centrotemporálních hrotů, vykazují více vyjádřenou hyperaktivně-impuzivní symptomatiku. Předpokládá se, že centrotemporální EEG patologie může nejasným mechanizmem snižovat práh citlivosti, způsobovat tak časnější nástup a těžší průběh ADHD. U pacientů s BERS je také zjištěn signifikantní deficit pozornosti. Důležité je, že míra poruchy pozornosti není závislá na frekvencí epileptiformních výbojů v bdělém stavu či četnosti záchvatů [42,44]. Naopak lateralizační aspekt může být významný a právě lokalizace centrotemporálních hrotů pravostranně či bilaterálně je častěji spojena s poruchou pozornosti [42]. Předpokládá se funkční dysbalance mezi hemisférami způsobená epileptiformními výboji. Lateralizační aspekty je však nutno brát obezřetně, poněvadž právě u pacientů s BERS je často pozorována alterace fokusu z jedné hemisféry na druhou.
Aktivace epileptiformní aktivity v EEG ve spánku a její možná sekundární generalizace u pacientů s BERS může významně ovlivňovat kognitivní deficit a vizuálně-percepční schopnosti. Je zodpovědná za signifikantně nižší celkový inteligenční skór dle WISC-III testu, slabší vizuomotorickou koordinaci, nonverbální krátkodobou paměť a udržení pozornosti [45]. Snížení frekvence epileptiformní aktivity ve spánku, ať již spontánně, či po nasazení antiepileptické medikace, může zlepšit neuropsychologický profil pacientů s BERS, a to dokonce do takové míry, že je poté srovnatelný s kontrolní skupinou [45].
Spánkové epileptické syndromy
Spánek může být významným aktivátorem epileptiformních grafoelementů v EEG. Právě aktivace specifické patologie u pacientů s BERS může být spoluzodpovědná za kognitivní deficit a behaviorální změny, jak bylo již uvedeno v předchozím odstavci. Frekventní epileptiformní výboje ve spánku, které lze zaznamenat např. u pacientů s CSWS (se syndromem s kontinuálními komplexy hrot-vlna v synchronním spánku) mohou narušovat neurální okruhy a zasahovat do procesů učení a kognitivních funkcí [46]. Další významnou skupinou jsou pacienti s noční epilepsií frontálního laloku (NFLE). Ta vychází z orbitofrontálních a mediálních oblastí frontálního laloku a je často asociována s ADHD [47].
Nelze opomenout ani fakt, že spánková EEG patologie a noční epileptické záchvaty snižují kvalitu spánku, oddalují nástup první REM fáze a vedou k defragmentaci spánku [48]. Tyto faktory bezesporu vedou k denní ospalosti, jež se může především u dětí manifestovat paradoxně hyperaktivitou a také poruchou pozornosti.
Závěr
U pacientů s epilepsií se nezřídka setkáváme se symptomy hyperkinetické poruchy/ADHD. Není dosud jednoznačně vysvětleno, jaké jsou společné patofyziologické mechanizmy. Současné znalosti a výsledky výzkumů nás vedou k pochopení prefronto-striato-thalamo-kortikálních okruhů jako možných příčinných mechanizmů a řada epileptických syndromů s frontálním lalokem spojených tuto hypotézu podporuje. Jaký je podíl epilepsie či EEG patologie na klinickém vyjádření a prognóze HKP/ADHD, je v současné době předmětem zájmu mnoha studií. Právě pochopení komplexnosti těchto patofyziologických spojitostí nám umožní správně diagnostikovat a vést terapii, která může být pro pacienta s HKP/ADHD a epilepsií zásadní a v nemalé míře se podílí na socioekonomických aspektech těchto komorbidních diagnóz.
MUDr. Pavlína Cahová
Klinika dětské neurologie
LF MU a FN Brno
Černopolní 9
613 00 Brno
e-mail: pavlina.cahova@seznam.czPřijato k recenzi: 17. 9. 2010
Přijato do tisku: 5. 10. 2010
Sources
1. Drtílková I, Šerý O et al. Hyperkinetická porucha. ADHD. 1st ed. Praha: Galén 2007.
2. Piccirilli M, D’Alessandro P, Sciarma T, Cantoni C, Dioguardi MS, Giuglietti M et al. Attention problems in epilepsy: possible significance of the epileptogenic focus. Epilepsia 1994; 35(5): 1091–1096.
3. Mezinárodní klasifikace nemocí. Duševní poruchy a poruchy chování. Popisy klinických příznaků a diagnostická vodítka. 10. revize. Praha: Psychiatrické centrum 2000.
4. American Psychiatric Association. Diagnostic and Statistic Manual of Mental Disorders, 4th ed (DSM-IV). Washington DC: American Psychiatric Association 1994.
5. Ounsted C. The hyperkinetic syndrome in epileptic children. Lancet 1955; 269(6885): 303–311.
6. Hesdorffer DC, Ludvigsson P, Olafsson E, Gudmundsson G Kjartansson O, Hauser A. ADHD as a risk factor for incident unprovoked seizures and epilepsy in children. Arch Gen Psychiatry 2004; 61(7): 731–736.
7. Dunn DW, Austin JK, Harezlak J, Ambrosius WT. ADHD and epilepsy in childhood. Dev Med Child Neurol 2003; 45(1): 50–54.
8. Hermann B, Jones J, Dabbs K, Chase AA, Sheth R, Fine J et al. The frequency, complications and aetiology of ADHD in new onset pediatric epilepsy. Brain 2007; 130(12): 3135–3148.
9. Thome-Souza S, Kuczynski E, Assumpcao F Jr, Rzezak P, Fuentes D, Fiore L et al. Which factors may play a pivotal role on determining the type of psychiatric disorder in children and adolescents with epilepsy? Epilepsy Behav 2004; 5(6): 988–994.
10. Salpekar JA, Dunn DW. Psychiatric and psychosocial consequences of pediatric epilepsy. Semin Pediatr Neurol 2007; 14(4): 181–188.
11. Richer LP, Shevell MI, Rosenblatt BR. Epileptiform abnormalities in children with attention-deficit hyperactivity disorder. Pediatr Neurol 2002; 26(2): 125–129.
12. Hughes JR, DeLeo AJ, Melyn MA. The electroencephalogram in attention-deficit hyperaktivity disorder: emphasis on epileptiform discharges. Epilepsy Behav 2000; 1(4): 271–277.
13. Silvestri R, Gagliano A, Calarese T, Arico I, Cedro C, Condurso R et al. Ictal and interictal EEG abnormalities in ADHD children recorded over night by video-polysomnography. Epilepsy Res 2007; 75(2–3): 130–137.
14. Ambler Z, Bednařík J, Růžička E. Klinická neurologie – 1. část obecná. Praha: Triton 2004.
15. Bedard AC, Nichols S, Barbosa JA. The development of selective inhibitory control across the life span. Dev Neuropsychol 2002; 21(1): 93–111.
16. Medřická H, Kunčíková M, Novák V. ADHD. Neurol pro Praxi 2007; 8(4): 219–221.
17. Barkley RA. Attention-deficit hyperaktivity disorder: a handbook for diagnosis and treatment. 3rd ed. New Your: The Guilford Press 2006.
18. Deonna T, Zesiger P, Davidoff V, Maeder M, Mayor C, Roulet E. Benign partial epilepsy of childhood: a longitudinal neuropsychological and EEG study of cognitive function. Dev Med Chil Neurol 2000; 42(9): 595–603.
19. Cahová P, Pejčochová J, Ošlejšková H. The occurrence of epileptiform activity on EEG and epilepsy in children with hyperkinetic disorder: a retrospective study. Proceedings of the 9th European Congress on Epileptology; 2010; Rhodes, Greece. Epilepsia 2010; 51 (Suppl 4): 1–189.
20. Aldenkamp AP, Arends J, Overwg-Plandsoen TC, van Bronsvijk KC, Schyns-Soeterboek A, Linden I et al. Acute cognitive effects of nonconvulsive difficult-to-detect epileptic seizures and epileptiform electroencephalographic discharges. J Child Neurol 2001; 16(2): 119–123.
21. Semrud-Clikeman M, Wical B. Components of attention in children with complex partial seizures with and without ADHD. Epilepsia 1999; 40(2): 211–215.
22. Bourgeois BF. Antiepileptic drugs, learning, and behavior in childhood epilepsy. Epilepsia 1998; 39(9): 913–921.
23. Deltour L, Barathon M, Quagliano V, Vernier MP, Despretz P, Boucart M et al. Children with benign epilepsy with centrotemporal spikes (BECTS) show impaired attentional control: evidence from an attentional capture paradigma. Epileptic Disord 2007; 9(1): 32–38.
24. Cortez MA, Perez Velazques JL, Snead OC III. Animal models of epilepsy and progressive effects of seizures. Adv Neurol 2006; 97 : 293–304.
25. Meencke HJ. Pathological findings in childhood absence epilepsy. In: Duncan JS, Panayiotopoulos CP (eds). Typical absences and related epileptic syndromes. London: Churchill Communications Europe 1995 : 122–132.
26. Castellanos FX, Lee PP, Sharp W, Jeffries NO, Greenstein DK, Clasen LS et al. Developmental trajectories of brain volume abnormalities in children and adolescents with attention-deficit/hyperactivity disorder. JAMA 2002; 288(14): 1740–1748.
27. Hill DE, Yeo RA, Campbell RA, Hart B, Vigil J, Brooks W. Magnetic resonance imaging correlates of attention-deficit/hyperactivity disorder in children. Neuropsychology 2003; 17(3): 496–506.
28. Mackie S, Shaw P, Lenroot R, Pierson R, Greenstein DK, Nugent TF III et al. Cerebellar development and clinical outcome in attention deficit hyperactivity disorder. Am J Psychiatry 2007; 164(4): 647–655.
29. Ben-Yehudah G, Guediche S, Fiez JA. Cerebellar contributions to verbal working memory: beyond cognitive theory. Cerebellum 2007; 6(3): 193–201.
30. Willcutt EG, Doyle AE, Nigg JT, Faraone SV, Pennington BF. Validity of the executive function theory of attention-deficit/hyperactivity disorder: a meta-analytic review. Biol Psychiatry 2005; 57(11): 1336–1346.
31. Roessner V, Becker A, Banaschewski T, Rothenberger A. Executive functions in children with chronic tic disorders with/without ADHD: new insights. Eur Child Adolesc Psychiatry 2007; 16 (Suppl 1): 36–44.
32. Bechtel N, Kobel M, Penner I-K, Klarhofer M, Scheffler K, Opis K et al. Decreased fractional anisotropy in the middle cerebellar peduncle in children with epilepsy and/or attention deficit/hyperacitivty disorder: A preliminary study. Epilepsy Behav 2009; 15(3): 294–298.
33. Ben-Ari Y, Holmes GL. Effects of seizures on developmental processes in the immature brain. Lancet Neurol 2006; 5(12): 1055–1063.
34. Hernandez MT, Sauerwein HC, Jambaque I, De Guise E, Lussier F, Lortie A et al. Deficits in executive functions and motor coordination in children with frontal lobe epilepsy. Neuropsychologia 2002; 40(4): 384–400.
35. Prevost J, Lortie A, Nguyen D, Lassonde M, Carmant L. Nonlesional frontal lobe epilepsy (FLE) of childhood: clinical presentation, response to treatment and comorbidity. Epilepsia 2006; 47(12): 2198–2201.
36. Henkin Y, Sadeh M, Kvity S, Shabtai E, Kishon-Rabin L, Gadoth N. Cognitive function idiopathic generalised epilepsy of childhood. Dev Med Child Neurol 2005; 47(2): 126–132.
37. Nolan MA, Redoblado MA, Lah S, Sabaz M, Lawson JA, Cunningham AM et al. Memory function in childhood epilepsy syndromes. J Pediatr Child Health 2004; 40(1–2): 20–27.
38. Pavone P, Bianchini R, Trifiletti RR, Incorpora G, Pavone L, Parano E. Neuropsychological assessment in children with absence epilepsy. Neurology 2001; 56(8): 1047–1051.
39. Caplan R, Siddarth P, Stahl L, Lanphier E, Vona P, Gurbani S et al. Childhood absence epilepsy: behavioral, cognitive, and linguistic comorbidities. Epilepsia 2008; 49(11): 1838–1846.
40. Holtmann M, Becker K, Kentner-Figura B, Schmidt MH. Increased frequency of rolandic spikes in ADHD children. Epilepsia 2003; 44(9): 1241–1244.
41. Holtmann M, Matei A, Hellmann U, Becker K, Poustka F, Schmidt MH. Rolandic spikes increase impulsivity in ADHD – a neuropsychological pilot study. Brain Dev 2006; 28(10): 633–640.
42. Deltour L, Quaglino V, Barathon M, DeBroca A, Berquin P. Clinical evaluation of attentional processes in children with benign childhood epilepsy with centrotemporal spikes (BCECTS). Epileptic Disord 2007; 9(4): 424–431.
43. Stephani U, Carlsson G. The spectrum from BCECTS to LKS: The rolandic EEG trait – impact on cognition. Epilepsia 2006; 47 (Suppl 2): 67–70.
44. Deltour L, Barathon M, Quaglino V, Vernier MP, Despretz P, Boucart M et al. Children with benign epilepsy with centrotemporal spikes (BECTS) show impaired attentional control: evidence from an attentional capture paradigm. Epileptic Disord 2007; 9(1): 32–38.
45. Baglietto G, Battaglia FM, Nobili L, Totorelli S, DeNegri E, Nalevo MG et al. Neuropsychological disorders related to interictal epileptic discharges during sleep in benign epilepsy of childhood with centrotemporal or rolandic spikes. Dev Med Child Neurol 2001; 43(6): 407–412.
46. Nickels K, Wirrell E. Electrical status epilepticus in sleep. Semin Pediatr Neurol 2008; 15(2): 50–60.
47. Ryvlin P, Rheims S, Risse G. Nocturnal frontal lobe epilepsy. Epilepsia 2006; 47 (Suppl 2): 83–86.
48. Parisi P, Moavero R, Verrotti A, Curatolo P. Attention deficit hyperactivity disorder in children with epilepsy. Brain Dev 2010; 32(1): 10–16.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2011 Issue 2-
All articles in this issue
- Syndrom neklidných nohou
- Využití kombinace metod magnetické rezonance pro diagnostiku tumorů
- Hyperkinetická porucha/„Attention Deficit Hyperactivity Disorder“ u dětských pacientů s epilepsií
- Invazivní mykotické sinusitidy
- Hluboká mozková stimulace u nemocných s extrapyramidovými poruchami pohybu – stereotaktická procedura a intraoperační nálezy
- Operační léčba poranění peroneálního nervu
- Radioterapií indukované meningeomy
- Oboustranná neurochorioretinitis na podkladě syfilis u 33leté uživatelky pervitinu – kazuistika
- Neurodegenerácia asociovaná s pantotenátkinázou – kazuistika
- Progredující axonální senzitivně-motorická multifokální polyneuropatie u pacientky s chronickou hepatitidou C
- Náhle vzniklá dušnost jako příznak vedoucí k diagnóze amyotrofické laterální sklerózy – kazuistika
- Léčba kraniosynostóz remodelační technikou
- Pacient s Creutzfeldtovou-Jakobovou nemocí se sníženým prokrvením mozku na Tc-99 ECD SPECT v počátcích choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndrom neklidných nohou
- Operační léčba poranění peroneálního nervu
- Náhle vzniklá dušnost jako příznak vedoucí k diagnóze amyotrofické laterální sklerózy – kazuistika
- Invazivní mykotické sinusitidy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

