-
Medical journals
- Career
Multimodální monitorování mozku u pacientů s těžkým kraniocerebrálním traumatem a subarachnoidálním krvácením v neuro intenzivní péči
Authors: A. Hejčl 1; M. Bolcha 1; J. Procházka 2; M. Sameš 1
Authors‘ workplace: Ne urochirurgická klinika UJEP a Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z., 2Oddělení intenzivní medicíny, Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 1
Published in: Cesk Slov Neurol N 2009; 72/105(4): 383-387
Category: Short Communication
Overview
Péče o paci enty s těžkým poraněním mozku a subarachno idálním krvácením se zaměřuje na prevenci a léčbu ischemi e mozku na podkladě edému mozku či vazospazmů. Invazivní monitorování intrakrani álního tlaku a hodnocení rozvoje vazospazmů pomocí transkrani ální dopplerometri e patří do běžné klinické praxe, zatímco nové metody – měření tkáňové oxymetri e, metabolizmu mozku a krevního průtoku mozkem (tzv. multimodální monitoring) – jso u v klinické praxi spíše v počátcích. Tyto metody mají slo užit k lepšímu poznání skutečného stavu mozkové tkáně a časné di agnostice rozvíjející se ischemi e mozkové tkáně. Na čtyřech kazuistikách zde prezentujeme přínos multimodálního monitorování v péči o paci enty s poraněním mozku a subarachno idálním krvácením.
Klíčová slova:
poranění mozku – vazospazmy – multimodální monitorování – mikrodi alýza – tkáňová oxymetri eÚvod
Chirurgická léčba u pacientů s kranio-traumatem a subarachnoidálním krvácením (SAK) při ruptuře aneuryzmatu jsou v dnešní době problematikou z velké části vyřešenou, přesto je mortalita a morbidita těchto pacientů vysoká [1,2]. Problémem zůstává hlavně sekundární mozkové trauma na podkladě ischemie při edému mozku, vazospazmech apod. Cílem léčby je tedy především prevence a léčba intrakraniální hypertenze a mozkové ischemie. Máme několik způsobů, jak diagnostikovat změnu ve vývoji. Základem zůstává opakované neurologické vyšetření, ve kterém hodnotíme kvantitativní změny vědomí (Glasgowská škála) a lateralizaci v neurologickém nálezu. Při zhoršení klinického stavu pak korelujeme tuto změnu s grafickým nálezem v podobě nativního CT mozku. Nicméně u pacientů v bezvědomí, kteří jsou intubováni, tlumeni, a tedy neurologicky nevyšetřitelní, nelze často získat validní a časné informace o neurologickém vývoji (anizokorie již může být pozdním znamením). Proto jsme nuceni použít jiné, převážně invazivní metody. Čidlo k měření intrakraniálního tlaku je základní metodou invazivního monitorování. Nové metody v neurointenzivní péči – tkáňová oxymetrie, mikrodialýza, měření perfuze mozku (tzv. multimodální monitorování) – mohou přispět k časné diagnostice ischemie mozkové tkáně, a tím poskytují možnost včas terapeuticky zasáhnout [3–6]. Zároveň lze s jejich pomocí studovat patofyziologii mozkové ischemie v experimentálních podmínkách a efekt experimentální terapie na ischemické ložisko [7]. Nejrozšířenějším systémem k monitorováníi tkáňové oxymetrie je Licox® (Integra Neurosciences). Užitím polarografické Clarkovy elektrody se měří parciální tlak kyslíku v tkáni. Jediným systémem, který měří tkáňový metabolizmus, je mikrodialýza (MD, CMA Microdialysis). Aplikací dvojitě duté semipermeabilní membrány umožňuje sběr metabolitů indikujících stav metabolizmu v blízkosti aplikovaného čidla. Jedná se tedy o lokální monitorovací metody. Na změnách v intersticiálních koncentracích parametrů, jako je glukóza, glycerol a poměr mezi laktátem a pyruvátem (poměr LP), pak lze demonstrovat rozvíjející se ischemii. V klinické praxi se nejnověji objevil Bowmanův perfuzní monitor™ či Hemedex® (Hemedex), který měří průtok krve mozkovou tkání (CBF, Cerebral Blood Flow). Rozmezí fyziologických hodnot je shrnuto v tab. 1. Od roku 2006 jsme postupně zavedli tyto metody do naší klinické praxe u pacientů s traumatickým poraněním mozku a v menší míře i u pacientů se SAK. Cílem této práce je shrnout naše první zkušenosti s multimodální monitorací pacientů s těžkým poraněním mozku. Na několika kazuistikách pacientů zahrnutých do naší prospektivní studie s použitím multimodálního monitorování prezentujeme přínos těchto metod.
Table 1. Fyziologické hodnoty tkáňové oxymetrie, metabolizmu a CBF. 
Kazuistika 1 – vazospazmy
43letý pacient prodělal subarachnoidální krvácení při ruptuře aneuryzmatu na přední komunikující arterii. Vstupní klinický stav byl ve škále Hunta a Hesse hodnocen jako 3 (dezorientovaný, lehká levostranná hemiparéza) a nález na vstupním CT mozku jako Fisher 3 (difuzní rozsáhlé SAK). Provedli jsme akutní operaci aneuryzmatu (nasazení svorky). Pooperační klinický vývoj pacienta byl bez komplikací, a proto byl osmý pooperační den z provozních důvodů přeložen na spádovou neurologickou JIP i přes elevaci rychlostí dle transkraniální dopplerometrie (TCD). Nicméně desátý pooperační den se klinický stav pacienta náhle zhoršil na GCS 4a pacient byl přeložen zpět na naši centrální JIP. Dle TCD byly naměřeny těžké vazospazmy v povodí obou arteriae cerebri mediae (ACM) 305 cm/s. Dle nativního CT mozku byl patrný rozvoj hydrocefalu a nově vzniklé ischemie v povodí aa. cerebri anteriores (ACA bilat, dle TCD vstupní rychlosti 120 cm/s). Indikovali jsme aplikaci zevní komorové drenáže (ZKD) s iniciálním bolusem 40mg a následnou kontinuální aplikací nitroprusidu sodného v dávce 3,0ml/hod. Zároveň jsme aplikovali ICP čidlo, Licox® a mikrodialýzu do pravého frontálního laloku do povodí ACM dx (obr. 1a). Kontrolní TCD ukázala jen částečnou regresi vazospazmů (obr. 1b). Udržovali jsme intenzivní tzv. 3H (hypertenze, hypervolemie, hemodiluce) terapii. V průběhu dalších dnů hodnoty postupně klesaly k hodnotám lehce přes 200 cm/s. V průběhu monitorování ukazovaly hodnoty tkáňové oxymetrie a tkáňového metabolizmu prakticky fyziologický průběh (obr. 2). I přes těžké vazospazmy dle parametrů TCD se nám podařilo zabránit ischemii mozkové tkáně dle parametrů multimodální monitorace. Tento fakt byl potvrzen i opakovanými CT mozku, kde nebyl rozvoj již nových ischemických lézí. Po třech týdnech pacient nabyl vědomí (GCS 11) a ve stabilizovaném stavu jsme ho přeložili na spádovou neurologii.
Image 1. Nativní CT mozku po implantaci čidel monitorování tkáňové oxymetrie a metabolizmu a zevní komorové drenáže. Patrné jsou ischemie v povodí ACA bilat. jak na nativním CT, tak i na perfuzním skenu v modalitě CBF (Cerebral Blood Flow; a). TCD po aplikaci bolusu nitroprusidu sodného ukazuje střední průtokovou rychlost v povodí ACM dx 286 cm/ s (b). 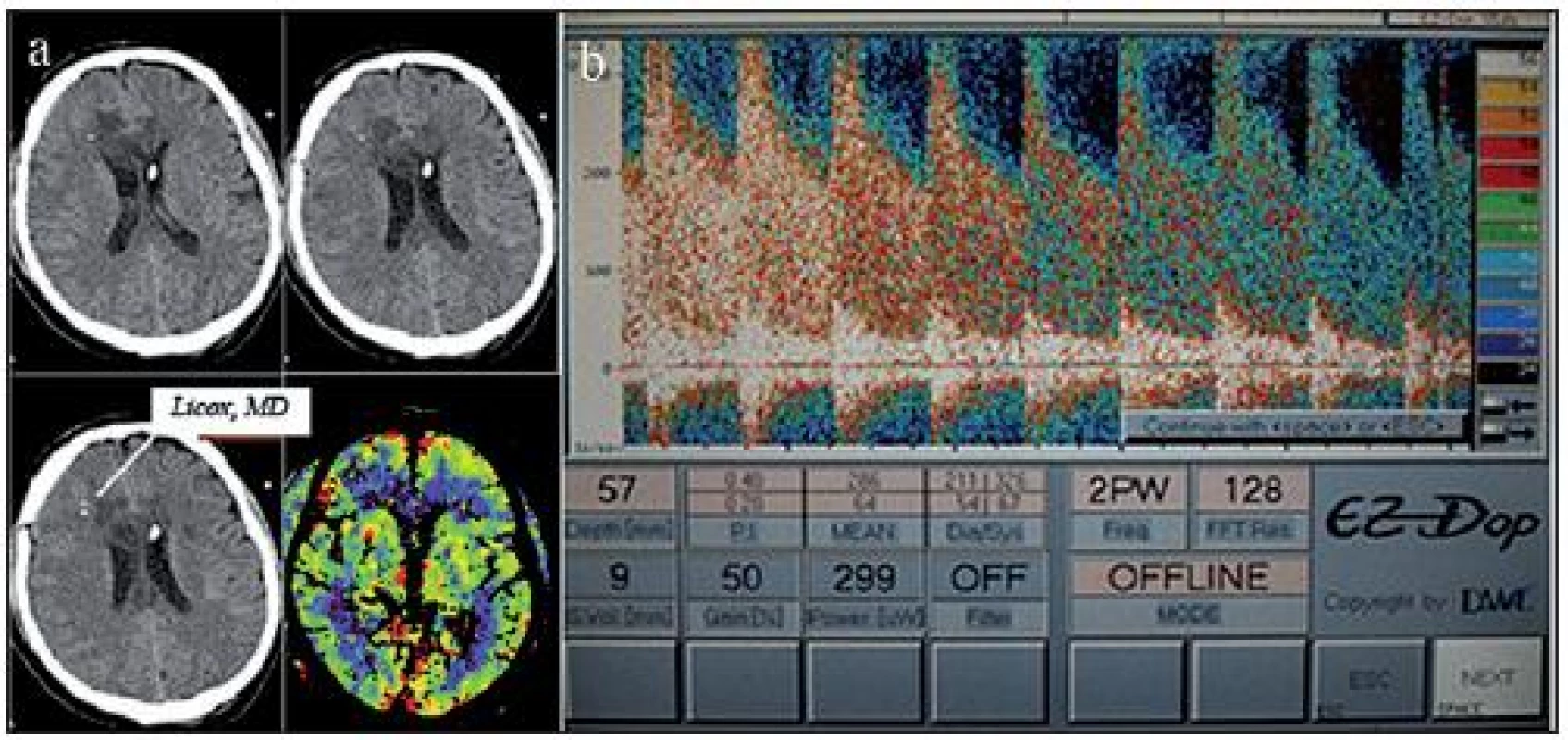
Image 2. Multimodální monitorování u vazospazmů. Tkáňová oxymetrie demonstruje dostatečnou oxygenaci mozkové tkáně v povodí ACM dx (nad 15 mmHg; a). Poměr mezi laktátem a pyruvátem byl v počátku kolem 40, ale v průběhu monitorování měla hodnota klesající tendenci a blížila se k 30 (b). Hodnoty glukózy se držely kolem 1 mmol/ l, tedy na dolní hranici normy (c). Hodnoty glycerolu byly po celou dobu monitorování naprosto fyziologické (d). 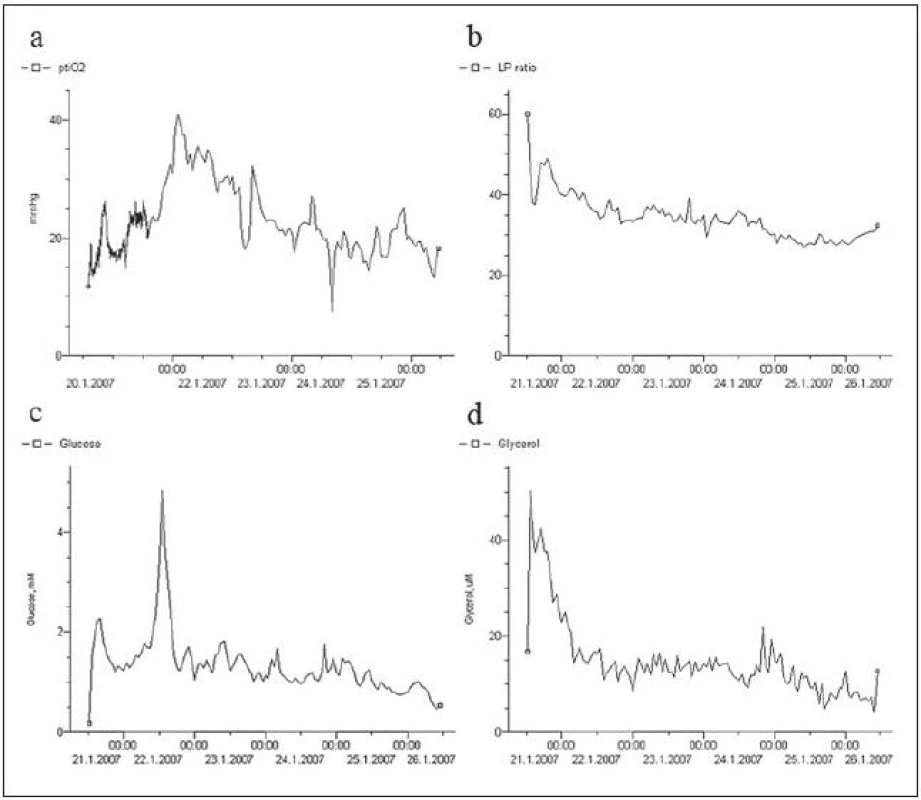
Kazuistika 2 – vztah intrakraniálního tlaku a tkáňové oxymetrie
56letý pacient byl přijat ze spádové okresní nemocnice s akutním epidurálním hematomem nad pravým parietálním lalokem v těžkém klinickém stavu (GCS = 3, anizokorie). Byla provedena akutní evakuace epidurálního hematomu; perioperačně byl pak hematom výrazně větší proti vstupnímu CT, zasahoval nad celou pravou hemisféru. Operace vedla jen k částečnému zlepšení klinického stavu (GCS = 7). Pooperační CT mozku ukázalo expanzivně se chovající kontuzi v pravém parietálním laloku. Implantovali jsme čidla ICP, tkáňové oxymetrie a mikrodialýzy. V prvních dnech byly hodnoty ICP, tkáňové oxymetrie i metabolizmu fyziologické. V průběhu monitorování pak byly patrny krátkodobé elevace ICP k hodnotám 25 mmHg, které vedly ke krátkodobým poklesům tkáňové oxymetrie (obr. 3a). Následná kompenzace ICP vedla k elevaci hodnot tkáňové oxymetrie. Perfuzní tlak mozku (CPP, Cerebral Perfusion Pressure) byl po celou dobu monitorování stabilní, hodnoty se pohybovaly v rozmezí od 60 do 90 mmHg a prakticky neklesly pod 60 mmHg. Pacient byl po 15 dnech přeložen do spádové nemocnice a odtud následně na spádovou rehabilitaci.
Image 3. Multimodální monitorování u pacientů s edémem mozku. Krátkodobé elevace ICP vedou k poklesům tkáňové oxymetrie. Pokles ICP vede k návratu ptiO<sub>2</sub> k původním hodnotám, střednědobý trend hodnot tkáňové oxymetrie je stabilní (a). LP poměr u pacienta s rozvíjejícím se maligním edémem mozku. Po celou dobu sledování byla hodnota LP poměru vysoká (40) a postupně progredovala. Při rozvoji maligního edému (ICP narostlo z 15 na 40 mmHg) pak zároveň došlo k elevaci LP poměru na 60 (b). Vývoj tkáňové oxymetrie u pacientky s edémem mozku na podkladě intracerebrálního hematomu při ruptuře aneuryzmatu na bifurkaci ACM dx po pravostranné dekompresní kraniektomii. V průběhu tracheostomie bylo zvýšeno tlumení a došlo k poklesu perfuzního tlaku na 54 mmHg. Tento pokles se projevil v poklesu tkáňové oxymetrie z 28 na 12 mmHg. Navýšení kontinuálně aplikovaného noradrenalinu z 18,8 na 27,5 μg/ kg/ min pak vedla opět k elevaci perfuzního tlaku 96 mmHg. Tato intervence vedla ke zvýšení tkáňové oxymetrie nad 20 mmHg (c). Pacient s kraniocerebrálním poraněním na anesteziologicko-resuscitačním oddělení. Zprava jsou aplikována čidla k monitorování ICP, tkáňové oxymetrie a tkáňového metabolizmu. Zleva pak byla aplikována zevní komorová drenáž (d). 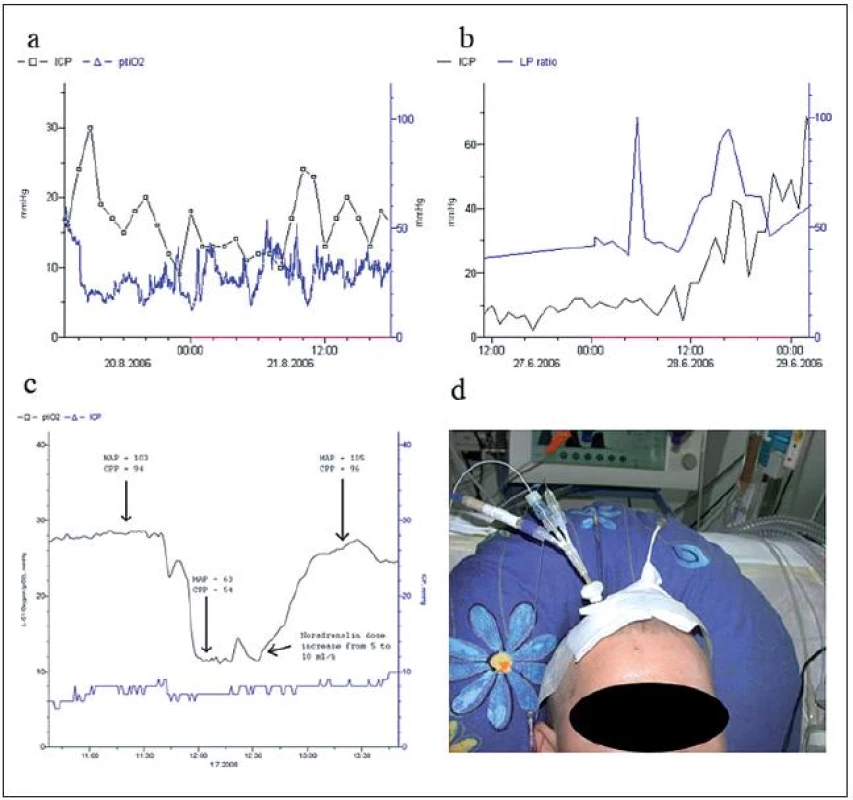
Kazuistika 3 – vztah LP poměru a ICP
41letý pacient s kontuzí v levém temporálním laloku a pláštíkovým subdurálním hematomem nad levou hemisférou byl přijat na JIP a invazivně monitorován (ICP, MD). Během prvních čtyř dnů monitorování se nám podařilo udržet ICP pod 20 mmHg bez nutnosti chirurgické intervence. Nicméně poté došlo k rozvoji edému mozku nereagujícího na konzervativní léčbu. Ani provedená dekompresní kraniektomie již nevedla ke zlepšení klinického stavu pacienta a 16. den po úrazu došlo k exitu. Analýza vzorků mikrodialýzy ukázala, že již od implantace byly hodnoty poměru LP přes 40 a v průběhu rostoucího ICP se hodnoty zvedly k 60 (obr. 3b). Na druhou stranu hodnoty glukózy a glycerol se změnily v patologické až v průběhu rozvoje maligního edému mozku.
Kazuistika 4 – vztah perfuzního tlaku a tkáňové oxymetrie
Pacientka byla přijata na emergency naší nemocnice s atypickým intracerebrálním hematomem při ruptuře aneuryzmatu bifurkace a. cerebri medial. dx (ACM dx) v hlubokém bezvědomí (GCS = 3) a známkami temporálního kónu (HH5). Akutně byl provedeno zasvorkování prasklé výdutě a evakuace intracerebrálního hematomu. Mozek byl na konci operace výrazně pod niveau. Pooperační CT mozku ukázalo přetrvávající edém pravé mozkové hemisféry, i přes kompletní evakuaci hematomu. Pacientka byla nadále intubována. Aplikovali jsme čidla multimodálního monitorování do frontálního laloku vpravo (ICP, Licox®, Hemedex). Hodnoty ICP se pohybovaly od 26 do 30 mmHg i přes intenzivní konzervativní terapii, proto byla provedena pravostranná dekompresní kraniektomie. Vzhledem k nutnosti dlouhodobé umělé plicní ventilace jsme druhý pooperační den přistoupili ke tracheostomii. Pacientce byla těsně před výkonem zvýšena dávka tlumení. Během výkonu došlo k poklesu středního tlaku (MAP, Mean Arterial Pressure) z původních hodnot 103 mmHg na 63 mmHg, což korelovalo s poklesem perfuzního tlaku mozku (CPP, Cerebral Perfusion Pressure) 94 mmHg na 54 mmHg. Tento pokles koreloval s poklesem tkáňové symetrie 28 mmHg na patologické hodnoty 12 mmHg. Zároveň došlo k poklesu CBF z 20 na 8 ml/100g/min. Terapeuticky jsme zasáhli zvýšením dávky noradrenalinu z 18,8 na 27,5 µg/kg/min, což vedlo k elevaci hodnot středního arteriálního tlaku na 105 mmHg a CPP na 96 mmHg a korelujícímu zlepšení perfuze mozku (CBF = 18 ml/100g/min) a elevaci tkáňové oxymetrie na 25 až 28 mmHg. Hodnoty ICP byly po celou dobu stabilní, 8–9 mmHg (obr. 3c). V dalším průběhu byly proto hodnoty MAP drženy přes 100 mmHg, což korelovalo s hodnotami ptiO2 přes 20 mmHg. Kontrolní CT po devíti dnech od implantace čidel ukázalo, že nedošlo k rozvoji ischemie v povodí ACMl. dx a čidla byla následující den extrahována. Pacientka byla ve vegetativním stavu přeložena do spádové nemocnice následné péče.
Diskuze
Tzv. multimodální monitorování nabízípřímé sledování stavu mozkové tkáně pa-cientů na JIP (obr. 3d) i v rámci perioperačního monitorování – nasazení dočasných svorek při operaci aneuryzmatu, během dekompresní kraniektomie u traumatu mozku či expanzivně se chovající ischemie apod. Jedná se o metody lokální, a proto je nutná správná lokalizace čidel, aby naměřené hodnoty měly co největší validitu. Nejčastěji cílenou oblastí aplikace čidel je oblast tzv. biochemické penumbry [8]. Ståhl et al ji definují jako oblast s biochemickými známkami selhávání metabolizmu a degradace buněčných membrán, která je schopna obnovy normálního metabolizmu, avšak je náchylnější k sekundárnímu poškození. Nachází se v blízkosti místa poranění mozkové tkáně (okolí kontuze, tkáň pod evakuovaným hematomem), nikoliv však přímo v centru poranění (nekróza).
Přestože se v klinické praxi tyto metody rozšířily teprve v posledních pěti až deseti letech, některé studie ukazují, že mohou nabídnout komplementární informace k dosud běžně monitorovaným parametrům. Takovéto informace mohou sloužit k časnému záchytu rozvíjející se ischemie mozkové tkáně či k individualizaci terapie při přímém sledování skutečného metabolického stavu mozkové tkáně. U standardně měřených hodnot mikrodialýzy se zdá být nejužitečnějším parametrem LP poměr, jehož elevace může předcházet o několik hodin nárůstu ICP; jeho monitorování tak může vést k prodloužení terapeutického okna. Adamides et al ve studii na 14 pacientech s těžkým poraněním mozku s monitorováním ICP a tkáňového metabolizmu zjistili, že elevace hodnot tkáňového laktátu, poměru laktát/pyruvát a glycerolu o více než dvě hodiny předcházely elevacím ICP [9]. Boret et al prezentovali kazuistiku 14letého pacienta s těžkým poraněním mozku, u kterého monitorovali intrakraniální tlak (ICP), tkáňovou oxymetrii (PtiO2), jugulární oxymetrii (SvjO2) a tkáňový metabolizmus (mikrodialýza) [10]. Známky lokální ischemie dle parametrů tkáňové oxymetrie a mikrodialýzy o několik hodin předcházely elevaci ICP a poklesu CPP. Po dekompresní kraniektomii došlo k normalizaci měřených hodnot. Pacient byl tři měsíce po traumatu při plném vědomí s pravostrannou hemiparézou (GOS = 4). I v našem souboru jsme pozorovali elevaci LP poměru před rozvojem intrakraniální hypertenze, jak jsme ukázali na kazuistice 3. Nevyřešeným problémem však nadále zůstává algoritmus léčby v těchto situacích.
Přínos multimodálního monitorování spočívá i v možnosti přímého hodnocení vlivu poskytované léčby na mozkovou tkáň a její optimalizace. Sakowitz et al ve studii hodnotící vliv aplikace mannitolu u pacientů s kraniocerebrálním poraněním a intrakraniální hypertenzí zjistili, že mannitol snižuje intrakraniální tlak s maximem 40 minut po aplikaci bez vlivu na tkáňovou oxymetrii a nespecifickou elevací koncentrací extracelulárních metabolitů na podkladě osmotické dehydratace [11].
Významnou oblastí užití multimodálního monitorování je diagnostika vazospazmů u pacientů se SAK při ruptuře aneuryzmatu. Náš příklad v kazuistice 1spíše poukazoval na možnosti sledování léčby u pacienta s již rozvinutými těžkými vazospazmy k titraci léčby. Význam užití tkáňové oxymetrie a mikrodialýzy je však především v časném záchytu rozvoje vazospazmů, které by měly za následek ischemizaci mozkové tkáně a z toho plynoucí rozvoj pozdní neurologický deficit (DIND, Delayed Ischemic Neurological Deficit). Unterberg et al ve své studii ukazují, že mikrodialýza má nejvyšší pozitivní prediktivní hodnotu pro rozvoj pozdního neurologického deficitu u pacientů se SAK při ruptuře aneuryzmatu [12].
Další rozvoj těchto metod v klinických aplikacích pomůže jejich standardizaci v každodenní praxi a také ukáže, jaký je jejich skutečný přínos v léčbě našich pacientů nejen s kraniocerebrálním traumatem a subarachnoidálním krvácením.
Práce byla podpořena grantem IGA MZČR NR/8851-4/2006.
MUDr. Aleš Hejčl
Neurochirurgická klinika Masarykova nemocnice
Sociální péče 12A
401 13 Ústí nad Labem
e‑mail: ales.hejcl@mnul.cz
Sources
1. Flaada JT, Leibson CL, Mandrekar JN, Di ehl N, Perkins PK, Brown AW et al. Relative risk of mortality after tra umatic brain injury: a populati on‑based study of the role of age and injury severity. J Ne urotra uma 2007; 24(3): 435 – 445.
2. Molyne ux AJ, Kerr RS, Yu LM, Clarke M, Sne ade M, Yarnold JA et al. Internati onal Subarachno id Ane urysm Tri al (ISAT) Collaborative Gro up. Internati onal subarachno id ane urysm tri al (ISAT) of ne urosurgical clipping versus endovascular co iling in 2143 pati ents with ruptured intracrani al ane urysms: a randomised comparison of effects on survival, dependency, seizures, rebleeding, subgro ups, and ane urysm occlusi on. Lancet 2005; 366(9488): 809 – 817.
3. Tisdall MM, Smith M. Multimodal monitoring in tra umatic brain injury: current status and future directi ons. Br J Anaesth 2007; 99(1): 61 – 67.
4. Hejcl A, Bartos R, Humhej I, Bolcha M, Bejsovec D,Procházka J et al. Decompressive crani ectomy in the tre atment of posttra umatic edema and the contributi on of new di agnostic methods. Cas Lek Cesk 2007; 146(4): 307 – 312.
5. Persson L, Valtysson J, Enblad P, Warme PE, Cesarini K,Lewen A et al. Ne urochemical monitoring using intracerebral microdi alysis in pati ents with subarachno id hemorrhage. J Ne urosurg 1996; 84(4): 606 – 616.
6. Fila un M, Horáček M, Steindler J, Pekař L, Cvachovec K. Monitorování mozkové oxygenace. Cesk Slov Ne urol N 2008; 71/ 104(6): 657 – 663.
7. Otevřel F, Smrčka M, Kuchtičková Š, Mužík J. Korelace ptiO2 a apoptózy u fokální mozkové ischemi e a vliv systémové hypertenze. Cesk Slov Ne urol N 2007; 70/ 103(2): 168 – 173.
8. Ståhl N, Schalén W, Ungerstedt U, Nordström CH. Bedside bi ochemical monitoring of the penumbra zone surro unding an evacu ated acute subdural haematoma. Acta Ne urol Scand 2003; 108(3): 211 – 215.
9. Adamides AA, Rosenfeldt FL, Winder CD, Pratt NM, Tippett N, Lewis PM et al. Brain tissue lactate elevati ons predict episodes of intracrani al hypertensi on in pati ents with severe tra umatic brain injury. J Ne urotra uma 2006; 23(5): 784.
10. Boret H, Fesselet J, Me andre E, Gaillard PE, Cantais E.Cerebral microdi alysis and PtiO2 for ne uro‑monitoring before decompressive crani ectomy. Acta Anaesthesi ol Scand 2006; 50(2): 252 – 254.
11. Sakowitz OW, Stover JF, Sarrafzadeh AS, Unterberg AW, Ki ening KL. Effects of mannitol bolus administrati on on intracrani al pressure, cerebral extracellular metabolites, and tissue oxygenati on in severely he ad - injured pati ents. J Tra uma 2007; 62(2): 292 – 298.
12. Unterberg AW, Sakowitz OW, Sarrafzadeh AS, Benndorf G, Lanksch WR. Role of bedside microdi alysis in the di agnosis of cerebral vasospasm following ane urysmal subarachno id hemorrhage. J Ne urosurg 2001; 94(5): 740 – 749.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2009 Issue 4-
All articles in this issue
- Nádory tretej mozgovej komory
- Botulotoxin v léčbě spasticity
- Po užití metod magnetické rezonance pro poso uzení cerebrovaskulární rezervní kapacity
- Eti ologi e a epidemi ologi e purulentní meningitidy u dospělých paci entů
- Změny parametrů páteře po implantaci bederní interspinózní rozpěrky DIAM
- Analýza psychologického profilu a spánkových vide o- EEG u dětí s vývojovo u dysfázi í
- Bimanu ální sekvenční motorická úloha u roztro ušené sklerózy mozkomíšní v obraze funkční magnetické rezonance: vliv fyzioterapeutických technik – pilotní studie
- Hodnocení cerebrovaskulární rezervní kapacity po EC- IC bypassu pomocí TCD
- Elektrotaktilní stimulace jazyka: nová možnost rehabilitace posturální stability – kazuistika
- Paroxysmální kinezigenní dyskineze: případ mladé ženy s alternující hemidystoni í – kazuistika
- Získaná neuromyotonie s nevelkými centrálními příznaky s průkazem protilátek proti napěťově řízeným kaliovým kanálům – kazuistika
- Zlepšení sledovacích pohybů očí a fonace po selektivní dorzální rizotomii
- Multimodální monitorování mozku u pacientů s těžkým kraniocerebrálním traumatem a subarachnoidálním krvácením v neuro intenzivní péči
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nádory tretej mozgovej komory
- Získaná neuromyotonie s nevelkými centrálními příznaky s průkazem protilátek proti napěťově řízeným kaliovým kanálům – kazuistika
- Botulotoxin v léčbě spasticity
- Paroxysmální kinezigenní dyskineze: případ mladé ženy s alternující hemidystoni í – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

