-
Medical journals
- Career
Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy
Authors: M. Vaněčková 1; Z. Seidl 1,2
Authors‘ workplace: Radiodiagnostická klinika, oddělení MR, 1. LF UK a VFN v Praze 1; Vysoká škola zdravotnická, Praha 2
Published in: Cesk Slov Neurol N 2008; 71/104(6): 664-672
Category: Review Article
Práce vznikla za podpory výzkumného záměru MZOVFN2005 a MSMOO21620849.
Overview
Práce je věnována úloze magnetické rezonance (MR) v di agnostice a nalézání patologicko anatomických korelátů u roztro ušené sklerózy mozkomíšní (RS). Magnetická rezonance je nejdůležitější z podpůrných vyšetřovacích metod pro di agnostiku RS. V práci je shrnut přehled měnících se MR kritéri í a srovnání jejich výtěžnosti. Jso u zde uvedeny techniky, které se po užívají k monitorování průběhu choroby a především k predikci progrese onemocnění. Tyto metodiky se dělí na konvenční MR, kam patří sledování objemu ložisek, měření úbytku mozkové tkáně a zjišťování přítomnosti poruchy hematoencefalické bari éry, a na nekonvenční MR. Mezi nekonvenční MR se řadí vyšetření s magnetizačním transferem, difuzně vážený obraz, spektroskopi e, perfuze, funkční magnetická rezonance a relaxometri e, z nichž některé jso u doposud užívány po uze experimentálně a jejich přínos pro klinicko u praxi není zcela jednoznačný, především vzhledem k časové náročnosti vyšetřovacího protokolu.
Klíčová slova:
roztroušená skleróza mozkomíšní – magnetická rezonance – diagnostická kritéria – atrofie – magnetizační transfer – difuzně vážený obraz – spektroskopie – perfuze – funkční magnetická rezonance – relaxometrieÚvod
V současné době má magnetická rezonance (MR) u roztroušené sklerózy mozkomíšní (RS) dvě základní role. V první řadě to je úloha diagnostická, kde je MR nejdůležitějším paraklinickým testem. Druhým úkolem je výzkum patofyziologických dějů, které probíhají u tohoto onemocnění. Nové techniky MR pomáhají lépe pochopit proces in vivo. S tím souvisí i vývoj postprocesingových zpracování MR obrazu, které umožňují monitorovat chorobu a především optimalizovat léčbu konkrétního pacienta.
1. Diagnostika RS
Hlavním úkolem MR je podpořit klinické podezření na RS a vyloučit jiná onemocnění (role diferenciálně diagnostická). Tato oblast během posledních dvou desetiletí prošla určitým vývojem, zpřesňovala se kritéria, zvažoval se optimální protokol pro vyšetření magnetickou rezonancí [1–4].
Zásadním mezníkem byla práce Patyho et al, kteří korelovali jednotlivé paraklinické testy a především porovnali detekci ložisek na počítačové tomografii (CT) s MR [2]. To vedlo k tomu, že se magnetická rezonance stala jednoznačně nejvhodnější zobrazovací metodou pro podporu diagnózy RS. V 80. letech proběhly studie, které korelovaly obraz na MR s pitevními patologickými nálezy a ukázaly, že patologická ložiska v T2 váženém obraze na MR korespondují s plakami RS na pitevních nálezech [5]. Základní protokol (konvenční MR v diagnostice RS) obsahoval T2 vážený obraz (konvenční spin‑echo), T1 vážený obraz nativně a po podání kontrastní látky, kdy kontrastní látka detekovala porušenou hematoencefalickou bariéru, která vypovídala o aktivitě choroby [6]. Tento základní protokol vyhovoval třem důležitým rolím MR: 1. podpora diagnostiky RS, 2. vyloučení jiných onemocnění a 3. možnost objektivně měřit změny v průběhu dané choroby a tím sledovat úspěšnost léčby. Pro první dvě je nutno podotknout, že MR je velmi senzitivní metoda, ale má nižší specificitu. Patologický proces u RS zahrnuje velké množství patologicko‑anatomických změn (zánět, demyelinizaci, axonální postižení a jejich ztrátu, reparativní mechanizmy, gliózu) [7,8]. MR je limitována v zobrazení těchto patologicko‑anatomických korelátů, což vyúsťuje v klinicko‑radiologický paradox [9,10]. Specificitu zvyšuje přítomnost některých znaků typických u RS – tzv. typického obrazu: léze oválné, uložené především periventrikulárně a juxtakortikálně (obr. 1), v corpus callosum, častý výskyt infratentoriálních lézí – zejména v pontu a mozečku (obr. 2). K základnímu protokolu MR mozku lze doplnit vyšetření páteře, kde jsou patologická ložiska pozorována především v krční míše a ložisko má být menší než výška dvou obratlů (obr. 3). Pro podporu diagnózy RS v obraze MR se užívala kritéria Fazekase (alespoň tři léze a splnění dvou následujících kritérií – buď jedno ložisko uložené infratentoriálně, nebo ložisko uložené periventrikulárně či ložisko větší než 6 mm [1]) a Patyho – čtyři léze nebo tři léze, z nichž alespoň jedna je periventrikulárně [2].
Image 1. FLAIR (Fluid Attenuated Inversion Recovery), na transverzálním řezu je patrný typický oválný tvar (Dawsonovy prsty) a distribuce ložisek u roztroušené sklerózy mozkomíšní. Jsou patrná vícečetná ložiska zvýšené intenzity signálu periventrikulárně, jedno ložisko je i juxtakortikálně. 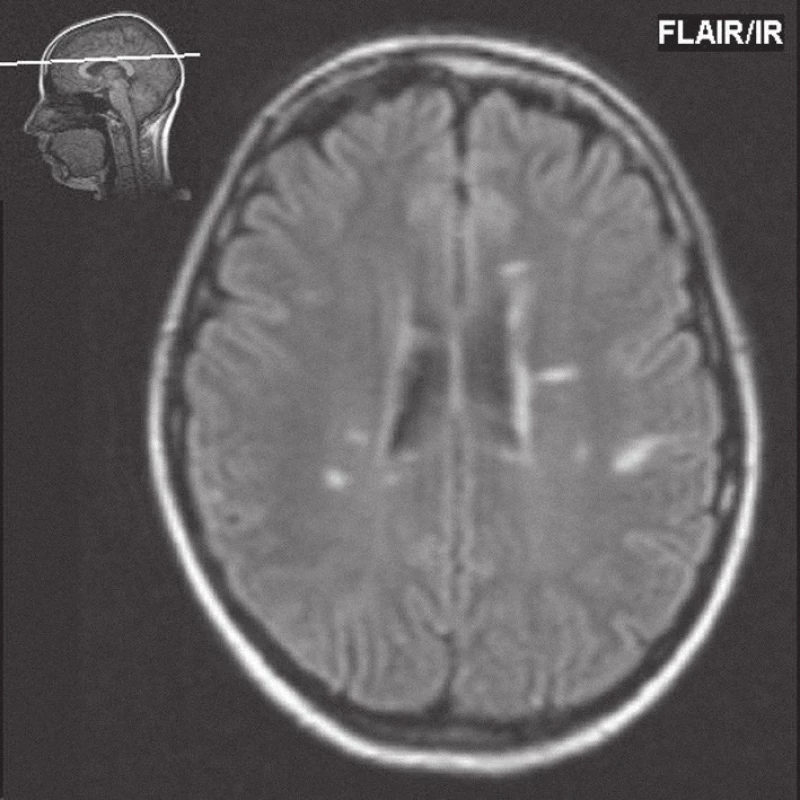
Image 2. T2W obraz, na transverzálním řezu jso u infratentoriálně patrná dvě ložiska zvýšené intenzity signálu, která odpovídají plakám. 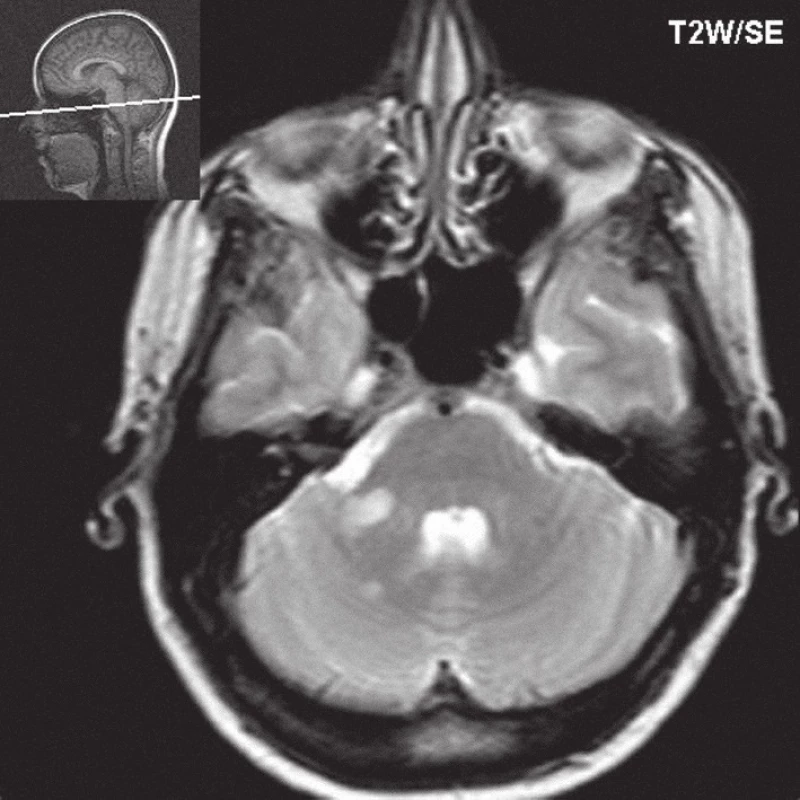
Image 3. T2W obraz, na sagitálním řezu je ve výši C1 obratle patrné intramedulárně ložisko zvýšené intenzity signálu, které odpovídá míšní place. 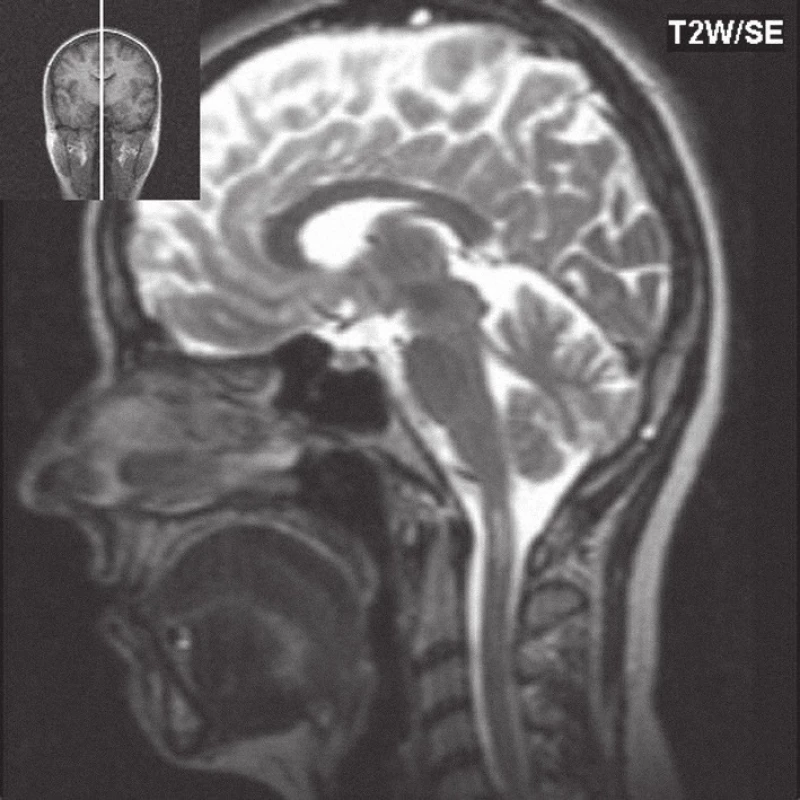
S rozvojem MR přístrojů se částečně měnil i protokol. V současné době se jako základní protokol provádí T2 vážený obraz (TSE – Turbo Spin Echo), FLAIR (Fluid Attenuated Inversion Recovery) a nativní a postkontrastní T1 vážený obraz, vše v transverzálních řezech. Při podezření na lézi intramedulárně se provádí MR páteře v sagitálních řezech v T2 váženém obraze. Nyní se začínají používat tzv. hlavokrční cívky, které jsou schopny vyšetřit s vysokou kvalitou i krční páteř, kde jsou plaky lokalizovány nejčastěji, a proto základní protokol obsahuje i T2 vážený obraz v sagitálních řezech. Sekvence FLAIR zlepšila detekci ložisek, vzhledem k potlačení signálu likvoru, periventrikulárně a juxtakortikálně [11–13]. Zobrazení v T2 váženém obraze je optimálnější pro detekci infratentoriálních lézí. V roce 2001 byla pro diagnostiku RS přijata McDonaldova kritéria, která kombinují klinický stav (ataky, objektivní léze) a pomocné vyšetřovací metody (MR, vyšetření likvoru a zrakové evokované potenciály) [14]. V roce 2005 Polman tato kritéria revidoval [15]. MR vyšetření sleduje dva aspekty: diseminaci v prostoru a diseminaci v čase. Tato kritéria navrhli Barkhof et al a Tintore et al [3,4]. Za pozitivní MR kritéria považujeme: diseminace v prostoru – splnění alespoň tří podmínek: 1. alespoň jedno ložisko, které zesiluje intenzitu signálu po podání kontrastní látky, nebo devět hyperintenzních ložisek v T2 váženém obraze; 2. alespoň jedno ložisko infratentoriálně; 3. alespoň jedno ložisko juxtakortikálně; 4. alespoň tři ložiska periventrikulárně; ložisko intramedulárně může být ekvivalentem k ložisku infratentoriálně; plaka lokalizovaná intramedulárně, která zesiluje intenzitu signálu po podání kontrastní látky je ekvivalentem ke stejně se chovajícímu ložisku intracerebrálně. Jakýkoliv počet intramedulárních ložisek může být zahrnut do celkového počtu (viz 1. kritérium), tab. 1. Diseminace v čase: (alespoň jedna podmínka) detekce zesílení intenzity signálu po podání kontrastní látky (enhancement) ložiska po třech či více měsících po první atace, které nekoresponduje topicky s neurologickými příznaky, nebo detekce nové plaky v T2 váženém obraze, který se objevil 30 či více dnů po první atace (tab. 2) [15]. Nejnovější kritéria, o nichž se v poslední době diskutuje a teprve se začínají používat v klinické praxi, jsou tzv. Nová kritéria [16]. Jejich výhodou je, že oproti kritériím McDonalda mají mnohem vyšší senzitivitu – 72 % (McDonald 2001 47 %, revidovaná McDonaldova k 60 %), při jen minimálně snížené specificitě 87 % (McDonald 2001 91 %, revidovaná McDonaldova 88 %) [17]. Tato „Nová kritéria“ umožňují u klinicky izolovaného syndromu stanovit dříve a s větší senzitivitou diagnózu klinicky definitivní RS než s využitím McDonaldových kritérií [17]. Pozitivní „Nová kritéria“ jsou následující – pro diseminaci v prostoru je třeba splnit následující: alespoň jedno ložisko v každé z alespoň dvou typických lokalizací (periventrikulárně, juxtakortikálně, v zadní jámě, intramedulárně). Ložiska, která jsou v mozkovém kmeni a míše a mají odpovídající klinickou symptomatologii, se nepočítají. Pro pozitivní diseminaci v čase je nutné alespoň jedno nové ložisko v T2 váženém obraze na následujícím vyšetření MR (tab. 3) [16,17].
Table 1. Revidovaná McDonaldova kritéri a (2005), pro pozitivní diseminaci v prostoru je nutné splnit alespoň tři podmínky 
Table 2. Diseminace v čase, nutno splnit alespoň jednu podmínku. 
Table 3. Nová kritéria (2006). 
2. Od konvenčních metod monitorování RS k experimentální metodice
Již od začátku, kdy se MR stala klíčovou pro určení klinicky definitivní RS, se uvažovalo o tom, zda by MR mohla pomoci při monitorování choroby a zda by nebyla schopna předvídat její zhoršení v budoucnosti. Nejprve se pro tyto změny používala detekce poruchy hematoencefalické bariéry po podání kontrastní látky, ať už v obvyklých dávkách (0,1 mmol/kg), obr. 6c [6,18], nebo až v trojnásobné dávce (0,3 mmol/kg) [19]. Počet zesílených (enhanced) ložisek vzrůstá krátce před relapsem nebo během něho a predikuje následnou aktivitu [20]. Naopak počet zesílených plak je nízký u primárně progresivní formy [21]. Udává se střední korelace mezi stupněm klinického postižení a frekvencí enhancujících ložisek u remitentní a sekundárně progresivní formy RS [22]. Dále byly vytvořeny postprocesingové techniky na určování objemu ložisek (zjišťoval se tzv. lesion load), nejprve v T2 váženém obraze, dále i v sekvenci FLAIR (obr. 4) [20,23,24]. Vzhledem k široké škále patologických procesů, jejichž korelátem v MR je hypersignální ložisko v T2 váženém obraze nebo v FLAIR (zánět, demyelinizace, axonální postižení, reparativní mechanizmy, glióza) je korelace těchto metod s klinickým stavem jen nízká (klinicko‑radiologický paradox) [8,9,13,25]. Proto se začala provádět volumometrie hyposignálních ložisek v T1 váženém obraze, tzv. black holes, kde je korelace silnější [26], a měření atrofie mozku. Nejprve se zjišťoval celkový úbytek mozku, později se určoval tzv. BPF (Brain Parenchymal Fraction), obr. 5 [27,28], či frakcionované měření objemu šedé a bílé hmoty [29]. Obě nás především informují o postižení a ztrátě axonů [7]. Všechny výše uvedené metody monitorování patří mezi tzv. konvenční MR techniky, které se začínají v rutinní praxi využívat pro sledování choroby, i když, jak jsme poznamenali výše, mají značné limitace [30–34]. Jejich výhodou je, že se stávají běžně užívanými a že pro MR vyšetření není potřeba provádět další sekvence, než je nutné pro diagnostickou MR. Pouze je nutné provádět tenčí řezy (jsou postačující řezy o tloušťce 3 mm) [25]. Myslíme si, že pro rutinní praxi by bylo lepší pacienty na začátku léčby rozdělit podle parametrů na MR; určit, který je pro ně během prvních let léčby klíčový a ten dále sledovat (například u pacientů, kteří mají velký „lesion load“ – LL – v T2 váženém obraze a u nichž se domníváme, že převažují zánětlivé procesy, sledovat „lesion load“ v T2 váženém obraze; naopak u těch s malým LL a jen s jeho minimální změnou, sledovat atrofii mozku, či objem černých děr) [35,36].
Image 4. FLAIR, transverzální řez, technika volumometrie patologických ložisek (plak). Vyšrafovány červeně jsou oblasti, které dosahují určité prahové hodnoty signálové intenzity (po aplikaci filtrů a morfologických operací), z nich je spočítán objem. Zde byl objem 11,3 cm<sup>3</sup>. 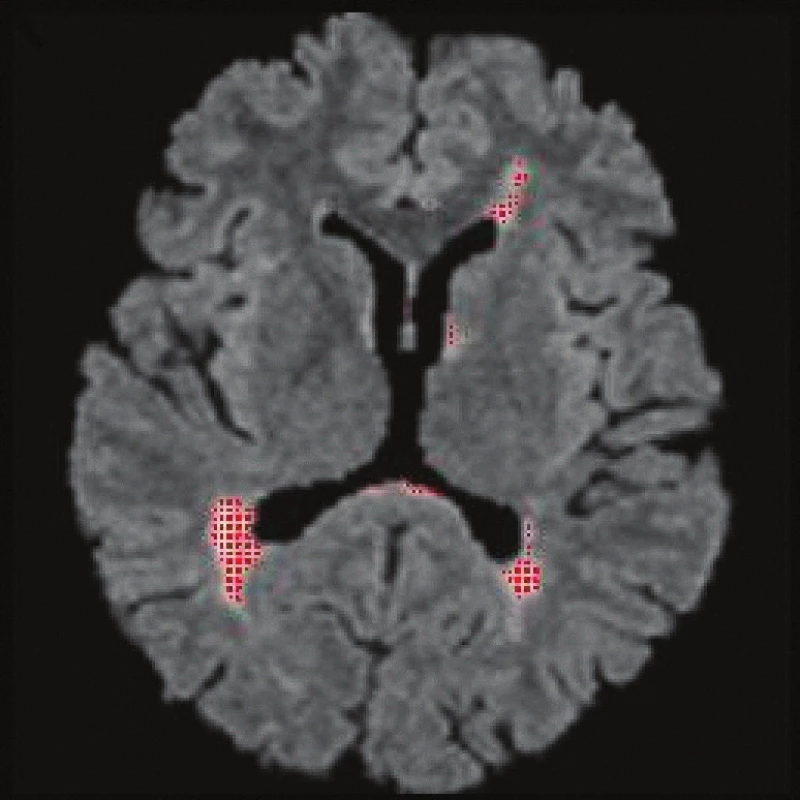
Image 5. Technika určování BPF (Brain Parenchymal Fraction), což je poměr objemu mozkové tkáně (zde vyšrafován červeně) ku objemu mozku + likvorových prostor (modrá kontura). Hodnota BPF byla 84,92. 
Obr. 6a. T2W obraz, na transverzálním řezu jso u patrná dvě ložiska (plaky) v blízkosti frontálního rohu levé postranní komory. 
Obr. 6b. T1W s MTC off resonance, při frontálním rohu levé postranní komory je patrné ložisko zvýšené intenzity signálu (šipka). Druhé ložisko, které bylo patrné v T2W obraze, se zde nezobrazilo, odpovídá tedy nejspíše place staršího data, změněné v gliovou jizvu. 
Obr. 6c. T1W s podáním kontrastní látky (Gd- DTPA), na transverzálním řezu je patrné zesílení intenzity signálu tvaru neúplného prstence (typický u RS), toto ložisko se zobrazilo i v T1W s MTC, což podporuje naší hypotézu o aktivním charakteru plak, které se zobrazí na T1W s MTC (šipka). 
Vzhledem k tomu, že toto konvenční MR zobrazení nedostatečně vysvětluje široké spektrum patologických dějů u RS, vyvíjejí se tzv. nekonvenční MR techniky, které se snaží tyto jednotlivé patologické děje ozřejmit. Například konvenční zobrazení nezohledňuje děje, které probíhají v bílé hmotě, když v ní nejsou makroskopicky viditelná patologická ložiska (užívá se zkratka NAWM – Normal-Appearing White Matter) [37,38]. Ty mohou určovat tzv. kvantitativní, strukturální MR techniky: zobrazení s magnetizačním transferem (MT) [39] (obr. 6b), difuzně vážený obraz (DWI) [39,40], MR spektroskopie. Informuje nás o tom i měření atrofie.
Nevýhodou těchto nekonvenčních metod je délka vyšetření. U základního tzv. diagnostického protokolu činí přibližně 20 min (záleží na typu přístroje), při užití konvenčního MR zobrazení je jen minimální časový nárůst vzhledem k tenčím řezům (celkový čas vyšetření je okolo 30 min). Při provedení všech výše zmíněných technik přesáhne doba vyšetření délku jedné hodiny, což je jak z ekonomického hlediska, tak i vzhledem k možnému diskomfortu pacienta při vyšetření neúnosné.
Magnetizační transfer (MT)
Zobrazení MR s magnetizačním transferem (MT) využívá změny kontrastu po aplikaci specifického prepulzu, který ovlivňuje soubory volných a vázaných protonů. Každá tkáň obsahuje obě formy. Po aplikaci prepulzu dojde k saturaci jednoho souboru protonů, což vede k narušení rovnováhy a k ustavení nové rovnováhy. To má za následek snížení magnetizace v druhém souboru [37,41]. V mozku tyto dva soubory korespondují s protony tkáňové tekutiny (soubor volných protonů) a s protony v makromolekulách myelinu a dalších buněčných membránách (soubor vázaných protonů). MT mimo rezonanci (off-resonance) využívá rozdílu šíře pásma rezonančních frekvencí volných a vázaných protonů; po aplikaci radiofrekvenčního prepulzu, který se liší o delta od úzkého frekvenčního rezonančního pásma volné vody, dojde k selektivní saturaci vázaných protonů. Stupeň ztráty signálu závisí na hustotě makromolekul v dané tkáni. MTR (Magnetization Transfer Ratio) představuje rychlost výměny vázaných a volných protonů. Odráží redukci kapacity makromolekul v CNS ke změnám magnetizace s okolními molekulami vody, což reflektuje ztrátu myelinu a snížení hustoty axonů [42].
Vyhodnocení zobrazení s použitím MT má široké použití. Dříve se především porovnávala hodnota MTR u hypersignálních ložisek v T2W obraze, kde MT asociuje se stupněm demyelinizace [43]. Při užití MT se zobrazují pouze aktivní ložiska (do šesti měsíců po atace), která mají nízký MTR (v T1W obraze mají zvýšený signál s MT) (obr. 6a–c). Pokles MTR byl nalezen i v okolí hypersignálních ložisek v T2 váženém obraze v bílé hmotě, na rozdíl od bílé hmoty vzdálenější od ložisek. Pokles MTR byl také zjištěn v NAWM a NABT (Normal Appearing Brain Tissue) [44]. I když signál pocházející z šedé hmoty má méně organizovanou strukturu, což se týká souborů volné a vázané vody a je tudíž při aplikaci prepulzu méně potlačen. Nově se začíná využívat i zobrazení šedé hmoty, protože se ukazuje, že hodnota MTR u šedé hmoty koreluje s kognitivním postižením [45].
Největším přínosem užití MTR je, že ač pokles MTR je nespecifický, vykazuje přesný poměr mezi MTR a procentem reziduálních axonů a stupněm demyelinizace, což konvenční metody MR zobrazení neumožňují [42]. Hodnota MTR vysoce asociuje s procentem reziduálních axonů a stupněm demyelinizace jak u ložisek patrných v T2W obraze, tak i u normální mozkové tkáně (NABT), což doložily práce zabývající se korelací MR obrazu a pitevními nálezy [46]. Vzhledem k výše popsané asociaci by MTR mohl být vhodný jako dlouhodobý prognostický marker sledování vývoje choroby, při monitorování výsledků experimentální léčby [47]. Problémem při užití pro sledování léčby je její reprodukovatelnost. Změny MTR totiž nemusí reflektovat pouze změny ve tkáních, ale jsou závislé i na parametrech sekvence a typu MR přístroje. Je proto nezbytné minimalizovat tyto technické změny, které by mohly zkreslit výsledky a znemožnit sledování v různých centrech [47].
Difuzně vážený obraz (DWI)
Difuze je definována jako náhodný opakující se translační pohyb molekul v tekutém prostředí z míst s vyšší koncentrací do míst s koncentrací nižší; v CNS závisí na mikrostruktuře tkáňových komponent zahrnujících buněčné membrány a organely. U difuzně váženého zobrazení je aplikován velice silný párový gradientní pulz, které slouží k defázování a refázování difundujících spinů. [42,48]. Zobrazení pomocí DWI nás informuje o změněné integritě tkáně, o ztrátě tkáňové anizotropie. Patologické procesy, jejichž výsledkem je pokles restrikčních bariér, mohou způsobit vzestup ADC (Apparent Diffusion Coefficient). První studie s DWI popisovaly vzestup ADC, a to jak uvnitř ložisek, tak i mimo ně (NAWM), bez významného vztahu ke klinickému stavu. Byl zde problém s náchylností k pohybovým artefaktům.
Velikost difuze ovšemže závisí na směru, ve kterém je měřena, což charakterizuje difuzní tenzor (DT). V současné době nejsou známy všechny procesy, které vedou ke změně difuze u pacientů s RS. Některé patologické změny mohou ovlivňovat difuzi rozdílným způsobem, čímž snižují především specificitu dané metodiky [49]. Difuzní tenzor těsněji koreluje s klinickým postižením. Pomocí zobrazení s DT jsme schopni detekovat a kvantifikovat tkáňové postižení uvnitř hypersignálních ložisek v T2 váženém obraze i mimo ně. Ukazuje se, že tato metodika je vhodná především na krátkodobé sledování [50]. DT reflektuje variabilitu patologických ložisek (ložisek zvýšené intenzity signálu v T2W obraze). Velké abnormality nalézáme především v oblasti ložisek snížené intenzity signálu v T1W obraze. Reprezentují ireverzibilní změny tkáně a axonální ztrátu. Tato metodika bohužel v současné době vykazuje i určité limitace. Například nejsou jednoznačné výsledky, porovnáme‑li zesílená (enhanced) ložiska a ložiska bez zesílení signálu po podání kontrastní látky. Dále detekovaná ložiska na DT MR mohou mít rozdílný původ (obdobné limitace mají léze detekované v T2W obraze a FLAIR), nevíme, zda jsou ložiska permanentní, či zda se jedná pouze o přechodný stav na základě edému, demyelinizace a remyelinizace [51].
DT traktografie je metodika, která zobrazuje difuzní koeficienty podél os difuzního elipsoidu, a tím může poskytnout například popis Valeriánské degenerace axonů v NAWM u pacientů s RS [49]. DT traktografie může také být použita pro segmentaci různých funkčních oblastí bílé hmoty, jako je kortikospinální trakt či corpus callosum. DT traktografie může pomoci při pochopení mechanizmu zhoršení klinického postižení [49].
Nevýhodou vyšetření DT je velká variabilita mezi jednotlivými typy MR přístrojů [49]. Stále se vede diskuze, jaké parametry jsou optimální a jaké by mělo být postprocesingové zpracování. To jsou důvody, které dosud zabraňovaly širšímu použití DT při monitorování výsledků experimentální léčby. Tato metodika se teprve začíná používat a nové studie ji zařazují do protokolu pro sledování pacientů vedle konvenčních MR technik, chybí ale výsledky dlouhodobého sledování.
Spektroskopie, perfuze (PWI), relaxometrie
Spektroskopie (1H-MRS, proton MRS) [48] může poskytnout kvantitativní informaci o dvou hlavních aspektech RS: o aktivním zánětlivém/demyelinizačním procesu a axonálním postižení [52]. Pro sledování neurodegenerace se posuzuje hodnota N-acetylaspartatu (NAA), která je markerem axonální integrity. Měření metabolitů, jako je cholin (Cho) a myoinositol (mI), jsou důležitá pro posouzení destrukce myelinu a remyelinizace [53]. V současné době se však 1H-MRS k rutinnímu monitoringu neužívá a je spíše jen experimentální metodikou, která se zaměřuje především na popis stavů, jako je axonální poškození či destrukce myelinu a remyelinizace.
Ve stadiu výzkumu je u RS vyšetření perfuze (PWI), které zobrazuje lokální změny v prokrvení [54,48]. Ukazuje se, že by mohl být úzký vztah mezi regionálními změnami perfuze a neuropsychologického postižení u RS [55].
Relaxometrie se zaměřuje na detekciakumulace železa či jeho sloučenin. Depozita železa jsou pozorována u stárnoucího mozku a u řady chronických neurologických onemocnění (Alzheimerovy choroby, Parkinsonova onemocnění) [56] a též u RS [57]. Pomocí měření transverzální a longitudinální relaxace můžeme odhadnout množství železa v mozku.
Nejčastěji se provádí T2 relaxometrie (R2 relaxometrie). Zobrazujeme veličinu R2 (rychlost relaxace), která je inverzní k T2 a která lineárně závisí na koncentraci železa.
Další možnost je R2* relaxometrie (R2* je inverzní k gradient-echo T2* relaxačnímu času). Každá z těchto možností má své výhody i nevýhody [58], někdy se užívá i rozdílu R2* – R2.
Nejnověji byla vyvinuta metodika, která ještě citlivěji kvantifikuje depozita železa. Jedná se o tzv. korelaci magnetického pole (Magnetic Field Correlation, MFC), která využívá asymetrie spin echa ke kvantifikaci železa; opakovaně se přidává refokuzační puls, v pěti časových posuvech [57,59]. Bohužel tato nová metodika je vhodná jen pro přístroje s větší intenzitou magnetického pole (3 Tesla a výše); signál roste se čtvercem intenzity magnetického pole. U RS byla nalezena zvýšená depozita železa v oblasti nucleus ruber, talamu, nucleus dentatus, caudatu a rolandické kůře ve srovnání se zdravou populací [57].
Funkční magnetická rezonance (fMR)
Funkční magnetická rezonance (fMR) mapuje oblasti mozku, které jsou aktivovány během pohybu, senzitivních či kognitivních stimulací [48]. Funkční magnetická rezonance kvantifikuje okysličení krve a detekuje oblasti, které mají větší lokální průtok krve, což reflektuje vzestup neuronální aktivity v dané oblasti při určitém paradigmatu (například pohybovém) v porovnání s vyšetřením bez něho (v klidu). Užívá se technika závisející na stupni okysličení krve (Blood Oxygen Level-Dependent, BOLD) jako sonda hemodynamické odpovědi mozku na jeho aktivaci [60]. Zobrazení pomocí fMR může ukázat adaptaci mozku na ireverzibilní tkáňové postižení (obr. 7, 8). fMR indikuje, že kortikální reorganizace se objevuje brzy po klinickém vzplanutí choroby a pokračuje během onemocnění [61].
Image 6. Funkční magnetická rezonance (fMR), použito obvyklé paradigma (pohyby palce ruky), zdravý dobrovolník. Barevně vyznačená area označuje poměrně malé ložisko v oblasti gyrus precentralis, které je korelátem primární motorické arey. 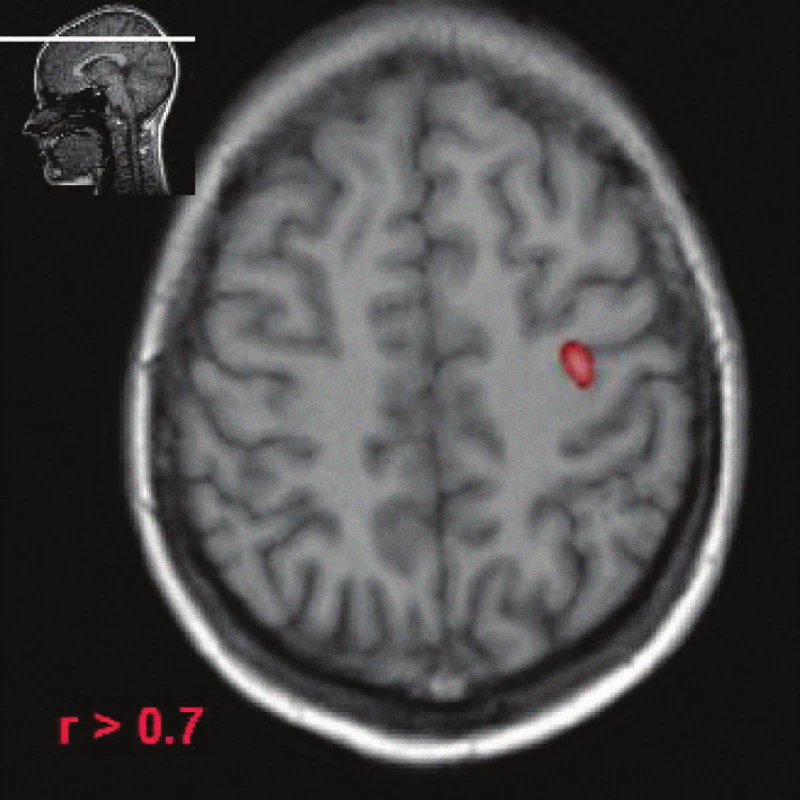
Image 7. fMR, pacient s RS, použito stejné paradigma jako u zdravého jedince (obr. 7), vyhodnocení s použitím stejného prahu korelačního koeficientu (větší než 0,7) jako u obr. 7. U pacienta s RS je zřejmé, že motorická area je rozsáhlejší, kromě primární motorické arey zasahuje i do suplementární motorické oblasti. To by mohlo být interpretováno, dle našeho názoru, plasticitou mozku, respektive při insuficienci primární motorické arey se více uplatňují i jiné oblasti mozku (suplementární motorické centrum). 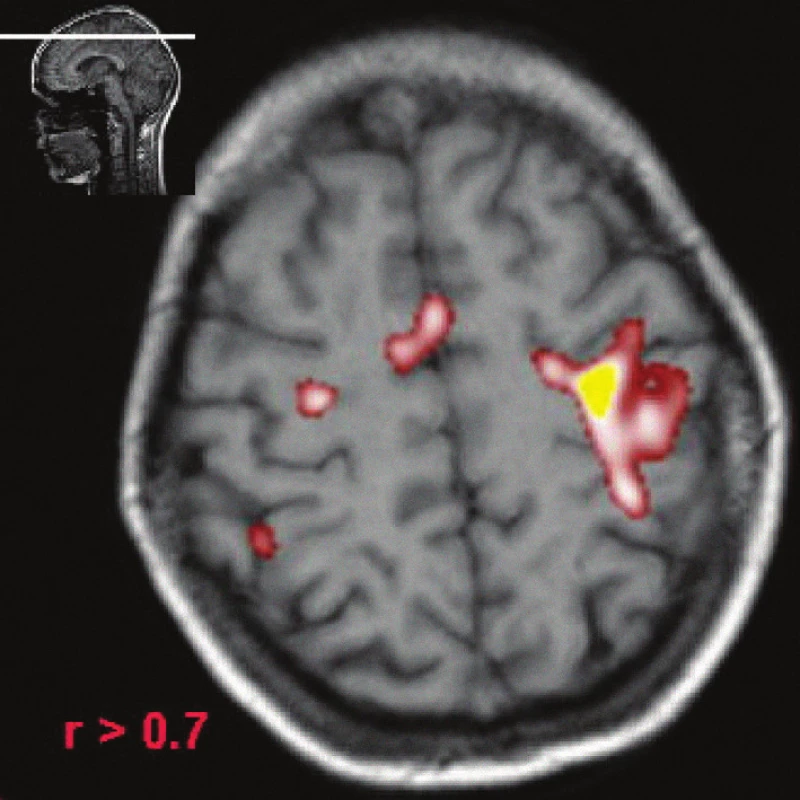
Závěr
Základní rolí magnetické rezonance u roztroušené sklerózy mozkomíšní je stále podpora diagnózy a diferenciální diagnostika. Pro monitorování průběhu choroby, respektive účinků léčby, jsou v klinických studiích nejpoužívanější konvenční metody MR, u nichž však vzhledem k nepostihnutí všech aspektů choroby jsou značné limitace. Proto se testují tzv. nekonvenční metodiky, které jsou schopny zobrazit či kvantifikovat další patologické děje. Dosud však nebyla nalezena taková metodika, na základě jejíhož vyhodnocení bychom byli schopni jednoznačně určit jistou progresi onemocnění u konkrétního pacienta.
MUDr. Manuela Vaněčková, Ph.D.
Radiodiagnostická klinika
Oddělení MR
1. LF UK a VFN
Kateřinská 30
128 08 Praha 2
e-mail: man.van@post.cz
Přijato k recenzi: 22. 4. 2008
Přijato do tisku: 18. 8. 2008
Sources
1. Fazekas F, Offenbacher H, Fuchs S, Schmidt R, Niederkorn K, Horner S et al. Criteria for an increased specificity of MR interpretation in elderly subjects with suspected multiple sclerosis. Neurology 1988; 38(12): 1822–1825.
2. Paty DW, Oger JF, Kastrukoff LF, Hashimoto SA, Hooge JP, Eisen AA et al. MR in the diagnosis of MS: a prospective study with comparison of clinical evaluation, evoked potentials, oligoclonal banding, and CT. Neurology 1988; 38(2): 180–185.
3. Barkhof F, Filippi M, Miller DH, P Scheltens, A Campi, CH Polman et al. Comparison of MR imaging criteria at first presentation to predict conversion to clinically definite multiple sclerosis. Brain 1997; 120(11): 2059–2069.
4. Tintoré M, Rovira A, Martinez MJ, Rio J,Díaz-Villoslada P, Brieva L et al. Isolated demyelinating syndromes: comparison of different MR imaging criteria to predict conversion to clinically definite multiple sclerosis. AJNR Am J Neuroradiol 2000; 21(4): 702–706.
5. Stewart WA, Hall LD, Berry K, Paty DW. Correlation between NMR scan and brain slice data in multiple sclerosis. Lancet 1984; 2(8399): 412.
6. Miller DH, Barkhof F, Nauta JJ. Gadolinium enhancement increases the sensitivity of MR in detecting disease activity in multiple sclerosis. Brain 1993; 116(5): 1077–1094.
7. Trapp BD, Peterson J, Ransohoff RM, Rudick R, Mörk S, Bö L. Axonal transection in the multiple sclerosis. Engl J Med 1998; 338(5): 278–285.
8. Lassmann H. Mechanisms of demyelination and tissue destruction in multiple sclerosis. Clin Neurol Neurosurg 2002; 104(3): 168–171.
9. Barkhof F. MR in multiple sclerosis: correlation with Expanded Disability Status Scale (EDSS). Mult Scler 1999; 5(4): 283–286.
10. Lucchinetti C, Brück W, Parisi J, Scheithauer B, Rodriguez M, Lassmann H. Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Ann Neurol 2000; 47(6): 707–717.
11. Baratti C, Yousry T, Kadziora C, Spuler S,Mammi S. Comparison of fast-FLAIR vs Standard SE sequences for measurement of brain MR lesion loads in patients with multiple sclerosis. Neuroradiology 1995; 37 : 90–95.
12. Seidl Z, Obenberger J. Magnetická rezonance jako modalita diagnostiky roztroušené sklerózy mozkomíšní. Současná realita, literární přehled doplněný zkušeností našeho pracoviště a budoucí perspektivy využití MR. Cesk Slov Neurol N 1998; 61/94(3): 118–128.
13. Ciccarelli O, Brex PA, Thompson AJ, Miller DH. Disability and lesion load in MS: a reassessment with MS functional composite score and 3D fast FLAIR. J Neurol 2002; 249(1): 18–24.
14. McDonald WI, Compston A, Edan G, Goodkin D, Hartung HP, Lublin FD et al. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. Ann Neurol 2001; 50(1): 121–127.
15. Polman CH, Reingold SC, Edan G, Filippi M, Hartung HP, Kappos L et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the „McDonald Criteria“. Ann Neurol 2005; 58(6): 840–846.
16. Swanton JK, Rovira A, Tintore M, Altmann DR, Barkhof F, Filippi M et al. MR criteria for multiple sclerosis in patients presenting with clinically isolated syndromes: a multicentre retrospective study. Lancet Neurol 2007; 6(8): 677–686.
17. Swanton JK, Fernando K, Dalton CM, Miszkiel KA, Thompson AJ, Plant GT et al. Modification of MR criteria for multiple sclerosis in patients with clinically isolated syndromes. J Neurol Neurosurg Psychiatry 2006; 77(7): 830–833.
18. Silver NC, Good CD, Barker GJ, MacManus DG, Thompson AJ, Moseley IF et al. Sensitivity of contrast enhanced MR in multiple sclerosis. Effects of gadolinium dose, magnetisation transfer contrast and delayed imaging. Brain 1997; 120(7): 1749–1761.
19. Filippi M, Capra R, Campi A, Colombo B,Prandini F, Marcianò N et al. Triple dose of gadolinium-DTPA and delayed MR in patients with bening multiple sclerosis. J Neurol Neurosurg Psychiatry 1996; 60(5): 526–530.
20. Molyneux PD, Filippi M, Barkhof F, Gasperini C, Yousry TA, Truyen L et al. Correlations between monthly enhanced MR lesion rate and changes in T2 lesion volume in multiple sclerosis. Ann Neurol 1998; 43(3): 332–339.
21. Kidd D, Thorpe JW, Kendall BE, Barker GJ, Miller DH, McDonald WI et al. MR dynamics of brain and spinal cord in progressive multiple sclerosis. J Neurol Neurosurg Psychiatry 1996; 60(1): 15–19.
22. Losseff N, Kingsley D, McDonald WI Miller DH, Thompson AJ. Clinical and magnetic resonance imaging predictors in primary and secondary progressive multiple sclerosis. Mult Scler 1996; 1(4): 218–222.
23. Miller DH, Grossman RI, Reingold SC, McFarland HF. The role of magnetic resonance techniques in understanding and managing multiple sclerosis. Brain 1998; 121(1): 3–24.
24. Vaněčková M, Seidl Z, Krásenský J, Obenberger J, Havrdová E, Viták T et al. Sledování objemu ložisek u roztroušené sklerózy mozkomíšní magnetickou rezonancí. Cesk Slov Neurol N 2002; 65/98(3): 175–179.
25. Brex PA, Ciccarelli O, O‘Riordan JI, Sailer M, Thompson AJ, Miller DH. A longitudinal study of abnormalities on MR and disability from multiple sclerosis. N Engl J Med 2002; 346(3): 158–164.
26. Sailer M, Losseff NA, Wang L, Gawne-Cain ML, Thompson AJ, Miller DH. T1 lesion load and cerebral atrophy as a marker for clinical progression in patients with multiple sclerosis. A prospective 18 months follow‑up study. Eur J Neurol 2001; 8(1): 31–42.
27. Rudick RA, Fisher E, Lee JC, Simon J, Jacobs L. Use of the brain parenchymal fraction to measure whole brain atrophy in relapsing-remitting MS. Multiple Sclerosis Collaborative Research Group. Neurology 1999; 53(8): 1698–1704.
28. Filippi M, Rovaris M, Iannucci G, Mennea S, Sormani P, Comi G. Whole brain volume changes in patients with progressive MS treated with cladribine. Neurology 2000; 55(11): 1714–1718.
29. Yulin GE, Grossman RI, Udupa JK, Babb JS, Nyúl LG, Kolson LD. Brain atrophy in Relapsing-Remitting Multiple Sclerosis: Fractional Volumetric Analysis of Gray Matter and White Matter. Neuroradiology 2001; 220(3): 606–610.
30. Fisher E, Rudick RA, Cutter G, Baier M, Miller D, Weinstock-Guttman B et al. Relationship between brain atrophy and disability: an 8-year follow‑up study of multiple sclerosis patients. Mult Scler 2000; 6(6): 373–377.
31. Havrdova E, Horakova D, Pospisilova L, Cox J, Dwyer M, Seidl Z et al. ApoE epsilon 4 positivity does not predict more severe clinical and MR outcome: A 5-year longitudinal study. Neurology 2007; 12 (Suppl 1):A164–A164.
32. Schreiber K, Sørensen PS, Koch-Henriksen N, Wagner A, Blinkenberg M, Svarer C et al. Correlations of brain MR parameters to disability in multiple sclerosis. Acta Neurol Scand 2001; 104(1): 24–30.
33. Zivadinov R, Rudick RA, De Masi R, Nasuelli D, Ukmar M, Pozzi-Mucelli RS et al. Effects of IV methylprednisolone on brain atrophy in relapsing-remitting MS. Neurology 2001; 57(7): 1239–1247.
34. Horakova D, Cox JL, Havrdova E, Hussein S, Dolezal O, Cookfair D et al. Evolution of different MR measures in patients with active relapsing-remitting multiple sclerosis over 2 and 5 years: a case control study. J Neurol Neurosurg Psychiatry 2008; 79(4): 407–414.
35. Bielekova B, Kadom N, Fisher E, Jeffries N, Ohayon J, Richert N et al. MR as a marker for disease heterogeneity in multiple sclerosis. Neurology 2005; 65(7): 1071–1076.
36. Vaneckova M, Seidl Z, Krasensky J, Havrdova E, Horakova D, Dolezal O et al. The predictive ability of magnetic resonance imaging to progression of clinical disability in patients with multiple sclerosis. J Neurol 2007; 254 (Suppl 3): III/163.
37. Miller DH, Thompson AJ, Filippi M.Magnetic resonance studies of abnormalities in the normal appearing white matter and grey matter in multiple sclerosis. J Neurol 2003; 250(12): 1407–1419.
38. Vrenken H, Rombouts SA, Pouwels PJ, Barkhof F. Voxel‑based analysis of quantitative T1 maps demonstrates that multiple sclerosis acts troughout the normal-appearing white matter. AJNR Am J Neuroradiol 2006; 27(4): 868–874.
39. Wolff SD, Balaban RS. Magnetization transfer imaging: practical aspects and clinical applications. Radiology 1994; 192(3): 593–599.
40. Iannucci G, Rovaris M, Giacomotti L,Comi G, Filippi M. Correlation of multiple sclerosis measures ferived from T2-weighted, T1-weighted, magnetization transfer and diffusion tensor MR imaging. AJNR Am J Neuroradiol 2001; 22(8): 1462–1467.
41. Seidl Z, Obenberger J, Daneš J, Viták T,Krásenský J, Belšán T. Využití magnetizačního transferu při zobrazování magnetickou rezonancí v CNS. Čes Radiol 1997; 51(4): 223–226.
42. Filippi M, Grossman RI. MR techniques to monitor MS evolution: The present and the future. Neurology 2002; 58 : 1147–1153.
43. Hiehle JF jr, Grossman RI, Ramer KN, Gonzalez-Scarano F, Cohen JA. Magnetization transfer effects in MR–detected multiple sclerosis lesions:comparison with gadolinium-enhanced spin‑echo images and nonenhanced T1-weighted images. AJNR Am J Neuroradiol. 1995; 16(1): 69–77
44. Ge Y, Grossman RI, Udupa JK, Babb JS, Mannon LJ, McGowan J. Magnetization transfer ratio histogram analysis of normal-appearing gray matter and normal-appearing white matter in multiple sclerosis. J Comput Assist Tomogr 2002; 26(1): 62–68.
45. Ranjeva JP, Audoin B, Au Duong MV, Ibarrola D, Confort-Gouny S, Malikova I et al. Local tissue damage assessed with statistical mapping analysis of brain magnetization transfer ratio: relationship with functional status of patients in the earliest stage of multiple sclerosis AJNR Am J Neuroradiol 2005; 26(1): 119–127.
46. Schmierer K, Scaravilli F, Altman D, Barker GJ, Miller DH. Magnetization transfer ratio and myelin in postmortem multiple sclerosis brain. Ann Neurol 2004; 56(3): 407–415.
47. Filippi M, Agosta F. Magnetization transfer MR in multiple sclerosis. J Neuroimaging 2007; 17 (Suppl 1): 22S–26S.
48. Seidl Z, Vaněčková M. Magnetická rezonance hlavy, mozku a páteře. Praha: Grada Publishing 2007.
49. Rovaris M, Filippi M. Diffusion tensor MR in multiple sclerosis. J Neuroimaging 2007; 17 (Suppl 1): 27S–30S.
50. Rovaris M, Gallo A, Valsasina P, Benedetti B, Caputo D, Ghezzi A et al. Short‑term accrual of gray matter pathology in patients with progressive multiple sclerosis: an in vivo study using diffusion tensor MR. Neuroimage 2005; 24(4): 1139–1146.
51. Filippi M, Cercignani M, Inglese M, Horsfield MA, Comi G. Diffusion tensor magnetic resonance imaging in multiple sclerosis. Neurology 2001; 56(3): 304–311.
52. Arnold DL, Riess GT, Mathews PM, Francis GS, Collins DL, Wolfson C et al. Use of the proton magnetic resonance spectroscopy for monitoring disease progression in multiple sclerosis. Ann Neurol 1994; 36(1): 76–82.
53. De Stefano N, Filippi M. MR spectroscopy in multiple slerosis. J Neuroimaging 2007; 17 (Suppl 1): 31S–35S.
54. Wuerfel J, Bellman-Strobl J, Brunecker P, Aktas O, McFarland H, Villringer A et al. Changes in cerebral perfusion precede plaque formation in multiple sclerosis: a longitudinal perfusion MR study. Brain 2004; 127 (1): 111–119.
55. Inglese M, Adhya S, Johnson G, Babb JS, Miles L, Jaggi H et al. Perfusion magnetic resonance imaging correlates of neuropsychological impairment in multiple sclerosis. J Cereb Blood Flow Metab 2008; 28(1): 164–171.
56. Vymazal J, Righini A, Brooks RA, Canesi M, Mariani C, Leonardi M et al. T1 and T2 in the brain of healthy subjects, patients with Parkinson disease, and patients with multiple system atrophy: relation to iron content. Radiology 1999; 211(2): 489–495.
57. Stankiewicz J, Panter SS, Neema M, Arora A, Batt C, Bakshi R. Iron in chronic brain disorders: imaging and neurotherapeutic implications. Neurotherapeutics 2007; 4(3): 371–386.
58. Neema M, Stankiewicz J, Arora A, Dandamudi V, Batt C, Guss ZD et al. T1 - and T2‑based MR measures of diffuse gray matter and white matter damage in patients with multiple sclerosis. J Neuroimaging 2007; 17 (Suppl 1): 16S–21S.
59. Ge Y, Jensen JH, Lu H, Helpern JA, Miles L, Inglese M et al. Quantitative assessment of iron accumulation in the deep gray matter of multiple sclerosis by magnetic field correlation imaging. AJNR Am J Neuroradiol 2007; 28(9): 1639–1644.
60. Grossman RI, McGowan JC. Perspectives on Multiple Sclerosis. AJNR Am J Neuroradiol 1998; 19(7): 1251–1265.
61. Filippi M, Bakshi R, Rovaris M, Comi G. MR and multiple sclerosis: What happened in the last 10 years. J Neuroimaging 2007; 17 (Suppl 1): 1S–2S.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2008 Issue 6-
All articles in this issue
- Spánková apnoe dospělého věku
- Monitorování mozkové oxygenace
- Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy
- Vztah atrofie amygdaly a dalších vybraných mozkových struktur k emocionální agnozii u Alzheimerovy nemoci
- Farmakoepidemiologická studie souboru 427 pacientů léčených pro epilepsii
- Vyšetřování proteinu 14-3-3 v mozkomíšním moku – klinicko‑patologická korelace
- Syndrom kubitálního kanálu. Srovnání operačních technik prosté dekomprese a přední transpozice ulnárního nervu
- Endonazální endoskopická transsfenoidální resekce selárních lézí
- Přední krční mikroforaminotomie v řešení unilaterální monosegmentální radikulopatie (prospektivně vedená pilotní studie – 15 pacientů)
- Extraoperativní mapování pomocí kortikálního gridu před resekcí difuzního oligodendrogliomu v řečově dominantní hemisféře – alternativa „awake kraniotomie“ – kazuistika
- Status absencí u geriatrického pacienta s recentní diagnózou idiopatické generalizované epilepsie – kazuistika
- Subakutně probíhající reverzibilní hypertenzní leukoencefalopatie – kazuistika
- Rozdíly v počtu CAG opakování mezi pohlavími a jejich korelace s klinickým obrazem u Huntingtonovy choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy
- Spánková apnoe dospělého věku
- Subakutně probíhající reverzibilní hypertenzní leukoencefalopatie – kazuistika
- Vyšetřování proteinu 14-3-3 v mozkomíšním moku – klinicko‑patologická korelace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

