-
Medical journals
- Career
Extraoperativní mapování pomocí kortikálního gridu před resekcí difuzního oligodendrogliomu v řečově dominantní hemisféře – alternativa „awake kraniotomie“ – kazuistika
Authors: R. Bartoš 1; J. Ceé 1; A. Zolal 1; A. Hejčl 1; M. Bolcha 1; J. Prokšová 2; M. Sameš 1
Authors‘ workplace: Neurochirurgická klinika UJEP a Krajská zdravotní, a. s. – Masarykova nemocnice v Ústí nad Labem, o. z. 1; Rehabilitační oddělení – logopedie, Krajská zdravotní, a. s. – Masarykova nemocnice v Ústí nad Labem, o. z. 2
Published in: Cesk Slov Neurol N 2008; 71/104(6): 718-721
Category: Case Report
Overview
Na příkladu kazuistiky pacientky s difuzním oligodenrogliomem WHO II prezentujeme metodiku extraoperativního mapování pomocí dočasně implantovaného kortikálního gridu jako alternativu „awake“ operace. Upozorňujeme na technické aspekty tohoto způsobu mapování kortikálních funkcí a v diskuzi obě metodiky srovnáváme.
Klíčová slova:
funkční mapování – gliom – kortikální grid – funkční magnetická rezonance – traktografieÚvod
Při operacích intrinsických tumorů ve vysoce elokventních oblastech představuje awake kraniotomie a intraoperativní elektrická kortikální stimulace „zlatý standard“ mapování kortikálních funkcí. Tato technika však klade vysoké požadavky na schopnosti neuroanesteziologa a vyžaduje kooperativního pacienta. Pro část pacientů je tedy její použití nevhodné. V této kazuistice uvádíme možnost alternativní metodiky – extraoperativní mapování pomocí kortikálního gridu při dvoudobé operaci.
Materiál a metodika
45letá pacientka přijatá na naši kliniku po parciálním epileptickém záchvatu s příznaky smíšené afázie a jacksonských pravostranných křečí byla po symptomatické léčbě vstupního stavu vyšetřena pomocí MR (magnetická rezonance) s nálezem rozsáhlého hyperintenzního difuzního procesu v T2 váženém obraze, postihujícího celou perisylvijskou oblast levé hemisféry mozku. V T1 váženém obraze bylo ložisko hypointenzní, lokálně nehomogenní, velikosti 80 × 54 × 45 mm, nedocházelo k sycení po podání kontrastní látky, bylo tedy vysloveno podezření na difuzní gliom WHO grade II. Na základě standardního MR vyšetření však nebylo možné zcela vyloučit anaplastický grade III, který vyžaduje následnou onkologickou léčbu [1,2]. Předoperačně jsme provedli testování řečových funkcí mezinárodně osvědčenou metodou pomocí Bostonského diagnostického testu afázií (BDAE, Boston Diagnostic Aphasia Examination). Doplnili jsme funkční zobrazení řečových oblastí pomocí BOLD (Blood Oxygenation Level Dependent) funkční magnetické rezonance (fMR) s paradigmatem verbální fluence. Při tomto vyšetření se zobrazily clustery aktivity v operkulární oblasti gyrus frontalis inferior, části inzulární kůry a v gyrus frontalis medius postižené hemisféry. V souladu s klinickým průběhem jsme předpokládali řečovou dominanci levé hemisféry. Nedošlo však k BOLD aktivaci v temporoparietálních řečových oblastech, tedy výsledek fMR nemohl být využit pro intraoperativní rozvahu. DTI (Diffusion Tensor Imaging, MR traktografie) prokázala T2 infiltraci fasciculus arcuatus, který však byl zřejmě v korelaci s důkladným vyšetřením fatických funkcí funkčně intaktní. Pacientce byla nabídnuta operace s „awake“ fází. Vzhledem k anxióznímu habitu pacientky a jejím obavám z možné intolerance jsme po pacientčině podepsání informovaného souhlasu zvolili dvoudobou operaci s mapováním řečových funkcí v mezidobí. Navigovaně byla provedena kraniotomie zasahující nad celou kortikální projekci tumoru, s fotografickou dokumentací kortikální anatomie před implantací 64svodového (8 × 8) gridu s rozestupy jednotlivých elektrod 1 cm (Integra, Plainsboro, NJ, USA) a po ní. Poloha gridu byla po operaci ověřena CT vyšetřením. Polohu jednotlivých elektrod jsme na podkladě kortikální anatomie interpolovali do pracovního listu. Následující den jsme za pečlivého klinického monitorování pacientky na jednotce intenzivní péče provedli mapování korových funkcí postupným napojením jednotlivých svodů gridu přes interface na Ojemannův kortikální stimulátor (Radionics, Burlington, USA), při použití standardních parametrů stimulačního proudu (4–5 mA, 60Hz, délka trvání pravoúhlého pulzu 0,2 ms, doba stimulace do 5–10 s).
Výsledky
Celá oblast byla stimulována nejprve během vytváření číselných řad od 1 do 50. Při stimulaci mezi elektrodami 40–41, 41–49, 33–41 jsme pozorovali zástavu řeči („speech arrest“). Následoval test pojmenování obrázků. Při tomto vyšetření byly opět použity materiály z BDAE. Během stimulace mezi elektrodami 19–20, 20–21, 21–29, 20–28, 12–20, 20–29 jsme pozorovali poruchu pojmenování známých obrázků při zachování iniciace věty („To je…“). V kortikálních oblastech, ve kterých jsme při stimulaci detekovali poruchy řeči, jsme se věnovali i testování sémantických funkcí – vytváření vět na známé předměty prezentované jako obrázky. Mezi svody 13–14 jsme pozorovali selektivní poruchu vytvoření smysluplné věty na daný obrázek při neporušeném zachování jeho pojmenování. Při stimulaci mezi svody 59–60 jsme pozorovali záškuby pravostranného mimického svalstva, tedy oblast odpovídala laterální části precentrálního gyru. Testování trvalo 90 minut a během stimulace jsme nezaznamenali epileptický záchvat. Výsledky stimulací jsme barevně odlišili na CT laterogramu zavedeného gridu (obr. 1) a v pracovním listu, kde jsme vypracovali plán předpokládané bezpečné resekce v terénu tumoru jistě infiltrujícího i funkční oblasti (obr. 2). Operaci jsme v klasické celkové anestezii provedli následující den, při určení hloubky resekce jsme respektovali výsledky DTI traktografie fasciculus arcuatus implementovanou do T2 váženého anatomického skenu pomocí neuronavigačního přístroje Treon (Medtronic, Lousiville, CO, USA, obr. 3). Pacientka je bezprostředně po operaci bez fatické poruchy a lateralizace. Vertikalizována byla druhý pooperační den, se steskem na mírné vertigo, které odeznělo během týdenní hospitalizace. Kontrolní MR zaznamenala nekomplikovanou očekávaně parciální resekci. V T1 váženém obraze jsme resekci hodnotili jako radikální ohledně nehomogenity hypointenzního signálu, výsledná dutina měla velikost 30 × 20 × 15 mm a na kontrolní DTI MR se mediálně dotýkala zmíněného traktu. Histologické vyšetření prokázalo oligodendrogliom WHO II, Ki 67 (proliferační index) 8 %. Před resekcí a týden po ní bylo provedeno specializované logopedické vyšetření fatických funkcí, které se skládá z hodnocení spontánní řeči, porozumění mluvené řeči, opakování, pojmenování, čtení a psaní. Při pooperačním vyšetření došlo ke zlepšení ve všech kategoriích, kromě mírného zhoršení psaní – diktátu slov a pseudoslov, které nebylo extraoperativně testováno.
Image 1. CT laterogram po zavedení 64svodového gridu: světle modrá – zástava řeči, zelená – porucha pojmenování, hnědá – porucha tvorby vět, červená – záškuby mimického svalstva, tmavě modrá – rozsah parciální resekce. 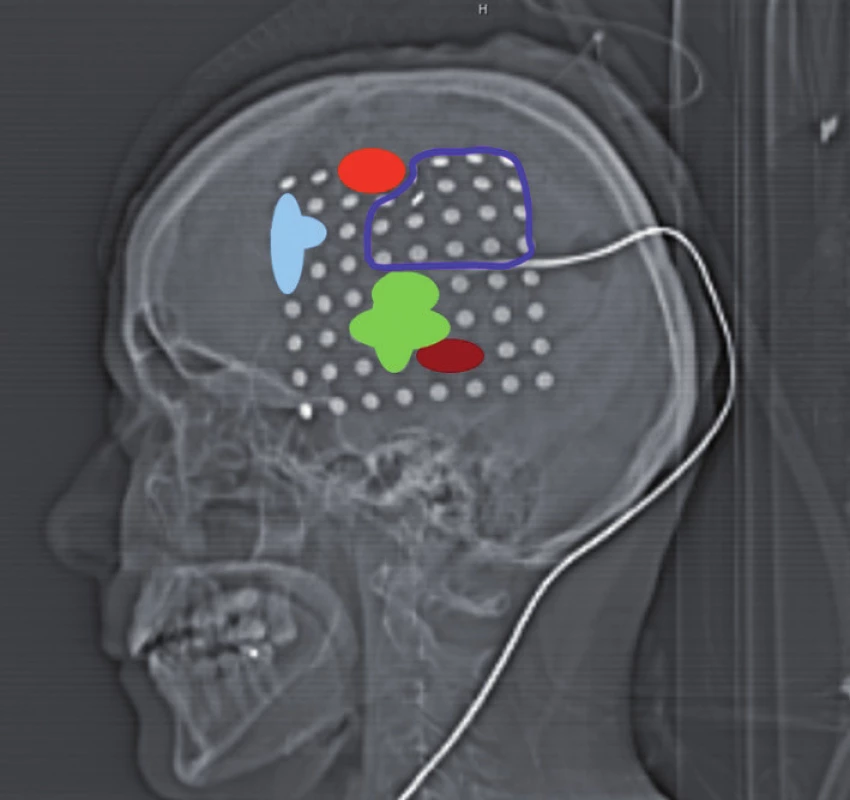
Image 2. Fotografie odhaleného kortexu se zaznamenáním polohy jednotlivých svodů: tmavě modrá – rozsah parciální resekce; černá – kortikální hranice tumoru dle navigace; barevné označení elektrod v oblastech s pozitivními odpověďmi na stimulaci (odpovídá obr. 1). 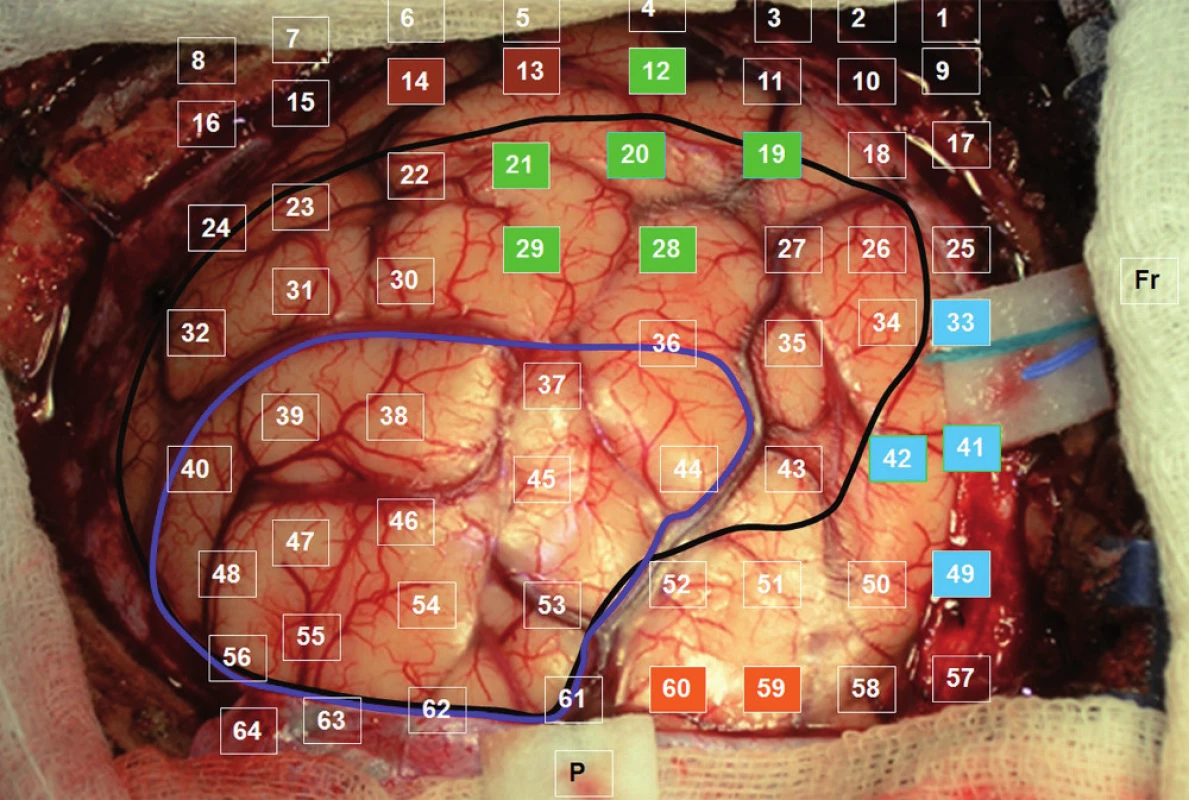
Diskuze
Dobrá tolerance operace s vědomou fází je dobře dokumentována, ovšem i velké série pacientů udávají určité procento pacientů nevhodných pro tuto metodiku. Například M. Bernstein, který entuziasticky referuje o awake resekci jako o optimálním příkladu ekonomické a minimálně invazivní metody, vyloučil z awake operace 105 pacientů ze 305 zvažovaných [3]. Za vylučující kritéria považuje neschopnost komunikace kvůli afázii, jazykové bariéře, dále mentální retardaci, emoční nestabilitu, zmatenost a okcipitální lézi. Whittle et al [4] na základě dotazníku vyplňovaného pacienty po awake operaci udávali, že bolest během procedury pociťovalo 20 % a úzkost 29 % pacientů. Naše skromná série [5], publikovaná v témže roce, vykazuje podobné výsledky. Navzdory výborné toleranci většinou pacientů bylo nutné pro úspěšné dokončení resekční fáze operace změnit anestezii na klasickou celkovou u 10 % pacientů. Za nevhodné pro awake operaci považujeme také pacienty s chronickou obstrukční plicní nemocí a obtížnými anatomickými poměry pro eventuální reintubaci. Při awake operaci jsou vzhledem k omezené době možné spolupráce většinou přijímána Ojemannova kritéria řečové elokvence, kdy dané místo je s identickým výsledkem 2 ze 3 stimulací považováno za elokventní či nonelokventní [6]. Časová náročnost ještě více vyzní při testování multilingvních pacientů [7]. Výhodou extraoperativního mapování pomocí gridu je možnost vícečetného zopakování vyšetření v oblastech se sporným výsledkem. Obtížnost a komplexita testů mohou být při prakticky neomezené době extraoperativního mapování v rozsahu i několika hodin taktéž vyšší. Kral et al, kteří publikovali pilotní soubor 16 pacientů, navrhují v oblastech s komplexní řečovou funkcí základní testování pomocí tvorby slovních řad (například číselných), pojmenovávání předmětů a tvorby vět, event. rozšířené o fonologickou analýzu, lexikální posuzování a sémantiku, počítání, čtení, psaní a Token test, hodnotící především impresivní složku řeči [8]. Velice užitečná až nezbytná je účast erudovaného logopeda, který je schopen taktéž detailně posoudit rozdíl předoperačního a pooperačního stavu [9].
Ovšem nelze opominout i nevýhody. Jedná se o dvoudobou operaci potenciálně zatíženou vyšším rizikem infekčních komplikací, progresí edému či krvácením do tumoru (zejména v případě WHO stupně III či IV), rizikem subdurálního krvácení. Bonnské pracoviště popisuje incidenci těchto komplikací u jednoho pacienta (6,26 %), samozřejmě s nutností urgentního řešení v případě symptomatické progrese peritumorálního edému [8]. Další nevýhodou je prodloužení doby hospitalizace o dva dny a v našich podmínkách jistě i poměrně vysoká cena 32 či 64svodového gridu. Avšak významnějším argumentem preferujícím awake kraniotomii oproti operaci v celkové anestezii je nemožnost subkortikální stimulace a monitorování funkce základních svazků asociačních drah bílé hmoty podílejících se na řeči – fasciculus arcuatus, fasciculus fronto-occipitalis inferior, jejichž zachování považují Duffau et al za důležitější než zachování vlastní elokventní kůry [10,11]. Ani DTI implementovaná do neuronavigačního přístroje nemůže přímou stimulaci nahradit. Stejně jako fMR, jejíž výsledek navíc závisí na stupni statistického hodnocení BOLD efektu [12], je tato metoda limitována při průběhu dráhy peritumorálním edémem či při její přímé infiltraci tumorem. Alternativou zvyšující výtěžnost DTI je selektivní trasování k dané kortikální oblasti zájmu – detekovatelné fMR, tedy určitá „symbióza“ obou vyšetření (obr. 3) [13]. Jisté je i horší prostorové rozlišení, při 1cm vzdálenosti jednotlivých stimulačních svodů, oproti 5mm rozestupu elektrod při klasické Ojemannově stimulaci. Problémem může být i možnost posunu gridu, proto je nutné vyhotovit pracovní list využívající detailní fotografii exponované mozkové kůry se zaznamenáním skutečné polohy jednotlivých svodů. Operatér se musí podrobně seznámit s danou kortikální anatomií a překontrolovat polohu gridu před jeho vynětím a započetím resekce [14].
Image 3. Vpravo: fúze operkulární řečové oblasti (fMR T1) a fasciculus arcuatus (DTI T2); vlevo: záznam neuronavigace (fúze DTI, fMR, T2) – červený crosshair: hloubka resekce respektující fasciculus arcuatus. 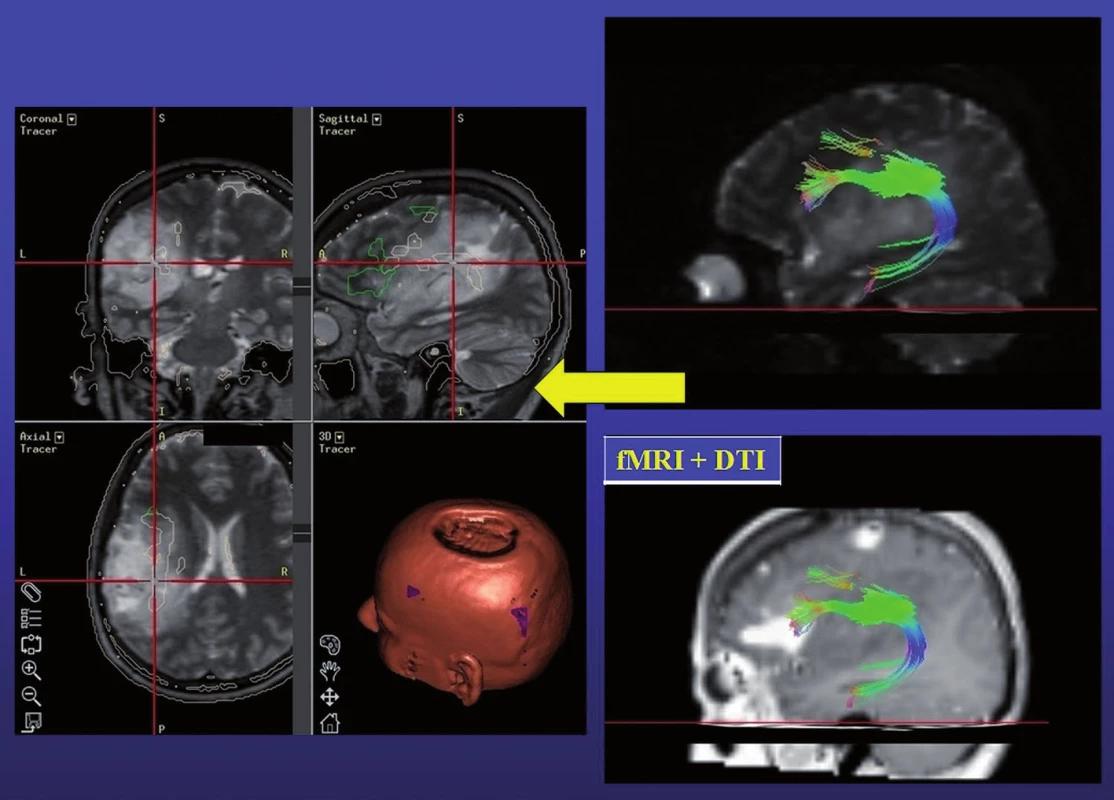
Závěr
Hranice kortikální resekce, zejména nízkostupňového gliomu, uloženého v elokventní oblasti, by měla být jistě limitována výsledky funkčního mapování pomocí kortikální stimulace. Extraoperativní mapování pomocí kortikálního gridu se zdá být užitečnou alternativou pro pacienty, kteří nejsou vhodnými kandidáty operace s vědomou fází, jež je současným „zlatým standardem“. Hlavní nevýhodou extraoperativního mapování je nemožnost subkortikální stimulace, která je pouze částečně kompenzovatelná zohledněním výsledků DTI aplikovaných do neuronavigace. Velkou výhodou je naopak možná komplexita a časový komfort vyšetření.
MUDr. Robert Bartoš
Neurochirurgická klinika
Masarykova nemocnice
Sociální péče 12A
401 13 Ústí nad Labem-Bukov
e-mail: robert.bartos@mnul.cz
Přijato k recenzi: 4. 2. 2008
Přijato do tisku: 12. 9. 2008
Sources
1. Compostella A, Tosoni A, Blat V, Franceschi E, Brandes AA. Prognostic factors for anaplastic astrocytomas. J Neurooncol 2007; 81(3): 295–303.
2. McKnight TR, Lamborn KR, Love TD, Berger MS, Chang S, Dillon WP et al. Correlation of magnetic resonance spectroscopic and growth characteristics within Grades II and III gliomas. J Neurosurg 2007; 106(4): 660–666.
3. Taylor MD, Bernstein M. Awake craniotomy with brain mapping as the routine surgical approach to treating patients with supratentorial intraaxial tumors: a prospective trial of 200 cases. J Neurosurg 1999; 90(1): 35–41.
4. Whittle IR, Midgley S, Georges H, Pringle AM, Taylor R. Patients perceptions of “awake” brain tumour surgery. Acta Neurochir (Wien) 2005; 147(3): 275–277.
5. Bartoš R, Sameš M, Vachata P, Červenka M, Jech R, Vymazal J et al. Výsledky a tolerance „awake“ resekcí mozkových tumorů. Cesk Slov Neurol N 2005; 68/101(1): 39–45.
6. Ojemann G, Ojemann J, Lettich E, Berger M. Cortical language localization in left, dominant hemisphere. An electrical stimulation mapping investigation in 117 patients. J Neurosurg 1989; 71(3): 316–326.
7. Roux FE, Trémoulet M. Organization of language areas in bilingual patients: a cortical stimulation study. J Neurosurg 2002; 97(4): 857–864.
8. Kral T, Kurthen M, Schramm J, Urbach H, Meyer B. Stimulation mapping via implanted grid electrodes prior to surgery for gliomas in highly eloquent cortex. Neurosurgery 2006; 58 (1 Suppl): 36–43.
9. Cséfalvay Z, Košťálová M, Klimešová M. Diagnostika a terapie afázie, alexie, agrafie. Praha: AKL ČR 2002.
10. Benzagmout M, Gatignol P, Duffau H. Resection of World Health Organization Grade II gliomas involving Broca‘s area: methodological and functional considerations. Neurosurgery 2007; 61(4): 741–753.
11. Duffau H, Capelle L, Denvil D, Sichez J, Gatignol P, Taillandier L et al. Usefulness of intraoperative electrical subcortical mapping during surgery for low-grade gliomas located within eloquent brain regions: functional results in a consecutive series of 103 patients. J Neurosurg 2003; 98(4): 764–778.
12. Roux FE, Ibarrola D, Tremoulet M, Lazorthes Y, Henry P et al. Methodological and technical issues for integrating functional magnetic resonance imaging data in a neuronavigational system. Neurosurgery 2001; 49(5): 1145–1157.
13. Smits M, Vernooij MW, Wielopolski PA, Vincent AJ, Houston GC, van der Lugt A. Incorporating functional MR imaging into diffusion tensor tractography in the preoperative assessment of the corticospinal tract in patients with brain tumors. AJNR Am J Neuroradiol 2007; 28(7): 1354–1361.
14. Meyer B. Osobní komunikace. Bonn 2006.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2008 Issue 6-
All articles in this issue
- Spánková apnoe dospělého věku
- Monitorování mozkové oxygenace
- Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy
- Vztah atrofie amygdaly a dalších vybraných mozkových struktur k emocionální agnozii u Alzheimerovy nemoci
- Farmakoepidemiologická studie souboru 427 pacientů léčených pro epilepsii
- Vyšetřování proteinu 14-3-3 v mozkomíšním moku – klinicko‑patologická korelace
- Syndrom kubitálního kanálu. Srovnání operačních technik prosté dekomprese a přední transpozice ulnárního nervu
- Endonazální endoskopická transsfenoidální resekce selárních lézí
- Přední krční mikroforaminotomie v řešení unilaterální monosegmentální radikulopatie (prospektivně vedená pilotní studie – 15 pacientů)
- Extraoperativní mapování pomocí kortikálního gridu před resekcí difuzního oligodendrogliomu v řečově dominantní hemisféře – alternativa „awake kraniotomie“ – kazuistika
- Status absencí u geriatrického pacienta s recentní diagnózou idiopatické generalizované epilepsie – kazuistika
- Subakutně probíhající reverzibilní hypertenzní leukoencefalopatie – kazuistika
- Rozdíly v počtu CAG opakování mezi pohlavími a jejich korelace s klinickým obrazem u Huntingtonovy choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy
- Spánková apnoe dospělého věku
- Subakutně probíhající reverzibilní hypertenzní leukoencefalopatie – kazuistika
- Vyšetřování proteinu 14-3-3 v mozkomíšním moku – klinicko‑patologická korelace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

