-
Medical journals
- Career
Endonazální endoskopická transsfenoidální resekce selárních lézí
Authors: V. Masopust; D. Netuka; V. Beneš
Authors‘ workplace: Neurochirurgická klinika 1. LF UK, IPVZ a ÚVN Praha
Published in: Cesk Slov Neurol N 2008; 71/104(6): 704-710
Category: Short Communication
Overview
Cíl:
Endoskopická technika resekce selárních lézí se v posledním desetiletí stala alternativou klasické mikrochirurgické resekce. Autoři hodnotí své dosavadní zkušenosti s endoskopickou technikou.Materiál:
Od května 2006 do prosince 2007 bylo na Neurochirurgické klinice 1. LF UK, IPVZ a ÚVN Praha provedeno 121 endoskopických endonazálních operací selárních lézí u 93 pacientů. Z tohoto počtu bylo 101 výkonů u pacientů s adenomy hypofýzy a 20 výkonů u pacientů s jinými selárními lézemi. Posledních 93 výkonů bylo provedeno binostrální technikou.Výsledky:
Po endoskopické endonazální operaci byla v naší sérii nulová mortalita, 30denní neurologická morbidita byla 1,1 % (1× jednostranná amauróza). Celkem v 9,6 % případů (devět pacientů) byla nutná reoperace pro pooperační likvoreu.Závěr:
Endoskopická technika je dobrou alternativou ke klasické neurochirurgické technice. Vyznačuje se zejména možností variability výkonů. Hlavní komplikací rozsáhlejších endoskopických endonazálních výkonů je pooperační likvorea. Až další studie prokáží, zda endoskopická technika dosahuje lepších výsledků než mikrochirurgická technika nebo vede k výsledkům stejným. Autoři textu jsou přesvědčeni o výhodách endoskopické techniky.Klíčová slova:
selární léze – endoskopická endonazální resekce – adenom hypofýzy – chirurgická léčbaÚvod
H. Schloffer provedl první transsfenoidální operaci adenomu hypofýzy 16. března 1907 v Innsbrucku (Rakousko) [1]. H. Schloffer používal paranazální řez. V roce 1909 H. Cushing provádí první transsfenoidální operace tímto přístupem. Ale již v roce 1910 opouští paranazální řez a začíná používat řez sublabiální, který navrhli A. E. Halstead a T. Kocher [2]. Tím byl položen základ pro budoucí chirurgickou léčbu adenomů hypofýzy. H. Cushing však transsfenoidální přístup v roce 1925 opouští ve prospěch přístupu transkraniálního. Sublabiální transsfenoidální přístup nebyl zapomenut zejména díky N. Dottovi a G. Guiotovi. G. Guiot zavádí použití intraoperační flouroskopie a J. Hardy přináší zásadní zvrat do pituitární neurochirurgie – začíná používat mikroskop. Následně dochází k celosvětovému vzkříšení tohoto přístupu [3]. První transsfenoidální operaci hypofýzy v ÚVN provedl E. Černý, později se touto problematikou zabýval zejména I. Fusek, který používal tento neurochirurgický přístup od počátku 70. let [4–6]. Prosazování tohoto přístupu však bylo postupné, nikoliv skokovité. V roce 1977 byl poměr mezi transkraniálními a transsfenoidálními operacemi 1,5 : 1, v roce 2003 byl tento poměr 1 : 6.
Až do začátku roku 2004 byl na naší klinice prováděn sublabiální transseptální přístup. Od dubna 2004 do dubna 2006 jsme prováděli přímý endonazální přístup s použitím mikroskopu. Od května 2006 jsme zařadili do našeho armamentária endoskopický mononostrální endonazální přístup. Od listopadu 2006 využíváme binostrální endoskopický endonazální přístup.
Existují základní čtyři léčebné postupy v oblasti selárních lézí: observace, neurochirurgický výkon, medikamentózní terapie a ozáření (ve většině případů na Leksellově gama noži). Tyto modality se vzájemně nevylučují, naopak se doplňují. Díky kombinaci léčebných modalit lze dosáhnout vyšších léčebných efektů a snížit rizika pro pacienta.
Endoskopický přístup představuje, dle našeho názoru, minimálně invazivní neurochirurgický přístup. Binostrální technika zvyšuje rozsah možností endoskopických technik v oblasti báze lební.
Materiál a metodika
Od května 2006 do prosince 2007 bylo na Neurochirurgické klinice 1. LF UK, IPVZ a ÚVN Praha provedeno 121 výkonů u 93 nemocných se selární expanzí. U všech nemocných byl proveden endoskopický endonazální přístup.
Endoskopicky jsme provedli 101 výkonů u 78 pacientů s adenomy hypofýzy. Tento soubor tvoří 35 mužů a 43 žen, průměrný věk je 50,1 roků (tab. 1).
Table 1. Skupina pacientů s adenomem hypofýzy. 
Celkem 17 pacientů mělo nadprodukci STH (somatotropní hormon), devět pacientů nadprodukci ACTH (adrenokortikotropní hormon). U tří pacientek byla zjištěna nadprodukce PRL (prolaktin). Ve dvou případech byla operace indikována pro apoplexii do adenomu a následnou poruchu zraku, v jednom případě byla operace provedena pro nedostatečné ovlivnění hladiny prolaktinu při farmakologické terapii. Zbylých 49 pacientů mělo afunkční makroadenom hypofýzy. Z této skupiny trpělo 39 pacientů poruchou zraku, 10 pacientů mělo zrak intaktní, ale adenom dosahoval k chiazmatu a na základě pacientova souhlasu byla provedena operace.
Celkem v osmi případech se jednalo o resekci recidivy adenomu, který byl dříve operován mikrochirurgickou technikou (v průměru po 5,6 letech).
Ve skupině non‑pituitárních selárních lézí jsme provedli 20 výkonů u 15 pacientů (tento soubor tvoří 13 žen a 2 muži, průměrný věk 51,1 roků, tab. 2). Endoskopický endonazální výkon byl realizován v těchto případech: kraniofaryngeom 3×, spontánní likvorea 2×, plazmocytom 2×, meningiom 2×, karcinom sinonazálního typu 1×, herniace difuzního astrocytomu přes lamina cribriformis a s tím související nazální likvorea 1×, dermoid 1×, pacient s adenomem hypofýzy a papilomem Schneiderova typu střední nosní konchy 1×, chordom 1×, sfenoidální mukokéla 1×.
Table 2. Skupina pacientů s non-pituitárními lézemi. 
Při endoskopii byla použita optika Storz 0 st. (Karl Storz – Endoskope, Německo), u pěti nemocných optika Storz 30 st. Prvních 28 výkonů bylo provedeno mononostrální technikou, následných 93 výkonů bylo již provedeno binostrální technikou.
První operace byly prováděny mononostrální technikou [7–11]. Technika je založena na využití jednoho nosního průduchu. Nejprve je provedena lateralizace střední nosní konchy, poté je přes ipsilaterální sfenoidální ostium otevřena sfenoidální dutina. Až v samotné sfenoidální dutině je otevřena i kontralaterální část této dutiny. Jedná se o minimálně invazivní přístup. Při této technice se používají speciální nástroje (např. kyreta se sáním) tak, aby se ušetřilo místo, které by bylo nutné pro další nástroj. Do jedné nostrily je možné zavést endoskop a jeden nástroj. Endoskop zavedený do stejné nostrily omezuje pohyb bajonetových nástrojů, které potřebují větší operační prostor. Při jemných pohybech nástroje pak hrozí, že nechtěný pohyb asistenta endoskopem může způsobit i nechtěný pohyb nástroje v tureckém sedle. Tato situace může být velmi nebezpečná.
Postupně jsme však přešli na binostrální techniku – „techniku čtyř rukou“ [12–16]. I v tomto případě nejprve provádíme lateralizaci střední konchy (obvykle vlevo), poté resekujeme malou oblast (cca 0,5 × 0,5 cm) zadní části nosního septa a odstraňujeme rostrum sfenoidální dutiny. Následně je otevřena sfenoidální dutina, odstraněna jsou její veškerá septa a sliznice sfenoidální dutiny. Využití obou nosních průduchů přináší mnohé výhody – zejména větší pracovní prostor, možnost použití více nástrojů a větší rozsah pohybů s těmito nástroji (obr. 1). Po většinu operace se používá jeden pracovní nástroj (např. kyreta), jedna sací kanyla a endoskop. Prakticky během každé operace je v určité fázi výkonu nutné použít dva nástroje najednou, sací kanylu a endoskop („technika čtyř rukou“).
Image 1. Endoskopický pohled do sfenoidální dutiny, spodina tureckého sedla snesena vysokoobrátkovou frézou, kyretou a sáním je odstraňován adenom hypofýzy. 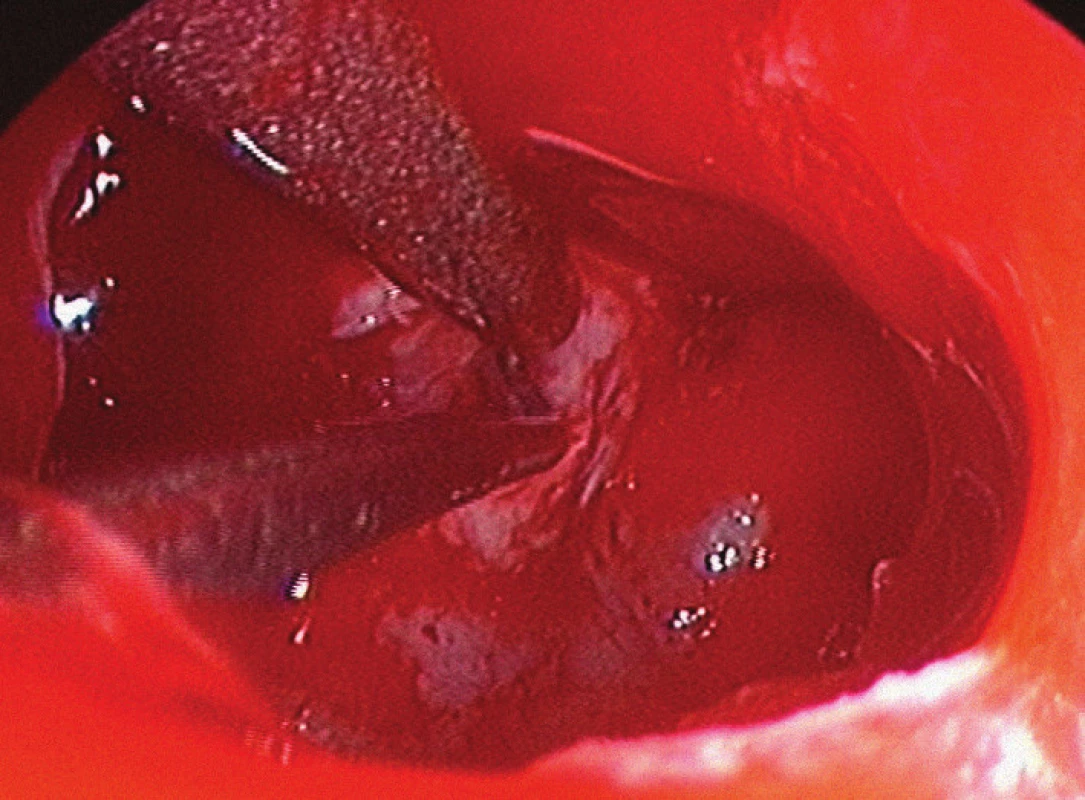
Levá nosní dírka je obvykle teritoriem asistenta, který zde většinou používá sání a endoskop. Je možné použít endoskop, který má ovladač sání i oplachu endoskopu zabudovaný v úchytu. Asistent má tak druhou ruku volnou a může ji používat k sání v operačním poli. Čistí dutinu nosní a může pomáhat i při samotné resekci tumoru. Rozsah pohybů nástroje asistenta je díky endoskopu lehce omezen. V pravém nosním průduchu endoskop není, a tudíž je zde možný velký rozsah pohybů. Nejčastěji používanými nástroji jsou sání a kyreta. Při endoskopii jsou bajonetové nástroje zbytečné a naopak zhoršují rozsah pohybu, nejlepší jsou rovné nástroje, na konci lomené v různých velikostech. Vhodné je střídání horizontálních i vertikálních kyret umožňujících uvolnění tumoru bez většího násilí. Pokud se jedná o velmi tuhý tumor, lze použít i ultrazvukový aspirátor, který má v pravé nosní dírce dostatek prostoru k pohybu. Pokud je naopak nádor měkký, je vhodná technika, při níž je tumor postupně resekován pohybem dvou sání. Problémem u měkkých tumorů může být rychlý pokles diafragmatu ve střední části. Proto je vhodné zpočátku adenom resekovat po stranách (cirkulární technika resekce). Přesto se resekci střední porce nelze vyhnout. Po poklesu diafragmatu je možné z levé nosní dírky bezpečně nadzvednout diafragma preparátorem a následně provést resekci rezidua selární léze.
Nejdůležitější částí resekce je uzavření komunikace s likvorovými cestami. Počet komunikací stoupá se zvyšováním radikality výkonu. Čím větší radikalita výkonu, tím větší je riziko poškození diafragmatu a následně riziko pooperační likvorey. Toto riziko ještě více stoupá u výkonů pro non‑pituitární léze. Pokud je cílem operace radikální resekce, nelze se vyhnout rozsáhlé komunikaci subarachnoidálního prostoru se sfenoidální dutinou. Uzavření této komunikace je zásadní zejména pro rozvoj rozšířených endonazálních přístupů [13–16]. V této sérii byly použity rozdílné postupy uzavření likvorové komunikace – jak klasické (použití fascie, svalu, či tuku + použití tkáňového lepidla, Tissucol, Baxter AG, Rakousko), tak s užitím umělého materiálu (TissuDura, Baxter AG, Rakousko).
Při endoskopické technice lze kvalitně ošetřit krvácení z nosní sliznice, proto po výkonu standardně nezavádíme přední nosní tamponádu.
Výsledky
Mortalita v tomto relativně malém souboru je 0 %, 30denní neurologická morbidita 1,3 %. U jednoho pacienta s gigantickým adenomem hypofýzy a kompletní bitemporální hemianopsií se pooperačně rozvinula jednostranná amauróza. V tomto případě došlo ke krvácení do rezidua adenomu hypofýzy, indikována byla transkraniální resekce rezidua adenomu. Výkon proběhl bez komplikací, resekce byla subtotální. Jednostranná amauróza se však neupravila, na druhém oku se předoperační temporální výpad zorného pole částečně zlepšil. Po operaci jsme nezaznamenali poruchu hypotalamických funkcí a následný minerálový rozvrat. Čtyři pacienti, kteří předoperačně nepotřebovali substituci desmopressinem (Minirin Spray, Ferring – Léčiva, a.s., ČR), pět dní po výkonu opouštěli naši kliniku s potřebou pravidelné aplikace tohoto léku. Šest měsíců po operaci pouze jeden z těchto čtyř pacientů stále potřeboval substituci desmopressinem, u zbylých tří pacientů bylo možné tuto substituci vysadit. U všech nemocných byl nasazen po operaci hydrocortison (Hydrocortison tbl., Zentiva a.s., Praha, ČR) a snižován na standardní dávku 30-20-10-0 mg p.o. před překladem do endokrinologické péče, kde byl dále snižován dle funkcí adenohypofýzy. Ve skupině STH produkujících adenomů došlo k endokrinologické normalizaci v 58,9 % případů (tj. u 10 pacientů), ve skupině ACTH produkujících adenomů v 66,6 % případů (tj. u šesti pacientů) a ve skupině PRL produkujících adenomů v 33,3 % (tj. u jedné pacientky).
Předoperačně se vyskytovala porucha zraku u 39 pacientů. Pooperačně se zrak výrazně zlepšil/upravil v 29 případech (74,4 %), beze změn zůstal v devíti případech (23,1 %) a v jednom případě se zhoršil (2,6 %) – tab. 3.
Table 3. Oftalmologické výsledky u pacientů s předoperační poruchou zraku. 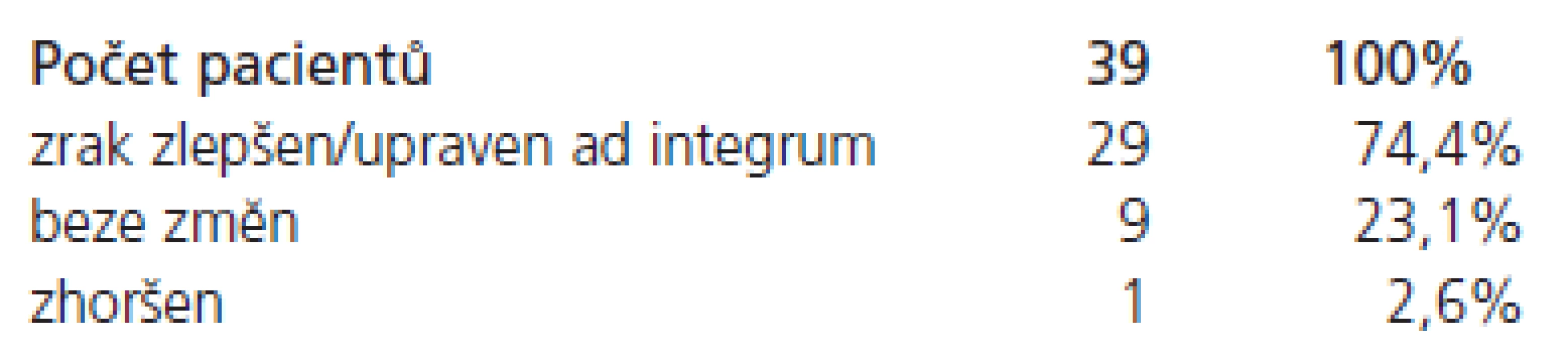
Parciální resekce u afunkčních makroadenomů byla indikována v 17 případech (vzhledem k růstu adenomu hypofýzy do kavernózního splavu, zejména laterálně od krkavice, paraselární růst adenomu, biologický věk pacienta, významná komorbidita atd.). Pokus o radikální resekci byl indikován v 32 případech afunkčních adenomů. Tohoto cíle bylo dosaženo v 23 případech (71,9 %), cíle nebylo dosaženo v devíti případech (28,1 %). Ve dvou případech se jednalo o velmi tuhý adenom hypofýzy, v sedmi případech byl operatér přesvědčen o radikalitě výkonu, ale na kontrolní MR bylo reziduum adenomu odhaleno (tab. 4).
Table 4. Výsledky ve skupině afunkčních adenomů hypofýzy, kde byla indikována radikální resekce. 
Ve skupině pacientů s adenomem hypofýzy bylo provedeno 23 druhých výkonů. V sedmi případech byla indikována operace pro pooperační nazální likvoreu. Po druhé operaci nebyla zaznamenána recidiva likvorey. U sedmi pacientů s gigantickými adenomy byl plánovitě proveden dvoudobý výkon, tj. během prvního výkonu byla provedena parciální resekce adenomu a po třech měsících (po poklesu kraniální složky tumoru) byla provedena druhá operace (obr. 2 a–c). Ve čtyřech případech byla indikována druhá operace vzhledem k neuspokojivému nálezu na kontrolní MR po třech měsících, tj. u pacientů s příliš velkým reziduem adenomu. V pěti případech byla indikována reoperace pro přetrvávající hormonální nadprodukci (3× u STH adenomu, 2× u ACTH adenomu).
Obr. 2a. Předoperační MR po podání kontrastní látky u pacienta s adenomem hypofýzy, koronární řez. 
Obr. 2b. MR dva měsíce po první operaci, stejný řez, stejná technika zobrazení. Stav po parciální resekci adenomu, reziduum adenomu však již „spadlo“, jasně diferencovatelné chiazma, kterého se nyní dotýká reziduum adenomu, není však elevováno. 
Obr. 2c. MR první pooperační den po druhém transsfenoidálním výkonu, stejný řez, stejná technika zobrazení, chiazma nyní zcela volné. 
Mortalita ve skupině non‑pituitárních lézí byla 0 %, neurologická morbidita 0 %, avšak u 20 % pacientů byl indikován následující operační výkon pro nazální likvoreu. 30denní morbidita u těchto pacientů nebyla zaznamenána, přesto procento reoperací pro nazální likvoreu je v současné době vysoké.
Radikální/subtotální resekce bylo dosaženo u dvou ze tří kraniofaryngeomů, u jednoho ze dvou meningiomů (u pacientky s meningiomem planum shenoidale), u chordomu báze lební (obr. 3 a, b),dermoidu a papillomu Schneiderova typu. U karcinomu sinonazálního typu, plazmocytomu a herniovaného astrocytomu byla indikována rozšířená biopsie, radikální výkon nebyl indikován.
Obr. 3a. Předoperační MR, axiální řez, T2 vážení. Rozsáhlý chordom báze lební. 
Obr. 3b. Po operační MR, axiální řez, T2 vážení. Stav po subtotální endoskopické endonazální resekci. 
Ve skupině non‑pituitárních selárních lézí byl celkem pětkrát proveden další operační výkon: dvě operace u pacientky se spontánní likvoreou (1× provedena reoperace pro přetrvávající likvoreu, 1× zaveden ventrikuloperitoneální shunt), dvě operace u pacientky s pooperační likvoreou (1× reoperace, 1× zaveden ventrikuloperitoneální shunt), u jedné pacientky byla první operace přerušena pro arteriální krvácení, samotná resekce byla provedena během druhé operace.
Nosní tamponádu jsme zaváděli v těchto indikacích: pro difuzní peroperační endonazální krvácení v šesti případech (v pěti případech při reoperaci), v jednom případě při peroperačním krvácení z krkavice, v devíti případech reoperací pro pooperační likvoreu. V jednom případě z celé prezentované série bylo nutné pooperačně zavést nosní tamponádu pro nosní krvácení. Ve zbylých 104 případech nebyla zavedena nosní tamponáda (85,9 % celého souboru). V těchto případech pacienti výrazně pozitivně hodnotili pooperační komfort, analgetika byla podávána zcela sporadicky.
Diskuze
V roce 2004 jsme opustili klasický sublabiální transseptální přístup a začali provádět přímý endonazální přístup. Mikrochirurgické techniky (jak při sublabiálním, tak přímém endonazálním přístupu) vyžadují použití endonazálního rozvěrače, který komprimuje okolní nazální sliznici.
Od konce 90. let minulého století lze v literatuře pozorovat strmý nástup publikací o endoskopické technice operací selárních lézí. My jsme na tuto techniku přešli v roce 2006.
Nelze však tvrdit, že mikrochirurgická technika „se přežila“ a že je prokázáno, že endoskopické výkony dosahují lepších výsledků. Mnohá zahraniční pracoviště tento přístup stále doporučují [17–20]. Z českých autorů se nedá opomenout práce Náhlovského et al [21], kteří analyzovali rizika transsfenoidálních výkonů při použití mikrochirurgické techniky, a Sameše et al [22], kteří prezentovali výsledky přímého endonazálního přístupu mikrochirurgickou technikou.
Je nutné připustit, že pro neurochirurgy, kteří dlouhá léta operují pod mikroskopem, je přechod na endoskopické techniky složitý, a tudíž i potenciálně rizikový. Taktéž je na obranu mikroskopických technik nutné uvést fakt, že operační výkon mikroskopickou technikou je rychlejší, a tudíž zkracuje dobu celkové anestezie. „Zdlouhavost“ endoskopického přístupu jsme pozorovali zejména v roce 2006, nyní se již časově výrazně neliší od mikrochirurgického přístupu.
Nutnost použití rozvěrače a větší flexibilita endoskopického přístupu nás přiměly opustit klasický mikrochirurgický přístup. V roce 2006 jsme poprvé použili čistě endoskopickou mononostrální endonazální techniku při resekcích selárních expanzí. Brzy jsme však (po 28 výkonech) přešli k binostrální technice.
Endonazální operace je založena na průniku dutinou nosní s minimálním atakováním přítomných struktur. Při rozsáhlejších výkonech v oblasti báze lební však Kassam et al nejprve resekují jednu střední konchu a druhou lateralizují [14–16]. Takto získávají ještě větší rozsah pohybů, který je nutný při operacích tumorů v oblasti přední jámy lební, kavernózního splavu a klivu. My tuto techniku prozatím nepoužíváme. Při použití této techniky bychom očekávali větší nazální morbiditu, ale pittsburská skupina referuje dobré výsledky i v této oblasti [23].
Těsně před operací je provedena anemizace a dezinfekce dutiny nosní. Pro endoskopickou techniku je nezbytná velmi dobrá spolupráce operatéra s asistentem. Asistent ovládá endoskop a odsává převážně v levé části dutiny nosní. Operatér se pak většinou pohybuje v pravé části dutiny nosní, kde používá resekční nástroje a sání. Dnes též využíváme tzv. techniky dvou sání (nádor je resekován pomocí těchto sání, kyreta se v tomto případě nepoužívá) a ultrazvukového aspirátoru (včetně kostního ultrazvukového aspirátoru).
Velmi důležité pro rozvoj techniky je využití moderní navigační technologie [24]. V našem případě bezrámová navigace Stealth, Medtronic, USA. Nejedná se však o zařízení, které by nám umožňovalo operovat, ale o pomůcku zlepšující orientaci operatéra. Též u drobných hormonálně aktivních tumorů nás navigační systém navádí přímo na nádor, snižuje riziko poškození adenohypofýzy, a tím zvyšuje naději na kompletní zachování hypofyzárních funkcí.
Velmi přínosné jistě bude použití peroperační magnetické rezonance, která zřejmě pomůže zvýšit radikalitu výkonů, aniž se zvýší výskyt operačních komplikací [19,25–27]. Tato metoda nebyla v prezentovaném souboru použita, ale od dubna 2008 je na našem pracovišti rutinně využívána.
Zvyšování radikality výkonu (např. resekce porce tumoru, která prorůstá do kavernózního splavu) potenciálně zvyšuje riziko poškození vnitřní karotidy. Díky možnosti stereotaktického ozáření rezidua adenomu hypofýzy (např. v kavernózním splavu) není morbidita spojená se snahou o radikalitu výkonu v této oblasti přijatelná.
Při odstraňování meningeomu planum sphenoidale jsme narazili na krvácení z karotidy v místě invaze tumoru. Jedná se o poměrně intenzivní krvácení, které je ale v tomto prostoru zvladatelné lokání tamponádou hemostatickým materiálem (Surgicell, Johnson & Johnson, USA). Je však nutné provést kontrolní angiografické vyšetření, abychom vyloučili případně vzniklé pseudoaneuryzma, které by bylo indikované k endovaskulárnímu ošetření. V našem případě ke vzniku pseudoaneuryzmatu nedošlo. Stejný přístup k této komplikaci prezentovali např. Cappabianca et al [28].
Pooperační likvorea je hlavní komplikací endonazálních výkonů pro non‑pituitární patologie báze lební. Zvláštní skupinu představují pacienti se spontánní nazální likvoreou, u kterých dochází k rozvoji hyporesorbce likvoru. Proto samotné ošetření místa úniku likvoru bývá nedostatečné a ve větším procentu případů je nutné zavést trvalou drenáž mozkomíšního moku (obvykle ventrikulo-peritoneální shunt). Zcela odlišnou kategorii též představují non‑pituitární léze báze lební, při jejichž resekci dochází k široké komunikaci mezi subarachnoidálním prostorem a dutinou nosní. Uzavření takovéto komunikace je obtížné a v současné době neexistuje jedna určitá technika, která by tuto situaci excelentně řešila. Jako nadějné se ukazují techniky, které využívají živených laloků.
V námi prezentovaném souboru bylo pozorováno vyšší procento pooperační likvorey i ve skupině adenomů hypofýzy. Jsme přesvědčeni, že je to dáno jednak učební křivkou v oblasti endoskopické techniky a též snahou o maximální radikalitu výkonů, která přináší větší procento peroperační likvorey. Endoskopické výkony pro non‑pituitární patologie naleznou své pevné uplatnění ve spektru výkonů v oblasti báze lební v případě, že se podaří snížit procento pooperačních likvoreí. V posledních letech byly prezentovány různé techniky plastiky báze lební po endonazálních výkonech [29–34]. Další práce teprve prokáží, která technika v této oblasti je nejvhodnější.
Transkraniální přístupy k selárním lézím používáme zřídka (u adenomů hypofýzy v poměru cca 50 : 1). Přesto je nelze opomenout a zcela vyřadit ze spektra výkonů v dané problematice [35–37]. Rizika těchto výkonů odpovídají důležitým strukturám, které v této oblasti zastiňují tumor, tj. optický nerv, karotida, perforátory. Nelze též opomenout fakt, že k transkraniálnímu výkonu jsou indikovány nejkomplikovanější adenomy hypofýzy (velikost, směr růstu, předchozí operační výkony).
Závěr
Endoskopická endonazální technika je vhodná technika k resekci adenomů hypofýzy a přilehlých lézí báze lební. Endoskopické techniky přinášejí vysoký komfort pro nemocné vhledem k absenci nosní tamponády. Neurologická morbidita těchto výkonů je minimální. Binostrální technika přináší možnost většího rozsahu a variability endonazálních výkonů. Hlavní komplikací těchto výkonů je pooperační likvorea. Techniky, které mají této komplikaci zabránit, se stále vyvíjejí a teprve další studie prokáží, který postup v této oblasti je nejvhodnější.
MUDr. Václav Masopust
Neurochirurgická klinika
1. LF UK, IPVZ a ÚVN Praha
U vojenské nemocnice 1200
16902 Praha 6
e‑mail: vaclav.masopust@uvn.cz
Přijato k recenzi: 23. 6. 2008
Přijato do tisku: 23. 9. 2008
Sources
1. Lindholm J. A century of pituitary surgery: Schloffer‘s legacy. Neurosurgery 2007; 61(4): 865–867.
2. Cohen-Gadol AA, Liu JK, Laws ER jr. Cushing‘s first case of transsphenoidal surgery: the launch of the pituitary surgery era. J Neurosurg 2005; 103(3): 570–574.
3. Liu JK, Das K, Weiss MH, Laws ER jr, Couldwell WT. The history and evolution of transsphenoidal surgery. J Neurosurg 2001; 95(6): 1083–1096.
4. Fusek I, Černý E. Transsphenoidal operation of hypophyseal tumors. J Neurosurg Sci 1977; 21, 159–160.
5. Fusek I, Černý E. Naše zkušenosti s indikacemi transsfenoidálních operací nádorů tureckého sedla. Cesk Neurol Neurochir 1978; 41(2): 107–114.
6. Fusek I. Chirurgické léčení nádorů tureckého sedla transsfenoidálním přístupem. Praha: Avicenum 1986.
7. Cappabianca P, Alfieri A, de Divitiis E. Endoscopic endonasal transsphenoidal approach to the sella: towards functional endoscopic pituitary surgery (FEPS). Minim Invasive Neurosurg 1998; 41(2): 66–73.
8. Cappabianca P, Alfiery A, de Divitiis E, Tschabitscher M. Atlas of Endoscopic Anatomy for Endonasal Intracranial Surgery. New York: Springer-Verlag 2001 : 134.
9. Cappabianca P, Alfiery A, Thermes S, Buonamassa S, de Divitiis E. Instruments for endoscopic endonasal transsphenoidal surgery. Neurosurgery 1999; 45(2): 392–396.
10. de Divitiis E, Cappabianca P. Endoscopic endonasal transspehenoidal surgery. In: Pickard JD et al (eds). Advances and Technical Standards in Neurosurgery. 27th ed. New York: Springer-Verlag 2002 : 137–177.
11. Jho HD, Carrau RL. Endoscopic endonasal transsphenoidal surgery: experience with 50 patients. J Neurosurg 1997; 87(1): 44–51.
12. Cavallo LM, Messina A, Gardner P, Esposito F, Kassam AB, Cappabianca P et al. Extended endoscopic endonasal approach to the pterygopalatine fossa: anatomical study and clinical considerations. Neurosurg Focus 2005; 19(1): E5.
13. de Divitiis E, Cappabianca P, Cavallo LM. Endoscopic transsphenoidal approach: adaptability of the procedure to different sellar lesion. Neurosurgery 2002; 51(3): 669–707.
14. Kassam A, Snyderman CH, Mintz A, Gardner P, Carrau RL. Expanded endonasal approach: the rostrocaudal axis. Part I. Crista galli to the sella turcica. Neurosurg Focus 2005; 19(1): E3
15. Kassam A, Snyderman CH, Mintz A, Gardner P, Carrau RL. Expanded endonasal approach: the rostrocaudal axis. Part II. Posterior clinoids to the foramen magnum. Neurosurg Focus 2005; 19(1): E4
16. Kassam A, Gardner P, Snyderman C, Mintz A, Carrau R. Expanded endonasal approach: fully endoscopic, completely transnasal approach to the middle third of the clivus, petrous bone, middle cranial fossa, and infratemporal fossa. Neurosurg Focus 2005; 19(1): E6.
17. Dusick JR, Esposito F, Mattozo CA, Chaloner C, McArthur DL, Kelly DF. Endonasal transsphenoidal surgery: the patient‘s perspective-survey results from 259 patients. Surg Neurol 2006; 65(4): 332–341.
18. Ludecke DK, Abe T. Transsphenoidal microsurgery for newly diagnosed acromegaly: a personal view after more than 1,000 operations. Neuroendocrinology 2006; 83(3–4): 230–239.
19. Nimsky C, von Keller B, Ganslandt O,Fahlbusch R. Intraoperative high‑field magnetic resonance imaging in transsphenoidal surgery of hormonally inactive pituitary macroadenomas. Neurosurgery 2006; 59(1): 105–114.
20. Shou XF, Li SQ, Wang YF, Zhao Y, Jia PF, Zhou LF. Treatment of pituitary adenomas with a transsphenoidal approach. Neurosurgery 2005; 56(2): 249–256.
21. Náhlovský J, Česák J, Látr I, Čáp J, Žižka J, Krajina A. Komplikace transsfenoidálních operací u našich nemocných – příčiny, řešení. Cesk Slov Neurol N 2004; 67/100(2): 112–119.
22. Sameš M, Vachata P, Saur K, Budíková M.Přímý transnazální miniinvazivní přístup pro mikrochirurgickou resekci adenomů hypofýzy. Cesk Slov Neurol N 2005; 68/101(5): 338–342.
23. Snyderman C, Kassam A, Carrau R, Mintz A, Gardner P, Prevedello DM. Acquisition of surgical skills for endonasal skull base surgery: a training program. Laryngoscope 2007; 117(4): 699–705.
24. Elias WJ, Chadduck JB, Alden TD, Laws ER jr. Frameless stereotaxy for transsphenoidal surgery. Neurosurgery 1999; 45(2): 271–277.
25. Fahlbush R, Ganslandt O, Buchfelder M, Schott W, Nimsky C. Intraoperative magnetic resonance imaging during transsphenoidal surgery. J Neurosurg 2001; 95(3): 381–390.
26. Martin CH, Schwartz R, Jolesz F, Black PM. Transspehenoidal resection of pituitary adenomas in an intraoperative MRI unit. Pituitary 1999; 2(2): 155–162.
27. Nimsky C, Ganslandt O, Kober H, Buchfelder M, Fahlbusch R. Intraoperative magnetic resonance imaging combined with neuronavigation: a new concept. Neurosurgery 2001; 48(5): 1082–1091.
28. Cappabianca P, Briganti F, Cavallo LM, de Divitiis E. Pseudoaneurysm of the intracavernous carotid artery following endoscopic endonasal trans‑spehenoidal surgery treated by endovascular approach. Acta Neurochir (Wien) 2001; 143(1): 95–96.
29. Cappabianca P, Cavallo LM, Mariniello G,de Divitiis O, Romero AD, de Divitiis E. Easy sellar reconstuction in endoscopic endonasal transsphenoidal surgery with polyester-silicone dural substitute and fibrin glue: technical note. Neurosurgery 2001; 49(2): 473–476.
30. de Divitiis E, Esposito F, Cappabianca P, Cavallo LM, de Divitiis O. Tuberculum sellae meningiomas: high route or low route? A series of 51 consecutive cases. Neurosurgery 2008; 62(3): 556–563.
31. de Divitiis E, Cappabianca P, Cavallo LM, Esposito F, de Divitiis O, Messina A. Extended endoscopic transsphenoidal approach for extrasellar craniopharyngiomas. Neurosurgery 2007; 61 (5 Suppl 2): 219–227.
32. Fortes FS, Carrau RL, Snyderman CH, Kassam A, Prevedello D, Vescan A et al. Transpterygoid transposition of a temporoparietal fascia flap: a new method for skull base reconstruction after endoscopic expanded endonasal approaches. Laryngoscope 2007; 117(6): 970–976.
33. Fortes FS, Carrau RL, Snyderman CH, Prevedello D, Vescan A, Mintz A et al. The posterior pedicle inferior turbinate flap: a new vascularized flap for skull base reconstruction. Laryngoscope 2007; 117(8): 1329–1332.
34. Snyderman CH, Kassam AB, Carrau R, Mintz A. Endoscopic Reconstruction of Cranial Base Defects following Endonasal Skull Base Surgery. Skull Base 2007; 17(1): 73–78.
35. Ray BS. Intracranial hypophysectomy. J Neurosurg 1968; 28(2): 180–186.
36. Buchfelder M, Kreutzer J. Transcranial surgery for pituitary adenomas. Pituitary. In press 2008.
37. Youssef AS, Agazzi S, van Loveren HR. Transcranial surgery for pituitary adenomas. Neurosurgery 2005; 57(1 Suppl): 168–175.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2008 Issue 6-
All articles in this issue
- Spánková apnoe dospělého věku
- Monitorování mozkové oxygenace
- Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy
- Vztah atrofie amygdaly a dalších vybraných mozkových struktur k emocionální agnozii u Alzheimerovy nemoci
- Farmakoepidemiologická studie souboru 427 pacientů léčených pro epilepsii
- Vyšetřování proteinu 14-3-3 v mozkomíšním moku – klinicko‑patologická korelace
- Syndrom kubitálního kanálu. Srovnání operačních technik prosté dekomprese a přední transpozice ulnárního nervu
- Endonazální endoskopická transsfenoidální resekce selárních lézí
- Přední krční mikroforaminotomie v řešení unilaterální monosegmentální radikulopatie (prospektivně vedená pilotní studie – 15 pacientů)
- Extraoperativní mapování pomocí kortikálního gridu před resekcí difuzního oligodendrogliomu v řečově dominantní hemisféře – alternativa „awake kraniotomie“ – kazuistika
- Status absencí u geriatrického pacienta s recentní diagnózou idiopatické generalizované epilepsie – kazuistika
- Subakutně probíhající reverzibilní hypertenzní leukoencefalopatie – kazuistika
- Rozdíly v počtu CAG opakování mezi pohlavími a jejich korelace s klinickým obrazem u Huntingtonovy choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy
- Spánková apnoe dospělého věku
- Subakutně probíhající reverzibilní hypertenzní leukoencefalopatie – kazuistika
- Vyšetřování proteinu 14-3-3 v mozkomíšním moku – klinicko‑patologická korelace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

