-
Medical journals
- Career
Protilátky proti glykokonjugátům v diagnostice autoimunitních neuropatií
Authors: K. Malíčková; I. Janatková; P. Šandová; T. Zima
Authors‘ workplace: Ústav klinické biochemie a laboratorní diagnostiky 1. LF UK a VFN, Praha
Published in: Cesk Slov Neurol N 2007; 70/103(6): 631-636
Category: Review Article
Overview
Autoimunitní neuropatie jsou imunopatologické stavy, které mohou být provázeny přítomností protilátek proti glykokonjugátům buněčných membrán nervových buněk. Nejvíce se uplatňují autoagresivní reakce proti gangliosidům a některým glykoproteinům, například proti glykoproteinu asociovanému s myelinem. U řady zánětlivých neuropatií lze definovat poměrně přesný profil anti-glykokonjugátových autoprotilátek. V současné době je v klinické laboratorní diagnostice dostupné testování protilátek proti širokému spektru gangliosidů a glykoproteinů, technicky se uplatňují především blotové metody, enzymová imunoanalýza a nepřímá imunofluorescence. Jde o metody časově a finančně dostupné, které mohou přispět ke stanovení či upřesnění diagnózy neuropatie.
Klíčová slova:
autoimunitní neuropatie – gangliosidy – glykoprotein asociovaný s myelinem – autoprotilátky – imunoblot – enzymová imunoanalýza – nepřímá imunofluorescenceÚvod
V posledních letech došlo ke znatelnému pokroku v objasnění klinické patofyziologie autoimunitních neuropatií. Výsledky výzkumů nasvědčují tomu, že možnými účastníky imunopatologických pochodů u těchto onemocnění jsou protilátky proti epitopům na karbohydrátových úsecích glykokonjugátů buněčných membrán [1,2,3].
Glykokonjugáty jsou zastřešujícím názvem pro sloučeniny obsahující karbohydrátovou (cukernou) složku, kovalentně vázanou na jinou (necukernou) chemickou strukturu. Dělí se do 5 skupin na 1. glykoproteiny, 2. glykopeptidy, 3. peptidoglykany, 4. glykolipidy a 5. lipopolysacharidy. U autoimunitních neuropatií jsou autoagresivní pochody namířeny zejména proti glykolipidům (do této skupiny patří např. gangliosidy, sulfatidy a sulfát-3-glukuronylparaglobosid) a proti glykoproteinúm (např. proti glykoproteinu asociovaný s myelinem, myelin-associated glycoprotein -MAG).
Protilátky proti glykokonjugátům v izotypu IgG jsou asociovány s akutními neuropatiemi a autoprotilátky v izotypu IgM jsou nacházeny u chronických stavů [3,4].
Přesná úloha protilátek proti glykokonjugátům u autoimunitních neuropatií dosud není zcela jasná. Neznáme především odpověď na základní otázku, a to zda mohou tyto autoprotilátky iniciovat proces vedoucí k neuropatii, a jsou tedy přímými aktéry primárního imunopatologického poškození, anebo zda jsou pouze průvodním jevem jiného (dosud neznámého) chorobného procesu, jehož následkem je poškození periferních nervů. Tato otázka je předmětem výzkumu mnoha vědeckých studií (jen za rok 2006 cituje databáze MEDLINE na dvě stovky prací, zaměřených na možné patofyziologické mechanizmy působení protilátek proti glykokonjugátům). Víme, že za normálních okolností nemají protilátky izotypu IgM schopnost proniknout do endoneuria vůbec a IgG protilátky pouze velmi omezeně. Prostup protilátek do endoneuria umožňuje poškození hematoneurální bariéry např. prostřednictvím cytokinů či jiných zánětlivých mediátorů. Teorie přímé účasti autoprotilátek na vzniku neuropatií předpokládají zejména poškození neuronů komplementem a nebo mechanizmy buněčné cytotoxicity závislé na protilátkách (antibody dependent cell cytotoxicity, ADCC) [5].
V oblasti klinické diagnostiky slouží stanovení protilátek proti glykokonjugátům jako doplňkové vyšetření k elektrofyziologickým, zobrazovacím a dalším (např. likvorologickým) analýzám. Pozitivní průkaz protilátek v séru by mohl zvýšit diagnostický záchyt periferních neuropatií a sledování dynamiky titru protilátek by v některých případech mohlo sloužit k monitoraci úspěšnosti terapie.
Protilátky proti gangliosidům
Gangliosidy patří do skupiny glykosfingolipidů. Jejich molekula se skládá z hydrofobního ceramidu (ceramid = N-acetylovaný sfingosin neboli aminoalkohol 2-amino-4-oktadecen-1,3-diol), na který je navázán hydrofilní oligosacharidový řetězec obsahující jeden až čtyři monosacharidy (některou z hexóz, např.glukózu, galaktózu, fukózu) a N-acetylneuraminovou kyselinu (neboli sialovou kyselinu) – schema struktury molekul některých gangliosidů uvádí obr. 1.
Image 1. Schéma molekul gangliosidů. 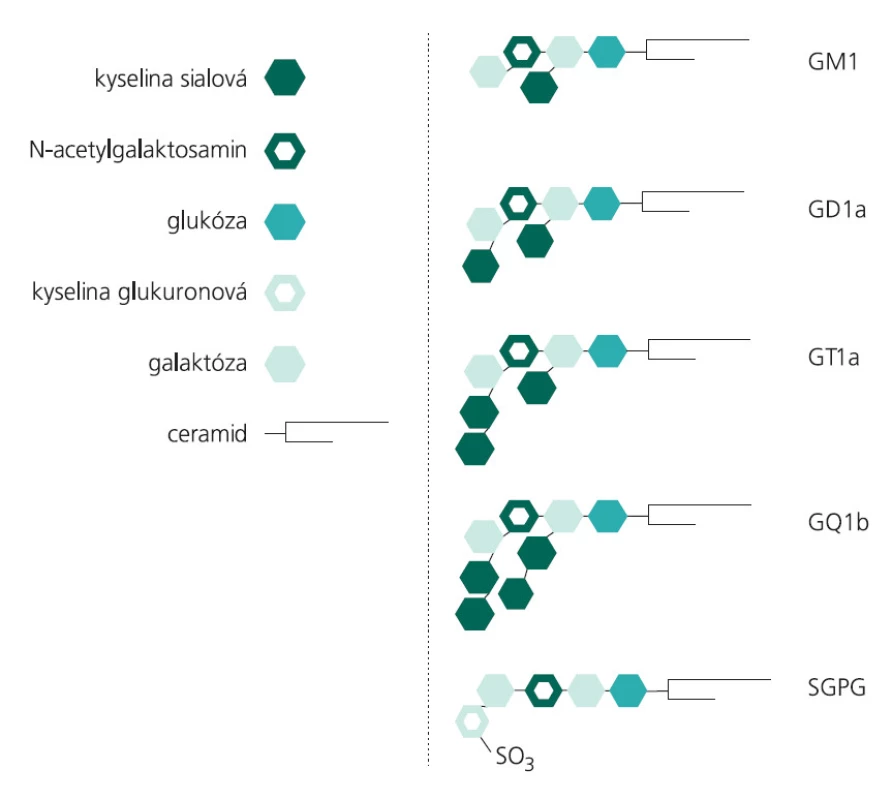
Hydrofobní část molekul je zanořena do lipidové dvouvrstvy buněčné membrány, hydrofilní sacharidová část ční nad povrch buněk.
Gangliosidy poprvé popsal v polovině minulého století Němec Ernst Klenk [6]. Izoloval je z mozkových ganglií (odtud jejich název). V mozkové tkáni tvoří gangliosidy asi 6 % z celkových lipidů. Dnes je známo, že gangliosidy jsou obsaženy v buněčných membránách všech tkání.
Gangliosidy jsou velmi heterogenní molekuly. Jejich heterogenitu poprvé zmínil Svennerholm v roce 1956 [7], který je rovněž autorem nomenklatury (obr. 2) [8,9].
Image 2. Nomenklatura gangliosidů. 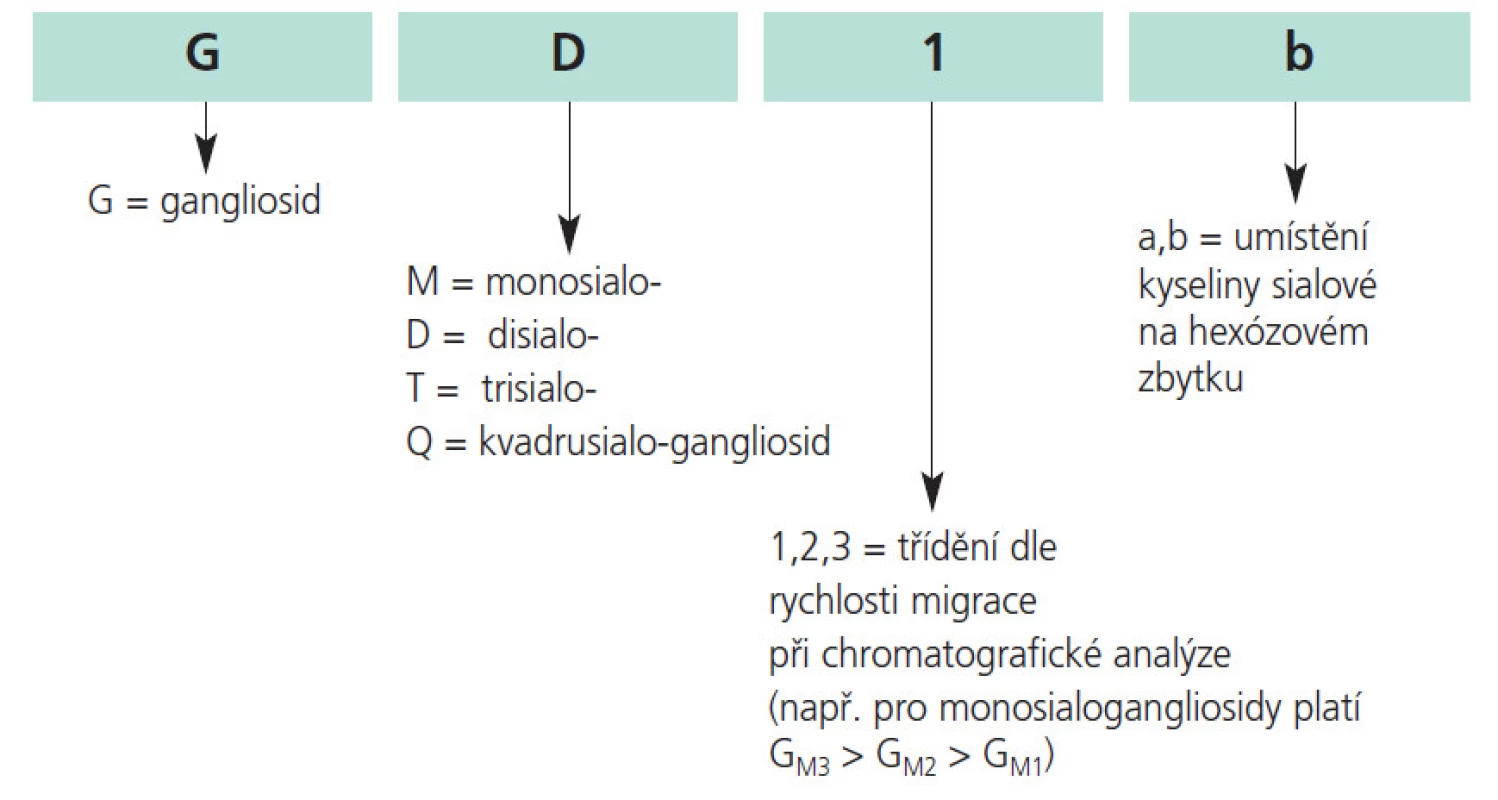
Je popsáno více než 100 gangliosidů, mimo mozek je nejčastějším gangliosidem GM3 [10]. V nervových buňkách centrálního a periferního nervového systému jsou nejvíce zastoupeny GM1, GD1a, GD1b a GT1, kde plní úlohu funkčních ligandů stability myelinu a prostřednictvím vazby na glykoprotein asociovaný s myelinem se účastní řízení regenerace nervů [1,11,12,13]. Na gangliosidy jsou nejbohatší oblasti Ranvierových zářezů a presynaptická nervová zakončení. V motorických nervech převládají GM1 a GD1, v senzitivních nervech převažují obecně disialogangliosidy (zejména GD1, GD2 a GD3), GQ1 jsou hojně zastoupeny v kraniálních motorických nervech inervujících extraokulární svaly [4,10].
Antigenním epitopem gangliosidů je nejčastěji extracelulární hydrofilní karbohydrátová struktura, vzácně ceramid v lipidové membráně. Tyto epitopy slouží in vivo jako receptory pro cytokiny, účastní se adhezních procesů, kde představují vazebná místa pro toxiny, viry a bakterie, kdy se cukerná část glykolipidu váže na lektinový receptor patogenu nebo na bakteriální toxiny [14,15].
Nejzávažnějším patofyziologickým mechanizmem vzniku postinfekčních autoagresivních reakcí, vedoucích k manifestaci neuropatií, jsou molekulární mimikry (tab. 1): gangliosidům jsou velmi podobné lipo-oligosacharidy (LOS) mnoha mikrobů [16,17,18].
Table 1. Lidské gangliosidy versus lipo-oligosacharidy mikrobiálního původu – molekulární mimikry. 
Indikace vyšetření protilátek proti gangliosidům a možné panely autoprotilátek u jednotlivých klinických diagnóz uvádí tab. 2.
Table 2. Přehled protilátek proti gangliosidům a souvislost jejich výskytu s akutními a chronickými zánětlivými neuropatiemi. 
Protilátky proti glykoproteinu asociovanému s myelinem (anti-myelin associated glycoprotein antibodies, anti-MAG)
MAG je prokázaným autoantigenem některých monoklonálních imunoglobulinů izotypu IgM u neuropatií [4]. Jde o 100 kDa glykoprotein s jednou transmembránovou, jednou cytoplazmatickou a pěti extracelulárními „imunoglobulin-like“ doménami. Hlavním antigenním epitopem MAG je trisacharid se sulfoskupinou zvaný HNK-1 (HSO3-3GlcAb1-3Gal1-4GlcNAc). Tuto sacharidovou sekvenci ovšem nacházíme rovněž i v jiných glykokonjugátech asociovaných s myelinem, např. v sulfát-3-glukuronylparaglobosidu (SGPG), z čehož vyplývá zkřížená pozitivní reaktivita sér anti-MAG pozitivních s anti-SGPG pozitivními (viz dále) [3,5,19]. Asociace anti-MAG s klinickými projevy chronické demyelinizační neuropatie byla poprvé popsána v roce 1980 [13]. Přítomnost anti-MAG v izotypu IgM je spjata s chronickou senzomotorickou demyelinizující periferní neuropatií, při které zpočátku dominují příznaky poškození senzitivních a až později motorických nervů. Asi 50 % pacientů s monoklonální gamapatií IgM a s klinickými projevy neuropatie vykazuje pozitivitu anti-MAG. Tyto autoprotilátky zřejmě interferují s procesem myelinizace a narušují interakci mezi axonem a „jeho“ Schwannovou buňkou, protože hlavní funkcí MAG je role adhezivní molekuly pro Schwannovy buňky při myelinizaci.
Indikace vyšetření anti-MAG: distální symetrická neuropatie vzniklá ve věku > 50 let, s tremorem a poruchami chůze, bolestmi DK, u 85 % pozitivit je zároveň přítomna monoklonální gamapatie IgM. Nejlepší prognózu mají pacienti s poklesem titru anti-MAG po imunointervenční léčbě o > 60 % [19].
Protilátky proti sulfát-3-glukuronylparaglobosidu (anti-SGPG) [4]
SGPG (sulfát-3-glukuronylparaglobosid) je kyselý glykolipid, jehož hlavním antigenním epitopem je stejně jako u MAG trisacharid HNK-1. Pro anti-MAG a anti-SGPG je proto typická značná zkřížená reaktivita a pro anti-SGPG proto platí většina údajů z předchozí části.
Velmi vzácné případy anti-MAG negativních a anti-SGPG pozitivních pacientů patří do klinické skupiny multifokálních motorických (axonálních) neuropatií bez demyelinizace. Polyklonální IgM protilátky proti SGPG nereagující s MAG byly ojediněle nalezeny i u nemocných s amyotrofickou laterální sklerózou.
Protilátky proti sulfatidům [10]
Sulfatidy jsou galaktocerebrosidy (ceramid + jedna galaktóza) se sulfoskupinou na třetím uhlíku galaktózy. Nacházejí se v myelinu axonů, ale též na membránách endoneuronálních makrofágů nebo v cytoplazmě Schwannových buněk.
Protilátky proti sulfatidům jsou nacházeny u polyneuropatií s dominujícím senzitivním postižením v distálních partiích končetin (bolesti nebo parestezie rukou a nohou), a to většinou u osob starších 50 let. Klinicky je často vyjádřen tzv. GALOP syndrom (gait disorder, autoantibody, late-age onset, polyneuropathy). Je-li u postižených osob nalezena též monoklonální gamapatie, můžou být přítomny i anti-MAG.
Přítomnost anti-sulfatidových protilátek naznačuje pravděpodobný pomalu progredující (mnohaletý) průběh onemocnění.
Indikace vyšetření: distální symetrická převážně senzorická neuropatie, věk > 50 let.
Laboratorní diagnostika protilátek proti glykokonjugátům
V posledních 5 letech světoví výrobci laboratorních diagnostik značně rozšířili nabídku diagnostických souprav na vyšetřování protilátek proti glykokonjugátům. Uplatňují se různé metody stanovení, soupravy různých výrobců se liší použitými glykokonjugáty (zdroj, čistota), z čehož může plynout mezilaboratorní variabilita výsledků.
V našich podmínkách se v oblasti detekce protilátek proti glykokonjugátům nejvíce rozšířily blotové techniky, enzymová imunoanalýza a nepřímá imunofluorescence.
Principem blotové techniky je separace antigenů elektroforeticky nebo izoelektrickou fokusací a následné přenesení na nitrocelulózovou membránu. Tento typ blotů se nazývá Western blot. Jiným podobným produktem je imunodot, u kterého je využíváno silně purifikovaných nativních antigenů nebo uměle připravených rekombinantních antigenů, které se přímo nanášejí na membránu. Doty jsou ve srovnání s bloty standardnější a jejich odečítání je snazší. Výrobce dodává již hotový nosič antigenů, který se inkubuje s vyšetřovaným materiálem (sérum, plazma, mozkomíšní mok). Výhodou blotových metod je možnost detekce několika cílových protilátek najednou, citlivost testů se pohybuje u hranice stanovitelnosti imunoglobulinů. U nás jsou k dispozici soupravy různých výrobců, např. Euroline–Euroimmun, Generic Assays, Immco nebo Bühlmannn. Na našem pracovišti používáme imunodot Euroline. Tento profil obsahuje antigeny GM1, GM2, GD1, GD2, GD3, GT1 a GQ1b, autoprotilátky jsou detekovány v obou izotypech (IgG i IgM).
ELISA metoda (enzyme-linked immunosorbent assay) umožňuje detekci protilátek proti jednomu cílovému antigenu, existují však i kombinované soupravy s možností stanovení panelu autoprotilátek proti celé řadě glykokonjugátů. ELISA technika se uplatňuje především při stanovení protilátek proti gangliosidům, její nespornou výhodou je získání kvantitativního nebo semikvantitativního výsledku, důležitého např. pro monitorování průběhu onemocnění a jeho léčby. U nás jsou nabízeny zejména ELISA soupravy firmy Immco (ImmuLisa) a švýcarské firmy Bühlmann.
Nepřímá imunofluorescence je využívána při detekci protilátek proti glykoproteinu asociovanému s myelinem. Metoda založená na vizualizaci reakce antigen-protilátka je dána existencí vhodného substrátu, kterým je u anti-MAG řez opičího periferního nervu (obr. 3).
Image 3. Stanovení protilátek proti glykoproteinu asociovanému s myelinem nepřímou imunofluorescencí. 
Substrát: primátí nervus ischiadicus – příčný řez (Immco Diagnostics, Biovendor) Fluorescenční mikroskop Olympus BX51, objektiv UPlan FI 40× Autor: RNDr. Ivana Janatková 3a) negativní nález anti-MAG protilátek: myelinový obal nervu není označený fluoresceinizothiocyanátem. 3b) pozitivní nález anti-MAG protilátek: zelená fluorescence myelinových obalů nervů. Pacient V. T., 72 let, EMG na vyšetřovaných nervech obou DK a PHK a vyšetření jehlovou elektrodou ze svalů PDK (m.tibialis ant.) vykazují chronickou difusní neurogenní lezi typu polyneuropatie, axonálně – demyelinizační, motoricko – senzitivní, symetrická distální forma, středně těžkého stupně. Závěr
Vyšetření protilátek proti glykokonjugátům v posledních letech pronikají do klinického laboratorního vyšetřování, testy slouží jako pomocná vyšetření při podezření na zánětlivé neuropatie a společně s dalšími testy zdokonalují jejich diagnostický záchyt. Výhodou je časová a finanční dostupnost vyšetřovacích metod. Autoimunitní neuropatie jsou zajímavou mezioborovou problematikou, u které lze očekávat další prohlubování vzájemné spolupráce mezi neurology a imunology. Domníváme se, že v současné době je třeba zaměřit pozornost na korelaci laboratorních nálezů s klinickým obrazem jednotlivých nemocí. Důležitou otázkou je rovněž prognostická hodnota vyšetření autoprotilátek a jejich dynamiky.
Přijato k recenzi: 3. 5. 2007
Přijato do tisku: 23. 5. 07
MUDr. Karin Malíčková
1. LF UK, ÚKBLD a VFN, Praha
Karlovo nám. 32
121 11 Praha 2
e-mail: kmali@lf1.cuni.cz
Sources
1. Ariga T, Miyatake T, Yu RK. Recent studies on the roles of antiglycosphingolipids in the pathogenesis of neurological disorders. J Neurosci Res 2001; 65 : 363-370.
2. O'Leary CP, Willison HJ. The role of antiglycolipid antibodies in peripheral neuropathies. Curr Opin Neurol 2000; 13 : 583-588.
3. Steck AJ. Auto-antibody tests in peripheral neuropathies: pros and cons. J Neurol 2000; 247 : 423-428.
4. Caudie C. Monoclonal IgM autoantibody reactivity in M-IgM peripheral neuropathy. Clin Rev Allergy Immunol 2000; 19 : 7-18.
5. Willison HJ, Yuki N. Peripheral neuropathies and anti-glycolipid antibodies. Brain 2002; 125 : 2591-2625.
6. Klenk E. Über der Gangliosides. Hoppe-Seylers Z Physiol Chem 1942; 273 : 276.
7. Svennerholm L. Composition of gangliosides from human brain. Nature 1956; 177 : 524-525.
8. Svennerholm L. Ganglioside metabolism. In: Comprehensive Biochemistry, Vol 18. New York: Elsevier 1970 : 201-227.
9. Svennerholm L. Ganglioside loss is a primary event in Alzheimer disease type I. Prog Brain Res 1994; 101 : 391-404.
10. Yuki N. Anti-ganglioside antibody and neuropathy: review of our research. J Peripher Nerv Syst 1998; 3 : 3-18.
11. Nobile-Orazio E, Cappellari A, Priori A. Multifocal motor neuropathy: current concepts and controversies.Muscle Nerve 2005; 31 : 663-680.
12. Nobile-Orazio E, Terenghi F, Carpo M, Bersano A. Treatment of multifocal motor neuropathy. Neurol Sci 2003; 24(Suppl 4): S251-S255.
13. Schwerer B. Antibodies against gangliosides: a link between preceding infection and immunopathogenesis of Guillain-Barre syndrome. Microbes Infect 2002; 4 : 373-384.
14. Prendergast MM, Moran AP. Lipopolysaccharides in the development of the Guillain-Barre syndrome and Miller Fisher syndrome forms of acute inflammatory peripheral neuropathies. J Endotoxin Res 2000; 6 : 341-359.
15. Willison HJ. The immunobiology of Guillain-Barre syndromes. J Peripher Nerv Syst 2005; 10 : 94-112.
16. Ang CW, Jacobs BC, Laman JD. The Guillain-Barre syndrome: a true case of molecular mimicry. Trends Immunol 2004; 25 : 61-66.
17. Komagamine T, Yuki N. Ganglioside mimicry as a cause of Guillain-Barre syndrome. CNS Neurol Disord Drug Targets 2006; 5 : 391-400.
18. Yuki N, Odaka M. Ganglioside mimicry as a cause of Guillain-Barre syndrome. Curr Opin Neurol 2005; 18 : 557-561.
19. Latov N, Sherman WH, Nemni R, Galassi G, Shyong JS, Penn AS et al. Plasma-cell dyscrasia and peripheral neuropathy with a monoclonal antibody to peripheral-nerve myelin NEJM 1980; 303 : 618-621.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2007 Issue 6-
All articles in this issue
- Obrna lícního nervu
- Elektrofyziologické vyšetření lícního nervu
- Protilátky proti glykokonjugátům v diagnostice autoimunitních neuropatií
- 5 let činnosti Národní referenční laboratoře lidských prionových onemocnění při Oddělení patologie a molekulární medicíny FTNsP: naše zkušenosti a přehled literatury
- Klinický pohled na výpočetní tomografii u akutní ischemie mozku
- Ultrazvukové hodnocení substantia nigra u pacientů s parkinsonskými syndromy
- Porovnání výsledků vyšetření zrakových evokovaných potenciálů u pacientů s roztroušenou sklerózou a neuroboreliózou
- Kognitívne evokované potenciály – vlna P300 u pacientov so sclerosis multiplex: vzťah k forme ochorenia, somatickému postihnutiu a kvalite života
- Poruchy polykání ve vztahu k vertebrogenním dysfunkcím
- Centrální neurocytom: kazuistika a přehled literatury
- Gelastické záchvaty u hypotalamického hamartomu: kazuistika
- Dercumova choroba (lipomatosis dolorosa) – zriedkavo diagnostikované ochorenie: kazuistika
- Poúrazová porucha čichu: kazuistiky
- Mozková žilní trombóza u uživatelek hormonální antikoncepce
- Úspěšné použití jediné otázky pro screening syndromu neklidných nohou v České republice
- Závisí vývoj dysfunkce mikce u roztroušené sklerózy na typu neurologické léčby?
- Relabující-remitující roztroušená skleróza a oligoklonální pruhy v průběhu léčby modifikující průběh choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Obrna lícního nervu
- Poruchy polykání ve vztahu k vertebrogenním dysfunkcím
- Protilátky proti glykokonjugátům v diagnostice autoimunitních neuropatií
- Dercumova choroba (lipomatosis dolorosa) – zriedkavo diagnostikované ochorenie: kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


