-
Medical journals
- Career
Diagnostika a léčba karcinózy mening u solidních nádorů
: F. Janků; L. Petruželka
: Onkologická klinika 1. LF UK a VFN, Praha
: Cesk Slov Neurol N 2007; 70/103(1): 23-29
: Review Article
Vytvořeno s podporou výzkumného záměru MSM0021620808
Karcinóza mening, nebo také jinými slovy leptomeningeální metastázy, se vyskytuje u 4-15 % pacientů se solidními nádory. Vzhledem k delšímu přežití pacientů a lepším možnostem diagnostických metod se jedná o stále častější komplikaci. Nejčastěji do mozkových plen metastazuje karcinom prsu, plic a melanom. Klinicky se karcinóza mening projevuje různými neurologickými příznaky, jako jsou bolesti hlavy a zad, obrny hlavových nervů, dvojité vidění apod. V diagnostice je klíčové cytologické vyšetření mozkomíšního moku. Ze zobrazovacích metod je nejpřínosnější magnetická rezonance. Bez léčby se medián přežití pohybuje v rozmezí 4-6 týdnů. Pacient umírá v důsledku prohlubujících se neurologických poruch. Intratekální chemoterapie s a nebo bez radioterapie může v některých případech prodloužit přežití na 4-6 měsíců. Pro aplikaci je nejvhodnější zavedení podkožního rezervoáru s katétrem do pravé postranní komory mozkové. Léčbě by mělo předcházet radionuklidové vyšetření proudění mozkomíšního moku. K intratekální léčbě se u solidních nádorů nejčastěji používá metotrexát. Komplikací léčby je arachnoiditida, leukoencefalopatie, myelopatie nebo infekce.
Klíčová slova:
karcinóza mening; leptomeningeální metastázy; intratekální chemoterapie; metotrexát, cytosin arabinosid; mozkomíšní mokÚvod
Infiltrace leptomening nádorovými buňkami se nazývá karcinóza mening. Často se také používá termín leptomeningeální metastázy. U solidních nádorů se vyskytuje u 4-15 % pacientů především v pokročilém stadiu onemocnění [1-4]. U 19 % pacientů s prokázaným neurologickým deficitem je karcinóza mening pitevním nálezem [5]. Z nádorů do mening nejčastěji metastazuje karcinom prsu, karcinom plic a maligní melanom [3, 6]. Většina pacientů s karcinózou mening má mnohočetné metastatické postižení, ale jsou popsány případy, kdy symptomy sdružené s karcinózou mening jsou první a někdy dokonce jedinou manifestací nádorového rozsevu [7, 8].
Patogeneze
Nádorové buňky se šíří do leptomening hematogenně, lymfogenně nebo přímo z okolních maligních lézí. V případě hematogenní a lymfogenní diseminace migrují nádorové buňky cestou venózních plexů nebo arteriální diseminací. Shromažďují se ve Virchowových-Robinových prostorech okolo cév mozku, odkud se šíří perivaskulárně. Popsána byla i možnost přímého šíření z jiných nádorových ložisek v rámci centrálního mozkového systému (CNS) a centripetální migrace perineurálními prostory [9-11]. Jakmile se nádorová buňka dostane do subarachnoidálních prostor, je dále unášena proudem mozkomíšního moku (MMM) a může se usadit prakticky kdekoliv. K rozsevu na mening může také dojít v průběhu chirurgického odstranění solitární mozkové metastázy [12]. Nádorová infiltrace je obvykle nejvýraznější v oblasti bazilárních cisteren a na dorzálním povrchu míchy [13].
Klinická manifestace
Postižení mening se může projevit několika způsoby. Obstrukce průtoku MMM vede ke zvýšení intrakraniálního tlaku a hydrocefalu. Infiltrace nervů v oblasti subarachnoidálních prostor vede k obrně hlavových nervů nebo radikulopatiím. Okluze cév pia mater v oblasti subarachnoidálních prostor vyvolává příznaky podobné cévní mozkové příhodě. Iritace nebo invaze do přilehlé tkáně mozku se projeví epileptickými záchvaty. Interference s metabolickými pochody CNS se může projevit encefalopatií [4,7,14,15]. Často se jedná o kombinaci jednotlivých příznaků. Nicméně nejčastěji se jedná o bolest hlavy, diplopii, dysfagii, dysartrii, změny chování, obrny hlavových nervů, bolesti zad, kořenové bolesti, inkontinenci a senzorickou nebo motorickou neuropatii [16-18]. Od karcinózy mening je nutné odlišit chronickou meningitidu způsobenou tuberkulózou, mykotickou infekcí nebo sarkoidózou. Podobné projevy mohou mít i metabolická onemocnění a toxické encefalopatie [1].
Diagnostika
Vyšetření MMM
Základním vyšetřením pro stanovení diagnózy je vyšetření MMM a cytologický průkaz maligních elementů [19]. Vzorek MMM lze získat pomocí lumbální punkce. Vzorek MMM by měl být odebrán za dodržení zásad sterility a co nejdříve doručen ke zpracování. Nedodržení těchto principů může snížit výtěžnost vyšetření. Posuzuje se tlak likvoru, cytologie, počet buněk, hodnota bílkoviny a glukózy [3]. Pokud je při lumbální punkci zjištěn normální tlak, normální počet buněk, normální hladina bílkoviny, glukózy a negativní cytologie, tak je pravděpodobnost výskytu karcinózy mening nižší než 5 % [6,20]. Počet elementů se stanovuje ve Fuchs-Rosenthalově komůrce. Normální počet buněk, ale nevylučuje jejich patologickou buněčnou skladbu. Maximálně lze odlišit buňky s nesegmentovanými jádry a polymorfonukleáry. Výskyt buněk výstelky likvorových cest (zejména ependymových) může imitovat maligní buňky [21]. Nicméně průkaz nádorových buněk je diagnostickým nálezem (obr. 1). Případy falešně pozitivních cytologií byly obvykle popsány pouze u maligních lymfomů se současně probíhající infekcí, kdy bylo problematické odlišit zánětlivé elementy od nádorových [22,23]. Falešně negativní cytologie je popisována ve 45-50 % [5,24]. Negativní cytologie při opakované punkci se udává jen u 20 % případů karcinózy. Opakovat lumbální punkci po 2 předchozích pokusech již není přínosné [6].
1. a) Shluk velkých epiteliálních nádorových buněk v mozkomíšním moku (barvení May-Grünwald-Giemsa). b) Shluk nádorových buněk v mozkomíšním moku s vakuolizací cytoplazmy (tzv. buňky tvaru pečetního prstenu) iagnostické pro adenokarcinom (archiv autora). 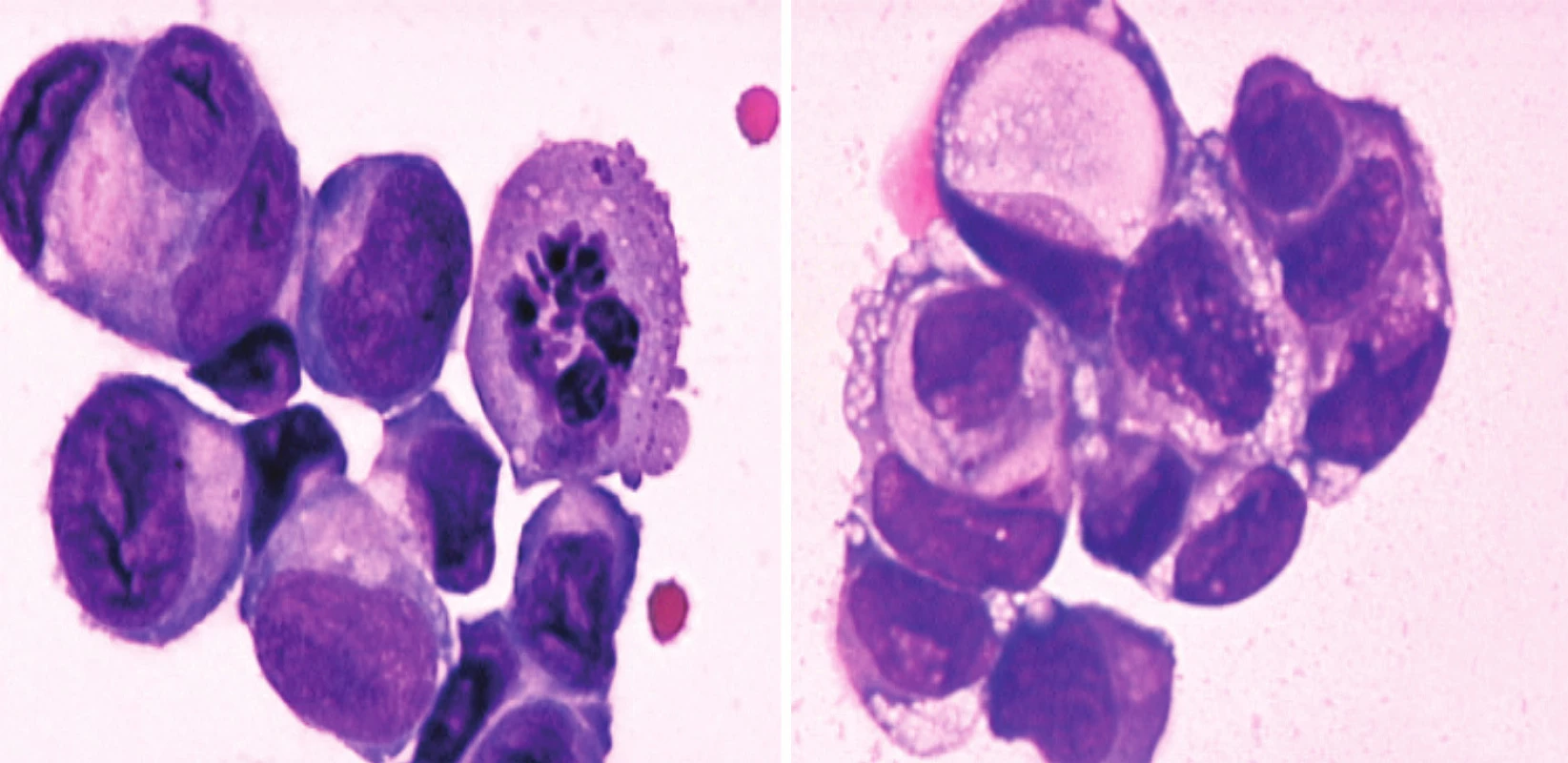
Nespecifickým nálezem je pleiocytóza MMM a zvýšená hladina bílkoviny [25]. Nižší hladina glukózy je pozorována kromě karcinózy i u infekcí. Využití nádorových markerů je limitováno jejich nízkou senzitivitou a specificitou [26]. Nejspolehlivější jsou markery, které produkují výlučně nádorové buňky. Nejčastěji se používá karcinoembryonální antigen (CEA) u adenokarcinomů, alfafetoprotein (AFP) a lidský choriový gonadotropin (HCG). Pokud není hladina CEA v séru významně zvýšena, může CEA v MMM vést k významnému zlepšení senzitivity lumbální punkce [8,27]. Ostatní markery patří mezi méně spolehlivé. Beta glukuronidáza je sice v MMM často zvýšená, ale stejný nález je popisován u akutních a chronických infekčních meningitid [28,29]. Stejně tak zvýšená hladina laktátdehydrogenázy se může kromě karcinózy mening vyskytovat u cévních mozkových příhod, bakteriálních meningitid, poranění hlavy, primárních mozkových nádorů a mozkových metastáz [30,31]. Marker beta-2-mikroglobulin je vhodný u hematologických malignit, ne však u solidních nádorů [32]. Navíc nespecifická elevace beta-2-mikroglobulinu byla pozorována po intratekálních aplikacích metotrexátu [33]. Imunocytochemie s využitím monoklonálních protilátek s výjimkou hematologických malignit obvykle nijak zásadně nezvyšuje senzitivitu cytologického vyšetření MMM [34-38].
Zobrazovací metody
Standardní metodou pro diagnostiku karcinózy mening je vyšetření magnetickou rezonancí s Gadoliniem (MR-Gd) [39]. Jelikož karcinóza mening se může vyskytovat kdekoliv, je vždy nutné vyšetřit komplexně celý CNS. Standardem je zobrazení T1 sekvence s kontrastem a bez kontrastu v kombinaci s T2 sekvencí [40]. Vyšetření MR-Gd má výrazně vyšší senzitivitu než počítačová tomografie (CT) s kontrastem (70 % vs 30 %) [40,41]. CT myelografie má s MR-Gd srovnatelnou senzitivitu, je ale více invazivní [42,43]. Nejčastějším nálezem CT nebo MR s kontrastem je sulko-cisternální enhancement (21 %), ependymální nebo subependymální enhancement 75 %), nepravidelný tentoriální enhancement (7 %), obliterace v oblasti sulků nebo cisteren (14 %), subarachnoidálně zvýrazněné uzlíky (29 %), intraventrikulárně zvýrazněné uzlíky (10 %) a hydrocefalus (10 %). Poměrně často jsou nalézány i koexistující mozkové metastázy [19,44]. Diagnostická hodnota FDG-PET je předmětem klinického výzkumu.
K posouzení dynamiky proudění MMM se používá radionuklidové vyšetření s 111indium-DTPA nebo 99Tc-albumin [11,45]. Abnormální cirkulace MMM se vykytuje u 30-70 % pacientů s karcinózou mening, kdy k blokádě proudění dochází nejčastěji v oblasti baze lební, páteřního kanálu a konvexit mozku [43,45]. U pacientů s poruchou proudění MMM bylo ve srovnání s nemocnými bez poruchy cirkulace MMM prokázáno kratší přežití ve 3 klinických studiích [45-47]. Radioterapie cílená na oblasti obstrukce může obnovit proudění MMM u 30 % pacientů s postižením v oblasti míchy a u 50 % s intrakraniálním postižením [48]. Obnovení normálního proudění MMM vede k delšímu přežití a celkově k lepším výsledkům léčby [45,46]. Přetrvávající blokáda proudění MMM vede nehomogenní distribuci cytostatika po intratekální aplikaci. Důsledkem je, že některé oblasti CNS jsou před chemoterapií zcela uchráněny a jinde naopak může dojít k akumulaci léků, což vede k zvýšené neurotoxicitě. Proto většina autorů doporučuje před aplikací intratekální chemoterapie provést radionuklidové vyšetření cirkulace MMM [49].
Prognóza
Medián přežití se u neléčených pacientů s karcinózou mening pohybuje okolo 4 až 6 týdnů [5,44]. Záměrem léčby je kontrola neurologických symptomů a prodloužení přežití. U některých pacientů lze prodloužit přežití na 4 až 6 měsíců. Mezi solidními nádory je na tom prognosticky nejlépe karcinom prsu s mediánem přežití u pacientů odpovídajících na léčbu více než 6 měsíců [50,51]. Prognóza u některých solidních nádorů je znázorněna v tab. 1. Obecně jsou akceptovány jako prognosticky nepříznivé následující faktory: špatný stav výkonnosti, mnohočetné neurologické poruchy, významné postižení CNS, současná encefalopatie, poruchy cirkulace MMM. Obecně pacienti s pokročilým nádorem neodpovídajícím na chemoterapii mají malou naději odpovědi na intratekální chemoterapii s a nebo bez radioterapie [10,52].
1. Medián přežití u karcinózy mening v závislosti na typu primárního nádoru. 
Léčba
Primárním cílem léčby je zlepšení nebo alespoň stabilizace neurologických obtíží a prodloužení přežití. Pokud specifická léčba navodí účinnou lokální kontrolu, pak tito pacienti často nakonec podlehnou spíše systémové progresi nádoru, než v důsledku neurologických poruch [6,17,53]. Nejpřínosnější je specifická léčba u pacientů s limitovaným systémovým postižením s velkou pravděpodobností odpovědi na léčbu, bez výrazných neurologických poruch, ve výborném stavu [50,54]. Léčba karcinózy mening musí být cílená na celý CNS. Standardem je cílená radioterapie na oblast symptomů nebo bulky postižení (např. mozkové metastázy) v kombinaci s intratekální chemoterapií. Cílem ozařování je kontrola symptomů a zamezení nádorového růstu v oblastech méně exponovaných intratekální chemoterapii, jakou jsou např. kořeny nervů, Virchowovy-Robinovy prostory. Ozáření celého CNS se pro svou výraznou toxicitu a omezenou chemosenzitivitu u solidních nádorů nepoužívá. Základním pilířem léčby je aplikace intratekální chemoterapie, jejímž cílem je kontrola nádorového růstu v oblastech se subklinickým postižením a likvidace nádorových buněk cestujících MMM. V retrospektivních analýzách ve srovnání s historickými kontrolami intratekální chemoterapie prodlužuje přežití [46,50-55]. Intratekální chemoterapie může být aplikována cestou lumbální punkce nebo pomocí podkožně implantovaného rezervoáru (Ommaya rezervoár) s ventrikulárním katétrem ústícím do pravé postranní komory (obr. 2). Rezervoár je většinou umístěn nad pravou nedominantní hemisférou. Jedná se o nebolestivý způsob aplikace, který zaručuje poměrně uniformní distribuci cytostatika. Naproti tomu dle některých studií 10-15 % lumbálních punkcí není aplikováno do subarachnoidálních prostor [56]. Při aplikaci pomocí Ommaya rezervoáru byl u leukemií prokázán větší počet léčebných odpovědí a prodloužení přežití [57,58]. U solidních nádorů sice podobná data nejsou k dispozici, ale i tak lze předpokládat podobný efekt. Při hodnocení léčebné odpovědi je ale poměrně problematické používat vzorky odebrané z rezervoáru, protože likvor v komorách je ve srovnání se punktátem z lumbální punkce odebraným ve stejnou dobu málokdy cytologicky pozitivní. Navíc likvor v komorách má většinou vyšší hladinu glukózy a nižší hladinu bílkoviny [59]. K hodnocení léčebné odpovědi se tedy doporučuje používat lumbální punkce. Aplikaci intratekální chemoterapie cestou Ommaya rezervoáru by mělo předcházet vyšetření cirkulace MMM pomocí radionuklidové ventrikulografie. Poruchy proudění mohou vést k omezení účinnosti a vystupňované toxicitě v důsledku poruchy distribuce cytostatika [46].
2. Ommaya rezervoár (archiv autora). 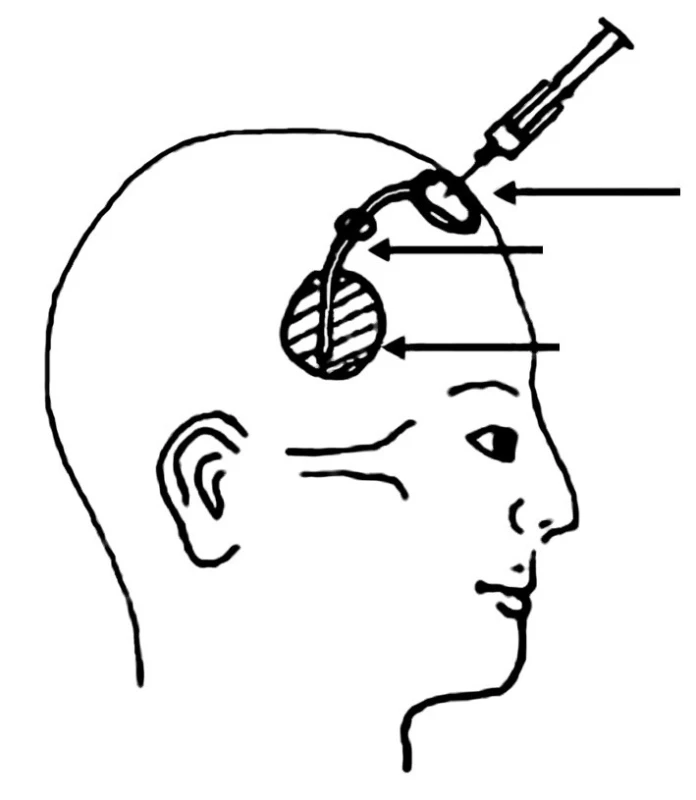
K intratekálnímu podání se hodí jen několik cytostatik (tab. 2). Jelikož je objem cirkulujícího MMM u většiny dospělých obdobný, dávka cytostatika se neurčuje na základě tělesného povrchu [60]. Nejčastěji používá metotrexát v dávkách 10-15 mg aplikován intratekálně 2krát týdně po dobu 4 týdnů nebo do vyčištění moku. Pak následuje týdenní a následně měsíční udržovací léčba. Toto schéma případně v kombinaci s radioterapií vede ke zmírnění symptomů u 50 % pacientů, nicméně přežití obvykle nepřesahuje 6 měsíců [6,53,55,61]. Navržený léčebný algoritmus pro indukční a konzolidační léčbu znázorňují obr. 3 a 4. Přestože se jedná o nízké dávky cytostatika, byly pozorovány u pacientů s omezenou hematologickou rezervou, ledvinnou nedostatečností nebo významnými výpotky případy myelosuprese. K prevenci hematologické toxicity a mukozitidy je vhodné podat systémově kyselinu foliniovou, která neproniká do MMM. Tiotepa je alkylační cytostatikum s poměrně širokým spektrem aktivity u solidních nádorů. Jeho nevýhodou je poměrně rychlá clearance z MMM [62,63]. V randomizovaném srovnání tiotepy s metotrexátem nebyl pozorován rozdíl v přežití. Intratekální tiotepa způsobuje méně neurologických nežádoucích účinků, ale je více myelotoxická. Proto je zatím intratekální metotrexát s kyselinou foliniovou považován za lepší alternativu především u pacientů s omezenou hematologickou rezervou nebo u pacientů léčených konkomitantní systémovou chemoterapií [64]. Navíc tiotepa není v současné době v České republice dostupná. Cytosin arabinosid (cytarabin) je účinný spíše u hematologických malignit a ani jeho kombinace s metotrexátem nevede u solidních nádorů k lepším výsledkům [65, 66]. Pro intratekální aplikaci byl speciálně vyvinut lipozomální cytarabin s řízeným uvolňováním (DepoCyt ®), který dosahuje dlouhodobě přetrvávajících cytotoxických hladin v MMM (více než 10 dní). Ve srovnání s metotrexátem vede terapie preparátem DepoCyt k prodloužení času do neurologické progrese u solidních nádorů [67,68]. Navíc v rameni s lipozomálním cytarabinem byla pozorována nižší toxicita. Podobně dopadlo srovnání u lymfomů [69]. Nicméně lipozomální cytarabin není v České republice v současnosti k dispozici.
2. Chemoterapeutické režimy používané k léčbě karcinózy mening. 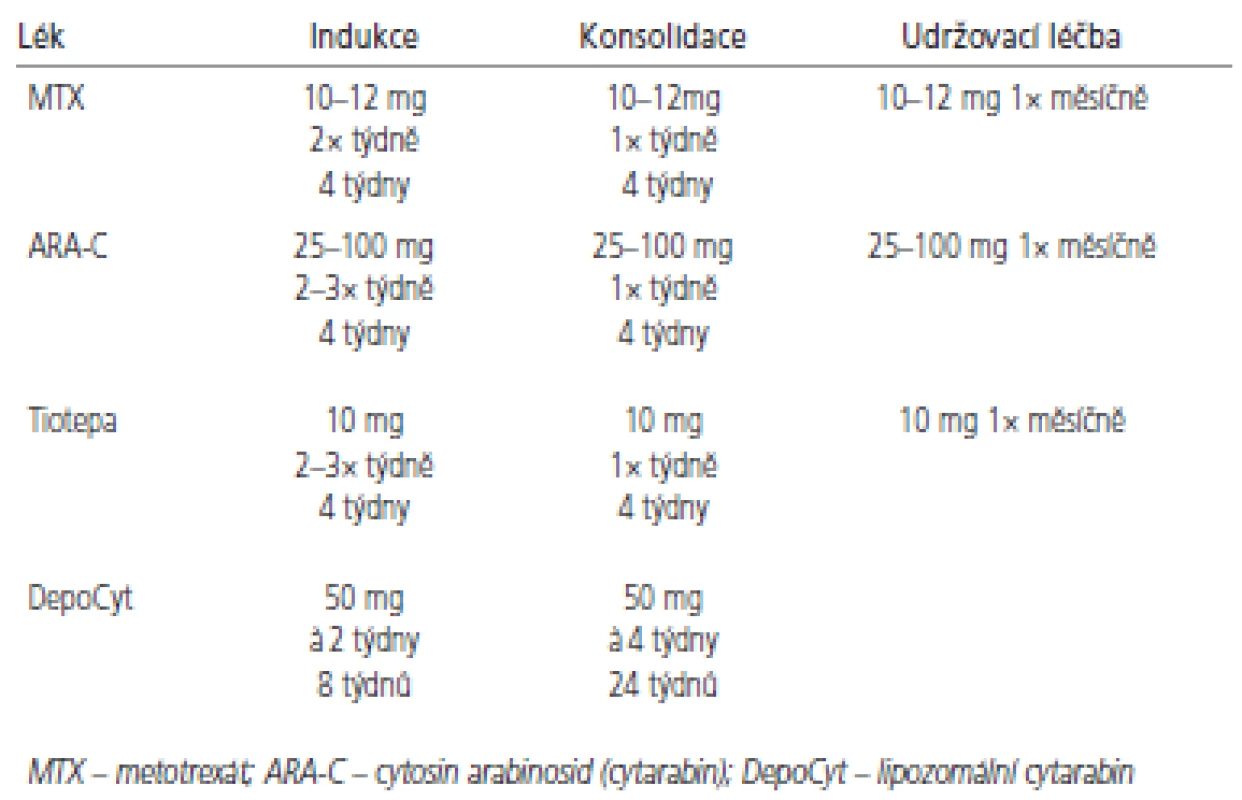
3. Léčebný algoritmus – indukční léčba. 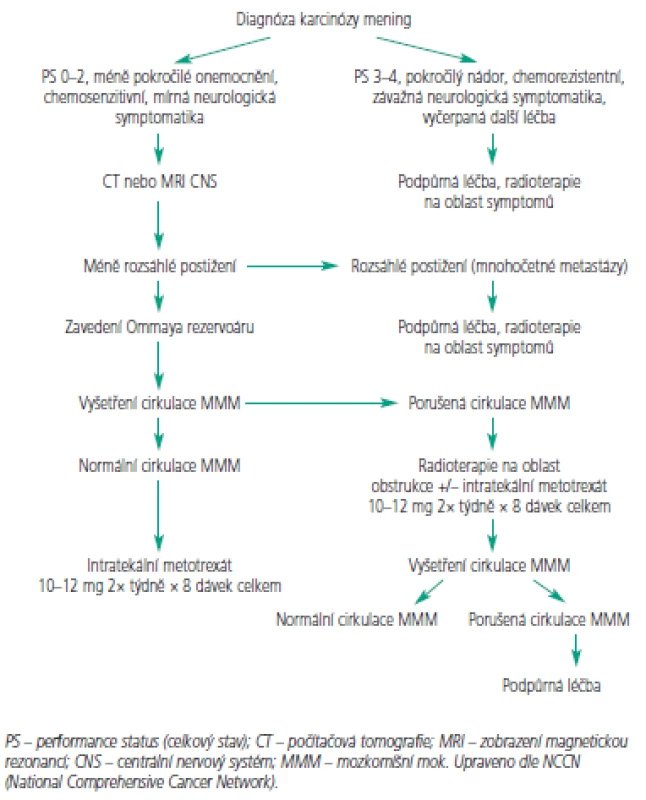
4. Léčebný algoritmus – konsolidační a udržovací léčba. 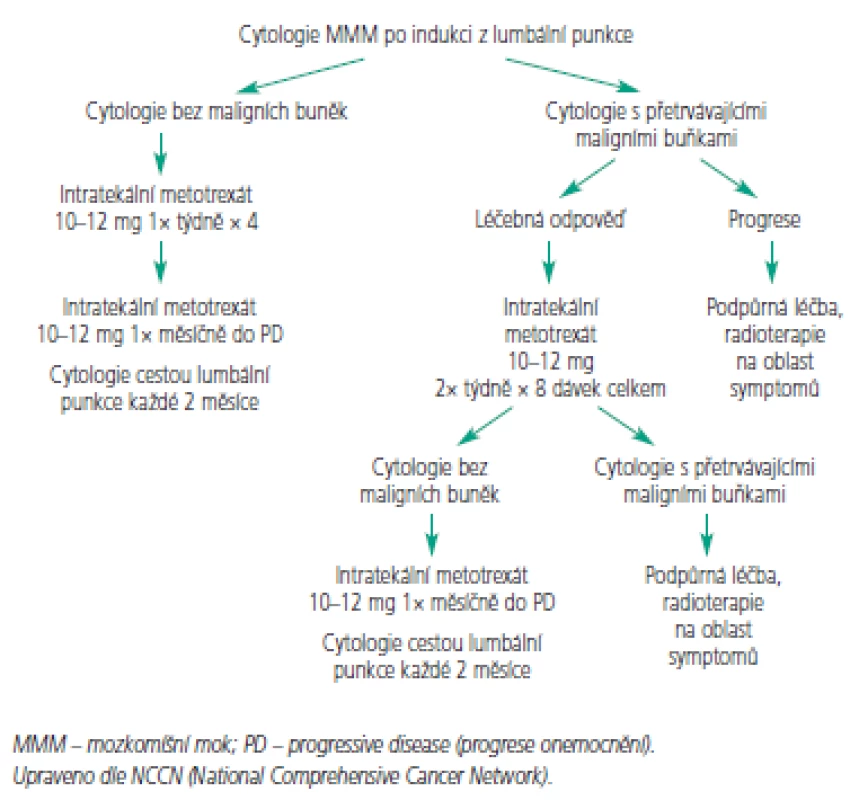
Z ostatních léků jsou ve fázi klinického zkoušení mafosfamid, diaziquon, topotekan [70], gemcitabin a temozolomid [71]. Z imunoterapie se zkouší interleukin-2 a interferon-alfa [72]. Probíhají studie s monoklonálními protilátkami včetně radiokonjugátů [73] a s genovou léčbou [74].
Mezi komplikace intratekální chemoterapie patří na jedné straně problémy spojené se zavedením Ommaya rezervoáru a nežádoucí účinky chemoterapie na straně druhé [75]. Mezi komplikace rezervoáru patří jeho špatná pozice (ve 3-12 %), obstrukce nebo infekce povětšinou kožními komenzály. Infekční komplikace jsou pozorovány u 2-13 % pacientů a nejčastěji izolovaným organizmem je vcelku předvídatelně Staphyloccocus epidermidis. Není jednotný názor na to, zda je v případě infekce nutné odstranit rezervoár. Všeobecně se ale jako léčba první linie upřednostňuje aplikace antibiotik i.v. s nebo bez intratekální aplikace [76]. Rutinní kultivace MMM u asymptomatických pacientů nemají smysl, protože je poměrně velké riziko kontaminace kožní flórou. Intratekální chemoterapie může vést k myelosupresi, proto se doporučuje doplnit podání metotrexátu kyselinou foliniovou v dávce 10 mg každých 6 hodin po dobu 24 hodin. Nepříjemnou komplikací je akutní arachnoiditida, která postihuje téměř polovinu léčených pacientů. Projevuje se horečkou, nauzeou, zvracením, meningeálními příznaky, světloplachostí a někdy změnami chování. K léčbě se doporučují antiemetika, antipyretika a kortikoidy [60]. Zřídka může dojít k rozvoji subakutní leukoencefalopatie, myelopatie nebo u dlouhodobě přežívajících pacientů k pozdní leukoencefalopatii s progresivní demencí [77]. Patogeneze těchto změn není plně objasněna.
Závěr
Pod pojmem karcinóza mening se skrývá onemocnění s variabilním klinickým obrazem. Výsledky léčby se liší v závislosti na typu primárního nádoru. Relativně prognosticky nejpříznivější je karcinom prsu. Na opačné straně stojí nemalobuněčný karcinom plic a maligní melanom, které jsou obecně méně chemosenzitivní. Dalším problémem zůstává, které pacienty léčit intratekální chemoterapií s nebo bez radioterapie, a komu případně doporučit pouze symptomatickou léčbu. Na základě přehledu doposud publikovaných prací byl navržen algoritmus, podle kterého je specifická léčba doporučována pacientům v dobrém stavu, s méně pokročilým chemosenzitivním nádorem. Pacienti ve špatném klinickém stavu s rozsáhlým postižením by měli být léčeni symptomaticky analgetiky, antiemetiky, kortikoidy, případně radioterapií na oblasti symptomů. Co se týče výběru léků pro intratekální chemoterapii solidních nádorů, zůstávají možnosti velmi omezené. Lékem volby zůstává metotrexát. Další možností je tiotepa, která ale ve srovnání s metotrexátem nepřináší žádnou zásadní výhodou a navíc není v České republice dostupná. Nadějí do budoucna může být lipozomální cytarabin, který ale také není v současnosti v České republice registrován. Ve fázi výzkumu je celá řada inovativních léčebných postupů včetně genové léčby, které ale mají do praktického využití zatím daleko.
MUDr. Filip Janků
Onkologická klinika 1.LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
email: janku.filip@vfn.cz
Přijato k recenzi: 25. 9. 2005
Přijato do tisku: 3. 7. 2006
Sources
1. Chamberlain MC. Neoplastic meningitis. J Clin Oncol 2005; 23 : 3605-13.
2. Nugent JL, Bunn PA Jr, Matthews MJ et al. CNS metastases in small cell bronchogenic carcinoma: Increasing frequency and changing pattern with lengthening survival. Cancer 1979; 44 : 1885-93.
3. Kaplan JG, DeSouza TG, Farkash A et al. Leptomeningeal metastases: Comparison of clinical features and laboratory data of solid tumors, lymphomas and leukemias. J Neurooncol 1990; 9 : 225-9.
4. Chamberlain MC. Carcinomatous meningitis. Arch Neurol 1997; 54 : 16-17.
5. Glass JP, Melamed M, Chernik NL et al. Malignant cells in cerebrospinal fluid (CSF): The meaning of a positive CSF cytology. Neurology 1979; 29 : 1369-75.
6. Wasserstrom WR, Glass JP, Posner JB. Diagnosis and treatment of leptomeningeal metastases from solid tumors: Experience with 90 patients. Cancer 1982; 49 : 759-72.
7. Balm M, Hammack J. Leptomeningeal carcinomatosis: Presenting features and prognostic factors. Arch Neurol 1996; 53 : 626-32.
8. Janků F, Dušková J, Petruželka L et al. Meningeal carcinomatosis as the first manifestation of gastric adenocarcinoma. Čas Lék Česk 2001; 140 : 636-9.
9. Gonzalez-Vitale JC, Garcia-Bunuel R. Meningeal carcinomatosis. Cancer 1976; 37 : 2906-11.
10. Grossman SA, Krabak MJ. Leptomeningeal carcinomatosis. Cancer Treat Rev 1999; 25 : 103-19.
11. Chamberlain MC. Radioisotope CSF flow studies in leptomeningeal metastases. J Neurooncol 1998; 38 : 135-40.
12. Norris LK, Grossman SA, Olivi A. Neoplastic meningitis following surgical resection of isolated cerebellar metastases: A potentially preventable complication. J Neuro-Oncol 1997; 32 : 215–23.
13. Boyle R, Thomas M, Adams JH. Diffuse involvement of the leptomeninges by tumour: A clinical and pathological study of 63 cases. Postgrad Med J 1980; 56 : 149-58. ¨
14. DeAngelis LM. Current diagnosis and treatment of leptomeningeal metastasis. J Neurooncol 1998; 38 : 245–52.
15. Jayson GC, Howell A. Carcinomatous meningitis in solid tumors. Ann Oncol 1996; 7 : 773–86.
16. Olson ME, Chernik NL, Posner JB. Infiltration of the leptomeninges by systemic cancer. A clinical and pathologic study. Arch Neurol 1974; 30 : 122–37.
17. Theodore WH, Gendelman S. Meningeal carcinomatosis. Arch Neurol 1981; 38 : 696–9.
18. Twijnstra A, Ongerboer dr Visser BW, van Zanten AP. Diagnosis of leptomeningeal metastasis. Clin Neurol Neurosurg 1987; 89 : 79–85.
19. Doležil D, Čuřík R, Nováčková L et al. Úskalí diagnostiky leptomeningeálních metastáz. Neurologie pro praxi 2002; 2 : 99-101.
20. Reuler JB, Meier D. Leptomeningeal carcinomatosis with normal CSF features. Arch Intern Med 1979; 139 : 237–8.
21. Adam P. Cytologie likvoru. Pardubice: STAPRO 1995.
22. Davies SF, Gormus BJ, Yarchoan R. Cryptococcal meningitis with false-positive cytology in the CSF: Use of T-cell rosetting to exclude meningeal lymphoma. JAMA 1978; 239 : 2369–70.
23. Rawlinson DG, Billingham ME, Berry PF. Cytology of the cerebrospinal fluid in patients with Hodgkin’s disease or malignant lymphoma. Acta Neuropathol (Berl) 1975; 6 : 187–91.
24. Ehya H, Hajdu SI, Melamed MR. Cytopathology of nonlymphoreticular neoplasms metastatic to the central nervous system. Acta Cytol 1981; 25 : 599–610.
25. Murray JJ, Greco FA, Wolff SN et al. Neoplastic meningitis. Marked variation of cerebrospinal fluid composition in the absence of extradural block. Am J Med 1978; 75 : 289–94.
26. Chamberlain MC. Cytologically negative carcinomatous meningitis: usefulness of CSF biochemical markers. Neurology 1998; 50 : 1173–5.
27. Jacobi C, Reiber H, Felgenhauer K. The clinical relevance of locally produced carcinoembryonic antigen in cerebrospinal fluid. J Neurol 1986; 233 : 358–61.
28. Shuttleworth E, Allen N. CSF beta-glucuronidase assay in the diagnosis of neoplastic meningitis. Arch Neurol 1980; 37 : 684–7.
29. Tallman RD, Kimbrough SM, O'Brien JF et al. Assay for betaglucuronidase in cerebrospinal fluid. Usefulness for the detection of neoplastic meningitis. Mayo Clin Proc 1985; 60 : 293–8.
30. Twijnstra A, van Zanten AP, Hart AA et al. Serial lumbar and ventricle cerebrospinal fluid lactate dehydrogenase activities in patients with leptomeningeal metastases from solid and haematological tumours. J Neurol Neurosurg Psychiatry 1987; 50 : 313–20.
31. Twijnstra A, van Zanten AP, Nooven WJ. Sensitivity and specificity of single and combined tumour markers in the diagnosis of leptomeningeal metastasis from breast cancer. J Neurol Neurosurg Psychiatry 1986; 49 : 1246–50.
32. Adachi N. Beta-2-microglobulin levels in the cerebrospinal fluid. their value as a disease marker. Eur Neurol 1991; 31 : 181–5.
33. Jeffery GM, Frampton CM, Legge HM et al. Cerebrospinal fluid B2-microglobulin levels in meningeal involvement by malignancy. Pathology 1990; 22 : 20–3.
34. Garson JA, Coakham HB, Kemshead JT et al. The role of monoclonal antibodies in brain tumour diagnosis and cerebrospinal fluid (CSF) cytology. J Neurooncol 1985; 3 : 165-71.
35. Hovestadt A, Henzen-Logmans SC, Vecht CJ. Immunohistochemical analysis of the cerebrospinal fluid for carcinomatous and lymphomatous leptomeningitis. Br J Cancer 1990; 62 : 653-4.
36. Boogerd W, Vroom TM, van Heerde P et al. CSF cytology versus immunocytochemistry in meningeal carcinomatosis. J Neurol Neurosurg Psychiatry 1988; 51 : 142-5.
37. Van Oostenbrugge RJ, Hopman AH, Ramaekers FC et al. In situ hybridization: A possible diagnostic aid in leptomeningeal metastasis. J Neurooncol 1998; 38 : 127-33.
38. Van Oostenbrugge RJ, Hopman AH, Arends JW et al. The value of interphase cytogenetics in cytology for the diagnosis of leptomeningeal metastases. Neurology 1998; 51 : 906-8.
39. Schumacher M, Orszagh M. Imaging techniques in neoplastic meningiosis. J Neurooncol 1998; 38 : 111-20.
40. Chamberlain MC, Sandy AD, Press GA. Leptomeningeal metastasis: A comparison of gadolinium-enhanced MR and contrast-enhanced CT of the brain. Neurology 1990; 40 : 435-8.
41. Sze G, Soletsky S, Bronen R et al. MR imaging of the cranial meninges with emphasis on contrast enhancement and meningeal carcinomatosis. Am J Roentgenol 1989; 153 : 1039-49.
42. Schuknecht B, Huber P, Buller B et al. Spinal leptomeningeal neoplastic disease: Evaluation by MR, myelography and CT myelography. Eur Neurol 1992; 32 : 11-6.
43. Chamberlain MC. Comparative spine imaging in leptomeningeal metastases. J Neurooncol 1995; 23 : 233-8.
44. Doležil D, Čuřík R, Doležilová V et al. Clinical picture and diagnostic algorithm of leptomeningeal metastases. Eur J Neurol 2003; 10(Suppl 1): 184.
45. Glantz MJ, Hall WA, Cole BF et al. Diagnosis, management, and survival of patients with leptomeningeal cancer based on cerebrospinal fluid-flow status. Cancer 1995; 75 : 2919-31.
46. Chamberlain MC, Kormanik PA. Prognostic significance of 111indium-DTPA CSF flow studies in leptomeningeal metastases. Neurology 1996; 46 : 1674-7.
47. Mason WP, Yeh SD, DeAngelis LM. 111Indium-diethylenetriamine pentaacetic acid cerebrospinal fluid flow studies predict distribution of intrathecally administered chemotherapy and outcome in patients with leptomeningeal metastases. Neurology 1998; 50 : 438-44.
48. Chamberlain MC, Corey-Bloom J. Leptomeningeal metastases: 111indium-DTPA CSF flow studies. Neurology 1991; 41 : 1765-9.
49. Chamberlain MC, Kormanik P, Jaeckle KA et al. 111Indium-diethylenetriamine pentaacetic acid CSF flow studies predict distribution of intrathecally administered chemotherapy and outcome in patients with leptomeningeal metastases. Neurology 1999; 52 : 216-7.
50. Chamberlain MC, Kormanik PR. Carcinomatous meningitis secondary to breast cancer: Predictors of response to combined modality therapy. J Neurooncol 1997; 35 : 55-64.
51. Chamberlain MC, Kormanik P. Carcinoma meningitis secondary to non-small cell lung cancer: Combined modality therapy. Arch Neurol 1998; 55 : 506-12.
52. Chamberlain MC. Neoplastic meningitis–related encephalopathy: Prognostic significance. Neurology 2003; 60: A17-18.
53. Shapiro WR, Posner JB, Ushio Y et al. Treatment of meningeal neoplasms. Cancer Treat Rep 1977; 61 : 733–43.
54. Grossman SA, Moynihan TJ. Neoplastic meningitis. Neurology Clinics of North America 1991; 9 : 843–56.
55. Sause WT, Crowley J, Eyre HJ et al. Whole brain irradiation and intrathecal methotrexate in the treatment of solid tumor leptomeningeal metastases: A Southwest Oncology Group study. J Neurooncol 1988; 6 : 107-12.
56. Shapiro WR, Young DF, Mehta BM. Methotrexate: Distribution in cerebrospinal fluid after intravenous, ventricular and lumbar injections. N Engl J Med 1975; 293 : 161–6.
57. Bleyer WA, Poplack DG. Intraventricular versus intralumbar methotrexate for CNS leukemia: Prolonged remission with the Ommaya reservoir. Med Pediatr Oncol 1979; 6 : 207–13.
58. Haghbin M, Galicich JH. Use of the Ommaya reservoir in prevention and treatment of CNS leukemia. Am J Pediatr Hematol Oncol 1979; 1 : 111–7.
59. Rogers LR, Duchesneau PM, Nunez C et al. Comparison of cisternal and lumbar CSF examination in leptomeningeal metastasis. Neurol 1992; 42 : 1239–41.
60. Bleyer WA, Drake JC, Chabner BA. Neurotoxicity and elevated cerebrospinal fluid methotrexate concentration in meningeal leukemia. N Engl J Med 1973; 289 : 770–3.
61. Hitchins RN, Bell DR, Woods RL et al. Aprospective randomized trial of single-agent versus combination chemotherapy in meningeal carcinomatosis. J Clin Oncol 1987; 5 : 1655–62.
62. Grochow LB, Grossman SA, Garrett S. Pharmacokinetics of Intraventricular Thiotepa (TT) in Patients with Meningeal Carcinomatosis. Proc Am Soc Clin Oncol 1982; 1 : 19.
63. Gutin PH, Weiss HD, Wiernik PH et al. Intrathecal N, N‘, N‘‘ - triethylenethiophosphoramide {thio - TEPA(NSC 6396)} in the treatment of malignant meningeal disease: Phase I–II study. Cancer 1976; 38 : 1471–5.
64. Grossman SA, Finkelstein DM, Ruckdeschel JC et al. Randomized prospective comparison of intraventricular methotrexate and thiotepa in patients with previously untreated neoplastic meningitis. J Clin Oncol, 1993; 11 : 561–9.
65. Stewart DJ, Maroun JA, Hugenholtz H et al. Combined intraommaya methotrexate, cytosine arabinoside, hydrocortisone and thio-TEPA for meningeal involvement by malignancies. J Neurooncol. 1987; 5 : 315-22.
66. Giannone L, Greco FA, Hainsowrth JD. Combination intraventricular chemotherapy for meningeal neoplasia. J Clin Oncol 1986; 4 : 68–73.
67. Glantz MJ, Jaeckle KA, Chamberlain MC et al. A randomized controlled trial comparing intrathecal sustained-release cytarabine (DepoCyt) to intrathecal methotrexate in patients with neoplastic meningitis from solid tumors. Clin Cancer Res 1999; 5 : 3394-402.
68. Jaeckle KA, Batchelor T, O'Day SJ et al. An open label trial of sustained-release cytarabine (DepoCyt) for the intrathecal treatment of solid tumor neoplastic meningitis. J Neurooncol 2002; 57 : 231-9.
69. Glantz MJ, LaFollette S, Jaeckle KA et al. Randomized trial of a slow release versus a standard formulation of cytarabine for the intrathecal treatment of lymphomatous meningitis. J Clin Oncol 1999; 17 : 3110-6.
70. Blaney SM, Poplack DG. New cytotoxic drugs for intrathecal administration. J Neurooncol 1998; 38 : 219-23.
71. Sampson JH, Archer GE, Villavicencio AT et al. Treatment of neoplastic meningitis with intrathecal temozolomide. Clin Cancer Res 1999; 5 : 1183-8.
72. Herrlinger U, Weller M, Schabet M. New aspects of immunotherapy of leptomeningeal metastasis. J Neurooncol 1998; 38 : 233-9.
73. Coakham HB, Kemshead JT. Treatment of neoplastic meningitis by targeted radiation using 131I-radiolabelled monoclonal antibodies. J Neurooncol 1998; 38 : 225-32.
74. Vrionis FD. Gene therapy of neoplastic meningiosis. J Neurooncol 1998; 38 : 241-4.
75. Chamberlain MC, Kormanik PA, Barba D. Complications associated with intraventricular chemotherapy in patients with leptomeningeal metastases. J Neurosurg 1997; 87 : 694-9.
76. Sandberg DI, Bilsky MH, Souweidane MM et al. Ommaya reservoirs for the treatment of leptomeningeal metastases. Neurosurgery 2000; 47 : 49-54.
77. Kerr JZ, Berg S, Blaney SM. Intrathecal chemotherapy. Crit Rev Oncol Hematol 2001; 37 : 227-36.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2007 Issue 1-
All articles in this issue
- Diagnosis and treatment of leptomeningeal carcinomatosis in solid tumors
- The Liquor Tau Protein and Beta Amyloid in Alzheimer’s Disease
- Intravenous Thrombolytic Therapy with Recombinant Tissue Plasminogen Activator rt-PA (Actilyse®) – Our First Experience from Practice
- The Determination of Serum and Cerebrospinal Fluid Clusterine Utilized in the Diagnostics of the CNS Affection – A Pilot Study
- The Effects of Bilateral Narrowing the Internal Carotid Artery on the Cerebrovascular Reserve Capacity of the Posterior Cerebrovascular System
- Huntington´s Disease: Experience with Genetic Testing within 1994 – 2005
- The Examination of Visual Evoked Potentials and Ultrasound Evaluation of Orbital Hemodynamics in Acute Unilateral Optic Neuritis – Significance for Clinical Practice
- Neuroendoscopy and Mathematical Model of Dynamics of Cerebral Ventricles
- Bobble-Head Doll Syndrome in Suprasellar Cysts: Results of Neuroendoscopic Treatment in Four Children
- Hemorrhage into Glioblastoma at a Traffic Accident
- Panic Disorder – Neuropsychiatric Profile
- Surgical treatment of the metastatic cervical spine tumours
- Cognitive Deficit after Therapy for Intracranial Aneurysms
- The Use of Transcranial Doppler for Demonstrating Intracranial Hypertension in Children with Scaphocephaly
- Predictive Value of Ultrasensitive C-Reactive Protein in Ischemic Cerebrovascular Accident and Its Relation to Atherosclerosis of Carotid Arteries
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Panic Disorder – Neuropsychiatric Profile
- The Liquor Tau Protein and Beta Amyloid in Alzheimer’s Disease
- Diagnosis and treatment of leptomeningeal carcinomatosis in solid tumors
- Surgical treatment of the metastatic cervical spine tumours
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

