-
Medical journals
- Career
Osteoporóza pri systémovej mastocytóze: kazuistika
Authors: Vaňuga Peter 1; Ságová Ivana 1; Kulich Michal 1; Vaňuga Anton 1,2
Authors‘ workplace: Endokrinologické oddelenie, Národný endokrinologický a diabetologický ústav n. o. (NEDÚ), Ľubochňa 1; Alpha medical, s. r. o., Martin 2
Published in: Clinical Osteology 2020; 25(2): 85-91
Category:
Overview
Mastocytóza je raritné ochorenie, ktoré je charakterizované abnormálnou proliferáciou mastocytov, so širokým spektrom klinických prejavov v dôsledku postihnutia rôznych tkanív a orgánov. Častou manifestáciou systémovej mastocytózy, najmä v dospelosti, je osteoporóza. Najčastejším miestom postihnutia je lumbálna chrbtica, v dôsledku väčšej straty trabekulárnej kosti v porovnaní s kortikálnou kosťou. Patomechanizmus vzniku osteoporózy pri mastocytóze je multifaktoriálny. K osteoporóze dochádza jednak v dôsledku neoplastickej infiltrácie kostnej drene mastocytmi, najmä však vplyvom uvoľnených mediátorov z mastocytu ako napr. histamínu, heparínu, prostaglandínov, cytokínov, ktoré zvyšujú aktivitu osteoklastov, a tým aj kostnú resorpciu. V liečbe osteoporózy pri mastocytóze sú indikované najmä bisfosfonáty, ďalšou alternatívou je denosumab. V našej kazuistike popisujeme prípad 33-ročnej pacientky s anamnézou urticaria pigmentosa, s ťažkou manifestnou osteoporózou s kompresívnymi fraktúrami torakálnej a lumbálnej chrbtice na podklade agresívnej formy systémovej mastocytózy.
Klíčová slova:
bisfosfonáty – denosumab – kostná resorpcia – osteoporóza – systémová mastocytóza
Úvod
Mastocytózy predstavujú heterogénnu skupinu ochorení, ktoré sú charakterizované zvýšenou proliferáciou a akumuláciou mastocytov v rôznych orgánoch a tkanivách, najčastejšie v koži a kostnej dreni [1,2]. Mastocyt je bunka pochádzajúca z kostnej drene, ktorá preukazuje aspoň čiastočnú imunohistochemickú pozitivitu a pozitivitu CD34. Stimuláciou mastocytu (termickou, chemickou, IgE alebo imunitnou) dochádza k degranulácii mastocytu s uvoľnením mediátorov (napr. histamínu, tryptázy, chymázy, prostaglandínu D2, tumor nekrotizujúceho faktora alfa/TNFalfa, interferónu gama, interleukínov), čo má za následok lokálnu, prípadne celkovú reakciu až anafylaktický šok. Medzi klinické prejavy súvisiace s týmto ochorením patrí svrbenie kože, začervenanie kože, návaly tepla, hnačky, angioedémy, bolesti hlavy, depresie, náhle poklesy alebo vzostupy tlaku krvi, febrility, časté močenie, nechutenstvo, chudnutie a napokon anafylaxia so synkopou až šokom. Systémová mastocytóza (SM) je podskupinou mastocytóz, ktorá je charakterizovaná mastocytárnou infiltráciou minimálne jedného vnútorného orgánu (napr. kostná dreň, gastrointestinálny trakt, skelet) [3]. Pre vznik systémovej mastocytózy je kľúčovou mutácia KIT D816V, ktorá sa vyskytuje u 95 % pacientov s pokročilou SM. SM sa podľa WHO klasifikácie z roku 2016 rozdeľuje na indolentnú SM, tlejúcu (smoldering) a skupinu pokročilých (advanced), medzi ktoré patrí agresívna SM, SM s asociovanou hematologickou neopláziou a mastocytová leukémia [4,5]. Klinický obraz SM určujú prejavy vyvolané mediátormi uvoľnenými z aktivovaných mastocytov a dysfunkcia orgánov vyplývajúca z infiltrácie mastocytmi [6,7]. Kožné prejavy pri SM môžu a nemusia byť prítomné (s/bez urticaria pigmentosa). Kostné prejavy sú jedným z najčastejších príznakov SM, najmä u dospelých. Môžu sa prejavovať bolesťami kostí, difúznou osteopéniou alebo osteoporózou, zvýšenou fragilitou až patologickými fraktúrami, difúznou osteosklerózou alebo fokálnymi osteolytickými so súčasnými osteosklerotickými kostnými léziami [8,9]. Najčastejším miestom postihnutia je lumbálna chrbtica, v dôsledku väčšej straty trabekulárnej kosti v porovnaní s kortikálnou kosťou. Potvrdzuje to aj skutočnosť, že väčšina zlomenín pri SM je na telách stavcov. Vysvetlenie je pravdepodobne vo zvýšenej náchylnosti klonálnych mastocytov kolonizovať metabolicky najviac aktívnu kostnú dreň [10,11]. Druhým najčastejšie postihnutým orgánom pri SM je gastrointestinálny trakt (GIT). Klinickými prejavmi postihnutia GIT sú hnačky, vracanie, bolesti brucha, kŕče, peptický vred a malabsorpčný syndróm. Pri SM sa môže vyskytovať aj postihnutie pečene, sleziny a žlčníka. V dôsledku infiltrácie kostnej drene mastocytmi s možnou neskoršou fibrotizáciou dochádza pri tomto ochorení k rozvoju normochrómnej normocytovej anémie s eozinofíliou, trombocytopéniou a leukocytózou. K periférnej lymfadenopatii s postihnutím najmä krčných, axilárnych a inguinálnych lymfatických uzlín dochádza asi u 26–58 % pacientov [3]. SM sa diagnostikuje na základe systému malých a veľkých kritérií (tab. 1) a molekulárne genetického vyšetrenia. Pre potvrdenie SM musia byť prítomné 3 malé kritériá, alebo 1 veľké a súčasne 1 malé kritérium. Liečba SM je zameraná na tlmenie klinických prejavov spôsobených uvoľnenými mediátormi z mastocytov, pri pokročilej SM sa indikuje na zmenšenie nádorovej masy cytoredukčná liečba. Konvenčná liečba je interferón alfa a kladribín, vo vývoji je viacero inhibítorov tyrozínkinázy. Jediným efektívnym a dostupným liekom je zatiaľ midostaurín. Vyliečenie je možné len alogénnou transplantáciou kmeňových buniek [7].
Table 1. Diagnostické kritéria pre systémovú mastocytózu 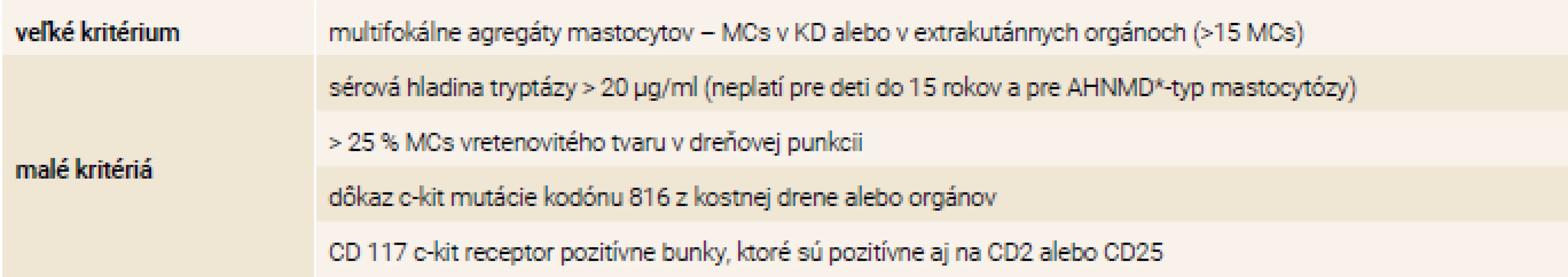
MCs – mastocyty SM-AHNMD – systémová mastocytóza s hematologickým ochorením nevyvolávajúca proliferáciu mastocytov/Systemic Mastocytosis with an Associated clonal Haematological Non-Mast cell lineage Disease Kazuistika
V našej kazuistike popisujeme prípad 33-ročnej pacientky s ťažkou manifestnou osteoporózou s kompresívnymi fraktúrami stavcov torakálnej a lumbálnej chrbtice na podklade agresívnej formy systémovej mastocytózy. Pacientka bola od roku 2001 (vo veku 17 rokov) sledovaná dermatológom pre urticaria pigmentosa a bola opakovane liečená fotochemoterapiou PUVA (psoralény a UVA-žiarenie) bez efektu. V roku 2003 mala realizovanú biopsiu z kožného ložiska – histologicky bez potvrdenia diagnózy urticaria pigmentosa ako aj mastocytózy. V ďalších rokoch pacientka nechodila na kontroly ku dermatológovi, nakoľko nemala výraznejšie ťažkosti, až na kožné lézie, ktoré boli bez pocitu svrbenia. V roku 2017 počas tretieho trimestra primogravidity začala pacientka pociťovať bolesti v oblasti torakálnej a lumbálnej chrbtice s postupnou progresiou intenzity. Týždeň po spontánnom pôrode mala pacientka maximálnu intenzitu bolestí s obmedzením chôdze. Pri klinickom vyšetrení bola prítomná palpačná citlivosť s maximom v oblasti lumbálnej chrbtice, hybnosť pre lumbalgiu nebola vyšetrená. Následne realizovaný RTG ukázal nález suspektných fraktúr stavcov Th9 a L1 ako aj suspektnej osteoporózy. Vyšetrení magnetickou rezonanciou (MR) chrbtice potvrdilo nález kompresívnej fraktúry s postihnutím predných 2 stĺpcov tiel Th9, Th10, Th12 a L1, L4. Vzhľadom na osteofyty a menej výrazný edém v oblasti Th9, Th10, Th12 a L1 sa jednalo skôr o staršie fraktúry, čerstvá fraktúra bola v oblasti tela stavca L4 (obr). Následne bola pacientka hospitalizovaná na ortopedickom oddelení. Do liečby boli pridané analgetiká a myelorelaxanciá. Bola zahájená rehabilitácia s postupnou vertikalizáciou v korzete s odporučením endokrinologického vyšetrenia. V 7/2017 bola pacientka vyšetrená na endokrinologickej ambulancii NEDÚ Ľubochňa: laboratórne mineralogram v norme, potvrdená hypovitaminóza D bez sekundárnej hyperparatyreózy, s eleváciou osteomarkerov, kortizolový status bol norme, bez tyreopatie, hypofýzo-gonadálny status bol v norme. Z ďalších parametrov bola prítomná kombinovaná dyslipidémia a ľahká elevácia pečeňových enzýmov GMT a ALP (laboratórne parametre uvádzame v tab. 2). Bolo realizované denzitometrické vyšetrenie s potvrdením výrazne zníženej kostnej denzity pre daný vek a pohlavie v oblasti lumbálnej chrbtice aj femoru (tab. 3). Do liečby boli pridané preparáty kalcia a vitamín D (Caltrate 600/400 IU 1-0-0 a Vigantol oil 3 kvapky denne). Osteogenetické vyšetrenie bolo s negatívnym nálezom (tab. 4). Vzhľadom k manifestnej osteoporóze bola po schválení poisťovňou v 8/2017 zahájená osteoformačná liečba teriparatidom (Forsteo 20 μg 1-krát denne s.c.). Pri kontrolnom endokrinologickom vyšetrení v 12/2017 bola laboratórne verifikovaná elevácia hladiny osteomarkerov svedčiaca pre dobrý efekt osteoformačnej liečby (tab. 2). Vzhľadom k suspekcii na mastocytózu ako príčinu sekundárnej osteoporózy bolo realizované dermatologické vyšetrenie s následným odporučením realizácie hematologicko-onkologického vyšetrenia. V 8/2018 bola realizovaná trepanobiopsia kostnej drene (hranične reprezentatívna stagingová vzorka špongiózy) s obrazom normocelulárnej kostnej drene (KD), granulopoéza bez zmnoženia blastov, zo zreteľným zvýšením zrelej eozinofilnej komponenty. V erytrocytovom rade sú známky makrocytovej dyserytropoézy. V interstíciu bez difúznej fibrózy s nálezom prevažne disperzných a len ojedinele v drobných zhlukoch nakopených granulovaných aj degranulovaných až vretenovitých mastocytov (CD117+) s parciálnou koexpresiou CD25, ktorých celkový podiel je < 5 %. Prietokovou cytometriou KD vo vyšetrenej vzorke nález minimálneho množstva elementov s fenotypom CD117++, CD 2+, CD 25+, CD 11c+, CD 33+, CD 43+ na úrovni 0,07 %. Bolo doplnené genetické vyšetrenie KD s potvrdením mutácie v D816V v géne cKIT. Laboratórne elevovaná hladina sérovej tryptázy > 20 μg/l (norma do 11,4 μg/l). V rámci stagingu ochorenia bolo doplnené USG abdomenu s nálezom hepatomegálie, echokardiografický nález v norme, RTG hrudníka bez patologického nálezu. Hematológ stav zhodnotil ako agresívnu systémovú mastocytózu s odporučením pridania antacida (Famotidin 20 mg tbl 1-krát denne) a antihistaminika (Aerius 5 mg tbl 1-krát denne) do liečby. Po schválení poisťovňou v 12/2018 bol následne do liečby pridaný inhibítor proteín kinázy – midostaurín (Rydapt 2-krát 50 mg denne).V 7/2018 bolo realizované kontrolné denzitometrické vyšetrenie, podľa ktorého došlo k podstatnému nárastu kostnej denzity vplyvom osteoformačnej liečby teriparatidom (tab. 3), laboratórne výsledky uvádzame v tab. 2. Po 18-mesačnej osteoformačnej liečbe po konzultácii s hematoonkologóm bolo doporučené zahájenie antiresorpčnej liečby denosumabom (Prolia 60 mg s.c. po 6 mesiacov). Kontrolné hematologické vyšetrenie bolo v 1/2019: hladina sérovej tryptázy 22,9 μg/l, krvný obraz v norme, s odporučením pokračovania v liečbe midostaurínom. V 2/2019 bolo realizované kontrolné endokrinologické vyšetrenie – laboratórne parametre uvádzame v tab. 2 s doplnením denzitometrického vyšetrenia, podľa ktorého bola kostná denzita s opätovným nárastom kostnej denzity pri pokračujúcej liečbe denosumabom (tab. 3) bez vzniku nových kompresívnych fraktúr.
Image 1. bočná snímka torakálnej a lumbálnej chrbtice s kompresívnymi fraktúrami tiel stavcov Th9, Th10, Th12 a L1, L4 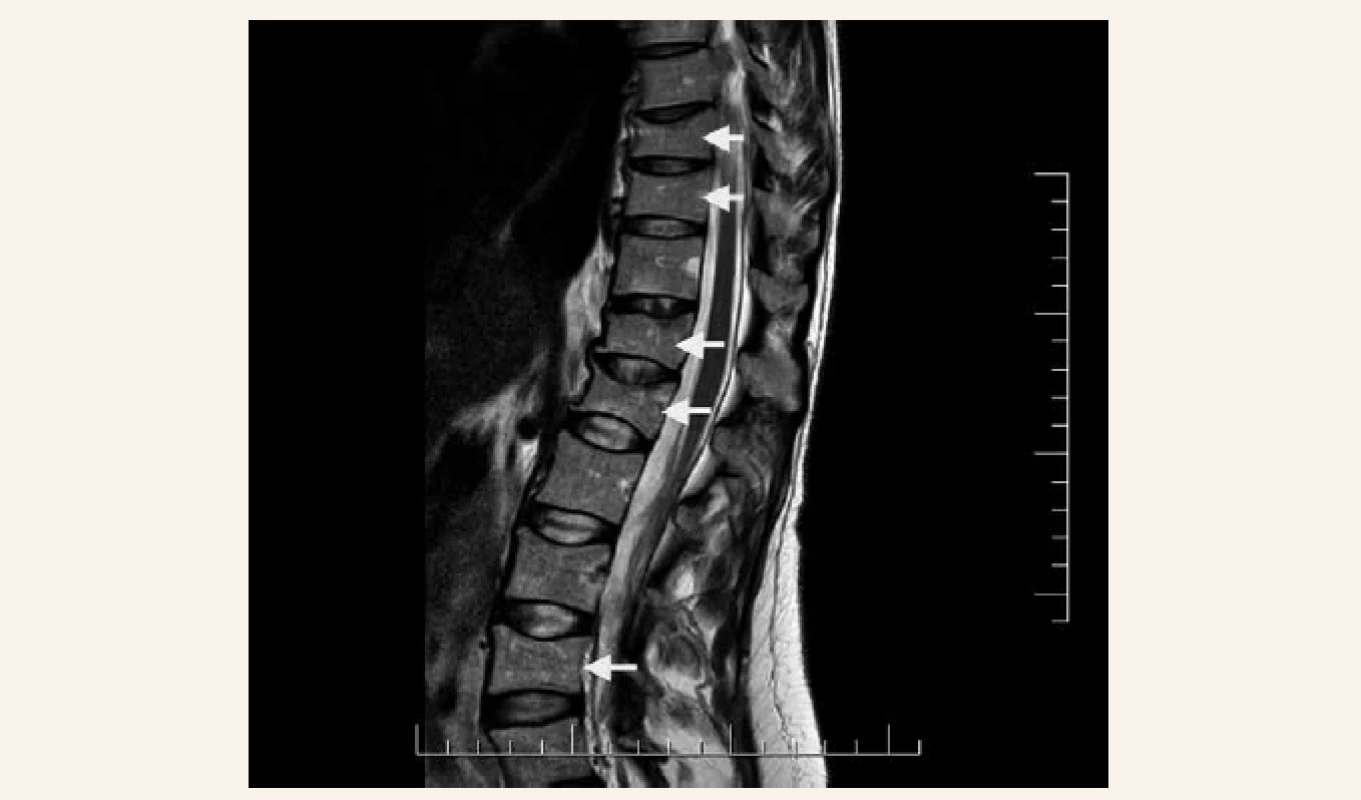
Table 2. Laboratórne parametre počas monitoringu v NEDÚ Ľubochňa 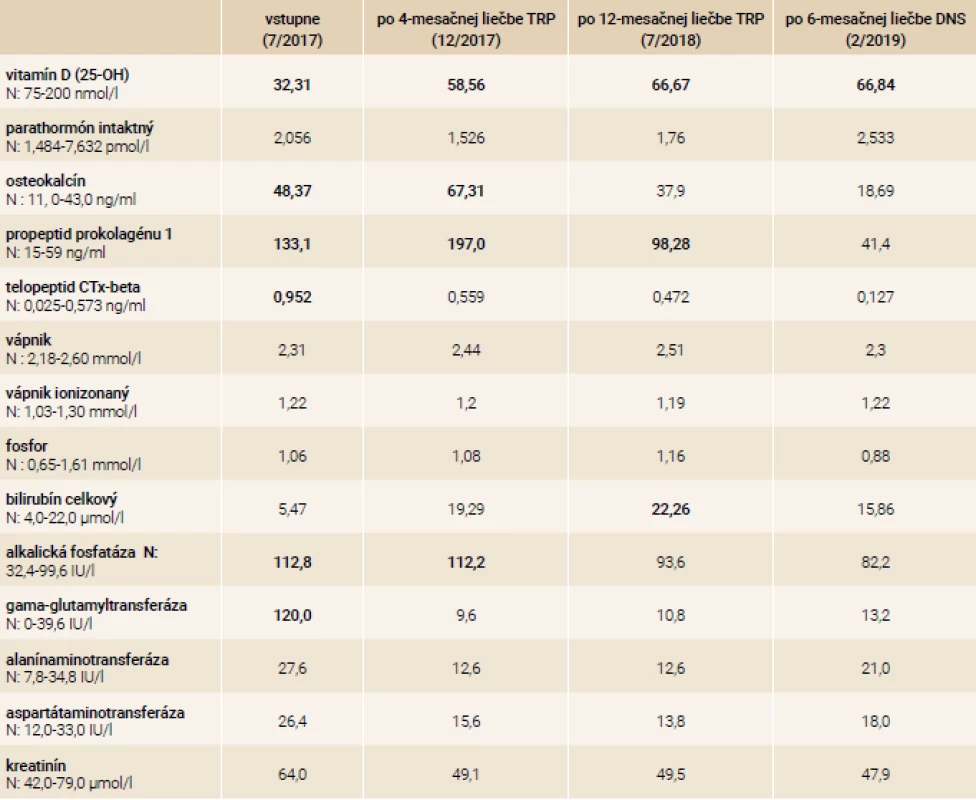
DNS – denosumab TRP – teriparatid Table 3. Výsledky denzitometrických vyšetrení počas monitoringu v NEDÚ Ľubochňa 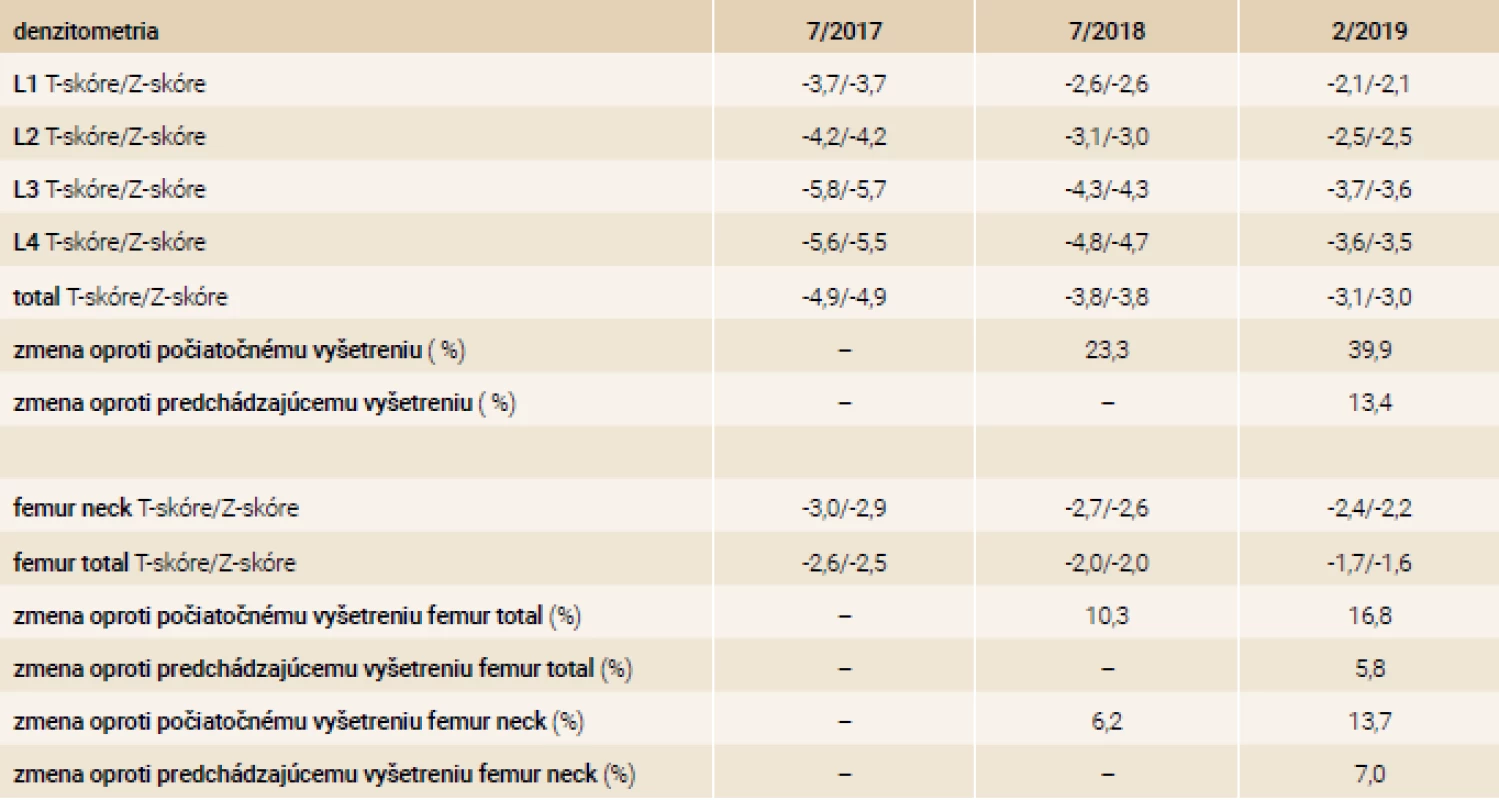
Table 4. Výsledky osteogenetického vyšetrenia pomocou PCR – genotypy 7/2017 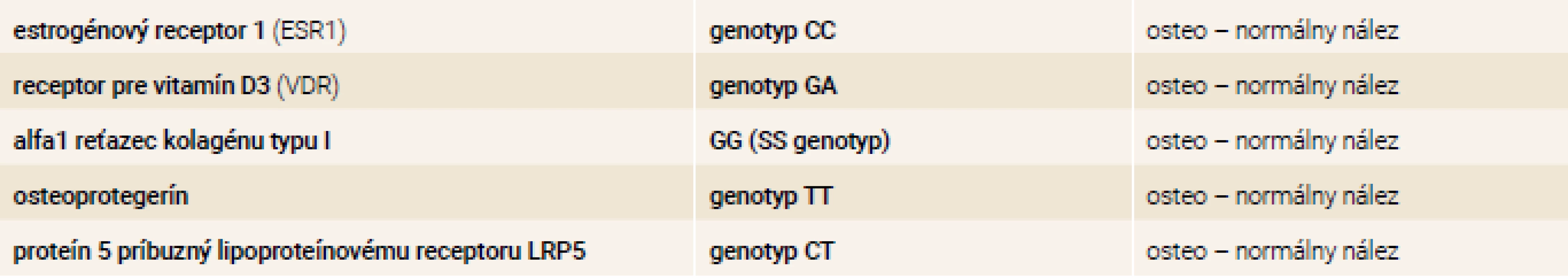
Diskusia
Mastocytóza je zriedkavé ochorenie s odhadovanou incidenciou 5–10 prípadov/1 000 000 obyvateľov [12]. Ochorenie je charakterizované excesívnym nahromadením mastocytov v rôznych orgánoch a telesných tkanivách. Podľa WHO klasifikácie z roku 2016 sa mastocytóza rozdeľuje na kožnú mastocytózu, systémovú mastocytózu a mastocytový sarkóm [5]. Systémová mastocytóza je definovaná mastocytárnou infiltráciou minimálne jedného vnútorného orgánu (napr. kostná dreň, gastrointestinálny trakt, skelet, slezina, lymfatické uzliny). Klinické prejavy ochorenia sú variabilné, spôsobené jednak efektom mediátorov uvoľňovaných aktiváciou mastocytov, ako aj následkom infiltrácie vnútorných orgánov a kože. Kožné postihnutie je veľmi časté, vyskytuje sa vo viac ako 90 % prípadov. Najčastejšími kožnými prejavmi sú urtikária, flush, pruritus a angioedém. Postihnutie GIT vedie k nevoľnosti, zvracaniu, hnačke a bolesti brucha. Zriedkavo sa môže vyskytnúť aj hepatopatia, portálna hypertenzia, hypersplenizmus a malabsorpcia [13]. V prípade našej pacientky bola z kožných prejavov anamnesticky prítomná urticaria pigmentosa, ktorá však histologicky nebola verifikovaná a z prejavov postihnutia GIT bola prítomná hepatomegália. Klinicky dominovali príznaky z kostného postihnutia, a to ťažká manifestná osteoporóza s kompresívnymi fraktúrami torakálnej a lumbálnej chrbtice. Kostné anomálie patria k najčastejším prejavom SM. U detí sa vyskytujú v 15 % a u dospelých v 60–90 % [14]. Podľa tradičných kritérií pre diagnostiku osteoporózy podľa WHO (T-skóre < -2,5) sa prevalencia osteoporózy u pacientov s SM pohybuje od 18–31 % [10,11,13]. V týchto štúdiách však boli zaradení aj starší pacienti, takže skutočná prevalencia osteoporózy pri mastocytóze zostáva stále nejasná. V štúdií s 199 pacientmi s indolentnou systémovou mastocytózou (81 žien, priemerný vek 53 rokov, vekové rozpätie 23–84 rokov; 118 mužov, priemerný vek 49 rokov, vekové rozpätie 20–82 rokov) bola prevalencia osteoporózy (T-skóre < -2,5) vyššia u žien v porovnaní s mužmi, avšak ženy mali vyšší vekový priemer. Pri použití Z-skóre (Z-skóre < -2) pri hodnotení osteoporózy bol v tejto štúdií potvrdený vyšší výskyt osteoporózy u mužov v porovnaní so ženami, a to najmä v oblasti lumbálnej chrbtice (33 % vs 12 %). Prevalencia vertebrálnych fraktúr bola u mužov 20 %, kým u žien 14 %. Hladina tryptázy v sére > 20 mg/l bola pozorovaná v 70 % prípadov, zatiaľ čo u 9 pacientov bola v norme [11]. Z ďalších väčších štúdií Van der Veer s kolektívom potvrdili u 157 pacientov s indolentnou SM (65 mužov a 92 žien, vekový priemer 54 ± 12 rokov) vysokú, až 37% prevalenciu osteoporotických zlomenín. Vyššia prevalencia manifestnej osteoporózy bola u mužov. Z celkového počtu 235 fraktúr bolo 62 % vertebrálnych, 1 % pelvických a 36 % nonvertebrálnych [15]. Pri systémovej mastocytóze bývajú prítomné aj iné kostné prejavy ochorenia ako difúzna osteoskleróza, alebo fokálne osteolytické so súčasnými osteosklerotickými kostnými léziami. V štúdii s 75 dospelými pacientmi s mastocytózou malo 37 postihnutie kostí, 23 osteoporózu, 6 axiálnu osteosklerózu, 1 osteolytickú léziu a 3 zmiešaný kostný nález [10]. Hlavným obmedzením doposiaľ dostupných štúdií je ich prierezový charakter, ktorý neumožňuje zistiť vzťah medzi skutočným postihnutím kostí a progresiou choroby. Na pochopenie vývoja kostného postihnutia u pacientov so SM sú potrebné longitudinálne štúdie. Najčastejším miestom postihnutia pri SM je lumbálna chrbtica, čo naznačuje preferenčné postihnutie trabekulárnej kosti. V patogenéze osteoporózy pri SM sa uplatňuje jednak neoplastická infiltrácia kostnej drene mastocytmi, avšak dominantný je vplyv lokálneho uvoľnenia mediátorov z mastocytu ako napr. histamínu, heparínu, tryptázy, lipidových mediátorov, prostaglandínov a cytokínov [16]. Uvoľnené cytokíny ako TNFalfa, interleukíny 1 a 6 zvyšujú aktivitu osteoklastov a súčasne inhibujú aktivitu osteoblastov [16,17]. Histamín predstavuje kľúčový mediátor so stimulačným efektom na osteoklasty a ich prekurzory [18]. Štúdie na zvieracích modeloch potvrdili u knock out myší pre histamín dekarboxylázu (enzým potrebný pre syntézu histamínu) zníženie počtu osteoklastov a zvýšenie kostnej formácie [19]. Prekurzory osteoklastov sú hlavným zdrojom histamínu. Histamín ovplyvňuje kostnú resorpciu priamo prostredníctvom účinku na osteoklasty a ich prekurzory, ale taktiež nepriamo, a to zvýšením expresie receptora aktivátora nukleárneho faktora kappa B ligand (RANKL) osteoblastami [17]. Tryptáza a heparín môžu priamo aktivovať osteoklasty, ako aj dráhu RANKL, a tým zvýšiť kostnú resorpciu [20]. V niektorých štúdiách boli zaznamenané zvýšené hladiny sklerostínu a Dickkopf 1 proteínu (DKK1), ktoré sú inhibítormi dráhy Wnt [21]. Tieto výsledky naznačujú, že u pacientov so SM môže byť ovplyvnená aj dráha Wnt/beta-katenín, čo má za následok nedostatočnú tvorbu kostí, a tým nízku kostnú hustotu. Sérové hladiny sklerostínu negatívne korelovali s hladinami 25-hydroxyvitamínu D, čo by mohlo naznačovať, že hladiny vitamínu D sú určujúce pre hladiny sklerostínu u pacientov s indolentnou SM [22]. Pri hodnotení kostných zmien u pacientov so SM sa využíva zo zobrazovacích metód denzitometrické vyšetrenie (DXA), RTG-snímka chrbtice, prípadne CT a MR chrbtice. Citlivosť a špecifickosť DXA v predikcii zlomenín stavcov u pacientov s SM je obmedzená, nakoľko pri stavoch po fraktúrach stavcov chrbtice, alebo pri deformitách stavcov napr. pri osteoartritíde, môže byť kostná denzita arteficiálne zvýšená. Z uvedeného dôvodu mnohí autori u pacientov so SM odporúčajú realizáciu laterálneho RTG-snímku chrbtice so zameraním na morfometriu stavcov. Zlomeniny stavcov sa hodnotia vizuálne. Bežne sa používa semikvantitatívny systém podľa Genanta, podľa ktorého strata výšky tela stavca o najmenej 20 % sa považuje za zlomeninu [23]. Posúdenie zlomenín stavcov pomocou DXA môže byť užitočné pri hodnotení zlomenín stavcov, najmä pri následných kontrolách [24]. Význam stanovenia markerov kostného obratu u pacientov so SM zostáva nejasný. Rossini vo svojej štúdii u 82 pacientov so SM nepotvrdil koreláciu medzi sérovou hladinou markerov kostného obratu (CTX a kostný izoenzým ALP) a T-skóre/Z-skóre, ako aj koreláciu medzi hladinou sérovej tryptázy a T-skóre/Z-skóre [11]. Seitz s kolektívom v prierezovej štúdií u 300 pacientov s indolentnou SM takisto nepotvrdil význam stanovenia markerov kostného metabolizmu v predikcii vertebrálnych fraktúr. Normálne sérové hladiny kostných markerov boli prítomné aj u pacientov s vertebrálnymi fraktúrami verifikovanými RTG [25]. Posúdenie markerov kostného obratu v predikcii vertebrálnych fraktúr je obmedzené pravdepodobne kvôli nepravidelnej distribúcii neoplastických mastocytov v kostnej dreni, ako aj prítomnosti ďalších kostných prejavov u SM okrem zmien v kostnej denzite [8]. Na druhej strane vysoké hladiny kostných markerov sú podozrivé pre kostné postihnutie u pacientov so SM. Prierezové štúdie doposiaľ publikovanej literatúry o liečbe osteoporózy súvisiacej s mastocytózou zdôraznili všeobecne nízku úroveň dôkazov o účinnosti rôznych terapeutických možností, najmä z dôvodu nedostatku údajov z longitudinálnych randomizovaných kontrolovaných štúdií. V klinickej praxi sa odporúča dostatočná substitúcia vápnika a vitamínu D (1 000 mg vápnika a 800 IU vitamínu D denne). Súčasné dôkazy naznačujú, že bisfosfonáty by mali byť liečbou prvej línie osteoporózy spojenej s mastocytózou, aj keď účinnosť proti zlomeninám ešte musí byť potvrdená štúdiami [26,27]. Použitie monoklonálnej protilátky proti RANKL – denosumabu v liečbe osteoporózy na podklade mastocytózy sa javí byť ďalšou možnosťou liečby [28]. S využitím teriparatidu v liečbe tohto typu sekundárnej osteoporózy nie sú doposiaľ v literatúre dostatočné údaje. Hoci sú bisfosfonáty liečbou prvej voľby u pacientov s osteoporózou na podklade mastocytózy, my sme vzhľadom k závažnej manifestnej osteoporóze zvolili osteoformačnú liečbu teriparatidom, ktorá je však časovo obmedzená, preto sme po jej ukončení (po konzultácii s pracoviskom Osteocentrum Brno s.r.o.) ďalej pokračovali v antiresorpčnej liečbe denosumabom. Je to nový trend, ktorý odporúčame aj pri liečbe ďalších pacientov.
Záver
Mastocytóza je zriedkavou príčinou sekundárnej osteoporózy, ktorá môže byť poddiagnostikovaná v dôsledku nedostatočnej informovanosti. Na systémovú mastocytózu by sme mali myslieť u každého pacienta, ktorý má nevysvetliteľnú osteoporózou a vyššie uvedené symptómy z uvoľnenia mediátorov z mastocytov. Je veľmi pravdepodobné, že genetické vyšetrenia v budúcnosti odhalia vyššie riziko osteoporózy u týchto pacientov, ale zlatým štandardom manažmentu v súčasnosti je denzitometrické vyšetrenie, resp. klinická manifestácia (fraktúry) v anamnéze.
Sources
Krishnaswamy G, Ajitawi O, Chi DS.The human mast cell: an overview. Methods Mol Biol 2006; 315 : 13–34. Dostupné z DOI: <http://dx.doi.org/10.1385/1–59259–967–2 : 013>.
Arock M, Valent P. Pathogenesis, classification and treatmentof mastocytosis: state of the art in 2010 and future perspectives. Expert Rev Hematol 2010; 3(4): 497–516. Dostupné z DOI: <http://dx.doi.org/10.1586/ehm.10.42>.
Martinásková K. Mastocytózy – komplexný pohľad na problematiku. Dermatol Prax 2011; 5(1): 7–12. Dostupné z WWW: Dostupné z DOI: <http://www.solen.sk/pdf/0bcb7ffa68647a6077fc3b844e58e64e.pdf>.
Arber DA, Orazi A, Hasserjian R et al. The 2016 revision to the WHO classification of myeloid neoplasms and acute leukemias. Blood 2016; 127(20) :2391–2402. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2016–03–643544>.
Horny HP, Metcalfe DD, Bennet JM et al. Mastocytosis. In: Swerdlow SH, Campo E, Harris NL et al. WHO clasification of tumours of haemopoetic and lymphoid tissues. 4th ed. WHO – Lyon International Agency for Research in Cancer2008 : 54–63. ISBN 978–9283224310.
Pardanani A, Akin C, Valent P. Pathogenesis, clinical features and treatment advances in mastocytosis. Best Pract Res Clin Haematol 2006; 19(3): 595–615. Dostupné z DOI: <http://dx.doi.org/10.1016/j.beha.2005.07.010>.
Lazur J. Systémová mastocytóza – diagnostika a prospektívy liečby. Onkológia 2019; 14(6): 434–438. Dostupné z WWW: <http://www.solen.sk/pdf/85adfc9725b48edf153ca1368a90dfb5.pdf>.
Rossini M, Zanotti R, Viapiana O et al. Bone involvement and osteoporosis in mastocytosis. Immunol Allergy Clin North Am 2014; 34(2): 383–396. Dostupné z DOI: <http://dx.doi.org/10.1016/j.iac.2014.01.011>.
Escribano L, Alvarez-Twose I, Sánchez-Muñoz L et al. Prognosis in adult indolent systemic mastocytosis: a long-term study of the Spanish Network on Mastocytosis in a series of 145 patients. J Allergy Clin Immunol 2009; 124(3): 514–521. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2009.05.003>.
Barete S, Assous N, de Gennes C et al. Systemic mastocytosis and bone involvement in a cohort of 75 patients. Ann Rheum Dis 2010; 69(10): 1838–1841. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2009.124511>.
Rossini M, Zanotti R, Bonadonna P et al. Bone mineral density, bone turnover markers and fractures in patients with indolent systemic mastocytosis. Bone 2011; 49(4): 880–885. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2011.07.004>.
Hartmann K, Henz BM. Mastocytosis: recent advances in defining the disease. Br J Dermatol 2001; 144(4): 682–695. Dostupné z DOI: <http://dx.doi.org/10.1046/j.1365–2133.2001.04123.x>.
Rossini M, Zanotti R, Orsolini G et al. Prevalence, pathogenesis and treatment options for mastocytosis related osteoporosis. Osteroporos Int 2016; 27(8): 2411–2421. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–016–3539–1>.
Van Gysel D, Oranje AP. Mastocytosis. Eur J Pediat Dermatol 2008; 18(2): 101–104. Dostupné z WWW: <https://www.ejpd.com/journal/index.php/EJPD/article/view/516>.
Van der Veer E, van der Goot W, de Monchy JG et al. High prevalence of fractures and osteoporosis in patients with indolent systemic mastocytosis. Allergy 2012; 67(3): 431–438. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1398–9995.2011.02780.x>.
Brockow K, Akin C, Huber M et al. IL-6 levels predict disease variant and extent of organ involvement in patients with mastocytosis. Clin Immunol 2005; 115(2): 216–223. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clim.2005.01.011>.
Chiappetta N, Gruber B .The role of mast cells in osteoporosis. Semin Arthritis Rheum 2006; 36(1):32–36. Dostupné z DOI: <http://dx.doi.org/10.1016/j.semarthrit.2006.03.004>.
Galli SJ, Tsai M. Mast cells: versatile regulators of inflammation, tissue remodeling, host defense and homeostasis. J Dermatol Sci 2008; 49(1): 7–19. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jdermsci.2007.09.009>.
Biosse-Duplan M, Baroukh B, Dy M et al. Histamine promotes osteoclastogenesis through the differential expression of histamine receptors on osteoclasts and osteoblasts. Am J Pathol 2009; 174(4): 1426–1434. Dostupné z DOI: <http://dx.doi.org/10.2353/ajpath.2009.080871>.
Chiappetta N, Gruber B. The role of mast cells in osteoporosis. Semin Arthritis Rheum 2006; 36(1): 32–36. Dostupné z DOI: <http://dx.doi.org/10.1016/j.semarthrit.2006.03.004>.
Rossini M, Viapiana O, Zanotti R et al. Dickkopf-1 and sclerostin serum levels in patients with systemic mastocytosis. Calcif Tissue Int 2015; 96(5):410–416. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–015–9969–5>.
Rossini M, Adami S, Zanotti R et al. Serum levels of bone cytokines in indolent systemic mastocytosis associated with osteopenia or osteoporosis. J Allergy Clin Immunol 2014; 133(3): 933–935. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2013.12.007>.
Genant HK, Wu CY, van Kuijk C et al. Vertebral fracture assessment using a semiquantitative technique. J Bone Miner Res 1993; 8(9): 1137–1148. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.5650080915>.
Guillaume N, Desoutter J, Chandesris O et al. Bone complications of mastocytosis: a link between clinical and biological characteristics. Am J Med 2013; 126(1): 75–84. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2012.07.018>.
Seitz S, Barvencik F, Koehne T, Priemel M et al. Increased osteoblast and osteoclast indices in individuals with systemic mastocytosis. Osteoporos Int 2013; 24(8): 2325–2334. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–013–2305-x>.
Rossini M, Zanotti R, Viapiana O et al. Zoledronic acid in osteoporosis secondary to mastocytosis. Am J Med 2014; 127(11): 1127–1134. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2014.06.015>.
Rossini M, Adami G, Adami S et al. Safety issues and adverse reactions with osteoporosis management. Expert Opin Drug Saf 2016; 15(3): 321–332. Dostupné z DOI: <http://doi: 10.1517/14740338.2016.1136287>.
Orsolini G, Gavioli I, Tripi I et al. Denosumab for the Treatment of Mastocytosis-Related Osteoporosis: A Case Series. Calcif Tissue Int 2017; 100(6): 595–598. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–017–0241-z>.
Labels
Clinical biochemistry Paediatric gynaecology Paediatric radiology Paediatric rheumatology Endocrinology Gynaecology and obstetrics Internal medicine Orthopaedics General practitioner for adults Radiodiagnostics Rehabilitation Rheumatology Traumatology Osteology
Article was published inClinical Osteology

2020 Issue 2-
All articles in this issue
- Životní jubileum pana profesora MUDr. Jana Štěpána, DrSc.
- Bone turnover markers in osteoporosis: a common statement on their use of the Society for Metabolic Bone Diseases within the Czech Medical Association of J.E. Purkyne (SMBD CzMA JEP) and the Czech Society of Clinical Biochemistry within the Czech Medical Association of J.E. Purkyne (CSCB CzMA JEP)
- Definition of osteoporotic (fragility) fracture: a statement of the Society for Metabolic Bone Diseases within the Czech Medical Association of J.E. Purkyne (SMOS CzMa of JEP)
- Osteoporosis on systemic mastocytosis: case report
- Treatment of atypical femoral fracture with teriparatide: case report
- Osteolytic deposits of the pelvis leading to the diagnosis of primary hyperparathyreosis: case report
- Clinical Osteology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Bone turnover markers in osteoporosis: a common statement on their use of the Society for Metabolic Bone Diseases within the Czech Medical Association of J.E. Purkyne (SMBD CzMA JEP) and the Czech Society of Clinical Biochemistry within the Czech Medical Association of J.E. Purkyne (CSCB CzMA JEP)
- Osteolytic deposits of the pelvis leading to the diagnosis of primary hyperparathyreosis: case report
- Osteoporosis on systemic mastocytosis: case report
- Definition of osteoporotic (fragility) fracture: a statement of the Society for Metabolic Bone Diseases within the Czech Medical Association of J.E. Purkyne (SMOS CzMa of JEP)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

