-
Medical journals
- Career
Perzistencia pri denosumabe u slovenských pacientov s kostnými metastázami – prospektívna observačná štúdia
Authors: M. Porubská 1; A. Němcová 2
Authors‘ workplace: Onkologický ústav sv. Alžbety, Bratislava, Slovenská republika 1; Amgen Slovakia s. r. o., Bratislava, Slovenská republika 2
Published in: Klin Onkol 2023; 36(1): 54-64
Category: Original Articles
doi: https://doi.org/10.48095/ccko202354Overview
Východiská: Integrovaná analýza klinických skúšaní fázy III u pacientov s pokročilými solídnymi nádormi preukázala superioritu denosumabu v porovnaní s kyselinou zoledrónovou v prevencii príhod súvisiacich so skeletom. Klinická účinnosť lieku však závisí od jeho pravidelného a pokračujúceho podávania (tzv. perzistencie); perzistencia pri použití denosumabu v onkologickej indikácii v reálnej klinickej praxi na Slovensku nebola doteraz stanovená. Súbor pacientov a metódy: Išlo o prospektívnu, observačnú, neintervenčnú štúdiu s jednou liečebnou skupinou u pacientov s kostnými metastázami zo solídnych nádorov, ktorí boli liečení denosumabom. Denosumab bol podávaný v reálnej klinickej praxi v 5 európskych krajinách raz za 4 týždne. V tomto článku sú prezentované výsledky týkajúce sa 54 pacientov zo Slovenska. Perzistencia bola definovaná ako podávanie denosumabu v ≤ 35dňových intervaloch počas 24 alebo 48 týždňov. Výsledky: Predchádzajúce príhody súvisiace so skeletom boli zistené u 5,6 % pacientov. Perzistencia bola preukázaná u 84,8 % pacientov počas 24 týždňov a u 61,4 % pacientov počas 48 týždňov. Medián (95% interval spoľahlivosti – confidence interval (CI)) času do neperzistencie bol 306,5 dňa (Q1 = 151,0; Q3 = 315,0). Najčastejším dôvodom neperzistencie bolo oneskorené podanie denosumabu. V priebehu času bola zistená tendencia k užívaniu slabších analgetík, pričom > 70 % pacientov nepotrebovalo žiadne analgetiká. Hladina vápnika v sére zostala v referenčnom rozpätí počas celej štúdie. Osteonekróza čeľuste, ktorá podliehala formálnemu zhodnoteniu, nebola zaznamenaná u žiadneho slovenského pacienta. Záver: Väčšina pacientov dostávala denosumab pravidelne raz za 4 týždne počas 24 týždňov liečby. Neperzistencia bola zapríčinená hlavne jeho oneskoreným podaním. Výskyt nežiaducich účinkov lieku zodpovedal očakávaniam vyplývajúcim z predchádzajúcich štúdií, osteonekróza čeľuste sa nevyskytla u žiadneho z pacientov zúčastnených v štúdii.
Klíčová slova:
denosumab – perzistencia – observačná štúdia – kostné metastázy – solídne nádory
Úvod
Kostné metastázy a následné skeletálne komplikácie predstavujú významnú záťaž pre pacientov s nádorovými ochoreniami a často vedú k závažnej bolesti, zníženej kvalite života, nestabilite a k zhoršeniu neurologických funkcií [1]. Kostné metastázy sú časté u pacientov s pokročilým karcinómom prsníka, prostaty alebo pľúc. Kostné lézie sa často vyskytujú aj u pacientov s mnohopočetným myelómom. Farmakologický manažment kostných metastáz na Slovensku zahŕňa antiresorpčnú liečbu bisfosfonátmi alebo biologickú liečbu denosumabom [2–4].
Denosumab je plne humánna monoklonálna protilátka, ktorá inhibuje ligand receptora aktivujúceho nukleárny faktor kB (receptor activator of nuclear factor kB ligand – RANKL) na kostných bunkách. Na Slovensku je denosumab (v jeho onkologickej indikácii) schválený na prevenciu príhod súvisiacich so skeletom (skeletal-related events – SRE), definovaných ako patologická fraktúra, ožarovanie kosti, kompresia miechy alebo chirurgický zákrok na kosti, u dospelých s pokročilým nádorovým ochorením postihujúcim kosti a na liečbu dospelých a dospievajúcich s vyvinutým skeletom s obrovskobunkovým kostným nádorom, ktorý je neresekovateľný, alebo kde chirurgická resekcia bude mať pravdepodobne za následok závažnú morbiditu [5].
V integrovanej analýze priamych (head to head) porovnávacích klinických skúšaní fázy III sa preukázalo, že denosumab je superiórny oproti kyseline zoledrónovej v prevencii SRE [6]. V reálnej klinickej praxi sa však účinnosť preukázaná v kontrolovaných klinických skúšaniach nemusí dosiahnuť z dôvodu nepravidelného podávania, neplánovaného prerušenia alebo ukončenia liečby. Zistilo sa, že SRE vzniknuté v dôsledku kostných metastáz sú spojené s ďalšími hospitalizáciami a so zvýšenou potrebou chirurgických alebo iných výkonov [7]. To ukazuje, že hoci nízka miera kompliancie a/alebo perzistencie znižuje náklady na liečbu, následne môže zvyšovať využívanie zdravotnej starostlivosti. Výhodnosť subkutánnej formy podávania a priaznivý pomer prínosu a rizika denosumabu môžu viesť k vysokej miere perzistencie nielen v kontrolovaných klinických skúšaniach, ale aj v reálnej klinickej praxi. Cieľom tejto štúdie bolo získať relevantné informácie o používaní denosumabu v podmienkach reálnej klinickej praxe a o perzistencii pri tomto lieku. Celkové výsledky tejto štúdie publikovali Haslbauer et al [8]. Tento článok sa podrobne zaoberá subpopuláciou slovenských pacientov z tejto štúdie.
Súbor pacientov a metódy
Dizajn štúdie
Išlo o prospektívnu, observačnú, neintervenčnú, multicentrickú kohortovú štúdiu s jednou liečebnou skupinou vykonanú u pacientov so solídnymi nádormi a s kostnými metastázami. Hlavná štúdia sa uskutočnila v Rakúsku, v Českej republike, v Maďarsku, na Slovensku a v Bulharsku; v tomto článku je prezentovaný podsúbor pacientov zo Slovenska. Nevyžadovali sa žiadne laboratórne, diagnostické alebo terapeutické postupy nad rámec bežnej starostlivosti o pacientov. Pacienti boli pozorovaní od zaradenia do štúdie až do podania poslednej dávky denosumabu. Prvá dávka denosumabu bola podaná v priebehu 28 dní pred zaradením. Pacienti boli pozorovaní počas maximálne 48 týždňov po podaní prvej dávky denosumabu a počas 30 dní následného sledovania (follow-up) zameraného na bezpečnosť lieku.
Kritériá vhodnosti
Dospelí pacienti (≥ 18 rokov), ktorí boli vhodní na zaradenie do štúdie, boli liečení denosumabom v dávke 120 mg podávanej subkutánne raz za 4 týždne z dôvodu potvrdených kostných metastáz z karcinómu prsníka, prostaty, pľúc alebo z iných solídnych nádorov. Hodnota výkonnostného stavu podľa Eastern Cooperative Oncology Group (ECOG) musela byť 0–2. Z účasti na štúdii boli vylúčení pacienti, ktorým bol diagnostikovaný mnohopočetný myelóm, ktorí predtým v rámci prevencie SRE dostávali bisfosfonáty alebo iné antiresorpčné látky dlhšie ako 6 mesiacov, alebo u ktorých bol denosumab kontraindikovaný. Podrobnejšie kritériá vhodnosti je možné nájsť v publikácii Haslbauera et al [8].
Ciele štúdie
Primárnym cieľom štúdie bolo odhadnúť perzistenciu pri liečbe denosumabom v bežnej klinickej praxi po 24 týždňoch. Sekundárne a exploračné ciele zahŕňali odhad perzistencie po 48 týždňoch, čas do neperzistencie a dôvody neperzistencie, demografické charakteristiky pacientov, charakteristiky ochorenia, lekársku anamnézu a súbežne podávanú liečbu, ako napr. protinádorovú liečbu, liečbu bolesti a suplementáciu vápnikom/vitamínom D, pacientmi oznamované výsledky (patient reported outcomes) a dôvody uprednostnenia denosumabu pred inými terapeutickými možnosťami.
Hlásenie nežiaducich účinkov lieku
Údaje o bezpečnosti týkajúce sa denosumabu boli zbierané počas 30 dní po podaní poslednej dávky denosumabu. Osteonekróza čeľuste (osteonecrosis of the jaw – ONJ) sa považovala za nežiaducu udalosť osobitného záujmu. Všetky prípady podozrenia na ONJ boli zdokumentované a hlásené ako závažné nežiaduce účinky lieku (serious adverse drug reaction – SADR) bez ohľadu na priradené kritérium závažnosti a kauzálny vzťah s denosumabom. Každý prípad podozrenia na ONJ bol posúdený nezávislou hodnotiacou komisiou, aby sa potvrdila alebo vyvrátila súvislosť ONJ s denosumabom.
Etické aspekty
Táto štúdia bola vykonaná v súlade so všetkými príslušnými národnými požiadavkami. Od pacienta alebo jeho zákonného zástupcu bol získaný písomný informovaný súhlas. Pred náborom pacientov alebo zberom akýchkoľvek údajov bol získaný súhlas národnej etickej komisie.
Štatistická analýza
Podrobný opis použitých metód štatistických analýz a definícií je možné nájsť v publikácii Haslbauera et al [8]. Testovaná nebola žiadna formálna hypotéza. Štatistické analýzy zahŕňali všetkých zaradených pacientov, ktorí spĺňali kritériá vhodnosti a dostali aspoň jednu dávku denosumabu. Perzistencia bola definovaná ako podávanie denosumabu v ≤ 35dňových intervaloch počas 24 alebo 48 týždňov.
Pri kontinuálnych premenných bola prezentovaná deskriptívna štatistika vrátane priemeru, štandardnej (smerodajnej) odchýlky (standard deviation – SD), mediánu, prvého (Q1) a tretieho (Q3) kvartilu, minimálnej a maximálnej hodnoty (rozmedzie), ako aj 95% obojstranných intervalov spoľahlivosti (confidence interval – CI), keď to bolo vhodné. Chýbajúce hodnoty kontinuálnych premenných boli započítané ako “chýbajúce” (missing). Pri kategorických premenných bol uvádzaný počet a percento pacientov v každej kategórii. Pri binárnych premenných bol uvádzaný počet a percento pacientov spolu s presnými obojstrannými intervalmi spoľahlivosti, keď to bolo vhodné. Chýbajúce výsledky boli vylúčené z výpočtu CI, avšak počet a percento pacientov s chýbajúcimi výsledkami boli uvedené pre kategorické dáta. Na analýzu údajov týkajúcich sa času do neperzistencie bola použitá metóda podľa Kaplana Meiera a Coxov model proporcionálnych rizík. Na štatistickú analýzu bol použitý systém SAS 9.4.
Výsledky
Opis toku pacientov
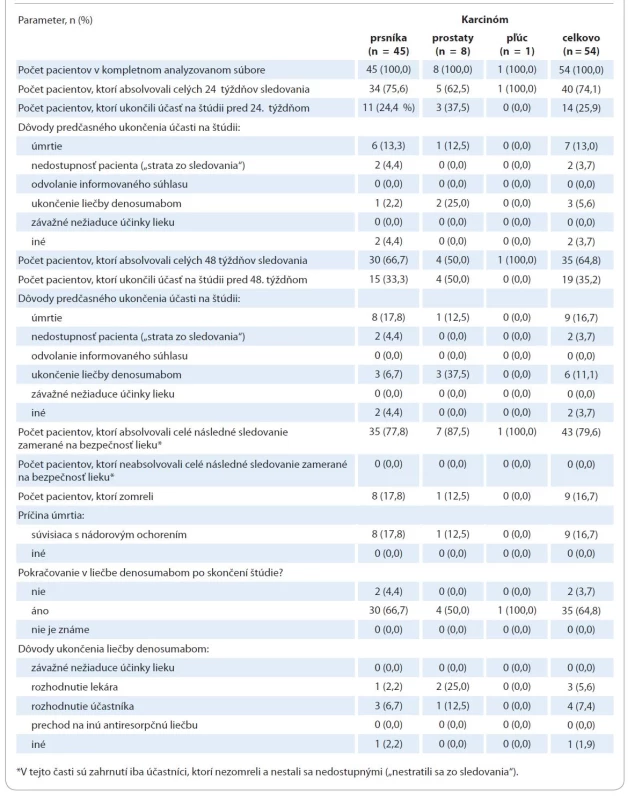
Analyzovaných bolo celkovo 54 slovenských pacientov (schéma 1). Celková populácia v štúdii pozostávala z 598 pacientov.
Schéma 1. Zobrazenie toku pacientov. 
* Zaradených bolo 634 pacientov: 319 z Rakúska, 130 z Bulharska, 109 z Českej republiky, 58 zo Slovenska a 18 z Maďarska. Z analýzy bolo vylúčených 36 pacientov. Dôvody vylúčenia z analýzy boli nedodržanie inklúznych alebo exklúznych kritérií, chybný duplicitný údaj v databáze alebo údaj vložený omylom, napr. súbor výcvikových dát chybne vložený do reálnej databázy namiesto do výcvikovej databázy.
** V tejto časti sú zahrnutí iba pacienti, ktorí nezomreli a nestali sa nedostupnými („nestratili sa zo sledovania“).Z 54 pacientov, u ktorých sa začala liečba denosumabom, 40 (74,1 %) absolvovalo celých 24 týždňov sledovania a 14 (25,9 %) predčasne ukončilo účasť na štúdii. Hlavnými dôvodmi predčasného ukončenia účasti na štúdii boli úmrtie (13,0 %, n = 7), ukončenie liečby denosumabom (5,6 %, n = 3), nedostupnosť pacienta („strata zo sledovania“) a iné dôvody (3,7 % pri každom, n = 2). V 48. týždni bolo ešte stále sledovaných 35 pacientov (64,8 %) a 19 (35,2 %) pacientov predčasne ukončilo účasť na štúdii. Medián (Q1; Q3) trvania sledovania súvisiaceho so štúdiou bol 48,6 týždňa (24,7; 49,9). Po skončení sledovaného obdobia súvisiaceho so štúdiou pokračovalo v liečbe denosumabom 35 pacientov (64,8 %). Liečbu denosumabom ukončilo celkovo 8 pacientov (14,8 %), 6 pacientov počas sledovania a 2 pacienti po skončení sledovaného obdobia. Uvedené dôvody ukončenia liečby denosumabom boli rozhodnutie lekára (n = 3, 5,6 %), rozhodnutie pacienta (n = 4, 7,4 %) alebo iné dôvody (n = 1, 1,9 %). Žiadny pacient neukončil liečbu z dôvodu nežiaducich účinkov lieku ani neprešiel na liečbu inou antiresorpčnou látkou. Celkový počet úmrtí počas sledovaného obdobia vrátane následného sledovania zameraného na bezpečnosť lieku bol 9 (16,7 %), pričom úmrtie bolo vo všetkých prípadoch zapríčinené základným nádorovým ochorením. Podrobný opis toku pacientov podľa typu nádorového ochorenia je uvedený v tab. 1.
Demografické charakteristiky pacientov
Zaradených bolo 83,3 % (n = 45) pacientov s karcinómom prsníka, 14,8 % (n = 8) pacientov s karcinómom prostaty a 1,9 % (n = 1) pacientov s karcinómom pľúc (graf 1). Väčšina pacientov bola ženského pohlavia (83,3 %, n = 45), čo bolo dôsledkom veľkého počtu žien s karcinómom prsníka (tab. 2). Medián veku bol 60,0 rokov (rozmedzie 39–85); 33,3 % (n = 18) bolo vo veku 65 rokov alebo starších. Výkonnostný stav podľa ECOG bol 0 u 75,9 % pacientov (n = 41), 1 u 22,2 % (n = 12) a 2 u 1,9 % (n = 1).
Graph 1. Distribúcia typov nádorového ochorenia, celkovo a pre Slovensko. 
Table 2. Demografické charakteristiky pacientov a charakteristiky ochorenia. Percentá sú založené na počte pacientov v kompletnom analyzovanom súbore. 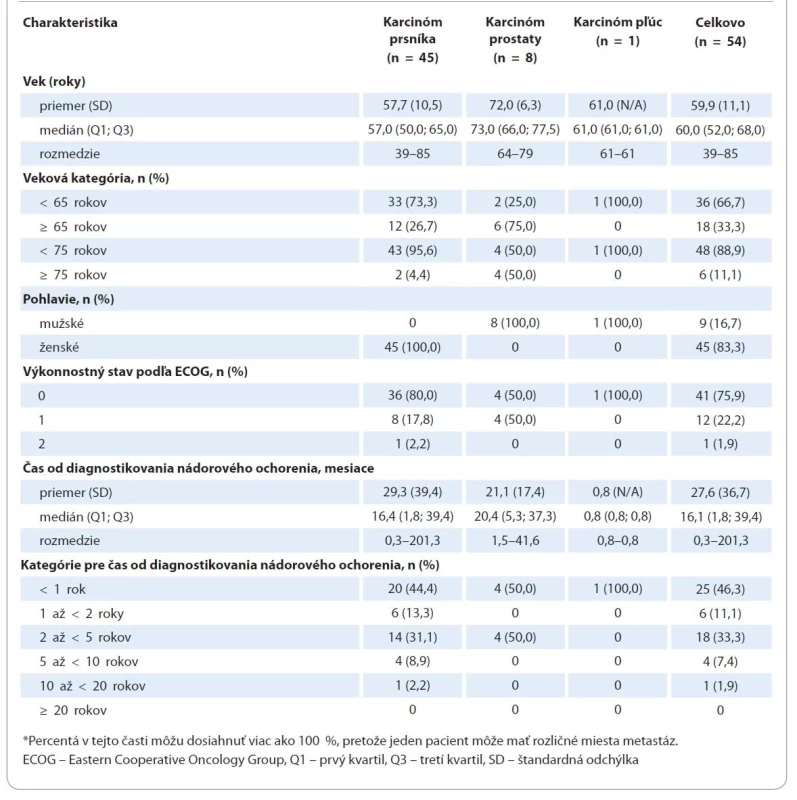
Tab. 2 – pokračování. Demografické charakteristiky pacientov a charakteristiky ochorenia. Percentá sú založené na počte pacientov v kompletnom analyzovanom súbore. 
Charakteristiky ochorenia
Medián (Q1; Q3) času od diagnostikovania nádorového ochorenia bol 16,1 mesiaca (1,8; 39,4), pričom u 46,3 % pacientov (n = 25) bolo nádorové ochorenie diagnostikované pred me - nej ako jedným rokom pred zaradením do štúdie. Medián času od stanovenia diagnózy sa pohyboval od 0,8 mesiaca u pacienta s karcinómom pľúc do 20,4 mesiaca u pacientov s karcinómom prostaty (tab. 2). Pacienti museli mať potvrdené metastatické ochorenie. Medián času od diagnostikovania metastatického ochorenia bol 1,5 mesiaca (interkvartilové rozpätie (IQR): 0,9; 4,5) a u 88,9 % pacientov (n = 48) bolo metastatické ochorenie diagnostikované pred menej ako jedným rokom pred zaradením do štúdie. Podľa miesta metastáz malo 51,9 % pacientov (n = 28) iba kostné metastázy a 48,1 % pacientov (n = 26) malo metastázy okrem v kostiach aj na iných miestach. Ďalšími miestami metastáz boli pečeň u 20,4 % pacientov (n = 11), pľúca u 16,7 % pacientov (n = 9) a mozog u 3,7 % pacientov (n = 2) a 27,8 % pacientov (n = 15) malo metastázy na iných miestach. Pacienti mohli mať metastázy na viac než jednom mieste. Kostné metastázy boli diagnostikované pred menej ako jedným rokom pred zaradením do štúdie u 92,6 % pacientov (n = 50) a väčšinou boli asymptomatické a diagnostikované zobrazovacím vyšetrením (64,8 %, n = 35; tab. 2). Medián času, ktorý uplynul medzi diagnostikovaním kostných metastáz a začiatkom liečby denosumabom, bol 1,2 mesiaca (IQR 0,7; 3,0).
Predchádzajúce príhody súvisiace so skeletom
Výskyt SRE pred zaradením do štúdie bol potvrdený u 5,6 % pacientov (n = 3): u 3,7 % (n = 2) pacientov sa vyskytli patologické fraktúry a u 1,9 % (n = 1) pacientov sa vyskytla kompresia miechy. Čas, ktorý uplynul medzi diagnostikovaním SRE a zaradením do štúdie, bol kratší ako 3 mesiace u 1,9 % pacientov (n = 1) a 3–6 mesiacov u 3,7 % (n = 3).
Protinádorové terapie
Ešte pred začatím liečby denosumabom dostalo, v rámci liečby metastatického ochorenia, 50,0 % pacientov (n = 27) chemoterapiu, 35,2 % (n = 19) endokrinnú liečbu, 18,5 % (n = 6) rádioterapiu a 11,1 % (n = 6) podstúpilo operáciu. Počas obdobia sledovania a súbežne s liečbou denosumabom dostávalo 66,7 % pacientov (n = 36) chemoterapiu, 59,3 % (n = 32) endokrinnú liečbu, 20,4 % (n = 11) rádioterapiu a 11,1 % (n = 6) podstúpilo operáciu.
Zdôvodnenie liečby denosumabom a dĺžka jej trvania
Pred začatím liečby denosumabom dostávalo 5,6 % pacientov (n = 3) iné antiresorpčné látky, pričom u všetkých to bola kyselina zoledrónová podávaná intravenózne raz za 4 týždne. Všetci pacienti dostávali antiresorpčnú liečbu 6 mesiacov alebo kratšie, ako to vyžadovali inklúzne kritériá. U všetkých troch pacientov bola liečba kyselinou zoledrónovou ukončená na základe rozhodnutia lekára, a to z dôvodu formy podávania (n = 1), renálnej insuficiencie (n = 1) alebo z iných nešpecifikovaných dôvodov (n = 1).
Najčastejšie lekárom uvádzané dôvody voľby denosumabu boli prevencia prvej SRE (70,4 %, n = 38; prvý najdôležitejší dôvod) a superiórna účinnosť denosumabu (40,7 %, n = 22, druhý najdôležitejší dôvod; 27,8 %, n = 15, tretí najdôležitejší dôvod).
Medián (Q1; Q3) počtu podaných dávok denosumabu bol 12 (6,0; 12,0) a pacienti ich dostali počas obdobia 310 dní (150,0; 319,0).
Suplementácia vápnikom a vitamínom D
Medián (Q1; Q3) hladiny vápnika v sére pri zaradení do štúdie bol 2,38 (2,29; 2,50) mmol/l. Pri druhej dávke denosumabu dosiahla hladina vápnika v sére najnižšiu hodnotu (tzv. nadir) 2,30 (2,23; 2,39) mmol/l. Hladina vápnika v sére sa udržala nad touto najnižšou hodnotou od tretej dávky až do konca štúdie. Pri zaradení do štúdie dostávalo 81,5 % pacientov (n = 44) suplementáciu vápnikom a vitamínom D. Toto percento pacientov sa zvýšilo na 94,4 % (n = 51) pri 2. dávke a potom neustále klesalo (graf 2).
Graph 2. Hladiny vápnika v sére a suplementácia vápnikom a vitamínom D v priebehu času. 
IQR – interkvartilové rozpätie Perzistencia po 24 a 48 týždňoch
Perzistencia v 24. týždni bola celkovo 84,8 % (95% CI 71,1–93,7), pričom u pacientov s karcinómom prostaty bola 57,1 %, u pacientov s karcinómom prsníka bola 89,5 % a u pacienta s karcinómom pľúc bola 100,0 %. Graf 3 zobrazuje perzistenciu po 24 týždňoch podľa typu nádoru. Perzistencia na Slovensku v porovnaní s ďalšími krajinami, ktoré boli zapojené do hlavnej štúdie, je uvedená v publikácii Haslbauera et al [8]. Perzistencia po 48 týždňoch bola 61,4 % (95% CI 45,5–75,6).
Graph 3. Perzistencia pri denosumabe po 24 týždňoch podľa typu nádoru (95% CI). 
Čas do neperzistencie
Medián (Q1; Q3) času do neperzistencie bol 306,5 (151,0; 315,0) dňa, pričom u pacientov s karcinómom prsníka bol 308,0 (168,0; 315,0) dní, u pacientov s karcinómom prostaty bol 186,0 (71,5; 309,5) dní a u pacienta s karcinómom pľúc bol 328,0 (328,0; 328,0) dní.
Analýza mediánu času do neperzistencie podľa predchádzajúcej antiresorpčnej liečby (áno/nie) ukázala medián (Q1; Q3) 146,0 dní (56,0; 168,0) u 3 pacientov s predchádzajúcou antiresorpčnou liečbou a 308,0 dní (162,0; 315,0) u 51 pacientov bez predchádzajúcej antiresorpčnej liečby.
Pomocou Coxovho modelu proporcionálnych rizík sa zistilo, že vek v čase diagnostikovania nádorového ochorenia < 65 rokov vs. ≥ 65 rokov významne súvisí s časom do neperzistencie pri denosumabe (p < 0,05, Waldov test).
Dôvody neperzistencie
Prekročenie prípustného intervalu medzi jednotlivými injekciami bolo uvádzané ako najčastejší dôvod neperzistencie v 24. týždni, ako aj v 48. týždni (definície nájdete v časti Súbor pacientov a metódy). Ďalšie uvádzané dôvody boli predčasné ukončenie liečby denosumabom a iné dôvody. V grafe 4 sú zobrazené dôvody neperzistencie v 24. týždni a v 48. týždni.
Graph 4. Dôvody neperzistencie pri denosumabe po 24 a 48 týždňoch. Protokol štúdie definoval 6 dôvodov neperzistencie, ale 3 z nich sa v slovenskej subpopulácii nevyskytli, konkrétne odvolanie informovaného súhlasu, závažné nežiaduce účinky lieku ((S)ADR) a nedostatok injekcií. Protokolom definovaný prípustný časový interval medzi jednotlivými injekciami bol maximálne 35dňový. 
Liečba bolesti
Celkovo možno konštatovať, že potreba silných analgetík bola vo všeobecnosti veľmi nízka. Percento pacientov, ktorí nepotrebovali žiadne analgetiká, zostávalo stabilné a predstavovalo > 70 % pacientov s dostupnými údajmi v príslušných časových bodoch. Väčšina pacientov, ktorí pri zaradení do štúdie užívali lieky proti bolesti, užívala neopioidné analgetiká (14,8 %, n = 8; skóre Analgesic Quantification Algorithm“ (AQA) = 1) alebo silné opioidy v nízkej dennej dávke < 75 mg perorálneho ekvivalentu morfínu (7,4 %, n = 4; skóre AQA = 3). Hodnotenie posunu v užívaní analgetík (v zmysle potreby užívania silnejších analgetík) u pacientov, ktorí pri zaradení do štúdie neužívali žiadne alebo užívali iba slabé opioidné analgetiká (AQA skóre ≤ 2), ukázalo, že u veľmi malého percenta pacientov došlo v neskorších časových bodoch k posunu na skóre AQA = 3 a u žiadneho pacienta nedošlo k posunu na ešte vyššie skóre AQA (graf 5).
Graph 5. Percento pacientov, ktorí mali pri zaradení do štúdie skóre „analgesic quantification algorithm“ (AQA) ≤ 2 a u ktorých došlo k posunu na skóre AQA > 2 pri neskorších dávkach denosumabu. Zo všetkých možných stupňov posunu sa u slovenských pacientov vyskytol iba posun na skóre AQA = 3. 
Bezpečnosť
Zaznamenávané boli iba nežiaduce účinky lieku (adverse drug reactions – ADR), ktoré ošetrujúci lekár považoval za súvisiace s denosumabom. ADR sa vyskytol celkovo u 3,7 % pacientov (n = 2). Hláseným ADR bola hypokalciémia u obidvoch pacientov, ktorá neviedla k ukončeniu liečby denosumabom. Hlásené neboli žiadne závažné ani fatálne ADR a najmä ani žiadne prípady ONJ. Celkovo bola miera incidencie nežiaducich účinkov lieku, upravená vzhľadom na dĺžku expozície, 0,055 (95% CI 0,007–0,199) na 100 pacientorokov.
Diskusia
V slovenskej subpopulácii z hlavnej štúdie sa u 84,8 % pacientov preukázalo pravidelné a pokračujúce používanie denosumabu, tj. perzistencia, počas 24 týždňov a u 61,4 % pacientov počas 48 týždňov. Najčastejším dôvodom neperzistencie bolo oneskorené podanie lieku. Iba šesť pacientov ukončilo liečbu denosumabom počas sledovaného obdobia.
V hlavnej štúdii zahŕňajúcej pacientov z Rakúska, Českej republiky, Maďarska, Slovenska a Bulharska bola celková miera perzistencie nižšia, a to 62,6 % (95% CI 58,4–66,7) po 24 týždňoch a 40,1 % (95% CI 35,9–44,4) po 48 týždňoch. Medzi krajinami sa perzistencia po 24 týždňoch pohybovala na úrovni 56,0 % (Rakúsko) až 84,8 % (Slovensko) [8]. V nemeckej štúdii X-TREME s podobným dizajnom [9] bola perzistencia pri denosumabe v 24. týždni 61,5 %. Perzistencia v 48. týždni bola 37,7 %. V hlavnej štúdii (v celkovej populácii) ako aj v štúdii X-TREME sa zistila značná variabilita v perzistencii medzi jednotlivými typmi nádorov a relatívne zastúpenie jednotlivých typov nádorov v populácii skúmanej v danej krajine aspoň sčasti vysvetľuje celkovú mieru perzistencie zistenú v danej krajine. V celkovej populácii v štúdii bola perzistencia po 24 týždňoch najvyššia u pacientov s karcinómom prsníka (69,5 %) a u pacientov s karcinómom prostaty (69,3 %) a najnižšia u pacientov s karcinómom pľúc (26,1 %) [8]. V subpopulácii skúmanej na Slovensku mali takmer všetci pacienti karcinóm prsníka alebo karcinóm prostaty, ktoré sú spájané s vysokou mierou perzistencie. Ďalší rozdiel medzi krajinami spočíva v spôsobe výdaja denosumabu. Na Slovensku bol počas prvej časti štúdie denosumab vydávaný vo verejnej lekárni a od októbra 2016 bol k dispozícii iba v nemocničnej lekárni. Hlavne v tých krajinách, v ktorých bol denosumab vydávaný vo verejnej lekárni a nepodával sa výlučne v nemocnici, môžu byť údaje, ktoré pacienti zaznamenávali do denníka účastníka štúdie, nepresné.
Počas realizácie tejto štúdie na Slovensku nebol hlásený žiadny prípad ONJ. V celkovej populácii v štúdii bola incidencia osteonekrózy 0,5 % (n = 3), pričom išlo o dva potvrdené prípady ONJ a o jeden prípad osteonekrózy s nešpecifikovanou lokalizáciou. V nemeckej štúdii X-TREME bol výskyt prípadov podozrenia na ONJ 1,3 % [9] a randomizované kontrolované štúdie s denosumabom hlásili incidenciu ONJ medzi 1,1 % až 2,3 % [10–12].
Táto štúdia je vystavená všetkým obmedzeniam, ktoré sú neoddeliteľne späté so samotným dizajnom observačnej štúdie, a to najmä vychýleniu (predpojatosti) pri výbere pacientov a pri prezentovaní výsledkov (selection and reporting bias) a chýbaniu zaslepenia a kontrolnej skupiny. Uskutočnili sa analýzy senzitivity, aby sa určilo, či pacienti, ktorí vypadli zo štúdie z dôvodu ukončenia liečby denosumabom, majú vplyv na odhadnutie perzistencie a podrobne sú opísané v článku venovanom hlavnej štúdii [8]. Stručne možno zhrnúť, že predĺženie prípustného časového intervalu bolo jediným faktorom, ktorý mal vplyv na výsledky v analýzach senzitivity.
Záver
Perzistencia pri liečbe denosumabom podávaným raz za mesiac počas 24 týždňov sa preukázala u väčšiny slovenských pacientov. Získané dáta nasvedčujú, že perzistenciu ovplyvňoval vek. Najčastejším dôvodom neperzistencie bolo nedodržanie intervalu podávania. Väčšina pacientov užívala výživové doplnky s obsahom vápnika a vitamínu D v súlade s odporúčaným dávkovaním. Výskyt ADR zodpovedal očakávaniam vyplývajúcim z predchádzajúcich štúdií a neboli hlásené žiadne prípady ONJ.
Poďakovanie
Margit Hemetsberger z Hemetsberger medical services, Viedeň, Rakúsko, asistovala pri písaní medicínskeho textu.
Autori by chceli poďakovať všetkým pacientom a pracovníkom z participujúcich centier.
Finančná podpora
Táto štúdia bola sponzorovaná spoločnosťou Amgen.
Vyhlásenie o konflikte záujmov
Miriam Porubská deklaruje, že nemá žiadny konflikt záujmov.
Alena Nemcová je zamestnankyňou spoločnosti Amgen. Spoločnosť Amgen uchováva zdrojové údaje a autori mali k týmto údajom prístup. Kvalifikovaní výskumníci môžu požiadať o údaje z klinických štúdií spoločnosti Amgen. Úplné podrobnosti sú dostupné na internetovej stránke: http: //www.amgen.com/datasharing.
MUDr. Miriam Porubská
Onkologický ústav sv. Alžbety, s.r.o.
Interná onkologická klinika
Heydukova 10
812 50 Bratislava
Slovenská republika
e mail: miriam.porubska@ousa.sk
Obdržané/Submitted: 21. 3. 2022
Prijaté/Accepted: 15. 6. 2021
Sources
1. Weinfurt KP, Li Y, Castel LD et al. The significance of skeletal-related events for the health-related quality of life of patients with metastatic prostate cancer. Ann Oncol 2005; 16 (4): 579–584. doi: 10.1093/annonc/mdi122.
2. Škripeková A. Prevencia skeletálnych komplikácií v protinádorovej liečbe s využitím biologickej liečby. MediNEWS 2014; 1 : 45–46.
3. Špánik S, Špániková B. Súčasné odporúčania na liečbu bisfosfonátmi pri nádorových ochoreniach. Onkológia 2013; 8 (6): 368–373.
4. Križanová K. Využitie biologickej liečby v prevencii bolesti a komplikácií kostných metastáz pri nádorových ochoreniach. Paliat Med Liec Boles 2013; 6 (2): 48–52.
5. Ema.europa.eu. Súhrn charakteristických vlastností lieku. [online]. Dostupné z: https: //www.ema.europa.eu/en/documents/product-information/xgeva-epar-product-information_sk.pdf.
6. Lipton A, Fizazi K, Stopeck AT et al. Superiority of denosumab to zoledronic acid for prevention of skeletal-related events: a combined analysis of 3 pivotal, randomised, phase 3 trials. Eur J Cancer 2012; 48 (16): 3082–3092. doi: 10.1016/j.ejca.2012.08.002.
7. Pereira J, Body JJ, Gunther O et al. Cost of skeletal complications from bone metastases in six European countries. J Med Econ 2016; 19 (6): 611–618. doi: 10.3111/13696998.2016.1150852.
8. Haslbauer F, Petzer A, Safanda M et al. Prospective observational study to evaluate the persistence of treatment with denosumab in patients with bone metastases from solid tumors in routine clinical practice: final analysis. Support Care Cancer 2020; 28 (4): 1855–1865. doi: 10.1007/s00520-019-04988-7.
9. Diel I, Ansorge S, Hohmann D et al. Denosumab and bisphosphonates persistence, compliance and switch in patients with solid tumors (ST) and bone metastases (BM). [online]. Available from: https: //www.valueinhealthjournal.com/article/S1098-3015 (17) 30702-7/ fulltext.
10. Fizazi K, Carducci M, Smith M et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet 2011; 377 (9768): 813–822. doi: 10.1016/S0140-6736 (10) 62344-6.
11. Henry DH, Costa L, Goldwasser F et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer (excluding breast and prostate cancer) or multiple myeloma. J Clin Oncol 2011; 29 (9): 1125–1132. doi: 10.1200/JCO.2010.31.3304.
12. Stopeck AT, Lipton A, Body JJ et al. Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer: a randomized, double-blind study. J Clin Oncol 2010; 28 (35): 5132–5139. doi: 10.1200/JCO.2010.29.7101.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2023 Issue 1-
All articles in this issue
- Editorial
- Lymfopenie způsobená radioterapií – možný kritický faktor v současné onkologické léčbě
- Onkolytické viry a léčení nádorového bujení
- Prediktory kognitívnych omylov u odliečených onkologických pacientov
- Informace z České onkologické společnosti
- Perzistencia pri denosumabe u slovenských pacientov s kostnými metastázami – prospektívna observačná štúdia
- Raritný prípad obrovského mucinózneho cystadenómu vaječníka zapríčiňujúceho akútnu renálnu insuficienciu a kompartment syndróm
- Poděkování recenzentům
- Vzácné choroby provázené hypergamaglobulinemií a zánětlivými projevy
- Hereditární nádorová onemocnění v klinické praxi
- Komplikace onkologických pacientů a možnosti jejich řešení v primární péči
- Snížení rizika užívání tabáku – mýtus, nebo realita?
- prof. RNDr. PhMr. Jan Kovařík, DrSc.
- Prediktívne biomarkery v imunoterapii triple-negatívneho karcinómu prsníka – súčasné poznatky a perspektívy
- Kapacita pro výstavbu infrastruktury onkologické péče v oblasti Karnataka – současnost a budoucnost
- Unikátní přirozená historie EGFR mutovaného adenokarcinomu
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Onkolytické viry a léčení nádorového bujení
- Lymfopenie způsobená radioterapií – možný kritický faktor v současné onkologické léčbě
- Prediktívne biomarkery v imunoterapii triple-negatívneho karcinómu prsníka – súčasné poznatky a perspektívy
- Prediktory kognitívnych omylov u odliečených onkologických pacientov
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career